Acta Botánica Venezuelica
versión impresa ISSN 0084-5906
Acta Bot. Venez. v.26 n.2 Caracas jul. 2003
TÉCNICA DE COLORACIÓN ÚTIL EN LA INTERPRETACIÓN ANATÓMICA DE GRACILARIOPSIS TENUIFRONS Y GRACILARIACHILENSIS (RHODOPHYTA)
Staining technique useful in the anatomical interpretation of
Gracilariopsis tenuifrons and Gracilaria chilensis (Rhodophyta)
Silvia PÉREZ-CORTÉZ1, Beatriz VERA2 y Cristian SÁNCHEZ3
1 Fundación Instituto Botánico de Venezuela, Jardín Botánico de Caracas, Av. Salvador Allende, Aptdo. 2156. Caracas 1010-A, Venezuela. perezsi@camelot.rect.ucv.ve
2 Instituto de Biología Experimental. Centro de Botánica Tropical. Universidad Central de Venezuela. Apartado 20513. Caracas-Venezuela.
3 CICNAT, Laboratorio de Fisonomía y Anatomía Vegetal, Instituto Pedagógico de Caracas, Universidad Pedagógica Experimental Libertador, Av. Páez, El Paraíso, Caracas-Venezuela.
RESUMEN
Las técnicas utilizadas en el estudio anatómico de atraqueófitas implican procedimientos costosos y complejos. Esto motivó el desarrollo de un método sencillo y económico para el estudio anatómico de macroalgas que consiste en deshidratar la muestra con glicerina, rehidratar hasta etanol 50%, colorear con una mezcla de safranina-azul de toluidina en relación 3:1, incluir en parafina y preparar láminas permanentes. El material vegetal para el estudio proviene de cultivos de Gracilariopsis tenuifrons ubicados en la Península de Araya (Venezuela) de Gelca C.A. y de poblaciones silvestres de Gracilaria chilensis en la Bahía de Concepción en Chile. En las preparaciones obtenidas es posible caracterizar los distintos tipos celulares que conforman el talo de estas especies.
Palabras clave: Gracilariopsis, Gracilaria, coloración, micropreparación, anatomía, agarophyta, alga, Rhodophyta
ABSTRACT
The anatomic techniques used in atraqueophyta are based on complex and expensive procedures; due to these reasons, a simple and economic method for the anatomic study of macroalgae was developed. This method consists on dehydration with glycerin, rehydration until ethanol 50%, staining with safranin-toloudine blue, inclusion on paraffin and preparation of permanent films. The studied macroalgae come from cultures of Gracilariopsis tenuifrons of Gelca C.A. at the Araya Peninsula (Venezuela) and from wild population of Gracilaria chilensis in Conception Bay in Chile. The slides obtained let us characterize the cellular types present in the thallus of these species.
Key words: Gracilariopsis, Gracilaria, staining, micropreparation, anatomy, agarophyte, algae, Rhodophyta
INTRODUCCIÓN
La diferenciación taxonómica a nivel de especie en algunos grupos de macroalgas resulta compleja debido a la homogeneidad morfológica que muchas veces presentan los talos de estas especies (Santelices 1989). Esto ha obligado a los investigadores a recurrir a la utilización de caracteres anatómicos para su diferenciación.
Existe abundante literatura referente a las técnicas aplicadas para el estudio anatómico de traqueófitas y se conoce que los resultados son altamente satisfactorios (Johansen 1940; Sass 1940; Roth 1964; Agurto 1983; Curtis 1986; Schneider 1990). Sin embargo, la literatura sobre las técnicas usadas para el estudio anatómico de atraqueófitas no es tan abundante y evidencia la complejidad de éstas (McCully et al. 1980; Riosmena-Rodríguez 1983; Velázquez & Varela 1994). El presente trabajo pretende contribuir con una técnica sencilla para el estudio anatómico de macroalgas.
MATERIALES Y MÉTODOS
El material vegetal para el estudio proviene de cultivos de Gracilariopsis tenuifrons (C.J. Bird & E.C. Oliveira) Fredericq & Hommers ubicados en la Península de Araya (Venezuela) de Gelca C.A. y de poblaciones silvestres de Gracilaria chilensis Bird, Mclachlan & Oliveira en la Bahía de Concepción en Chile.
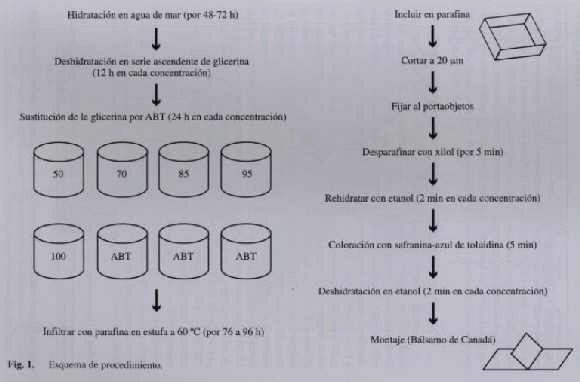
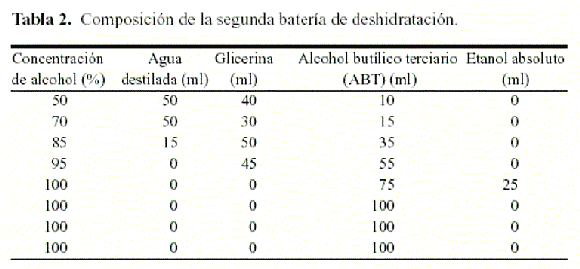
Se trabajó con material deshidratado, el cual fue rehidratado con agua de mar durante 48-72 h para su posterior procesamiento (Fig. 1). Secciones del talo rehidratado de aproximadamente 1 cm de longitud fueron sometidas a un proceso de deshidratación, para lo cual se colocaron en una serie ascendente de alcohol constituida por agua de mar y glicerina (Tabla 1), dejándose la muestra en cada concentración durante 12 h a temperatura ambiente. Una vez que el material estaba totalmente deshidratado, se procedió a sustituir la glicerina del tejido por alcohol butílico terciario (ABT), pasando la muestra por una segunda batería ascendente de alcoholes (Tabla 2).
Posteriormente se procedió a infiltrar el material vegetal en parafina, colocándolo en un vial con una mezcla de ABT y parafina, en una estufa a 60 ºC. Estas muestras permanecieron en la estufa de 76 a 96 h hasta la evaporación total del ABT. Luego de la infiltración, se procedió a incluir el material colocándolo en parafina fundida en un molde de cartulina manila de 3x3 cm de área y 1 cm de profundidad. Una vez que se solidificó el bloque de parafina, se procedió a seccionar transversalmente, a 20 µm de grosor, la muestra en un micrótomo de rotación. Los mejores cortes fueron fijados sobre un portaobjetos con glicerina al 1% y se dejó secar por 24 h. Posteriormente los cortes fijados se colocaron en xilol puro durante cinco min para desparafinar. Inmediatamente se procedió a rehidratar la muestra en una serie descendente de etanol (Tabla 3), dejándola en cada concentración por 2 min. A continuación se colorearon los cortes durante 5 min, con una combinación de safranina 1% y azul de toluidina 1% en relación 3:1, ambos preparados en etanol 50%. Se agregaron en la mezcla de coloración, como mordiente, gotas (± 3) de solución saturada de ácido pícrico. Luego se deshidrataron nuevamente en una serie ascendente de etanol (50-70-95-100%) dejándose durante 2 min en cada concentración, por último se colocó el material durante 30 s en xilol puro. Finalmente se prepararon láminas permanentes, se usó como medio de montaje Bálsamo de Canadá (Fig. 1). En estas preparaciones se determinaron las dimensiones promedio de los diferentes tipos celulares en un microscopio óptico (Nikon Optiphot-2) con un micrómetro ocular calibrado, para lo cual se utilizaron 30 muestras. Se realizó un registro microfotográfico (Cámara Nikon FX-35DX) de distintas regiones del talo.
RESULTADOS
En las preparaciones obtenidas se observó diferenciación anatómica entre Gracilaria chilensis (Fig. 2A) y Gracilariopsis tenuifrons (Fig. 2B) y fue posible caracterizar y medir los distintos tipos celulares de la región cortical, subcortical y medular que conforman el talo de estas especies. Las células medulares y subcorticales de Gracilariopsis tenuifrons casi duplican las dimensiones de estas células en Gracilaria chilensis. La pared de las células corticales de Gracilaria chilensis es dos veces más gruesa que la de Gracilariopsis tenuifrons (Tabla 4).
DISCUSIÓN
El tiempo de permanencia de una muestra en la serie de deshidratación depende del tamaño, textura y consistencia del material (Johansen 1940; Sass 1940; Roth 1964); en este trabajo se utilizaron tiempos de deshidratación de 12 y 24 h con la finalidad de garantizar la integridad celular de los tejidos, debido a que cambios rápidos y/o drásticos de concentración provocan el colapso del protoplasto y la distorsión de la forma celular (Sass 1940); sin embargo, es probable que se pueda trabajar con un tiempo de permanencia menor para cada una de las etapas de la deshidratación, pero se decidió utilizar un intervalo de permanencia amplio que asegura la deshidratación adecuada del material y que además permite mayor versatilidad al método, el cual podría ser estandarizado para otros grupos de macroalgas. En cuanto al agente deshidratante utilizado (glicerina) se puede indicar que este alcohol posee características apropiadas para el procesamiento de materiales delicados debido a que su consistencia contribuye a que la deshidratación del tejido sea gradual (Saas 1940).
El azul de toluidina es un colorante metacromático que reacciona con la celulosa presente en la pared celular (Sass 1940; Roth 1964; Agurto 1983; Moura et al. 1997) y es altamente afín con los polisacáridos presentes en la misma (McCully et al. 1980; Moura et al. 1997); esto genera una gama de tonalidades en el tejido que depende de la cantidad de celulosa y polisacáridos presentes en cada tipo celular. La safranina es un colorante monocromático que también reacciona con la celulosa (Sass 1940; Roth 1964; Agurto 1983). La combinación de estos dos colorantes potencia su efectividad frente a la celulosa, permitiendo diferenciar bien los distintos tipos celulares, y además obtener una coloración similar al color natural de las macroalgas estudiadas, comúnmente conocidas como algas rojas.
Durante varios años esta técnica ha sido utilizada en el laboratorio de estudios micromorfoanatómicos del Instituto de Biología Experimental y se han obtenido buenos resultados observándose las estructuras bien definidas y con una coloración semejante a la que presentan en su estado natural.
AGRADECIMIENTOS
Los autores agradecemos a la Prof. Helga Lindorf por su gentil colaboración en la lectura y revisión crítica del trabajo, a la Lic. Mayra García por sus observaciones y aportes y al Comité Editorial de Acta Botanica Venezuelica por sus comentarios. También deseamos agradecer al Laboratorio de Fisionomía y Anatomía Vegetal de la UPEL, al laboratorio de Morfoanatomía Vegetal de IBEUCV y al Postgrado en Botánica de la UCV.
BIBLIOGRAFIA
1. Agurto, J. 1983. Colorantes y coloraciones. Editorial Popular Los Andes. Lima. [ Links ]
2. Curtis, J. 1986. Microtecnia vegetal. Editorial Trillas. Universidad Autónoma de Chapingo. México. [ Links ]
3. Johansen, D.A. 1940. Plant microtechnique. McGraw-Hill Book Company. New York-London. [ Links ]
4. McCully, M.E., J.L.J. Goff & P.C. Adshead. 1980. Preparation of algae for light microscopy. In: Devolopmental and cytological methods. Handbook of phycological methods (Gantt, E., ed.) 3: 263-283. Cambridge Univ. Press. [ Links ]
5. Moura, C.W.N., J.E. Graus & M. Cordeiro-Marino. 1997. Metodología para la obtencão de cortes histológicos com Historresina e coloração con azul de toluidina O para algas coralináceas (Rhodophyta, Corallinales). Hoehnea 24(2): 17-27. [ Links ]
6. Riosmena-Rodríguez, R. 1993. Una propuesta de técnica histológica para el estudio de algas coralinas (Corallinales-Rhodophyta). Rev. Inv. Cient. 4(1): 65-73. [ Links ]
7. Roth, I. 1964. Microtecnia vegetal. Ediciones de la Biblioteca UCV. Caracas. [ Links ]
8. Santelices, B. 1989. Algas marinas de Chile: distribución, ecología, utilización y diversidad. Editorial Universidad Católica de Chile. [ Links ]
9. Sass, J.E. 1940. Elements of botanical microtechnique. McGraw-Hill Book Company Inc. New York. [ Links ]
10. Schneider, H. 1990. Plant anatomy and general botany. In: Staining procedures (Clark, G., ed.), pp. 324-339. Williams & Williams, London. [ Links ]
11. Velázquez, Y. & R. Varela. 1994. Guía para la recolección y preservación de macroalgas. In: Las algas: manual de colección, preservación, clasificación y terminología (Monente, J.A. & J.C. Nasser, eds.), pp. 7-25. Fundación La Salle de Ciencias Naturales. Caracas-Venezuela. [ Links ]












 uBio
uBio