Acta Botánica Venezuelica
versión impresa ISSN 0084-5906
Acta Bot. Venez. v.32 n.1 Caracas jun. 2009
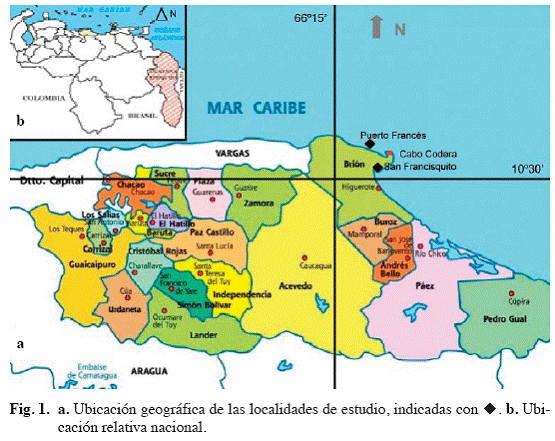
Estudio ficológico de las localidades de Puerto Francés y San Francisquito, Estado Miranda, Venezuela
Phycological study at the Puerto Francés and San Francisquito localities, Miranda State, Venezuela
Sonia Ardito1 y Mayra García2
1 Departamento de Biología, Facultad Experimental de Ciencias y Tecnología,
2 Fundación Instituto Botánico de Venezuela, Herbario Nacional de Venezuela,
RESUMEN
Se realizó un estudio ficológico en las localidades de Puerto Francés y San Francisquito del estado Miranda, Venezuela. Se registró un total de 70 especies, representadas por 41 Rhodophyta, 20 Chlorophyta, 9 Ochrophyta, de las cuales 24 son nuevos registros para el estado Miranda, y uno se cita por primera vez para la costa venezolana. Se presenta una lista taxonómica y se describen sólo aquellas especies que representan nuevos aportes. Se observó mayor riqueza de especies en Puerto Francés con respecto a San Francisquito y esta diferencia podría estar relacionada con características ambientales particulares asociadas a cada una de las localidades estudiadas.
Palabras clave: Catálogo, litoral rocoso, macroalgas marinas, Miranda, Venezuela
ABSTRACT
A phycological study was conducted at Puerto Francés and San Francisquito localities, of the Miranda State,Venezuela. In this study 70 species were recorded, 41 Rhodophyta, 20 Chlorophyta, 9 Ochrophyta, of which 24 species represent new records for the state and one for the Venezuelan coast. A checklist of species is given and only the new records are described. Puerto Francés presents a higher species richness than San Francisquito, which might be due to the proper environmental conditions associated with each one of the localities.
Key words: Checklist, Miranda, rocky littoral, seaweeds,
INTRODUCCIÓN
En la costa venezolana se han realizado diversos estudios taxonómicos sobre algas que involucran inventarios ficoflorísticos. Una parte considerable de éstos ha sido llevada a cabo en la región oriental del país o en refugios naturales, como es el caso de las algas marinas bénticas de los parques nacionales. Dicha información está recopilada en el catálogo de Ganesan (1989) y en el catálogo de macroalgas marinas del Herbario Nacional de Venezuela (Ardito & Vera 1997). Posterior al catálogo de Ganesan (1989), otros trabajos se han realizado en áreas costeras pertenecientes a parques nacionales, tales como el de González & Vera (1994), Narváez (1995), Gil (2001), en el Parque Nacional Morrocoy, Gómez (1998) en el Archipiélago Los Roques, Barrios et al. (2003) y Silva et al. (2003) en el Parque Nacional Mochima.
En la región central los principales inventarios ficoflorísticos se han realizado en el estado Vargas; hasta el presente se destacan los trabajos de Ríos (1972), realizado en Playa Grande y Arrecife, González (1977) en Punta de Tarma, Ardito et al. (1995) en Taguao, Vera (1996, 1997, 2000) quien trabajó en nueve localidades de la región oriental del estado Vargas, y García & Gómez (2001) en Carmen de Uria.
Con relación al estado Miranda, los estudios sobre algas marinas pueden considerarse dispersos y fragmentarios; uno de los trabajos pioneros en estas costas, específicamente en la zona de Tacarigua, es el de Post (1938, en Ganesan 1989), posteriormente Hammer & Gessner (1967) realizaron un amplio inventario de la vegetación marina de la costa centro-occidental del país; Ríos (1972) y Acosta (1974) trabajaron en localidades como Carenero e Higuerote, en el primer caso, y Los Totumos en el segundo. Más recientemente Solé & Vera (1997) realizaron un estudio ficológico en las playas de Chirimena y Punta Caimán.
Cabe destacar que la costa mirandina presenta una extensión de
En virtud de la creciente contaminación de las costas mirandinas, es de gran utilidad contar con registros de las especies de algas presentes en esta zona, que permitirán evaluar los cambios y consecuencias de tal alteración, así como establecer posibles especies indicadoras. En este sentido, el objetivo de este trabajo es contribuir al conocimiento de la flora de las algas marinas del estado Miranda, determinando para ello la composición de especies en dos localidades donde no se conocía su ficoflora hasta el presente, colaborando así con la actualización ficoflorística del estado, además de ampliar la colección de la ficoteca del Herbario Nacional de Venezuela (VEN).
MATERIALES Y MÉTODOS
Área de estudio
Las localidades San Francisquito y Puerto Francés se encuentran ubicadas al norte de Venezuela, en el estado Miranda, municipio Brión, entre 10°3517 N y 66°0510 O (Fig. 1), abarcando aproximadamente
Trabajo de campo
Se realizaron colecciones mensuales, durante seis meses, de las diferentes especies de algas presentes en los sustratos rocosos de la zona intermareal de las localidades estudiadas.
Las muestras de algas fueron colectadas manualmente y en caso de ser necesario se utilizó una espátula, con la finalidad de preservar los órganos de fijación. Se colocaron en bolsas plásticas y se preservaron en una solución de formaldehído al 4% en agua de mar, transportándolas en una cava hasta el laboratorio para su posterior análisis.
Procesamiento de las muestras
En el laboratorio cada muestra se separó en dos porciones, una para ser depositada en el herbario y con la otra se realizó un estudio morfoanátomico para la identificación taxonómica de las especies. Las muestras para herbario se montaron sobre cartulina, con agentes preservativos tales como alcohol 70% y unas gotas de formol; fueron prensadas y secadas a temperatura ambiente y posteriormente incorporadas al Herbario Nacional de Venezuela (VEN).
Para el estudio morfoanatómico se realizaron cortes a mano alzada y se prepararon láminas semipermanentes con una solución de glicerina al 30% (García & Gómez 2001). También se realizaron diferentes tinciones del material a estudiar con azul de toluidina al 1% o con una solución acuosa de safranina-toluidina (1:1) al 1% (Pérez-Cortéz et al. 2003) con el objeto de visualizar adecuadamente su estructura interna. Se tomaron fotografías, macro y microscópicas de las distintas especies con una cámara digital marca Nikon Coolpix-4500, que se adaptó a un microscopio compuesto Nikon Eclipse E-200. Para la identificación y descripción taxonómica de las especies se empleó la bibliografía respectiva para cada caso (Taylor 1960; Ríos 1972; Cordeiro-Marino 1978; Abbott 1999; Littler & Littler 2000).
Se elaboró una lista de especies ordenadas de acuerdo con el sistema de clasificación propuesto por Wynne (2005), también se consultaron los sinónimos en la base de datos de algas de Guiry & Dhonncha (2008).
Comparación ficoflorística entre las localidades estudiadas
Se realizó una comparación ficoflorística entre ambas localidades con base en datos de presencia y ausencia de especies, y a partir de éstos se calculó el coeficiente de similitud de Jaccard (1908), mediante la siguiente fórmula: Cj = C/ A+B-C, donde Cj = Coeficiente de similitud de Jaccard, C = Número de especies comunes, A = Número de especies presentes en Puerto Francés, B = Número de especies presentes en San Francisquito.
RESULTADOS Y DISCUSIÓN
Se identificó un total de 70 especies (Tabla 1), de las cuales 20 pertenecen al Phylum Chlorophyta, 9 al Ochrophyta y 41 al Rhodophyta. Cabe destacar que 24 especies representan nuevos registros para el estado Miranda y la especie Griffithsia schousboei Montagne constituye una primera cita para la costa venezolana, siendo una de las siete especies del género reconocidas para las costas tropicales y subtropicales (Wynne 2005; Guiry & Dhonncha 2008).
Las algas reportadas se encontraron creciendo sobre sustratos rocosos de la zona intermareal, en algunos casos entremezcladas, mientras que en otros son algas epífitas, tal es el caso de Sahlingia subintegra, Colaconema hallandicum, Ceramium deslongchampsii, Taenioma perpusillum, y algunas parásitas como: Centrocerocolax ubatubensis e Hypneocolax stellaris. Las 24 adiciones constituyen un valioso aporte ficológico para el Estado, incrementando el número de especies conocidas hasta el presente de
Al examinar el número de especies pertenecientes a cada una de las phyla estudiadas se observó mayor proporción de algas rodófitas, seguidas por las clorófitas y por último las ocrófitas, lo cual indica que la ficoflora de esta zona es típicamente tropical, de acuerdo con lo postulado por Kapraun (1978, citado por Gil 2001). Esta proporción es común para el resto de la costa venezolana y la costa caribeña (Vera 2000).
Al comparar la riqueza de especies entre ambas localidades se observó que fue mayor en Puerto Francés que en San Francisquito (Tabla 1), obteniéndose un índice de similitud de 0,51%, lo cual indica que estas dos localidades son diferentes en un 49%. Estas diferencias podrían ser explicadas en función de características ambientales, sin embargo este trabajo no fue diseñado con la finalidad de evaluar el efecto de tales factores sobre la composición de especies entre las distintas localidades, no obstante, debido a diferencias observadas, se hicieron algunas consideraciones, que pueden servir de base para futuros estudios ecológicos. Puerto Francés y San Francisquito están ubicados geográficamente a ambos lados de Cabo Codera, el cual es considerado un punto de navegación importante por el sistema de corrientes que allí converge (Balladares et al. 1997); alrededor de esta región se manifiesta un cambio en el sentido de las corrientes que podría originar diferencias en cuanto a disponibilidad de nutrientes, temperatura y salinidad entre las localidades señaladas. Estos factores ambientales son de vital importancia para el crecimiento, desarrollo y distribución de las algas, donde los valores óptimos para el crecimiento y desarrollo varían dependiendo de la especie (Darley 1987; Dring 1992; Yokoya & Oliveira 1993; Orduña & Robledo 1999), lo que podría contribuir a que la composición de especies fuera distinta entre las localidades estudiadas.
La costa de Puerto Francés es más expuesta a mar abierto que la de San Francisquito, por lo que el grado de exposición al oleaje es mayor, este factor ha sido interpretado como uno de los más importantes que condiciona la distribución de las algas intermareales y por ende, la composición de especies (Bertness et al. 2001), señalándose que en ciertos casos causa un efecto beneficioso sobre el crecimiento de las algas debido a que genera mayor circulación del agua, favoreciendo así la absorción de nutrientes (Dring 1992).
Las algas marinas, en especial las que crecen en zonas intermareales, están sometidas a fluctuaciones periódicas de salinidad, pudiendo presentar períodos de emersión durante la marea baja; esto trae como consecuencia que las algas experimenten marcados extremos de salinidad, pero también las algas intermareales pueden estar expuestas a corrientes de agua dulce que desembocan en el mar, y esto puede conducir a una disminución de la salinidad del medio intermareal (Darley 1987; Bertness et al. 2001); éste es el caso de la localidad de San Francisquito, cuya costa presenta un aporte de agua dulce proveniente de una laguna interna y además está bajo la influencia de la desembocadura del río Tuy, por lo que es probable que la salinidad del agua en esta localidad sea menor que en Puerto Francés.
En las zonas intermareales la disponibilidad de sustratos así como la naturaleza y las características del mismo (presencia de hendiduras, grietas, hoyos y canales) crean condiciones particulares que llevan a la formación de microhábitats que pueden modificar la composición de especies entre localidades cercanas (McGuinness & Underwood 1986; Ardito 1994). En Puerto Francés hay mayor disponibilidad de sustratos que en San Francisquito, ya que existen plataformas coralinas y una cantidad de rocas disgregadas más numerosa, lo que genera gran diversidad de microhábitats para el desarrollo de las distintas especies de algas.
Para una adecuada interpretación ecológica de las diferencias observadas en la composición de especies de estas localidades se hace necesario la medición de un conjunto de variables ambientales que permitan explicarla; además, tal como indica Vera (2000), en este tipo de ambientes es necesario muestrear por varios años para ubicar microhábitats que en ocasiones no son accesibles por el fuerte oleaje o por la altura de la marea. Además existen especies ocasionales que entran en la comunidad cuando las condiciones así lo permiten; también existen interacciones biológicas con otros organismos tales como la competencia y la herbivoría que podrían afectar la composición de especies (Underwood & Jernakoff 1984). Se puede afirmar en este trabajo que la composición de especies en las localidades estudiadas no depende de un único factor sino de la interacción de factores abióticos y bióticos. Se recomienda continuar con los estudios ficológicos en otras localidades de esta región, ya que resulta de interés que en trabajos anteriores y en éste se han citado nuevos registros para el país, éstos permitirán establecer comparaciones con otras regiones en cuanto a la riqueza de especies.
Lista y descripciones morfoanatómicas
Se presentan y describen las especies que son nuevos registros para el estado Miranda y la costa venezolana.
Chlorophyta
Ulvales
Ulvaceae
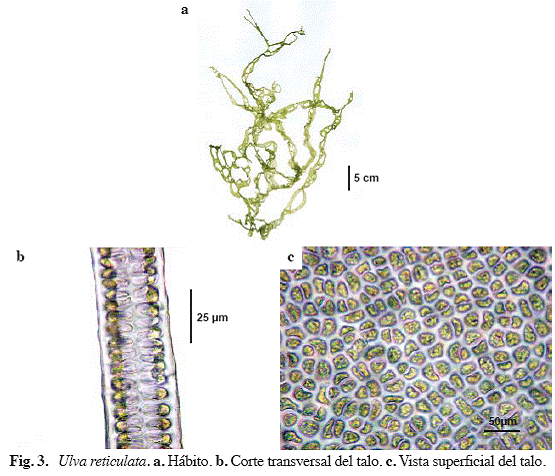
Ulva reticulata Forssk (Fig. 3) Phycoseris reticulata Forssk.
Referencias: Ganesan et al. (1985: 239, Fig. 1, 8);
Santelices (1988: 246; lám. AA, Fig. 7).
Alga de color verde brillante, laminar, hasta
o estípite distinguible. Láminas con numerosas perforaciones de tamaño y forma diferentes, dándole al talo una apariencia de red, los márgenes presentan dientes microscópicos. Organización parenquimática con dos células de grosor, rectangulares o subovaladas de 7,2-12 μm de ancho y de16,8-21,6 μm de largo, un cloroplasto parietal, semilunar con 1-4 pirenoides.
Material examinado: San Francisquito, 28/04/04, S. Ardito, M. García & W. Durán 384 (VEN). Ibid., 30/06/04, S. Ardito, O. Hokche & J. Hernández 605 (VEN).
Cladophorales
Cladophoraceae
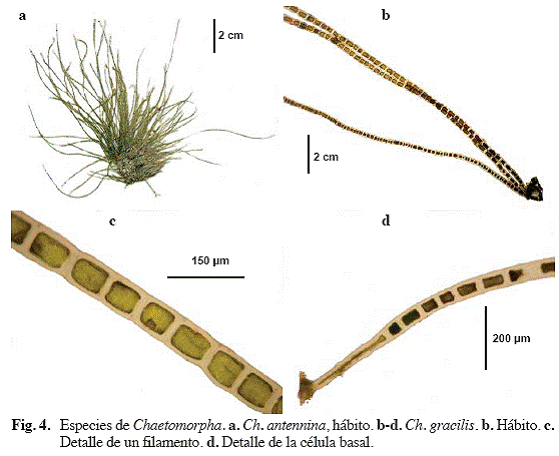
Chaetomorpha antennina (Bory) Kütz. (Fig.
Chaetomorphopsis pacifica Lyon
Referencias: Albornoz (1986-1988: 14, Fig. 4); Ardito et al. (1995: 59); García (1999: 26; Fig.
Alga de color verde brillante, filamentosa, erecta, no ramificada, rígida, creciendo en grupos fijados al sustrato mediante un disco de hasta
Material examinado: Puerto Francés, 16 /03/2004, S. Ardito, M. García & W. Durán 373 (VEN). Ibid., 9/06/2004, S. Ardito, O. Hokche & J. Hernández 552 (VEN).
Chaetomorpha gracilis Kütz (Fig. 4b-d)
Lola gracilis (Kütz.) Chapman 1961
Referencias: Littler & Littler (2000: 318; Fig. 1, 2), Lemus (1979), Schneider & Searles (1991: 59; Fig. 39, 40), Schnetter (1978: 66; lám. 7, Fig. c); Taylor (1960: 70).
Alga de color verde oscuro, filamentosa, no ramificada, entre 15 y
Material examinado: Puerto Francés, 21/07/04, S. Ardito, M. García, O. Hokche & J. Hernández 695 (VEN). San Francisquito, 11/08/04, S. Ardito, M. García & J. Hernández 715 (VEN).
Boodleaceae
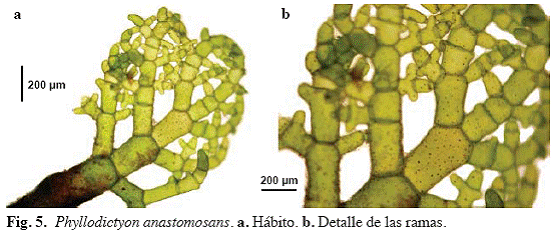
Phyllodictyon anastomosans (Harv.) Kraft & Wynne (Fig. 5)
Struvea anastomosans var. caracasana (Grunow ex Murray Boodle) Collins 1909.
Referencias: Ardito et al. (1995), García (1999: 28; Fig. 11c), Littler & Littler (2000: 328; Fig. 1-2); Ríos (1972: 232, lám. 6, Fig. 9), Taylor (1960: 122, lám. 5, 9, Fig. 1, 2), Wynne (1995: 332; Fig. 86).
Alga de color verde brillante, erecta, hasta
Material examinado: San Francisquito, 28/04/04, M. García, S. Ardito & W. Durán 962a (VEN), Puerto Francés, 11/08/04, M. García, S. Ardito & W. Durán 962b (VEN).
Bryopsidales
Bryopsidaceae
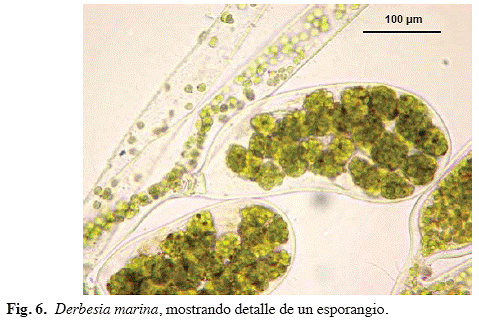
Derbesia marina (Lyngb.) Solier (Fig. 6)
Halicystis ovalis (Lyngb.) Areschoug
Referencias: Littler & Littler (2000: 346, Fig. 1), Stegenga & Vroman (1988: 300, Fig. 1-4), Joly et al. (1965: 129; lám. 2, Fig. 2-3).
Alga de color verde oscuro, formada por delicados filamentos, esporófito de
Material examinado: Puerto Francés, 28/04/04, M. García, S. Ardito & W. Durán 963 (VEN).
Caulerpaceae
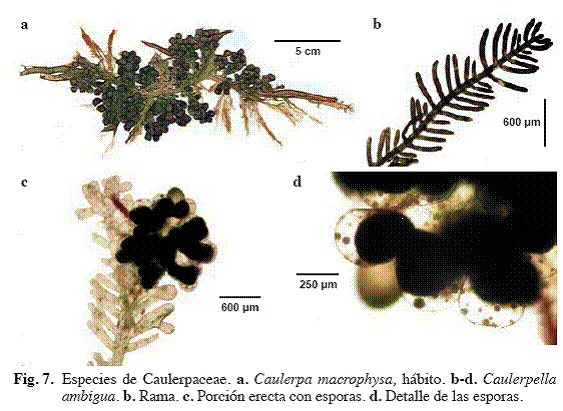
Caulerpa macrophysa (Sond. ex Kütz.) G. Murray (Fig. 7a)
Caulerpa racemosa var. macrophysa (Sond. ex Kütz.) W.R. Taylor
Referencias: Littler & Littler (2000: 362, Fig. 1, 2), Ríos (1972: 236, lám. 8, Fig. 19), Schnetter (1978: 66, lám. 7, Fig. c).
Alga de color verde grama, diferenciado en una porción rizoidal, una estolonífera y una erecta de
Material examinado: San Francisquito, 17/03/2003, S. Ardito, M. García & D. García 349 (VEN). Ibid, 11/08/04, S. Ardito, M. García & J. Hernández 714 (VEN).
Caulerpella ambigua (Okamura) Prudhomme van Reine & Lokhorst (Fig. 7b-d)
Caulerpa vickersiae Børgesen, Caulerpa vickersiae var. furcifolia
Referencias: Littler & Littler (2000: 378, Fig. 1-3), Vera (2000: 37, Fig. 15a); Wynne (1995: 331, Fig. 85).
Alga de color verde oscuro, diferenciada en filoides, cauloides y rizoides, hasta
Material examinado: Puerto Francés, 28/04/04, S. Ardito, M. García & W. Durán 423 (VEN).
Polyphysaceae
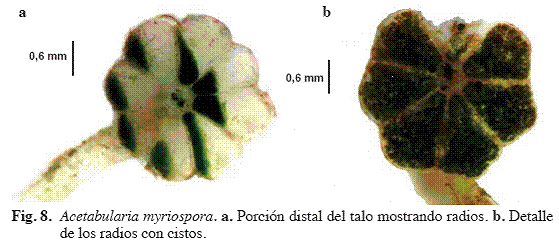
Acetabularia myriospora A.B. Joly & Cord.-Mar. (Fig. 8)
Polyphysa myriospora (Joly & Cord.-Mar.) Bula-Meyer, Polyphysa deltaoide (M. Howe) E. Sosa
Referencias: Littler & Littler (2000: 442, Fig. 1-3), García et al. (2003: 233, Fig. 1 a-c).
Alga de color verde brillante, erecta, frágil, calcificada, de 0,2-
Material examinado: Puerto Francés, 30/06/04, S. Ardito, O. Hokche & J. Hernández 778 (VEN).
Ochrophyta
Sphacelariales
Sphacelariaceae
Sphacelaria rigidula Kütz. (Fig. 9a)
Sphacelaria furcigera Kütz., Sphacelaria variabilis Sauvageau, Sphacelaria linearis Takamatsu, Sphacelaria apicalis Takamatsu, Sphacelaria expansa Noda, Sphacelaria iwagaskensis Noda
Referencias: Lemus (1974: 31, Fig. 20), Littler & Littler (2000: 252, Fig. 1), Ouriques & Cordeiro (2004: 307, Fig. 32-34).
Alga de color marrón oscuro, filamentosa, erecta, formando césped de hasta
Material examinado: Puerto Francés, 16/03/04, M. García, S. Ardito & W. Durán 853 (VEN).
Sphacelaria tribuloides Menegh. (Fig. 9b)
Sphacelaria rigida Hering
Referencias: Chapman (1963: 183), Taylor (1960: 211, lám. 29, Fig. 6), Lemus (1974: 32, Fig. 25-28, 30-32), Kapraum (1984: 72, Fig. 131), Littler & Littler (2000: 252, Fig. 1-2), Vera (2000: 62, Fig. 22a).
Alga color marrón oscuro, filamentosa, erecta, de
Material examinado: Puerto Francés, 11/08/2004, S. Ardito, M. García, O. Hokche & J. Hernández 767 (VEN).
Rhodophyta
Erythropeltidales
Erythrotrichiaceae
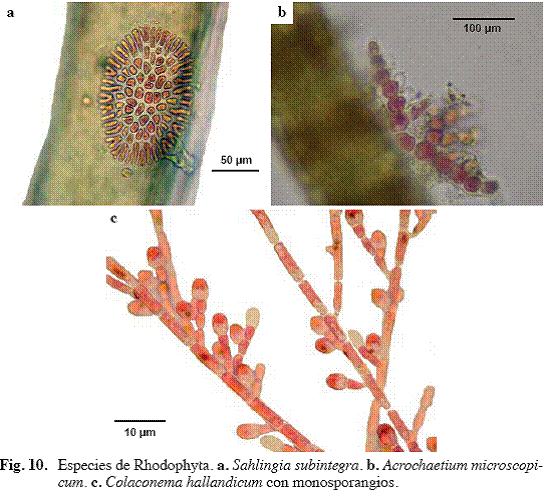
Sahlingia subintegra (Rosenv.) Kornmann (Fig. 10a)
Erythropeltis subintegra (Rosenv.) Kornmann & Sahling, Erythrotrichopeltis subintegra (Rosenv.) Kornmann & Sahling
Referencias: Silva et al. (2003: 160, Fig. 2)
Alga de color rosado, epífita de otras macroalgas. Talo constituido por células dispuestas radialmente, que forma un disco entre 50 y 100 μm de diámetro, células centrales entre 6-8 μm de largo y 3-5 μm de diámetro.
Material examinado: San Francisquito, 13/10/04, M. García, S. Ardito, O. Hokche & M. Gamero 964 (VEN).
Acrochaetiales
Acrochaetiaceae
Acrochaetium microscopicum (Nägeli ex Kütz.) Nägeli (Fig. 10b)
Audouinella microscopica (Nägeli ex Kütz.) Woelk., Audouinella trifila (Buffham) Dixon, Audouinella crassipes (Børgesen ) Garbary 1979
Referencias: Abbott (1999: 54, Fig. 3g)
Alga de color rosado, epífita, filamentosa de hasta 100 μm de largo. Ramificación lateral. Células rectangulares de 5-8 μm de ancho y 25-30 μm de largo. Ápices obtusos, algunas veces presentan pelos incoloros.
Material examinado: Puerto Francés, 28/04/04, M. García, S. Ardito & W. Durán 965 (VEN).
Colaconematales
Colaconemataceae
Colaconema hallandicum (Kylin) Afonso-Carillo, Sanson, Sangil & Diaz-Villa (Fig. 10c)
Acrochaetium sargassi Børgesen, Acrochaetium hallandicum (Kylin) G. Hamel, Rhodochorton hallandicum (Kylin) Drew, Kylinia hallandica (Kylin) Kylin, Chromastrum hallandicum (Kylin) Papenfuss, Audouinella hallandica (Kylin) Woelkerling
Referencias: Schneider & Searles (1991: 200, Fig. 238)
Alga de color rosado, epífita, filamentosa, monosifónica, hasta 1mm de largo, fijada al sustrato mediante una célula basal, no dividida, elongada a rectangular, con base disciforme. Ramificación alterna, lateral o irregular. Células cilíndricas de 3-7 μm de diámetro y de 3-10 μm de largo. Monosporangios ovoides, simples o en pares, pedicelados, originándose terminalmente de las ramas laterales.
Material examinado: Puerto Francés, 13/10/04, S. Ardito, M. García, O. Hokche & M. Gamero 779 (VEN).
Ceramiales
Ceramiaceae
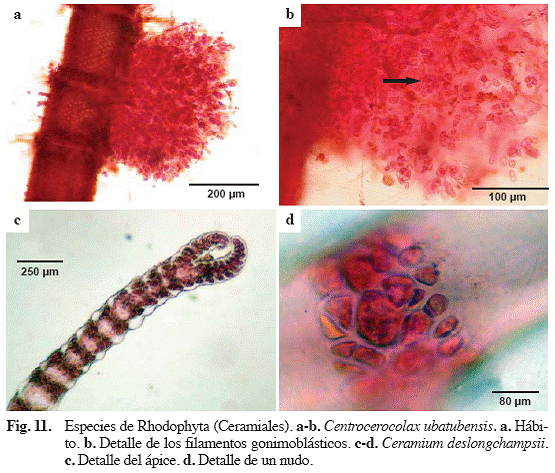
Centrocerocolax ubatubensis A.B.Joly (Fig. 11a, b)
Referencias: Joly (1965: 73-79, Fig. 1-29), García & Gómez (2001: 7, Fig. 5).
Alga incolora, parásita, formando masas verrugosas, de 200-250 μm de diámetro, esféricas a irregularmente lobuladas, fijadas al huésped por una célula alargada. Filamentos ramificados coalescentes, inmersos en una matriz gelatinosa. Célula apical visible por los bordes del talo. Gonimoblastos inmersos en el talo, muy ramificados.
Material examinado: Puerto Francés, 28/04/04, M. García, S. Ardito & W. Durán 964 (VEN).
Ceramium deslongchampsii Chauvin ex Duby (Fig. 11c, d)
Ceramium pellucidum (Kützing) Zanardini, Ceramium strictum Greville & Harvey, Ceramium diaphanum var. strictum (Kützing) Feldmann-Mazoyer
Referencias: Cordeiro-Marino (1978: 87, Fig. 236-241), Maggs & Hommersand (1993), Barros-Barreto & Yoneshigue-Valentin (2001)
Alga filamentosa, epífita, color rosado a rojizo, de
Material examinado: Puerto Francés, 28/04/04, M. García, S. Ardito & W. Durán 964 (VEN).
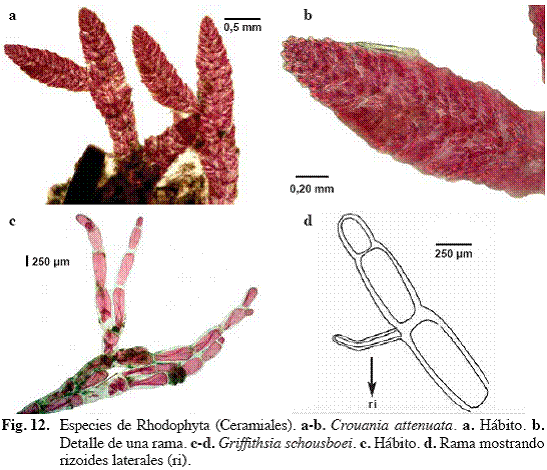
Crouania attenuata (C. Agardh) J. Agardh (Fig. 12a, b)
Crouania bispora P. Crouan & H. Crouan
Referencias: Littler & Littler (2000: 154, Fig. 1-2); García & Gómez (2001: 8, Fig. 7).
Alga delicada, gelatinosa, de color rosado pálido, hasta
Material examinado: San Francisquito, 09/06/04, S. Ardito, O. Hokche & J. Hernández 800 (VEN); Puerto Francés, 21/07/04, M. García, S. Ardito, O. Hokche & J. Hernández 967 (VEN).
Griffithsia schousboei Montagne (Fig. 12c, d)
Griffithsia subbiconica Stegenga
Referencias: Chapman (1963: 190), Joly et al. (1965: 135, lám. 6, Fig. 1-11); Taylor (1972: 516), Ballantine & Wynne (1986: 501); Littler & Littler (2000: 156, Fig. 1, 2).
Alga de color rosado oscuro, con porciones postradas y erectas de hasta
Material examinado: Puerto Francés, 28/04/04, S. Ardito, M. García & W. Durán 801 (VEN).
Delesseriaceae
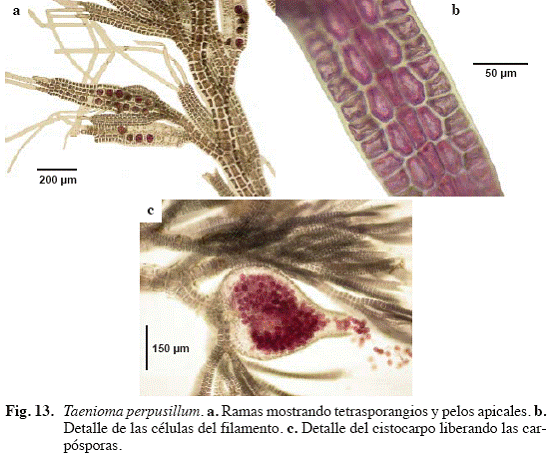
Taenioma perpusillum (J. Agardh) J. Agardh (Fig. 13)
Taenioma dotyi Hollenberg
Referencias: Ganesan et al. (1985: 243, Fig. 20-25); Sartoni & Salghetti (1988: 145; Fig. 1a).
Alga de color marrón-rojizo, con porciones erectas y postradas. Eje postrado polisifonal, cilíndrico, entre 130 y 200 μm de diámetro, a partir del cual se originan rizoides unicelulares y a intervalos de
Material examinado: Puerto Francés, 13/10/04, S. Ardito, M. García, O. Hokche & M. Gamero 768 (VEN).
Dasyaceae
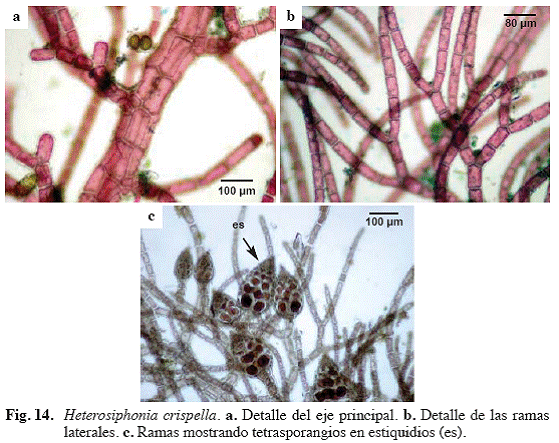
Heterosiphonia crispella (C. Agardh) M. J. Wynne (Fig. 14)
Heterosiphonia wurdemanni (Bailey ex Harvey) Falkenberg 1987
Referencias: Cordeiro-Marino (1978: 105, Fig. 306-309); Littler & Littler (2000: 108, Fig. 1-3).
Alga de color rosado oscuro, con porciones postradas y erectas, hasta
Material examinado: Puerto Francés, 13/10/04, M. García, S. Ardito, O. Hokche & M. Gamero 968 (VEN).
Rhodomelaceae
Acanthophora muscoides (L.) Bory (Fig. 15)
Fucus muscoides L., Chondria muscoides C. Agardh
Referencias: Littler & Littler (2000: 190, Fig. 1-3); De Jong et al. (1999: 225, Fig. 15-20).
Alga erecta, cartilaginosa, ramificada, de color marrón rojizo, entre 8 y
Material examinado: San Francisquito, 09/06/04, S. Ardito, O. Hokche & J. Hernández 563 (VEN). Ibid, 21/07/04, S. Ardito, M. García, O. Hokche & J. Hernández 675 (VEN).
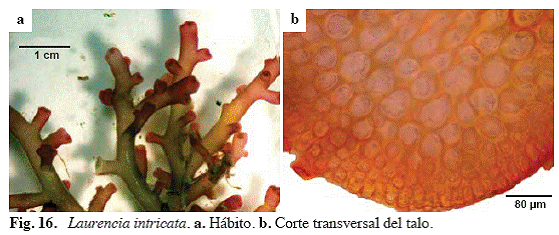
Laurencia intricata Lamouroux (Fig. 16)
Laurencia obtusa var. intricata (Lamouroux) J. Agardh 1842, Laurencia implicata J. Agardh 1852.
Referencias: Taylor (1960: 626), García (1999: 78, Fig. 38).
Alga de color rosado-rojizo, de 3-
Material examinado: San Francisquito, 09/06/04, S. Ardito, O. Hokche & J. Hernández 575 (VEN). Puerto Francés, 13/10/04, S. Ardito, M. García, O. Hokche & M. Gamero 770 (VEN).
Gelidiales
Gelidiaceae
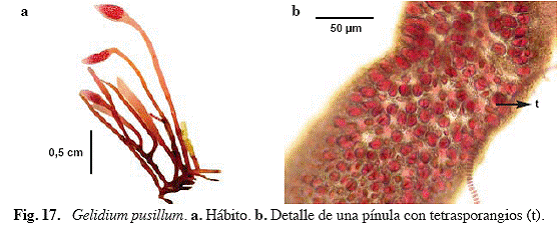
Gelidium pusillum (Stackhouse) Le Jolis (Fig. 17)
Acrocarpus pusillus (Stachouse) Kütz., Gelidium repens Okamura, nom. illeg.
Referencias: Taylor (1960: 354, lám. 45, Fig. 4), Ríos (1972: 266, lám. 22, Fig. 3, 4), Rodríguez (1991: 8, Fig. 3-5), Schneider & Searles (1991: 218, Fig. 256, 257), García (1999: 55, Fig. 21d, 22a, b), Littler & Littler (2000: 44, Fig. 13), Vera (2000: 96, Fig. 33a).
Alga de color rojo a marrón oscuro, erecta, rígida, de
Material examinado: San Francisquito, 30/06704, S. Ardito, O. Hokche & J. Hernández 618 (VEN).
Gigartinales
Cystocloniaceae
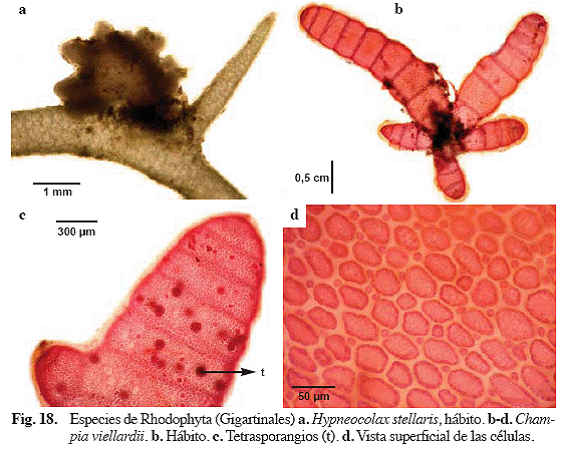
Hypneocolax stellaris Børgesen (Fig. 18a)
Referencias: Taylor (1960: 469); Albornoz & Ganesan (1994: 19-28, Fig. 2-9)
Alga color rosado pálido, parásita, formando pústulas, solitaria o en grupos, de 1-
Material examinado: Puerto Francés, 21/07/04, S. Ardito, M. García, O. Hokche & J. Hernández 802 (VEN).
Rhodymeniales
Rhodymeniaceae
Champia viellardii Kützing (Fig. 18 b-d)
Referencias: Ríos (1972: 287), Wynne (1995: 285, Fig. 22-24), García (1999: 67, Fig. 30), Abbott (1999: 218, Fig. 60 d-f), Littler & Littler (2000: 114, Fig. 1-4).
Alga de color rojo pálido, iridiscente, segmentada, hasta
Material examinado: Puerto Francés, 11/08/04, S. Ardito, M. García & J. Hernández 700 (VEN).
AGRADECIMIENTOS
Las autoras de este trabajo agradecen a
BIBLIOGRAFÍA
1. Abbott,
2. Acosta, J.M. 1974. Estudio de las comunidades vegetales en
3. Albornoz, O. 1986-88. Macroalgas marinas del estado Falcón (Venezuela) I. Bol. Centro Invest. Biol. 17: 1-34.
4. Albornoz, O. & E.K. Ganesan. 1994. Marine macroalgae of
5. Ardito, S. 1994. Algunos aspectos en la estructura de una comunidad intermareal de macroalgas marinas en una región del litoral central de Venezuela. Trabajo Especial de Grado. Facultad de Ciencias. Universidad Central de Venezuela. Caracas, Venezuela.
6. Ardito, S., S. Gómez & B. Vera. 1995. Estudio sistemático de las macroalgas marinas bentónicas en la localidad de Taguao, Distrito Federal, Litoral Central, Venezuela. Acta Bot. Venez. 20(2): 25-108.
7. Ardito, S. & B. Vera. 1997. Catálogo de las macroalgas marinas del Herbario Nacional de Venezuela. Acta Bot. Venez. 18(1-2): 53-66.
8. Balladares, C., P. Castellanos & F. Müller-Karger. 1997. Upwelling streams in the Venezuelan coast observed by NOAA satellites. Fourth International Conference on remote sensing for Marine and Coastal Enviroments,
9. Ballantine, D. & M. Wynne. 1986. Notes on the marine algae of
10. Barrios, J., S. Sant, E. Méndez & L. Ruiz. 2003. Macroalgas asociadas a arrecifes coralinos en el Parque Nacional Mochima, Venezuela. Saber, Universidad de Oriente, Venezuela 15(1-2): 28-32.
11. Barros-Barreto, M.B. & Y. Yoneshigue-Valentin. 2001. Aspectos morfológicos do genero Ceramium Roth (Ceramiaceae, Rhodophyta) no Estado do Rio de Janeiro. Hoehnea 28(1): 77-110. [ Links ]
12. Bertness, M., S. Gaines & M. Hay. 2001. Marine community ecology. Sinaver Associates,
13. Chapman V. 1963. The marine algae of
14. Cordeiro-Marino, M. 1978. Rodoficeas bentónicas marinhas do estado de Santa Catarina Brasil. Rickia 7: 1-123. [ Links ]
15. Darley, M. 1987. Biología de las algas. Enfoque fisiológico. Editorial Limusa S.A., México. [ Links ]
16. De Jong, Y., C. Hitipeuw & W. PrudHomme Van Reine.
17. Dring, M. 1992. The biology of marine plants.
18. Ganesan, E.
19. Ganesan, E.K., O. de Alfonso, M. Aponte & A. González. 1985. Studies of the marine algal flora of
20. García, M. 1999. Estudio florístico de las macroalgas bénticas marinas de la localidad de Carmen de Uria, Litoral Central, estado Vargas. Trabajo Especial de Grado. Facultad de Ciencias. Universidad Central de Venezuela. Caracas, Venezuela. [ Links ]
21. García, M. & S. Gómez. 2001. Nuevos registros ficoflorísticos para el estado Vargas, Litoral Central, Venezuela. Acta Bot. Venez. 24(1): 1-12. [ Links ]
22. García, M., B. Vera & S. Gómez. 2003. Acetabularia myriospora Joly & Cordeiro-Marino (Chlorophyta, Polyphysaceae) nuevo registro para la costa venezolana. Acta Bot. Venez. 26(2): 231-236. [ Links ]
23. Gil, N. 2001. Estudio florístico de las macroalgas marinas que crecen en la localidad de Playa Mero (Cayo Ánimas, Parque Nacional Morrocoy, estado Falcón, Venezuela). Trabajo Especial de Grado. Facultad de Ciencias. Universidad Central de Venezuela. Caracas, Venezuela. [ Links ]
24. Gómez, S. 1998. Rhodophyta (algas marinas rojas) del Parque Nacional Archipiélago Los Roques. Tesis Doctoral. Facultad de Ciencias. Universidad Central de Venezuela. Caracas, Venezuela. [ Links ]
25. González, A. 1977. Estudio fico-ecológico de una región del Litoral Central (Punta de Tarma) Venezuela. Acta Bot. Venez. 12(1-4): 207-240. [ Links ]
26. González, A. & B. Vera. 1994. Algas. In: Flora del Parque Nacional Morrocoy. (Manara, B., ed.), pp. 63-126. Fundación Instituto Botánico de Venezuela y Agencia Española de Cooperación Internacional (AECI), Caracas. [ Links ]
27. Guiry, M.D. & N. Dhonncha. 2008. Algaebase versión 2.1. World-wide electronic publication, National University of Ireland,
28. Hammer, L. & F. Gessner. 1967. La taxonomía de la vegetación marina en la costa de Venezuela. Bol. Inst. Oceanogr. Univ. Oriente 6: 186-265.
29. Jaccard, P. 1908. Nouvelles sur la distribution florale. Bull. Soc. Vaud. Sci. Nat. 44: 223-270. [ Links ]
30. Joly, A. 1965. Centrocerocolax, a new parasitic genus of the Rhodophyta. Rickia 2: 73-79. [ Links ]
31. Joly, A., M. Cordeiro, N. Yamasguishi & Y. Ugadim. 1965. Additions to the marine flora of Brazil IV. Rickia 2: 129-139. [ Links ]
32. Kapraun, D. 1984. An illustrated guide to the benthic marine algae of Coastal North Carolina II. Chlorophyta and Phaeophyta. In: Biblioteca Phycologica (Cramer, J., ed.), pp. 7-104. The Universityof North Carolina Press, Chapel Hill.
33. Lemus, A. 1974. Estudio taxonómico de las familias Ectocarpaceae, Sphacelariaceae y Dictyotaceae (Phaeophyta) de las costas occidentales del estado Sucre, Venezuela. Bol. Inst. Oceanogr. Univ. Oriente 13(1-2): 23-46.
34. Lemus, A. 1979. Las algas marinas del Golfo de Paria, Venezuela. I. Chlorophyta y Phaeophyta. Bol. Inst. Oceanogr. Univ. Oriente 18: 17-36.
35. Littler, D. & M. Littler. 2000.
36. Maggs, C.A. & M.H. Hommersand. 1993. Seaweeds of the
37. McGuinness, K. & A. Underwood. 1986. Habitats structures and the nature of communities on intertidal boulder. J Exp Mar Biol Ecol. 104: 97-123. [ Links ]
38. Narváez, A. 1995. Ecología de comunidades de algas que se establecen sobre sustratos artificiales en un arrecife coralino del Parque Nacional Morrocoy. Trabajo Especial de Grado. Facultad de Ciencias. Universidad Central de Venezuela.
39. Orduña, J. & D. Robledo. 1999. Effects of irradiance and temperature on the release and growth of carpospores fron Gracilaria cornea J. Agardh (Gracilariales, Rhodophyta). Bot. Mar. 42: 315-319.
40. Ouriques, L. & M. Cordeiro. 2004. Levantamento florístico das ordens Ectocarpales, Chordariales, Scytosiphonales e Sphacelariales (Phaeophyta) do litoral do estado de Santa Catarina, Brasil. Hoehnea 31(3): 293-312.
41. Peréz-Cortéz, S., B. Vera & C. Sánchez. 2003. Técnica de coloración útil en la interpretación anatómica de Gracilariopsis tenuifrons y Gracilaria chilensis (Rhodophyta). Acta Bot. Venez. 26(2): 237-244.
42. Ríos, N. 1972. Contribución al estudio sistemático de las algas macroscópicas de la costa de Venezuela. Acta Bot. Venez. 7(1-4): 219-324.
43. Rodríguez, N. 1991. Estudio taxonómico en agarofitas de Venezuela I. Notas sobre el género Gelidium Lamourox (Rhodophyta, Gelidiales). Ernstia 2(3-4): 77-93
44. Santelices, B. 1988. Algas marinas de Chile. Universidad Católica de Chile, Santiago. [ Links ]
45. Sartoni, G. & U. Salghetti. 1988. Osservazioni morfologiche in Taenioma perpusillum (J. Agardh) J. Agardh e T. nanum (Kützing) Papenfuss (Delesseriaceae, Rhodophyta). Inform. Bot. Ital. 19(2): 144-154. [ Links ]
46. Schneider, C.W. & R. Searles. 1991. Seaweeds of the Southeastern United
47. Schnetter, R. 1978. Marine Algen der Karibischen Kusten von Kolombien. II. Chlorophyceae. Bibl. Phycol. 42: 1-199. [ Links ]
48. Silva, S., L. Brito & A. Lemus. 2003. Nuevas adiciones de algas marinas para el Parque Nacional Mochima, Sucre, Venezuela. Revista Biol. Trop. 51(4): 159-165. [ Links ]
49. Solé, M.A. & B. Vera. 1997. Caracterización de las macroalgas marinas bénticas en la región Chirimena-Punta Caimán, estado Miranda, Venezuela.
50. Stegenga, H. & M. Vroman. 1988. Additions to the marine algal flora of
53. Underwood, A. & P. Jernakoff. 1984. Effects of interactions between algae and grazing gastropods on the structure of low-shore intertidal algal community. Oecologia 48: 221-233. [ Links ]
54. Vera, B. 1996. Registro ficoflorístico de la localidad de El Cusuy, Litoral Central de Venezuela. Acta Bot.
55. Vera, B. 1997. Estudio ficológico de la localidad de Punta Care, Litoral Central de Venezuela. Libro de resúmenes del XIII Congreso Venezolano de Botánica, Universidad Nacional Experimental del Táchira. San Cristóbal, Venezuela. [ Links ]
56. Vera, B. 2000. Estudio ficoflorístico de la región oriental del Litoral Central de Venezuela, estado Vargas, Venezuela. Trabajo de Ascenso. Facultad de Ciencias. Universidad Central de Venezuela. Caracas, Venezuela. [ Links ]
57. Wynne, M.J. 1995. Benthic marine algae from the Seychelles collected during the R/V Te veja Indian Ocean Expedition. Contr. Univ. Michigan Herb. 20: 261-346. [ Links ]
58. Wynne, M.
59. Yokoya, N. & E. Oliveira. 1993. Effects of temperature and salinity on spores germination and sporeling development in South American agarophytes (Rhodophyta). Jap. J. Phycol. 41: 283-293. [ Links ]












 uBio
uBio