Acta Botánica Venezuelica
versión impresa ISSN 0084-5906
Acta Bot. Venez. v.34 n.1 Caracas jun. 2011
EFECTO DEL AMBIENTE DE DESARROLLO SOBRE LA ANATOMÍA FOLIAR DE Cattleya jenmanii Rolfe Y C. lueddemanniana Rchb.f. (ORCHIDACEAE)
Jhonathan Torres A. y María E. Sanabria Ch.
Postgrado de Agronomía. Decanato de Universidad Centroccidental Lisandro Alvarado. Aptdo. 400. Barquisimeto. Venezuela. jhonathantorres@ucla.edu.ve
RESUMEN
Las orquídeas Cattleya jenmanii y C. lueddemanniana son especies ornamentales, endémicas de Venezuela. Su propagación comercial se logra por cultivo in vitro y durante la aclimatación suelen producirse pérdidas que implican costos adicionales. Es necesario comprender el efecto de tales actividades sobre la estructura anatómica de las vitroplantas para diseñar prácticas de manejo en vivero. El propósito del presente trabajo fue describir y comparar la anatomía de la lámina foliar de las dos especies de orquídeas mencionadas, provenientes de orquideario y en dos momentos diferentes de la propagación in vitro (multiplicación y aclimatación). Para ello se comparó la anatomía foliar de plantas cultivadas en orquideario y multiplicación in vitro, usando microscopía óptica. Los cultivos fueron realizados en medio Murashige-Skoog (1962). Las vitroplantas enraizadas fueron aclimatadas en un propagador de neblina durante una semana, en cámara húmeda por cuatro semanas y en orquideario durante tres semanas. Las muestras se procesaron mediante procedimientos de microtecnia clásica. El ambiente donde se desarrolló el proceso de mutiplicación in vitro indujo la reducción del espesor de la lámina, de la epidermis y la cutícula; disminuyó la complejidad del mesofilo, con ausencia de hipodermis, nódulos de fibras, haces vasculares de segundo orden e idioblastos, mientras que en las hojas provenientes de vitroplantas recién aclimatadas hubo una tendencia a la adquisición de una organización similar a la de las cultivadas en orquideario, pero con características de hojas desarrolladas in vitro, lo que sugiere que la adaptación a las condiciones ex vitro no se completó durante las ocho semanas de aclimatación.
Palabras clave: Aclimatación, anatomía, Cattleya, orquídeas, propagación in vitro
Effect of the development environment on the leaf anatomy of Cattleya jenmanii Rolfe and C. lueddemanniana Rchb.f. (Orchidaceae)
ABSTRACT
The orchids Cattleya jenmanii and C. lueddemanniana are important ornamental species, endemics of Venezuela. The commercial production is achieved by in vitro culture. During the acclimatization, there take place plant losses that imply additional costs. For the appropriate design of practices of culture in greenhouses, it is important to understand the effect of the acclimatization in the anatomy of in vitro plants. The intention of the present work was to describe and to compare the leaf anatomy of the two named species of orchids, grown in the orchidarium house and in two different moments of in vitro propagation (multiplication and acclimatization). Plants were cultured in the Murashige-Skoog medium (1962). The rooted vitroplants were acclimatized in a mist propagator during a week, humid chamber for four weeks and orchidarium for three weeks. The samples were processed by means of classical microtechnique procedures. The in vitro environment induced the thickness reduction of the leaf blade, epiderm and cuticle; mesophyll complexity reduction, hypoderm, fiber nodules, vascular bundles and idioblast absence. In the acclimatization stage, there was a trend to the acquisition of an similar structural organization to orchids house stage, but with characteristics of in vitro leaves. This suggests that the adjustment to the ex vitro conditions was not completed during eight weeks of acclimatization.
Key words: Acclimatization, anatomy, Cattleya, in vitro propagation, orchids
Recibido: 16/08/2008 Aceptado: 12/03/2010
INTRODUCCIÓN
La propagación in vitro de plantas ha experimentado un considerable incremento del número de materiales en que es aplicable y del conocimiento de los factores que determinan su éxito. Entre ellos destacan los relacionados con el ambiente de cultivo (Piqueras & Debergh 1999). En términos generales, a esta disciplina se le puede considerar una herramienta exitosa, pero en casos particulares presenta inconvenientes. Ciertas especies no se adaptan bien a la propagación in vitro. Otras logran superar exitosamente todas las fases, pero presentan dificultades en el momento de la aclimatación, hasta el punto de restringir la aplicabilidad de la micropropagación (Pospisilova et al. 1998). Algunos autores han atribuido esta situación a las condiciones particularmente benignas del interior de los recipientes de cultivo, que no existen en los ambientes de crecimiento natural, y que suprimen estímulos externos indispensables para el desarrollo normal. Esto causa la aparición de múltiples defectos y anormalidades anatómicas y fisiológicas que afectan los mecanismos de regulación hídrica y de fotosíntesis, que en definitiva dificultan la adaptación al ambiente ex vitro (Masooma et al. 1998; Zobayed et al. 1999; Majada et al. 2000; Seon et al. 2000). La alta humedad relativa en el interior de los recipientes de cultivo in vitro promueve el crecimiento, pero también induce alteraciones en la estructura de las hojas (Apóstolo et al. 2005).
Las diferencias anatómicas entre individuos de una especie o entre especies de un mismo género son dependientes en gran medida del genotipo. Sin embargo, las condiciones ambientales tienen una fuerte influencia en la estructura de brotes y hojas, particularmente en las plantas sujetas a la propagación in vitro. Seon et al. (2000) señalan que las condiciones típicas de micropropagación causan alteraciones en el desarrollo normal de los estomas y reducen la capacidad de adaptación de las hojas a cambios ambientales.
Durante la aclimatación suelen producirse pérdidas debidas a fallas en la adaptación al ambiente ex vitro (Masooma et al. 1998; Zobayed et al. 1999; Majada et al. 2000; Seon et al. 2000). Para superar tal condición se generan costos adicionales y mayor complejidad de las labores de cultivo. Esto justifica la necesidad de estudiar el efecto del ambiente en las plantas cultivadas in vitro y del proceso de aclimatación sobre la estructura anatómica de las hojas de vitroplantas de orquídeas, con la finalidad de diseñar prácticas efectivas de manejo temprano en vivero. Estudios con una orientación similar han sido llevados a cabo en diversos cultivos, como por ejemplo en Rubus idaeus L. (Donnelly et al. 1985), vid (Dami & Hughes 1995), tabaco (Pospisilova et al. 1998), papa (Zobayed et al. 1999), clavel (Majada et al. 2000, 2002), Dendrobium Sw. (Anita et al. 2000), alcachofa (Apóstolo et al. 2005) y Cattleya jenmanii (Torres et al. 2006). El propósito del presente trabajo fue describir y comparar la anatomía de la lámina foliar de las orquídeas jenmanii y C. lueddemanniana, provenientes de orquideario y en dos momentos diferentes de la propagación in vitro (multiplicación y aclimatización), por medio de microscopía óptica, dado que las vitroplantas de dichas especies presentan dificultades de adaptación al ambiente ex vitro.
MATERIALES Y MÉTODOS
Cultivo en orquideario de Cattleya jenmanii y C. lueddemannniana
Se cultivaron 12 plantas adultas de cada especie en el umbráculo del Posgrado de Horticultura de la Universidad Centroccidental Lisandro Alvarado (UCLA), en Tarabana 10º05 N, 69º16 O y 510 m snm, estado Lara, Venezuela, bajo una irradiancia máxima de 180 μmol.s-1.m-2, temperatura promedio de 30ºC y humedad relativa promedio de 71%. Se tomaron muestras de las 12 plantas de cada especie.
Micropropagación y aclimatización de Cattleya jenmanii y C. lueddemannniana
En la etapa de micropropagación se trabajó con 24 individuos de cada especie, provenientes de la Unidad de Biotecnología Vegetal de la UCLA. Se cultivaron en el medio de Murashige-Skoog (1962), modificado para el cultivo de Cattleya Lindl. por Torres & Mogollón (1997), con 2 mg/l de Bencil Adenina (BA). La irradiación en el cuarto de crecimiento fue de 37,84 μmol.s-1.m-2, el fotoperíodo de 16 h y la temperatura de 25±2ºC. Se usaron recipientes de cristal con tapa translúcida precintada con film plástico para el empacado. Al final del período de propagación in vitro se realizó un muestreo y el resto de las vitroplantas cultivadas se transfirieron a la fase de aclimatación. Durante esta última fase de cultivo, las vitroplantas enraizadas fueron tratadas con una solución de 3 g/l de Ridomil y plantadas en maceteros de 8 cm de diámetro con un sustrato compuesto por fibra de helecho arborescente. Posteriormente fueron colocadas en propagador de neblina, con una frecuencia de aspersión de 5 min cada 24 h, durante una semana.
Luego fueron transferidas a una cámara húmeda con una irradiancia de 40-60 μmol.s-1.m-2, durante 4 semanas y al umbráculo durante 3 semanas, al cabo de las cuales se realizó la toma de muestras a 24 vitroplantas por especie.
Estudios de microscopía óptica
Para los estudios se emplearon 48 muestras, que representaban 12 hojas para las plantas adultas en umbráculo y 24 para las plantas in vitro y en aclimatación.
Las mismas consistieron en secciones extraídas del tercio medio de hojas adultas del simpodio más reciente. Éstas fueron posteriormente subdivididas y fijadas en FAA (Roth 1964). Se realizaron secciones transversales de forma manual y con micrótomo de acuerdo a los métodos de microtecnia clásica descritos por Sass (1958) y Roth (1964). El montaje de los cortes se hizo con Permount.
Las observaciones se realizaron en el Laboratorio de Microscopía del Instituto de Biología Molecular y Celular de las Plantas de la Universidad Politécnica de Valencia, España. Se utilizó un microscopio óptico Nikon Eclipse E600. Las variables: grosor de epidermis adaxial y abaxial, grosor de la cutícula adaxial y abaxial, grosor de la lámina foliar, grosor de mesofilo, área de haces vasculares, área de xilema y área de floema, se midieron en fotomicrografías tomadas con una cámara digital Color View 12 de la casa Soft Imaging System y el procesamiento de imágenes con el programa analySIS 3.1. Se tomaron datos de 2 a 5 campos de cada muestra en cada ambiente. Los datos fueron analizados mediante el programa Statgrafics Plus 5.1. Para ello se realizaron transformaciones de datos, análisis de varianza y pruebas de medias de Duncan, para aquellos datos que se ajustaban a la distribución normal (área promedio de haces vasculares, xilema y floema en secciones transversales de hojas de Cattleya jenmanii). Se utilizó la prueba no paramétrica de Kruscal-Wallis para analizar los datos que no se ajustaban a dicha distribución (resto de las variables estudiadas), de acuerdo a lo señalado por Corder & Foreman (2009).
RESULTADOS
Cattleya jenmanii Rolfe
Caracteres anatómicos de la hoja desarrollada en orquideario (Tabla 1, Fig. 1) Lámina foliar glabra e hipoestomática. Tamaño de las células epidérmicas similar en ambas superficies (Fig. 1a). Cutícula engrosada con abundantes depósitos de ceras, más delgada en la epidermis abaxial que en la adaxial, la primera con numerosos estomas ubicados a nivel de la superficie foliar (Fig. 1b). Hipodermis formada por una capa de células de contenido hialino, ubicada por debajo de la epidermis adaxial. Mesofilo bifacial, con ligera diferenciación de las células en la mitad adaxial y abaxial. La primera con células alargadas ricas en cloroplastos y con pocos espacios intercelulares, y la segunda con células isodiamétricas o ligeramente alargadas, con paredes delgadas, cloroplastos y escasos espacios intercelulares. Las secciones presentan 20-22 estratos de células, incluyendo la hipodermis. Nódulos de fibras esclerenquimáticas no ligados al tejido vascular, formando una fila adyacente a la epidermis abaxial. Haces vasculares rodeados por una vaina de fibras de esclerénquima ubicadas frente al floema, con paredes más engrosadas que el resto. Los haces vasculares dispuestos en dos niveles, los de mayor tamaño en la parte central de la lámina, los menores, adyacentes a la epidermis adaxial. Los de primer orden son colaterales y están rodeados de una vaina de fibras y células esEfecto del ambiente en la anatomía 203 tegmáticas con cuerpos silícicos. Células rafidiíferas escasas, adyacentes a ambas epidermis, abundantes idioblastos mucilaginosos (Fig. 1a, b).

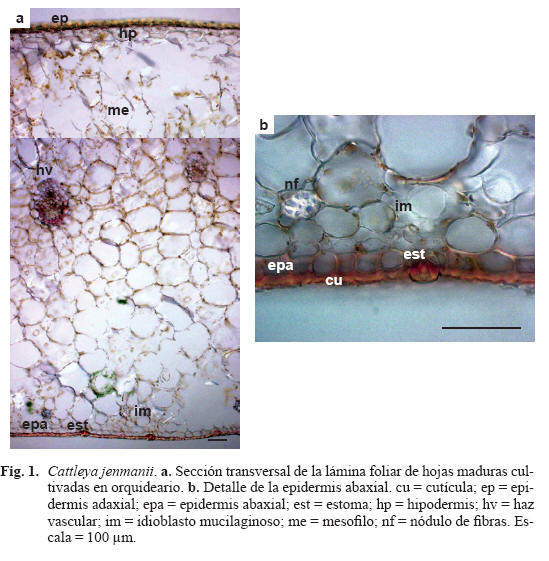
Caracteres anatómicos de la hoja desarrollada in vitro (Tabla 1, Fig. 2)
Lámina foliar anfiestomática. Epidermis adaxial con células ligeramente más grandes que en la abaxial, cutícula poco engrosada, tricomas glandulares tricelulares caedizos y estomas aislados (Fig. 2a). Epidermis abaxial con estomas numerosos y cutícula poco engrosada (Fig. 2b). Hipodermis ausente. Mesofilo isofacial con 9-12 estratos de células isodiamétricas con paredes delgadas y espacios intercelulares. Haces vasculares colaterales dispuestos en una fila paralela, equidistante a ambas epidermis y rodeados por una vaina de esclerénquima constituida por fibras con paredes poco engrosadas y células estegmáticas escasas.
Caracteres anatómicos de la hoja desarrollada durante la aclimatación (Tabla 1, Fig. 3)
Lámina foliar anfiestomática y tricomas glandulares tricelulares. Epidermis adaxial compuesta por células más grandes que la adaxial, cutícula poco engrosada y estomas aislados (Fig. 3a). Epidermis abaxial con numerosos estomas ubicados al nivel de la superficie foliar, cutícula poco engrosada (Fig. 3b). Hipodermis ausente. Mesofilo isofacial compuesto por 11-12 estratos de células isodiamétricas con paredes delgadas, sin diferenciación morfológica y con espacios intercelulares. Haces vasculares dispuestos en dos niveles, los de primer orden equidistantes a ambas epidermis y los de segundo, próximos a la adaxial y rodeados por una vaina de fibras de esclerénquima con paredes poco engrosadas. Los haces de primer orden son colaterales y están rodeados de células estegmáticas escasas, con cuerpos silícicos. Células rafidiíferas adyacentes a ambas epidermis.

Cattleya lueddemanniana Rchb. f.
Caracteres anatómicos de la hoja desarrollada en orquideario (Tabla 2, Fig. 4)
Lámina foliar glabra e hipoestomática (Fig. 4a). Epidermis adaxial (Fig. 4b) con células más grandes que en la abaxial. Cutícula más gruesa en la epidermis adaxial que en la abaxial con abundante depósito de ceras epicuticulares. La epidermis abaxial con numerosos estomas que sobresalen ligeramente de la superficie foliar (Fig. 4c). Hipodermis formada por una capa de células ubicada por debajo de la epidermis adaxial y constituida por células con contenido hialino. Mesofilo bifacial, con ligera diferenciación entre las células de la mitad adaxial y la abaxial. En la mitad adaxial, las células son alargadas, ricas en cloroplastos y con pocos espacios intercelulares, y en la mitad abaxial son isodiamétricas o ligeramente alargadas, con espacios intercelulares y pocos cloroplastos. Las secciones presentan 28-31 estratos de células, incluyendo la hipodermis. Nódulos de fibras esclerenquimáticas, no ligados al tejido vascular, distribuidos en filas adyacentes a ambas epidermis, los adaxiales más pequeños que los abaxiales. Haces vasculares rodeados por una vaina de fibras de esclerénquima con paredes engrosadas, engrosamiento mayor en las fibras ubicadas frente al floema. Haces vasculares dispuestos en tres niveles, los de mayor tamaño adyacentes a la epidermis abaxial, los de menor, a la adaxial y los de tamaño intermedio entre los anteriores. Haces vasculares de primer orden colaterales y rodeados de una vaina de fibras de esclerénquima y células estegmáticas con cuerpos silícicos. Células rafidiíferas escasas en posición adyacente a la epidermis adaxial, idioblastos mucilaginosos igualmente escasos.



Cracteres anatómicos de la hoja desarrollada in vitro (Tabla 2, Fig. 5)
Lámina foliar anfiestomática (Fig. 5a). Epidermis adaxial con células de tamaño similar a las de la abaxial, cutícula poco engrosada, tricomas glandulares bi celulares caedizos y tricomas simples pluricelulares (Fig. 5b, c). Epidermis abaxial con cutícula poco engrosada y numerosos estomas que sobresalen ligeramente de la superficie foliar y cutícula (Fig. 5d). Hipodermis ausente. Mesofilo isofacial compuesto por células isodiamétricas de paredes delgadas y con espacios intercelulares. Las secciones presentan 13-16 estratos de células. Haces vasculares dispuestos en dos niveles, los de mayor tamaño colaterales, en la parte central, y los más pequeños, próximos a la epidermis adaxial, todos rodeados de una vaina de esclerénquima cuyas células tienen las paredes poco engrosadas y células estegmáticas con cuerpos silícicos. Células rafidiíferas formando una fila en posición adyacente a la epidermis adaxial.

Caracteres anatómicos de la hoja desarrollada durante la aclimatación (Tabla 2, Fig. 6)
Lámina foliar de tipo anfiestomático. Epidermis adaxial con células un poco más grandes que las de la abaxial, cutícula poco engrosada. Epidermis abaxial con cutícula poco engrosada y numerosos estomas que sobresalen ligeramente de la superficie foliar. Hipodermis ausente. Mesofilo isofacial compuesto por 13-18 estratos de células isodiamétricas de paredes delgadas sin diferenciación morfológica y con espacios intercelulares (Fig. 6a). Nódulos de fibras esclerenquimáticas no ligados al tejido vascular en filas adyacentes a la epidermis abaxial (Fig. 6b). Haces vasculares dispuestos en dos niveles, los de mayor tamaño en la parte central, otros más pequeños, próximos a la epidermis adaxial, ambos rodeados por vainas de fibras con paredes poco engrosadas. Los de primer orden son colaterales y presentan células estegmáticas con cuerpos silícicos en la vaina. Células rafidiíferas formando una fila en posición adyacente a la epidermis adaxial y escasos idioblastos mucilaginosos.
Cuantificación de variables de las hojas en las tres condiciones
Cattleya jenmanii
El ambiente de desarrollo afectó el grosor de la epidermis, la lámina foliar y el mesofilo, medidos en secciones transversales de las hojas (Tabla 3).

En orquideario el grosor de la epidermis adaxial y abaxial varió desde un máximo de 42,0 y 37,7 μm, respectivamente, hasta un mínimo de 30,4 y 21,4 μm y 26,5 y 21,8 μm, en multiplicación y aclimatación. El grosor de la lámina foliar y del mesofilo fue mayor en orquideario, y menor en multiplicación in vitro. El área de haces vasculares, xilema y floema (Tabla 3), también se vieron afectados por el ambiente de desarrollo, y fue mayor en las tres variables en orquideario, y menor en aclimatación.

Cattleya lueddemanniana
El ambiente de desarrollo afectó el grosor de la epidermis, de la cutícula, de la lámina foliar y del mesofilo (Tabla 4). Las epidermis y cutículas adaxiales y abaxiales de plantas en orquideario registraron los mayores promedios variando desde 91,7 hasta 16,6 μm, en comparación con los promedios de las plantas de multiplicación in vitro y aclimatación. Estas últimas registraron los valores más bajos y similares entre sí para el grosor de las epidermis adaxial y abaxial (Tabla 4). Los menores grosores de cutícula adaxial y abaxial se presentaron en las hojas de plantas de multiplicación in vitro con 2,3 y 2,0 μm, mientras que las de la fase de aclimatación, valores intermedios con 5,5 y 4,0 μm. Las plantas en orquideario también registraron los mayores promedios de grosor de la lámina foliar y el mesofilo, con 2431,1 y 2286,7 μm, respectivamente; las plantas en multiplicación in vitro los menores valores con 443,3 y 413,1 μm, y las provenientes de aclimatación, con valores intermedios de 652,6 y 606,1 μm. El área de haces vasculares, el xilema y el floema (Tabla 4) también fueron afectados por el ambiente de desarrollo. Los mayores promedios de las tres variables se registraron en las plantas en orquideario; las de multiplicación in vitro y aclimatación registraron los menores (Tabla 4).

DISCUSIÓN
De los trabajos de investigación que existen acerca de la anatomía de la lámina foliar de Cattleya y de los demás representantes de Orchidaceae se puede deducir que, en general, las especies estudiadas durante la fase de orquideario no difirieron del patrón mostrado por la familia (Moller & Rasmussen 1984). Campos & Oliveira (1987) y Bonates (1993) describieron una anatomía similar en intermedia Graham. y C. eldorado Linden, respectivamente.
La anatomía de la lámina foliar de jenmanii y lueddemanniana en condiciones de orquideario fue similar a otros taxones de Orchidaceae en características como la presencia de una hipodermis uniseriada, idioblastos rafidíferos y haces vasculares colaterales con esclerénquima asociado (tribu Vanilleae, género Octomeria R.Br. y Sophronitis coccinea Rchb.f.), tricomas tricelulares, nódulos de fibras, haces vasculares colaterales, esclerénquima asociado con los haces vasculares, cuerpos silícicos e idioblastos mucilaginosos (subtribu Casetinae y Sophronitis coccinea) (Wakabayashi 1957; Bernardi et al. 1994; Widholzer & de Oliveira 1994; Baruah 1998; Stern & Judd 2000, 2001).
La lámina foliar presentó características xeromórficas en ambas especies. Entre éstas resaltaron el engrosamiento de la lámina, la epidermis y la cutícula, la presencia de hipodermis y el desarrollo del esclerénquima (Moller & Rasmussen 1984; Rundall 1992). Sin embargo, los promedios correspondientes al grosor de la lámina foliar, la epidermis, el número de capas de células del mesofilo, el número de filas de haces vasculares y de nódulos de fibras fueron menores en C. jenmanii que en lueddemanniana. Estas diferencias en la intensidad de las características xeromórficas pueden estar relacionadas con el hábitat donde se desarrollan las especies estudiadas. jenmanii crece entre los 800 y 1200 m snm, en selvas densas, húmedas y tupidas, mientras que el biotipo larense de C. lueddemanniana crece entre 400 y 700 m snm, en espinares, cardonales, bosques de galería en tierras bajas y selvas veraneras (Aulisi & Foldats 1989; Cuenca 1997).
Los resultados obtenidos permitieron describir el efecto de las condiciones de cultivo sobre la anatomía foliar de C. jenmanii y lueddemanniana, y el modo en que ésta varió ante el cambio ambiental durante la aclimatación. La diferencia existente entre el grosor de la lámina en las hojas de cultivo in vitro y de orquideario puede ser atribuida a la reducción del tamaño de estructuras y adquisición de caracteres juveniles propios de la micropropagación, tal como lo indicaron Anita et al. (2000). La epidermis, la cutícula y las capas de ceras epicuticulares desarrolladas in vitro son más delgadas que en orquideario. Además, se presentaron estomas y tricomas glandulares en la superficie adaxial que no fueron encontrados en la lámina foliar de orquideario. Esto podría ser atribuido al efecto del cultivo in vitro, lo que corresponde con George (1996), quien indicó que la micropropagación en contenedores cerrados resulta invariablemente en la formación de hojas con anormalidades estructurales y funcionales. Además, la ausencia de estímulos ambientales podría haber permitido la permanencia de tricomas que, en condiciones de cultivo ex vitro, se perderían. Durante la aclimatación no se detectaron cambios en el grosor de la epidermis o de la cutícula, ni en la presencia de tricomas y estomas en la superficie adaxial, en comparación con la multiplicación in vitro, que permitieran considerar la adaptación a las nuevas condiciones. Es evidente que el proceso de desarrollo de la lámina foliar adaptada a las condiciones ex vitro requiere un período mayor que la duración del presente estudio. Al respecto, Anita et al. (2000) señalaron una reducción en la deposición de ceras epicuticulares en hojas de Dendrobium producidas in vitro en comparación con las desarrolladas in vivo o durante la aclimatación. Este fenómeno también ha sido descrito para otras especies no pertenecientes a la familia Orchidaceae, como el tabaco (Pospisilova et al. 1998).
En las plantas provenientes de multiplicación in vitro el mesofilo presentó una menor complejidad estructural, con ausencia de hipodermis y de nódulos de fibras, una fila de haces vasculares de segundo orden y los idioblastos mucilaginosos, además de la reducción del número de estratos de células, el menor tamaño y complejidad de los haces vasculares, la menor cantidad de fibras asociadas al tejido vascular, el menor grosor de las paredes de las fibras y la reducción de la diferenciación del parénquima asimilador. Este efecto del cultivo in vitro fue descrito en especies no pertenecientes a Orchidaceae, tal como lo señaló Apóstolo et al. (2005) para alcachofa. Parece razonable pensar que las hojas desarrolladas en recipientes de cultivo in vitro no están expuestas a condiciones hídricas, de luminosidad y movimiento que activarían la expresión de los genes responsables del desarrollo de dichas características en el tejido fundamental y de sostén. Al respecto, Brainerd et al. (1981) señalaron que las vitroplantas de ciruelo experimentaron una reducción de tamaño de las células del parénquima en empalizada y un incremento de los espacios intercelulares durante el desarrollo in vitro. George (1996) indicó que la micropropagación en contenedores cerrados resulta invariablemente en la formación de hojas con anormalidades estructurales y funcionales. Durante la aclimatación se observó una tendencia a la adquisición de características similares a las de orquideario, pero manteniendo rasgos comunes con las desarrolladas in vitro, como la ausencia de hipodermis y la estructura homogénea del mesofilo. Estas características podrían ser consideradas como indicadores de que la hoja aún no ha adquirido la conformación requerida para la adaptación completa a las condiciones ex vitro, en lo referente al control del balance hídrico y la captación de la energía luminosa. La permanencia de características intermedias entre las hojas desarrolladas en el ambiente in vitro y el orquideario fue señalada en Cattleya jenmanii por Torres et al. (2006). Tales efectos se reducen progresivamente en las hojas nuevas. Campos & Oliveira (1987) encontraron en C. intermedia que a medida que se incrementó la luminosidad, se estimuló el desarrollo de caracteres xeromórficos.
A pesar de tratarse de una observación de campo permite inferir que la baja luminosidad durante la micropropagación afectó el desarrollo de estructuras de control de la pérdida de humedad en la hoja.
Estas observaciones representan una contribución a la comprensión de las causas que originan el fallo en la aclimatación y los retrasos en el desarrollo temprano en vivero de vitroplantas aclimatizadas de Cattleya.
BIBLIOGRAFÍA
1. Anita, S., L. Priya, K. Rajmohan & S. Alex. 2000. Comparison of chlorophyll content, water loss, and anatomical features of leaves of the normal, in vitro cultured and, hardened Dendrobium hybrid plants. J. Orchid Soc. India 14(1-2): 41-46.
2. Apóstolo, N., C. Brutti & B. Llorente. 2005. Leaf anatomy of Cynara scolymus L. in successive micropropagation stages. In Vitro Cell. Developmental Biol. 41: 307-313.
3. Aulisi, C. & E. Foldats. 1989. Monografía de las Cattleyas venezolanas y sus variedades. Editorial Torino. Caracas.
4. Baruah, A. 1998. Vegetavive anatomy of the endemic orchid Vanilla pilifera Holt. Phytomorphology 48(1): 101-105. [ Links ]
5. Bernardi, J., P. de Oliveira & J. de Araújo. 1994. Anatomia foliar de espécies do gênero Octomeria (Orchidaceae). Napaea 10: 7-14.
6. Bonates, L. 1993. Estudios ecofisiológicos de Orchidaceae da Amazonia. II. Anatomía ecológica foliar de espécies com metabolismo CAM de uma campina de Amazonia Cantral. Acta Amazon. 23(4): 315-348.
7. Brainerd, K., L. Fuchigami, S. Kwiatkowski & C. Clark. 1981. Leaf anatomy and water stress of aseptically cultured Pixi plum grown under different environments. HortScience 16: 173-175.
8. Campos, V. & P. Oliveira. 1987. Morfo-anatomía foliar de Cattleya intermedia (Orchidaceae). Napaea 2: 1-10.
9. Corder, G. & D. Foreman. 2009. Nonparametric statistics for non-statisticians: a step-by-step approach. Wiley, New York.
10. Cuenca, R. 1997. Cattleya jenmanii Rolf. Parte I. Orquideofilo 5(1): 4-7. [ Links ]
11. Dami, I. & H. Hughes. 1995. Leaf anatomy and water loss of in vitro PEG-treated Valiant grape. Pl. Cell Tissue Organ Cult. 42: 179-184.
12. Donnelly, D., W. Vidaver & K. Lee. 1985. The anatomy of tissue cultured red raspberry prior to and after transfer to soil. Pl. 4: 43-50.
13. George, E. 1996. Plant propagation by tissue culture. Part 2. In: Practice. Phenotipe of micropropagated material. Capítulo 15. Exegetics Limited. [ Links ]
14. Majada, J., F. Tadeo, M. Fal & R. Sánchez-Tamés. 2000. Impact of culture vessel ventilation on the anatomy and morphology of micropropagated carnation. Pl. Cell. Tissue Organ Cult. 63: 207-214.
15. Majada, J., M. Fal, F. Tadeo & R. Sánchez-Tamés. 2002. Effects of natural ventilation on leaf ultraestructure of Dianthus caryophyllus L. cultured in vitro. In Vitro Cell. Developmental Biol. 38: 272-278.
16. Masooma, A., H. Hughes & F. Safadi. 1998. Studies on stomatal function, epicuticular wax and stem-root transition region of polyethylene glycol-treated and nontreated in vitro grape plantlets. In Vitro Cell. Developmental Biol. 34: 1-7.
17. Murashige, T. & F. Skoog. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Pl. 15: 473-497.
18. Moller, J. & H. Rasmussen. 1984. Stegmata in Orchidales: character state distribution and polarity. Bot. J. Linn. Soc. 89: 53-76.
19. Piqueras, A. & P. Debergh. 1999. Morphogenesis in micropropagation. In: Woong- Young, S. & S. Bhojwani (eds.). Morphogenesis in Plant Tissue Cultures, pp. 443-462. Kluwer Academic Publishers. Dordrecht, Holanda.
20. Pospisilova, J., N. Wilhelmova, H. Synkova, J. Catsky, D. Krebs, I. Tichá, B. Hanackova & J. Snopek. 1998. Acclimation of tobacco plantlets to ex vitro conditions as affected by application of abscisic acid. J. Exp. Bot. 49(322): 863-869.
21. Roth, I. 1964. Microtecnia Vegetal. Ediciones Biblioteca UCV. Caracas, Venezuela. [ Links ]
22. Rundall, P. 1992. Anatomy of flowering plants. Cambridge University Press, Cambridge. [ Links ]
23. Sass, J. 1958. Vegetal Microtechnique. Iowa State University Press, Iowa. [ Links ]
24. Seon, J., Y. Cui, T. Kozai & K. Paek. 2000. Influence of in vitro growth conditions on photosynthetic competence and survival rate of Rehmannia glutinosa plantlets during acclimatization period. Pl. Cell Tissue Organ Cult. 61: 135-142.
25. Stern, W. & W. Judd. 2000. Comparative anatomy and systematics of the orchid tribe Vanilleae excluding Vanilla. Bot. J. Linn. Soc. 134: 179-202.
26. Stern, W. & W. Judd. 2001. Comparative anatomy and systematics of Cataseinae (Orchidaceae). J. Linn. Soc. 136: 153-178.
27. Torres, J. & N. Mogollón. 1997. Micropropagación clonal masiva de Cattleya lueddemanniana Rchb. f. Proc. Interam. Soc. Trop. Hort. 41: 92-98.
28. Torres, J., L. Laskowski & M. Sanabria. 2006. Efecto del ambiente de desarrollo sobre la anatomía de la epidermis foliar de Cattleya jenmnii Rolfe. Bioagro 18(2): 93-99.
29. Wakabayashi, S. 1957. On the form and formative stage of raphidian cells in some araceous and orchidaceous plants. J. Jap. Bot. 32: 368-374. [ Links ]
30. Widholzer, C. & P. de Oliveira. 1994. Tipo fotosintético e anatomia foliar de Sophronitis coccinea (Orchidaceae). Napaea 10: 23-29.
31. Zobayed, S., F. Afreen-Zobayed, C. Kubota & T. Kozai. 1999. Stomatal characteristics and leaf anatomy of potato plantlets cultured in vitro under photoautotrophic and photomixotrophic conditions. In Vitro Cell. Developmental Biol. 35: 183-188.












 uBio
uBio 
