Ernstia
versión impresa ISSN 0252-8274
Ernstia v.18 n.1 Caracas jun. 2008
EFECTO DE LA SALINIZACION CON NaCl o Na2SO4 SOBRE LA ANATOMIA FOLIAR EN DOS GENOTIPOS DE CAÑA DE AZUCAR (SACCHARUM SPP.) CON TOLERANCIA SALINA DIFERENCIAL
Marina Garcia y Damelis Jauregui
Universidad Central de Venezuela. Facultad de Agronomia. Instituto de Botanica Agricola. Maracay - estado Aragua. Apartado Postal 4579. Venezuela. E-mail: garciam@agr.ucv.ve
COMPENDIO
Se estudio la anatomia foliar en dos genotipos de caña de azucar que difieren en tolerancia salina: 'PR692176' (tolerante) y 'V78-1' (sensible), con el objetivo de detectar caracteres estructurales que puedan estar vinculados con la sensibilidad diferencial a las sales en este cultivo. Las plantas crecieron en un substrato artificial irrigado con solucion nutritiva y a partir de los dos meses de edad se sometieron a salinizacion con NaCl o Na2SO4 por 60 dias. El estudio anatomico se realizo sobre porciones del tercio medio de la lamina de la hoja mas recientemente expandida, las cuales se fijaron y se procesaron mediante tecnicas convencionales para su estudio bajo microscopia optica. La respuesta de los genotipos ante la salinizacion con NaCl fue distinta; en PR692176 esa sal provoco un aumento en el grado de suculencia, no asi en V78-1, mientras que el Na2SO4 indujo una fuerte reduccion en el tamano de las celulas epidermicas y del mesofilo en ambos genotipos. PR692176 mostro los valores mas altos de espesor de cuticula, densidad de estomas y de micropelos, asi como una menor distancia intervenal, respecto a V78-1, lo cual puede representar una ventaja para el primer genotipo en cuanto a su capacidad para enfrentar el efecto de estres hidrico provocado por la sales, contribuyendo asi a explicar su mayor tolerancia a la salinidad.
PALABRAS CLAVE Anatomia, hoja, Saccharum, sales.
ABSTRACT
The foliar anatomy in two genotypes of sugarcane with different salt tolerance PR692176 (salt tolerant) and V78-1 (salt sensitive) was studied with the objective to determine structural characters related with the differential response. The plants were grown on an artificial substrate irrigated with nutritive solution and after two months were treated with NaCl or Na2SO4 for sixty days. This investigation was performed with portions of the middle third of blade of the most recently expanded leaf blade, which were fixed and were processed in the usual way for optical microscope study. The response of the genotypes was different in the treatment with NaCl in PR692176 this salt caused increment in succulence, but not in V78-1, while Na2SO4 induced a great reduction in the size of the epidermal cells and the mesophyll in both genotypes. PR692176 showed the highest values of cuticle thickness, stomatal density and microhair density, as wells as a lower mean interveinal distance in relation to V78-1 this may represent a benefit for first genotype in relation to its capacity to deal with the effect of hidric stress caused by salts, contributing to explain its tolerance to salinity.
KEY WORDS Anatomy, leaf, Saccharum, salt.
INTRODUCCION
La salinidad es uno de los principales factores abioticos que limitan la productividad agricola debido a que la inmensa mayoria de las plantas cultivadas son sensibles a esta condicion (Maas 1990). El efecto mas comun sobre las plantas es la reduccion del desarrollo debido a una disminucion del potencial osmotico del medio de crecimiento y, en consecuencia, de su potencial hidrico; la toxicidad ionica normalmente asociada con la absorcion excesiva de Na+ y de Cl- y un desequilibrio nutricional debido a la interferencia de los iones salinos con la absorcion de los nutrientes esenciales que requiere la planta (Greenway y Munns 1980, Lacerda 2005). Adicionalmente, la combinacion de los efectos antes indicados, a menudo genera un desequilibrio metabolico que provoca danos oxidativos (Azevedo-Neto et al. 2005).
Las plantas disponen de una variedad de mecanismos de respuesta a los efectos adversos de la salinidad, los cuales operan a nivel de todos los organos y de los tejidos y celulas (Willadino y Camara 2005). Algunas estrategias incluyen 91 M. Garcia y D. Jauregui Salinizacion, anatomia foliar de caña de azucar cambios anatomicos que pueden ser de importancia, bien para mejorar la eficiencia en el uso de agua y reducir el impacto del deficit hidrico provocado por la salinidad, o bien para reducir el efecto toxico de las sales. La hoja tradicionalmente se ha considerado un organo de gran importancia en lo que respecta a la regulacion de los niveles de sales en el vastago; no obstante, son escasos los trabajos relacionados con las modificaciones histologicas de los tejidos de este organo, en los cultivos sometidos a tratamientos con salinidad.
Una de las caracteristicas foliares que se ha vinculado con la tolerancia a sales en las glicofitas es la suculencia (Poljakoff-Mayber 1975, Gorham et al. 1985, Hagemeyer 1997, Glenn et al. 1997); se ha indicado que el incremento de la relacion vacuola/citoplasma de las celulas del mesofilo permite diluir las sales acumuladas e incrementar la capacidad de las celulas para absorberlas de la solucion del apoplasto (Gorham et al. 1985). Otro rasgo que se considera importante en condiciones salinas es el incremento en el grosor de la cuticula y la deposicion de ceras en la misma, debido a su efecto en prevenir el sobrecalentamiento de la hoja, contribuyendo asi a reducir la transpiracion y consecuentemente el impacto del estres hidrico impuesto por las sales (Gorham et al. 1985).
Garcia (2004) estudio la anatomia radical en dos genotipos de caña de azucar con sensibilidad diferencial ante las sales (PR692176, 'tolerante' y V78-1, 'sensible') y encontro que en ambos se produjeron cambios dirigidos a prevenir la entrada masiva de sales a la estela y/o a mejorar la capacidad de retencion de estas en la raiz, siendo este ultimo mas notable en la variedad tolerante. Con base en esos resultados, en la presente investigacion se estudio la anatomia foliar en los genotipos de caña de azucar antes indicados con el objetivo de determinar si existen caracteres en este organo vinculados con la sensibilidad diferencial a la salinidad.
MATERIALES Y METODOS
El experimento se condujo en un cobertizo ubicado en el Instituto de Botanica Agricola de la Facultad de Agronomia, de la Universidad Central de Venezuela, en Maracay. Se usaron dos genotipos de caña de azucar que segun reportes previos (Garcia y Medina 2003, Garcia 2004) muestran sensibilidad diferencial ante las sales: 'PR692176' (tolerante a sales) y 'V78-1' (sensible a sales). Se sembraron esquejes desinfectados con una yema, obtenidos en los semilleros basicos de Fundacaña (Chivacoa . estado Yaracuy); la siembra se efectuo en semilleros y las plantas permanecieron en estos por un mes, transplantandose posteriormente a bolsas de 8 kg de capacidad (Garcia y Medina 2003). El riego se efectuo una vez al dia, utilizando para ello una solucion nutritiva Hoagland modificada, previamente usada en caña de azucar (Kumar et al. 1994).
Un mes despues del transplante, se iniciaron los tratamientos salinos para lo cual se anadio a la solucion nutritiva base NaCl (100 mol m-3) o Na2SO4 (50 mol m-3); el riego con cada una de estas soluciones constituyo un tratamiento de salinidad y paralelamente, se mantuvo un tratamiento testigo, en el que las plantas se regaron con solucion nutritiva sin aporte adicional de sales.
Luego de 60 dias de iniciados los tratamientos de estres salino, se seleccionaron aleatoriamente tres plantas de cada uno y se muestrearon segmentos de aproximadamente dos cm2 de la lamina de la hoja mas recientemente expandida, conocida como hoja TVD (hoja mas joven con labio visible). Las muestras se fijaron en una mezcla de glutaraldehido al 2,4% y paraformaldehido al 0,30% en buffer fosfato 0,02 M (pH 7,2). En el caso de los tratamientos con sales, se anadio sacarosa (100 mol m-3) a la solucion fijadora, para evitar que los tejidos sufrieran cambios por efecto osmotico. Las muestras se deshidrataron en una serie creciente de etanol; luego se infiltraron gradualmente en glicol metacrilato (JB-4) y se incluyeron en resina pura, siguiendo el procedimiento descrito por Ruzin (1999). Se realizaron secciones transversales de 4 µm de espesor, usando un ultramicrotomo, las mismas se tineron, usando una mezcla toluidina-fucsina basica (v/v) al 0,5 % en solucion acuosa y finalmente se montaron en forma de laminas permanentes. µm
Para el estudio de la lamina en vista frontal, segmentos foliares se sometieron a la accion de acido fluorhidrico al 5% por 24 horas, luego se lavaron varias veces con agua destilada y se colocaron en hipoclorito de sodio comercial al 2,25% hasta lograr la separacion de las epidermis, las cuales se tineron con azul de toluidina acuosa al 1% y se montaron en glicerina 50%. Las preparaciones se estudiaron bajo un microscopio optico marca LeitzMR, y se tomaron imagenes digitales con la ayuda de una camara adaptada al mismo; adicionalmente, se determinaron las siguientes medidas anatomicas: grosor de cuticula (mas pared tangencial externa) adaxial y abaxial; espesor de ambas epidermis (sin incluir celulas buliformes), del mesofilo y de la hoja; distancia intervenal (tomada desde la pared externa de la vaina vascular de un haz hasta la del proximo); densidad y longitud de estomas y densidad de micropelos. De cada una de estas variables se efectuaron 30 medidas u observaciones, en 93 M. Garcia y D. Jauregui Salinizacion, anatomia foliar de caña de azucar diferentes preparaciones microscopicas y posteriormente, se calculo el promedio y la desviacion estandar.
RESULTADOS
En general, las plantas control de los dos genotipos mostraron una conformacion anatomica similar en cuanto a los tejidos presentes y a su disposicion en la lamina foliar, coincidiendo en forma general con las descripciones realizadas para especies diferentes de Saccharum (Van Dillewijn 1952, Metcalfe 1960 y Colbert y Evert 1982); no obstante, se observaron diferencias en algunas variables anatomicas cuantitativas.
En las plantas control, las celulas de ambas epidermis se apreciaron mayormente subesfericas en seccion transversal (Figs. 1A y 1D) y en especial en la adaxial, el grosor de la cuticula mas pared tangencial externa, resulto ligeramente mayor en PR692176 que en V78-1 (Tabla I).
En las epidermis de ambos genotipos se observaron aguijones (Figs. 2C, 2D, 2E y 2F), en mayor densidad aunque no cuantificada en la abaxial y ubicados mayormente sobre zonas costales; dichos aguijones son medianos con apice corto y paredes engrosadas. La morfologia de los micropelos fue semejante en los dos genotipos y se caracterizan por presentar una celula distal caediza, ligeramente mas larga que la basal, de pared mas delgada y con contenido menos denso (Figs. 2A y 2D); se detectaron diferencias en los valores de la densidad de estas estructuras a nivel de la superficie abaxial, donde el numero de tricomas por mm-2 fue seis veces mayor en PR692176 que en V78-1 (Tabla II).
Las hojas son anfiestomaticas con aparatos estomaticos ovoides, tipo domo bajo y triangulares (Fig. 2), distribuidos en dos filas por zona intercostal y separados entre ellos por una celula elongada y entre filas por celulas elongadas con paredes moderada e irregularmente onduladas y medianamente gruesas, en la cuales se intercalan celulas cortas, silicificadas, altas y estrechas o cuadradas, de contornos lisos (Fig. 2D). La densidad de estomas fue mayor en la epidermis abaxial que en la adaxial, pero la mayor longitud de estas estructuras epidermicas se registro en la ultima, para ambos genotipos (Tabla II); en ambas epidermis PR692176 mostro el mas alto numero de estomas por mm-2 siendo estos mas pequenos, en comparacion con V78-1, pero la diferencia entre ambos genotipos fue mayor en la epidermis abaxial, donde el primer genotipo tuvo una densidad estomatica un 37,5% superior que el segundo.

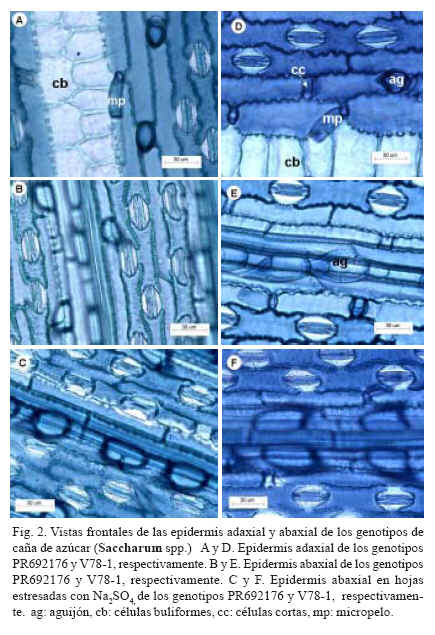
El arreglo de las celulas buliformes fue semejante en las dos variedades (Figs. 1A, 1D, 2A y 2D) y en ambos casos estuvieron asociadas con celulas parenquimaticas translucidas que forman una o dos columnas, uniseriadas a cada lado de un haz de tercer orden; no obstante, en PR692176 frecuentemente se presentaron en mayor numero y alcanzaron la epidermis abaxial (Fig. 1A), mientras que en V78-1, lo mas comun fue que se presentaran en menor numero pero de mayor tamano y que llegaran solo hasta la mitad del mesofilo (Fig. 1D).
El sistema vascular esta constituido por haces de tres ordenes diferentes (Fig. 1D), dispuestos en forma alterna, los de primer y segundo orden se ubican en la parte media de la lamina, mientras que los de tercer orden se localizan preferentemente debajo de grupos de celulas buliformes (Figs. 1A y 1D).
Los haces de primer orden definen contornos ligeramente triangulares, los de segundo orden son elipticos y los de tercer orden circulares (Figs. 1A y 1D). En los tres tipos se distinguen claramente xilema y floema, aun cuando mas abundante en los de primer orden con elementos metaxilematicos evidentes. Los haces estan rodeados por una vaina continua de celulas parenquimaticas, de tamanos diferentes y con cloroplastos dispuestos perifericamente. Cada haz a su vez tiene celulas clorofilianas arregladas radialmente y tanto hacia el lado adaxial como abaxial son visibles grupos de celulas esclerenquimaticas, con una disminucion progresiva de acuerdo al orden del haz, es decir mas celulas en aquellos de primer orden y menos en los de tercer orden.
El mesofilo de estas hojas esta integrado por parenquima de celulas translucidas y clorofilianas en un arreglo Kranz tipico. Sin embargo, las variedades mostraron variacion en cuanto a la distancia intervenal, la cual fue aproximadamente 9 µm menor en PR692176, respecto a V78-1 (Tabla I), lo que se refleja en un mayor volumen de tejido parenquimatico (ya sea por mayor numero de celulas o mayor volumen de cada una), asi los haces estan mas proximos en PR692176 que en V78-1.
El espesor de la hoja fue 22,1% mayor en V78-1 que en PR692176, lo que se debe fundamentalmente a un mayor grosor del mesofilo en el primer genotipo, respecto al segundo, ya que el espesor del tejido epidermico no mostro diferencias notables entre ambos (Tabla I).


Los cambios mas evidentes al aplicar los tratamientos salinos se observaron en algunas de las variables cuantitativas. En las plantas estresadas con NaCl, el grosor de la cuticula y de ambas epidermis mostraron valores similares a los de las plantas testigo (Tabla I). El espesor a nivel de las celulas buliformes no se midio, pero se aprecio un aumento visible en su tamano respecto al testigo, en seccion transversal de la hoja en los dos genotipos (Figs. 1B y 1E). En cuanto a los estomas, su densidad se incremento respecto a las plantas testigo, 4,4 y 21% en la epidermis adaxial y 5,6 y 14,2% en la abaxial, en PR692176 y V78- 1 respectivamente; en tanto que el tamano de los estomas se redujo levemente en el primer genotipo y fue notablemente mayor en el segundo (Tabla II). Los genotipos no mostraron diferencias en la densidad de micropelos en relacion a las plantas no estresadas (Tabla II).
En relacion al mesofilo, en las plantas tratadas con esta sal se observo un incremento de 8,4% en PR692176 y una reduccion de 23,7% en V78-1, lo cual se reflejo en un ligero aumento en el espesor de la hoja del primer genotipo (Fig. 1B), respecto a las plantas control, mientras que el efecto contrario se noto en V78-1 (Fig. 1E). La distancia intervenal se incremento casi 20 µm en PR692176 y casi 10 µm en V78-1, respecto a las plantas testigo, de manera que en ambos genotipos el valor de esta variable resulto similar.
En las plantas estresadas con Na2SO4, el espesor de la cuticula adaxial y abaxial fue similar al de las plantas control, pero el espesor de las epidermis, del mesofilo y de la hoja, se redujo considerablemente en los dos genotipos, respecto a las plantas control (Tabla I). Se observaron hojas mas compactas y con tendencia a un mayor desarrollo de tejido esclerenquimatico en posicion subepidermica a nivel de los haces conductores, en las plantas de los dos genotipos estresadas con esta sal (Figs. 1C y 1F). La distancia intervenal se redujo ligeramente en PR692176 y en mayor proporcion en V78-1, en comparacion con las plantas no estresadas. Respecto a los estomas, la densidad estomatica se incremento en 31,8% y 24,03% en la epidermis adaxial y en 17,8 y 26,7 % en la abaxial en PR692176 (Fig. 2C) y V78-1 (Fig. 2F) respectivamente, en comparacion a las plantas control, mientras que el tamano estomatico se redujo en ambas epidermis y la magnitud de esa disminucion fue mayor en V78-1 (Tabla II). La densidad de micropelos en ambos genotipos y en las dos epidermis, no mostro cambios apreciables respecto a las plantas testigo.
DISCUSION
Se determinaron diferencias entre los genotipos investigados, en especial en lo que respecta a algunos rasgos anatomicos cuantitativos, que podrian ser de importancia en cuanto a su comportamiento ante el estres salino. Las plantas testigo de PR692176 se distinguen de las de V78-1 por presentar una cuticula ERNSTIA 18(1) 2008: 89-105 100 ligeramente mas gruesa y la mayor densidad de micropelos y de estomas y estos ultimos mas pequenos en la epidermis abaxial. Las cuticulas mas gruesas brindan una mejor proteccion contra el calentamiento excesivo de la hoja, contribuyendo asi a reducir la transpiracion (Wilkinson 1979, Dietz y Hartung 1996). Por otra parte, el acortamiento de la distancia entre los haces vasculares, es un indicio de una mejor vascularizacion de este organo, ya que se genera una red de venas mas densa (Fahn y Cutler 1992), caracteristica de gran importancia bajo condiciones de disponibilidad hidrica restringida. Una mayor densidad de estomas de menor tamano, se relaciona con un incremento en la resistencia difusiva de la lamina, que conduce a una reduccion en la transpiracion foliar (Roth 1990), siendo por ello comunmente asociada con especies adaptadas a crecer en ambientes secos (Fahn y Cutler 1992, Garcia y Lapp 2001, 2004). PR692176 se destaco por su mayor densidad de micropelos en la epidermis abaxial que V78-1. La pubescencia disminuye la absorcion de energia radiante o permite una mejor disipacion de esta una vez absorbida, contribuyendo asi a regular la temperatura foliar y a reducir la perdida de agua por transpiracion (Johnson 1975, Ehleringer y Mooney 1978, Fahn y Cutler 1992). Por otra parte, los micropelos en Saccharum pudiesen tener alguna funcion secretora de sales (Glenn et al. 1997), lo cual se ha senalado como uno de los mecanismos mas eficientes para manejar el exceso de las mismas (Fahn y Cutler 1992, Hagemeyer 1997). Estas caracteristicas constituyen una ventaja para PR692176, en relacion a V78-1 y pueden ayudar a explicar su mayor capacidad para tolerar condiciones de sequia (Zerega 1995) y en parte, tambien su mejor comportamiento ante la salinidad (Garcia y Medina 2003, Garcia 2004). Cabe indicar que en el caso particular de la caña de azucar, la tolerancia a sequia ha resultado estrechamente relacionada con la tolerancia al estres por salinidad (Syed y El-Swaify 1972, Wahid et al. 1997, Wahid 2004).
Uno de los efectos mas notables provocados por el NaCl fue el aumento en el tamano de las celulas buliformes y de las celulas incoloras en el mesofilo en PR692176, y en menor magnitud en V78-1, lo que se reflejo en un aumento en el grosor del mesofilo y de la hoja en el primer genotipo; lo contrario ocurrio en V78-1, en el cual estos valores se redujeron. Este comportamiento reflejo un incremento en el grado de suculencia de este organo, en el caso particular de PR692176. La salinizacion con Na2SO4, por el contrario, tuvo en los dos genotipos un efecto depresor sobre el espesor de las ambas epidermis, del mesofilo y consecuentemente de la lamina foliar; esta sal indujo la formacion de hojas mas compactas y con mayor desarrollo de esclerenquima, todo lo cual indico que el Na2SO4 provoco deshidratacion de los tejidos foliares, rasgos 101 M. Garcia y D. Jauregui Salinizacion, anatomia foliar de caña de azucar tipicamente asociados con el xeromorfismo (Fahn y Cutler 1992). Este comportamiento coincide con senalamientos segun los cuales la suculencia esta relacionada con la composicion de la solucion salina. Evidencias obtenidas en otras glicofitas, han demostrado que la salinizacion con NaCl provoca suculencia en los tejidos foliares (Longstreth y Nobel 1979, Poljakoff-Mayber 1975, Serrato Valenti et al. 1991, Bray y Reid 2002).
En genotipos de citricos se ha reportado que tanto el NaCl como el CaCl2 provocan suculencia foliar, estando ese incremento en el volumen celular positivamente correlacionado con el contenido de Cl- en las hojas (Romero-Aranda et al. 1998). Respecto al efecto de la salinizacion con Na2SO4 sobre la anatomia foliar se conoce menos, debido a que la sal mas ampliamente usada para provocar estres es el NaCl. Hayward y Long (1941) fueron de los primeros en estudiar el efecto de la salinizacion con NaCl y Na2SO4 sobre la histologia de la hoja en plantas de tomate y encontraron que con ambas sales el grosor de la lamina se incremento mas o menos en la misma proporcion; por el contrario, Strogonov (1962) citado por Poljakoff-Mayber (1975) senalo que el Na2SO4 causo haloxeromorfismo marcado en hojas de algodon, lo que coincide con lo reportado por Degano (1999) en Tessaria absinthioides y con lo observado en este estudio.
El estres salino provocó un acortamiento en la distancia intervenal en las plantas tratadas con Na2SO4, lo cual puede explicarse como una estrategia para compensar la deshidratacion de los tejidos foliares provocada por la primera sal. Por el contrario, en las plantas estresadas con NaCl la distancia intervenal se incremento, mas en PR692176 que en V78-1, lo que puede vincularse con el incremento en el grado de suculencia ocurrido en el primer genotipo.
En cuanto a los estomas, ambas sales provocaron un incremento en la densidad estomatica y una reduccion en la longitud de estos en las dos epidermis, siendo este efecto, en general, mas notable en las plantas estresadas con Na2SO4 y en el genotipo sensible. Este comportamiento se ha explicado como una respuesta para enfrentar el efecto de estres hidrico provocado por la salinidad (Longstreth y Nobel 1979) y su efecto mas acentuado en V78-1 podria relacionarse con la mayor sensibilidad a la sequia que exhibe este genotipo (Zerega 1995). Es de hacer notar que el comportamiento de la densidad y el tamano estomatico en otras glicofitas sometidas a estres salino es variable, en Kandelia candel L., Hwang y Chen (1995) encontraron una disminucion en la densidad de estomas al incrementar la concentracion de NaCl. Por el contrario, en caraota (Bray y Reid 2002) y en tomate (Salas et al. 2001) reportaron un incremento en la densidad de estomas y una disminucion en su longitud solo en la epidermis abaxial, mientras que en Hibiscus cannabinus (Curtis y Lauchli 1987), senalaron resultados similares a los encontrados en este estudio, el incremento se observo en ambas epidermis. Por otra parte, las sales no influenciaron el desarrollo de micropelos en los genotipos, pero es conveniente profundizar los estudios de esta variable, en lo referente a sus capacidades para secretar sales.
En la raiz de los genotipos estudiados tanto el NaCl como el Na2SO4 causaron un aumento mas o menos similar en el grado de suculencia de este organo, lo cual evidencia que el efecto de estas dos sales en provocar suculencia varia dependiendo del organo considerado. Por otra parte, el crecimiento de los genotipos fue mas deprimido en presencia de NaCl que de Na2SO4 (Garcia 2004), lo que indica que el efecto beneficioso de la primera sal en promover suculencia, no contrarresta el efecto toxico del Cl- para este cultivo (Bernstein et al. 1966, Syed y El-Swaify 1972, Garcia 2004).
AGRADECIMIENTO
Al Consejo de Desarrollo Cientifico y Humanistico de la Universidad Central de Venezuela, por el financiamiento otorgado para la realizacion de esta investigacion, a traves del Proyecto No PI 01-00-6736-2007. Al Sr. Hector Verde, por su dedicacion durante la consecucion del ensayo. Al Ingo Agro Fernando Gil y a la TSU Georgina Pena de Fundacaña, por el suministro del material vegetal utilizado.
REFERENCIAS BIBLIOGRAFICAS
-
Azevedo-Neto A., J. Prisco, J. Eneas-Filho, J. Medeiros and E. Gomes-Filho. 2005. Hydrogen peroxide pre-treatment induces salt-stress acclimation in maize plants. J. Plant. Physiol. 162: 1114-1122.
-
Bernstein, L., E. Francois and R. Clark. 1966. Salt tolerance of N.Co. varieties of sugarcane. I. Sprouting, growth and yield. Agron. J. 58: 489-493.
-
Bray, S. and D. Reid. 2002. The effect of salinity and CO2 enrichment on the growth and anatomy of the second trifoliate leaf of Phaseolus vulgaris. Can. J. Bot. 80: 349-359.
-
Colbert, J. and R. Evert. 1982. Leaf vasculature in sugarcane (Saccharum officinarum L.). Planta. 156: 136-151. 103
-
M. Garcia y D. Jauregui Salinizacion, anatomia foliar de caña de azucar Curtis, P. and A. Lauchli. 1987. The effect of moderate salt stress on leaf anatomy in Hibiscus cannabinus (Kenaf) and its relation to leaf area. Amer. J. Bot. 74: 538-542.
-
Degano, C. 1999. Respuestas morfologicas y anatomicas de Tessaria absinthioides (Hook. et. Arn.) DC. a la salinidad. Revta brasil. Bot. Sao Paulo 22: 357-363.
-
Dietz, K. and W. Hartung. 1996. The leaf epidermis: its ecophysiological significance. Progress in Botany 57: 32-53.
-
Ehleringer, J. and H. Mooney. 1978. Leaf hairs: Effects on physiological activity and adaptative value to a desert shrub. Oecologia 37: 183-200.
-
Fahn D. and D. Cutler. 1992. Xerophytes. Encyclopedia of plant anatomy XIII. Gebruder Borntraeger. Berlin. 177
-
p. Garcia, M. 2004. Crecimiento, morfoanatomia radical, acumulacion de solutos organicos y relaciones ionicas en dos genotipos de caña de azucar (Saccharum spp.) con tolerancia salina contrastante. Trabajo de Grado para optar al Titulo de Doctor en Ciencias Agricolas. Facultad de Agronomia. Universidad Central de Venezuela. Maracay. 246 p.
-
Garcia, M. y E. Medina. 2003. Crecimiento y acumulacion de prolina en dos genotipos de caña de azucar sometidos a salinizacion con cloruro de sodio. Rev. Fac. Agron. (LUZ) 20: 168-179.
-
Garcia, M. y M. Lapp. 2001. Morfoanatomia foliar en tres biotipos de Pithecellobium unguis-cati (L.) Bentham creciendo en distintas comunidades vegetales. Phyton 2001: 147-158.
-
Garcia, M. y M. Lapp. 2004. Anatomia foliar en especimenes de Oyedaea verbesinoides DC. (Asteraceae) creciendo en tres ambientes distintos. Ernstia 15: 129-143.
-
Glenn, E., J. Brown and M. Khan. 1997. Mechanisms of salt tolerante in higher plants. In: Basra A. and R. Basra (Eds.). Mechanisms of environmental stress resistance in plants. 83-110. Harwood Academia Publishers. The Netherlands. 240 p.
-
Gorham, J., R. Wyn Jones and E. McDonell. 1985. Some mechanisms of salt tolerance in crop plants. Plant Soil 89: 15-40.
-
Greenway, H. and R. Munns. 1980. Mechanisms of plant tolerance in nonhalophytes. Ann. Rev. Plant Physiol. 31: 149-190.
-
Hagemeyer, J. 1997. Salinization . a problem of global scale. In: M. Prassad (Ed.). Plant ecophysiology. 173-205. John Willey & Sons, Inc. NY, USA.
-
Hayward, H. and E. Long. 1941. Anatomical and physiological response of the tomato to varying concentrations of sodium chloride, sodium sulphate and nutrient solution. Bot. Gaz. 102: 437-462.
-
Hwang, Y. and S. Chen. 1995. Anatomical responses in Kandelia candel (L.) Druce seedlings growing in the presence of different concentrations of NaCl. Bot. Bull. Acad. Sin. 36: 181-188.
-
Johnson, H. 1975. Plant pubescence: an ecological perspective. Bot. Rev. 41: 233-257.
-
Kumar, S., K. Naiudu and H. Sehtiya. 1994. Causes of growth reduction in elongating and expanding leaf tissue of sugarcane under saline conditions. Aut. J. Plant Physiol. 21: 71-83.
-
Lacerda, C. 2005. Interacao salinidade x nutricao mineral. En: Custodio R., E. Araujo, L. Gomes e U. Cavalcante (Eds.). Estresses ambientais: Danos e beneficios em plantas. p. 127-137. MXM Grafica e editora. 499 p.
-
Longstreth, D. and P. Nobel. 1979. Salinity effects on leaf anatomy. Plant Physiol. 63: 700-703.
-
Maas, E. 1990. Crop salt tolerance. In: K. Tanji (Ed.) Agricultural salinity assessment and management. 262-304. ASCE. NY., USA.
-
Metcalfe, C. 1960. Anatomy of the monocotyledons. I. Gramineae. Oxford at the Clarendon Press. 731 p.
-
Poljakoff-Mayber, A. 1975. Morphological and anatomical changes in plants as a response to salinity stress. A. Poljakoff-Mayber and J. Gale (Eds). In: Plant in saline environments. p: 97-117. Springer Verlag. NY. USA. 213 p.
-
Romero-Aranda, R., J. Moya, F. Tadeo, F. Legaz, E. Primo-Millo and M. Talon. 1998. Physiological and anatomical disturbances induced by chloride salts in sensitive and tolerant citrus: beneficial and detrimental effects of cations. Plant Cell Environ. 21: 1243-1253.
-
Roth, I. 1990. Leaf structure of a Venezuelan cloud forest in relation to the microclimate. Gebruder Borntraeger, Berlin, Germany. 244 p.
-
Ruzin, S. 1999. Plant microtechnique and microscopy. Oxford University Press, Inc. NY, USA. 322 p.
-
Salas, J., M. Sanabria y R. Pire. 2001. Variacion en el indice y densidad estomatica en plantas de tomate (Lycopersicon esculentum Mill.) sometidas a tratamientos salinos. Bioagro 13: 99-104.
-
Serrato Valenti, G., M. Ferro, D. Ferraro and F. Riveros. 1991. Anatomical changes in Prosopis tamarugo Phil, seedlings growing at different levels of NaCl salinity. Ann. Bot. 68: 47-53.
-
Syed, M. and S. El-Swaify. 1972. Effect of saline water irrigation on N.Co.310. 422 p.
-
Van Dillewijn, C. 1952. Botany of sugarcane. The Chronica Botanica Co.
-
Wahid, A. 2004. Analysis of toxic and osmotic effects of sodium chloride on leaf growth and economic yield of sugar cane. Bot. Bull. Acad. Sin. 46: 135-142.
-
Wahid, A., A. Rao y E. Rasul. 1997. Identification of salt tolerance traits in sugarcane lines. Field Crop Res. 54: 9-17.
-
Wilkinson, H. 1979. The plant surface (mainly leaf). Metcalfe C. y L. Chalk (Eds). In: Anatomy of the dicotyledons. 97-165. Clarendon Pres. Oxford. 297 p.
-
Willadino, L. e T. Camara. 2005. Aspectos fisiologicos do estresse salino em plantas. En: Custodio R., E. Araujo, L. Gomez e U. Cavalcante (Eds.). Estresses ambientais: Danos e beneficios em plantas. 127-137. MXM Grafica e editora. Recife . Brasil. 499 p.
-
Zerega, L. 1995. Comportamiento varietal de la caña de azucar ante condiciones estresantes del suelo, las principales enfermedades y epocas de siembra y cosecha. Fundazucar. Boletin No. 13: 9-11.












 uBio
uBio 
