Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Técnica de la Facultad de Ingeniería Universidad del Zulia
versión impresa ISSN 0254-0770
Rev. Téc. Ing. Univ. Zulia v.26 n.2 Maracaibo ago. 2003
Kinetic of copper-sulfate pentahydrate production from scrap copper
Alfredo E. Varela V., Alexandra Arias y Yelitza Reyes
Facultad de Ingeniería, Escuela de Ingeniería Química. Universidad de Carabobo, Valencia, Venezuela. E-mail: avarela@thor.uc.edu.ve
Abstract
The industrial production of copper sulfate pentahydrate (CuSO4.5H2O), from scrap copper and airy sulfuric acid, requires knowledge of the reaction kinetics for analysis and development. The experimental work was intended to determine the effects of different conditions (temperature, pressure, and airflow rate) on the conversion of sulfuric acid with time. A 4-liters stainless steel cylinder reactor was fabricated for this purpose. The feed was scrap copper, a 1.35 M sulfuric acid solution, and airflow supplied at the bottom of the reactor. Sample analysis by titration during the experimental trials allowed the determination of the reaction course until the liquid solution is about 2% weight sulfuric acid. Results suggest that the process is controlled by dilution of oxygen from the air bubble/liquid interphase to the liquid solution. For the experimental conditions used in this work, the recommended model kinetics is ![]() , where ag is the gas bubble/liquid interfacial area per unit volume of liquid free of bubbles, kL the oxygen mass transfer coefficient, and H is the Henry constant. Values of agkL increase with airflow rate due to the increase in ag.
, where ag is the gas bubble/liquid interfacial area per unit volume of liquid free of bubbles, kL the oxygen mass transfer coefficient, and H is the Henry constant. Values of agkL increase with airflow rate due to the increase in ag.
Key words: Copper sulfate, sulfuric acid, reaction kinetics, three-phase reactor
Cinética de la producción de sulfato de cobre pentahidratado a partir de chatarra de cobre
Resumen
Para mejorar la producción industrial de sulfato de cobre pentahidratado (CuSO4.5H2O), a partir de chatarra de cobre y ácido sulfúrico aireado, es aconsejable conocer la cinética de la reacción. La metodología usada consistió en determinar el efecto de diferentes condiciones de temperatura, presión y caudal de aire sobre la variación de la conversión del ácido sulfúrico con el tiempo. Para ello se construyó un reactor cilíndrico de 4 litros. La alimentación consistió en chatarra de cobre, ácido sulfúrico y una corriente de aire añadida por el fondo del reactor. Se recogieron muestras y analizaron por titulación durante el transcurso de la reacción hasta que la solución alcanza aproximadamente un 2% en peso de ácido sulfúrico. Los resultados experimentales indican que el proceso es controlado por la difusión del oxígeno del aire desde la interfase burbujas/líquido a la solución líquida. A las condiciones experimentales empleadas, la ecuación de velocidad recomendada es dada por ![]() donde ag es el área interfacial burbujas/líquido por unidad de volumen líquido libre de burbujas, kL el coeficiente de transferencia de masa del oxígeno, y H la constante de la ley de Henry. Los valores del producto agkL aumentan con el flujo de aire debido al incremento en el área ag.
donde ag es el área interfacial burbujas/líquido por unidad de volumen líquido libre de burbujas, kL el coeficiente de transferencia de masa del oxígeno, y H la constante de la ley de Henry. Los valores del producto agkL aumentan con el flujo de aire debido al incremento en el área ag.
Palabras clave: Sulfato de cobre, ácido sulfúrico, cinética de reacciones, reactor en tres fases.
Recibido: 17 de Diciembre de 2002
Revisado: 30 de Junio de 2003
Introducción
El sulfato de cobre pentahidratado es utilizado como ingrediente en alimentos de animales, en la agricultura por su efectiva acción fungicida, en procesos industriales como galvanoplastia, como anticorrosivo de metales, y en el tratamiento de agua, eliminando algas y malos olores. También es utilizado como algicida en aguas de piscinas, lagos y reservas acuíferas, y en otras aplicaciones tales como tratamiento de alcantarillas, preservación de madera, pigmentos, usos veterinarios y químicos. Chapman [1] plantea el creciente interés por la investigación sobre los mecanismos de acción y resistencia del sulfato de cobre como biocida.
El proceso de producción del sulfato de cobre pentahidratado a partir de chatarra de cobre consta básicamente de siete etapas: recepción y selección de la chatarra, reacción, cristalización, escurrimiento, secado, cernido y molienda, pesado y ensacado. La reacción se efectúa a 90°C en un reactor por lotes donde ocurre la oxidación del cobre en presencia de aire y ácido sulfúrico (H2SO4) en medio acuoso, y tiene una duración de unas 18 horas, por lo que el tiempo de elaboración del producto final es alto. De allí que es conveniente estudiar la cinética del proceso de reacción con el fin de reducir el tiempo de reacción y los costos de operación.
Los trabajos publicados en la literatura se han limitado a estudios de corrosión. Entre ellos se pueden mencionar el de Quartarone et al. [2] que probaron el efecto del indol (benzotriazol) como un inhibidor de corrosión de cobre en solución H2SO4 0.5M aireado a temperaturas entre 25 y 55°C. Tromans y Ahmed [3] determinaron la resistencia a la corrosión de películas de cobre en soluciones de ácido sulfúrico con concentraciones entre 1 y 10 moles/litro. Carey y Wheatcraft [4], en un estudio del transporte de sulfato de cobre en una solución de ácido sulfúrico, sugieren que la rata de difusión en la solución electrolítica puede causar variaciones de densidad en el volumen de líquido.
Publicaciones recientes se han orientado al estudio de la cinética del proceso de cristalización. Mohan et al. [5] determinaron la cinética de crecimiento de cristales de sulfato de cobre usando un calorímetro de barrido diferencial (DSC) a temperaturas entre 0 y 200°C. Mahon y Myerson [6] analizaron datos de cristalización mediante un modelo termodinámico.
Mecanismo de Reacción y Procesos de Transferencia de Masa
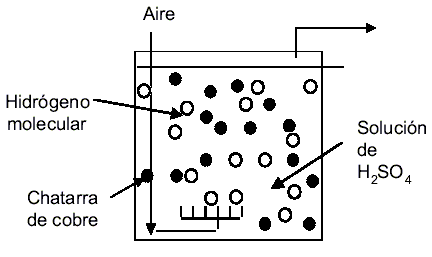
La Figura 1 muestra un esquema del mecanismo de oxidación del cobre en solución ácida aireada [7]. Las etapas del proceso son: (1) migración de iones hidrógeno a la superficie del cobre; (2) flujo de electrones sobre la superficie metálica de cobre a los iones hidrógeno; (3) formación de hidrógeno atómico; (4) formación de moléculas de hidrógeno; (5) liberación de hidrógeno molecular desde la superficie del cobre. La reacción global es
2Cu + 2H2SO4 + O2 ® 2CuSO4 + 2H2O (1)
Figura 1. Mecanismo de reacción del cobre en ácido sulfúrico aireado.
La Figura 2 muestra un esquema de las etapas del reactor en tres fases y la Figura 3 las concentraciones de oxígeno involucradas en el proceso.
Figura 2. Modelo del reactor con tres fases.
Figura 3. Perfiles de concentración de oxígeno en el reactor.
El oxígeno del aire pasa por cinco etapas: 1) Transferencia desde la burbuja de gas a la interfase burbuja/líquido, 2) transferencia desde la interfase burbuja/líquido a la fase líquida, 3) mezclado y difusión en el líquido, 4) transferencia desde el líquido a la superficie externa del sólido, y 5) reacción en la superficie del sólido. Asumiendo que la distribución de oxígeno en el líquido es uniforme, debido a la agitación causada por las burbujas de aire, se puede descartar la etapa 3. Adicionalmente, asumiendo que la velocidad de transferencia de oxígeno es igual para das las etapas, las cinéticas de los pasos 1, 2 y 4 se pueden escribir respectivamente como
2
- rO = kLag ( CiL - CL )
2
- rO = ksas ( CL - Cs ) (2)
2
donde ag es el área interfacial burbuja/líquido por unidad de volumen de líquido libre de burbujas, kg, kL, y ks son los coeficientes de transferencia de masa.
Considerando que existe equilibrio en la interfase burbuja-líquido, las concentraciones Cig y CiL están relacionadas por medio de la ley de Henry,
Cig = HCiL (3)
y que la reacción es irreversible y de primer orden con respecto a la concentración de oxígeno sobre la superficie, la velocidad puede escribirse
- rO = kasCs (4)
2
donde ks es el área externa del sólido por unidad de volumen de líquido (libre de burbujas, cm2/cm3), k la constante de velocidad (cm/s), Cs la concentración del oxígeno en la superficie externa del sólido (gmol/litro). Luego, combinando las Ecuaciones (2), (3) y (4), la velocidad global puede expresarse en términos de la concentración de oxígeno en la fase gas como sigue
- rO = ko as Cg (5)
2
donde
1 as 1 as H 1 1
= + + H ( + ) (6)
ko ag kg ag kL ks k
Parte Experimental
El reactor es un cilíndro de acero inoxidable de 4 litros, altura de 50 cm y diámetro de 10 cm. La Figura 4 muestra un esquema del equipo y componentes auxiliares. En la parte inferior tiene una válvula (V-5) que permite la descarga de la solución del reactor, además posee un tubo perforado para producir las burbujas de aire dentro del reactor, un rotámetro y una válvula (V-3) con los cuales se mide y controla el caudal de aire. Una chaqueta de calentamiento por vapor de agua permite mantener la temperatura de reacción mediante la regulación de la presión del vapor con las válvulas V-1 y V-2. La temperatura de reacción se mide con un termopar conectado a un indicador digital. La presión se miden con un manómetro Bourdon (IP, 0-50 bar, ± 0.1 bar) conectado a la salida. La válvula V-4 se usa para regular la presión de aire.
Figura 4. Diagrama esquemático del equipo experimental.
Procedimiento Experimental
En esta sección se presentan las experiencias realizadas para determinar los efectos de la temperatura, presión, flujo de aire y agente oxidante. Ensayos preliminares demostraron que la máxima cantidad de aire a la que es posible operar es 1.4 litros/min, ya que por encima de este flujo, el aire arrastra el líquido del reactor. La carga se fijó en 2129.5 gramos de chatarra de cobre, 3130 cm3 de agua y 460.9 gramos de ácido sulfúrico (250 mL). Luego de cargado el reactor, se procede a suministrar vapor de agua y se abre la válvula de aire, llevando el reactor a las condiciones establecidas para el experimento. A partir de este instante se toman las muestras para ser analizada por titulación ácido-base lo cual permite obtener el porcentaje en peso de ácido sulfúrico.
La Tabla 1 lista las condiciones experimentales utilizadas. El Experimento 1 se efectuó a condiciones de operación de un reactor industrial, mientras que el resto de los experimentos fueron realizados para determinar el efecto de diversos factores sobre la variación en el tiempo de la conversión del ácido. Los experimentos 8 y 9 tuvieron por objeto observar el comportamiento del sistema con la generación in situ de oxígeno mediante agentes oxidantes.
Tabla 1
Condiciones experimentales
| Experimento | Temperatura (°C) | Presión manométrica (bar) | Caudal de aire (lt/min) | Agente oxidante |
| 1 | 90 | 0,93 | 0,4 |
|
| 2 | 95 | 0,93 | 0,4 |
|
| 3 | 85 | 0,93 | 0,4 |
|
| 4 | 90 | 1,32 | 0,4 |
|
| 5 | 90 | 1,70 | 0,4 |
|
| 6 | 90 | 0,93 | 0,8 |
|
| 7 | 90 | 0,93 | 1,2 |
|
| 8 | 90 | 0,93 | 0,4 | HNO3 |
| 9 | 90 | 0,93 | 0,4 | H2O2 |
| 10 | 90 | 1,32 | 0,8 |
|
| 11 | 95 | 1,32 | 1,2 |
|
| 12 | 90 | 1,70 | 1,2 |
|
| 13 | 95 | 1,70 | 0,8 |
|
Análisis químico del producto obtenido en todos los experimentos, luego de cristalizado y filtrado, indicaron una composición promedio de 99.5% en peso de sulfato de cobre pentahidratado y 25% en peso de cobre.
Resultados y Discusión
La Figura 5 muestra el comportamiento de la concentración del ácido sulfúrico con el tiempo para diferentes presiones y temperaturas y un flujo de aire de 0.4 lt/min (Experimentos 1, 2, 3, 4 y 5). Nótese que en los Experimentos 4 (90°C, 1.32) y 5 (90°C, 1.70 bar) dan mayores conversiones, menor concentración de H2SO4 en el tiempo, que los experimentos 1, 2 y 3 a menores presiones y diferentes temperaturas, inclusive que el Experimento 2 a mayor temperatura (95°C).
Experimento 1, 2, 3, 4 y 5 a las condiciones mostradas en la Tabla 1.
La influencia del flujo de aire y la generación in situ de oxígeno sobre la conversión del ácido es ilustrada en la Figura 6 para los Experimentos 1, 6, 7, 8 y 9 con una temperatura de 90oC. La concentración del ácido disminuyó más rápidamente en los Experimentos 6 y 7 con flujos de aire de 0.8 y 1.2 litros/min respecto al Experimento 1 (0.4 lt/min de aire). Los Experimentos 8 y 9 muestran más alta conversión respecto al Experimento 1, a pesar de tener el mismo flujo de aire, 0.4 litros/min, debido a la presencia de agentes oxidantes. Se puede concluir de aquí que la rata de transferencia de oxígeno es favorecida por la generación in situ de oxígeno, a causa de la presencia de agentes oxidantes.
Figura 5. Efecto de la temperatura y la presión sobre la composición del ácido.
Figura 6. Efectos del flujo de aire y la generación de oxígeno sobre la variación de la acidez con el tiempo. Experimentos 1,6,7,8 y 9 (90°C) a las condiciones mostradas en la Tabla 1.
Al observar las Figuras 5 y 6, se deduce que la velocidad de reacción del ácido sulfúrico aumenta con la temperatura, la presión y el flujo de aire. A medida que aumentan el flujo de aire disminuye el tiempo de reacción total. A un tiempo de reacción de 250 min, se obtuvo una concentración final del ácido de 0.305 gmol/lt en el Experimentos 4 (Figura 5); mientras que a 165 min, la concentración final fue 0.000 gmol/lt, conversión es completa, en el Experimento 7 (Figura 6). A pesar de que la solubilidad del oxígeno en la solución aumenta con la presión, el efecto del flujo de aire es más influyente sobre la velocidad de reacción del ácido sulfúrico.
La Figura 7 muestra la influencia del caudal de aire, la presión y la temperatura sobre la variación de la concentración de ácido sulfúrico en el reactor con el tiempo, para flujos de aire entre 0.4 lt/min y 1.2 lt/min, y presiones entre 0.93 y 1.70 bar (Tabla 1) en los Experimentos 1, 7, 10, 11, 12 y 13. La acidez disminuye más rápidamente con los valores más altos de flujo de aire, y las líneas de tendencia son cercanas entre sí para presiones de 0.8 y 1.2 bar y temperaturas de 90 y 95°C. Esto confirma que la presión y la temperatura no son factores determinantes, y que, probablemente, se alcanza un máximo en la rata de transporte de oxígeno al líquido para flujos de aire alrededor de 0.8 lt/min.
Figura 7. Efectos del flujo de aire, prsión y temperatura sobre la variación de la concentración de ácido con el tiempo. Experimentos 1,7,10,11 y 13 a las condiciones mostradas en la Tabla 1.
Obsérvese también en la Figura 6, que con los agentes oxidantes, ácido nítrico y peróxido de hidrógeno (Experimentos 8 y 9) ocurren disminuciones más pronunciadas en la concentración de ácido sulfúrico, sobre todo al inicio de la reacción, respecto a los experimentos efectuados sólo con aire (Experimento 1). Todos estos resultados sugieren que la etapa determinante del proceso es la difusión de oxígeno a la superficie metálica.
El efecto de la temperatura puede observarse en la Figura 5, mediante los Experimentos 1, 2 y 3 a 0.93 bar y temperaturas de 90, 95 y 85°C respectivamente. La rapidez de cambio en la concentración del ácido aumenta con la temperatura. Pero esta rapidez es mayor en el Experimento 4 a 90°C y 1.32 bar. Esto se puede explicar con la Figura 1, ya que a mayor temperatura es posible una mayor ionización del ácido sulfúrico y mayor desprendimiento de hidrógeno que forma una capa pasivadora sobre el metal, lo cual facilita la reacción de oxidación. Sin embargo, ésta no es información suficiente para extraer una conclusión definitiva sobre cómo influye la temperatura en las etapas del proceso.
Determinación de la Expresión Cinética
De acuerdo con la estequiometría de la reacción, Ecuación (1), la velocidad de reacción del ácido sulfúrico puede expresarse en función de la del oxígeno.
rH SO = 2rO (7)
2 4 2
Del análisis de los resultados antes expuestos, se presume que el proceso es controlado por la difusión de oxígeno hasta la superficie metálica. Es frecuente considerar que la mayor resistencia al transporte de gases ligeramente solubles está en la fase líquida (Smith [8] y Fogler [9]), por lo que el término as / agkg en la Ecuación (6) se puede descartar. Cuando el flujo de aire es alto, aumenta la velocidad relativa entre el gas y el líquido, así como entre el líquido y el sólido; en consecuencia, las resistencias a la transferencia de oxígeno del líquido al sólido, término H / ks, es despreciable. La reacción sobre la superficie es rápida comparada con la velocidad de transferencia de masa de oxígeno y por tanto el término 1/k es también insignificante, de modo que la Ec. (6) se reduce a la expresión.
1 H
= (8)
koas agkL
Luego, combinando las Ecuaciones (2), (7) y (8) resulta
- rH SO = dCH SO / dt = 2( agkL / H )( CO ) (9)
2 4 2 4 2 g
Debido al alto flujo del aire, podemos considerar que la concentración en las corrientes de entrada y salida varía muy poco (reactor diferencial), por lo que la concentración de oxígeno en la fase burbuja puede ser calculada usando la presion y temperatura, mediante la ecuación para gases ideales expresada en la forma
PO 0.21P
2
(CO ) = = (10)
2 g RT RT
donde Po2 es la presión parcial del oxígeno (atm), R la constante universal de los gases, (0.08206 litros atm/mol K), y T la Temperatura (K).
Las velocidades de reacción del H2SO4 se hallan con las pendientes de las curvas de concentración-tiempo mostradas en las Figuras 5, 6 y 7, mientras las concentraciones de oxígeno son estimadas con la Ec. (10) y las condiciones dadas en la Tabla 1. Estos resultados son mostrados en la Tabla 2 y Figura 8 para los tres flujo de aire empleado.
Los valores de agkL / H calculados mediante la Ec. (9) y los valores de las pendientes – d[H2SO4]/dt para cada experimento aparecen graficados en la Figura 8 y presentados en la Tabla 2. Es de notar que el término agkL/H incrementa con el flujo de aire lo cual se debe al incremento del área ag, ya que la máxima variación en las temperaturas empleadas es baja (5°C). Con relación a los parámetros H y kL, se requieren otros experimentos para poder evaluarlos; sin embargo, se pueden hacer estimaciones con correlaciones conocidas. Tomando el valor de la constante de Henry (Smith, [8]) como H= 34.4 (gmol/cm3 gas)/(gmol/cm3 líquido), se pueden calcular los valores de agkL dados en la Tabla 2.
Tabla 2
Concentraciones de oxígeno y velocidades de reacción para las condiciones experimentales dadas en la Tabla 1
| Experimento | Flujo de aire, q, litros/min | (CO ), 2 g gmoles/litro | dCH SO / dt, 2 4 gmoles/(litro min) | agkL/H, min-1 | agkL min-1 |
| 1 | 0,4 | 0,013520 | 0,0027 | 0,2088 | 7,183 |
| 2 | 0,4 | 0,013336 | 0,0038 |
|
|
| 4 | 0,4 | 0,016234 | 0,0044 |
|
|
| 5 | 0,4 | 0,018877 | 0,0045 |
|
|
| 6 | 0,8 | 0,01352 | 0,0064 | 0,4752 | 16,342 |
| 10 | 0,8 | 0,016234 | 0,0093 |
|
|
| 13 | 0,8 | 0,018621 | 0,0105 |
|
|
| 7 | 1,2 | 0,01352 | 0,0084 | 0,6264 | 21,548 |
| 11 | 1,2 | 0,016013 | 0,0109 |
|
|
| 12 | 1,2 | 0,018877 | 0,0120 |
|
|
Figura 8. Velocidades de reacción del H2SO4 en función de la concentración de oxígeno para tres flujos de aire (q) y las condiciones indicadas en la Tabla 1.
Conclusiones y Recomendaciones
La velocidad de reacción aumenta al incrementar el flujo de aire, la presión y la temperatura. Sobre la base de los experimentos y las mediciones experimentales realizadas, se presume que el proceso es controlado por la transferencia de oxígeno del aire a la fase líquida.
Sobre las observaciones experimentales se concluye que la cinética es de primer orden en la concentración de oxígeno y es dada por ![]() . Los valores del término agkL/H aumentan con el flujo de aire debido al incremento que experimenta el área de transferencia de masa por unidad de volumen líquido, ag.
. Los valores del término agkL/H aumentan con el flujo de aire debido al incremento que experimenta el área de transferencia de masa por unidad de volumen líquido, ag.
Se recomienda planificar otra serie de experimentos con el fin de determinar el efecto de otras variables y las resistencias individuales del proceso. Es aconsejable realizar una selección exhaustiva de la chatarra con el fin de evitar la contaminación con otros materiales, lo cual puede acarrear desviaciones del comportamiento cinético del proceso. Adicionalmente, es aconsejable un estudio del efecto del tamaño de la chatarra sobre los resultados de este trabajo.
Para disminuir el tiempo de reacción en un reactor industrial, se recomienda operar el reactor a presión atmosférica, temperatura de 90°C, y un flujo de aire alto, tomando como referencia, para hacer el escalamiento, que con el reactor experimental de 10 cm de diámetro, el flujo apropiado es de 1.2 litros/min.
Referencias Bibliográficas
1. Chapman J.S.: Biocide resistance mechanisms. International Biodeteroration & Biodegradation, Vol. 51, Issue 2 (March 2003) 133-138. [ Links ]
2. Quartarone M., Bellomi and Zingales: Using indole (Benzotriazole) to inhibit copper corrosion in aerated 0,5 M sulfuric acid. The Journal of Science and Engineering, Vol. 54, N°8 (1998). [ Links ]
3. Tromans D. y Ahmed T.: Active/passive behavior of copper in strong sulfuric acid. Journal of Electrochemical Society, Vol. 145, No. 2 (1998) 601-608. [ Links ]
4. Carey A.E. and Wheatcraft S.W.: Non-Fickian ionic diffusion across high-concentration gradients. Water Resources Research, Vol. 31, No. 9 (1995) 2213-2218. [ Links ]
5. Mohan R., Boateng K.A. and Myerson A.S: Estimation of crystal growth kinetics using differential scanning calorimetry. Journal of Crystal Growth, Vol. 212, No. 3-4 (2000), 489-499. [ Links ]
6. Mohan R. and Myerson A.S.: Growth kinetics: a thermodynamic approach. Chemical Engineering Science, Vol. 57, No. 20 (2002), 4277-4285. [ Links ]
7. Fontana M.G. and Greene N.D.:"Corrosion Engieneering", 2ª Ed, McGraw-Hill, New York, NY, 1967. [ Links ]
8. Smith J.M.: Ingeniería de la Cinética Química, 2ª Ed., Continental, México, 1984. [ Links ]
9. Fogler H.S.: Elementos de Ingeniería de las Reacciones Químicas, 3a Ed., Pearson Educación, México, 2001. [ Links ]