Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Técnica de la Facultad de Ingeniería Universidad del Zulia
versión impresa ISSN 0254-0770
Rev. Téc. Ing. Univ. Zulia v.30 n.1 Maracaibo abr. 2007
Nitroxide mediated polymerization of n-butyl acrylate using accelerating agents
Myriam Gregorio-De Las Heras, David León, Orietta León, Diana Soto y Haydee Oliva
Laboratorio de Polímeros, Escuela de Ingeniería Química, Universidad del Zulia. Maracaibo, Venezuela. holiva@luz.edu.ve
Abstract
The effect of the Dicumyl Peroxide (DCP), Acetol and Acetic Anhydride on the conversion evolution, and molecular weight distribution in bulk nitroxide mediated polymerizations of n-butyl acrylate (BA) was studied. Temperature profile was 1 h at 90°C, and variable reaction times (between 2 and 32 hours) at 135°C. Benzoyl peroxide (BPO) and 4-hidroxy-2,2,6,6-tetramethylpiperidinyl-1-oxyl (4-OH-TEMPO) were used as initiator and stable radical, respectively. Thermal, conventional, and nitroxide mediated polymerizations of the acrylic monomer were carried out for comparison purposes. Conversion was determined gravimetrically and some samples were selected for characterization by size exclusion chromatography (SEC). With DCP conversions were low and the polymerization was uncontrolled. Polymerization was inhibited for molar relation [DCP]/[4-OH-TEMPO] below of 0,5; independently of the [4-OH TEMPO]/[BPO]. With acetol, reaction rate increased respect to the polymerization without this agent. Conversions reached 66%, while the products showed relatively narrow molecular weight distributions (PD 1,35-2,01). The polymerization rate increased significantly at [Anh Ac]/[4-OH-TEMPO] ³ 4. In these cases, conversions were higher than 70% at first 2 h of reaction time. However, there was no control over these polymerizations. From the comparison of the effect for the studied agents, is possible to conclude that acetol produce better results on distribution of molar mass control, at acceptable polymer yields.
Key words: Nitroxide mediated polymerization, 4-OH-TEMPO, n-butyl acrylate, accelerating agents.
Polimerización de acrilato de n-butilo mediada por nitróxidos usando agentes potencialmente acelerantes
Resumen
En este trabajo se estudió el efecto de la adición del peróxido de dicumilo (DCP), acetol y anhídrido acético (Anh Ac) sobre la evolución de la conversión y la distribución de pesos moleculares en la polimerización de acrilato de n-butilo (BA) mediada por nitróxido. Todas las polimerizaciones fueron en masa. El perfil de temperatura fue 90°C durante una hora y varios tiempos de reacción (entre 2 y 32 horas) a 135°C, usando como iniciador peróxido de benzoílo (BPO) y como radical estable el 4-OH-TEMPO (4-hidroxi-2,2,6,6 tetrametil piperidin-N-oxilo). Se realizaron las polimerizaciones térmica, química y mediada por nitróxidos del monómero acrílico para efectos de comparación. Se determinó la conversión gravimétricamente y se seleccionaron algunas muestras para su caracterización por cromatografía de exclusión por tamaño (SEC). Cuando se empleó peróxido de dicumilo, la polimerización se inhibió a relaciones molares [DCP]/[4-OH-TEMPO] inferiores a 0,5, independientemente de la relación [4-OH TEMPO]/[BPO] empleada (1,2 y 1,1). Por encima de 0,5, se obtuvieron bajas conversiones (<50%) y la reacción procedió de forma no controlada. Con la adición de acetol aumentó la velocidad de reacción a todas las relaciones molares [Acetol]/[4-OH-TEMPO] (2, 4, 5 y 6) estudiadas; obteniéndose conversiones hasta de 66% y distribuciones de pesos moleculares relativamente estrechas (PD 1,35-2,01). Con la adición de anhídrido acético la velocidad de polimerización aumentó significativamente a partir de la relación [Anh Ac]/[4-OH-TEMPO] = 4, con conversiones mayores que 70% en sólo 2 horas de reacción. Sin embargo, las polimerizaciones fueron no controladas. Al comparar el efecto de estos tres agentes, se concluye que el acetol conduce a rendimientos altos en tiempos de reacción aceptables, manteniendo un control moderado sobre la distribución de masas molares.
Palabras clave: Polimerización mediada por nitróxidos, 4-OH-TEMPO, Acrilato de n-butilo, agentes acelerantes.
Recibido: 27-03-06 Revisada: 05-03-07
Introducción
La polimerización mediada por nitróxidos es una de las técnicas más estudiadas para controlar la polimerización vía radicales. La clave del éxito de este tipo de polimerización es la desactivación reversible del radical creciente por los nitróxidos, lo que permite reducir significativamente las reacciones de terminación bimolecular, mostrando características cuasi “vivientes”.
La polimerización del acrilato de n-butilo (BA) en presencia de TEMPO (2,2,6,6-tetrametil-1-piperidiniloxilo) o sus derivados, es posible sólo bajo condiciones únicas de reacción. La dificultad asociada al TEMPO para controlar la polimerización del acrilato de n-butilo está directamente relacionada con la concentración de radicales N-oxilo libres la cual tiende a aumentar debido a las reacciones de terminación prematura que ocurren en el transcurso de la polimerización. El exceso de nitróxido libre orienta el equilibrio hacia la formación de cadenas durmientes, lo cual conduce a la inhibición de la reacción [1].
Se han utilizado nitróxidos acíclicos para la polimerización del acrilato de n-butilo, con resultados exitosos [2]. Sin embargo, estos nitróxidos requieren múltiples pasos para su preparación, algunos tienden a ser inestables y se descomponen, y en general, son muy costosos [1]. Por esta razón, el desarrollo de procesos de polimerización de los monómeros acrílicos basados en TEMPO sería importante no sólo por razones prácticas sino también económicas.
Se han estudiado varias alternativas para superar las limitaciones impuestas por las bajas velocidades de reacción en presencia de TEMPO. Diferentes autores han investigado el uso de agentes capaces de actuar como acelerantes de la polimerización en sistemas mediados por TEMPO o sus derivados. Entre los agentes utilizados hasta el momento, se encuentran: ácidos orgánicos tales como el ácido camforsulfónico (CSA) [3], el 2-fluoro-1-metil piridin-p-toluensulfónico (FMPTS) [4], el dodecilbencenosulfónico (DDBSA) [5] y el ascórbico [1], agentes reductores tales como la glucosa y la hidroxiacetona [6], agentes acilantes tal como el anhídrido acético [7] y los iniciadores de larga vida media tal como el peróxido de dicumilo [8].
Los estudios mencionados se han centrado principalmente en la homopolimerización del estireno, siendo relativamente escasa la información publicada para otros monómeros. En este trabajo, se escogieron tres agentes para evaluar su eficiencia como acelerantes en la polimerización del acrilato de n-butilo mediada por nitróxidos, en función de su accesibilidad o disponibilidad comercial y bajo costo. Los agentes seleccionados fueron: el peróxido de dicumilo (DCP), la hidroxiacetona o acetol y el anhídrido acético.
Parte Experimental
Materiales
Inicialmente se removió el agua presente en el monómero usando tamices moleculares Linde 3A de Alfa Products. Posteriormente, se destiló bajo vacío y se almacenó a 5°C en atmósfera inerte. Se seleccionó como mediador nitróxido el 4-hidroxi-2,2,6,6-tetrametil-1-N-oxil- piperidina (4-OH-TEMPO), de Aldrich, 97%, cuya estructura se muestra en la Figura 1. El peróxido de benzoilo (BPO) al 97% y el DCP al 99%de Akzo Nobel se seleccionaron como iniciadores con distintos perfiles de descomposición; la hidroxiacetona o acetol (Aldrich, 90%) y el anhídrido acético (Merck, 98,5%), utilizados como agentes potencialmente acelerantes de la reacción, se usaron tal como se recibieron.
Figura 1. Estructura de 4-hidroxi-2,2,6,6- tetrametil-1-N-oxil- piperidina (4-OH- TEMPO).
Síntesis y caracterización
Síntesis de los homopolímeros en presencia de nitróxidos
Las polimerizaciones se llevaron a cabo en masa, en tubos de vidrio previamente desoxigenados, bajo atmósfera de nitrógeno. En todos los casos, se tomaron 10 mL de solución con composiciones variables, según la formulación empleada. Los tubos se calentaron a 90°C durante una hora, para promover la formación de la alcoxiamina. Luego, se aumentó la temperatura hasta 135°C por tiempos de reacción variables. Una vez alcanzado el tiempo de reacción establecido las reacciones se detuvieron por inmersión en nitrógeno líquido. Todos los polímeros se separaron del monómero residual por disolución en THF y reprecipitación en metanol. Luego, los productos se secaron al vacío a 25°C hasta peso constante. La Tabla 1 presenta las condiciones de reacción estudiadas.
Tabla 1
Condiciones experimentales de las homopolimerizaciones de acrilato de n-butilo mediadas por 4-OH-TEMPO e iniciadas por BPO a 135°C en presencia de DCP, acetolo anhídrido acético

Para efectos de comparación, se llevaron a cabo homopolimerizaciones vía radicales libres convencional (iniciada con BPO y térmicamente), siguiendo el perfil de temperatura antes señalado.
Caracterización de los polímeros
En todos los casos se determinaron las conversiones a partir de la relación en masa de monómero convertido a monómero alimentado. Todos los homopolímeros se analizaron por cromatografía de exclusión por tamaños (SEC) en un cromatógrafo Waters-Breeze, equipado con un conjunto de 6 columnas Waters Styragel en serie con un intervalo de 102-107 g/mol, un refractómetro diferencial (Waters 2414 modelo 410) y un detector UV (Waters modelo 440, a 254 nm). Como solvente de arrastre se utilizó THF a 1 mL/min y 25°C. Se utilizaron estándares de poliestireno para construir la curva de calibración universal. La concentración de las muestras inyectadas fue de 1 mg/mL y el volumen de inyección fue de 200 µL.
Resultados y Discusión
Para efectos de comparación, en la Tabla 2 se presentan los resultados globales y las condiciones de reacción de las polimerizaciones del acrilato de n-butilo térmicas, radical convencional, (usando BPO a diferentes tiempos de reacción) y mediada por nitróxidos a relaciones de [4-OH-TEMPO]/[BPO] de 1,2 y 1,1. Para algunos experimentos también se determinaron las curvas de distribución de pesos moleculares. Como se esperaba, el homopolímero obtenido por autopolimerización del monómero exhibe altas conversiones, debido al marcado efecto gel característico de los monómeros acrílicos, especialmente en reacciones en masa. Los altos pesos moleculares obtenidos en ausencia de iniciador aumentan la viscosidad del medio, acentuando este efecto. Comparando los resultados de la polimerización en presencia o no de BPO, a iguales tiempos de reacción, se encuentra que el tiempo de vida media del BPO a la temperatura de reacción es muy corto, razón por la cual una vez que se consume el iniciador, la reacción procede la mayor parte del tiempo por iniciación térmica. Esto justifica la similitud en la evolución de la conversión en ambas reacciones. El efecto del iniciador se manifestó en la diferencia existente en las distribuciones de pesos moleculares de las reacciones con y sin el peróxido. La fracción de polímero de bajo peso molecular producida por iniciación química al principio de la reacción causó una disminución significativa del y un aumento en la polidispersidad respecto al polímero obtenido por iniciación puramente térmica. Una característica común a ambas reacciones, fue el escaso control sobre la distribución de pesos moleculares.
Tabla 2
Resultados de la polimerización térmica, química y mediada por 4-OH-TEMPO del acrilato de n-butilo

La polimerización en presencia de nitróxido compensaría esta desventaja. Sin embargo, cuando se usó solo el 4-OH-TEMPO las reacciones se inhibieron independientemente de la relación [4-OH-TEMPO]/[BPO] y del tiempo de polimerización, debido al exceso del nitróxido libre que permanece en el sistema. En la Figura 2 se presenta el mecanismo de reacción para este tipo de sistemas.

Figura 2. Me canismo para la polimerización controlada de BA con BPO/4-OH-TEMPO.
La velocidad de reacción está controlada por el equilibrio entre los radicales activos, el nitróxido y las especies durmientes. A diferencia de los sistemas estirénicos, los radicales generados durante la autopolimerización del monómero acrílico son insuficientes para consumir el exceso de nitróxido libre en el medio y favorecer la propagación de las cadenas. A este hecho se suman a) la baja constante de equilibrio de este sistema en particular producto de la baja constante de disociación del enlace TEMPO-acrilato y a la alta velocidad de combinación del TEMPO con el centro activo de la cadena polimérica [1] y b) las reacciones de terminación que contribuyen al incremento de la concentración de N-oxilos libres [6]. En la referencia [6] se midió por ESR la evolución de la concentración de nitróxido libre en la polimerización de n-butil acrilato, encontrándose un aumento en la concentración de esta especie con el tiempo de reacción hasta alcanzar niveles donde se propicia la inhibición de la polimerización.
Dada la naturaleza de la especie activa, las reacciones de terminación no pueden eliminarse, sólo disminuirse (en la presencia de N-oxilos), por lo que el resultado deseado se lograría por el incremento de: a) la constante de equilibrio, ya sea por aumento de la constante de velocidad de disociación y/o disminución de la constante de velocidad de combinación, b) la relación de centros activos a nitróxido libre, ya sea aumentando la concentración de cadenas propagantes activas o disminuyendo la concentración de nitróxido libre.
Esto sería factible adicionando concentraciones adecuadas de un compuesto capaz de propiciar cambios en el sistema por alguna de estas vías.
Polimerizaciones del acrilato de n-butilo mediadas por nitróxidos empleando peróxido de dicumilo (DCP)
El DCP se descompone lentamente a las condiciones de reacción generando radicales capaces de atrapar el nitróxido que se libera en el transcurso de la reacción producto de terminaciones prematuras. En la Figura 3 se presentan las curvas conversión vs. tiempo para las homopolimerizaciones del BA controladas por N-oxilos, a relaciones molares de 4-OH-TEMPO/BPO de 1,1 y 1,2 en presencia de DCP. Los resultados sugieren que el DCP fue efectivo en un intervalo de concentración limitado. Así, a DCP/4-OH-TEMPO = 0,2 el DCP generó una cantidad baja de radicales, que junto con los producidos por descomposición del BPO y del monómero fueron insuficientes para consumir el exceso de nitróxido libre en el medio y permitir la propagación de las especies, aun después de 32 h de reacción.

Figura 3. Polimerizaciones de acrilato de n-butilo mediadas por nitróxido, en presencia de DCP y a relaciones molares de [4-OH-TEMPO]/[BPO] = 1,1 (símbolos rellenos) y 1,2 (símbolos vacíos).
A relaciones molares iguales a 0,5 el rendimiento fue apreciable e independiente del tiempo de reacción. Cuando se duplicó el tiempo de polimerización sólo hubo un incremento de alrededor del 3% en la conversión. Esto podría explicarse en función de los cortos tiempos de vida media de los peróxidos utilizados a la temperatura de reacción. En las primeras horas de reacción, la descomposición del DCP de mayor tiempo de vida media efectivamente cambia la proporción de centros activos/nitróxido lográndose que la polimerización se lleve a cabo de manera no impedida. Posteriormente, el consumo de especies activas por reacciones de terminación bimolecular prematura causa un descenso en la velocidad de polimerización.
Un hecho que destaca en la Figura 3 y en la Tabla 3, es el menor rendimiento obtenido a la relación de [DCP]/[4-OH-TEMPO] de 0,9. Probablemente a estas condiciones se produciría un exceso de radicales activos que desplazaría el equilibrio hacia la formación de especies durmientes, inhibiendo la polimerización. Adicionalmente, la probabilidad de terminación entre las especies activas también aumentaría, conllevando al ensanchamiento de la distribución de pesos moleculares. Otra posibilidad es que la eficiencia del iniciador disminuya por efecto de la alta concentración de DCP. Una combinación de estos efectos podría explicar la conducta observada. La adición de un segundo iniciador al sistema resultó en polidispersidades similares a las de polimerizaciones radicálicas convencionales (PD = 2,09-7,30). En las Figuras 4 y 5 se observa que la distribución de pesos moleculares con el sistema BPO/DCP/4-OH-TEMPO fue más estrecha que la de los poliacrilatos obtenidos térmicamente y solo con BPO, presentándose, sin embargo, colas en la zona de bajas masas molares.
Tabla 3
Pesos moleculares y polidispersidades de muestras seleccionadas de poli(acrilato de n-butilo) en presencia de DCP. [4-OH-TEMPO]/[BPO] = 1,2


Figura 4. Distribución de pesos moleculares de los poli(acrilatos de n-butilo) sintetizados en presencia de nitróxido ([4-OH-TEMPO]/[BPO] = 1,2), empleando DCP a diferentes relaciones molares [DCP]/[4-OH-TEMPO], para las muestras de la Ta bla 3.

Figura 5. Distribución de pesos moleculares de los poli(acrilatos de n-butilo) sintetizados en presencia de nitróxido ([4-OH-TEMPO]/[BPO] = 1,1) y empleando DCP a diferentes relaciones molares [DCP]/[4-OH-TEMPO].
Cuando se redujo la relación 4-OH-TEMPO/BPO a 1,1 se observaron las mismas tendencias antes descritas en cuanto a rendimientos (Figura 3) y a pesos moleculares (Figuras 4 y 5). Las mayores diferencias entre los dos grupos de experimentos corresponden a las velocidades de polimerización. La conversión a un mismo tiempo de reacción fue mayor a la más alta concentración relativa de nitróxido, si bien intuitivamente se esperaría lo contrario. Posiblemente el 4-OH-TEMPO afecta la eficiencia de los peróxidos, mediante una interacción entre este radical y los provenientes de la descomposición del iniciador.
Se comprobó la reproducibilidad del sistema tomando réplicas a las 8 h a relaciones [4-OH-TEMPO]/[DCP] ³ 0,5. Se encontraron diferencias en los rendimientos inferiores al 7%.
Polimerizaciones del acrilato de n-butilo mediadas por nitróxidos adicionando acetol
En la Figura 6 se presenta la evolución de la conversión a las diferentes concentraciones relativas de acetol/4-OH-TEMPO estudiadas. Se observa que a medida que se incrementó la concentración de acetol disminuyeron los períodos de inducción y aumentaron las conversiones. Estos resultados podrían ser explicados por medio de una interacción directa entre el acetol y el nitróxido, ya sea en su forma libre o como parte de la alcoxiamina. En el primer caso, esta interacción disminuiría la eficiencia del nitróxido para atrapar radicales, mientras que en el segundo, se debilitaría el enlace P-ON (tal como se muestra en el Figura 7) y se desplazaría el equilibrio hacia la activación de los polirradicales, permitiendo el crecimiento de las cadenas.

Figura 6. Evolución de la conversión en las homopolimerizaciones de acrilato de n-butilo mediadas por nitróxidos empleando acetol a diferentes relaciones [Ace tol]/[4-OH-TEMPO].

Figura 7. Mecanismo de acción del acetol, con polarización del enlace PON por interacciones tipo puentes de hidrógeno con el grupo OH del acetol.
Este mecanismo se propone tomando en consideración lo reportado por Keoshkerian [6] y Lizotte [9].
En la Figura 6 se observa que, aun a la menor concentración de hidroxiacetona, ocurre un aumento constante de la conversión hasta las 14 h de polimerización, luego de lo cual la reacción se hace más lenta. El mismo comportamiento se encuentra a concentraciones mayores del agente.
Durante las primeras horas de reacción la alta concentración de radicales, tanto activos como nitróxido, favorece la formación de la alcoxiamina, y, a su vez, la reacción entre ésta y el acetol, permitiendo nuevamente la activación del polirradical. Sin embargo, a medida que transcurre el tiempo, las reacciones laterales y de terminación contribuyen al incremento del nitróxido libre, desplazando el equilibrio hacia la izquierda, con la consecuente formación de especies durmientes, siendo este efecto acelerado por un exceso de acetol en el medio.
La relación óptima de [Acetol]/[4-OH- TEMPO] podría estar entre 0,5-1, considerando que de acuerdo con el Figura 7, la interacción se produciría entre un grupo –OH del acetol y el –ON del nitróxido y que los tautómeros del acetol poseen 1 ó 2 grupos –OH por molécula. Si bien no se estudiaron relaciones [Acetol]/[4-OH-TEMPO] menores que 2, la extrapolación de los datos experimentales indica que aumentarían los periodos de inducción y se requerirían largos tiempos de reacción para obtener rendimientos apreciables, en caso de que la reacción no se inhiba completamente.
La Tabla 4 presenta los ![]() y polidispersidades de algunas muestras seleccionadas. Las correspondientes distribuciones de pesos moleculares en presencia de acetol, a diferentes relaciones [Acetol]/[4-OH-TEMPO] y a igual conversión, se presentan en las Figuras 8 y 9, respectivamente. Las distribuciones de masas molares fueron prácticamente independientes de la relación de concentraciones y de los tiempos de polimerización para relaciones [Acetol]/[4-OH- TEMPO] ³ 4, lo cual confirmaría que el acetol está en exceso cuando se emplean estas relaciones.
y polidispersidades de algunas muestras seleccionadas. Las correspondientes distribuciones de pesos moleculares en presencia de acetol, a diferentes relaciones [Acetol]/[4-OH-TEMPO] y a igual conversión, se presentan en las Figuras 8 y 9, respectivamente. Las distribuciones de masas molares fueron prácticamente independientes de la relación de concentraciones y de los tiempos de polimerización para relaciones [Acetol]/[4-OH- TEMPO] ³ 4, lo cual confirmaría que el acetol está en exceso cuando se emplean estas relaciones.
Tabla 4
Pesos moleculares y polidispersidades de muestras seleccionadas de poli(acrilato de n-butilo) en presencia de acetol a 135°C

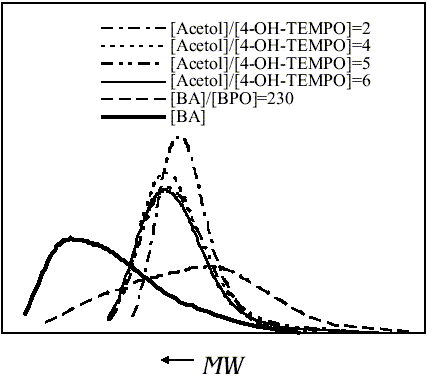
Figura 8. Comparación de las distribuciones de pesos moleculares de los poli(acrilatos de n-butilo) sintetizados en presencia de nitróxido empleando acetol a diferentes concentraciones, tiempo de reacción = 10 h.

Figura 9. Comparación de las distribuciones de pesos moleculares de los poli(acrilatos de n-butilo) sintetizados en presencia de nitróxido empleando acetol a diferentes concentraciones, a una misma conversión (46%).
Como era de esperar, a conversión constante (Figura 9) la distribución de pesos moleculares fue independiente de la relación [Acetol]/[4-OH- TEMPO]. En todos los casos, las distribuciones de pesos moleculares fueron más estrechas que aquellas de la polimerización radical convencional, lo que indica el crecimiento controlado de las cadenas poliméricas. Se realizaron algunas réplicas de las polimerizaciones de acrilato de n-butilo en presencia de acetol, variando la cantidad de este agente, para confirmar la reproducibilidad del sistema, encontrándose diferencias no mayores que 6%.
Polimerizaciones del acrilato de n-butilo mediadas por nitróxidos empleando anhídrido acético
En la Figura 10 se muestran los resultados obtenidos para las polimerizaciones de acrilato de n-butilo mediadas por nitróxido, empleando diferentes concentraciones de anhídrido. Se observa que a medida que aumenta la concentración del agente incrementa la velocidad de reacción de manera no lineal, ocurriendo la polimerización de manera no impedida a partir de la relación [Anh Ac]/[4-OH-TEMPO] = 4.

Figura 10. Evolución de la conversión en las homopolimerizaciones de acrilato de n-butilo mediadas por nitróxido empleando anhídrido acético a diferentes relaciones [Anh Ac]/[4-OH-TEMPO].
La ausencia de un período de inducción, para [Anh Ac]/[4-OH-TEMPO] = 4, indica que la concentración de especies activas superó a la del 4-OH-TEMPO rápidamente, siendo comparables las conversiones con aquellas de la polimerización convencional iniciada con BPO, en las primeras horas de reacción. Luego, la conversión aumenta muy lentamente, independientemente del tiempo, por lo que la mayor parte del polímero obtenido se produjo en las primeras horas de reacción. A la relación mayor que 4, el comportamiento es más acentuado desde las primeras horas, siendo incluso las velocidades de reacción mayores que para la polimerización química convencional. La relación óptima [Anh Ac]/[4-OH-TEMPO] podría estar entre 2 y 4.
Las altas conversiones en estas polimerizaciones podrían explicarse en función de una interacción entre los radicales benzoiloxilos y el anhídrido, aumentando la eficiencia del iniciador o la reactividad de los radicales, de manera similar a lo que ocurre entre un aldehído y un radical [10]. El radical benzoiloxilo induciría el rompimiento homolítico del anhídrido acético formándose un nuevo peróxido (teniendo como sustituyentes a un grupo benzoilo y uno acetilo), que podría fácilmente disociarse en un par de radicales. La interacción entre el radical benzoiloxilo y el anhídrido también conduciría directamente a la generación de un radical acetilo, según se muestra en la Figura 11.

Figura 11. Interacción entre los radicales producidos por descomposición del BPO y el anhídrido acético.
Según este mecanismo, el peso molecular disminuiría con la generación de un mayor número de cadenas crecientes. No obstante, las distribuciones de pesos moleculares (Figura 10) no reflejan un marcado decaimiento en el mismo.
Otra posible causa de las altas conversiones sería la reacción degradativa directa entre el anhídrido y el nitróxido libre, que reduciría la concentración inicial de ambos, tal como se observa en el Figura 12. Según este mecanismo, propuesto por Baumman y col. [4] una drástica disminución del 4-OH-TEMPO resultaría en una polimerización con poco o ningún control, tendiendo a una polimerización radical convencional. Adicionalmente, el ion acetato formado (Figura 12) podría afectar igualmente la eficiencia del iniciador o la reactividad de los radicales. Las distribuciones de pesos moleculares (Figura 13 y Tabla 5) están en acuerdo con esta explicación. De cualquier manera, la presencia de vapores desde la etapa de precalentamiento a 90°C, en todas las muestras que polimerizaron, sugiere que el anhídrido tiene una interacción directa con uno o varios componentes del medio, que ocasionan la formación de compuestos de bajo punto de ebullición. Simultáneamente, podría estar ocurriendo la evaporación parcial del anhídrido acético.

Figura 12. Reacciones de degradación entre el anhídrido acético y el TEMPO [4].

Figura 13. Comparación de las distribuciones de pesos moleculares de los poli(acrilatos de n-butilo) sintetizados en presencia de nitróxido empleando anhídrido acético a diferentes concentraciones, a 10 h de reacción.
Tabla 5
Pesos moleculares y polidispersidades de muestras seleccionadas de poli(acrilato de n-butilo) en presencia de anhídrido acético a 135°C

Los resultados obtenidos contradicen tanto el mecanismo de acilación propuesto por Malmstrom y col. [7], como la explicación de Goto y col. [11] basada en una posible alteración de la actividad del 4-OH-TEMPO como agente capturador de radicales. Si esto último ocurriera aisladamente la polimerización se asemejaría a una polimerización química convencional. Sólo un efecto combinado del mecanismo propuesto por Baumman y col. [4] y el aumento de la eficiencia del iniciador debido a la adición del anhídrido acético justificaría los resultados obtenidos.
En este caso las réplicas realizadas para verificar la reproducibilidad en las mediciones de conversión, arrojaron desviaciones entre 3 y 16%.
Comparación de los resultados obtenidos en las polimerizaciones mediadas por nitróxidos de acrilato de n-butilo en presencia de aditivos
En la Figura 14 se presentan los resultados de la evolución de la conversión con el tiempo en las homopolimerizaciones mediadas por 4-OH-TEMPO, para los tres agentes empleados a concentraciones similares de los mismos.

Figura 14. Comparación de la evolución de la conversión con el tiempo en las polimerizaciones de acrilato de n-butilo mediadas por nitróxido empleando: DCP, ace tol, o Anh Ac.
A partir de las 6 h, el efecto de la adición de los agentes sobre la evolución de la conversión sigue el siguiente orden: anhídrido acético > acetol > DCP. Sin embargo, a menores tiempos se invierte el orden cuando se emplearon el acetol y el DCP. En todos los casos, las conversiones fueron mayores cuando se adicionó anhídrido acético que para los otros dos aditivos. Al mismo tiempo de reacción (10 h), se observó una distribución de pesos moleculares más angosta cuando se empleó acetol en comparación con el anhídrido (Figura 15). La curva para el DCP corresponde a un tiempo de reacción mayor y presenta la distribución de pesos moleculares más amplia.

Figura 15. Comparación de las distribuciones de pesos moleculares de los poli(acrilatos de n-butilo) sintetizados en presencia de nitróxido empleando acetol o anhídrido acético a 10 h y DCP a 16 h, de reacción.
El análisis del efecto global de los diferentes agentes indica que la velocidad de reacción en presencia de acetol fue aceptable, manteniéndose el control sobre la distribución de masas molares a bajos tiempos de reacción.
Conclusiones
Cuando se empleó peróxido de dicumilo como agente potencialmente acelerante la polimerización procedió a partir de la relación [DCP]/[4-OH-TEMPO] = 0,5 para relaciones [4-OH-TEMPO]/[BPO] de 1,1 y 1,2. Cuando se disminuyó esta última relación a 1,1 se obtuvieron menores conversiones y polidispersidades, pero en ningún caso se tuvo control sobre la polimerización.
La adición de acetol al sistema aumenta la velocidad de reacción, ocurriendo la polimerización en todas las relaciones [Acetol/[4-OH-TEMPO] empleadas, lográndose un mejor control sobre la misma para la relación [Acetol/[4-OH-TEMPO] = 2 a tiempos de reacción menores o iguales a 10 h. En el caso del anhídrido acético, este aditivo produjo un marcado incremento sobre la velocidad de polimerización, superando incluso a la velocidad de la polimerización radical convencional. La reacción procedió a partir de una relación [Anh Ac]/[4-OH-TEMPO] = 4 con las menores polidispersidades a tiempos de reacción menores o iguales a 6 h.
La comparación del efecto de la adición de los tres agentes, indicó que la velocidad de reacción en presencia de acetol fue aceptable, manteniéndose el control sobre la distribución de masas molares a bajos tiempos de reacción.
Agradecimientos
Este trabajo fue financiado por el FONACIT (Proyecto S1-2001001103) y CONDES-LUZ, Venezuela. Los autores agradecen a la Universidad del Zulia, al grupo de polímeros del INTEC (Argentina) por las mediciones por SEC y a la empresa INTEQUIM por proveer el monómero.
Referencias Bibliográficas
1. Georges, M K; Lukkarila, J and L Szkurhan. “TEMPO mediated n-butyl acrylate polymerization”. Macromolecules, Vol. 37, (2004) 1297-1303 [ Links ]
2. Ananchenko, G. S. Souaille, M. Fischer, H. Le Mercier, C. Tordo, P. “Decomposition of model alkoxyamines in simple and polymerizing systems. II. Diastereomeric N-(2-methylpropyl)-N-(1-diethyl-phosphono-2,2-dimethylpropyl)-aminoxyl-based compounds”. J. Polym. Sci., Part A: Polym. Chem., Vol. 40, (2002)3264-3283. [ Links ]
3. Georges, M. K; Veregin, P. N; Kazmaier, P. M; Hamer, G. K; Saban, M. “Narrow polydispersity polystyrene by a free-radical polymerization process-rate enhancement”. Macromolecules. Vol. 27, (1994) 7228-7229. [ Links ]
4. Baumann, M; Schmidt-Naake, G. “Acetic anhydride-accelerating agent for nitroxide-controlled free radical copolymerization of styrene and acrylonitrile”. Macromol. Chem. Phys. Vol. 202, (2001) 2727-2731. [ Links ]
5. MacLeod, P; Georges, M; Quinlan, M; Listigovers, N. “Stable free radical polymerization of acrylates using macroinitiators”. Macromolecules. Vol. 38, (1997) 459-460. [ Links ]
6. Keoshkerian, B; Georges, M; Quinlan, M; Veregin, R. “Polyacrylates and polydienes to high conversions by a stable free radical polymerization process: Use of reducing agents”. Macromolecules, Vol. 31, (1998) 7559-7561. [ Links ]
7. Malmstrom, E; Miller, R; Hawker, C. J. “Developments of a new of rate-accelerating additives for nitroxide-mediated living free radical polymerization”. Tetrahedron. Vol 53, Nº 45, (1997) 15225-15236. [ Links ]
8. Greszta, D.; Matyjaszewski, K. “TEMPO–mediated polymerization of styrene: rate enhancement with dicumyl peroxide”. J. Polym. Sci. Part A: Polym. Chem. Vol. 35, (1997)1857-1861. [ Links ]
9. Lizotte, J R, Long, T E. “Stable Free Radical Polymerization Kinetics of Alkyl Acrylate Monomers Using in situ FTIR Spectroscopy: Influence of Hydroxyl-Containing Monomers and Additives”. Macromol Chem Phys, Vol. 205, Nº 5 (2004) 692-698 [ Links ]
10. March, J. “Advanced Organic Chemistry”. John Wiley & Sons Editorial. Third Edition. 1985. [ Links ]
11. Goto, A; Tsujii, Y; Fukuda, T. “Effects of acetic anhydride on the activation and polymerization rates in nitroxide-mediated polymerization of styrene”. Chemistry Letters, (2000) 788-789. [ Links ]













