Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Técnica de la Facultad de Ingeniería Universidad del Zulia
versión impresa ISSN 0254-0770
Rev. Téc. Ing. Univ. Zulia v.30 n.Especial Maracaibo nov. 2007
A review of corrosion by biogenic sulphide in the oil industry
Zoilabet Duque
Fundación Instituto Zuliano de Investigaciones Tecnológicas (INZIT). Maracaibo, Venezuela. Telf./fax: 58-261-7913371. zduque@inzit.gob.ve
Abstract
There exist serious problems in the water-injection systems of the oil industry due to Microbiologically Induced Corrosion, associated with the presence of Biogenic H2S. Several investigators consider that the presence of Sulphate-Reducing Bacteria is the principal cause of bacterial corrosion in natural-water storage and distribution systems. But there are other groups of bacteria H2S producers that are not considered in current microbiological treatments and controls, all caused by the insufficiency of studies that determine the groups of organisms responsible of its production. This review describes the presence of other anaerobic microorganisms that produce this aggressive metabolite or its derivatives in water-injection systems in the oil industry.
Key words: Biogenic sulphide, microbiologically induced corrosion, oil industry.
Una revisión de la corrosión por sulfuro biogénico en la industria petrolera
Resumen
La industria petrolera en sus sistemas de inyección de agua para la recuperación secundaria de crudo ha presentado problemas de corrosión microbiana; tradicionalmente éstos se han asociado a bacterias reductoras de sulfato, productoras de H2S, lo cual es considerado por diferentes investigadores del área, como el principal causante de corrosión bacteriana en los sistemas de distribución de aguas naturales centrando el control de tratamiento químico en este grupo bacteriano. A todo ello la problemática microbiana sigue siendo recurrente a nivel mundial. Por lo cual resulta significativo investigar la presencia de otros microorganismos anaeróbicos productores de este metabolito agresivo o de sus derivados en los sistemas de inyección de agua en la industria petrolífera. Este trabajo presenta una revisión de la sulfidogenesis y la corrosividad promovida por estos microorganismos, resaltando la necesidad de indagar la participación de diferentes grupos anaeróbicos y su consideración a efectos de realizar un mejor control de la corrosión bacteriana.
Palabras clave: Sulfuro biogénico, corrosión microbiológica, industria petrolera.
Recibido el 30 de Junio de 2006 En forma revisada el 30 de Julio de 2007
Introducción
En la década de los 50 se inició el interés en las interrelaciones de los microorganismos de las aguas de inyección de la industria petrolera y es en los años 80 cuando se reconoció a la Corrosión Microbiana (MIC: "Microbiologically Induced Corrosion") como un problema de esta industria, debido a la utilización de aguas de inyección en los procesos de recuperación secundaria de crudo y la asociación de la corrosión a los microorganismos presentes en estos procesos. Hoy en día la MIC es un campo multidisciplinario de las ciencias, incorporando investigaciones en las áreas de microbiología, biología molecular, electroquímica, metalurgia, biofísica y bioquímica, entre otros [1]. En su haber existen técnicas avanzadas para los análisis superficiales [2], electroquímicas, microsensores físicos y químicos, así como los significativos aportes de las técnicas de identificación molecular en las caracterizaciones de investigaciones sobre las poblaciones involucradas en la MIC [3]. A nivel mundial se han identificado a las bacterias reductoras de sulfato (SRB: "Sulphate Reducing Bacteria") como promotoras de los procesos de MIC y son comúnmente resaltadas, dado que generan H2S, desencadenante de severos problemas de corrosión [4-5], los cuales se desarrollan en condiciones anaerobias que permiten la reducción por vía metabólica de compuestos azufrados [6].
H2S Biogénico en la Industria Petrolera
La presencia de H2S en la industria petrolera es un problema significativo que acarrea fuertes implicaciones a las operaciones petrolíferas, tanto en producción primaria como secundaria, debido a la corrosión generada y los subsecuentes desarrollos de aglomeraciones bioorgánicas que promueven los bioensuciamientos en las líneas de inyección afectando el área de flujo y así la velocidad de inyección del agua, lo que conlleva a una ineficiente producción [7, 8].
En USA se ha reportado que en la industria petrolera, involucrando producción, transporte y almacén, un aproximado del 20% de las pérdidas por corrosión es a causa de la corrosión microbiana. Siendo producción una de las áreas más afectadas en sus procesos de recuperación [1]. Al respecto, la industria petrolera venezolana se ve fuertemente afectada, dado que aproximadamente el 40% de la producción se desarrolla por los procesos de recuperación secundaria por inyección de agua [9, 10]. Entre las causas más señaladas capaces de generar sulfuro de hidrógeno en la producción primaria están [7, 8, 11]:
– Disolución de materiales piríticos. Se han indicado cantidades mínimas de Piritas en las rocas de los reservorios, por lo cual no es considerado como factor principal.
– Craqueo de compuestos organoazufrados: Por acción térmica se rompen enlaces C-S, lo cual varía según los patrones de profundidad y temperatura.
– Reducción termoquímica de sulfatos. Para que ocurra la reducción, el reservorio debiera estar en temperaturas superiores a 120°C en presencia de catalizadores.
– Oxidación termoquímica de compuestos organoazufrados. Ocurre a temperaturas superiores de 80oC.
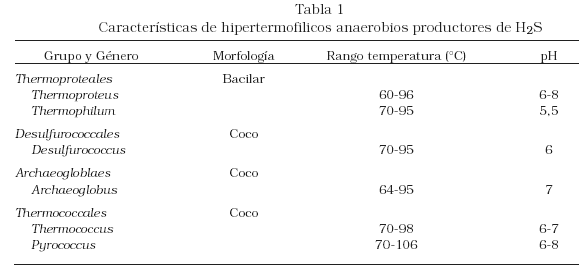
– Generación de sulfuro biogénico. Existe una alta potencialidad por investigar en esta área, pues poco se ha indagado en los microorganismos termofilicos e hipertermofilicos productores de H2S, como las Arqueas, las cuales se desarrollan en condiciones extremas de temperatura entre otras variables [12-13], descritas en la Tabla 1 [14].
Con respecto a la actividad bacteriana en producción primaria, se ha reportado SRB termofílicas en reservorios petrolíferos. Así mismo, en campos petroleros donde geológicamente no existen zonas de producción de H2S, ni fuentes de azufre que contribuya termoquimicamente a formarlo, reportándose que el H2S es de origen biogénico, debido a que las aguas utilizadas en los procesos de perforación y completación de los pozos pueden aportar microorganismos productores de H2S de diferentes grupos identificados los géneros Desulfovibrio, Desulfobacter, Desulfosarcina, Clostridium, siendo estos favorecidos por la concentración de sulfatos, ácidos grasos y orgánicos en el agua (nutrientes que favorecen el desarrollo bacteriano) [7, 10].
A diferencia de los sistemas de producción primaria, la presencia de sulfuros en los procesos de producción secundaria se han asociado principalmente a las SRB mesofílicas [7, 8], las cuales contribuyen a la formación de H2S por lo siguiente [4, 7]:
– Abundante fuente de sulfato en aguas naturales, utilizadas en estos procesos petrolíferos.
– Suministro de nutrientes (materia orgánica, ácidos grasos, etc.)
– Reacciones redox con bisulfito (adicionado en algunos tratamientos químicos). Debido a los bajos niveles de bisulfito de amonio en muchos sistemas, la conversión de bisulfito a sulfuro no es considerada como un factor principal.
– Introducción de microorganismos capaces de desarrollarse en el yacimiento.
En el caso del Occidente Venezolano, el agua del Lago de Maracaibo, es utilizada en los procesos de recuperación tanto como agua o vapor, según sea el tipo de crudo [9, 10]. En lo que se refiere a inyección de agua, los problemas han sido recurrentes tanto en formación de depósitos como de daños localizados asociados a sulfuro biogénico [10, 15]. Ante ello, se han desarrollado diferentes estudios que contribuyan a esclarecer la problemática generada por la actividad biogénica en los procesos de recuperación secundaria de crudo [10, 16, 17].
Además de los procesos de recuperación por inyección de agua, en nuestros campos venezolanos también utilizamos la recuperación térmica, la cual consiste en inyección de vapor al pozo durante un periodo de tiempo [9], para estimular la producción en crudos de 9 a 15° API, dado este proceso, el vapor de agua saturada incrementa el corte de agua del yacimiento [9, 18, 19], además depende la naturaleza química del crudo éste puede verse afectado con la aportación de H2S [20]. Igualmente, según la calidad del vapor se suele adicionar mayor o menor cantidad nutrientes de la fuente acuífera utilizada, la cual en las condiciones de temperaturas, de estos yacimientos, inducen a relacionar el H2S biogénico con las Arqueas o termofilicas [12,13], por lo cual aún hay mucha investigación que desarrollarse al respecto.
En la Tabla 2 se presenta un ejemplo de la corrosividad del acero al carbono, presente a dos condiciones reales de procesos de recuperación secundaria de crudo [21]. Como puede observarse la velocidad de corrosión del acero en la presencia de H2S es acelerada, promoviendo la formación de sulfuros de hierro dada una diversidad de reacciones oxido-redox [4, 21, 22] expresada de forma simple y generalizada en la reacción (1).
Con respecto a las reacciones oxido-redox que conllevan a la reacción (1) diferentes autores han descrito un mecanismo complejo que explica la conformación de diferentes productos de FexSy, aunque existen diferentes criterios al respecto se da una convergencia en la afirmación de que estos productos estimulan la reacción catódica; donde el acero al carbono se comporta anódicamente y suscita una transferencia de electrones a través del sulfuro de hierro [6, 21, 23-27]. Entre los diferentes compuestos de FexSy posibles, la Mackinawita (FeS -tetragonal) es producida desde hierro y óxidos de hierro promovidos por consorcios de microorganismos [25] además de las bacterias productoras de H2S [24]. La presencia de éste en productos de corrosión, formados en aguas naturales poco profundas, se ha reportado como una evidencia de la influencia de las SRB. Las cuales al encontrarse en continua exposición con Mackinawita la altera a Greigita (Fe3S4), Esmitita (Fe9S11) y finalmente a Pirrotita (Fe7S8) [22, 25-26].
Las SRB pueden producir Pirita, aunque no es un producto de corrosión típico, puede ser formado desde la Makinawita en contacto con azufre elemental, tal como lo demuestra Lee [26], en sus investigaciones sobre productos de corrosión por bacterias, indica que la Pirita se forma por las reacciones de oxidación del H2S generado ante bajos niveles de oxígeno (1,8 mg/L), donde las reacciones cinéticas son más favorables a la formación de oxido y en consecuencia este reacciona con el H2S, tal como lo describen las reacciones (2-4):
3H2S + 2FeO(OH) + S° + 4H2O. (2)
Los iones polisulfuros, Sx=, pueden ser formados a través de la interacción de azufre elemental y sulfuro disuelto así [26]:
HS- + (x-1)S ® H+ + Sx-2. (3)
De la reacción (6) Sx-2 es un polisulfuro con x =2-5, estos son altamente reactivos y pueden combinarse con iones ferrosos formando Pirita, a temperatura ambiente, según (4):
Fe+2 + S4S–2 + HS– ? FeS2 + S3S–2 + H+. (4)
Todos los productos FexSy son catódicos con respecto al metal base, donde las características de adherencia del mismo variaran según sea el producto generado ante la cinética promovida localmente, donde la exposición del material desnudo en las zonas porosas forma micro-ánodos que aceleran el proceso corrosivo localmente [3, 22, 28].
Actualmente existen diferentes planteamientos hipotéticos en discusión abierta, sobre la intensificación de corrosión por H2S biogénico, donde algunos investigadores soportan la tesis sobre la acción catalítica del hidrosulfuro y iones sulfuro [21]. Otro postulado es la influencia de los bioprecipitados de sulfuro sobre el substrato metálico, los cuales sirven como aceptores de electrones a las reacciones catódicas en los sistemas anaerobios, dependiendo el efecto corrosivo más de los productos que de la actividad de la actividad bacteriana [22, 24].
Adicionalmente a los problemas corrosivos descritos anteriormente, las SRB han sido estudiadas por su influencia a la corrosión bajo tensión en presencia de sulfuro (SSCC: "Sulfide Stress Corrosion Cracking") el cual se desarrolla en los aceros de alta resistencia o en zonas donde estén presentes altos esfuerzos residuales y fragilización por hidrógeno (HIC: "Hydrogen Induced Cracking") el cual es el resultado de la permeación del hidrógeno generado catódicamente en la matriz del acero. Los átomos de hidrógeno producidos sobre la superficie del acero producto de la reacción catódica, pueden combinarse según reacciones (5-7) a gas inocuo (H2), donde en la presencia de sulfuro la recombinación es afectada, por lo que los átomos de hidrógeno difunden hacia el acero y/o se recombinan formando H2(g) [4, 23].
Reacción neta
2H+ + 2e– ® H2 . (7)
Ante todo lo planteado anteriormente, también se agregan los problemas de seguridad del ambiente y de operarios, debido a la toxicidad del H2S, tema preocupante que ha obligado en algunos casos a cerrar pozos, afectando severamente los compromisos adquiridos por producción [18, 28]. Situaciones que exige seguir haciendo muchos esfuerzos por entender la generación del sulfuro para un adecuado control. Inquietud ésta, expresada igualmente por Lie y col. (1999) ante el desarrollo de diversos controles exclusivos a un solo origen biogénico como es el caso de producto que inhiben la desasimilación del sulfato y obvian cualquier otra fuente de H2S [29].
Hasta los momentos las SRB han sido las protagonistas en los estudios de la MIC; sin embargo, la producción de H2S y en si la MIC no sólo se deriva de las SRB [29, 30], sino que éstas son parte de un proceso complejo dada la diversidad microbiana, capaces de generar sulfuro biogénico y otros metabolitos agresivos al material expuesto. Es por ello resaltante, hoy en día considerar la problemática de H2S como un problema más allá de la desasimilación del sulfato [10, 31], siendo necesario evaluar las interrelaciones bacterianas y los productos de estos con el sustrato metálico según las condiciones de desarrollo.
Sulfuro Biogénico
El H2S es un producto biogeoquímico, generado en diversos ambientes como estuarios naturales y sistemas industriales, este producto no solo reacciona con el hierro u otros metales de los materiales y el disuelto en las soluciones acuosas, sino que también puede reaccionar con los compuestos celulares que lo contienen [14, 30].
La interface metal-H2S-H2O es un sistema altamente complejo, lo cual se complica aun más cuando es promovida bioorgánicamente y sin la cual bajo condiciones iguales de equilibrio puede dar una amplia variedad de formación de compuestos. Donde la concentración del H2S depende de la acidez del medio, según se reporta en la Tabla 3 [21].
El ciclo biogeoquímico del azufre también resulta complejo (Figura 1), debido a los diferentes estados de oxidación en que puede estar dicho elemento y el hecho de que algunas transformaciones proceden tanto de vías orgánicas como inorgánicas [14].
Producción de sulfuros por compuestos órgano azufrados
Los compuestos orgánicos pueden ser aceptores en procesos de respiración anaeróbica, siendo parte del proceso metabólico y después reducido internamente, esto es indicado en el ciclo del azufre donde el H2S es producto del metabolismo de compuestos órgano azufrados como las proteínas (Proteólisis o desulfurilación), esquematizado en la siguiente reacción [32]:
Proteína ® aminoácidos ® CO2 + NH4 +aminas + H2S + H2O + RCOOH´s. (8)
La descomposición de compuestos órgano azufrados representa una fuente significativa de sulfuros a los ecosistemas de agua dulce. Muchas bacterias descomponedoras pueden liberar H2S de la oxidación de aminoácidos que contienen azufre [14]. De hecho, todos los organismos contienen aproximadamente 1% (10.000 mg/L) de azufre en proteínas, donde la metionina, na y cisteína son ejemplos de aminoácidos que contienen azufre, todas las células contienen estos aminoácidos y son descompuestos cuando los organismos mueren; el H2S es perceptible a concentraciones tan bajas como 0,2 mg/L [4].
Diferentes investigadores han reportado un grupo bacteriano de aguas de inyección de la industria petrolífera, capaces de producir H2S y ácidos orgánicos de péptidos, como fuentes de carbono y fuentes de energía [17, 31]; algunos grupos bacterianos con estos metabolismos (Escherichia coli, Clostridiums y Bacteroides) fueron aislados e identificados, de aguas de inyección para recuperación secundaria de crudo en el Occidente Venezolano [10], siendo importantes en los procesos corrosivos, dado que los péptidos son un substrato común en las biopelículas [17]. Cabe recordar que la biopelícula es la interfase bioorgánica precursora de los severos procesos corrosivos localizados [6, 24].
Por otra parte, se han descrito varios géneros de arqueobacterias y eubacterias quimioorganotróficas con capacidad de oxidar sustratos orgánicos anaeróbicamente (principalmente péptidos pequeños, glucosa y almidón), utilizándolos como aceptor final de electrones. En arqueobacterias este proceso de respiración se observa mayormente en los géneros Thermococcus y Thermoproteus y en menor grado en los géneros Desulfurococcus, Thermophilum y Pyrococcus, entre otros. Las arqueobacterias quimiolitotróficas demuestran la capacidad de crecer autotróficamente a expensas de CO2, H2 y S. Este grupo lo integran arqueobacterias de los géneros Acidians, Pyrodictium y Thermoproteus [12-14].
En el grupo de las Eubacterias, la respiración anaerobia de azufre es llevada a cabo por bacterias pertenecientes a los géneros: Desulfuromonas, Desulfurella y Campylobacter. Estas bacterias acoplan la oxidación de substratos tales como acetato y etanol a la reducción del azufre elemental a sulfuro de hidrógeno. La capacidad para reducir azufre elemental se extiende también a bacterias aerobias facultativas quimiorganotróficas pertenecientes a los géneros Proteus, Pseudomonas y Salmonella [14]. Un ejemplo de anaerobias facultativas productoras de H2S es Shewanella y de anaerobiasWollinella y Desulfuromonas [25]. Estas bacterias también exhiben la capacidad de reducir compuestos sulfurados tales como tiosulfato, sulfito y dimetilsulfóxido (DMSO) [14]. Recientes investigaciones han reportado que Escherichia coli contiene una enzima capaz de catabolizar la D-cisteina a piruvato, H2S y NH3. Actividad similar fue detectada en Citrobacter freundii, Klebsiella pneumoniae, Enterobacter cloacae, Chlorella fusca, Spinacia oleracea y varias Fusobacterium sp. [35].
Además de los aminoácidos, vitaminas y cofactores que contienen azufre, el dimetilsulfuro (H3C-S-CH3) es el organosulfurado más abundante en la naturaleza, el cual es producido por diversos microorganismos en ambientes anóxicos y puede ser utilizado como [14]:
– Substrato para la metanogénesis y sulfidogenesis (CH4 y H2S).
– Donante de electrones para la reducción de CO2 en la fotosíntesis en bacterias púrpuras (produciendo dimetil sulfóxido, DMSO).
– Donante de electrones en trayectos catabólicos que generan energía (produciendo DMSO, el cual puede a su vez servir como aceptor de electrones de respiración anaerobia, generándose el dimetilsulfuro nuevamente, por diversos grupos bacterianos como Campylobacter, Escherichia y muchas bacterias púrpura).
En la naturaleza, se producen otros organosulfurados que forman parte del ciclo del azufre son: metaniotiol (CH3SH), disulfuro de carbono (CS2) y organosulfurados aromáticos (ej. tiofenos y tianaftenos, presentes en combustibles fósiles). En términos cuantitativos, la producción y consumo del H3C-S-CH3 se considera como la más significativa y la de mayor impacto ecológico. No obstante, el impacto de los órganosulfurados aromáticos en el ciclo de azufre se acentúa en la medida que incrementa la quema de combustibles fósiles [14].
Es importante destacar, que la capacidad enzimática de diversos microorganismos por romper enlaces de C-S de los compuestos organosulfurados, están siendo estudiadas, no solamente por los efectos corrosivos que algunas generan con la producción de H2S, sino que también por la utilidad de aplicar estos metabolismos en beneficio del desarrollo biotecnológico que permitan generar mecanismos de biodesulfuración controlados en la industria petrolera [33, 34].
En términos generales hay mucho que evaluar aún de estos grupos bacterianos y su participación en la corrosión (MIC) y su impacto en la industria.
Producción de sulfuros a través de compuestos inorgánicos
Los compuestos inorgánicos capaces de ser metabolizados a H2S existen en varios estados de oxidación desde +6 a –2, dados en la Tabla 4; entre los cuales, el sulfato está ampliamente presente en medios acuáticos, donde el más grande reservorio es el mar [5, 14].
Recientemente se han descrito la capacidad de diferentes bacterias anaerobias para desasimilar sulfonatos (Sulfidogénesis) con la producción resultante de H2S, siendo el sulfonato el aceptor terminal de electrones, en el caso de las SRB se describen como única fuente de carbono y energía. Laue (1997) reportó que Bilophila wadswarthia utilizó un número de sulfonatos alifáticos como aceptor final para su desarrollo, adicionalmente al sulfito y tiosulfato, pero no metaboliza sulfato. Lie (1999) encontró que algunos miembros del genero Desulfitobacterium utilizaban sulfonatos alifáticos como aceptores final de electrones [29], demostrando así otras vías metabólicas productoras de H2S diferentes a SRB.
Tal como se observa en la Tabla 4, el azufre existe en varios estados de oxidación, sólo los compuestos con número de oxidación –2, 0 y +6 se encuentran en cantidades significativas en la naturaleza. Por ser el SO4= uno de los principales constituyentes de azufre inorgánico [25], se ha evidenciado la presencia de las SRB en los ambientes anóxicos asociados a los procesos corrosivos [2-3], por lo cual ha sido uno de los grupos más estudiados en la MIC.
Bacterias reductoras de sulfato (SRB)
La producción de H2S desde sulfato fue reconocida en 1864 por Meyer [31]. Las SRB se encuentran ampliamente distribuidas en ambientes naturales, siendo éstas estrictamente anaeróbicas [36]. Su desarrollo cumple un amplio espectro de condiciones ambientales, se han conseguido en aguas residuales, procesos de recuperación secundaria, plantas nucleares, entre otras, asociadas a una diversidad de materiales expuestos en estos ambientes [31]. El H2S frecuentemente es asumido como producto de la reducción de sulfato; no obstante, se han reportado especies SRB capaces de utilizar tiosulfato y/o sulfito como aceptores finales de electrones [17, 25, 36, 37].
Las SRB son todas heterotróficas y principalmente mesofilicas, metabolizan compuestos orgánicos de cadena simple como fuentes de carbono [38]. La reacción (9) es un ejemplo típico, donde del lactato es una fuente de carbono simple, empleada en los laboratorios [14, 16]:
2CH3CHOHCOO– + SO4–2 ® 2CH3COO– + 2CO2 + 2H2O+ S–2. (9)
El análisis de secuencias de ADNr ha permitido organizar los géneros de SRB en 4 grupos diferentes: Gram-negativa mesofílica, Gram positiva formadora de esporas, Termofílicas y Archaeal termofílica (Tabla 5); todos estos grupos son caracterizados por el uso de sulfato como aceptor final de electrones, la reducción de sulfato queda restringida a este grupo filogenético, exclusividad que hoy en día es una incertidumbre para los investigadores [39].
En los últimos años se han desarrollando diversos controles de la MIC con compuestos específicos que afectan el mecanismo de inhibición de la desasimilación del sulfato, para ello se ha promovido la inclusión de sales de molibdato y de tungsteno, y más recientemente derivados de antraquinona [26, 40]. No obstante, estos controles tan específicos para las SRB siguen siendo insuficientes para el control de la MIC, pues omiten otros mecanismos de respiración anaerobia y formación de sulfuros por otros grupos bacterianos, tal como la reducción del tiosulfato, además de los otros grupos descritos anteriormente.
Bacterias reductoras de tiosulfato
El tiosulfato está naturalmente abundante en los ecosistemas donde el H2S y el O2 entran en contacto como los sistemas industriales y tuberías de transporte petrolífero, entre otros. La reducción de tiosulfato a H2S ha sido comprobada en Bacterias anaerobias-facultativas como Shewanella o anaerobias como Wollinella y Desulfuromonas [41, 37]. Así mismo, grupos no identificados aislados de aguas de recuperación de crudo fueron clasificados como reductoras de tiosulfato (S2O3–) y no de sulfato, generadoras de sulfuro [25]. Otras consideraciones evaluadas en MIC reportadas por Magot [17] fue la reoxidación del H2S en tiosulfato o el reciclo del S2O3. Crolet [31] indicó la presencia de 30 ppb de oxigeno en líneas de aguas para sistemas de producción de crudo, las cuales contenían H2S, cuya trasformación inmediata era la formación de tiosulfato así:
2H2S + 2O2 ® S2O3= +`H2O + 2H+. (10)
El tiosulfato esta involucrado en los metabolismos de diferentes grupos productores de H2S no reductores de sulfato fermentativos, anaerobios y algunas especies SRB. Crolet [31] reportó efectos más corrosivos cuando se utilizaba tiosulfato como aceptor de electrones en lugar de sulfato, por lo cual propuso considerar otras reacciones agresivas diferentes a la desasimilación del sulfato, es decir considerar la producción del H2S por los diversos grupos potencialmente corrosivos presentes en la biopelícula [6, 27].
Conclusiones
Los procesos biogénicos productores de H2S se encuentran en la industria petrolera, dada la existencia de una diversidad de microorganismos capaces de metabolizar compuestos azufrados, tantos orgánicos como inorgánicos, además de encontrarse de forma natural en las diferentes fuentes de agua utilizadas en la recuperación de crudo. Además, las condiciones extremas de los sistemas productores, igualmente permiten el desarrollo de grupos específicos termofilicos e hipertermofilicos capaces de producir H2S.
Es necesario resaltar, que el tratamiento anticorrosivo, contribuye a disminuir áreas de fácil asentamiento y desarrollo bacteriano que desencadenen procesos de ataques localizados más severos en el tiempo, debido a la formación de poli sulfuros y/o áreas catódicas también promovidas por los productos de las reacciones químicas con los iones ferrosos del sistema en deterioro.
Referencias Bibliográficas
1. Prassod R. Corrosion´2000. Assessment and control of MIC in the oil industry in the 20th century. Paper 0390 (2000).
2. Beech, I., Sunner J., Hiraoka K. International Microbiology, Vol 8 (5), pp. 157-168 (2005).
3. Videla H., Herrera L. Microbiologically influenced corrosion: looking to the future. International Microbiology Vol. 8, pp. 169-180 (2005).
4. Nemati M., Voordouw G. Identification and Characterization of SRB involved in microbially influenced corrosion in oil fields. Corrosion´2000. Paper 126 (2000).
5. Winston R. Revie. Uhlig´s Corrosion Handbook. 2da. Edition. (Electrochemical Society Series, John Wiley & Sons, INC, pp 482-483, 2000).
6. Keresztes Z., Felhösi, Kálmán E. Role of redox properties of biofilms in corrosion processes. Electrochimica Acta 46, pp. 3841-3849 (2001).
7. Kane R.D., Surinach P. A Field study of microbiological growth and reservoir souring. Paper. 208. CORROSION´97. (1997).
8. Farqunar G.B. Review and update of technology related to formation souring. CORROSION ´97. Paper.210. (1997).
9. Paris de Ferrer M. Inyección de agua y gas en yacimientos petrolíferos. 2da edición. (Ediciones AstroData, pp. 29, 2001)
10. Duque Z. Diferenciación corrosiva de bacterias heterótrofas productoras de H2S reductoras y no de sulfato, aisladas de aguas de inyección. Universidad Politécnica de Madrid. Sección de publicaciones E.T.S.I.I. de Madrid. España. ISBN: 84-688-4214-1. (Tesis doctoral). 2003.
11. Worden R.H., Smalley P., Barclay S.A. H2S and diagenetic pyrite in North Sea sandstones: due to TSR or organic sulphur compound cracking? Journal of Geochemical Exploration. 78-79, pp.487-491 (2003).
12. Lappin-Scott H.M., Bass C.J., Mc Alpine K., Sanders P. Survival mechanisms of hydrogen sulphide-producing bacteria isolated from extreme environments and their role in corrosion. Int. Biodeterioration & Biodegradation, Vol 34, 3-4, pp.305-319 (1994).
13. Sand W. Microbial life geothermal waters. Geothermics. 32, pp.655-667 (2003).
14. Madigan M., Martinko J., Parker J. Brock Biología de los microorganismos. 10a edición Brock. Pearson Prentice hall. España 2003.
15. Asvencor. Revista Corrosion. Edición especial 2001-2004.
16. Romero de M., Duque Z., Rodríguez L., Rincón de O., Pérez O., Araujo I. A Study of Microbiologically Induced Corrosion by Sulfate-Reducing Bacteria on Carbon Steel Using Hydrogen Permeation. Corrosion. Vol. 61, 1 pp. 68-75 (2005).
17. Magot M., Carreaul L., Cayol J.-L, Ollivier B., -Crolet J.-L. Sulphide-Producing, not Sulphate-Reducing Anaerobic Bacteria Presumptively involved in bacterial corrosion. Proceedings of the 3rd International EFC worksop on Microbial Corrosion. The Institute of Materials. London. pp.294-299, 1994.
18. García Y. Recopilación de Información para la Caracterización del agua de formación del campo Tía Juana. Informe de Pasantías en la UE-TEP. LUZ, Venezuela (2005).
19. Larrazabal M. Optimización del Sistema de tratamiento de agua para la generación de vapor de la Planta de vapor E4 UE-TEP- PDVSA. URU, Venezuela. (Trabajo de grado), 2005.
20. Hongfu F., Yongjian L., Liying Z., Xiaofei Z. The study on composition changes of heavy oils during steam stimulation processes. Fuel, 81, pp.1733-1738 (2002).
21. Gerus B.R.D. Detection and mitigation of weight loss corrosion in sour gas gathering systems. H2S Corrosion in oil & gas production a compilation of classic papers. Part II. Co-editors: R.N. Tuttle and R.D. Kane (NACE, 1994).
22. Fernández M. Estudio mecanístico de la acción de la BSR en la corrosión del acero al carbono utilizando permeación de hidrógeno y polarización catódica. ULA (Tesis doctoral). Venezuela. 2003.
23. Her-Hsiumg H., Ju-Tung L.,Wen-Ta T. Effect of H2S on the electrochemical behaviour of steel weld in acidic chloride solutions. Materials Chem. and Physics, 58, pp.177-181 (1999).
24. Beech I.B., Sunner J. Biocorrosion: towards understand interactions between biofilms and metals. Current Opinion in Biotechnology, 15, pp. 181-186 (2004).
25. Little B., Ray R., Pope R. The relationship between corrosion and the biological sulphur cycle. Corrosion, vol. 56, No. 4, pp. 433, 2000.
26. Lee W., Lewandoski Z., Morrison M., Characlis W., AVCI R., Nielsen P. H. Corrosion of mil steel underweath aerobic biofilms containing sulphate-reducing bacteria. Part II. AT high dissolved oxygen concentration. Biofouling, vol. 7, pp.217-239 (1993).
27. Marchal R., Chaussepied B., Warzywoda M. Effect of ferrous ion availability on growth of a corroding sulfate-reducing bacterium. International Biodeterioration & Biodegradation 47, pp. 125-131 (2001).
28. Starosvetsky D., Armon R., Yahalom J., Starosvetsky J. Pitting corrosion of carbon steel caused by iron bacteria. International Biodeterioration & Biodegradation 47, pp. 79-87 (2001).
29. Mosquera A. Generación de sulfuro de hidrogeno en los pozos estimulados con vapor en la Unidad de Explotacion Bachaquero Lago, (Tesis de Ingeniería), LUZ, 2005.
30. Lie T., Godchaux W., Leadsetter E. Sulfonates as Terminal electron acceptors for growth of Sulphite-Reducing Bacteria: Effects of Inhibidors of Sulfidogenesis. Applied and Environmental Microbiology., vol. 65, No.10. pp. 4611-4617 (1999).
31. Crolet J.L, Magot M.F. Observations of non SRB Sulfidogenesis bacteria from oilfield production facilities. CORROSION´95, Paper 188 (1995).
32. Soutourina J., Blanquet S., Plateau P. Role of D-Cysteine Desulfhydrase in the adaptation of Escherichia coli to D-Cysteine. The Journal of Biological Chemistry, Vol 276, 44, Issue of November 2, pp. 40864.(2001).
33. Le Borgne S., Quintero R. Review: Biotechnological processes for the refining of petroleum. Fuel Processing Technology, 81, pp. 155-169 (2003).
34. Olmo C., Santos V., Alcon A., García-Ochoa F. Production of a Rhodococcus erythropolis IGTS8 biocatalyst for DBT biodesulfurization: infuence of operacional conditions. Biochemical Engineering Journal 22, pp.229-237 (2005).
35. Rubio C., Ott Ch., Amiel C., Dupont-Moral I., Travert J., Mariey L. Sulfatp/thiosulfato reducing bacteria characterization by FT-IR spectroscopy: A new approach to biocorrosion control. Journal of Microbiological Methods.Vol 64, 3, pp. 287-296 (2006).
36. Matias P., Pereira I., Soares C., Carrondo M., Review: Sulphate respiration from hydrogen in Desulfovibrio bacteria: a structural biolgy overview. Biophysics & Molecular Biology, 89, pp. 292-329 (2005).
37. Castro H.F.,Williams N.H., Ogram A. Phylogeny of Sulfate-reducing bacteria. FEMS Microbiology Ecology. 31.p.1-9. (2000).
38. Burger E. D. Mechanisms of Antraquinone Inhibition of Sulfate-Reducing Bacteria. SPE International 50764. P.597. (1999).
39. Mellor J. Characterization of thiosulfate reducing bacteria. Final Year Report. University of Portsmouth Microbiology Research Group Student. (2000).