Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Técnica de la Facultad de Ingeniería Universidad del Zulia
versión impresa ISSN 0254-0770
Rev. Téc. Ing. Univ. Zulia v.31 n.Especial Maracaibo dic. 2008
Continue production of single cell protein of Kluyveromyces marxianus var. marxianus
from diluited cheese whey
Glorymar Buitrago, Laura Soto, Gisela Páez, Karelen Araujo,
Zulay Mármol y Marisela Rincón
Escuela de Ingeniería Química, Laboratorios de Tecnología de Alimentos y Fermentaciones Industriales, Facultad de Ingeniería, Universidad del Zulia, Apartado 526. Maracaibo 4001-A, Venezuela.
Telf: 0261-7598746, Fax: 0261-7598800. gpaezr@gmail.com
Abstract
The continuous culture of the nutritious yeast Kluyveromyces marxianus var. marxianus ATCC 8554 was studied on deproteinized and supplemented whey as a function of the dilution rate (D), at pH 5,0 and temperature 30°C. A Bioreactor Bioflo 4000 was used, with a work volume of 3 liters. The dilution rate was changed between 0,10; 0,15; 0,20; 0,25 y 0,30 h–1. Whey was characterized, assessing its contents of nitrogen, lactose, phosphorus, protein, dampness, ash, and pH. Analyses were made in triplicate at lactose concentration of 2,0 ± 0,42%. The maximum specific growth rate (µmáx = 0,44 h–1), saturation constant (KS = 8,55 kg/m3h), maintenance coefficient (m = 0,25 kg lactose/ kg biomass h) and the growth yield (YC = 0,50 kg biomass/ kg lactose) were determined from continuous culture, Monod model was used. The maximum production of biomass in continuous culture was 4,0 kg/ m 3 at a dilution rate of 0,15 h–1 and the maximum productivity was 0,79 kg/ m3 h at a dilution rate of 0,20 h–1. Results from this study proved that can be obtained biomass of K. marxianus var. marxianus to low concentrations of substrate, which contribuyes the possibility of establishing a process of the single cell protein and subsequent assessments as protein concentrates.
Key words:
Whey, Kluyveromyces marxianus, continuous culture, dilution rate, productivity.
Producción continua de proteína unicelular de Kluyveromyces marxianus var. marxianus a partir de lactosuero diluido
Resumen
Se estudió la producción en cultivo continuo de Kluyveromyces marxianus var. marxianus ATCC 8554 en lactosuero desproteinizado y suplementado en función de la tasa de dilución (D), a pH 5,0 y temperatura de 30°C. Se empleó un Bioreactor marca New Brunswick Scientific modelo Bioflo 4000 con un volumen de trabajo de 3 litros. Las tasas de dilución fueron 0,10; 0,15; 0,20; 0,25 y 0,30 h–1. El lactosuero se caracterizó en términos de nitrógeno, lactosa, fósforo, proteínas, humedad, cenizas y pH. Los análisis se realizaron por triplicado a una concentración de lactosa de 2,00 ± 0,42%. En el cultivo continuo, se determinaron valores de la tasa específica de crecimiento máximo (µmáx = 0,44 h–1) según el modelo de Monod, constante específica de consumo de sustrato (KS = 8,55 m3/ kg x h), coeficiente de mantenimiento m = 0,25 kg lactosa/ kg biomasa x h) y rendimiento real (YC = 0,50 kg biomasa/ kg lactosa). La máxima producción de biomasa (4,0 kg/ m3) se obtuvo a una tasa de dilución de 0,15 h–1 y la máxima productividad (0,79 kg/ m3h) a una tasa de 0,20 h–1. Los resultados demostraron que puede obtenerse biomasa de la K. marxianus var. marxianus a bajas concentraciones de sustrato, lo que genera la posibilidad de establecer la producción continua de proteína unicelular como concentrado proteico.
Palabras clave:
Suero de leche, Kluyveromyces marxianus, cultivo continuo, tasa de dilución, productividad.
Introducción
La producción de aislados proteicos de microorganismos tiene como propósito la obtención de proteínas de alto valor nutricional con propiedades funcionales específicas para sustituir parcialmente las proteínas de cereales, soya, leche, huevos y de otras fuentes en la elaboración de helados, quesos, mayonesas, productos de panadería, entre otros [2], con la finalidad de combatir la desnutrición que actualmente representa uno de los problemas más graves a nivel mundial, debido a que fuentes convencionales provenientes de áreas como la agricultura, ganadería y pesca, no satisfacen completamente los requerimientos proteicos de la población [1].
En la producción de proteína unicelular para consumo humano y animal, se utilizan microorganismos como: Saccharomyces cerevisiae, Candida utilis, Fusarium graminearum y Kluyveromyces marxianus. Este último, es un microorganismo que fermenta rápidamente la lactosa, azúcar que constituye la parte esencial del extracto seco de los sueros [3], en una concentración de 4 a 5% p/v [4].
El suero de leche es de alto valor nutritivo, contiene además de lactosa, proteínas, elementos minerales, grasa, ácido láctico y agua. Estos componentes, hacen del lactosuero una materia prima para la obtención de productos con diversas aplicaciones en biotecnología [5] y [6], destacándose su uso como medio de cultivo para obtención de proteína unicelular [2]. Al utilizar el lactosuero como sustrato se evita su vertimiento en cuerpos de agua, disminuyendo el potencial contaminante del mismo, ya que este es considerado como el contaminante más abundante de la industria láctea [2].
La proteína unicelular puede obtenerse a partir de un bioproceso continuo, en el que se cultivan células en un sistema abierto hasta alcanzar el estado estacionario, lográndose una mayor productividad que en el bioproceso por carga [7]. Estudios realizados en cultivos por carga con diferentes concentraciones de lactosa [5] y [8], indican que se obtiene una mayor producción microbiana a bajas concentraciones de este azúcar. De allí el objetivo de esta investigación de evaluar la producción de proteína unicelular de K. marxianus var. marxianus a partir de lactosuero diluido en cultivo continuo.
Parte Experimental
Microorganismo
Se utilizó la levadura Kluyveromyces marxianus var. marxianus ATCC 8554. Esta fue obtenida de la American Type Culture Colection (ATCC), activada y mantenida en tubos de cultivo de 25 x150 mm, sobre YM Bacto Agar en forma de cuña.
Medio de cultivo
Se utilizó suero de leche ácido desnatado, proveniente de la producción de queso requesón, suministrado por la industria láctea PACOMELA ubicada vía Palito Blanco, Maracaibo, Estado Zulia.
Para la preparación del medio de cultivo se siguieron las siguientes etapas:
1. Tratamiento Termoácido: Etapa principal para precipitar toda la proteína contenida en el medio de cultivo. Para ello se calentó el suero de leche hasta 90°C ajustando pH a 4.5 utilizando HCl (concentrado) por 15 minutos aproximadamente para después dejar enfriar hasta una temperatura de 40°C y someterlo al proceso de prefiltrado, para garantizar una desproteinización eficiente.
2. Prefiltrado: Se utilizó tierra de diatomea (compuesto de sílice rosa calcinado) como medio filtrante para separar los grumos de caseína que precipitaron luego del tratamiento termoácido. Este período tuvo una duración de 5 horas aproximadamente.
3. Dilución: Se procedió a diluir el suero de leche con agua destilada, a una proporción de 1:1,2. Se utilizó un Refractómetro Bausch & Lomb para determinar el porcentaje de sólidos solubles, luego se midió y se ajustó la concentración de lactosa con el método de Dubois y Col [11], al 2,00%. Una vez obtenida la concentración deseada de éste azúcar se filtró empleando papel de filtro Whatman Nº 1 con embudo de porcelana y Tierra de Diatomea.
4. Suplementación: El suero de leche se suplementó con extracto de levadura al 0,75% p/v (Merck), sulfato de magnesio 0,05% (Fisher) y sulfato de amonio (Merck y Bian Chemical) al 0,84% p/v. Todos los reactivos químicos utilizados como suplemento fueron de grado analítico. El pH se ajustó a 5,0, con HCl 6 N y NaOH al 10%.
5. Esterilización: Se utilizó un autoclave Felisa FE-339 a 115°C y 24,6 psi durante 20 minutos.
Métodos de análisis
Nitrógeno. El contenido de nitrógeno se determinó por el método de Kjeldahl [9].
Proteínas. Se determinó como el porcentaje de nitrógeno multiplicado por el factor 6.25 para el caso de la levadura y por 6.38 para el caso del suero de leche [9].
Lactosa. Se determinó utilizando el método espectrocolorimétrico de Dubois y col. [10], a una longitud de onda de 490 nm.
Humedad. Se determinó siguiendo el método 16.192 de la A.O.A.C. [9].
Fósforo. Se determinó mediante el método espectrocolorimétrico del molibdovanadato de amonio 16.115 de la A.O.A.C. [9], a una longitud de onda a 440 nm.
Cenizas. Se determinó las cenizas por el método 16.196 de la A.O.A.C. [9].
Biomasa. Se determinó por medio de la densidad óptica obtenida a través del espectrofotómetro Cary 50 a una longitud de onda de 650 nm. Se relacionó la densidad óptica con el peso de biomasa por unidad de volumen a través de una curva de calibración (LDD: 0,51) construida previamente [5]; adicionalmente se calculó la velocidad específica de crecimiento (µ), el rendimiento (Y) y la constante de saturación de sustrato (Ks) para las condiciones establecidas [11].
Proceso de fermentación
Preparación del inóculo. Se preparó añadiendo a cada 100 ml de medio la suspensión de células obtenidas de una cuña de mantenimiento. Posteriormente el inóculo se incubó a 30°C y 200 r.p.m. durante 7 horas en una incubadora New Brunswick Scientific INNOVA 4300, para garantizar la fase logarítmica del crecimiento.
Bioprocesos. Se realizó un cultivo por carga a una temperatura de 30°C, 200 r.p.m., y pH de 5,00, por triplicado durante 14 horas. La mayor concentración de biomasa se obtuvo a las 7 horas considerándose éste como el tiempo de preparación del inóculo. El tamaño del inóculo se determinó con la cámara de Neubauer (New York, 11101) y con el método estándar de dilución en placa [12]. El cultivo continuo se realizó por triplicado a tasas de dilución 0,10; 0,15; 0,20; 0,25 y 0,30, iniciándose como un cultivo por carga en un fermentador New Brunswick Scientific, modelo Bioflo 4000 (New Jersey, USA). La temperatura y la agitación se mantuvieron constantes y el pH se controló automáticamente con soluciones de HCl 6 N y NaOH al 10%. Se utilizó un volumen de trabajo de 3 litros con un inóculo del 10%. En la etapa inicial del bioproceso se realizaron mediciones analíticas horarias durante 7 horas. En el cultivo continuo, se evaluaron durante hora y media antes y después de alcanzar el estado estacionario (todos los parámetros antes mencionados), en intervalos de media hora.
Resultados y Discusión
La caracterización del suero de leche fresco, desproteinizado y diluido se muestra en la Tabla 1. Los valores de pH obtenidos (5,43 ± 0,09) indican que se utilizó un suero ácido [13].
La concentración de lactosa, 5,00%, así como la concentración de cenizas (2,3 ± 0,1%) y algunas trazas de sales se corresponden con los valores característicos reportados por Gonzaléz [14] para este tipo de suero. El contenido de proteínas del suero fresco disminuyó un 38% al desproteinizarlo, indicando la eficiencia del proceso de desproteinización empleada.
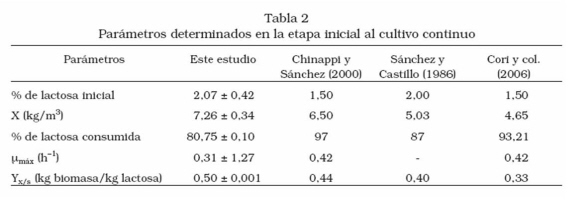
En la Figura 1 se muestra la cinética de crecimiento de la levadura Kluyveromyces marxianus var. marxianus y el consumo de sustrato promedio a 30°C, pH 5,0 y 200 rpm. La concentración de biomasa y de sustrato corresponden a los valores promedios obtenidos durante las primeras 7 horas, etapa inicial del cultivo continuo, a las diferentes tasas de dilución empleadas. El crecimiento del microorganismo estuvo caracterizado por una fase exponencial de 6 horas, obteniéndose la máxima concentración de biomasa en la hora 7, (7,26 ± 0,34) con un rendimiento de 0,50 ± 0,001.
Figura 1. Cinética del crecimiento y consumo de sustrato utilizando suero diluido a pH 5,00 a
temperatura de 30°C y 200 r.p.m. en la etapa inicial del cultivo continuo.
Los parámetros de crecimiento: Xmáx, µmáx, Yx/s,% de lactosa consumida, se muestran en la Tabla 2 y se comparan con los resultados reportados por Chinappi y Sánchez [5], Cori y col. [8] y Sánchez y Castillo [15]. El porcentaje de lactosa consumida (80,75 ± 0,100) fue menor, así como la máxima velocidad específica de crecimiento (0,31 ± 1,27), mientras que el rendimiento en biomasa fue mayor (0,50). Este comportamiento podría explicarse a las diferencias en las condiciones de operación del cultivo y del tipo de microorganismo utilizados.
El valor promedio de la velocidad específica de crecimiento obtenido sirvió para establecer las tasas de dilución (D) empleadas en el cultivo continuo (0,10; 0,15; 0,20; 0,25 y 0,30 h–1).
El efecto de la tasa de dilución sobre la concentración de biomasa, concentración de lactosa y productividad en el estado estacionario se muestra en la Figura 2. La concentración de biomasa disminuyó a medida que aumentó la tasa de dilución, manteniéndose constante entre 0,10 h–1 y 0,20 h–1, a partir de esta última el cultivo en el bioreactor se encontró en condiciones de lavado. El comportamiento del microorganismo se ajustó al modelo de Monod, así mismo se calcularon valores de µmáx y Ks.
Figura 2. Efecto de la tasa de dilución en la producción de biomasa de Kluyveromyces marxianus var.
marxianus ATCC 8554, productividad y consumo de sustrato en suero diluido a temperatura de 30°C,
200 r.p.m. y pH 5,0.
Figura 3. Cálculo del coeficiente de rendimiento y mantenimiento celular.
Conclusiones
A baja concentración de lactosa (2%) y a una tasa de dilución de 0,15 h–1, se obtuvo la mayor producción de biomasa (4,00 kg/m3), mientras que la mayor productividad (0,79 kg/m3h) se alcanzó a 0,20 h–1, por lo que se define como tasa de dilución óptima. La velocidad específica de crecimiento, µmáx fue de 0,44 h–1 con rendimiento real, (Yx/s)C de 0,50 kg biomasa/kg de lactosa utilizada y un coeficiente de mantenimiento celular, ms igual a 0,25 kg lactosa/ kg biomasa x h. El lavado del cultivo del bioreactor se produjo a una tasa mayor de 0,20 h–1, mientras que el crecimiento microbiano durante las tasas de dilución entre 0,10 y 0,20 h–1 se mantuvo estable.
Se obtuvo una máxima producción microbiana de 7,26 kg/m3, el tiempo de inoculación fue de 7 horas a partir del cual comenzó el cultivo continuo, con un consumo de sustrato de 80,75%.
Los resultados demuestran que se puede obtener biomasa de K. marxianus var. marxianus a bajas concentraciones de lactosa, con rendimiento del 50%, lo que genera la posibilidad de establecer un sistema de producción continua de proteína unicelular para su uso como concentrado proteico.
Agradecimiento
Los autores agradecen al Consejo de Desarrollo Científico y Humanístico (CONDES) por el financiamiento a esta investigación y al personal de los Laboratorios de Tecnología de Alimentos y Fermentaciones Industriales.
Referencias Bibliográficas
1. Quintero R. R.: “Ingeniería Bioquímica. Teoría y Aplicaciones”. Alambra Mexicana, 1988. [ Links ]
2. García G., Quintero R. y López M.: “Biotecnología Alimentaria”, Limusa Noriega Editores. Primera Edición, 1993.
3. Robinson R.: “Microbiología Lactológica”, Editorial Acribia, S. A., Zaragoza España, 1987.
4. Alais Ch.: “Ciencia de la leche”, Principios de Técnicas lechera, Quinta Impresión, 1988.
5. Chinappi I. y Sánchez J.: “Producción de biomasa de Kluyveromyces fragilis en suero de leche desproteinizado”. Acta Científica Venezolana, Vol 51, (2000), 223-230.
6. Quintero H., Rodríguez M., Páez G., Mármol Z. y Rincón M.: “Producción de Proteína Unicelular (Kluyveromyces fragilis) a partir del Suero de Leche”. Revista Científica, FCV- LUZ Vol. 9, Nº 2, (2001) 87-94.
7. Scragg A.: “Biotecnología para ingenieros.” Sistemas biológicos en procesos tecnológicos. Editorial Limusa, México, 1996.
8. Cori M., Rivas N., Dorta B., Pacheco E. y Bertsch A.: “Obtención y caracterización de dos concentrados proteicos a partir de biomasa de Kluyveromyces marxianus var. marxianus cultivada en suero lácteo desproteinizado" Revista Científica, FCV- LUZ Vol. 16, Nº 3, (2006) 315-324.
9. AOAC.: “Oficial Method of Análisis”, Asociation of Official Analytical Chemists. Arlington, Virginia, Edition 15th, 1990.
10. Pirt S.: ”Principles of microbe and cell cultivation”. New York EEUU, Blackwell Scientific Publication, Primera Edición, 1975.
11. Dubois M., Gilles K., Hamilton J., Rebers P. y Smith F.: “Colorimetric method for determination of sugars and related substances”, Analitical Chemestry, Vol. 28, N º 3, (1956), 350-356.
12. Brock T., Madigan M, Martinko P. y M. John.: “Biología de los Microorganismos”. Octava de Edición. Prentice Hall, 1998.
13. Badui D.: “Química de los alimentos”. Longman de México Editores, S.A. de C. V, 1999.
14. González S.: “The biotechnological utilization of cheese whey: a review”. Bioresearch Tecnology. 1996.
15. Sánchez S. y Castillo F.: “Efect of pH on the growth of Kluyveromyces fragilis on desproteinized whey”. Acta Cientifica Venezolana Vol. 31, (1986), 24-26.
16. Montiel X., Carruyo I., Marcano J., Mármol Z. y Páez G.: ”Producción de b- D galactosidasa por Kluyveromyces marxianus var. marxianus en cultivo por carga con lactosuero como sustrato”. Rev. Téc. Ing. Univ. Zulia. Vol. 23, Nº 2, (2000), 134-140.
Recibido el 30 de Junio de 2007
En forma revisada el 31 de Julio de 2008















_128.JPG)

.JPG)
