Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Latinoamericana de Metalurgia y Materiales
versión impresa ISSN 0255-6952
Rev. LatinAm. Met. Mat. v.26 n.1-2 Caracas ene. 2006
Nanopartículas de SnO2 Obtenidas por el Método de Precipitación Controlada
Alejandra Montenegro Hernández 1*, Miriam S. Castro 2, Jorge E. Rodríguez-Páez 1
1: Grupo de Ciencia y Tecnología de Materiales Cerámicos (CYTEMAC), Universidad del Cauca.
Calle 5 N° 4-70 Popayán, Cauca, Colombia.
2: Instituto de Investigación en Ciencia y Tecnología de Materiales (INTEMA, CONICET-UNMdP). Av. Juan B. Justo 4302, B7608FDQ, Mar del Plata, Argentina
* E-mail:amontenegro@unicauca.edu.co
Publicado On-Line: 11-Dic-2006
Disponible en: www.polimeros.labb.usb.ve/RLMM/home.html
Resumen
El óxido de estaño, SnO2, es un compuesto utilizado en muchas aplicaciones tecnológicas entre ellas como sensor de gas y en la fabricación de desviadores de sobretensiones, varistores, entre otros. En el presente trabajo se utilizó el método de precipitación controlada, MPC, para sintetizar óxido de estaño de tamaño nanométrico empleando como precursor sulfato de estaño. El control de las diferentes etapas del proceso de síntesis se realizó a través de los registros de variación de pH, valoración potenciométrica, y de la conductividad específica y valoración conductimétrica del sistema. Estas curvas contienen información sobre los diferentes procesos que ocurren en el sistema y se pueden utilizar para garantizar la reproducibilidad del proceso. Las características del polvo cerámico obtenido se determinaron utilizando difracción de rayos X (DRX), espectroscopia infrarroja (FTIR), y Microscopía Electrónica de Transmisión (MET).
Palabras Claves: Síntesis; SnO2; Precipitación controlada; Nanopartículas; Valoración potenciométrica
Abstract
Tin oxide, SnO2, is a compound used in many technological applications among them as gas sensor and in the production of diverters surges, varistors, among others. In the present work the controlled precipitation method, MPC, was used to synthesize tin oxide, using tin sulfate as precursor. The control of the different stages of the synthesis process was carried out through the registrations of pH variation, potentiometric titration, and specific conductivity of the system. These curves contain information on the different processes that taking place in the system and they can be used to guarantee the reproducibility of the process. The characteristics of the obtained ceramic powder were determined using X rays diffraction (XRD), infrared spectroscopy (FTIR), and transmission electron microscopy (TEM).
Keywords: Synthesis; Tin oxide; Controlled precipitation; Nanoparticles; Potentiometric valuation.
Recibido: 18-Sep-2006; Revisado: 15-Nov-2006; Aceptado: 20-Nov-2006
1. INTRODUCCIÓN
El óxido de estaño, SnO2, es un material semiconductor transparente con gran estabilidad química y mecánica. El óxido tiene una fase estable que presenta una estructura cristalina tetragonal, tipo rutilo, conocida como casiterita. El calor de formación de esta estructura es de 1,9 x 103 J mol-1 y su capacidad calorífica de 52,59 J mol-1 K-1. La densidad es 6,95 cm.-3 [1]. Los principales yacimientos de este mineral se encuentran en Brasil, Perú y Bolivia [2]. Al igual que el óxido de cinc, el SnO2 es un semiconductor con banda prohibida ancha y presenta una adecuada combinación de propiedades químicas, electrónicas y ópticas que lo hacen útil como material para sensores de gas [3], varistores [4], catalizadores [5], dispositivos optoelectrónicos, electrodos electrocatalíticos y celdas fotovoltaicas [6-8].
Diferentes métodos de síntesis han sido utilizados para la obtención del SnO2. Zhang y Gao [9] sintetizaron nanopartículas de SnO2 utilizando un método químico novedoso partiendo de estaño granulado. Para lograrlo, adicionaron cuidadosa-mente, una solución 8 mol L-1 de HNO3 a una mezcla de 3 g de estaño granulado con 10g de ácido cítrico, hasta que obtuvieron una solución clara. Posteriormente adicionaron NH4OH, gota a gota, hasta que el sistema alcanzó un valor de pH 8. Después de un proceso de reflujo, a 100°C durante 2 h, obtuvieron partículas de SnO2 en el rango de 2,8 y 5,1 nm con una superficie específica entre 289 y 143 m2g-1.
Otro método de síntesis empleado ampliamente es el de sol-gel. Con este proceso se pueden obtener polvos cerámicos a través del crecimiento de oxo-polímeros del metal en un solvente [10,11]. De Monredon et al. [12] utilizaron isopropóxido de estaño disuelto en etanol absoluto, bajo una atmósfera seca, y utilizando como acomplejante acetilacetona, AcacH, el cual fue adicionado al sistema bajo continua agitación. La hidrólisis de la solución fue realizada usando soluciones acuosas ácidas (ácido p-toluenosulfónico) que se dejaron envejecer, durante 24 h en botellas de vidrio fuertemente sellados, en un horno a 60°C. A través de este método de síntesis se obtuvieron partículas de óxido de estaño monodispersadas con tamaño entre 1 y 2 nm.
Utilizando el método de precipitación homogénea Song y Kang [13] sintetizaron SnO2 con un tamaño de partícula entre 3 y 4 nm de diámetro, una distribución de tamaño de partícula estrecho y un valor de superficie específica entre 24 y 44 m2g-1. Para ello se disolvió urea en una solución acuosa de SnCl4.5H2O (0,01M). La solución fue hidrolizada a 90°C durante 4h y se enfrió utilizando agua con hielo. El precipitado se separó del sistema utilizando ultracentrifugación de la solución, el cual se secó a 100°C por 24 h. El polvo seco se trató térmicamente a diferentes temperaturas siendo la más favorable, para las características del polvo cerámico, la realizada a 600°C.
Como se puede deducir de lo enunciado, el método de síntesis del SnO2 tiene un gran efecto sobre el tamaño de partícula, la morfología de la misma y sus propiedades semiconductoras; hay en la literatura [14,15] estudios que tratan explícitamente esta relación. Aunque en los trabajos sobre la obtención de SnO2 se realiza una descripción adecuada de los métodos de síntesis, en ellos no se hace mención a los mecanismos fisicoquímicos que llevan a la formación de las partículas.
En este trabajo se estudió la obtención de SnO2 a partir de soluciones acuosas de sulfato de estaño, utilizando como precipitante hidróxido de amonio, NH4OH. Con base en las curvas de valoración potenciométrica y conductimétrica se determinaron las diferentes etapas del proceso y se analizaron los fenómenos fisicoquímicos que ocurren durante la adición del precipitante. Los sólidos obtenidos a diferentes valores de pH del sistema, y al final del proceso, se caracterizaron con difracción de rayos X (DRX), espectroscopia infrarroja por transformada de Fourier (FTIR) y Microscopía Electrónica de transmisión (MET).
2. Parte EXPERIMENTAL
2.1 Síntesis de los Polvos Cerámicos de SnO2
Se prepararon soluciones acuosas a diferente concentración de SnSO4 (Fisher Scientific 95%), con 0,1 M de HNO3 (Carlo Erba 99%). Las soluciones se agitaron constantemente a 200 r.p.m., a temperatura ambiente, hasta que no se observaron partículas del precursor en suspensión ni sedimentadas. Luego se adicionó hidróxido de amonio (NH4OH - Mallincrodt 28%) a una velocidad de 0,034 mL s-1 utilizando para ello un dosificador (Metrohm Dosimat 685). La variación del pH del sistema se registró con un pH-metro (Metrohm 744), con electrodo de vidrio, y la conductividad especifica del sistema con un conductímetro Toledo MC126. A medida que se adicionó el NH4OH al sistema, el pH y el cambio de conductividad especifica se graficaron en función del volumen adicionado de precipitante, NH4OH, obteniéndose así las curvas de valoración potenciométrica y conductimétrica del sistema de estaño.
La suspensión obtenida se filtró al vacío para eliminar el solvente y reducir la cantidad de iones de sulfato disueltos en él; el sólido húmedo se redispersó en agua destilada utilizando un equipo de dispersión de alta cizalla, Ultraturrax IKA T-50, sometiendo la mezcla a una velocidad de agitación de 4000 r.p.m, durante 3 minutos. La suspensión obtenida se dejó reposar durante 24 horas y se volvió a repetir el proceso indicado dos veces más; el producto obtenido, al finalizar el lavado con agua, se secó en una estufa a 60 °C durante 24 horas, luego se trituró en un mortero de ágata y el polvo obtenido fue el que se caracterizó.
2.2 Caracterización de los Polvos Cerámicos Obtenidos
Los polvos obtenidos fueron caracterizados por difracción de rayos X (DRX), para determinar las fases cristalinas presentes en los sólidos; el equipo empleado fue un difractómetro Philips utilizando la radiación a 1,790Å del Co, en el rango de 20 a 70° (2θ). La espectroscopia infrarroja por transformada de Fourier se empleó con el fin de conocer los grupos funcionales que existen en las diferentes fases sólidas que se forman durante el proceso de síntesis; para ello se utilizó el espectrofotómetro FTIR Nicolet IR200. La distribución de tamaño de partícula, de los polvos cerámicos sintetizados, se determinó utilizando un equipo Micromeritics Sedigraph 5000D. Por ultimo, para conocer el tamaño y morfología de las partículas se empleó el microscopio electrónico de transmisión Jeol JEM-1200 EX.
3. RESULTADOS Y DISCUSIÓN
3.1 Valoración Potenciométrica
La curva de valoración potenciométrica de la Figura 1(a), obtenida para una disolución 0.3M de SnSO4 y 0.1 de HNO3 al adicionar el agente precipitante (NH4OH), presenta 4 regiones bien definidas si se considera la variación de la pendiente de la curva; mientras la región A presenta una variación apreciable en el valor de pH la B es prácticamente plana, indicando un alto consumo de OH- por parte del sistema. La región C muestra un cambio abrupto de la pendiente de la curva mientras en D el valor de la pendiente es muy pequeño y corresponde a la saturación de la disolución.
Al disolver SnSO4 en agua se presenta una disociación parcial del precursor que se puede expresar a través de una reacción del siguiente tipo:
[Sn(SO4)N]-z + H2O ®
[Sn(SO4)N-h(OH2)h]-(z-h)+hSO42- (1)
donde la especie [Sn(SO4)N] representa el poliedro de coordinación del Sn2+ en solución. Si se produjera una disociación completa del precursor, en el sistema ocurriría la siguiente reacción:
SnSO4 + H2O ®
que generaría un complejo acuo de estaño el cual podría seguir interactuando con el agua a través de reacciones de hidrólisis:
[Sn(OH2)N]z+ + H2O ®
[Sn(OH)h(OH2)N-h](z-h) + H3+O (3)
Adicional a la reacción 3, puede ocurrir la hidrólisis espontánea de la especie sulfatada, producto de la reacción 1, y que se puede expresar así:
[Sn(SO4)N-h(OH2)h]-(z-2) + H2O ®
Sn(SO4)N-h(OH2)h-1(OH)]-(z-3) + H3+O (4)
Obteniéndose como un producto de la reacción, protones, H3+O, los cuales ocasionan la disminución del pH del sistema, tal como se observa experimentalmente al disolver el precursor de estaño en agua.
Por otro lado, si se observa la Figura 1, en la región A de la curva, ocurre inicialmente un leve incremento en el valor del pH que se debe, principalmente, a la neutralización del HNO3 por el NH4OH que se adiciona, produciéndose nitrato de amonio (NH4NO3). Debido a que el ion sulfato se enlaza fuertemente al catión, se pueden conformar sulfatos básicos de estaño a través de la siguiente reacción:
SnSO4 + nNH4OH ®
Sn(OH)n(SO4)1-n/2 + n/2 (NH4)2SO4 (5)
(a)
(b)
Figura 1: Curvas de valoración potenciométrica correspondientes al sistema Sn(SO4)-HNO3 – H2O: (a) para una concentración 0,3 M de SnSO4 y (b) diferentes concentraciones de estaño.
En esta región, cerca a pH 2, se forma una fase sólida transitoria que se disuelve al agitar el sistema, retomando la transparencia y homogeneidad inicial.
En la región B ocurre un alto consumo del OH- suministrado por el NH4OH. En esta zona de la curva debe presentarse, principalmente, la conformación de especies poli-nucleares del tipo [Sn2(OH)2]2+, [Sn3(OH)4]2+ y [Sn3(SO4)(OH)4], etc., como resultado del desarrollo de las reacciones de condensación que experimentan las especies hidrolizadas de estaño [11]. Los complejos tipo oxi-hidroxi que se pueden formar en esta región presentan una composición cercana a 3SnO.H2O, los cuales contienen agrupaciones de poliedros Sn6O8, que se unen entre si por enlaces de hidrógeno dando como resultado una formula estructural Sn6O8H4, compuesto que puede formarse a partir de la siguiente reacción de condensación [16]:
2[Sn3(OH)4]2+ + 4OH- ®
[Sn6O8H4] + 4H2O (6)
Las especies poli-nucleares que se conforman interactuarán para formar los embriones y núcleos de la fase sólida. Es por esto que en esta región empiezan a formarse partículas en suspensión de color blanco, que no se disuelven, alrededor de un valor de pH 3; al seguir adicionando NH4OH al sistema éste se torna lechoso, con partículas coloidales en suspensión. Como se verá en el difractograma de rayos X de la muestra sólida obtenida a pH 3,9, en ella existe casiterita que se debe producir a través de la siguiente reacción [17]:
SnO + H2O ® SnO2 + H2 (7)
En la región C ocurre un incremento abrupto del pH. En esta región la formación de los complejos y compuestos de estaño, y por lo tanto de los núcleos de fase sólida, debe disminuir notablemente. Alrededor de pH 5, el sistema se convierte en una suspensión altamente viscosa y comienza a cambiar de color, pasando de un color blanco a uno crema claro; estas características se mantienen hasta un pH 7,5. Por encima de pH 7,5 la viscosidad del sistema disminuyó pero mantuvo su turbidez y cambio de color, pasando de crema claro a crema oscuro y posteriormente, con la adición del NH4OH, a un color marrón claro; este color es mantenido por la suspensión en la región D que corresponde a la saturación del sistema. En esta última región, la formación de aglomerados es un fenómeno importante.
La Figura 1(b) muestra como se modifican las curvas de valoración potenciométrica al variar la concentración del precursor de estaño, SnSO4, en el sistema. En todas ellas son evidentes las cuatro regiones de la Figura 1(a), descritas anteriormente. La extensión de las regiones A y B se incrementa a medida que aumenta la concentración del precursor, esto debido a que la formación de núcleos de fase sólida debe ser mayor al incrementarse la concentración de SnSO4 en el sistema.
3.1.1 Valoración Conductimétrica
En la Figura 2(a) se observa la curva de conductividad específica en función del volumen de NH4OH que se ha adicionado a la disolución 0.3M de SnSO4.
(a)
(b)
Figura 2: Curvas de valoración conductimétrica correspondientes al sistema SnSO4 – HNO3 – H2O: (a) para una concentración 0.3M de SnSO4 y (b) diferentes concentraciones de estaño.
En la Figura 2(a) se distinguen cuatro regiones. La región 1, que está relacionada con la zona A de la curva potenciométrica (Figura 1(a)), corresponde a la valoración de un ácido fuerte y por lo tanto representa principalmente la neutralización del HNO3 por parte del NH4OH adicionado.
Considerando la forma que presenta la región 2, Figura 2(a), esta debe corresponder a una valoración de grupos superficiales de naturaleza ácido débil con una base débil. Ya que los compuestos intermedios de estaño, y por lo tanto los núcleos de la fase sólida se están formando en esta región, el número de iones en la disolución se incrementa ocasionando un aumento de la conductividad. La no perfecta linealidad pone en evidencia la presencia de grupos polinucleares y poliméricos de naturaleza ácido débil [18].
La región 3, relacionada con la zona C de la curva potenciométrica, representa la consolidación de los núcleos de fase sólida y su crecimiento por lo que la cantidad de especies polinucleares en el sistema disminuye abruptamente. La región 4 está relacionada con la zona D de la curva de la Figura 1(a) y representaría la valoración del exceso de base adicionada o la saturación que ocurre en el sistema.
La Figura 2(b) muestra como se modifican las curvas de valoración potenciométrica al variar la concentración de SnSO4 en el sistema; la conductividad se incrementa al aumentar la concentración del precursor de estaño. Esto es debido, en parte, a la conductancia superficial de los coloides que se forman en el sistema [19]. En todas es evidente la presencia de las cuatro regiones descritas anteriormente.
3.2 Caracterización de la Fase Sólida de las Suspensiones
3.2.1 Difracción de rayos X
Para determinar el efecto del pH sobre la naturaleza de los sólidos que se forman en el seno de la disolución, se analizaron con DRX muestras obtenidas al filtrar suspensiones conformadas a diferentes valores de este parámetro.
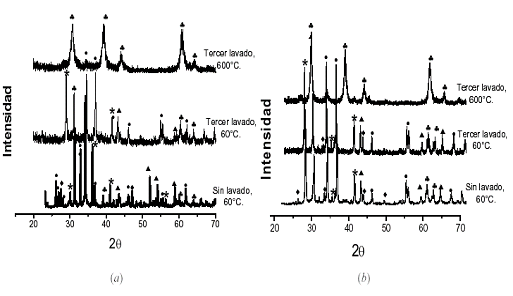
En la Figura 3 se muestran los difractogramas correspondientes a sólidos, obtenidos del sistema con una concentración 0,3 M de sulfato de estaño y 0,1 M de HNO3, los cuales indican que las principales fases cristalinas presentes en ellos son las siguientes: SnO (PDF77-2296), SnO2 (PDF41-1445), Sn3O(OH)2SO4 (PDF30-1376), NH4NO3 (PDF73-1518), y (NH4)2SO4 (PDF84-0127). Como se puede observar en la Figura 3, para un pH entre 6,25 y 6,40 la casiterita SnO2 es una de las principales fases cristalinas y el Sn3O(OH)2SO4 ya no está presente en gran cantidad como para los valores de pH 3,97 y 9,35.
Con el fin de observar el efecto que tiene el proceso de lavado en agua, sobre la transformación de fase de los compuestos que existen en el sistema de estaño, se utilizó DRX. En los difractogramas, Figura 3, se observa que para los diferentes valores de pH considerados, y después de lavar las muestras 3 veces con agua, se elimina el nitrato de amonio NH4NO3 y el sulfato de amonio (NH4)2SO4 como fases cristalinas en las muestras, sin embargo no es posible eliminar totalmente el ion sulfato ya que el Sn3O(OH)2SO4 sigue estando presente al final del proceso de lavado.
Otro aspecto importante a resaltar es que para las muestras obtenidas a pH > 6, y que fueron lavadas tres veces, se favorece la presencia del SnO, romarchita, como fase importante en la muestra. Por otro lado, el tratamiento térmico a 600°C favorece la presencia del SnO2, como principal fase cristalina en los sólidos, aunque sigue presente en muy pequeña cantidad el oxi-hidroxisulfato de estaño.
3.2.2 Espectroscopia Infrarroja con transformada de Fourier (FTIR)
Los espectros FTIR correspondientes a muestras sólidas obtenidas de la suspensión de estaño a diferentes valores de pH, para una concentración 0,3 M, se indican en la Figura 4.
En la Figura 4, y en la Tabla 1, se indica la asignación de bandas del sistema a diferentes valores de pH, se puede observar que desde valores de pH bajo se presentan enlaces de naturaleza bidentada del sulfato con el estaño; a medida que el ambiente coordinativo del Sn se satura de grupos OH- suministrados por el agente precipitante (NH4OH), pasa de tener enlaces bidentados a monodentados. Por otro lado, a un valor de pH 6,25 se fortalece el enlace característico del óxido de estaño.
Figura 3: Difractogramas de rayos X correspondientes a muestras sólidas sin lavar, tercer lavado y posterior tratamiento térmico a 600°C, para diferentes valores de pH (a) 3,97; (b) 6,25; (c) 6,40 y (d) 9,35.[● (Sn3O(OH)2SO4, D SnO2, D (NH4)2SO4 , * SnO, D NH4NO3]
Figura 4: Espectros FTIR de muestras sólidas obtenidas a diferentes valores de pH: (a) 3,97; (b) 6,25; (c) 6,40 y (d) 9,35 para el sistema de sulfato de estaño 0,3 M.
De la Figura 5, y la Tabla 2, se observa que para valor de pH 6,40 uno de los principales grupos funcionales es el O-Sn-O al que se le asigna la banda en 635 cm-1 y 792 cm-1 [7-10,13,20-22]. Al someter a tratamiento térmico los polvos cerámicos desaparece la banda a 545cm-1, atribuida al enlace Sn-OH, y se fortalece la banda a 635 cm-1 con lo que se puede concluir que la temperatura favorece la oxidación del SnO para formar el SnO2, reiterando los resultados de DRX. Por otro lado, el proceso de lavado permitió reducir el contenido de complejos de sulfato, como se evidencia por el debilitamiento o desaparición de las bandas asociadas a este complejo, Figura 5(a). Esto se puede deber, a que el proceso de lavado favorece las reacciones de hidrólisis favoreciendo el intercambio de los OH- con los sulfatos libres; aunque el lavado no elimina completamente los enlaces del sulfato con el estaño, disminuye de manera considerable, su presencia como se puede corroborar con los difractogramas de la Figura 3.
Figura 5: Espectros FTIR correspondientes a muestras sólidas obtenidas del sistema 0,3 M de sulfato de estaño a un valor de pH de 6,40 donde se indican el efecto (a) de los lavados con agua y (b) el del tratamiento térmico a 600°C.
Tabla 1. Principales bandas de los espectros FTIR correspondientes a muestras sólidas del sistema sulfato de estaño, obtenidas a diferentes valores de pH (7,10,13,14,20-24).
| ν (cm-1) pH 3,7 | ν (cm-1) pH 6,25 | ν (cm-1) pH 6,40 | ν (cm-1) pH 9,35 | Grupos funcionales |
| 556 | 543 | 546 | 546 | Sn-O-H |
| 635 | 734 | 635 | 734, 813 | *SnO2 |
| 436, 635, 965 1038, 1100 | 955, 1038, 1100 | 635, 955 1038, 1100, | 955, 1038 1117 | |
| 1402 | 1402 | 1402 | -------- | * (NH4)2SO4 |
| 1632 | 1620 | 1632 | 1620 | H-O-H |
| 3342 | 3293 | 2917, 3306 | 2844, 3317 | O-H |
* Bandas características de este compuesto.
Tabla 2. Principales bandas presentes en los espectros FTIR correspondientes a muestras sólidas del sistema de estaño, a pH 6,40 sin lavar, lavada tres veces y tratadas térmicamente a 600°C.
| ν (cm-1) Sin lavar | ν (cm-1) 3er lavado | ν (cm-1) Sin lavar y calcinada a 600°C | ν (cm-1) Tercer lavado y calcinada a 600°C | Grupos funcionales |
| 545 | 545 | ---------- | ---------- | Sn-O-H |
| 635 | 792 | 632 | 636 | *SnO2 |
| 635, 955 1035, 1100 | 1031, 1120 | 1141 | 1141 | |
| ---------- | ---------- | 632, 1130 | 636, 1130 | |
| 1402 | 1402 | 1461, 1377 | --------- | *(NH4)2SO4 |
| 1624 | 1624 | 1632 | 1632 | H-O-H |
| 2917, 3306 | 2230, 3330 | 2859, 2929, 3443 | 2859, 2929, 3443 | O-H |
| --------- | --------- | 2356 | 2356 | CO |
| --------- | --------- | 2921, 2860 | 2853, 2927 | C-H |
* Bandas características de este compuesto.
Espectros muy similares a los de la Figura 5, se obtienen para los sólidos sintetizados a otros valores de pH. Independiente del valor de pH, las bandas correspondientes al complejo unidentado de sulfato, en la muestra lavada, no son tan evidentes como en el espectro de la muestra sin lavar. La banda a 620 cm-1 se asigna principalmente al SnO2 aunque puede contener información del sulfato unidentado ó libre; por otro lado, al calcinar las muestras se destacan las bandas correspondientes al SnO2, Figura 5(b).
3.2.3 Microscopía Electrónica de transmisión. (MET)
La Figura 6 muestra fotografías obtenidas con MET del polvo cerámico sintetizado del sistema SnSO4-NH3-H2O, con una concentración 0,3 M de sulfato de estaño a un valor de pH 6,40. En la Figura 6(a) se observa la fotografía de la muestra sin tratamiento térmico e ilustra que las partículas son de pequeño tamaño, ~20 nm, y se encuentran sueltas; si se comparan con las partículas que se observan en la Figura 6(b), muestra tratada térmicamente a 600°C, es evidente la formación de aglomerados de partículas debido a la acción de fuerzas superficiales y a que durante el proceso de calcinación las partículas al ser tan pequeñas, y por lo tanto muy reactivas, interactúan entre si formando enlaces sólidos entre ellas (cuellos).
Estudios realizados utilizando sedigrafía para determinar el tamaño de partícula indican que el polvo cerámico tiene un tamaño medio de partícula de ~ 2 μm y el 20% y 80% de la distribución presenta un tamaño de partícula entre ~ 0,7 μm y ~ 13 μm respectivamente, distribución muy ancha debido a la presencia de aglomerados; este resultado reitera lo que se observa en la Figura 6.
Figura 6: Fotografías obtenidas con MET de los polvos cerámicos del sistema 0,3 M de SnSO4, sintetizados a un valor de pH 6,40 y tratados térmicamente a (a) 60°C y (b) 600°C.
4. CONCLUSIONES
De este trabajo se puede concluir lo siguiente:
· El método de precipitación controlada permite obtener polvos cerámicos de SnO2 con tamaño nanométrico. El conocimiento de los diferentes fenómenos fisicoquímicos que ocurren durante la formación de las partículas, adquirido al analizar las curvas de valoración potenciométrica y conductimétrica y caracterizando la fase sólida del sistema, permite obtener polvos cerámicos con características pre-determinadas, en tamaño y forma de partícula, y también garantizar la reproducibilidad de este método de síntesis.
Las principales fases cristalinas presentes en los sólidos obtenidos del sistema sulfato de estaño con una concentración 0,3 M, y 0,1 M de HNO3 a diferentes valores de pH, son las siguientes: SnO, SnO2, Sn3O(OH)2SO4, NH4NO3, y (NH4)2SO4. Después de lavar las muestras con agua se eliminan el NH4NO3 y el (NH4)2SO4) pero no el ion sulfato, que aun está presente en el compuesto Sn3O(OH)2SO4.
Al tratar las muestras a 600°C se favorece la conformación del SnO2 como principal fase cristalina, independiente del valor de pH, aunque sigue presente en muy pequeña cantidad el hidroxisulfato de estaño. El tamaño de cristalito del SnO2 obtenido es muy pequeño como lo indica el ancho de los picos característicos del óxido en los difractogramas analizados.
Las fotografías de microscopia electrónica de transmisión muestran partículas de tamaño nanométrico. Además son evidentes aglomerados visualmente blandos, lo que justificaría el rango ancho en la distribución de tamaño de partícula observado en el estudio de sedigrafia.
5. Agradecimientos
Este proyecto fue realizado en el marco del convenio CIAM-COLCIENCIAS. Los autores agradecen al proyecto PROALERTA VIII.13 de la Red CyTED de Materiales Electrocerámicos, por la ayuda económica brindada a la Srta. Alejandra Montenegro para que pudiera realizar su pasantía en la División Cerámicos del Instituto de Investigaciones en Ciencia y Tecnología de Materiales-INTEMA (Mar del Plata, Argentina).
6. Referencias bibliográficas
1. Jarzebski ZM, Marton JP, J. Electrochem. Soc. 1976; 123 (9): 299C-310C. [ Links ]
2]. Huamán F, Reyes L, Estrada W, Gutarra A, Tecnia 1998; 8: 77-83.
3. Díaz-Delgado R, Tin Oxide Gas Sensors: An Electrochemical Approach, Tesis doctoral. Barcelona (España): Universidad de Barcelona (UB), 2002.
4. Borges Marques VP, Influência do Óxido de Cromo nas Propriedades Varistoras do Óxido de Estanho, Tesis M.Sc. en Química. Araraquara (Brasil): Instituto de Química, Universidade Estadual Paulista (UNESP), 2003.
5. Ararat C, Varela JA, Rodríguez-Paéz JE, Bol. Soc. Esp. Ceram. V. 2005; 44 (4): 215-222.
6. Chopra KL, Major S, Pandya DK, Thin Solids Film 1983; 102 (1): 1-46.
7. Chatterjee K, Chatterjee S, Banerjee A, Raut M, Pal NC, Sen A, Maiti HS, Mater. Chem. Phys. 2003; 81 (1): 33-38.
8. Fagan JG, Amarakon VRW, Am. Ceram. Soc. Bull. 1993; 72: 119-129.
9. Zhang J, Gao L, J. Solid State Chem. 2004; 177 (4-5): 1425-1430.
10. Brinker CJ, Scherer GW, Sol-Gel Science: The Physics and Chemistry of Sol-Gel Processing . San Diego (EE.UU.): Academic Press, 1990.
11. Jolivet J-P, Metal Oxide Chemistry and Synthesis: From Solution to Solid State. Weinheim (Germany): Wiley-VCH Verlag GmbH, 2000.
12. de Monredon S, Cellot A, Ribot F, Sanchez C, Armelao L, Gueneau L, Delattre L, J. Mater. Chem. 2002; 12 (8): 2396-2400.
13. Song KC, Kang Y, Mater. Lett. 2000; 42 (5): 283-289.
14. Sergent N, Gélin P, Périer-Camby L, Praliaud H, Thomas G, Sensor Actuat. B-Chem. 2002; 84 (2-3): 176-188.
15. Ristić M, Ivanda M, Popović S, Musić S, J. Non-Cryst. Solids 2002; 303 (2): 270-280.
16. Greenwood NN, Earnshaw A, Chemistry of the elements. Oxford (Great Britain): Butterworth-Heinemann Ltd, 1996.
17. Stumm W, Morgan JJ, Aquatic Chemistry: Chemical Equilibria and Rates in Natural Waters, 3er Ed. New York (EE.UU.): John Wiley & Sons Canada, Ltd., 1996.
18. Homola A, James RO, J. Colloid Interf. Sci. 1977; 59 (1): 123-134.
19. Stone-Masui J, Watillon A, J. Colloid Interf. Sci. 1975; 52 (3): 479-503.
20. Jiménez VM, Caballero A, Fernandez A, Espinós JP, Ocaña M, González-Elip AR, Solid State Ionics 1999; 116 (1-2): 117-127.
21. Farmer VC, The Infrared Spectra of Minerals, Mineralogical Society Monograph, Number 4. London (Great Britain): Mineralogical Society, 1974.
22. Ocaña M, Matijević E, J. Mater. Res. 1990; 5 (5): 1083-1091.
23. Nakamoto K, Infrared and Raman Spectra of Inorganic and Coordination Compounds, 4ta Ed. New York (EE.UU.): John Wiley & Sons Inc., 1986, p. 60-64.