Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Latinoamericana de Metalurgia y Materiales
versión impresa ISSN 0255-6952
Rev. LatinAm. Metal. Mater. v.32 n.1 Caracas jun. 2012
Estudio comparativo del uso de ácido cítrico y urea en la síntesis de manganitas de calcio dopadas con europio, por el método de combustión
Felipe Legorreta-García *, Leticia E. Hernández-Cruz, Francisco J. García-Delgado, Ana María Bolarín-Miró, Félix Sánchez de Jesús
Universidad Autónoma del Estado de Hidalgo-Área Académica de Ciencias de la Tierra y Materiales, Carr. Pachuca-Tulancingo Km. 4.5, 42184, Mineral de la Reforma, Hidalgo, México, *e-mail: felegorreta@hotmail.com
RESUMEN
Se sintetizaron mediante el método de combustión, manganitas de calcio dopadas con europio de composición estequiométrica ideal Eu0.05Ca0.95MnO3-δ; utilizando como sales precursoras, nitratos de calcio, manganeso y europio. Se estudió el efecto del tipo de agente combustible (ácido cítrico y urea) y su concentración (urea (U): 1, 2, 3, 4, 5, 10 y 20) y ácido cítrico (AC): 0.25, 0.5, 0.75, 1, 1.5, 2, 3, 4, 5, 7 y 10). Con la finalidad de estudiar el tamaño, la morfología y la estructura cristalina de las partículas se hicieron análisis de tamaño de partícula (ATP), microscopía electrónica de barrido (MEB) y difracción de rayos X (DRX). Se sintetizó exitosamente la manganita mediante el método de combustión, estructuralmente constituida por una mezcla de dos fases: CaMnO3-ortorrómbica y Ca2MnO4-tetraédrica. Los resultados revelaron que la proporción de agente combustible afecta notablemente el rendimiento, la morfología y tamaño de las partículas sintetizadas.
Palabras Claves: Manganitas, Europio, Combustión, Síntesis
Comparative study of the use of citric acid and urea in the synthesis of calcium manganites doped with eu, by combustion method
ABSTRACT
Calcium manganites doped with europium were synthesized by combustion method, in a stoichiometric composition Eu0.05Ca0.95MnO3-δ; using as precursors salts, nitrates of calcium, manganese and europium. The type of fuel agent effect (citric acid and urea), the concentration effect (urea (U: 1, 2, 3, 4, 5, 10 y 20) and citric acid effect (AC: 0.25, 0.5, 0.75, 1, 1.5, 2, 3, 4, 5, 7 y 10)) of fuel agent were studied. In order to study the size, the morphology and the crystal structure of the particles, there were made particle size analyses (PSA), scanning electron microscopy (SEM) and X-ray diffraction (XRD). Manganite was successfully synthesized by combustion method, structurally composed of a mixture of two phases: CaMnO3-orthorhombic and Ca2MnO4-tetrahedral. The results showed that the proportion of fuel agent effects the performance, the morphology and size of the synthesized particles.
Keywords: Manganites, Europium, Combustion, Synthesis
Recibido: 27-07-2010; Revisado: 09-02-2011
Aceptado: 25-04-2011; Publicado: 28-04-20111. INTRODUCCIÓN
La síntesis de nuevos materiales "de diseño" o con características especiales, ha tenido gran auge en años recientes, con el objetivo de sintetizar y conformar cerámicos avanzados de manera económica, rápida, con altos rendimientos, sin impurezas o sin la necesidad de procesos posteriores de purificación. En este sentido se han desarrollado muchos métodos de síntesis, tales como: el método sol-gel [1], el de precipitación [2], el de mecano síntesis [3], el hidrotermal [4] y el de combustión [5], entre otros. De todos éstos, el método de combustión ha sido ampliamente usado en la síntesis de óxidos de manganeso obteniendo buenos resultados [6]. De la variedad de cerámicos que pueden prepararse por esta metodología se tienen a los óxidos dopados, entre los cuales se encuentran las manganitas [7].
Las manganitas con estructura tipo perovskita son una clase de óxidos, particularmente estudiados por sus propiedades de magneto resistencia colosal. En estos compuestos, la resistividad puede ser disminuida en varias órdenes de magnitud al aplicarles un campo magnético [7, 8]. La fórmula general de estos óxidos de manganeso es A1-xBxMnO3 donde A puede ser una tierra rara y B un metal alcalinoterreo. Los átomos de tierras raras en las manganitas, han sido utilizados porque muestran un importante constituyente del efecto magneto resistivo.
Últimamente se han publicado diversos artículos referentes a manganitas de lantano sustituidas con calcio y estroncio, LaxCa1-xMnO3 y LaxSr1-xMnO3, sin embargo, existe escasa información publicada concerniente a manganitas de calcio dopadas con otras tierras raras como lo es el sistema Eu-Ca-Mn-O [9, 10, 11].
La sustitución del europio (Eu) en la manganita de calcio es de gran interés debido a que éste puede asumir una gran variedad de configuraciones electrónicas en diferentes compuestos, confiriéndole ciertas propiedades ópticas que hacen que dichos compuestos sean buenos candidatos para aplicaciones innovadoras e interesantes, como por ejemplo en fibras ópticas, en foto almacenamiento, en diodos inorgánicos y láser, como marcadores en medicina y en diodos orgánicos electro luminiscentes (OLED), etc. [12].
La obtención de estas propiedades y la aplicación de este tipo de manganitas sólo son posibles cuando estos materiales se sintetizan en las dimensiones, morfología, microestructura, cristalinidad y composición química deseada [13]. El método de combustión ha sido utilizado ampliamente en la elaboración de diversos cerámicos, los combustibles más utilizados son el ácido cítrico, la urea o bien, una mezcla de estos. En trabajos anteriores se han realizado estudios de la variación de la proporción y tipo de combustible, con la finalidad de investigar las diferentes propiedades físicas obtenidas en los polvos cerámicos [5, 6], pero no se ha utilizado este método en la síntesis de la manganita Eu0.05Ca0.95MnO3-δ, razón por la cual en este trabajo se presentan los resultados obtenidos al estudiar efecto del uso de urea y ácido cítrico como combustibles en su obtención.
2. PARTE EXPERIMENTAL
El procedimiento de síntesis por combustión fue adaptado para la obtención de esta clase particular de cerámicos, del descrito por Patil [6]. Para tal efecto se mezclaron 0.95 moles de Ca(NO3).H2O (Aldrich), 0.05 moles de Eu(NO3)3.5H2O (Aldrich) y 1 mol de Mn(NO3)2.H2O (Aldrich), disolviéndolos en 20 mL de agua desionizada junto con cantidades variadas de urea o ácido cítrico para producir 1g de solución sólida. Las proporciones de urea y ácido cítrico se eligieron tomando en cuenta trabajos anteriores de síntesis de polvos cerámicos y se calcularon considerando la valencia total oxidante (VO) y total reductora (VR) de las diferentes especies [14, 15, 16, 17, 18, 19]. La valencia total oxidante de los nitratos es VO = 20.25. La valencia total reductora de la urea es VR = 6, y VR = 18 para el ácido cítrico.
La cantidad molar de urea (m) se calculó para que la llamada relación estequiométrica ( Φe) = mVR/Vo, fuera igual a la unidad, es decir m = 3.375 para la urea y m = 1.125, para el ácido cítrico. Sin embargo, como ha sido discutido por Zhang y Stangle [20], este método implica algunas aproximaciones. En primer lugar, el O2 de la atmósfera del aire no se toma en cuenta, lo cual afecta a la VO. En segundo lugar, los productos que contienen nitrógeno se consideran sólo como N2 (por lo tanto, el cero se toma como la valencia de éste elemento) a pesar de que los óxidos de nitrógeno y/o NH3 se pueden formar en proporciones usualmente indeterminadas. Esto afecta tanto a Vo y VR. Por lo tanto, para una síntesis en particular, es necesario determinar
experimentalmente la proporción de urea apropiada. Razón por la cual, para este estudio se calcularon valores diferentes de Φe, es decir, m = (3.375 – 67.5) y m = (0.281 – 11.25) para la urea y el ácido cítrico, respectivamente. Sin embargo por razones de simplicidad, de aquí en adelante, se designará como parámetro de estudio el factor multiplicativo "n"(proporción de combustible) y para indicar el uso de urea se utilizará Un (donde n = 1, 2, 3, 4, 5, 10 y 20) y ACn para el ácido cítrico (donde n =0 0.25, 0.5, 0.75, 1, 1.5, 2, 3, 4, 5, 7 y 10).La síntesis de la solución sólida Ca0.95Eu0.05MnO3-δ se efectuó de acuerdo a las reacciones generales (1) y (2):


La combustión se llevó a cabo siguiendo el diagrama de flujo mostrado en la Figura 1.
La solución acuosa contenida en un vaso de precipitados se introdujo en una mufla marca Felisa® con temperatura máxima de operación de 1100°C y sensibilidad de ± 2°C. La mufla se precalentó manteniéndose hasta antes de introducir el vaso a 500 ºC. En esta etapa se produjo la combustión, el proceso inició con la evaporación del agua, seguido de una reacción redox, producida entre los nitratos precursores y el combustible agregado. Durante el proceso de combustión se mantuvo la puerta abierta.
El oxígeno que participa en la reacción es únicamente el que contiene el aire del ambiente. El resultado de la combustión es un polvo de óxido de manganeso que posteriormente se caracteriza con el objeto de verificar si la estequiometria obtenida coincide con la preestablecida. Posteriormente, la mufla se cierra y el producto se calcina a 600 ºC durante dos horas, a fin de eliminar cualquier traza de carbono. En otros trabajos de síntesis de polvos cerámicos obtenidos por este método, se ha determinado que la cantidad de carbono contenida en polvos son únicamente trazas inferiores al 0.2% en masa [16]. Finalmente se aplicó un tratamiento térmico a 1000 °C durante dos horas a fin de distinguir las fases cristalinas de la solución sólida, ya que después de calcinación las fases no estaban completamente cristalizadas.
Se empleó un microscopio electrónico de barrido (MEB) marca JEOL JSM-6300, para caracterizar la morfología de los polvos, el cual tiene acoplado un analizador de energía dispersiva de rayos X (EDS) marca Noran, modelo 660 B-1SPS con el que se realizó un análisis químico semicuantitativo. Los polvos se introdujeron en un baño ultrasónico marca Branson, modelo 2510, con la finalidad de separar posibles aglomerados.
La distribución de tamaño de partícula y el diámetro medio (D50) se obtuvieron con un equipo de ATP Beckman & Coulter, modelo LS-13320. Se obtuvieron diagramas de difracción de cada uno de los polvos obtenidos para su caracterización estructural con el equipo GBC marca MMA. Estos diagramas fueron elaborados con los datos adquiridos en el intervalo 30 a 90o (2θ), con incrementos de 0.05o. En todos los experimentos se utilizaron radiaciones Cu-Kα (λ=1.5418 Å).
3. RESULTADOS Y DISCUSIÓN
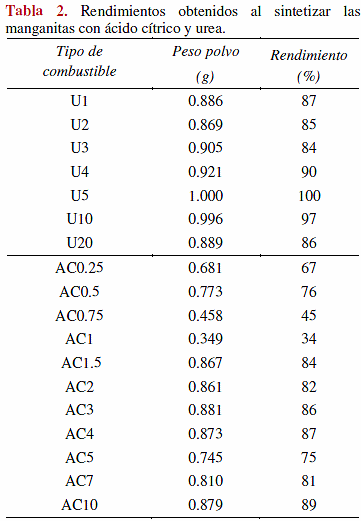
En la Tabla 1 se describen los detalles de cada experimento obtenidos al variar la proporción de combustible. Los resultados mostrados en esta tabla, permiten observar un comportamiento diferente frente a la combustión para cada tipo de combustible (urea o ácido cítrico). En el caso de la síntesis utilizando urea, la ignición fue acompañada en ocasiones con la presencia de flama; cuando se utilizó ácido cítrico como combustible, las igniciones eran en ocasiones sucesivas y con flamas de larga duración. Nótese que la cantidad utilizada de ácido cítrico fue inferior a la utilizada de urea, esto se atribuyó a la diferencia de poder reactivo de cada agente combustible.
Otro parámetro que se consideró evaluar, fue el tiempo de reacción, no mostrado, y se definió como el tiempo que tarda la solución desde el inicio de la evaporación del agua hasta que la combustión termina en su totalidad, es decir cuando ya no se observa la presencia de ningún tipo de incandescencia, ni gases; como es de esperarse a mayor cantidad de agente combustible, el tiempo incrementa. Costa y colaboradores relacionaron este valor con el tamaño y morfología de partícula, al emplear este tipo de síntesis en la obtención de cerámicos y cuyos resultados refieren que el tiempo de reacción influye en las características físicas, particularmente en la superficie específica [21].
Se obtuvieron los rendimientos del proceso y en la Tabla 2 se muestran los resultados, en los cuales puede observarse que cuando se utilizó urea como combustible, el rendimiento fue mayor al 80%, mientras que cuando se empleó ácido cítrico, los rendimientos obtenidos fueron mucho menores, del 34 al 45%, para algunos casos. Lo anterior se puede asociar a que las reacciones fueron más exotérmicas cuando se empleó ácido cítrico, este hecho fue observado en la lectura de la temperatura indicada en la mufla, en el instante exacto en que ocurría la combustión, es decir, en el momento de observar una flama u observar material incandescente, en el caso de no generarse una flama.
Esta diferencia en la exotermicidad, puede ser explicada en base a la naturaleza de cada combustible y en la cantidad utilizada del mismo. La urea forma complejos estables con el manganeso (hasta aproximadamente 50°C), al incrementar la cantidad de combustible, se fijan los átomos metálicos, lo que podría hacer que la reacción sea menos exotérmica estabilizando el sistema, llevando a cabo reacciones más eficientes y menos violentas, comparada con el ácido cítrico [22]. Por otro lado, existen reportes acerca de la formación de geles citrato-metal, y de la formación de complejos citrato-Ca y citrato-Mn, además de los estudios hechos por Biamino, y aquellos reportados por Cordier y colaboradores [23, 14], que mencionan la probable formación de polímeros. A bajas concentraciones de ácido cítrico los citratos metálicos son menos estables y más reactivos, sin embargo se asume que a mayores concentraciones de ácido cítrico los citratos metálicos son más estables y por lo tanto, la reacción más eficiente [14].
Se determinaron las distribuciones de tamaño de partícula de los polvos obtenidos, pero sólo se presenta tamaño promedio (D50). En la Figura 2a se presenta el D50 para cada proporción de urea, en esta figura es posible observar que los resultados presentan dos comportamientos: uno que exhibe un rango de tamaños que oscila entre 50 y 176 micrómetros cuando no se utiliza baño ultrasónico y otro con rangos entre 10 y 40 micrómetros, cuando si se aplica el baño ultrasónico. Estos resultados fueron comparados con las distribuciones de tamaños arrojadas por el equipo (no mostradas), poniendo en evidencia dos o más distribuciones de tamaños cuando no se aplicaba un baño ultrasónico.
Sin embargo, considerando el tipo de síntesis no es congruente obtener dos o más distribuciones de tamaños en una misma muestra, puesto que en todos los casos, la combustión mostró ser homogénea. Esta dispersión en los resultados se asocia a problemas de aglomeración de partículas. Con el fin de evitar éste problema, se sometieron los polvos a un baño ultrasónico durante 30 segundos.
En la Figura 2b, se aprecian las gráficas de D50 de tamaños de los polvos cerámicos, pero utilizando ácido cítrico como combustible. Para este caso se tuvo un comportamiento muy similar a la Figura 2a, por lo que se comprobó la hipótesis de que por la aglomeración de partículas no se es capaz de discernir mediante la técnica de análisis por difracción láser, arrojando datos que presentan poblaciones de partículas inexistentes y por lo tanto, errores en el resultado de la medición. Debido al argumento anterior, queda establecido aplicar baño ultrasónico de 30 segundos antes de realizar la medición de la distribución de los polvos cerámicos. Nótese además que al utilizar ACn se obtienen inferiores comparados con la urea, esto se relaciona con un tamaño de partícula inferior pudo haber abandonado el recipiente en el momento de la ignición-flama.
La caracterización de esta manganita por microscopía electrónica de barrido, mostró una gran variedad de morfologías, dependiendo del tipo y la proporción de combustible utilizado, tal como se aprecia en la Figuras 3 y 4, donde se muestra la morfología para polvos sintetizados con urea y ácido cítrico como combustible, respectivamente, modificando la proporción de combustible.
En el caso de utilizar U1 (Figura 3a), se observó una partícula amorfa de gran tamaño, mayor a 500 µm, con la presencia de pequeños aglomerados sobre ella, además se aprecia una superficie plana con círculos concéntricos en diferentes áreas, probablemente debido al proceso simultáneo de solidificación y desprendimiento de gases durante la síntesis. Cuando se empleó U2, Figura 3b, se aprecia un cambio en la morfología, apareciendo una serie de partículas más definidas, y un poco afiladas de tamaños que van de 10 a 70 µm. Al incrementar la proporción de combustible, Figuras 3 d, e y f, se encontraron partículas entre 30 µm y 200 µm con una morfología similar.
Un caso particular y único es el de U4, en donde bajo estas condiciones las partículas del polvo cerámico muestran en su mayoría una morfología porosa, apreciándose partículas de 140 µm, con macroporos entre 1-10 µm, (Figura 3d).
La formación de poros se atribuye a reacciones a nivel local, que se conectan entre sí, por pequeños intersticios entre unidades de combustible, formando paredes porosas. Se asume que las reacciones rápidas, podrían formar pequeños cúmulos de polvos cerámicos.
En los casos en que se utilizó en la síntesis ácido cítrico como combustible, se encontraron morfologías diferentes a las observadas en los experimentos en los que se empleó urea. Para cuando se utilizó ácido cítrico la morfología fue muy similar en todos los ensayos observando la formación de partículas individuales, bien definidas, con poca presencia de aglomerados, de tamaños que van de 5 µm a 30 µm. Estos resultados indican que el efecto de la cantidad de combustible en la morfología de la partícula no es significativa (Figuras 4 a, b y c).
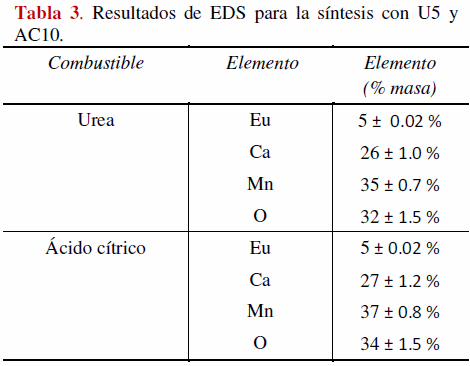
Al realizar un análisis semicuantitativo mediante EDS en 5 diferentes sitios de la superficie de la solución sólida, se obtuvo un 5% +/-0.02% en peso de europio, lo cual demuestra en primer lugar la homogeneidad de la muestra y en segundo, la presencia de este elemento en el cerámico sintetizado en la proporción deseada (ver tabla 3 en donde se hace la comparación cuando se utilizan los dos combustibles estudiados en las proporciones que mostraron mejores rendimientos de reacción).
El estudio cristalográfico de todas las soluciones sólidas obtenidas presentaron dos fases, ortorrómbica y tetraédrica como se puede apreciar en la Figura 5. Para todas las soluciones sólidas obtenidas, la fase tetraédrica fue mayoritaria. Sólo se comparan los difractogramas obtenidos al utilizar los dos combustibles (los más característicos) cuando n =1 y 5.
En ningún caso se detectó la presencia de óxidos de europio. La altura y ancho de los picos son similares, indicando que el tamaño de la cristalita es muy semejante. Además la posición de los picos está ligeramente desplazada hacia los valores inferiores de 2θ por lo que para este caso, se asume que los iones europio alteraron la distancia intereticular de las fases presentes.
Se hizo una revisión de las bases de datos de difracción existentes, pero no se encontraron datos correspondientes a las manganitas de calcio europio sintetizadas en este trabajo, por lo que al no encontrar en el análisis cristalográfico señales de óxidos de europio, se considera que este elemento se encuentra alojado dentro de la red cristalina de la manganita obtenida, la existencia de este elemento dentro del material quedó corroborada mediante EDS.
Un aspecto importante de resaltar es el hecho de que cuando se utilizaron de 1 a 5 proporciones de urea (U1 – U5) se observó que la intensidad de la fase con estructura tetraédrica tiende a incrementar, deteniéndose a una proporción máxima de U5. El mismo fenómeno se observa al utilizar el ácido cítrico en las mismas proporciones de síntesis.
Por otra parte, en trabajos previos Santiago y colaboradores realizaron un estudio mediante resonancia paramagnética electrónica (RPE) para esta solución sólida, también con la presencia de las fases ortorrómbica y tetraédrica, ésta última como fase mayoritaria (Eu0.05Ca0.95MnO3-δ), fue posible determinar la influencia que tiene el europio al sustituir algunos sitios del calcio dentro de la estructura de la manganita y el tipo de fases presentes, lo cual los autores asumen que se originó una modificación de la estructura electrónica y por consecuencia una valencia mixta del manganeso, induciendo así una interacción de doble intercambio, pero que además permitió comprobar la presencia del elemento Eu dentro de los polvos obtenidos [24].
Es posible entonces asumir la creación de una valencia mixta del manganeso en todas las soluciones sólidas obtenidas, fenómeno atribuido a la presencia de las fases ortorrómbica y tetraédrica de la manganita.
4. CONCLUSIONES
A partir del método de combustión se obtuvieron polvos cerámicos de manganitas de calcio dopadas con europio de estequiometria ideal Eu0.05Ca0.95MnO3-δ. De los combustibles evaluados en este trabajo, el ácido cítrico demostró tener menores rendimientos, ya que se obtuvieron porcentajes de 89 cuando se utilizó AC10, comparado con un rendimiento del 100% para cuando se utilizó urea en una proporción de combustible n = 5. Los tamaños de partícula más pequeños con D50 igual a 6 µm se obtuvieron al utilizar AC1, en comparación con 21.91 µm al trabajar con urea, a la misma concentración. El uso de estos combustibles proporcionó polvos de morfología diversa, destacando superficies planas, porosas y presencia de acículas. Los análisis de DRX mostraron la presencia de dos fases de la manganita: ortorrómbica y tetraédrica; predominando la fase tetrahedrica para todos polvos obtenidos. Al utilizar ambos combustibles en proporciones superiores a 5, la fase ortorrómbica tiende a incrementar muy ligeramente. No se detectó la presencia de óxidos de europio, lo cual apoya la hipótesis de que el europio se encuentra alojado dentro de la red cristalina, lo cual fue corroborado por EDS. Se logró comprobar que el tipo de combustible utilizado tiene gran influencia en los resultados obtenidos, tanto en el rendimiento de las reacciones, como en la morfología y en el tamaño de partícula. Adicionalmente se concluyó que la aplicación de baño ultrasónico, es determinante para la evaluación del tamaño de partícula (ATP), ya que permite la separación de los aglomerados.
5. AGRADECIMIENTOS
Los autores agradecen el apoyo del Consejo de Ciencia y Tecnología del Estado de Hidalgo por los apoyos recibidos mediante el proyecto FOMIX No. 129910.
6. REFERENCES
1. Yang Q. Advantages and Disadventages of Sol – Gel Processing. Tesis de doctorado, Universidad de Columbia Británica, Canadá, 1999. [ Links ]
2. Schwars JA, Contescu C. Chemical Reviews. 1995; 95: 482 – 483. [ Links ]
3. Cortés Escobedo CA, Sánchez de Jesús F, Bolarín Miró AM, Muñoz Saldaña J. Physica Status Solid. 4, 2007; 4: 40 - 54. [ Links ]
4. Bengisu M. Engineering Ceramics, Chapter 2: Production and Properties of Ceramic Powders, Whiskers, Fibers and Single Crystals, Springer Editions, 2001. [ Links ]
5. Patil KC, Aruna ST, Ekambaram S. Current Opinion in Solid State & Materials Science. 1997; 2: 158 – 159. [ Links ]
6. Patil KC, Aruna ST, Mimani T. Current Opinion in Solid State & Materials Science. 2002; 6: 507 – 512. [ Links ]
7. Arnache O, Urquijo J, Molina FJ, Pérez M, Mondragón F, Giratá D. Revista Colombiana de Física. 2006; 38(2): 449-452. [ Links ]
8. Von Helmont R., Wecker J., Holzapfel B., Schultz L., Samwer K. Phys. Rev. Lett 1993; 71(14): 2331. [ Links ]
9. Troyanchuk IO, Samsonenko NV, Szymezak H and Nabialek A. Journal of Solid State Chemistry. 1997; 131: 144-149. [ Links ]
10. Mukovskii YM, Hilscher G, Michor H. Ionov AM, 1998; 83(11): 7163-7165. [ Links ]
11. Oliver FW, Seifu D, Hoffman E, Williams C, Kannan E, Hallen B, and Hinmon C. Journal of Applied, An. Quim. 2006; 102(4): 40 - 45. [ Links ]
12. Briz A, De la Fuente M, Bautista L, Aubouy L, Paz A, García O. Europio: Naturaleza, luminiscencia y aplicaciones, An. Quim. 2006; 102(4): 40 - 45. [ Links ]
13. Costa AC, Tortella E, Morelli MR, Kaufman M, Kiminami RH. Effect of Heating Conditions During Combustion Synthesis on the Characteristics of Ni0.5Zn0.5Fe2O4 Nanopowders. Journal of Materials Science. 2002; 37: 3569 – 3572. [ Links ]
14. Cordier A, Peigney A, De Grave E, Flahaut E. Journal of the European Ceramic Society. 2006; 26: 3099 – 3111. [ Links ]
15. Patil K.C. Bulletin of Material Science. 1993; 16: 533. [ Links ]
16. Legorreta-Garcia F, Peigney A, Laurent Ch. Tetragonal-(Zr,Co)O2 solid solution. Materials Research Bulletin. 2008; 43: 3088–3099. [ Links ]
17. Legorreta-Garcia F, Gonzaga de Resende V, De Grave E, Peigney A, Bernabe A, Laurent Ch. Materials Research Bulletin. 2009; 44: 1301– 1311. [ Links ]
18. Resende, VG, Legorreta-Garcia F, Peigney A, De Grave E, Laurent Ch. Journal of Alloys and Compounds. 2009; 471: 204–210. [ Links ]
19. Jain SR, Adiga KC, Pai Verneker VR. Combust. Flame 1981; 40: 71. [ Links ]
20. Zhang Y, Stangle GC. J. Mater. Res 1994; 9: 1997–2004. [ Links ]
21. Costa AC, Tortella E, Morelli MR, Kaufman M, Kiminami RH. Journal of Materials Science, 2002; 37: 3569 – 3572. [ Links ]
22. Carp O, Patron L, Brezeanu M. Journal of Thermal Analysis and Calorimetry, 1999; 56: 561 – 568. [ Links ]
23. Biamino, S. and Badini, C. Combustion synthesis of lanthanum chromite sartting from water solutions: investigation of process mechanism by DTA-TGA-MS. J. Eur. Ceram. Soc 2004; 24: 3021-3034. [ Links ]
24. Santiago M, Hernández-Cruz LE, Montiel H, Flores González MA. Superficies y Vacío, 2010; 4(23): 25-30. [ Links ]