Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Latinoamericana de Metalurgia y Materiales
versión impresa ISSN 0255-6952
Rev. LatinAm. Metal. Mater. v.32 n.2 Caracas dic. 2012
Métodos para preparar hidrogeles químicos y físicos basados en almidón: Una revisión
Diana Soto*, Haydée Oliva*
Laboratorio de Polímeros y Reacciones, Escuela de Ingeniería Química, Universidad del Zulia, Zulia, Venezuela.
* e-mail: dsoto@fing.luz.edu.ve, holiva@fing.luz.edu.ve
RESUMEN
Los hidrogeles de almidón nativo, de sus componentes puros (amilosa y amilopectina) y de sus derivados, pueden resultar más atractivos para algunas aplicaciones que los hidrogeles sintéticos, debido principalmente a su biodegradabilidad. En este artículo, se resumen algunos métodos para la preparación de hidrogeles físicos y/o químicos a partir de almidón. Para la producción de hidrogeles físicos, se presentan estrategias basadas en interacciones de tipo hidrófobas, de carga, por enlaces de hidrógeno y por estereo-acomplejamientos. Para la preparación de hidrogeles químicos se analizan la copolimerización por injerto vía radicales libres de monómeros vinílicos, inducida por radiación o por iniciadores químicos y se incluyen las distintas vías empleadas para lograr el entrecruzamiento químico y/o físico. Adicionalmente, se introduce la producción de hidrogeles nanocompuestos, como una alternativa para la generación de materiales con propiedades mejoradas.
Palabras Claves: almidón, hidrogeles, entrecruzamiento, copolimerización por injerto
Methods for preparation of chemical and physical hydrogels based on starch: A review
ABSTRACT
Hydrogels from native starch, from its pure components (amylose and amylopectin) and from its derivatives are more attractive for some applications than synthetic hydrogels, mainly due to its biodegradability. In this work, some chemical and physical methods for hydrogels preparation are summarized. For the production of physical hydrogels, different strategies are presented based on hydrophobic interactions; charge interactions, hydrogenbonding and stereo-complexation. For the preparation of chemical hydrogels, the free radical grafting copolymerization of vinyl monomers induced by radiation or by chemical initiators is analyzed. Also, different ways for producing physical and chemical crosslinking are included. Furthermore, the production of hydrogelsnanocomposites is introduced as an alternative way to generate materials with improved properties.
Keywords: Starch, hydrogels, crosslinking, graft copolymerization
Recibido: 22-06-2011; Revisado: 15-09-2011 Aceptado: 13-11-2011; Publicado: 21-11-2011
1. INTRODUCCIÓN
Cuando los homo-o copolímeros hidrófilos se entrecruzan, química o físicamente, se forman redes tridimensionales que se hinchan en agua. Los hidrogeles pueden absorber desde 10 a 20% (un límite inferior arbitrario) hasta miles de veces su peso seco en agua. Cuando el contenido de agua excede de 100% se denominan hidrogeles superabsorbentes. [1,2].
El entrecruzamiento químico involucra la formación de enlaces covalentes entre las cadenas y puede lograrse empleando monómeros multifuncionales a bajas concentraciones o mediante el acoplamiento de radicales generados por radiación. En contraste, el entrecruzamiento físico se debe a interacciones secundarias no covalentes como enlaces de hidrógeno, interacciones electrostáticas, fuerzas hidrófobas o interacciones dipolo-dipolo [3,4].
Los hidrogeles de los polímeros naturales, especialmente los polisacáridos, han sido muy utilizados en los últimos años debido a sus ventajas únicas. En general, los polisacáridos son inocuos, abundantes y biocompatibles. Sin embargo, como se disuelven total o parcialmente en agua, no pueden formar hidrogeles estables.
El almidón es uno de los biopolímeros más abundantes y económicos. Se presenta en la naturaleza en forma de partículas discretas o gránulos, con diámetros en el intervalo de 2 a 100 µm. Está compuesto por dos homopolímeros de Dglucosa: la amilosa, un polímero lineal formado por unidades de α-D-glucopiranosa, unidas casi exclusivamente por enlaces α(1
→4); y la amilopectina, que presenta, además de las uniones α(1→4), uniones α(1→6) en las cuales se ramifica la estructura. La masa molar de la amilosa está en el intervalo de 105 a 106 g/mol. La amilopectina presenta una masa molar 1000 veces mayor, entre 107 y 109 g/mol y está ramificada cada 20-25 unidades de α-D-glucosa (ver Figura 1).Las principales fuentes para la producción de almidón a nivel comercial son la papa, el trigo, el maíz y el arroz.
La mayoría de estos almidones contiene de 20 a 30 % de amilosa, siendo el resto amilopectina y componentes minoritarios (menos del 1 %) tales como lípidos y proteínas. También se han usado a escala comercial y/o estudiado almidones provenientes de otras fuentes como yuca [5], el amaranto [6], el mango y el plátano [7], entre otros.
La aplicación del almidón como plástico biodegradable está restringida por su alta afinidad por el agua, su limitada procesabilidad y su baja solubilidad en los disolventes orgánicos comunes. Los almidones modificados física y químicamente, con propiedades mejoradas, son cada vez más importantes, no sólo por su bajo costo y numerosas aplicaciones industriales, sino principalmente por su biodegradabilidad. Un método efectivo para preparar hidrogeles a partir de polisacáridos, consiste en sintetizar redes híbridas entrecruzando las cadenas de polisacáridos con polímeros sintéticos.
La copolimerización por injerto se ha usado extensivamente en la modificación del almidón. Mediante copolimerización vía radicales libres, se han sintetizado copolímeros de injerto, tales como almidón-g-poli(ácido acrílico) (Alm-g-PAAcr), almidón-g-poli(acrilamida) (Alm-g-PAA) y almidón-g-poli(estireno).
En este artículo, se presenta una revisión de algunas estrategias para la preparación de hidrogeles basados en almidón, con potenciales aplicaciones en numerosas áreas, tales como medicina, farmacia, agricultura y protección ambiental. La Figura 2 resume las diferentes vías que pueden abordarse para la transformación del almidón en un hidrogel.
2. HIDROGELES POLIMÉRICOS. GENERALIDADES
La naturaleza hidrófila de los hidrogeles se debe a la presencia de grupos como hidroxilo (-OH), carboxilo (–COOH), amida (-CONH2) y sulfónico (SO3H), a lo largo de las cadenas poliméricas.
Cuando un hidrogel se somete a secado, el agua se evapora causando el colapso de la estructura. El gel pasa de un estado expandido, de máximo hinchamiento, a un estado colapsado con la consiguiente expulsión del disolvente. Este proceso es reversible [4].
En el estado seco, denominado xerogel, el gel es un material sólido, pero en presencia de agua se expande hasta alcanzar el hinchamiento en el equilibrio [4]. Este último estado resulta de un balance entre las fuerzas osmóticas que causan que el agua penetre entre las cadenas del polímero hidrófilo y las fuerzas cohesivas existentes entre estas cadenas que oponen resistencia a la expansión. Durante el hinchamiento, las cadenas que conforman la red se estiran. Simultáneamente aparece una fuerza retráctil en oposición al proceso de hinchamiento, ejercida por las cadenas de la red sobre el disolvente contenido en ella. El hinchamiento alcanza su valor máximo, o de equilibrio, cuando se obtiene un balance entre ambas fuerzas [2,3].
El proceso de difusión puede modelarse mediante el valor del número difusional de Deborah (De), que se define como la relación entre el tiempo de relajación característico del polímero y el tiempo de difusión característico del penetrante. Dependiendo del valor de De, la difusión puede ser clasificada como Fickiana o anómala [4].
Para determinar la naturaleza del mecanismo de transporte, las curvas de hinchamiento pueden ser ajustadas a la ecuación exponencial propuesta por Ritger y Peppas

donde Qt / Q∞ es la absorción fraccional de agua por parte del polímero, t es el tiempo, k es una constante característica del sistema y n es un exponente característico del modo de transporte del penetrante. El número de Deborah determina la forma de la curva de hinchamiento. [4].
Cuando la relajación es mucho más rápida que la difusión (De » 1) el valor de n es igual a 0.5 indicando un mecanismo de transporte Fickiano. Sí De « 1 la difusión es más rápida que la relajación, el transporte parece Fickiano, pero con una velocidad más lenta. Cuando De ~ 1, n varía entre 0.5 y 1, el hinchamiento es anómalo y la captación de agua o su liberación son controlados simultáneamente por los procesos de relajación y difusión. [4].
Los factores determinantes del grado de hinchamiento son la hidrofilia de las cadenas poliméricas y la densidad de entrecruzamiento, aunque también influyen la tacticidad y la cristalinidad. Se puede preparar hidrogeles que responden a diversos estímulos, incorporando algún comonómero estímulo-respuesta ya sea en el esqueleto o como grupos colgantes en la estructura de la red. Estos materiales poseen la habilidad de hincharse, encogerse, enrollarse o hasta degradarse en respuesta a una señal determinada y se conocen como hidrogeles inteligentes [8, 9].
Los estímulos externos que comúnmente causan el cambio abrupto en el volumen del hidrogel son: pH, temperatura, fuerza iónica, tipo de sal, campos eléctrico o magnético, radiación electromagnética y radiación ultrasónica. Además de controlar la cinética de hinchamiento, los estímulos pueden causar cambios estructurales en la red polimérica, modificar la permeabilidad o la fuerza mecánica del hidrogel [9,10].
En la fabricación de hidrogeles se han empleado diversos polímeros naturales solubles en agua que incluyen los polinucleótidos, los polipéptidos y los polisacáridos. Los hidrogeles naturales se preparan por entrecruzamiento químico o físico de estos polímeros. El entrecruzamiento químico de polisacáridos (almidón, alginato, quitina, quitosano, celulosa, oligopéptidos y ácido hialurónico) y proteínas (albúmina y gelatina) conduce a una gran variedad de hidrogeles bien definidos [3].
Los hidrogeles se sintetizan típicamente mediante alguno de estos procedimientos generales: (i) polimerización de monómeros hidrófilos con entrecruzamiento simultáneo o vía postpolimerización y (ii) modificación del carácter hidrófilo de polímeros con propiedades potenciales como hidrogel [8].
El método empleado normalmente para preparar hidrogeles es la copolimerización por injerto, vía radicales libres, de monómeros vinílicos hidrófilos de bajo peso molecular, en presencia de un agente entrecruzante polimerizable. En la síntesis, junto a los elementos habituales de cualquier reacción de polimerización, tales como disolvente, monómero o comonómeros e iniciador, se incorpora normalmente un monómero bifuncional para entrecruzar las cadenas poliméricas [11].
Los agentes entrecruzantes son compuestos multifuncionales que pueden contener por ejemplo: (i) mínimo dos dobles enlaces polimerizables; (ii) al menos un doble enlace polimerizable y un grupo funcional reactivo con el monómero; (iii) al menos dos grupos funcionales reactivos con el monómero y (iv) metales polivalentes capaces de formar entrecruzamientos iónicos [12].
El entrecruzamiento de polímeros produce diferentes tipos de redes poliméricas. Las redes interpenetradas (IPNs) son mezclas de dos redes poliméricas diferentes, sin enlaces covalentes entre las dos redes. Un tipo especial de IPNs son las denominadas redes semi-interpenetradas (semi-IPNs); en este caso, uno de los polímeros no se entrecruza químicamente y se encuentra en forma de cadenas lineales que interpenetran a la red formada por el otro polímero [13].
3. SÍNTESIS DE HIDROGELES BASADOS EN ALMIDÓN
Dada la naturaleza hidrofílica de sus componentes, los almidones nativos presentan una capacidad de absorción de agua elevada, con la desventaja de que el hinchamiento (gelatinización) ocurre solo en agua caliente. Cuando las moléculas de almidón se calientan en exceso de agua, su estructura cristalina se rompe y las moléculas de agua se unen con los grupos hidroxilo de la amilosa y de la amilopectina mediante enlaces de hidrógeno, causando un incremento en la solubilidad e hinchamiento del gránulo. La extensión de esta interacción está influenciada por la relación amilosa/amilopectina presente en el almidón, por la conformación y distribución de masas molares de ambos componentes y por el grado y longitud de las ramificaciones de la amilopectina [14].
La amilosa tiene el rol principal en la restricción del hinchamiento inicial, el hinchamiento procede más rápido una vez que ésta comienza a lixiviar. Los gránulos hinchados se hacen más susceptibles a la desintegración por corte, liberan material soluble mientras se rompen, aumentando así la solubilidad del almidón y por tanto su reactividad [14]. Este fenómeno se denomina gelatinización y comienza en las áreas intergranulares donde los enlaces de hidrógeno son más débiles. Durante el hinchamiento los gránulos de almidón se hacen más susceptibles a la desintegración por agitación. Las fuerzas de enlace en el gránulo también se hacen más débiles durante el calentamiento, incrementando la posibilidad de ruptura térmica o mecánica del gránulo [15].
El enfriamiento de la pasta de almidón gelatinizado propicia la formación de interacciones moleculares (enlaces de hidrógeno entre las cadenas de almidón), causando inicialmente la expulsión de agua (sinéresis), seguido de la cristalización de la amilosa. Esta transición de la amilosa amorfa a otra parcialmente cristalina es irreversible y se denomina retrogradación [14].
La reactividad química del almidón está controlada principalmente por la reactividad de sus residuos de glucosa [16] (Figura 3). Las cadenas normales de amilosa contienen un grupo terminal –OH (C1) en el extremo reductor y un –OH (C4) en el extremo no reductor de la macromolécula. Así, cada residuo de glucosa de la amilosa posee dos grupos hidroxilo secundario, en los carbonos C2 y C3, y un grupo hidroxilo primario en el carbono C6.
La reactividad de los grupos hidroxilo depende de factores electrónicos y conformacionales, incluyendo la disponibilidad estérica para los reactantes y/o la posibilidad de competencia de las reacciones de β-eliminación. Mediante cálculos basados en la Teoría del Orbital Molecular, realizados para los confórmeros de la Dglucopiranosa, se encontró que la acidez de los grupos OH disminuye en el orden siguiente: -OH en C3 > -OH en C2 > -OH en C6 [16].
Todos los grupos hidroxilo de la amilosa y la amilopectina potencialmente disponibles, exhiben la reactividad específica de los alcoholes. Esto indica que pueden ser oxidados y reducidos, pueden participar en la formación de enlaces de hidrógeno, y sus átomos de hidrógeno son susceptibles a intercambios isotópicos H-D. Estos grupos también pueden formar sales y participar en la formación de éteres y ésteres. Los últimos pueden formarse tanto con ácidos orgánicos como inorgánicos, incluyendo también derivados acílicos como halogenuros, anhídridos, etc.
El grupo hemiacetal terminal reductor en cada molécula de amilosa y amilopectina, reacciona de manera similar a los aldehídos y sus hemiacetales, siendo el sitio reactivo el átomo de carbono anomérico C1. Así, estos polisacáridos pueden reducirse y oxidarse en esa posición, y pueden también formar derivados con los compuestos del tipo NH2-X (hidracina, fenilhidracina, hidroxilamina).
El átomo de oxígeno del anillo de piranosa del grupo terminal reductor de la glucosa, exhibe reactividad típica por su participación en un hemiacetal, y es susceptible a la protonación, generando el grupo –OH en C5 del sacárido de cadena abierta.
Los enlaces glucosídicos exhiben reactividad típica de los enlaces acetálicos C-O-C, esto implica que experimentan ruptura en la protonación. Bajo condiciones ácidas ocurre la ruptura aleatoria de enlaces, estando favorecidos significativamente los enlaces terminales glucosídicos por encima de aquellos dentro de las cadenas. Tal ruptura del enlace glucosídico (hidrólisis del almidón) incrementa el número de grupos –OH en C1, C4 y C6 libres, y conduce finalmente a la D-glucosa [16].
3.1 Hidrogeles Físicos
Los hidrogeles se denominan físicos o reversibles cuando las redes se mantienen unidas por enredamientos moleculares y/o interacciones fisicoquímicas secundarias como: interacciones hidrófobas, condensación de cargas, enlaces de hidrógeno, estereo-acomplejamientos, o química supramolecular [13].
A pesar de su debilidad, estas interacciones son muy numerosas y su contribución a lo largo de toda la cadena polimérica da lugar a comportamientos muy complejos. Debido a que dependen de estímulos externos como el pH, la fuerza iónica, la composición del disolvente o la temperatura, permiten gran versatilidad en el comportamiento de los hidrogeles frente al medio, a diferencia de los materiales enlazados covalentemente. Las condiciones del entorno son las responsables de que predominen las fuerzas atractivas o repulsivas, produciéndose el colapso o el hinchamiento del gel. Estas estructuras supramoleculares locales se deben a combinaciones de múltiples interacciones secundarias no covalentes, las cuales permiten superar la disminución entrópica asociada con la organización [4].
Los hidrogeles físicos no son homogéneos ya que presentan clusters de enredamientos moleculares o dominios asociados, hidrófoba o iónicamente, que causan heterogeneidad [1].
3.1.1 Interacciones Hidrófobas
Los polímeros con dominios hidrófobos pueden entrecruzarse en ambientes acuosos mediante gelación térmica reversa, también conocida como química sol-gel. En la gelación hidrófoba, un gelador (segmento hidrófobo) se acopla al segmento de polímero hidrófilo mediante postcopolimerización por injerto, o directamente a través de un copolímero dibloque anfifílico.
Estos copolímeros anfifilos son solubles en agua a baja temperatura, pero al aumentar la temperatura los dominios hidrófobos se agregan para minimizar el área superficial de contacto con el agua, reduciendo la cantidad de agua estructurada y maximizando la entropía del disolvente. La temperatura a la cual ocurre la gelación depende de la concentración de polímero, la longitud de los bloques hidrófobos y la estructura química del polímero [13]. En la Figura 4 se esquematiza este tipo de interacciones.
Chen et al. [17], sintetizaron un copolímero de injerto de almidón con un monómero hidrófobo, Lláctido (LLA). Primero, modificaron la superficie de almidón por reacción de los grupos hidroxilo con ácido L-láctico. Luego sintetizaron el Alm-g-PLLA mediante polimerización por apertura de anillo (ROP) del LLA producido sobre la superficie modificada de los gránulos de almidón, utilizando 2etil hexanoato estañoso (Sn(Oct)2) como catalizador. El Alm-g-PLLA presentó una estructura core-shell, con un núcleo de almidón hidrófilos y una coraza de PLLA hidrófoba que inhibe el hinchamiento del almidón. Esta membrana de Alm-g-PLLA puede emplearse para encapsular urea u otros fertilizantes y herbicidas ya que la matriz modificada hidrófobamente liberará lentamente el fertilizante durante el riego y los períodos de lluvia.
3.1.2 Interacciones de Carga
El entrecruzamiento (o desentrecruzamiento) puede lograrse in situ por cambios de pH que producen la ionización o protonación de grupos funcionales iónicos y que causan la gelación. Las interacciones de carga pueden darse entre un polímero y una molécula pequeña o entre dos polímeros de carga opuesta para formar un hidrogel [13]. La Figura 5 ilustra esta clase de asociaciones.
Cuando un polielectrolito se combina con un ión multivalente de carga opuesta, se produce un gel físico conocido como hidrogel ionotrópico [1].
Si se mezclan dos polielectrolitos de cargas opuestas, estos pueden gelificar o precipitar dependiendo de su concentración, fuerza iónica y pH de la solución; el producto se denomina complejo coacervado o poliiónico. En un trabajo pionero [1] se estabilizaron cápsulas de alginato de calcio, recubriéndolas con un complejo coacervado de alginato-poli(L-lisina).
Los copolímeros de injerto de almidón con monómeros ácidos neutralizados generan almidones aniónicos que pueden gelificar mediante interacciones de carga. Prado et al. [18] reportaron la formación de un complejo interpolielectrolito (IPEC) novel entre almidón de maíz cationizado mediante la introducción del grupo 2-hidroxi-3(N,N,N-trimetilamonio)propilo y carragenina tipo kappa como contrapolianión. Cabe señalar que la carragenina está formada por unidades de galactosa y/o de anhidrogalactosa, sulfatadas o no, unidas por enlaces alternos α(1-3) y β(1-4). El tipo kappa está formado por unidades alternas de galactosa con un grupo sulfato en el carbono 4 y unidades de anhidrogalactosa sin sulfatar.
La caracterización del producto por mediciones de turbidez y análisis elemental indicó interacciones 1:1 de las unidades repetitivas. Comprobaron la formación del IPEC por el desplazamiento de las bandas correspondientes a los grupos sulfato de la carragenina y de los enlaces C-N del almidón catiónico, lo cual atribuyeron a las interacciones iónicas entre los grupos sulfato y los grupos amonio cuaternario. El hinchamiento de tabletas de IPEC obtenidas por compresión directa fue independiente del pH y presentó un valor máximo de 742 % luego de 24 h. Durante los ensayos de hinchamiento las tabletas de IPEC mantuvieron su integridad indicando la formación de una estructura tipo hidrogel.
3.1.3 Interacciones por Enlaces de Hidrógeno
Las interacciones por enlaces de hidrógeno se pueden emplear para producir hidrogeles in vitro por ciclos de congelamiento-descongelamiento.
Xiao y Yang [19], prepararon hidrogeles de un copolímero de injerto almidón-g-poli(alcohol vinílico) (Alm-g-PVA) entrecruzados físicamente. En primer lugar, injertaron poli(acetato de vinilo) (PVAc) sobre almidón mediante copolimerización radicalaria iniciada por persulfato de potasio (K2S2O8). El peso molecular del PVAc injertado fue controlado usando un agente de transferencia de cadena (metanol o etanol). El Alm-g-PVA se obtuvo por alcohólisis del Alm-g-PVAc, empleando una solución al 5 % de NaOH en metanol. Finalmente, prepararon los hidrogeles sometiendo una solución acuosa de Alm-g-PVA (10 % m/m) a varios ciclos de congelamiento-descongelamiento, durante 24 h a -16 ºC y por 5 h a temperatura ambiente. En este trabajo, obtuvieron hidrogeles de Alm-g-PVA suaves y elásticos, mientras que el almidón puro, sometido al mismo tratamiento de congelamientodescongelamiento, no gelificó. El proceso de gelación in vitro produjo una red porosa en la cual los dominios cristalinos de PVA actuaron como puntos de unión. La relación de hinchamiento de los hidrogeles aumentó con el incremento del peso molecular del PVA injertado y disminuyó con el aumento del número de ciclos congelamientodescongelamiento, debido a la mayor formación de entrecruzamientos físicos como resultado de la cristalización del PVA.
Yoshimura et al. [20], prepararon hidrogeles biodegradables mediante un procedimiento simple: esterificaron almidón con anhídrido succínico (SAnh), utilizando 4-dimetilaminopiridina como catalizador y dimetilsulfóxido (DMSO) o agua como disolvente, seguido de neutralización con NaOH, diálisis y precipitación con metanol. Estos hidrogeles se obtuvieron en ausencia de entrecruzante. Los autores presumen que la gelación ocurrió debido a la agregación de las cadenas de polímero por la regeneración de los enlaces de hidrógeno durante la diálisis.
3.1.4 Estereo-acomplejamiento
El término estereo-acomplejamiento se refiere a las interacciones que pueden darse entre cadenas poliméricas, o moléculas pequeñas, de la misma composición química pero diferente estereoquímica.
Los polímeros naturales pueden entrecruzarse mediante injerto estereo-acomplejante. El injerto de oligómeros de L-láctido y D-láctido sobre dextrano induce la gelación espontánea en agua [13]. El dextrano es un polisacárido similar a la amilopectina, que consiste en cadenas de glucosa muy ramificadas, cuyo enlace predominante es α(1→6) con ramificaciones α(1→3) y α(1→ 4). Dada la similitud estructural, es posible que se presente también este tipo de gelación en el almidón.
Estos hidrogeles muestran biocompatibilidad y biodegradabilidad excelentes, no requieren el uso de disolventes orgánicos, entrecruzantes químicos o formación de dominios hidrófobos. Presentan la limitante respecto a la composición en el cual pueden usarse; pequeños cambios en la estequiometría pueden debilitar o eliminar la interacción estereoquímica [13].
Algunos hidrogeles físicos han encontrado aplicaciones interesantes. Por ejemplo, Mehyar et al. [21] investigaron dos hidrogeles físicos (uno basado en almidón con enlaces de hidrógeno y otro basado en alginato de calcio, con interacciones iónicas), como posibles sustratos para agentes antimicrobianos. En estos sistemas, la difusividad dependió del par hidrogel-agente, teniéndose las más altas con las siguientes combinaciones: fosfato trisódico-hidrogel de almidón y clorito ácido de sodio-hidrogel de alginato.
3.2 Hidrogeles Químicos
Los hidrogeles se denominan químicos o permanentes cuando consisten de redes entrecruzadas covalentemente. Al igual que los hidrogeles físicos, los hidrogeles químicos no son homogéneos. Generalmente contienen regiones de alta densidad de entrecruzamiento y bajo grado de hinchamiento (clusters), dispersas en las regiones de baja densidad de entrecruzamiento y alto índice de hinchamiento. La presencia de estos clusters se debe a la agregación hidrófoba del agente entrecruzante. En algunos casos, dependiendo de la composición, del disolvente, la temperatura y la concentración de sólidos durante la gelación, puede ocurrir separación de fases formándose macroporos [13].
La incorporación de poliacrilatos en los biopolímeros y, específicamente, el injerto de monómeros acrílicos sobre almidón, da lugar a propiedades combinadas como la biocompatibilidad, atoxicidad y buena adhesión. Por otra parte, el almidón es más económico y más biodegradable que los polímeros vinílicos. Estas características han hecho realmente atractiva la producción de nuevos materiales preparados por esta vía.
Durante la irradiación de sistemas acuosos de almidón, se forman radicales sobre la cadena del polisacárido mediante la escisión homolítica de los enlaces C-H. La descomposición por radiación de las moléculas de agua genera radicales hidroxilo (OH) que abstraen hidrógenos de las cadenas de almidón (Alm), formando así los radicales de almidón (Alm0 ). En el caso de las copolimerizaciones, también se producen homoradicales (Mn). Cuando un homo-radical (M1) se injerta en los sitios activos del Alm0 se forma el macrorradical de injerto (Alm-M1) [5]. Las ecuaciones 2-5 esquematizan las etapas de iniciación por irradiación.
H2O + γ,e → H(ac) + OH(ac) (2)
OH (ac) + M → M1 + H2O (3)
OH (ac) + Alm → Alm0 + H2O (4)
Alm0 +M → Alm-M1 (5)
Como ya se mencionó, en el paso de iniciación también se pueden utilizar iniciadores químicos, que generan radicales cuando se someten a calentamiento o radiación UV.
Los radicales del iniciador (I) pueden reaccionar con el monómero (M) para iniciar su homopolimerización (M1), o extraer el hidrógeno de los –OH reactivos del almidón (Alm) para formar el radical de almidón (Alm0) que al adicionar M, inicia el crecimiento del radical de injerto (AlmM1). Las ecuaciones 6-9 esquematizan las reacciones inherentes a la etapa de iniciación por esta ruta.
I2
→ 2I (6)I +M →
M1 (7)I
+ Alm → Alm0 (8)Alm
0 +M → Alm-M1 (9)La propagación o crecimiento de la especie iniciadora, tiene lugar por la adición sucesiva de moléculas de monómero. Cada adición crea un nuevo radical que tiene la misma identidad que el anterior, con la diferencia de que posee una unidad repetitiva más. Las ecuaciones 10 y 11 representan el paso de propagación para la homo-y copolimerización, respectivamente.
M
n + M → M(n+1) (10)Alm-M
n + M → Alm-M(n+1) (11)Las reacciones de terminación pueden ocurrir por combinación entre dos radicales o por reacciones de transferencia de cadena. En el caso de la terminación por combinación ocurren las siguientes reacciones: (i) la combinación de dos macrorradicales de injerto produce el entrecruzamiento covalente del almidón (ecuación 12). (ii) la combinación de un macrorradical de injerto y un homorradical conduce a la formación del copolímero de injerto (ecuación 13) (iii) la combinación de dos homorradicales resulta en la formación de homopolímero (ecuación 14).
Alm-M
n + Alm-Mm → Alm-M(n+1)-Alm (12)Alm-M
n + Mn → Alm-M(n+m) (13)M
n + Mm → M(n+m) (14)En los mecanismos propuestos en la literatura no se hace mención a las reacciones de transferencia de cadena. Sin embargo, en estos sistemas podría ocurrir la transferencia de cadena al monómero (ecuaciones 15 a 17) y al almidón (ecuaciones 18 a 20). En estas reacciones el radical polimérico sustrae un átomo de una molécula con la formación de un nuevo radical.
M
n +M → Mn+ M1 (15)Alm-M
n +M → Alm-Mn + M1 (16)Alm
o +M → Alm + M1 (17)M
n + Alm → Mn + Almo (18)M
1 + Alm → M + Almo (19)Alm-M
n + Alm → Alm-Mn + Almo (20)En algunos casos, el almidón injertado con monómeros que poseen grupos nitrilo [22], ácido o éster como sustituyentes, se somete a un proceso de saponificación con la finalidad de favorecer el entrecruzamiento iónico a través de la sal que resulta de este proceso.
3.2.1 Copolimerización por Injerto y Entrecruzamiento por Irradiación
La irradiación en solución se prefiere, debido a que requiere menos energía para formar un macrorradical y la eficiencia de los radicales es mayor debido a la reducción de la viscosidad de la mezcla de reacción [3].
El procedimiento en las polimerizaciones en solución [5, 23-27] generalmente es el siguiente: en primer lugar el almidón se pregelatiniza en agua caliente, la pasta de almidón pregelatinizado se enfría hasta temperatura ambiente, se adiciona una cantidad predeterminada de monómero y se agita a baja velocidad, a temperatura ambiente, durante 1030 min. La mezcla almidón pregelatinizadomonómero se transfiere a tubos de vidrio y se purga con N
2(g) por 20 min. Transcurrido este tiempo, los tubos se sellan con laminillas de un metal y películas de parafina y se someten a irradiación. El producto de reacción se precipita con un nodisolvente y se seca al vacío por 24 h o hasta peso constante. En caso de obtenerse una mezcla de homo-y copolímero, éstos se separan por extracción con disolventes adecuados y se secan al vacío hasta peso constante para su posterior caracterización.Esta técnica no requiere iniciador, ni agente entrecruzante y puede usarse prácticamente con cualquier monómero vinílico. Tanto la reacción de polimerización, como el entrecruzamiento, pueden iniciarse a temperatura ambiente [8]. El injerto por radiación puede realizarse por pre-irradiación o por radiación simultánea. La radiación ionizante no es selectiva, tiene efecto sobre el sustrato polimérico, el monómero, el disolvente, u otra sustancia presente en el sistema [23].
En su primer trabajo, Kiatkamjornwong
et al. [5], estudiaron el efecto de la radiación sobre las propiedades de retención de líquido del almidón de yuca, pre-gelatinizado a 85 ºC y copolimerizado por injerto con acrilonitrilo (AN) por irradiación γ simultánea. Recubrieron la pared interior del recipiente de reacción con una laminilla de aluminio, reduciendo así la concentración de homopolímero a menos del 1,0 %. El copolímero de injerto saponificado presentó una retención de agua de 665 g/g por peso seco del producto.En un trabajo posterior, Kiatkamjornwong y Meechai [23], mejoraron la técnica anterior, incorporando ácido nítrico al medio de reacción. Con ese cambio, consiguieron aumentar la eficiencia de injerto del AN sobre almidón. Asimismo, estos autores mejoraron la capacidad de absorción de agua por congelamiento-secado del Alm-
g-PAN saponificado (HSPAN). El tratamiento del HSPAN con AlCl3.6H2O aumentó la velocidad de absorción, pero redujo la cantidad de agua absorbida.Continuando con la misma línea de trabajo, Kiatkamjornwong et al. [24, 25] copolimerizaron por injerto acrilamida (AA) y/o AAcr [24] y ácido maleico (MAc) [25] sobre almidón de yuca, mediante la técnica de irradiación γ simultánea, seguida de saponificación alcalina. La mayor absorción de agua (1142 g/g) la obtuvieron con un copolímero de injerto producido con una relación 2:1 de monómero:almidón, una dosis de 6.0 kGy/h y una relación 70:30 de AA:AAcr. La adición de 2 % m/m de un ácido diprótico como el MAc en la mezcla de reacción aumentó la absorción de agua del copolímero saponificado a 2256 g/g. En ambos casos los hidrogeles resultaron sensibles a cambios de pH. Estos investigadores propusieron además, un mecanismo de transferencia de carga para la copolimerización por injerto de MAc y AA sobre almidón.
Ali y AlArifi [28] sintetizaron una serie de copolímeros de almidón/ácido metacrílico (AMAcr) de diferentes composiciones. Tanto la copolimerización como el entrecruzamiento fueron inducidos empleando rayos γ. Investigaron el efecto de las condiciones de preparación sobre el proceso de gelación y encontraron que al incrementar la concentración total de la mezcla de reacción y/o la dosis de irradiación mejora tanto la conversión como el grado de gelación. Obtuvieron materiales superabsorbentes con hinchamiento máximo de 1200 % a las 2 h y resultaron sensibles a los cambios de pH.
Algunos de los hidrogeles sintetizados por irradiación han sido probados en la liberación controlada de fármacos. Eid [29] reportó la producción por irradiación γ de hidrogeles copoliméricos de almidón/AAcr con NVP. Los hidrogeles se cargaron con vitamina B12 y su velocidad de liberación fue dependiente del pH.
En un trabajo más reciente Ghasem et al. [30] sintetizaron hidrogeles nanoporosos de almidón/AAcr vía radiación UV y probaron su efectividad en la liberación controlada de hidrocloruro de tetraciclina en función del pH.
3.2.2 Reacciones de Copolímerización por Injerto con Iniciadores Químicos, Agentes
Entrecruzantes y Saponificación
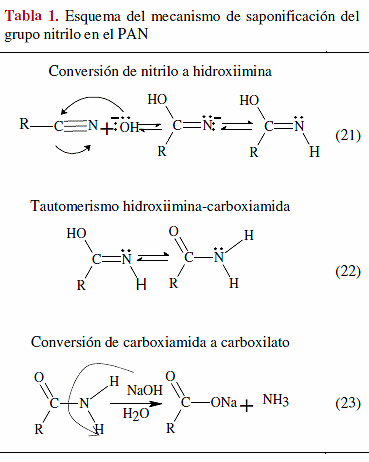
Los hidrogeles basados en copolímeros de injerto de almidón saponificados, son utilizados ampliamente en productos sanitarios como pañales, toallas sanitarias y almohadillas para incontinencia. El primer polímero superabsorbente fue preparado por Taylor y Bagley (1974), mediante saponificación del Alm-g-PAN, seguida de neutralización y secado. Mas adelante, se ha citado a otros investigadores [31] que produjeron materiales absorbentes aplicando el mismo tratamiento químico directamente a maíz entero y a harina de maíz; explicaron que la capacidad de absorción encontrada resulta del entrecruzamiento de la estructura del polielectrolito. Basándose en pruebas de solubilidad, estos autores indicaron que durante la copolimerización por injerto ocurre el entrecruzamiento por el acoplamiento de dos radicales de PAN en crecimiento, mientras que en la saponificación el entrecruzamiento ocurre por ataque del ión alcóxido del almidón sobre los grupos nitrilo. El mecanismo se esquematiza en la Tabla 1. En las primeras etapas de la saponificación se forma una poli(imina) conjugada por la polimerización de los nitrilo. Posteriormente, los enlaces poli(imina) se rompen produciendo una mezcla de carboxamida hidrófila y grupos carboxilato, seguido por un entrecruzamiento in situ de las cadenas de PAN injertadas. Estos investigadores también prepararon polímeros absorbentes por saponificación y neutralización de PAN homopolímero en presencia de almidón y PVA [31].
La facilidad con la cual los monómeros acrílicos polimerizan por injerto sobre almidón, ha capturado la atención de los investigadores a nivel mundial, siendo numerosas las publicaciones en este tema.
La reacción de injerto sobre almidón puede iniciarse por sistemas químicos que incluyen iones de metales de transición como Fe3+, Cu2+, Ce4+, V3+, Mn3+, o sus complejos [23]. Desde que fue descubierto por Mino y Kaizerman (1958) hasta el presente, el nitrato de amonio cérico (CAN) ha sido el iniciador más utilizado, probablemente por su baja energía de activación y por su mecanismo simple que facilita la formación de radicales libres directamente en la cadena de almidón. De esta manera, el CAN reduce la extensión de la reacción de homopolimerización y produce un copolímero de injerto, puro y noentrecruzado, aún a temperatura ambiente [32-35].
En la Tabla 2, se esquematiza el mecanismo de injerto de monómeros vinílicos sobre almidón iniciado con nitrato de amonio cérico [34]. La diferencia con respecto al mecanismo de copolimerización por injerto convencional, radica en que después de la descomposición del complejo almidón-Ce4+, los grupos aldehídicos presentes en el almidón oxidado (ecuación 27) pueden reaccionar con el Ce4+ para generar radicales carbonilo que también pueden iniciar la reacción de injerto (ecuación 28). Es decir, hay dos tipos de radicales sobre la cadena de almidón para iniciar el injerto del monómero vinílico.
En las últimas décadas se han propuesto varios sistemas de iniciación. Por ejemplo, Athawale
et al. [36-38] en sus primeros trabajos señalan el uso de: acetil acetonato de cobre (II)-ácido tricloroacético, persulfato de potasio-sulfito ácido de sodio, pervanadato de potasio, pirofosfato mangánico, trioxalato mangánico de potasio, peroxidisulfato de amonio, peróxido de hidrógeno-sulfato de amonio ferroso, persulfato de potasio, permanganato de potasio-tioacetamida y peróxido de hidrógenosulfato de hierro (II), entre otros.Más recientemente, además del sistema redox CANácido nítrico, diferentes investigadores [30-36] han empleado los siguientes sistemas de iniciación: permanganato de potasio-ácido sulfúrico, monopersulfato de potasio-hierro(II), persulfato de potasio–tiosulfato de sodio, vanadio-ácido mercaptosuccínico, permanganato de potasio-ácido cítrico y los sistemas complejos sulfato cérico– persulfato de amonio y sulfato cérico–persulfato de potasio.
Yamaguchi
et al. [39] copolimerizaron por injerto AN sobre almidón de maíz pregelatinizado empleando el sistema redox CAN-HNO3 como iniciador. Reportaron que cuando el Alm-g-PAN es parcialmente hidrolizado, bajo condiciones ácidas antes de la saponificación, se obtienen hidrogeles con mayor capacidad de absorción (1200 g H2O/g de muestra seca). El copolímero hidrolizado contiene cadenas más cortas de almidón, lo cual es consistente con la idea de que los hidroxilos del almidón están involucrados en el entrecruzamiento. La hidrólisis ácida se realizó con HCl(ac) 1N y la saponificación con NaOH(ac) 0,7N [31].Hashem et.al. [40] sintetizaron hidrogeles mediante la saponificación con NaOH 0,7 N de compositos de PAN y almidón de maíz. El término composito se refiere al material compuesto resultante de la polimerización de AN con almidón en presencia de CAN como iniciador, es decir, el composito consiste de Alm-g-PAN, PAN, almidón oxidado y almidón pregelatinizado sin reaccionar. Los hidrogeles producidos mostraron su máxima absorción de agua cuando se empleó: a) almidón pregelatinizado a 85ºC por 30 min, b) una relación molar AN/almidón de 4,8 y c) una concentración de CAN de 10 mmol/L. La saponificación tuvo lugar a 95ºC por 180 min. El hidrogel obtenido bajo estas condiciones, absorbió 920 g de agua y 38 mL de orina sintética por gramo de producto seco. En base a sus resultados, estos autores afirman que el incremento en la absorción de agua no se debe únicamente a la formación del copolímero de injerto, sino también a los cambios físicos en la estructura del almidón, por efecto de la gelatinización. Como se sabe, el principal cambio físico es un incremento en las regiones desordenadas en los gránulos de almidón, a expensas de las regiones ordenadas. Por tanto, el efecto principal de la gelatinización es el incremento del volumen libre de las cadenas de almidón, que combinado con su hidrofilia, le permite absorber un gran volumen de agua.
En otro trabajo, Tong y Zhang [41] propusieron un método rápido para preparar superabsorbentes a partir de Alm-g-PAN/ ácido 2-acrilamido-2metilpropanosulfónico (AMPS) saponificados. Sintetizaron copolímeros de AN y AMPS sobre almidón, empleando el sistema de iniciación redox pirofosfato mangánico [Mn4(P2O4)3]. Luego el producto se saponificó con KOH, variando la concentración y el tiempo de saponificación. La porción hidrófila del AMPS facilitó la penetración del álcali en el copolímero de injerto, disminuyendo gradualmente el tiempo de saponificación. La máxima absorción de agua fue de 1345 g/g de hidrogel seco. Sin embargo, cuando se usaron cantidades superiores a 6,68 % de AMPS, el copolímero de injerto se hizo soluble.
En una serie de estudios, Athawale et al. [32, 33, 35] injertaron AA y/o AAcr sobre almidón de maíz gelatinizado, empleando CAN como iniciador. En todos los casos saponificaron los copolímeros de injerto con NaOH para producir hidrogeles y sólo cuando trabajaron con la adición simultánea de ambos monómeros, emplearon N,N-metilén bisacrilamida (MBAA) como agente entrecruzante. El hidrogel preparado con AA tuvo un máximo de absorción de tan sólo 170 g/g, debido a que la eficiencia de injerto fue baja. Este resultado lo atribuyeron a la preferencia del monómero por los homorradicales (generados durante la homopolimerización del monómero) respecto a los macrorradicales producidos a partir del almidón. Cuando emplearon AAcr obtuvieron un máximo de absorción de 250 g/g. En este caso, la reacción de injerto procedió en las primeras etapas, pero luego la precipitación del homopolímero impidió la difusión del monómero a los macrorradicales de almidón, dando lugar a bajas eficiencias de injerto. En el caso del injerto simultáneo de los dos monómeros, el hidrogel absorbió un máximo de 510 g H2O/g de producto seco. La absorción de agua aumentó con la adición del entrecruzante a baja concentración (1 %). Este resultado lo explicaron en función de: (a) la formación de copolímero de injerto entrecruzado, lo cual produce una red continua; (b) el entrecruzamiento de los homopolímeros, que también participa en la absorción; y (c) el injerto de MBAA sobre el almidón, que produce un copolímero insoluble. Como era de esperar, cuando incrementaron la concentración de entrecruzante, la capacidad de absorción disminuyó. Es bien conocido, que una estructura rígida, altamente entrecruzada, no puede contener grandes cantidades de agua.
Sadeghi y Hosseinzadeh [42] señalaron algunas desventajas de las polimerizaciones vía radicales libres: baja reproducibilidad, poco control sobre la reacción de injerto, distribución de pesos moleculares ancha. Adicionalmente, requiere de atmósfera libre de oxígeno y del uso de iniciadores, monómeros y entrecruzantes tóxicos y costosos. Con base en estos argumentos, propusieron una optimización del procedimiento de síntesis empleado originalmente hace mas de dos décadas [31,39] para la modificación de almidón con AN y produjeron hidrogeles inteligentes, sensibles a cambios en el pH y a las sales, con una capacidad de absorción de hasta 555 g/g. Para este fin, convirtieron los grupos hidroxilo del almidón a iones alcóxido por la acción de NaOH. Los macroalcóxidos inician la reacción de entrecruzamiento entre las cadenas colgantes adyacentes de poliacrilonitrilo, con la formación de naftiridina como intermediario. Posteriormente, este intermediario es hidrolizado por el NaOH residual para producir grupos carboxamida y carboxilato. Establecieron la estructura del gel por espectroscopia FTIR.
Fares
et al. [43] polimerizaron N-ter-butilacrilamida (BAM) sobre almidón gelatinizado, empleando CAN como iniciador. El Alm-g-PBAM obtenido lo saponificaron con una solución al 5 % de NaOH, para producir hidrogeles termosensibles, los cuales mostraron una retención máxima de humedad de 162 %. Mediante difracción de rayos X detectaron que el injerto ocurre a través de las regiones amorfas (amilosa) y cristalinas (amilopectina). Las micrografías SEM mostraron que el injerto es un fenómeno superficial, es decir, no altera la naturaleza granular del almidón, pero lo hace más compacto y participa en la orientación de la superficie haciendo que algunos gránulos adquieran forma cúbica. Esta observación confirma que las cadenas de polímero sintético rodean y aglomeran los gránulos de almidón formando estructuras tipo bloque.Los copolímeros de injerto Alm-
g-PAA han sido ampliamente estudiados y continuamente se reportan nuevas aplicaciones. Tal es el caso del trabajo de Al-Karawi y Al-Daraji [44], quienes prepararon hidrogeles de Alm-g-PAA con distintos grados de injerto, mediante la variación en la concentración de iniciador. Estudiaron la liberación de ceftriaxona de sodio en agua, en una solución salina y en un buffer de pH=2. Encontraron que el fármaco se liberó gradualmente hasta alcanzar un valor límite, que fue función de la carga inicial de fármaco, de la capacidad de hinchamiento del hidrogel y de la naturaleza del medio de hinchamiento.Como se mencionó antes, el método empleado normalmente para preparar hidrogeles entrecruzados covalentemente, es la copolimerización por injerto, vía radicales libres, de monómeros vinílicos hidrófilos de bajo peso molecular, en presencia de un agente entrecruzante polimerizable [45]. Para entrecruzar metacrilatos, comúnmente se emplea etilenglicol dimetacrilato (EGDMA), para sistemas con AA se usa MBAA; mientras que para los sistemas basados en lactamas, la etilen divinilurea funciona bien. El agente entrecruzante metacriloetil vinil carbonato (MEVC) posee reactividad tanto para los monómeros metacrílicos como para las lactamas vinílicas. La copolimerización de NVP y HEMA con MEVC produce un hidrogel con mayor contenido de agua que el obtenido con el entrecruzante convencional EGDMA, debido a que se favorece una mayor incorporación de NVP en el copolímero [3].
En su revisión, Zhang
et al. [45] reseñan algunos hidrogeles preparados por entrecruzamiento químico de copolímeros de injerto de varios monómeros vinílicos sobre almidón soluble o componentes de almidón (Tabla 3). Asimismo, Mulhbacher et al. [46], reportó la modificación de un almidón rico en amilosa con grupos acetato, aminoetilo y carboximetilo, los cuales fueron entrecruzados con epiclorihidrina.Las mezclas de almidón con otros polímeros también se han utilizado como sustrato en la preparación de hidrogeles. Elvira et al. [47] polimerizaron AA y AAcr sobre una mezcla de almidón con un copolímero de etileno con alcohol vinílico (PE-co-PVA), empleando peróxido de benzoilo (BPO) y alcohol dimetilaminobencílico (DMOH) como sistema de iniciación y MBAA como agente entrecruzante. Este proceso de polimerización produjo una red semi-interpenetrada (semi-IPN), formada por cadenas de copolímero PAAcr-co-PAA injertadas sobre la mezcla de almidón, entrecruzadas químicamente mediante la reacción de la MBAA con la AA. Se obtuvieron hidrogeles con propiedades mecánicas mejoradas, sensibles al pH y con características de hinchamiento interesantes.
Para esclarecer la formación de las redes semi-IPNs, Keshava et al. [48] prepararon hidrogeles por copolimerización de AM y metacrilato de sodio (NMA) sobre almidón, usando el sistema de iniciación redox APS/TEMED. Emplearon tres agentes entrecruzantes diferentes: MBAA, 1,4-butanodiol diacrilato (BDDA) y dialil ftalato (DP). Obtuvieron hidrogeles con alta sensibilidad al pH y a las sales, debido a su carácter iónico. El orden de capacidad de hinchamiento fue DP > BDDA > MBAA. Puesto que la MBAA es completamente soluble en el medio de reacción y posee la mayor reactividad, forma redes altamente ordenadas que limitan la entrada de agua. En el caso del DP, se usó metanol como disolvente, el cual pudo haber actuado como agente porógeno.
Li et al. [49] obtuvieron redes semi-IPNs por polimerización de AAcr en presencia de un almidón catiónico (ALMC) y poli(cloruro de metacriloiloxietil trimetilamonio) (PDMC). Se correlacionó la concentración de entrecruzante y la relación de alimentación ALMC-g-PAA a PDMC con la capacidad de hinchamiento. Las propiedades de los hidrogeles se evaluaron en función del peso molecular crítico Mc, la morfología y ensayos de compresión. Los productos resultantes mostraron buenos compatibilidad, hinchamiento y resistencia mecánica.
Lanthong et al. [50] produjeron hidrogeles superabsorbentes de Alm-g-poli[MAc-co-ácido itacónico(IAc)], empleando el sistema iniciador APS/TEMED y MBAA como entrecruzante. En la polimerización se adicionó bicarbonato de sodio como agente espumante y el copolímero tribloque PEO-b-poli(óxido de propileno)-b-PEO como estabilizador de espuma. Los polímeros superabsorbentes proporcionaron una relación de hinchamiento máxima de 390 g/g, comparada con 39 g/g para el Alm-g-PMAc.
Pang et al. [51] prepararon hidrogeles a partir de almidón de sagú, MAc y PVA. La incorporación del ácido y del PVA al almidón se verificó por FTIR. Estos autores usaron dos métodos de regeneración del hidrogel: por precipitación y por secado en frío. Encontraron que es posible modular el hinchamiento variando la composición de la alimentación y el método de regeneración.
Otros autores han reportado la síntesis de hidrogeles de Alm-g-PVA con diferentes propósitos. Bursali et al. [52] sintetizaron hidrogeles de Alm-g-PVA, usando glutaraldehido como entrecruzante e incluyendo complejos de boro para estudiar la actividad antibacterial de estos últimos. Mientras que Han et al. [53] produjeron un hidrogel similar, pero empleando formaldehído como reticulante. Los resultados del análisis por difracción de rayos X, confirmaron que la estructura cristalina del PVA cambió por efecto del entrecruzamiento con el almidón. En este caso, se encapsuló un fertilizante en el hidrogel, creando una membrana del gel alrededor de las partículas solubles de fertilizante.
Hua y Wang [54] prepararon hidrogeles superabsorbentes basados en Alm-g-[PAAcr-cohumato de sodio(SH)]. El iniciador empleado en este caso fue APS y MBAA como entrecruzante. La introducción del SH mejoró la velocidad de hinchamiento y la capacidad de re-hinchamiento de los materiales, alcanzando valores de hasta 1100 g/g en agua destilada y 86 g/g en una solución 0,9 %p/p de NaCl.
Más recientemente el mismo grupo de investigadores [55] emplearon una serie de Alm-g[PAAcr-co-SH] para adsorber Cu+2 de soluciones acuosas. Sus resultados indicaron que la adición del 5 % de SH en la red polimérica del Alm-g-PAAcr no solo mejoró la velocidad inicial y la capacidad de adsorción final de Cu+2 , sino que también contribuyó marcadamente en la regeneración. Los hidrogeles presentaron una alta capacidad de adsorción en un amplio intervalo de pH. Los espectros de FTIR antes y después de la adsorción de Cu+2 revelaron que el principal mecanismo de adsorción fue el acomplejamiento.
Para preparar hidrogeles químicamente entrecruzados, además de la copolimerización por injerto simultánea, se puede recurrir a una estrategia de síntesis en dos etapas. En estos casos, el polisacárido se funcionaliza con dobles enlaces reactivos y luego se entrecruza por polimerización radicalaria. Un ejemplo importante implicó lo siguiente: (i) la modificación del almidón de maíz con cloruro de alilo, en presencia de bromuro de cetiltrimetil amonio (CTMAB) como catalizador de transferencia de fase y piridina como aceptor ácido; (ii) la copolimerización del almidón alil-modificado con AMAcr y AA a 50 ºC usando KPS como iniciador. Mediante este procedimiento en dos etapas, se obtuvo un hidrogel altamente entrecruzado con una capacidad de absorción de 6500 g/g en agua destilada y 4500 g/g en una solución 0,9 % de NaCl [45].
El enlace covalente entre cadenas de polímeros también puede darse por la reacción entre grupos funcionales con reactividad complementaria. Así, se pueden formar entrecruzamientos mediante reacciones de condensación debido a la presencia de grupos funcionales como –OH y –COOH en la cadena de almidón y sus derivados.
En este sentido, Seidel
et al. [56] sintetizaron hidrogeles de almidón estables, por entrecruzamiento de almidón carboximetilado (CMS) con bajo grado de sustitución (DS=0,45) con ácidos carboxílicos polifuncionales: maleico, tartárico, cítrico, malónico, succínico, glutámico y adípico. Estos investigadores obtuvieron la mejor estructura de red cuando emplearon ácido cítrico. Los mismos autores en otro trabajo [57], sintetizaron hidrogeles entrecruzando almidón de papa con ácido dicloroacético en presencia de ácido monocloroacético.Lawal et al. [58] produjeron hidrogeles basados en un almidón de yuca carboximetilado, empleando diferentes ácidos carboxílicos di-o polifuncionales como entrecruzantes. Tanto la absorción bajo carga como la capacidad de hinchamiento de los hidrogeles aumentaron en el orden: ácido butano tetracarboxílico > ácido pimélico > ácido subérico > ácido glutámico.
El uso de almidones derivatizados (almidones oxidados, almidones dialdehídos, etc.) tiene el propósito de incrementar la eficiencia de injerto y símultáneamente disminuir la homopolimerización. Peng et al. [59] sintetizaron hidrogeles superabsorbentes anfóteros, por copolimerización de mezclas de AM, cloruro de dialildimetilamonio y sulfato de almidón y sodio. Los resultados probaron que el puente salino es un factor de entrecruzamiento potencial en el hidrogel anfótero, el cual presentó una capacidad máxima en agua de 1493,1 g/g y 91,0 g/g en solución salina.
Chauhan et al. [60] sintetizaron hidrogeles mediante copolimerización por injerto de AA sobre CMS, empleando el sistema iniciador APS/TEMED y dos agentes entrecruzantes: MBAA y EGDMA.
Para mejorar la funcionalidad de los hidrogeles, una técnica empleada es la post-modificación del copolímero de injerto, por ejemplo, la conversión de grupos hidrófobos en grupos hidrófilos o grupos cargados.
Luftor
et al.[61] sintetizaron Alm-g-PAM usando CAN como iniciador. Luego prepararon un polímero absorbente con grupos ácido hidroxámico (– CONHO–), mediante reacción del PAM injertado con hidroxilamina en solución alcalina. Su máxima absorción fue de 192 g/g en agua y, a una misma concentración de sal, el hinchamiento mostró la siguiente tendencia: Na+ > Ca2+ > Fe+3 .Chauhan et al.[62] post-funcionalizaron un CMS-g-PAN con hidroxilamina, para convertir los grupo nitrilo (hidrófobos) en grupos amidoxima (hidrófilos). Estos hidrogeles los emplearon en la Fe+2 absorción de iones . En la reacción de copolimerización emplearon el sistema APS/TEMED y dos agentes entrecruzantes: MBAA y EGDMA. También se ha reportado la reacción de MMA con hidracina para producir una hidracida, compuesto útil para acomplejar iones Ag(I).
El uso combinado de la irradiación y el entrecruzamiento químico también ha sido investigado. Chen et al. [27], sintetizaron hidrogeles superabsorbentes mediante copolimerización por injerto de AAcr y AA sobre almidón de batata, empleando radiación γ y PEG como agente entrecruzante. La muestra con la máxima absorción de agua (2400 ± 10 g/g) alcanzó el equilibrio en aproximadamente 30 min.
Lee et al. [63] copolimerizaron almidón de sagú con AAcr en masa, usando radiación UV para la iniciación. Emplearon un fotoiniciador (Irgacure 2595), el cual absorbe un fotón de la fuente de luz UV para formar el radical iniciador. El almidón y cantidades variables del monómero se adicionaron a una solución al 2 % m/m del fotoiniciador, a temperatura ambiente. El almidón se dispersó mediante agitación vigorosa y se vertió inmediatamente en platillos de vidrio, para luego realizar el curado con UV. La irradiación del almidón de sagú (control) con UV, produjo un gel entrecruzado con alta temperatura de gelatinización, viscosidad elevada a la temperatura de gelatinización y con menor solubilidad e hinchamiento que el almidón nativo. La temperatura de gelatinización disminuyó luego del injerto. Adicionalmente, el Alm-g-PAAcr mostró valores de viscosidad, índice de hinchamiento y solubilidad mayores que los correspondientes para el almidón nativo.
Li y Zhang [64] prepararon un nuevo hidrogel mediante la fotopolimerización UV de un almidón comercial modificado. La síntesis tuvo lugar en dos etapas: (i) preparación del almidón acriloilado (AAlm) por reacción de almidón nativo (previamente dispersado en dimetilformamida) con trietilamina y cloruro de acriloilo. La reacción tuvo lugar en un baño de hielo por 24 h. El producto se precipitó con etanol, se filtró, se lavó y se secó bajo vacío por 48 h. (ii) polimerización inducida por UV del AAlm con el monómero zwiteriónico N,N'-dimetil(metilmetacriloil etil) propanosulfonato de amonio, [CH2=C(CH3)-CO-O-(CH2)2-N+(CH3)2-(CH2)3-SO3-] (DMAPS). Estos autores investigaron la cinética de hinchamiento de los hidrogeles obtenidos en agua destilada y en soluciones acuosas de NaCl y CaCl2. Encontraron que el índice de hinchamiento, tanto en agua como en las soluciones salinas, mejoró al aumentar la cantidad de DMAPS incorporado. Encontraron un sobrehinchamiento, con respecto al hinchamiento en equilibrio, para el hidrogel con el mayor contenido de DMAPS; y comportamiento anti-polielectrolitico, es decir mayor hinchamiento en soluciones salinas que en agua, siendo más marcado el efecto en la solución de CaCl2.
Geresh et al. [26], prepararon y caracterizaron copolímeros de injerto de AN, AAcr y AM sobre almidón de papa, maíz y arroz. La copolimerización fue inducida por radiación 60Co-g o por el sistema de iniciación redox CAN. Los copolímeros fueron saponificados mediante hidrólisis ácida. El producto resultó insoluble en agua y en NaOH(ac). Este resultado, junto con el hecho de que el PAAcr forma hidrogeles débiles en agua, indicó que tuvo lugar el entrecruzamiento. Encontraron que sólo los copolímeros obtenidos por radiación γ de los tres tipos de almidón, resultaron satisfactorios como sistemas de liberación prolongada de fármacos.
Las polimerizaciones en medio disperso también se han empleado para producir copolímeros basados en almidón. Kaewtatip y Tanrattanakul [65] sintetizaron almidón injertado con poliestireno, vía radicales libres en suspensión. Usaron persulfato de potasio como iniciador y agua como medio de reacción. Este estudio demostró la capacidad de polimerización del estireno sobre almidón granular sin emulsificante y la síntesis de copolímeros de injerto sin gelatinización del almidón.
Cho y Lee [66] copolimerizaron estireno sobre almidón de maíz nativo en emulsión, utilizando persulfato de potasio como iniciador, dodecil benceno sulfonato como emulsificante y disulfuro de tetraetiluranio como agente de transferencia de cadena. El porcentaje de injerto aumentó con la concentración de emulsificante.
Lu
et al. [67] prepararon almidón catiónico-g-PAM mediante polimerización en emulsión inversa seguida por una reacción de Mannich mediante goteo de un aducto aldehído-amina pre-formado. Emplearon KPS como iniciador, aceite blanco como medio continuo y una mezcla de monooleato de sorbitol (Span 80) y monopalmitato de sorbitol (Span 40) como agente emulsificante.Otros trabajos relacionados con la producción de microgeles de almidón son los de Wang et al. [68], quienes prepararon microesferas a partir de un látex de almidón (0,45g/mL) obtenido a pH 10, en presencia de Span 60 como surfactante, aceite vegetal como medio continuo, peroxidisulfato de amonio/sulfito ácido de sodio como iniciador, y MBAA como entrecruzante, a una velocidad de agitación de 350 rpm y 50ºC. El microgel fue capaz de adsorber 1,924 g del fármaco evaluado por gramo de gel.
Por otra parte Zhan et al. [69] reportaron la obtención de microesferas de almidón sintetizadas a partir de un almidón soluble por suspensión inversa. Para tal fin, emplearon epiclorhidrina como reticulante, Span 60 como emulsificante y una mezcla de aceite de castor y tolueno como fase orgánica. Li et al. [70] produjeron microesferas de almidón por emulsión inversa, usando MBAA como entrecruzante. Las microesferas del hidrogel se probaron en la adsorción de Ni+2 y de acuerdo con los parámetros termodinámicos, se verificó que la adsorción del ion era principalmente física.
Li et al. [71] produjeron microesferas de almidón entrecruzado por un método de suspensión inversa. Emplearon un almidón soluble como material de partida con MBAA como agente entrecruzante, una mezcla 80/20 ciclohexano/cloroformo como medio de dispersión, monoestearato de sorbitol (Span 60) monoestearato de sorbitol con PEO (Tween 60) como agente de dispersión y el sistema de iniciación K2S2O8 / Na2SO3.
Kwon Oh et al. [72] presentaron una excelente revisión acerca de diferentes métodos y estrategias para la preparación de micro y nanogeles útiles en aplicaciones biológicas y biomédicas, con énfasis en la liberación controlada de fármacos. Pese a que estos autores hacen referencia al empleo de diferentes polisacáridos como el quitosano, el hialurano y el dextrano para la producción de nanohidrogeles, llama la atención que no mencionan en su revisión el uso de almidón para estos fines.
Chakraborty et al [73] obtuvieron nanopartículas de almidón por formación de una microemulsión estabilizada con Aerosol OT (AOT, bis[2etilhexil]sulfosuccinato de sodio). Inmovilizaron la enzima Candida antartica Lipasa B sobre las nanopartículas de almidón y por esa vía consiguieron la acilación regioselectiva del almidón en el carbono 6 de la unidad de glucosa. El diámetro promedio de las partículas se mantuvo en 40 nm, aun después de la remoción del surfactante.
Zhai et al [74] sintetizaron nanopartículas de almidón por emulsión inversa, usando POCl3 como entrecruzante. Posteriormente incorporaron polioxametalatos (α-K8H6 [Si2W18Ti6O77] (Si2W18Ti6)) en las nanoesferas de almidón. El complejo exhibió actividad antitumoral en ratones, sin efectos mutagénicos.
Xiaofei et al [75] prepararon nanopartículas de almidón por precipitación gota a gota de etanol sobre una pasta de almidón. Las nanopartículas se modificaron con ácido cítrico y este material se usó para preparar nanocompuestos con almidón de melocotón plastificado con glicerina como matriz. La incorporación de las nanopartículas de almidón modificado mejoró el módulo de almacenamiento, la resistencia a la fluencia y el módulo de Young cuando su contenido varió de 0 a 4 %. La mejora en las propiedades se atribuyó a la buena interacción entre el refuerzo y la matriz. Tan et al [76] reportaron la fabricación de nanoesferas monodispersas de almidón mediante el procedimiento de nanoprecipitación por la adición gota a gota de agua a una solución de acetato de almidón en acetona, sin el uso de agentes estabilizantes. Las nanoesferas tienen aplicaciones potenciales en la encapsulación de fármacos hidrofóbicos. En un trabajo posterior, Tan et al [77] propusieron un método para preparar hidrogeles con alta resistencia mecánica. En primer lugar, prepararon nanoesferas con morfología núcleocoraza con grupos alilo derivatizables. Las nanoesferas basadas en almidón se emplearon como entrecruzante para preparar hidrogeles de poliacrilamida. El gel resultante presentó una resistencia mecánica 60 veces mayor que el hidrogel convencional y podría tener aplicaciones en la producción de tejido. El mismo grupo de investigación [78] reportó posteriormente la preparación de hidrogeles sensibles a la temperatura, basados en almidón y poli(N-isopropilacrilamida). En este caso, la resistencia mecánica del hidrogel fue 200 veces mayor, respecto a su par convencional.
Se han desarrollado nuevos nanogeles basados en poli(ácido acrílico), poli(acrilamida) y almidón mediante un proceso de microemulsión inversa que han sido usados en la extracción y liberación controlada de fragancias como la vainilla y para regular la dosis de medicamentos tóxicos [79]. Mas recientemente, Liu et al. [80] propusieron un método basado en la homogenización a alta presión para la reducción a tamaño nanométrico de partículas micrométricas de almidón dispersas en agua. La distribución del tamaño de partículas y el tamaño dependieron del número de ciclos de homogenización. El aumento en la viscosidad y en el potencial zeta fueron consistentes con la reducción del diámetro de las partículas de almidón.
También se han explorado otras rutas para mejorar las propiedades de los hidrogeles. Kuang et al. [81] obtuvieron un hidrogel super-poroso mediante la modificación química del almidón con grupos sulfato y grupos vinílicos reactivos. La alta porosidad del hidrogel se consiguió mediante la reacción de entrecruzamiento y un proceso de formación de espuma por soplado (gas-blowing foaming process). Los materiales obtenidos fueron superabsorbentes y mostraron una alta velocidad de hinchamiento en agua debido a un mecanismo de capilaridad promovido por la porosidad generada por el agente de expansión.
3.3 Hidrogeles Nanocompuestos
Para distinguir las diferencias en las propiedades mecánicas y de hinchamiento, algunos autores [82] han clasificado los hidrogeles en tres generaciones. Los hidrogeles convencionales o de primera generación, están caracterizados por hinchamiento rápido y alta capacidad de absorción, pero sus estructuras se rompen fácilmente aún a bajas presiones. Los de segunda generación o hidrogeles compuestos, muestran hinchamiento moderado, con propiedades mecánicas también mejoradas pero que aún se rompen cuando se les aplican esfuerzos moderados. La tercera generación incluye los hidrogeles híbridos, como los nanocompuestos con arcilla, los cuales presentan excelentes propiedades mecánicas [83].
En el caso de los hidrogeles, estos nanocompuestos generalmente consisten de una matriz orgánica (polímero) y un material de relleno inorgánico (por ejemplo, arcilla), a partir de los cuales se forman estructuras complejas a escala nanométrica. Los hidrogeles nanocompuestos se preparan mediante polimerización radicalaria
in situ, a temperatura cercana a la ambiental y sin agitación. En estos materiales se logran, simultáneamente, alta tenacidad, excelentes propiedades ópticas y sensibilidad a los estímulos externos, superando así las limitaciones de los hidrogeles de segunda generación [84].En un trabajo pionero [83] reportaron la producción de un hidrogel nanocompuesto, basado en NIPA y hectorita [Mg5,34Li0,66Si8O20(OH)4]Na0,66 como entrecruzante multifuncional. Las cadenas de PNIPA se injertaron sobre la superficie de la arcilla por uno o dos extremos. El producto presentó valores de elongación mayores de 1500 %. Las mediciones de ángulo de contacto demostraron que estos hidrogeles poseen hidrofobicidades superficiales extremadamente altas. Sus propiedades superiores, atrajeron poderosamente la atención de los investigadores y en pocos años hubo numerosos desarrollos en este campo. Los hidrogeles nanocompositos basados en almidón también participan en esta revolución de nuevos materiales.
Wu et al.[85] prepararon nanocompuestos superabsorbentes con una absorción de agua de 4000 g/g, mediante injerto de AA y caolinita sobre almidón de papa, seguido de saponificación con NaOH. La síntesis del Alm-g-PAA/caolinita se realizó con un procedimiento semejante al descrito para los copolímeros saponificados y entrecruzados, con un paso previo que incluyó la preparación de una suspensión de monómero (AA), agente entrecruzante (MBAA) y polvo ultrafino de arcilla (caolinita) en agua destilada a temperatura ambiente. Encontraron un efecto absorbente cooperativo de los grupos hidrófilos –CONH2, –COONa y –COOH.
En un trabajo posterior [86], estos autores evaluaron la influencia del mineral sobre las propiedades absorbentes de los hidrogeles. Empleando un procedimiento de síntesis similar, prepararon nanocompuestos con tres arcillas diferentes: bentonita, caolinita y sercita. La capacidad de absorción de agua de estos materiales fue en el orden: caolinita > bentonita > sercita. La bentonita se dispersa más fácilmente en agua y produce mayor cantidad de partículas que las otras dos arcillas, lo cual da lugar a mayor densidad de entrecruzamiento. Por otra parte, la hidratación y dispersión de la sercita fue inferior, por lo cual el injerto de esta arcilla sobre almidón fue el menor.
Zhang
et al. [87] prepararon hidrogeles nanocompuestos mediante copolimerización de AA y atapulguita sobre fosfato de almidón, en presencia de APS y MBAA como iniciador y entrecruzante, respectivamente. La absorción de agua en el equilibrio para este nanocompuesto fue de 1268 g/g. Las micrografías de los materiales obtenidos evidenciaron que tanto la fosforilación del almidón como la incorporación de atapulguita generan una superficie ondulante que facilita la penetración de agua en la red polimérica.Li et al. [88] sintetizaron nanocompuestos Alm-gPAAcr/atapulguita, empleando APS como iniciador y MBAA como entrecruzante. Los superabsorbentes producidos bajo las condiciones óptimas de síntesis exhibieron una absorción de 1077 y 61 g H2O/g de muestra en agua destilada y en solución de NaCl al 0,9 %, respectivamente.
Al et al. [89] también estudiaron el injerto de AAcr sobre almidón, pero en presencia de montmorillonita de sodio. Emplearon el iniciador redox CAN y MBAA como agente entrecruzante. Produjeron materiales con una capacidad de adsorción máxima de 2237 mg de tinta básica (safranina T)/g de muestra seca.
Xu et al. [90] investigaron el comportamiento de una red semi-IPN formada por un copolímero Almg-PAAcr y una PAAcr catiónica. Esta última, se usó además para promover el intercalamiento entre las láminas de la bentonita empleada en la preparación del nanomaterial. El hidrogel resultante mostró altas capacidad de hinchamiento y resistencia a la compresión a porcentajes de agua superiores al 99 %.
Huang et al. [91] modificaron una bentonita de sodio por intercalación de poli(cloruro de dimetildialilamonio). Tanto el patrón de XRD como las micrografías por MET indicaron que la arcilla se exfolió en el nanocompuesto. Posteriormente, se formó una semi-IPN entre el nanocompuesto preparado previamente y Alm-g-PAAcr. El material presentó características de un hidrogel nanocompuesto y anfótero y tuvo una excelente sensibilidad al pH en el intervalo de 2 a 4, además de una muy buena resistencia a la compresión, aun a alto contenido de agua absorbida.
Con el propósito de controlar la liberación de un fungicida tipo ditiocarbamato (Thiram), Singh et al. [92] incorporaron caolinita y bentonita a partículas de un hidrogel de almidón-alginato. Estos autores encontraron que la liberación del fungicida fue más lenta en las partículas que contenían bentonita, respecto a sus pares con caolinita y que la difusión no siguió la ley de Fick.
Gunko et al. [93] investigaron las relajaciones β y g de hidrogeles de almidón cargados con partículas de sílice modificadas con grupos aminopropilmetilsililo, empleando técnicas como espectroscopia de relajación dieléctrica de banda ancha y corriente de depolarización estimulada térmicamente. Encontraron que ambas relajaciones son afectadas significativamente por la presencia de agua y de las nanopartículas de sílice.
Además de sílice y aluminosilicatos, se han preparado nanocompuestos con nanopartículas de plata, basados en redes semiIPNs producidas a través de la polimerización de AA en presencia de un iniciador redox y diferentes carbohidratos (goma acacia, carboximetilcelulosa y almidón) [94]. Las nanopartículas de plata se obtuvieron por incorporación de nitrato de plata al gel, seguida de su reducción in situ. El tamaño de las nanopartículas dependió del carbohidrato empleado en la preparación del hidrogel.
4. CONCLUSIONES
Los hidrogeles derivados del almidón presentan varias ventajas respecto a los hidrogeles sintéticos, debido a la gran disponibilidad, el bajo costo y la biodegradabilidad de esta materia prima, que además es renovable. Se han utilizado diferentes rutas para modificar el almidón para la producción de hidrogeles como: a) la incorporación de nuevos grupos funcionales y/o la transformación de los grupos existentes en el almidón con la finalidad de favorecer las interacciones que dan lugar al entrecruzamiento físico, b) la combinación de las características deseables de algunos polímeros sintéticos con las del almidón para producir hidrogeles químicos, principalmente a través de la copolimerización por injerto, empleando distintos comonómeros, sistemas de iniciación y agentes reticulantes, c) mediante la combinación de las dos rutas anteriores, vía saponificación de copolímeros de injerto, d) mediante la adición de polímeros no entrecruzados para la formación de redes semi-IPN y mas recientemente, e) la adición de nanopartículas con distintas funciones. En este último grupo, destaca la inclusión de las nanopartículas de arcilla, las cuales mejoran significativamente la tenacidad de los hidrogeles nanocompuestos.
Dentro de los múltiples campos de aplicación de los hidrogeles de almidón, uno donde se investiga con mayor intensidad en los últimos años, es la liberación controlada de fármacos.
A pesar de la gran cantidad de publicaciones relativas a la producción de estos materiales, la mayoría de los trabajos se refieren al hinchamiento en el equilibrio y muy pocos han abordado el estudio sistemático de la cinética de hinchamiento y de la relación estructura-propiedades en estos complejos sistemas. Se requiere continuar investigando en estas áreas.
5. REFERENCIAS
1. Hoffman A. Adv. Drug. Deliver. Rev. 2002; 54 (1): 3-12. [ Links ]
2. Peppas N, Bures P, Leobandung W, Ichikawa H. Eur. J. Pharm. Biopharm. 2000; 50: 27-46. [ Links ]
3. Kunzler F. "Hydrogels". En: Encyclopedia of Polym. Sci. and Technol. 2, John Wiley & Sons, Inc., 2002, p. 691-722. [ Links ]
4. Díez Peña E. Desarrollo y Caracterización de Hidrogeles Poliméricos con Aplicación en la Liberación Controlada de Fármacos, Tesis Doctoral. Madrid ( España): Universidad Complutense de Madrid, 2002. [ Links ]
5. Kiatkamjornwong S, Chvajarempun J, Nakason C. Radiat. Phys. Chem. 1993; 42 (1): 47-52. [ Links ]
6. Teli MD, Nilesh G. Carbohyd. Polym. 2010; 81(3): 695-699. [ Links ]
7. Millán-Testa CE, Méndez-Montralvo MG, Ottenhof MA, Farhat TA, Bello-Pérez LA, J. Agr. Food Chem. 2005; 53: 495-501. [ Links ]
8. Guven O, Sen M, Karadag E, Saraydin D. Radiat. Phys. Chem. 1999; 56: 381-386. [ Links ]
9. Chaterjia S, Keun Kwonb I, Park K. Prog. Polym. Sci. (2007); 32:1083–1122. [ Links ]
10. Gupta P, Vermani K, Garg S. Drug Discoveries & Therapeutics (DDT). 2002; 7 (10): 569-579. [ Links ]
11. Zhang L. Starch/Starke. 2001; 53: 401-407. [ Links ]
12. Escobar J, García D, Zaldivar D, Katime I. Rev. Iberoam. Polim. 2002; 3(3): 1-25. [ Links ]
13. Hoare T, Kohane D. Polymer. 2008; 49: 1993- 2007. [ Links ]
14. Singh J, Kaur L, McCarthy O. Potato Starch and its Modification. En: Advances in Potato Chemistry and Technology, Academic Press, First Edition, New York, USA, 2009, p. 273-318. [ Links ]
15. Liu H, Xie F, Yu L, Chen L, Li L. Prog. Polym. Sci 2009; 34 (12): 1348-1368. [ Links ]
16. Tomasik P, Schilling C. "Chemical Modification of Starch", Advances in Carbohydrate Chemistry and Biochemistry, 2004; 59: 175-403. [ Links ]
17. Chen L, Xie Z, Zhuang X, Chen X y Jing X. Carbohyd. Polym. 2008; 72: 342-348. [ Links ]
18. Prado HJ, Matulewicz MC, Bonelli PR, Cukierman AL. Carbohyd. Res. 2009; 344: 1325– 1331. [ Links ]
19. Xiao C, Yang M. Carbohyd. Polym. 2006; 64: 37- 40. [ Links ]
20. Yoshimura T, Yoshimura R, Seki C, Fujioka R. Carbohyd. Polym. 2006 ; 64: 345-349. [ Links ]
21. Mehyar G, Liu Z, Jung H. Carbohyd. Polym. 2008; 74(1): 92-98. [ Links ]
22. Taylor NW, Fanta GF, Doane WM, Russell CR. J. Appl. Polym. Sci. 1978; 22: 1343-1357. [ Links ]
23. Kiatkamjornwong S, Meechap N. Radiat. Phys. Chem. 1997; 49 (61-3): 689-696. [ Links ]
24. Kiatkamjornwong S, Chomsaksakul W, Sonsuk M. Radiat. Phys. Chem. 2000; 59: 413-427. [ Links ]
25. Kiatkamjornwong S, Mongkolsawat K, Sonsuk M. Polymer. 2002; 43: 3915-3924. [ Links ]
26. Geresh S, Gilboa Y, Peisahov-Korol J, Gdalevsky G, Voorspoels J, Remon J, Kost J. J. Appl. Polym. Sci. 2002; 86: 1157-1162. [ Links ]
27. Chen P, Zhang W, Luo W, Fang Y. J. Appl. Polym. Sci. 2004; 93: 1748-1755. [ Links ]
28. Ali E, AlArifi A. Carbohyd. Polym. 2009; 78: 725–730. [ Links ]
29. Eid M. Nucl. Instrum. Meth. B. 2008; 266 (23): 5020-5026. [ Links ]
30. Ghasem RB, Ali P, Somayeh G, Rouhollah S, Farnaz J. J. Photoch. Photobio. B. 2011; 102 (3): 232-240. [ Links ]
31. Yamaguchi M, Watamoto H, Sakamoto M. Carbohyd. Polym. 1988; 9: 15-23. [ Links ]
32. Athawale V, Lele V. Starch/Starke. 1998; 50 (10): 426-431. [ Links ]
33. Athawale V, Lele V. Carbohyd. Polym. 1998; 35:21-27. [ Links ]
34. Lutfor M, Sidik S, Wan WY, Ab Rahman M, Mansor A, Jelas H. J. Appl. Polym. Sci. 2000; 77: 784-791. [ Links ]
35. Athawale V, Lele V. J. Appl. Polym. Sci. 2000; 77: 2480-2485. [ Links ]
36. Athawale V, Rathi S. Eur. Polym. J. 1997; 33(7): 1067-1071. [ Links ]
37. Athawale V, Rathi S. J. Appl. Polym. Sci. 1997; 66 (7):1399 -1408. [ Links ]
38. Athawale V, Lele V. Carbohyd. Polym. 2000; 41: 407-416. [ Links ]
39. Yamaguchi M, Watamoto H, Sakamoto M. Carbohyd. Polym. 1987; 7: 71-82. [ Links ]
40. Hashem A, Afifi M, El-Alfy E, Hebeish A. Am. J. Appl. Sc. 2005; 2 (3): 614-621. [ Links ]
41. Tong Q, Zhang G. Carbohyd. Polym. 2005; 62: 74-79. [ Links ]
42. Sadeghi M, Hosseinzadeh H. Turk J. Chem. 2008; 32: 375-388. [ Links ]
43. Fares M, El-Faqeeh A, Osman M. J. Polym. Res. 2003; 10:119-125. [ Links ]
44. Al-Karawi AJM, Al-Daraji AHR. Carbohyd. Polym. 2010; 79 (3): 769-774. [ Links ]
45. Zhang L, Yang C, Yan L. J. Bioact. Compat. Pol. 2005; 20: 297-314. [ Links ]
46. Mulhbacher J, Ispas-Szabo P, Ouellet M, Alex S, Mateescu M. Int J Biol Macromol. 2006; 40: 9–14. [ Links ]
47. Elvira C, Mano J, San Román J, Reis R. Biomaterials. 2002; 23: 1955-1966. [ Links ]
48. Keskava P, Murali Y, Sreeramulu J, Mohana K. React. Funct. Polym. 2006; 66: 1482-1493. [ Links ]
49. Li X, Xu S, Wang J, Chen X, Feng S. Carbohyd. Polym. 2009; 75 (4): 688-693. [ Links ]
50. Lanthong P, Nuisin R, Kiatkamjornwong S. Carbohyd. Polym. 2006; 66: 229-245. [ Links ]
51. Pang SC, Chin SF, Tay SH, Tchong FM. Carbohyd. Polym. 2011; 84 (1): 424-429. [ Links ]
52. Bursali EA, Coskun S, Kizil M, Yurdakoc M. Carbohyd. Polym. 2011; 83 (3): 1377-1383. [ Links ]
53. Han X, Chen S, Hu X. Desalination. 2009; 240 (1- 3): 21-26. [ Links ]
54. Hua S, Wang A. Polym. Advan. Technol. 2008; 19 (8): 1009–1014. [ Links ]
55. Zheng Y, Hua S, Wang A. Desalination. 2010; 263: 170–175. [ Links ]
56. Seidel C, Kulicke W, Heb C, Hartmann B, Lechner D, Lazik W. Starch/Starke. 2001; 53: 305-310. [ Links ]
57. Seidel C, Kulicke W, Heb C, Hartmann B, Lechner D, Lazik W. Starch/Starke. 2004; 56: 157-166. [ Links ]
58. Lawal O, Storz J, Storz H, Lohmann D, Lechner D, Kulicke WM. Eur. Polym. J. 2009; 45 (12): 3399-3408. [ Links ]
59. Peng G, Xu S, Peng Y, Wang J, Zheng L. Bioresource Technol. 2008; 99: 444-447. [ Links ]
60. Chauhan G, Kumar R, Verma M. J. Appl. Polym. Sci. 2007; 106: 1924-1931. [ Links ]
61. Lutfor M, Sidik S, Wan WY, Ab Rahman M, Mansor A, Jelas H. Carbohyd. Polym. 2001; 45: 95-100. [ Links ]
62. Chauhan G, Chauhan S, Verma M. Carbohyd. Polym. 2006, 66: 435-443. [ Links ]
63. Lee J, Kumar R, Rozman H, Azemi B. Food Chem. 2005; 91: 203-211. [ Links ]
64. Li J, Zhang L. Starch/Starke. 2007; 59: 418-422. [ Links ]
65. Kaewtatip K, Tanrattanakul V. Carbohyd. Polym. 2008; 73:647-655. [ Links ]
66. Cho G., Lee K. Carbohyd. Polym. 2002; 48: 125-130. [ Links ]
67. Lu S, Lin T, Cao D. Starch/Starke. 2003; 55: 222-227. [ Links ]
68. Wang W, Han S, Pu L, Zhang H. J Gansu Agr Univ, 2008-03. [ Links ]
69. Zhan G, Huang K, Zhang F. Huaxue Shijie (Chemical World) 2005-12. [ Links ]
70. Li Z, Wang L, Xiao H, Lai X. J of Chem Eng of Chinese Universities 2009-01. [ Links ]
71. Li Z, Miao Z, Wang L, Liu J, Dai Y, Bai W. Iran. Polym. J. 2008; 17(10): 735-744. [ Links ]
72. Kwon Oh J, Ik Lee D. Myung Park J Prog Polym Sci. 2009; 34(12): 1261-1282. [ Links ]
73. Chakraborty S, Sahoo B, Teraoka I, Miller L, Gross R. Macromol. 2005; 38 (1): 61–68. [ Links ]
74. Zhai F, Li D, Zhang Ch, Wang X, Li R. Eur J of Med Chem 2008; 43(9): 1911-1917. [ Links ]
75. Xiaofei M, Ruijuan J, Chang P, Jiugao Y. Biomacromol. 2008; 9(11):3314-3320. [ Links ]
76. Tan Y, Xu K, Li L, Liu C, Song C, Wang P. ACS Appl Mater Interfaces. 2009; 1(4):956-959. [ Links ]
77. Tan Y, Wang P, Xu K, Li W. Macromol Mat Eng. 2009;294(12): 855-859. [ Links ]
78. Tan Y, Wang P, Xu K, Li W, Sun S, Dong L. Soft Matter. 2010; 6:1467-1471. [ Links ]
79. Somasundaran P, Chakraborty S, Qiang Q, Deo P, Wang J, Ruizhang N. Cosmet Sci. 2004; 55: S1-S17. [ Links ]
80. Liu D, Wu Q, Chen H, Chang P. J Colloid Interf Sci. 2009; 339: 117-124.
[ Links ]81. Kuang J, Young K, Moo Huh K. Carbohyd. Polym. 2011; 83(1): 284-290. [ Links ]
82. Omidian H, Rocca J, Park K. J. Control Release. 2005; 102: 3-12. [ Links ]
83. Kopecek J. Biomaterials. 2007; 28: 5185-5192. [ Links ]
84. Haraguchi K. Curr. Opin. Solid St. M. 2007; 11: 47-54. [ Links ]
85. Wu J, Wei Y, Lin J, Lin S. Polym. Int. 2003; 52: 1909-1912. [ Links ]
86. Wu J, Wei Y, Lin J, Lin S. Polymer. 2003; 44: 6513-6520. [ Links ]
87. Zhang J, Li A, Wang A. Carbohyd. Polym. 2006; 65: 150-158. [ Links ]
88. Li A, Zhang J, Wang A. Bioresource Technol. 2007; 98: 327-332. [ Links ]
89. Al E, Güçlü G, Iyim T, Emik S, Özgümüs S. J. Appl. Polym. Sci. 2008; 109: 16-22. [ Links ]
90. Xu S, Zhang S, Yang J. Mater Lett. 2008; 62 (24): 3999-4002. [ Links ]
91. Huang X, Xu S, Zhong M, Wang J, Feng S, Shi R. Appl. Clay Sci. 2009; 42 (3-4): 455-459. [ Links ]
92. Singh B, Sharmaa DK, Kumara R, Gupta A. Appl. Clay Sci. 2009; 45 (1-2): 76-82. [ Links ]
93. Gunko VM, Pissis P, Spanoudaki A, Turova AA, Turov VV, Zarko VI, Goncharuk EV. Colloid Surface A. 2008; 320 (1-3): 247-259. [ Links ]
94. Vimala K, Samba Sivudu K, Murali Mohan Y, Sreedhar B, Mohana Raju K. Carbohyd. Polym. 2009; 75 (3): 463-471. [ Links ]