Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Latinoamericana de Metalurgia y Materiales
versión impresa ISSN 0255-6952
Rev. LatinAm. Metal. Mater. vol.35 no.2 Caracas dic. 2015
Síntesis y caracterización de óxidos: MgAl, MgFe, FeAl y MgFeAl para la degradación de fenol con foto-fenton solar
Katiuska Ramos*, Ygmar Jiménez, Carlos Linares
Universidad de Carabobo. Facultad Experimental de Ciencias y Tecnología. Departamento de Química. Carabobo. Venezuela.
*e-mail: kramos@uc.edu.ve
RESUMEN
Una serie de precursores sólidos: MgAl, MgFe, FeAl y MgFeAl fueron preparados por el método de coprecipitación, calcinados a 600°C y probados en la reacción de degradación del fenol (4700 ppm) con peróxido de hidrógeno y expuestos a luz solar (Foto-Fenton). Los precursores y sus productos calcinados, fueron caracterizados mediante difracción de rayos X (DRX), Infrarrojo por transformada de Fourier (FT-IR), análisis termogravimétrico, área específica BET y espectrofotometría UV-visible de reflectancia difusa. Los resultados demostraron que los óxidos mixtos: MgFeAl y MgAl adsorben CO2 atmosférico lo que genera su conversión parcial al hidróxido doble laminar (HDL) de partida. Los resultados catalíticos señalaron al óxido mixto MgFeAl como el catalizador más efectivo, demostrando que este sólido es capaz de lograr la remoción de 88% en la demanda química de oxígeno a pH próximo a 3 para una concentración en peróxido de hidrógeno de 56 g/L y 5 g/L del catalizador. No se observó concordancia entre la energía de banda gap de los catalizadores y su capacidad para la degradación.
Palabras Claves: HDL, foto-Fenton, fenol, luz solar
Synthesis and characterization of oxides: MgAl, MgFe, FeAl and MgFeAl for the phenol degradation with photo-fenton solar
ABSTRACT
A serie of solids precursors: MgAl, MgFe, FeAl and MgFeAl were prepared by a coprecipitation method, calcined at 600°C and tested in the degradation reaction of phenol (4700 ppm) with hydrogen peroxide and exposed to sunlight (Photo-Fenton). Precursors and their calcined products were characterized by means of X-ray diffraction (XRD), Fourier Transform Infrared (FT-IR), thermogravimetric analysis, specific area BET and Diffuse reflectance UV–vis spectroscopy. The results showed that the mixed oxides: MgFeAl and MgAl adsorbed CO2 atmospheric generating partial conversion to the starting layered double hydroxide (LDH). The catalytic results indicated the mixed oxide MgFeAl as the most effective catalyst, demonstrating that these solid is able to achieve 88% removal in the chemical oxygen demand to a pH of about 3 to a hydrogen peroxide concentration of 56 g/L and 5 g/L of catalyst. No correlation between the energy of band gap of the catalysts and its capacity for degradation.
Keywords: LDH, Photo-Fenton, phenol, sunlight
Recibido: 23-06-2014; Revisado: 15-12-2014
Aceptado: 19-02-2015; Publicado: 05-12-2015
1. INTRODUCCIÓN
Las diversas actividades desempeñadas por el hombre involucran generación de desechos químicos provenientes de fuentes como: industrias, laboratorios y residuos agrícolas, entre otros. Los procesos tipo Fenton, basados en la generación del radical oxhidrilo (OH, especie altamente oxidante), han sido probados para el tratamiento de compuestos recalcitrantes, debido a que los reactivos utilizados (peróxido-hierro) son fáciles de manipular y no representan una amenaza potencial para el ambiente. Sin embargo, el proceso Fenton homogéneo, en el cual el hierro se encuentra en solución, tiene la desventaja de la separación del hierro y su reuso, lo cual implica costos adicionales. Para superar esta desventaja, es posible la incorporación del hierro a diferentes soportes tales como: hidróxidos dobles laminares (HDL) [1], silica [2], carbón [3], entre otros. Una de las formas de mantener el hierro incorporado a un catalizador sólido es mediante la formación de óxidos mixtos provenientes de Hidróxidos dobles laminares (HDL) también conocidos como materiales tipo hidrotalcitas o arcillas aniónicas. Los HDL son una familia de compuestos inorgánicos de estructura laminar de fórmula general [M2+1-x M3+x (OH)2]x+(An-)x/n∙mH2O, donde M2+ es un catión divalente (Ca2+, Mg2+, Zn2+, Co2+, Ni2+, Cu2+, Mn2+), M3+ es un catión trivalente (Al3+, Cr3+, Fe3+, Co3+, Ni3+, Mn3+), An- es un anión (Cl-, NO3-, ClO4-, CO32-, SO42-) [4] , m es el número de moléculas de agua en la intercapa y el parámetro x es la relación entre los cationes que forman la lámina (x = M(III)/[M(II)+M(III)]). Ha sido reportado que el valor de x entre 0,2 y 0,4 es el óptimo para la formación de la fase HDL. Fuera de este intervalo se forman hidróxidos u otros compuestos [5].
Los HDL empleados como precursores para la obtención de óxidos mixtos permiten tener propiedades texturales controladas, alta estabilidad térmica, propiedades básicas intrínsecas y una excelente dispersión de las fases activas. Estos HDL pueden ser del tipo binario, ternario y hasta cuaternario dependiendo de la incorporación de dos, tres y hasta cuatro cationes. De otro lado, el empleo conjunto de diversas fases metálicas (metales de transición) reconocidas por sus propiedades catalíticas, conduce a un efecto sinérgico o cooperativo de los elementos presentes, hacia una mejora en las propiedades catalíticas del sólido final.
Se ha demostrado que la actividad de algunos HDL binarios es limitada. Es así como Alejandre et al. [6], llevaron a cabo la oxidación del fenol sobre óxidos mixtos provenientes de HDL binarias y ternarias (CuAl, NiAl, CuNiAl) demostrando una mayor actividad catalítica para los óxidos ternarios. Valente et al. [7], estudiaron la adsorción y degradación fotocatalítica de fenol y el ácido 2,4 diclorofenoxidiacetico con óxidos de MgAl y MgZnAl provenientes de HDL, demostrando que el MgAl no presentó una baja actividad catalítica para ambos sustratos. Mantilla et al. [8], probaron óxidos de ZnAl y ZnAlFe en la fotodegradación de fenol y cresol, demostrando que el cresol no se degrada con el óxido ZnAl y el fenol sólo se degrada en un 20%. Sin embargo, para los óxidos ternarios los porcentajes de conversión fueron de 98% para el fenol y una completa conversión del cresol. Adicionalmente, es de hacer notar que la incorporación de metales, como el cinc, cobre o níquel, cuya lixiviación es más tóxica que la del hierro, tiene la desventaja de que las regulaciones son más estrictas para su descarga.
Enmarcados en el panorama descrito, el principal objetivo de la presente investigación se orientó a la preparación de los catalizadores MgFe, MgAl, FeAl y MgFeAl su caracterización y posterior uso en la degradación fotoasistida de fenol con luz solar para comparar su efectividad como catalizadores.
2. PARTE EXPERIMENTAL
2.1 Síntesis de los catalizadores.
Los catalizadores fueron preparados por el método de coprecipitación a baja saturación [10]. Para sintetizar los HDL MgFe y MgAl, se prepararon 250 mL de soluciones de las sales de nitrato de Mg2+ (0,1125 mol), y Al3+ o Fe3+ (0,0375 mol). Para el HDL MgFeAl se prepararon 250 mL de una solución con Mg2+ (0,1125 mol), Al3+ (0,01 mol) y Fe3+ (0,0275 mol) [10] en relación molar de Mg(II):M(III) 3:1, y Fe:Al 2,75:1 [11]. Para el FeAl se prepararon 250 mL de una solución con Al3+ (0,1125 mol), y Fe3+ (0,0375 mol) en proporción Fe:Al 1:3. En la obtención de los precursores, se utilizó un balón de tres bocas conectado a un embudo de adición que contenía la mezcla de sales, un termómetro y un medidor de pH. En el balón se colocaron 250 mL de la solución de Na2CO3 (Riedel-de Haën, 99%, grado p.a.), 0,075 M ([CO3=]= 0,5[M3+]). La adición de la solución de sales se realizó a un flujo de 1 mL/min, sobre la solución de Na2CO3, con control de pH a 10, con adición de NaOH 2M (Riedel-de Haën, 99%, grado p.a) si hubiese sido necesario. La temperatura fue incrementándose desde 27ºC hasta alcanzar 80°C al finalizar la adición de la solución salina. Se mantuvo esta temperatura durante 17 horas en reflujo. El gel obtenido fue lavado con agua destilada tibia, centrifugado y vuelto a lavar hasta alcanzar un pH próximo a 7. El sólido obtenido se secó en estufa a 100°C por 4 horas, pulverizado en un mortero y finalmente calcinado empleando una rampa de calentamiento de 20°C/min: la primera etapa fue a 270°C (20ºC/min) por 30 min y una segunda etapa a 600°C, por 4 horas [12].
2.2 Caracterización de los catalizadores
Las medidas de área específica se llevaron a cabo por el método de BET usando N2 como gas adsorbente en un aparato Micromeritics modelo ASAP 2010. La determinación de la estructura se realizó mediante la técnica de difracción de rayos X de polvo (DRX) usando un difractómetro Siemens D500S. Los espectros infrarrojos se obtuvieron en un espectrofotómetro con transformada de Fourier (FT-IR) Shimadzu 8400S, con una resolución nominal 4 cm-1 y 20 scans, de 400 a 4000 cm-1. Las muestras se prepararon por dilución en bromuro potásico. Los análisis de termogravimetría (ATG) y térmico diferencial (ATD) se realizaron en un analizador térmico simultáneo TG/ATD/CDB/TA Instruments Q600 bajo una atmósfera reactiva de aire. Se utilizaron 9,7 mg de muestra, la cual fue analizada en el intervalo desde temperatura ambiente hasta alcanzar los 700ºC, utilizando una velocidad de calentamiento de 20ºC/min. Las energías de banda prohibida de los materiales en forma de polvo, se determinaron mediante espectrofotometría de UV-visible (miniscan XE plus) operado en el modo de reflectancia difusa. Las señales producidas fueron registradas en forma de la función de Kubelka-Munk F(R), abarcando un intervalo de longitudes de onda de 400-700 nm con un tamaño de paso de 10 nm.
2.3 Reacción de oxidación
Se trabajó con una relación Fenol:H2O2 1:33 (56 g de peróxido por litro de solución fenólica) y 5 g/L de catalizador [13]. Las pruebas catalíticas se realizaron en un reactor de vidrio de tres bocas (KIMAX, vidrio de borosilicato) de 250 mL de capacidad. En una de las bocas se conectó un refrigerante para el control de volátiles, en otra boca un medidor de pH y en la tercera boca una conexión para 2 embudos de adición (adición del H2SO4, NaOH y H2O2). Este sistema se colocó sobre una plancha con agitación magnética, con exposición al sol entre las 10:30 am y 12:30 pm, en días soleados en los jardines del edificio de Química de la Facyt, Bárbula, Venezuela (67º56´, 10º10´, 430 msnm) entre los meses de marzo a mayo. Para ello, se colocaron 50 mL de la solución de fenol (DQO de 11000 mg de O2/L, 4700 ppm de fenol) y se dispersó el catalizador sólido en el líquido. Se realizaron los experimentos a diferentes valores de pH controlándolo por medio de la adición de ácido sulfúrico o hidróxido de sodio diluido. Finalizado el tratamiento se procedió a medir el volumen final de muestra degradada, para posteriormente realizar el proceso centrifugado, y se tomó una alícuota del sobrenadante. Se analizó la Demanda Química de Oxígeno (DQO) al sobrenadante a fin de determinar la eficiencia del proceso de degradación en cada uno de los experimentos realizados.
Todos los experimentos se llevaron a cabo bajo condiciones similares de radiación solar (días soleados y relativamente despejados). La radiación solar se determinó utilizando la ecuación desarrollada por Samani [14],
![]()
Donde Rs es la cantidad de radiación que llega a un plano horizontal en la superficie terrestre, Ra La radiación solar recibida en la parte superior de la atmósfera terrestre sobre una superficie horizontal (MJ m-2 dia-1), cuyo valor varía a lo largo del año para diversas latitudes, Tmax y Tmin son las temperatura máxima y mínima del aire [°C], datos obtenidos de una estación meteorológica ubicadas cerca del área (Naguanagua) y kRs es un coeficiente de ajuste, cuyo valor es 0,19. El valor de radiación promedio obtenido fue de 273 ± 18 W/m2.
2.4 Caracterización de las muestras tratadas.
Como respuesta se empleó la DQO, obtenida por la digestión de la muestra en dicromato de potasio y ácido sulfúrico. La solución resultante fue incubada por 120 min a 150°C en un reactor para DQO Modelo 45600- Hach-company, (USA). La DQO fue determinada colorimétricamente usando un espectrofotómetro DR/2010 (Hach Company, USA). Para realizar el cálculo del porcentaje de degradación en base a la DQO, se usaron las siguientes ecuaciones:
DQO= DQO obtenida para la muestra diluida x factor de dilución x corrección por dilución. (2)
Corrección por dilución= Volumen de solución obtenida después del tratamiento/Volumen de solución fenólica 50 mL (3)
La determinación de Fe se realizó por la técnica de absorción atómica a la llama en un equipo GBC Avanta 932A.
3. RESULTADOS Y DISCUSIÓN
3.1 Caracterización de los catalizadores
Los espectros FT-IR de los sólidos sintetizados y calcinados son mostrados en la figura 1. Se observa una banda ancha para todos los sólidos, en el intervalo de 3550-3450 cm-1 debida a las vibraciones OH ···OH2 y H2O···OH2 cuando el OH se encuentra asociado con grupos de agua por puentes de hidrógeno. Las bandas observadas en 2360 cm-1 se atribuyen al ion carbonato adsorbido en la superficie de las HDL cuando se están preparando las pastillas [13]. La banda a 1640 cm-1 es característica de la deformación del ángulo de la molécula de agua dHOH, relativa a puentes de hidrógeno. La banda a 1382 cm-1 es atribuida, generalmente, al ion carbonato (u3). Sin embargo, Tomganp et al. [15] atribuyen esta banda al ion nitrato, e indican que cuando ambos aniones están presentes, se puede observar una banda ancha o dos bandas. La zona comprendida entre 500 y 1000 cm-1 es característica de los octaedros que forman la lámina. La banda a 596 cm-1 para el MgFe y MgFeAl se puede atribuir al enlace Fe-OH [15]. El espectro FT-IR del sólido FeAl coincide con el reportado por Markov et al. [17], para el hidróxido carbonato de hierro, atribuyendo la banda a 639 cm-1 al αFeO(OH), sugiriendo que el aluminio no fue incorporado a la estructura.
Después de la calcinación a 600ºC, todas las bandas disminuyeron su intensidad (figura 1B) y desparece la banda a 1382 cm-1. La banda a 686 cm-1, para el sólido MgAl, se debe las vibraciones Al-Mg-O. Para el sólido FeAl, la banda observada a 560 cm-1 puede ser asignada a la vibración Fe-O-Fe. Los óxidos MgFeAl y MgAl también fueron analizados después de varias semanas de calcinado, observando la aparición de una banda entre 1500 y 1400 cm-1. Estas bandas se forman cuando el CO2 es químicamente atrapado y estabilizado sobre la superficie de las partículas del óxido mixto, unido directamente como especies monodentadas sobre las especies O2-(base Lewis) de fuerte basicidad [18,19].
La figura 2.A representa los difractogramas de rayos X realizados a los sólidos precursores después de secados. Excepto el FeAl, todos los demás sólidos forman HDL durante la coprecipitación. Para los HDL MgAl, MgFe y MgFeAl los picos de difracción corresponden a las reflexiones características de HDL, con una serie de picos (0 0 1) que se presentan como líneas simétricas a bajos ángulos (planos de reflexión basal (0 0 1, 1 = 3,6) y reflexiones menos intensas para planos no basales (0 1 1, 1 = 2,5,8) [10]. Cuando un HDL se sintetiza con alta calidad cristalina, se puede observar en su perfil de difracción una o dos reflexiones después de los 2θ, 60°. Una de ellas, la reflexión (110), que en ocasiones puede aparecer acompañada por la reflexión (113), equivale a la distancia entre los cationes metálicos dentro de las láminas y al parámetro de celda a. Con la distancia de este plano es posible verificar la relación catiónica M2+/M3+.
Los parámetros de celda se calcularon mediante las reflexiones 003 y 110, considerando un empaquetamiento hexagonal del material [10], donde c corresponde al triple de la distancia (003), a es la distancia metal-metal promedio en la estructura (110) y dhkl corresponde a la distancia interlaminar. En la Tabla 1 se indican los parámetros de celda para los HDL MgFeAl, MgFe y MgAl. El parámetro de celda c se incrementó desde MgAl, MgFe hasta el valor máximo para MgFeAl, esto se atribuye al mayor radio iónico del Fe3+ (0,645Å) en comparación con el Al3+ (0,535Å) lo que ocasiona mayores distancias M-OH [20]. Sin embargo, se observa un valor similar para HDL MgFe y MgFeAl. Esto se debe a que el aluminio está en baja proporción con respecto al hierro (Fe/Al: 2,75/1) afectando poco el parámetro c en ambos HDL. Para el sólido FeAl después de secado, se evidencia la formación de un compuesto con poca cristalinidad, mostrando las reflexiones de hidróxido carbonato de hierro (II-III) a 2θ 18º, 20º, 36º [21], para este sólido en particular la estructura de HDL no puede formarse debido a la falta de cationes M(II) necesarios para la formación de las estructuras HDL. Estos resultados coinciden con lo reportado por los FT-IR.
La figura 2B representa los difractogramas para los diferentes hidróxidos calcinados. Al calcinar, colapsa la estructura de hidróxido y se forman los óxidos correspondientes [17]. Para los compuestos MgFe y MgFeAl se observan los picos a 2θ: 42,9º y 62,3º correspondientes a las reflexiones (200) y (220) características de las estructuras tipo periclasa, Mg(FeAl)O (JCPDS-ICDD 4-0829). Las reflexiones débiles a 2θ: 35º y 56,8º corresponden a la fase espinela (Mg(FeAl)2O4) (JCPDS 34-0192) [12] y MgFe2O4 (magnesioferrita) (JCPDS 17-0465) [22]. Con esto se confirma la conversión a óxidos mixtos tipo periclasa-espinela. Sin embargo, también se observa un pico en 2θ: 11º, el cual corresponde a fase HDL. Para el MgAl se observa una conversión casi completa a la fase HDL (2θ; 11º, 22º, 34º, 38º). Los sitios activos para adsorcion de CO2 sobre los HDL calcinados, estan asociados con sitios básicos superficiales O2--Mg2+ (MgO + CO2 ---> MgCO3). Esto confirma lo observado en los espectros FT-IR.
Para el sólido FeAl, después de la calcinación, las líneas coinciden con la forma g-Fe2O3 [20] indicando que las especies del hierro fueron aisladas del Al2O3. Con respecto al área específica, como se observa en la tabla 1, ésta se ve aumentada para los HDL que contienen aluminio en su estructura.
Al calcinar los sólidos, el área específica se incrementó. Este incremento se debe a la formación de numerosos microporos y canales en el material sólido durante la evaporación del agua de la intercapa y expulsión de los aniones [23].
Los resultados del análisis termogravimétrico (TG) y termodiferencial (ATD) de los sólidos se muestran en la figura 3. El HDL MgAl mostró dos picos endotérmicos a 217ºC y 404ºC, cada uno fue acompañado por una disminución del peso del material. Esto es un comportamiento típico de los HDL, el primer pico corresponde a la eliminación de agua fisisorbida e interlaminar sin colapso de la estructura y el segundo pico es debido a la descomposición de los aniones carbonatos y nitratos, y la condensación de los grupos hidroxilos en las capas octaédricas [24]. Para los HDL MgFeAl y MgFe los picos endotérmicos se desplazan a temperaturas menores especialmente cuando la sustitución de Al por Fe es completa. Este fenómeno podría estar relacionado con una menor estabilidad del cristal en las muestras con Fe como resultado de la distorsión causada por el mayor tamaño de los cationes Fe3+ [18]. Para el sólido FeAl no se observa el mismo patrón de los otros sólidos, confirmando que no se formó el HDL.
En la figura 4A se presentan los espectros de reflectancia difusa para los óxidos, mostrando para MgFe, MgFeAl y FeAl una alta reflectancia en el rango visible, a diferencia del óxido MgAl, indicando su baja absorción.
Mediante la espectroscopia de reflectancia difusa puede estimarse, de manera relativamente sencilla, la energía de banda prohibida o band-gap (Eg). Usualmente, los procesos fotocatalíticos se basan en la generación de pares electrón/hueco en la superficie de un sólido por medio de la excitación de la banda gap. Valores de energía de banda gap grandes indican una disminución en la capacidad semiconductora y teóricamente se reduce su actividad fotocatalítica [25]. La energía de banda gap (Eg) puede ser determinada a partir de la teoría de Kubelka-Munk:
F(R) = (1 − R)2/2R (4)
donde F(R) es la función Kubelka-Munk y R la reflectancia. Esta ecuación puede ser escrita como:
a(hv) = A(hv − Eg)1/n (5)
donde a es el coeficiente de absorción, el cual es proporcional a F(R), A es una constante de energía independiente, hν es la energía del fotón y el exponente n es determinado por el tipo de transición, n= 2 para una transición directa entre las bandas (de valencia y banda de conducción). La Eg se determina al graficar (ahν)2 versus hν y extrapolando una línea recta a partir de la curva hacia el eje de la abscisa, cuando a es igual a cero, Eg = hν [26]. Los valores así obtenidos están representados en la Tabla 2.
Para el óxido MgFe se obtuvo un valor de Eg de 2,40 e.V, cercano al reportado por Köferstein et al. [26]. Este valor le confiere características de semiconductor al sólido. Con respecto al MgFeAl no se encontró bibliografía que reportara el valor de banda gap para un compuesto con características similares, pero considerando que la incorporación del aluminio se realizó en pequeña proporción con respecto al hierro se puede suponer que el valor reportado en este trabajo (2,47 eV) es apropiado. Con respecto al sólido FeAl, es el que presenta menor banda gap. Este resultado es cercano al reportado para el aFe2O3 [27] y es comparable a los reportados en la bibliografía para la hematita [28, 29]. En vista de los resultados el orden de capacidad como semiconductor fotocatalítico sería el siguiente: FeAl>MgFe>MgFeAl.
3.2 Aplicación de los catalizadores en la degradación de fenol.
Se probaron los catalizadores sintetizados en su forma calcinada en la degradación fotoasistida del fenol, ajustando el pH del medio de reacción a un valor próximo a tres, obteniendo los resultados reflejados en la tabla 2.
Para el caso de los catalizadores MgAl y FeAl, se observa que la DQO aumenta con respecto al valor inicial (11000 mg O2/L). Esto se debe a una posible polimerización del fenol ya que al iniciar la reacción entre el fenol y los radicales oxhidrilos se conjugan una serie de reacciones en la que dos o más radicales fenoxi se acoplan, dando lugar a la formación de otros intermediarios más complejos, como moléculas de hasta dos anillos aromáticos unidos entre sí [30], lo que genera una mayor demanda de oxidante y por ende una mayor DQO. Para el catalizador MgAl, resulta interesante el valor obtenido de DQO, ya que debido a su valor de banda gap, no se esperarían propiedades de semiconductor fotocatalítico y además no presenta cationes con actividad redox. Como posible explicación se ha planteado que algunas fotorreacciones que se dan en la superficie de los óxidos metálicos no son todas fotocatalíticas, ya que la fotoexcitación en los sólidos puede causar su transición a otros estados de excitación metaestables, por ejemplo la formación de defectos fotoinducidos localizados en la superficie de los óxidos, los cuales pueden servir como centros activos para fotorreacciones en la superficie [31]. En relación al catalizador FeAl, como se indicó anteriormente, el posible compuesto obtenido fue Fe2O3. Se ha reportado con este óxido pobre actividad catalítica para procesos Fenton [27], coincidiendo con los resultados de este trabajo.
Con respecto a los catalizadores MgFe y MgFeAl, como se observa en la tabla 2, para el óxido mixto MgFeAl se obtuvo un mayor porcentaje de remoción (88%) y con el catalizador MgFe se obtiene 68% de degradación. Una las diferencias entre ambos, es el valor de banda gap, que para el catalizador MgFe es menor y a menor energía de banda gap aumenta su capacidad de semiconductor; sin embargo en este caso se observa como para el catalizador MgFe su capacidad de degradación fue menor. Esto implica necesariamente, que las propiedades estructurales del catalizador son más importantes al momento de la interacción entre el catalizador, el peróxido y el fenol que sus características como fotocatalizador. Estos resultados coinciden con los reportados por Karunakaran y Dhanalakshmi [28], quienes probaron 21 semiconductores para la degradación de fenol con luz solar, demostrando que la eficiencia fotocatalítica no está en concordancia con la energía de banda gap. Ellos también indican que la fotorreactividad de los semiconductores se determina por la estructura del cristal, morfología, tamaño y forma del mismo.
Con los resultados anteriores también se evidencia que el catalizador proveniente del HDL ternario, posee mayor actividad. Otra diferencia importante entre el MgFe y MgFeAl es la presencia de aluminio. El aumento en la capacidad de degradación del óxido MgFeAl sugiere que el aluminio podría favorecer la dispersión metálica y por tanto mejorar la capacidad de interacción del catalizador con el peróxido para la generación del radical oxhidrilo.
3.3 Influencia del pH sobre el proceso de degradación con el catalizador MgFeAl.
En función al mejor catalizador, se decidió estudiar la influencia del pH durante los experimentos. En la tabla 3 se observa como para el experimento Nº 1 no hubo variación en la DQO.
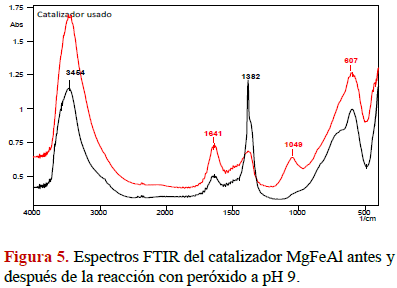
Adicionalmente para el experimento Nº 1 se realizó un espectro FT-IR al sólido después del experimento (figura 5), sin evidenciar adsorción del fenol sobre el catalizador ya que al compararlo con el catalizador fresco, sólo se observa una banda a 1049 cm-1 que corresponde probablemente a la incorporación de sulfato a la estructura [10].
Para el experimento Nº 2, se observó un valor de DQO de 18000 mg O2/L, mayor al valor de DQO inicial, lo que sugiere que se inicia el proceso, pero como se explicó anteriormente sólo se llega a la formación de polímeros que requieren mayor oxidante.
Para explicar estos resultados, se considera un mecanismo propuesto para la fotodegradación de compuestos orgánicos con catalizadores que contienen Fe en su estructura (denotado como ºFe) [33]. En primer lugar, por efecto de la radiación se reducen los sitios ºFe(III) en la superficie del catalizador a ºFe(II) (ecuación 6), seguidamente el peróxido se acerca y reacciona con el ºFe(II) para producir los radicales oxhidrilos (ecuación 7).
ºFe3+ + H2O + hv ® ºFe2+ + H+ + HO (6)
ºFe2+ + H2O2 ® ºFe3+ + HO + OH- (7)
En la figura 6, se ilustra como la superficie del catalizador en medio básico posee carga neta negativa. Mientras más básico sea el pH del medio, la interacción entre el catalizador y la molécula del peróxido es mínima debido a repulsión electrostática y por tanto no ocurrirá la interacción entre el peróxido y el catalizador para la producción del radical oxhidrilo. A medida que se acidifica la solución, los sitios básicos van siendo ocupados por los H+ formándose –M-OH2+ [34] y de esta manera se puede producir el acercamiento entre el peróxido y el catalizador.
Así mismo, se ha reportado que bajo condiciones ácidas o neutras la superficie protonada de óxidos de hierro favorece la formación de complejos de esfera interna: óxido-fenol, mientras que bajo condiciones básicas la combinación de OH- con el Fe3+ y Fe2+ sobre la superficie del óxido puede separar los reactivos de los centros metálicos [33].
Para los experimentos 3, 4 y 5 se observa un aumento en el porcentaje de degradación de DQO, pero también un incremento en la concentración de Fe en solución lo que implica que por efectos del pH lixivia parte del hierro y el proceso de degradación ocurre, en parte, mediante foto-Fenton homogéneo [33].
Estos resultados indican que el pH es uno de los parámetros más importantes que influye en la oxidación catalítica del fenol con peróxido de hidrógeno en fase heterogénea por tanto se recomienda que el pH se mantenga entre 3 y 5 para este catalizador en particular. Actualmente se está usando diseño de experimentos para obtener las mejores condiciones en la degradación del fenol con este óxido.
4. CONCLUSIONES
Para todos los precursores la fase HDL fue detectada por DRX, excepto para el sólido FeAl, lo cual es consistente con la poca pérdida de peso y la débil intensidad de los picos endotérmicos mostrados en las curvas TGA -DTA y los espectros infrarrojos.
Para los HDL MgFe y MgFeAl al ser calcinados a 600ºC se observaron las fases MgFe2O4, Mg(FeAl)O, (Mg(FeAl)2O4) confirmando la formación de óxidos mixtos tipo espinela-periclasa.
Para el FeAl se sugiere la formación del Fe2O3.
Para el MgAl la adsorción de humedad ocasiona la conversión parcial del óxido a HDL.
De las muestras sintetizadas el óxido MgFeAl mostró la más alta efectividad en la degradación del fenol con peróxido de hidrogeno y luz solar (88% remoción DQO), seguido del MgFe (68% de remoción DQO). Para el MgAl y FeAl, se evidenciaron inicios en el proceso de degradación, pero no resultaron ser eficientes en la remoción del fenol.
También se pudo evidenciar que el valor de banda gap no está directamente relacionada con la efectividad en la degradación de fenol con luz solar, ya que el compuesto con menor banda gap, no fue el más efectivo.
De este trabajo se obtuvo que el catalizador MgFeAl es efectivo en la degradación del fenol, pero el pH es un factor que debe ser estrictamente controlado.
5. AGRADECIMIENTOS
Al proyecto Fonacit (PAE-Fonacit Nº 2011000797) por el apoyo económico recibido. Al personal del departamento de Química de la Facyt y del CIMA UC, por su valiosa colaboración. Al Dr. Aaron Muñoz (Cimbuc) por su valiosa colaboración en la obtención de los espectros de reflectancia difusa.
6. REFERENCIAS
1. Shiraga M., Kawabata T., Li D., Shishido T., Komguchi K., Sano T., Takehira K. Appl Clay Sci. 2006; 33: 247–259. [ Links ]
2. Adam F., Andas J., Rahman I. Chemical Engineering Journal, 2010; 165: 658–667. [ Links ]
3. Nguyen T., Phan N., Do M., Ngo K. Journal of Hazardous Materials, 2011; 185: 653–661. [ Links ]
4. Martínez D. y Carbajal G. Avances en Química, 2012; 7 (1): 87-99. [ Links ]
5. Vulic T., Reitzmann A., Lázár K. Chemical Engineering Journal, 2012; 207-208: 913-922. [ Links ]
6. Alejandre A., Medina F., Rodríguez X., Salagre P., Cesteros Y., Sueiras J.E. Aplied Catalysis B: Environmental, 2001; 30: 195-207. [ Links ]
7. Valente J., Tzompantzi F., Prince J., Cortez J., Gomez R. Applied Catalysis B: Environmental, 2009; 90: 330–338. [ Links ]
8. Mantilla A., Tzompantzi F., Fernández J., Díaz J., Gómez R. Catalysis Today, 2010; 150: 353– 357. [ Links ]
9. Carja G., Husanua H., Gherasima C., Iovub H. Applied Catalysis B: Environmental, 2011; 107: 253– 259. [ Links ]
10. Kawabata T., Fujisaki N., Shishido T., Nomura K., Sano T., Takehira K. Journal of Molecular Catalysis A: Chemical, 2006; 253: 279–289. [ Links ]
11. Pavel O., Tichit D., Marcu I. Applied Clay Science, 2012; 61: 52–58. [ Links ]
12. Zhou S., Qian Z., Sun T., Xu X., Xia C. Applied Clay Science, 2011; 53: 627-633. [ Links ]
13. Samani Z. Journal of Irrigation and Drainage Engineering, 2000; 126 (4): 265,267. [ Links ]
14. Tongamp W., Zhang Q., Saito F. Powder Technology, 2008; 185: 43–48. [ Links ]
15. Kuśtrowski P., Rafalska-Łasocha A., Majda D., Tomaszewska D., Dziembaj R. Solid State Ionics, 2001; 141–142: 237–242. [ Links ]
16. Markov L.; Blaskov V.; Klissurski D. J. Mater. Sci. 1990; 25: 3096-3100. [ Links ]
17. León M., Diaz E., Vega A., Ordóñez S., Auroux A. Applied Catalysis B: Environmental, 2011; 102: 590–599. [ Links ]
18. Abelló S. Síntesi i Caracterització de Materials Basics i la se va aplicacio en reaccions dinteres industrial, Tesis Ph.D. Tarragona (España): Universitat Rovira i Virgilie, 2005. p 45-46. [ Links ]
19. Rozov K., Berner U., Taviot-Gueho C., Leroux F., Renaudin G., Kulik D., Diamond L.W. Cement and Concrete Research, 2009; 40 (8): 1248-1254. [ Links ]
20. Balasamy R., Khurshida A., Al-Ali A., Atanda L., Sagata K., Asamoto M., Yahiro H., Nomura K., Sano T., Takehira K., Al-Khattafa S. Applied Catalysis A: General, 2010, 390: 225–234. [ Links ]
21. Benselka-Hadj Abdelkader N., Bentouami A., Derriche Z., Bettahar N., C. de Menorval L. Chemical Engineering Journal, 2011; 169: 231– 238. [ Links ]
22. Vulić T., Hadnadjev M., Marinković-Nedučin R. Journal of Microscopy, 2008; 232: 634–638. [ Links ]
23. Balasamy R., Tope B., Khurshida A, Al-Ali A., Atanda L., Sagata K., Asamoto M., Yahiro H., Nomura K., Sano T., Takehira K., Al-Khattafa S. Applied Catalysis A: General, 2011; 398: 113– 122. [ Links ]
24. Valente J., Tzompantzi F., Prince J., Cortez J., Gomez R. Applied Catalysis B: Environmental, 2009; 90: 330–338. [ Links ]
25. Köferstein R., Walther T., Hesse D., Ebbinghaus S. J Mater Sci. 2013; 48: 6509–6518. [ Links ]
26. Guo L., Chen F., Fan X., Cai W., Zhang J. Applied Catalysis B: Environmental, 2010; 96: 162–168. [ Links ]
27. Wang C., Liu H., Sun Z. International Journal of Photoenergy, 2012; 2012: 10 p. [ Links ]
28. Karunakaran C., Dhanalakshmi R. Solar Energy Materials & Solar Cells, 2008; 92: 1315– 1321. [ Links ]
29. Belhadj N., Abdelhédi R., Savall A. Journal of Applied Electrochemistry, 2009; 39 (5): 663-669. [ Links ]
30. Mantilla A., Jacome-Acatitla G., Morales-Mendoza G., Tzompantzi F., Gomez R. Ind. Eng. Chem. Res. 2011; 50: 2762–2767. [ Links ]
31. Ohishi Y., Kawabata T., Shishido T., Takaki K., Zhang Q., Wang Y., Nomura K., Takehira K. Applied Catalysis A: General, 2005; 288: 220– 231. [ Links ]
32. Chen J. y Zhu L. Sep. Purif. Technol. 2009; 67: 282–288. [ Links ]
33. Zhang S., Zhao X., Niu H., Shi Y., Cai Y., Jiang G. Journal of Hazardous Materials, 2009; 167: 560–566. [ Links ]
34. Sable S., Medina F., Contreras S. Applied Catalysis B: Environmental, 2014, 150–151: 30–36. [ Links ]