Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Latinoamericana de Metalurgia y Materiales
versión impresa ISSN 0255-6952
Rev. LatinAm. Metal. Mater. vol.36 no.2 Caracas dic. 2016
Materiales polimeros de tipo hidrogeles: revisión sobre su caracterización mediante ftir, dsc, meb y met
Arnaldo Ramirez1,2, José Luis Benítez1,3, Luisa Rojas de Astudillo1 y Blanca Rojas de Gáscue1*.
1: Universidad de Oriente. Instituto de Investigaciones en Biomedicina y Ciencias Aplicadas, IIBCAUDO Dra. SusanTai, Cumaná, Estado Sucre, Venezuela.
2: Universidad de Oriente, Núcleo Bolívar, Unidad de Estudios Básicos, Ciudad Bolívar, Edo. Bolívar.
3: Universidad de Oriente, Departamento de Química, Escuela de Ciencias, Núcleo de Sucre, Cumaná, Venezuela. *e-mail: blanca_gascue@yahoo.com
RESUMEN
Hoy en día los hidrogeles son uno de los materiales más versátiles, debido a la facilidad con que es posible incorporar nuevos agentes a su estructura y darle características específicas, originando de esta forma diferentes tipos de geles (copolímeros, terpolímeros, semi-interpenetrados, de doble red, híbridos, etc), los cuales han sido aplicados principalmente en tres campos de desarrollo, como son: agricultura, biomedicina y ambiente. Debido a la importancia que tienen estos materiales en el siguiente trabajo se presenta el estudio de sus propiedades de absorción, interacciones y microestructura, mediante las técnicas analíticas comúnmente usadas: Espectroscopía Infrarroja con Transformada de Fourier (FTIR), Calorimetría Diferencial de Barrido (DSC) y Microscopia en sus modalidades: Óptica (MO), Electrónica de Barrido (MEB) y Electrónica de Transmisión (MET). Enfocándose en profundizar en el potencial que tienen las mismas para revelar los diferentes aspectos que implican los hidrogeles y sus aplicaciones.
Palabras Clave: Hidrogel, caracterización, FTIR, DSC, MEB, MET.
Polymers materials type hydrogels: review of their characterization by ftir, dsc, sem and tem
ABSTRACT
Hydrogels have become one of the most versatile materials, because new agents may be incorporated in its structures and providing specific characteristics, which produce different kinds of gels (copolymers, terpolymers, semi-interpenetrating, double network, hybrid, etc.), which have applications in the agriculture, biomedicine and environment. Due to the importance of these materials in the following work is presented the study of their absorption properties, interactions and microstructure, by using the analytical techniques of Fourier transform infrared spectroscopy ((FTIR), Differential Scanning Calorimetry (DSC) and Microscopy: Optical (OM), Scanning Electron (SEM) and Transmission Electron (TEM), with the approach of investigating the potential of these techniques to show the different aspects involving hydrogels and their applications
Key words: Hydrogel, Characterization, FTIR, DSC, MEB, MET
Recibido: 17-10-2015 ; Revisado: 07-03-2016 Aceptado: 07-03-2016 ; Publicado: 03-29-2016
1. INTRODUCCIÓN
1.1 La ciencia de los materiales, la biomimética y los geles poliméricos
La producción y elaboración de los materiales hasta convertirlos en productos terminados constituyen una parte importante de la economía actual. Pero el diseño de los productos manufacturados y de los sistemas de elaboración necesarios para su producción requiere el conocimiento de la estructura interna y las propiedades de los materiales, de tal manera que puedan elegirse los más adecuados para cada aplicación y crear los mejores métodos para procesarlos [1].
En los últimos años, en el desarrollo y diseño de nuevos materiales, los investigadores se han enfocado en la aplicación y el estudio de la Biomimética, la cual es una ciencia que estudia los modelos de la naturaleza y luego los imita o se inspira en sus diseños y procesos para resolver los problemas humanos. La biomimética es una corriente muy antigua, desde los principios del hombre queriendo imitar lo que hace la naturaleza, desde que el hombre quiso volar, hasta el desarrollo de aviones. La idea central de este concepto es que la naturaleza, imaginativa por necesidad, ha resuelto ya muchos de los problemas que requieren nuevos esfuerzos para ser resueltos actualmente. Los animales, las plantas y los microbios son organismos consumados. A lo largo de su evolución han acertado en lo que funciona, lo que es apropiado y lo que perdura. La emulación consciente de la genialidad de la naturaleza es una estrategia de supervivencia para la humanidad y un camino hacia el futuro sustentable. Mientras más se parezcan y funcionen los productos como el mundo natural, mayor es su probabilidad de sobrevivir en él. Algunas de las mayores aplicaciones de la biomimética se dan en el campo de los biomateriales, ya que se involucra la síntesis o copia de materiales biológicos y su aplicación en diseños prácticos [2].
En este sentido los geles poliméricos son de interés como materiales inteligentes o biomiméticos, ya que responden a cambios fisicoquímicos en su entorno tales como: la composición del solvente, la temperatura, el pH y otros. Estas características han generado que sean investigados ampliamente en cuanto a optimizar su síntesis para diseñar la relación "estimulo-respuesta", en el desarrollo de sensores de múltiples aplicaciones [3,4]. Este comportamiento característico de los geles, sumado a que durante su síntesis puede impartírsele: biocompatibilidad, biodegradabilidad, naturaleza inerte, buenas propiedades mecánicas, alta resistencia química y térmica, entre otros, ha abierto las puertas a una amplia variedad de aplicaciones tecnológicas en química, medicina, medio ambiente, agricultura, y en otros campos [5].
1.2 Hidrogeles
Los hidrogeles son geles poliméricos hidrofílicos formados por una red tridimensional que tiene la capacidad de absorber una gran cantidad de agua, hinchándose y aumentando considerablemente su volumen sin perder su forma (Figura 1) [6], hasta alcanzar su máximo grado de hidratación o índice de hinchamiento [7]. En estado seco el gel es un material sólido y duro, pero cuando entra en contacto con una solución acuosa, esta se difunde hacia el interior y el gel se hincha hasta alcanzar un equilibrio fisicoquímico. La difusión incluye la migración de agua en los espacios preexistentes o dinámicamente formados entre las cadenas del hidrogel [8].
Los hidrogeles también han despertado gran interés científico en aplicaciones biomédicas, debido a que presentan características favorables para utilizarlos como vehículos para la liberación controlada y selectiva de fármacos en el organismo: poseen una estructura tridimensional que permite almacenar moléculas pequeña, pueden ser biocompatibles debido al gran contenido de agua que poseen en su estructura, reduciendo de esta forma la irritación producida por fricción de los tejidos con los que entran en contacto, así como también disminuyendo la desnaturalización de proteínas [9].
La propiedad más importante que tienen los hidrogeles es el índice de hinchamiento, el cual es una medida de la cantidad de fluido que puede absorber el hidrogel en su interior [3]. En numerosos estudios se ha demostrado que al variar la composición inicial y la densidad de entrecruzamiento de un hidrogel, se afecta su índice de hinchamiento. Al incrementar el contenido de incorporación del monómero hidrófilo en la reacción de copolimerización, éste aporta una mayor cantidad de grupos afines a las moléculas de agua, favoreciendo así la interacción del hidrogel con las soluciones acuosas [10,11]. Sin embargo, si se incrementa la proporción de un monómero hidrófobo, este comportamiento se invierte. Esto se debe a que se favorece el aumento de las interacciones entre las cadenas de polímeros, disminuyendo en consecuencia las interacciones de la cadena con las moléculas de agua [12,13].
Por otro lado, a medida que el tamaño de poro de la red decrece, los hidrogeles también pueden exhibir una marcada reducción en el máximo contenido de agua que pueden almacenar. Esta característica puede regularse al incrementar el porcentaje de agente entrecruzante durante la reacción de polimerización. Un aumento del grado de entrecruzamiento reducirá el volumen libre dentro de la estructura de la red del hidrogel, reduciendo el tamaño de los poros [14-16]. La cantidad de fluido absorbido en estado de equilibrio es un balance entre las fuerzas osmóticas originadas por el agua al entrar en la red macromolecular y las fuerzas cohesivas ejercidas por las cadenas macromoleculares que se oponen a esa expansión.
1.3 Tipos de Hidrogeles en función de su síntesis y algunas aplicaciones
Dependiendo de su estructura química y los componentes utilizados para la síntesis de los hidrogeles, estos se pueden clasificar en los siguientes tipos:
1.3.1 Hidrogeles copolímeros
Los hidrogeles además del agente entrecruzante están formados por dos o más monómeros que pueden polimerizarse formando cadenas de composición aleatoria o formando bloques (dependiendo de la reactividad de los monómeros y demás condiciones de reacción). Este tipo de hidrogeles puede sintetizarse cuando se desea incorporar o mejorar en el material resultante una propiedad especifica de uno de los monómeros, como por ejemplo el carácter hidrófilo y su sensibilidad al pH, entre otros [17,18].
1.3.2 Hidrogeles de redes semi-interpenetradas (semi-IPN)
Los hidrogeles de redes semi-IPN se forman mediante la polimerización y reticulación de un monómero en presencia de un polímero ya formado; de esta manera el polímero queda ocluido en la red tridimensional del hidrogel. Es una de las estrategias que se ha diseñado para mejorar las propiedades mecánicas de los hidrogeles, así como también para incorporar las propiedades del polímero en el material final. Comúnmente se emplean para su obtención biopolímeros como por ejemplo el quitosano [19]. En la figura 2 se representa la estructura de un hidrogel convencional y un hidrogel semi-IPN.
1.3.3 Hidrogeles de doble red
Los geles de doble red (DN) se componen de dos redes interpenetradas (Figura 3) que lo hacen suave pero resistente, por lo que se espera un mejor rendimiento en las propiedades mecánicas. Estos geles blandos y húmedos con alta resistencia mecánica, baja fricción superficial, y altas propiedades de resistencia al deterioro son buenos candidatos como sustitutos de tejidos que soportan carga, y han sido sintetizados de poli(ácido 2- acrilamida-2-metil-1-propansulfónico) (PAMPS) (primera red) y poliacrilamida (PAAm) (segunda red) [20]. Estos hidrogeles presentan propiedades mecánicas superiores a los convencionales, son obtenidos mediante una síntesis de dos etapas donde la segunda red se forma en presencia de la primera, pueden aplicarse como prótesis de partes blandas como cartílagos [21].
1.3.4 Hidrogeles híbridos
A este grupo pertenecen los hidrogeles que presentan además de la fase orgánica constituida por las cadenas de polímeros entrecruzadas, una fase inorgánica con la que puede interaccionar físicamente (ejm: enlaces de hidrogeno) o químicamente (en este caso originando una nueva estructura). Existen varias formas para su síntesis, la más reportada consiste en una polimerización por adición donde se utiliza como media una suspensión acuosa de la fase inorgánica. Este tipo de hidrogel presenta propiedades superiores en comparación con el hidrogel convencional [23]. Nuestro grupo ha estado estudiando este tipo de hidrogeles empleando fases inorgánicas no convencionales como el Lodo Rojo (generado como subproducto por la empresa CVG BAUXILUM), y los finos de Ferrosilicomanganeso (generado como desecho por la empresa HEVENSA). La incorporación de la fase inorgánica a la matriz polimérica ha logrado mejorar la capacidad de hinchamiento del material en hidrogeles híbridos de poli(acrilamida-co-ácido itacónico)/Lodo Rojo [24], y poliacrilamida/Lodo Rojo [25], además de también en el último caso, mediante pruebas de análisis dinámico mecánico, se ha observado un aumento en el módulo de almacenamiento (G´) proporcional al contenido de Lodo Rojo empleado en la síntesis.
Los hidrogeles son materiales con gran versatilidad que permite aplicarlos en una variedad de campos, incluyendo el ambiental donde se utilizan en el tratamiento de cuerpos acuosos y efluentes industriales contaminados para la remoción de iones de metales tóxicos, o en la recuperación selectiva de metales valiosos en forma iónica (en la Tabla 1 se presentan algunos ejemplos). En este tipo de aplicación sobre todo a bajas concentraciones del ión los hidrogeles ofrecen ventajas significativas respecto a las técnicas utilizadas convencionalmente (extracción por solvente, precipitación, intercambio iónico, electrodeposición, osmosis), las cuales son altamente costosas y con bajo rendimiento a estas condiciones. Entre estas ventajas se pueden mencionar: sus características de red tridimensional, afinidad al agua, fácil aplicación en muestras líquidas, selectividad, capacidad de reutilización y la posibilidad de incorporar grupos químicos específicos mediante síntesis directa (evitando tratamiento post-síntesis necesarios en otros materiales). En nuestro laboratorio se ha estudiado ampliamente la remoción de iones metálicos presentes en muestras acuosas a partir de diversos tipos de hidrogeles como los semi-IPN de: Poliacrilamida/Quitosano, en los cuales la incorporación del quitosano agregó selectividad al material dándole una mayor afinidad hacia los iones de Ni2+ y Cu2+ y reduciendo su concentración un 50% respecto a la inicial en un efluente industrial proveniente de una empresa automotriz [26]. También se han investigado hidrogeles semi-IPN de Poliacrilamida/Polihidroxibutirato y Poliacrilamida/poli(Acido acrílico), confirmando que los grupos ionizables presentes en el polímero son los que pueden incrementar las interacciones electroestática con los cationes del medio. Además se demostró la recuperación efectiva de los iones absorbidos empleando una solución de HNO3, para la reutilización de los hidrogeles [27], lo cual es un aspecto importante cuando se plantea utilizar estos materiales a nivel de procesos de tratamiento.
Cuando los hidrogeles poseen grupos ácidos, a bajo pH su capacidad de absorción de iones metálicos disminuye apreciablemente, esto puede ser debido a que los grupos funcionales reactivos dentro de la red polimérica se encuentran protonados y/o se encuentran formando enlaces de tipo puente de hidrógeno entre ellos. Al aumentar el pH, la capacidad de absorción aumenta, debido a que se favorece la disociación de los grupos ácidos, y las interacciones entre el polímero y los iones metálicos aumentan [28,29].
Los hidrogeles sensibles al pH son los más extensamente estudiados. Ellos son capaces de cambiar su forma y volumen con una ligera variación del pH del medio. La capacidad de hinchamiento de un hidrogel con el pH del medio, depende de la estructura química del hidrogel y de la presencia de grupos funcionales ionizables en el mismo. Si el hidrogel no posee ningún grupo funcional ionizable, el pH no tiene ningún efecto sobre el hinchamiento [30]. En general, se tiene que el grado de hinchamiento de un hidrogel se incrementa cuando se aumenta el pH del medio, si el hidrogel posee grupos ionizables aniónicos (grupos ácidos), pero el hinchamiento disminuye si el hidrogel posee grupos funcionales catiónicos (grupos básicos) [10, 31].
La fuerza ionica es una medida de la concentracion y la carga de los iones presentes en la solucion donde se sumerge el hidrogel. La capacidad de hinchamiento de los hidrogeles disminuye drasticamente al incrementarse la fuerza ionica (concentracion) de la solucion. Debido a las interacciones entre los grupos ionizados del gel y los iones presentes en la solucion (entrecruzamientos ionicos), se genera una disminucion en la capacidad de la red para expandirse, lo cual se manifiesta con tamanos de poros mas pequenos en el material. Recientemente se ha reportado este fenomeno en hidrogeles de poli(acrilamida-co-acido itaconico) estudiados en soluciones de Ca2+, en los cuales se observo una disminucion del tamano de poro promedio desde 27 µm (en agua desionizada) hasta 8 µm aproximadamente (en solucion de 50 mg/L de Ca2+) estos cambios morfologicos ademas de afectar la capacidad de hinchamiento del material tambien causaron una disminucion en la cinetica de absorcion [32].
Además, los hidrogeles también pueden experimentar cambios de volumen en respuesta a pequeñas variaciones en la temperatura; a bajas temperaturas, por lo general, los hidrogeles muestran una buena capacidad de hinchamiento en agua, sin embargo al aumentar la temperatura la matriz polimérica se contrae, debido al incremento de las interacciones entre las cadenas del polímero, y disminución de las interacciones entre estas cadena con las moléculas de agua. Esto ocurre hasta que se produce un cambio en el equilibrio entre los distintos tipos de interacciones, especialmente las interacciones hidrofóbicas y hidrofílicas, y el hidrogel se hincha al aumentar la temperatura [13,14]. Este comportamiento, también afecta la capacidad de absorción de especies metálicas por los hidrogeles [33].
Por otra parte, en aplicaciones biomédicas se ha reportado, que los hidrogeles no presentan en la mayoría de los casos formación de coágulos cuando entra en contacto con la sangre. Diferentes estudios tanto in vitro [9] como in vitro [34], han demostrado que los hidrogeles sintéticos a partir de acrilamida presentan una buena biocompatibilidad al no observarse necrosis ni infección del tejido. Al respecto y buscando materiales biodegradables nuestro grupo ha estudiado las propiedades de hidrogeles de poliacrilamida y poliacrilamida semi-interpenetrado con quitosano, al estar en contacto con fluido fisiológico simulado del cuerpo humano [35]. También se han estudiado copolímeros de Poli(acrilamida-co-ácido itacónico) como agente liberador Tygacil un antibiótico de amplio espectro utilizado en el tratamiento combinado de infecciones en artroplastias, osteomielitis y fracturas abiertas en huesos. En este último caso se observó una buena afinidad química hidrogel-antibiótico, lo cual junto a la porosidad que presenta el material permite afirmar, que los geles pueden emplearse como potencial sustituto de otros materiales como el poli(metacrilato de metilo) que requieren tiempos largos de liberación del antibiótico y posterior cirugía para el retiro de la parte afectada [36]. La selectividad y la especificidad se logran escogiendo adecuadamente los monómeros a utilizar. Por ejemplo incorporando monómeros que presentan una solubilidad dependiente de la temperatura como la N-isopropilacrilamida se logran hidrogeles termosensibles [37]. Incorporando monómeros aniónicos como el ácido itacónico, ácido maleico, etc; se obtienen hidrogeles capaces de liberar el fármaco estimulado por un cambio de pH en el medio [38]. También es posible controlar las propiedades de absorción y liberación del gel ajustando los parámetros de síntesis como por ejemplo el medio de polimerización [39], se ha reportado una disminución en la reticulación de hidrogeles de poli(acrilamida-co-metil metacrilato), y un cambio en el mecanismo de difusión de la matriz polimérica, cuando se utiliza otro solvente como medio en lugar de agua desionizada, lo cual, es importante en aplicaciones que requieren controlen la respuesta de absorción como lentes de contacto, pañales y liberación de fármacos. En la tabla 1 se presentan algunas aplicaciones biomédicas de los hidrogeles.
Desde 1960, cuando nacen tal y como los conocemos hoy en día los hidrogeles, se han publicado numerosas revisiones sobre estos materiales, enfocadas en diferentes aspectos de los mismos, por ejemplo, en biomedicina se han publicado: patentes y productos comerciales [47], propiedades muco-adhesivas y bio-adhesivas [48], estructura y absorción de agua [49], biopolímeros en ingeniería de tejidos[50], mezclas de poli(vinilalcohol) para apósitos [51], tendencias y limitaciones de los hidrogeles como patrón de diseño en ingeniería de tejidos [52], principios moleculares y bionanotecnología [53], nanocompósitos para uso externo [54]. Del mismo modo la liberación controlada de fármacos por hidrogeles, se ha expuesto en varios trabajos que incluyen los siguientes temas: progresos y desafíos [55], nuevos métodos de entrecruzamiento [56], sistemas capaces de ajustar la tasa de liberación del fármaco [57], formulaciones farmacéuticas [58], hidrogeles de quitosano [59], liberación de fármacos oftalmológicos [60], estrategias para la liberación de factores bioactivos [61], hidrogeles sensibles al medio [62]. También se han realizado revisiones enfocadas en la síntesis de hidrogeles utilizando biopolímeros tales como: almidón [63], celulosa [64] y polisacáridos naturales [65]. Otro aspecto relevante de los hidrogeles es su capacidad para responder frente a un estímulo externo, por esto se han categorizado como materiales inteligentes, al respecto se han publicado revisiones tales como: hidrogeles híbridos inteligentes [66], hidrogeles termosensibles obtenidos mediante el método sol-gel [67], perspectiva histórica de hidrogeles inteligentes [68], hidrogeles termosensibles en biomedicina [69]. También la aplicación de los hidrogeles como sensores ha sido documentada mediante las siguientes revisiones: hidrogeles como detectores [70], hidrogeles como sensores y microsensores activados por el pH [71]. En cuanto a la síntesis y propiedades de los hidrogeles, se han escrito varias revisiones algunas de ellas enfocadas en: métodos de síntesis [72], formación in situ de hidrogeles termo sensibles [73], síntesis y factores que afectan las propiedades [74], diseño de hidrogeles semi-IPN [75], preparación y aplicaciones de hidrogeles [76], procesamiento y aplicaciones [77], nuevas rutas para preparar polímeros superabsorbentes [78], optimización de la síntesis por microondas de hidrogeles de alguinato de sodio y poli(vinilpirrolidona)[79]. En agricultura, donde estos materiales pueden emplearse para mejorar las propiedades de los suelos, se han reportado algunas revisiones: retención de agua en suelos [80], hidrogeles como dispositivos de liberación controlada de nutrientes [81]. Otras revisiones se han enfocado en los microgeles con variadas aplicaciones: microgeles y nanogeles como plataformas emergentes en ingeniería de tejidos y liberación controlada de fármacos [82], nanocompósitos: visión nanotecnológica [83]. Así mismo su capacidad como superabsorbentes también ha sido revisada [84].
A pesar de todos los trabajos mencionados, no se encontraron monografías desarrolladas en función de las técnicas empleadas para una eficiente caracterización de la microestructura de los hidrogeles y, de las variables de síntesis; de allí la importancia del trabajo que a continuación se presenta.
2. TÉCNICAS INSTRUMENTALES DE CARACTERIZACIÓN
A continuación se describe la utilización de la Espectroscopia Infrarroja con Transformada de Fourier (FTIR), la Calorimetría Diferencial de Barrido (DSC) y la Microscopía para caracterizar estos materiales conocidos como hidrogeles. Se toman ejemplos de publicaciones científicas centrados en hidrogeles basados en poli(acrilamida) en sus diferentes tipos: homopolímeros, copolímeros, semi-interpenetrados, híbridos.
2.1 Espectroscopia infrarroja con transformada de Fourier (FTIR)
La espectroscopía infrarroja con transformada de Fourier (FTIR) es una técnica utilizada comúnmente para estudiar y verificar la incorporación de monómeros a la estructura de hidrogeles, la misma permite observar la presencia de los grupos funcionales característicos de cada monómero. En la rama ambiental donde los hidrogeles son aplicados en el tratamiento de muestras acuosas con el fin de remover contaminantes como los iones de metales pesados, colorantes, aniones, etc. La FTIR brinda la oportunidad de estudiar las interacciones que ocurren entre los contaminantes y la matriz reticulada. Bucarito et al. (2014) evaluando la absorción de metales biodisponibles en aguas intersticiales provenientes del Golfo de Cariaco en hidrogeles de poliacrilamida, reportó un desplazamiento en la banda que corresponde al grupo carbonilo desde 1640 cm-1 a 1648 cm-1 cuando el polímero estuvo en contacto con las aguas intersticiales. Esta diferencia indica que efectivamente las vibraciones del grupo carbonilo se ven afectadas por las interacciones entre los metales presentes en el agua intersticial y el grupo carbonilo del polímero y permitió corroborar los mecanismos propuestos por otros [85].
En la figura 4, se presentan los espectros infrarrojos de hidrogeles de poliacrilamida, los cuales fueron entrecruzados con 1% y 10% de N´, N´-metilen-bis-acrilamida. En los espectros se destacan las siguientes señales: dos bandas en la región de 1.650 a 1.670 cm–1 atribuidas a la vibración de estiramiento asociada con el grupo carbonilo (C = O) de las funciones amida y a movimientos de flexión del grupo N–H, así como bandas de absorción en la región de 3.200 a 3.600 cm–1 las cuales son atribuidas a estiramientos de los enlaces N–H. Una banda a 2.940 cm–1 correspondiente al estiramiento de los enlaces C–H [86].
2.1.1 Estudio del proceso de polimerización
Esta técnica tiene una gran utilidad en el análisis cualitativo y cuantitativo. Su principal utilización ha sido la de identificar la presencia de grupos funcionales característicos presentes en los hidrogeles. Además, por esta técnica se puede detectar los grupos funcionales que interaccionan en la estructura tridimensional.
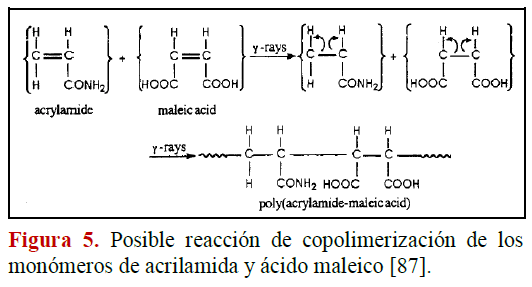
Saraydin et al. (1995) estudiaron la Influencia de la dosis de irradiacion g
Para entender la unión y reticulación de los hidrogeles de poli acrilamida y de poli(AAm-co- AM) durante la polimerización, se evaluaron los espectros FTIR de los hidrogeles y se presentan en la figura 6. En los espectros de FTIR de los hidrogeles, una banda alrededor de 1700-1725 cm-1 podría atribuirse a grupos carbonilo (C=O) en ácidos carboxílicos. Un pico fuerte a 1650 cm-1 es el grupo carbonilo (C=O) relacionado con grupos amida. Los picos de absorción mucho más amplios en las regiones de 3100 y 3500 cm-1 son bandas N-H y O-H. El pico ancho a 3500 cm-1 es un pico característico de amina primaria. El pico débil a 1550 cm-1 es una banda relacionada con el grupo carboxilo (COO-). Los picos débiles a 1000 y 1200 cm-1 son bandas de C-N y los picos débiles a 2850 y 1400 cm-' corresponden a grupos -CH2- en las cadenas.
La polimerización de hidrogeles de poliAAm y poli(AAm-co-AM) avanza sobre los dobles enlaces de la acrilamida y el ácido maleico, porque las bandas N-H se muestran en grandes cantidades en la estructura reticulada. Además, las bandas aproximadamente a 1700 cm-1 y entre 3100-3500 cm-1, han aumentado gradualmente con el aumento en el contenido de AM en los hidrogeles.
2.1.2 Estudio estructural de hidrogeles tipo copolímero de poli(acrilamida-co-ácido orgánico)
La utilización de ácidos orgánicos en la síntesis de los hidrogeles permite incrementar significativamente el carácter hidrofílico del hidrogel, así como también le otorga características de sensibilidad al pH, lo cual es muy conveniente en aplicaciones como la liberación controlada de fármacos en sitios específicos del organismo. La variación del índice de hinchamiento frente a un cambio en el pH del medio externo viene dado por la ionización de los grupos carboxílicos del monómero ácido (COOH), la cual ocurre a un pH cercano al valor del logaritmo negativo de la constante de ionización del ácido (pKa), en la figura 7 se presentan las estructuras y valores de pKa para algunos ácidos orgánicos utilizados comúnmente en la síntesis de hidrogeles tipo copolímero.
Los grupos funcionales para identificar la presencia del monómero ácido en la estructura del hidrogel tipo copolímero de acrilamida básicamente son: el estiramiento del enlace O-H en la región de los 3300 cm-1, igualmente el grupo carbonilo (C=O) que aparece en la región de 1700 a 1730 cm-1, Rojas de Gáscue et al. (2010) Reportó el desplazamiento de la banda de los grupos carbonilos de la amida y del ácido acrílico en los polímeros lineales desde 1640 cm-1 (poliacrilamida) y 1710 cm-1 (poliácido acrílico) hacia valores inferiores de número de onda en el hidrogel tipo copolímero 1615 y 1650 cm-1 respectivamente (figura 8) [42]. Este desplazamiento de las bandas también fue reportado por Ray et al. (2009) en nanogeles de poli(acrilamida-co-ácido acrílico) donde la banda del grupo carbonilo se desplaza desde 1715 cm-1 (en el poli(ácido acrílico)) a 1700 cm-1 (en el gel) [88]. Estos desplazamientos pueden deberse a las interacciones tipo puentes de hidrogeno entre los dos monómeros en la estructura del hidrogel.
En hidrogeles de poli(acrilamida-co-ácido maleico), además de los picos característicos de la acrilamida mencionados anteriormente también se han observado a 1715 cm-1 la banda correspondiente al estiramiento del grupo carbonilo (C=O) y a 1450 cm-1 el estiramiento del enlace C-O. Es de resaltar que en esta investigación se utilizó la espectroscopía infrarroja para estudiar la interacción del hidrogel con iones metálicos en solución: el hidrogel fue aplicado en la remoción de Cobre (Cu2+) y Plomo (Pb2+) y se pudieron observar cambios en la forma del pico a 1650 cm-1 (C=O amida-I de la acrilamida) y un ajuste del pico de la vibración del enlace –NH desde 1603 a 1610 cm-1 que se origina por la participación de la amida primaria a la complejación del Cu2+ con los grupos COOH , en la figura 9, se representan las posibles interacciones que ocurren entre el hidrogel y los iones metálicos y que originan el desplazamiento de las señales en el espectro (basado en la referencia [89]). Para hidrogeles de poli(acrilamida-co-ácido itacónico) se han reportado las bandas de vibración de tención del grupo oxidrilo (OH) entre 3000 y 3400 cm-1, la vibración de tensión de los grupos carbonilos entre 1680 y 1730 cm-1. En este caso la ausencia de las bandas características del enlace C=C a 1630 cm-1 y las bandas de vibración fuera del plano del enlace =C-H entre 905 y 915 cm-1 confirma la presencia de únicamente copolímero en la muestra indicando que el proceso de purificación del material fue adecuado [8].
En este sentido es posible utilizar la técnica de espectroscopía infrarroja para estimar cuantitativamente el porcentaje de conversión de los monómeros durante la polimerización, determinando el área bajo la curva de los picos C=C de la mezcla antes de la polimerización y el área bajo la curva de los picos C=C del copolímero sin purificación, se propone utilizar la siguiente ecuación
 (1)
(1)
Donde Ar representa el área de un pico característico del doble enlace C=C, en el hidrogel formado sin purificar (cantidad de monómero residual sin reaccionar) y Ai representa el área del mismo pico pero en la mezcla de los monómeros antes de la polimerización.
2.1.3 Estudio estructural de hidrogeles tipo semi-interpenetrados de poli(acrilamida)
Un hidrogel semi-interpenetrado (semi-IPN) se obtiene mediante el entrecruzamiento y la formación de la red hidrofílica en presencia de un polímero (Figura 2). Para la preparación de hidrogeles semi-IPN se utilizan biopolímeros como el quitosano, alguinato, goma guar, polihidroxibutirato entre otros. El análisis y los ejemplos mostrados en este trabajo están enfocados únicamente en el quitosano, el cual se obtiene de la desacetilación de la quitina bajo condiciones básicas, en la figura 10 se representa su estructura química.
El quitosano es un polisacarido lineal compuesto de cadenas distribuidas aleatoriamente de b-(1-4) D-glucosamina (unidades desacetiladas) y N-acetil-D-glucosamina (unidad acetilatada). Es uno de los biopolimeros que se han estudiado ampliamente, tiene propiedades que permiten su aplicacion en el campo biomedico y ambiental donde es empleado en el tratamiento de aguas para consumo humano. En el espectro infrarrojo del quitosano comunmente se reportan los siguientes picos: modo vibracional de la amida II en la region comprendida entre 1590 y 1605 cm-1, vibracion de estiramiento del enlace CH2 alrededor de 1425 cm-1 [90], una banda que corresponde al doblaje del grupo -NH2 a 1580 cm-1, la tension anti simetrica del enlace C-O-C en 1154 cm-1, las vibraciones del esqueleto caracteristicas de las estructuras piranosica en 1082 y 1032 cm-1[90].
El grado de desacetilación (GD) es uno de los parámetros químicos más importantes capaz de afectar las propiedades y aplicaciones finales que tenga el quitosano, en este sentido la espectroscopia infrarroja es una técnica fácil y rápida para la cuantificación del grado de desacetilación que contiene en quitosano, hay varios métodos que pueden utilizarse, uno de ellos es determinando la relación entre las áreas bajos los picos característicos de las unidades N-acetiladas (AM) y el área de un pico de referencia que no cambie con el grado de desacetilación de la muestra (AR), GD=AM/AR. Como pico característico de las unidades N-acetiladas se puede tomar la vibración de estiramiento de la amida I a 1655 cm-1 o el pico correspondiente a la amida II 1560 cm-1 (señalados en rojo en figura 10). Entre los picos que se han postulados como referencia se encuentran: el pico de vibración de estiramiento del enlace –OH a 3450 cm-1; estiramiento del enlace C-H a 2870-2880 cm-1; la vibración de flexión del enlace CH2 centrado a 1420 cm-1; el estiramiento anti simétrico del puente C-O-C alrededor de 1160 cm-1 (señalados en azul figura 10) [90]. La selección de la línea base es un paso clave cuando se utiliza la espectroscopía infrarroja para análisis cuantitativos. En la figura 11 se presentan la selección de las diferentes líneas bases mencionadas en la literatura para la quitina. La línea base se refiere a la línea que permite cuantificar el área bajo la curva de una banda (la cual es proporcional a la concentración de grupos químicos cuya vibración la generan). En la figura 11 se pueden apreciar la variedad de opciones (b1, b2, b3, b4, b5, b6, b7, b8, b9) que se puede tener, al momento de seleccionar una línea base para cuantificar por FTIR el grado de desacetilación del biopolímero.
En hidrogeles de acrilamida tipo semi-IPN la espectroscopia infrarroja puede utilizarse para estimar la concentración relativa de poliacrilamida y quitosano en el hidrogel, un ejemplo de esto fue reportado por Bocourt et al. (2008) El cual se seleccionó un pico característico de la poliacrilamida (1655 cm-1, amida I) y un pico de referencia presente solo en el quitosano (vibración del esqueleto propio de estructuras piranósica a 1082 cm-1). El espectro infrarrojo y la relación entre ambos picos (A1655/A1082) en función del contenido de quitosano se representa en la figura 12. Se observa claramente una disminución de la relación de las áreas a medida que se incrementa el contenido de quitosano. La relación de absorbancia disminuye debido a que se incrementa el área bajo la curva de la señal característica del quitosano (1082 cm-1), esta área es proporcional al contenido del quitosano en los hidrogeles.
La principal limitante que tiene el quitosano para su desarrollo y aplicación en diversas áreas es su poca solubilidad en solventes comunes (es soluble en soluciones concentradas de ácido acético), en este sentido los investigadores han estado desarrollando estrategias para incorporar a la estructura del quitosano grupos funcionales hidrofílicos (funcionalización) con la finalidad de mejorar su solubilidad sin perder sus propiedades positivas.
En algunos casos la espectroscopía infrarroja es una herramienta muy útil para verificar que en lugar de generarse un hidrogel de tipo semi-IPN, se han producido reacciones de funcionalización entre el quitosano y las cadenas del hidrogel. Un ejemplo de esto lo constituye el trabajo de Mahdavinia et al. (2004) [92], sobre hidrogeles de quitosano funcionalizado con poli(acrilamida-co-ácido acrílico), la evidencia de una reacción exitosa está dada por la presencia de un pico intenso a 1563 cm-1 que se atribuye a la vibración asimétrica del anión carboxilato (COO-) la cual también es confirmada por la presencia de un pico a 1401 cm-1 que está relacionado con el modo de vibración simétrica de este anión, por otro lado también se detectó a 1670 cm-1 un pico correspondiente a la carboxiamida (CONH2). En la figura 13 se presenta el espectro infrarrojo reportado y la estructura correspondiente.
2.1.4 Estudio estructural de hidrogeles tipo híbridos de poli(acrilamida)
Se conocen como hidrogeles híbridos o compósitos aquellos hidrogeles que se obtienen mediante la incorporación de un material inorgánico a la estructura del hidrogel convencional. En este tipo de hidrogeles la espectroscopía infrarroja puede ser bastante útil para elucidar el tipo de fuerza o interacciones involucradas en la formación del nuevo material. Wu et al. (2011) [93], plantea que la formación de nanocompósitos de poli(acrilamida)/hectorita ocurre mediante interacciones tipo puentes de hidrógenos entre la matriz orgánica y la arcilla, por la información mostrada en los espectros FTIR de los materiales (figura 14). De ellos se puede deducir que los puentes de hidrogeno se forman con la participación de los grupos amida de la poli(acrilamida) y los grupos oxidrilos (OH) presentes en la superficie de la arcilla (posiblemente ionizados). Así como también a la posible formación de complejos entre los iones metálicos de la superficie y los átomos de nitrógeno de la poli(acrilamida); el espectro infrarrojo del nanocompósito también refleja la efectiva incorporación de la hectorita en el material, que se pone de manifiesto por la señal a 1010 cm-1 , la cual comúnmente es asignada a la vibración del enlace Si-O del óxido de silicio (SiO2).
Vale destacar que el término nanocompósito se aplica debido al tamaño nanométrico de las partículas de la fase inorgánica, en este caso la hectorita sintética (comercializada por Rockwood Co.), la cual al exfoliarse forma capas que tienen un tamaño de 30 nm de diámetro y 1 nm de espesor. Cuando el producto final de este tipo de polimerizaciones también posee tamaño nanométrico, se le conoce como nanogel.
Se observa que el espectro del nanocompósito posee grupos funcionales correspondientes a la hectorita y a la poli(acrilamida) es de resaltar que los picos de la vibración de estiramiento del enlace N-H de las unidades de AAm que se presentan en el hidrogel convencional a 3350 y 3189 cm-1; sufrieron un desplazamiento hacia valores de 3368 y 3190 cm-1 cuando se incorporó la hectorita. Del mismo modo el pico que corresponde a los movimientos del grupo carbonilo (1662 cm-1) se hizo intenso, de acuerdo al autor estas observaciones indican la presencia de fuertes interacciones tipo enlaces de hidrógenos que ocurren mientras la hectorita ayuda a la formación de la red del material. Es de resaltar la presencia de pico correspondiente a la vibración de estiramiento del enlace Si-O-Si en el nanocompósito (1010 cm-1) lo cual revela la incorporación efectiva de la hectorita a la red de poli(acrilamida).
En el trabajo presentado por Mu y Zheng (2007) [94], la espectroscopía infrarroja fue útil para plantear la incorporación de la fase inorgánica (silsesquioxano poliédrico (POSS)) mediante la formación de enlaces covalentes entre los grupos amida (NH2) de la matriz de poli(N-isopropil acrilamida) y los grupos epóxido del POSS. Esto en base a la desaparición de la banda que se atribuye a la vibración de estiramiento del grupo epóxido a 910 cm-1 (corroborada por RMN-H). También se resalta en el espectro el incremento en la intensidad del pico de la vibración de estiramiento del enlace Si-O-Si en 1110 cm-1 a medida que aumenta el porcentaje de la fase inorgánica en la alimentación, en la figura 15 se presenta el espectro infrarrojo correspondiente.
2.2 Calorimetria diferencial de barrido (DSC)
Esta tecnica ha sido muy utilizada para el estudio de los hidrogeles. Mediante ella pueden medirse los cambios de masa y efectos termicos en los hidrogeles, en funcion de la temperatura. Saraydin et al. (1995) estudiaron la influencia de la dosis de irradiacion g y del contenido relativo de acido maleico (AM) en las propiedades termicas de los hidrogeles de poliAAm y poli(AAm-co-AM). Para examinar las propiedades termicas de los hidrogeles se investigaron los cambios en la temperatura de transicion vitrea (Tg), y se obtuvieron los barridos de calentamiento de los hidrogeles preparados. Estos se muestran en las figuras 16 y 17.
(como los que fueron analizados en este trabajo) es difícil que se presente este efecto, por lo que es posible que esta reducción en la Tg del hidrogel de poliacrilamida, al copolimerizar con el AM se deba más bien a la irregularidad que se genera en las cadenas por ser un copolímero al azar. No obstante, en los copolímeros la Tg aumentó gradualmente con el incremento del contenido de AM en los hidrogeles. Esto es causado por las interacciones de los grupos carboxilo del AM.
En la figura 17 se puede observar que la Tg de los hidrogeles, con el mismo contenido de AM en el hidrogel, aumentó con la dosis de irradiación.
Por su parte, Kim et al. (2005) [95], realizaron estudios de DSC para comprender la naturaleza del agua en hidrogeles semi-IPN hinchados, preparados con diferentes composiciones de quitosano y poliacrilamida (PAAm). La figura 18 representa la estructura del hidrogel semi-IPN quitosano/PAAm.
La figura 19 muestra el hinchamiento en agua de los hidrogeles semi-IPN quitosano/PAAm y PAAm. El hinchamiento en agua permite determinar el contenido total de agua en el equilibrio (EWC). Como puede observarse en la misma, los porcentajes de hinchamiento de los hidrogeles semi- IPN fueron entre 385% y 569%, y éstos cambian con el contenido PAAm. La absorción de agua por el hidrogel de PAAm llevó mucho tiempo para alcanzar el equilibrio. El porcentaje de hinchamiento del hidrogel de PAAm fue más alto que los hidrogeles quitosano/PAAm 1/8 (CSPM18), 1/6 (CSPM16), 1/4 (CSPM14).
Los mayores porcentajes de hinchamiento de equilibrio se obtuvieron al aumentar el contenido de PAAm en la estructura del hidrogel. Esto se atribuyó a la PAAm que tiene un gran contenido de grupos hidrófilos. Por lo tanto, las moléculas de agua pueden penetrar en las cadenas de polímero más fácilmente, lo que resulta en una mejora de las propiedades de hinchamiento en agua del hidrogel.
Generalmente, los estados del agua en contacto con los polímeros u otro material pueden ser clasificados en agua libre, la cual no toma parte en los enlaces de hidrógeno con las moléculas del polímero; el agua enlazada congelable o agua intermedia que interactúa débilmente con las moléculas del polímero, y el agua no congelable o agua ligada que se refiere a las moléculas de agua ligadas al polímero mediante puentes de hidrógeno.
De manera que en el caso específico de los hidrogeles el agua absorbida puede clasificarse en tres tipos: agua primaria, agua secundaria (estas dos constituyen el agua total enlazada) y agua terciaria (esta última representa el agua libre). La figura 20 muestra los barridos de calentamiento de los hidrogeles semi-IPN hinchados en agua como una función del contenido de quitosano. Un pico endotérmico apareció entre -20ºC y 10ºC, que se atribuyó a la presencia de agua terciaria en los hidrogeles semi-IPN, el agua terciaria es el tipo de agua que es absorbida en el hidrogel, posterior a la saturación de los grupos polares, por las primeras moléculas de agua (agua primaria) y la interacción de los sitios hidrófobos de la red con las siguientes moléculas de agua (agua secundaria). A partir de los datos obtenidos del hinchamiento y por DSC, se calcularon los valores del contenido total de agua en el equilibrio (EWC) y el contenido de agua libre y agua total enlazada, y se presentan en la figura 20.
Se expresó el agua enlazada como la diferencia entre los contenidos de agua total y libre. El contenido de agua enlazada en las muestras semi-IPN fue de 55% del contenido total de agua. Se observó que el volumen de agua libre disminuyó con el incremento del contenido de quitosano en los hidrogeles semi-IPN. Al parecer el quitosano por su estructura hidrófoba inhibe la absorción de agua terciaria, la cual está relacionada con el fenómeno de osmosis. No obstante, el contenido de agua enlazada total (primaria más secundaria) permanece casi inalterable respecto al contenido de quitosano en los hidrogeles.
2.3 Caracterización de hidrogeles por microscopía
2.3.1 Microscopía óptica (MO)
Esta técnica permite determinar, además de cambios dimensionales, la penetración de un disolvente dentro de un hidrogel. Conociendo la dependencia temporal del avance del disolvente hacia el interior del gel se puede obtener el coeficiente de difusión de dicho disolvente dentro de la red hinchada.
Ji y Ding (2002) [96], observaron con un microscopio óptico el hinchamiento en agua de un gel cilíndrico seco de poli(ácido acrílico-co-acrilamida) en tiempo real. En la figura 21 se representa el proceso de hinchamiento, mostrando que el núcleo no hinchado (región en gris con diámetro interno) limita la región de hinchamiento, lo cual conduce, a la formación de un patrón sinusoidal durante este proceso.
De acuerdo con los cambios del diámetro interno (dint) y del diámetro (dext), el proceso de hinchamiento de un hidrogel cilíndrico seco se ha clasificado en etapas [97, 98].
2.3.2 Microscopía Electrónica de Barrido (MEB)
La técnica de microscopia electrónica se fundamenta en el uso de electrones para formar imágenes, en este caso de hidrogeles. Nuestro grupo ha presentado y utilizado los parámetros de la técnica del secado de punto crítico, como herramienta de la microscopía electrónica de barrido (MEB) para observar la morfología en hidrogeles. El tratamiento en el secador de punto crítico los transforma en aerogeles, redes tridimensionales en estado seco, los cuales mantienen el tamaño de los poros que tenían cuando estaban hidratados; permitiendo de esta forma la caracterización morfológica de hidrogeles y la determinación del tamaño de los poros de los mismos [99,100].
Zhao et al. (2008) [101], compararon la morfología de hidrogeles de poli(N-isopropilacrilamida) sintetizados por dos métodos diferentes. El hidrogel PN se preparó por el método convencional en baño de María y el hidrogel PM se sintetizó por irradiación de microondas. Las figuras 22 y 23 muestran fotografías de MEB de los hidrogeles PN y PM secos e hinchados respectivamente. En estas figuras se muestran los efectos de los métodos de preparación de los hidrogeles en los parámetros de red de PN y PM. Se puede apreciar con mayor claridad en la figura 23 que la textura de la superficie de PM tenía mayor porosidad que la de PN en estado hidratado, lo que sugiere que la aplicación de irradiación de microondas para preparar el gel de poli(N-isopropilacrilamida) hizo el gel más poroso en comparación con la aplicación del método de calentamiento en baño de agua.
Los hidrogeles PN y PM en la figura 23 muestran claramente los mismos patrones característicos tridimensionales. Los poros más pequeños fueron confinados por la pared alveolada de la matriz del polímero. Sin embargo, el gel PM posee poros más uniformes y más profundos en comparación con el hidrogel de PN, tal como se muestra en la figura 23c y 23d. Estas fotografías MEB pueden mostrar claramente la diferencia en la estructura de la red superficial de PN y PM. En comparación con el método de calentamiento en baño de agua, el uso del método de irradiación de microondas para preparar el hidrogel no sólo lo hizo más poroso, sino que también hizo sus poros más uniformes y más profundos.
Tal diferencia en la estructura de la red de PN y PM, como se muestra en las figuras 22 y 23, tendrán una influencia en su comportamiento de hinchamiento/deshinchamiento.
Ramírez et al. (2013) [32], utilizaron la microscopia electrónica de barrido para estudiar la morfología superficial de hidrogeles de poli(acrilamida-co-ácido itacónico) en presencia de iones Ca2+, encontrando que el material sufrió cambios morfológicos como consecuencia de la interacción de los iones Ca2+ con los grupos ionizados en su estructura. Mediante esta técnica pudieron relacionar el comportamiento y algunas propiedades macroscópicas que exhibe el material, con los cambios microscópicos que mostró en su morfología. En la figura 24 se observan las micrografías tomadas y los respectivos histogramas. Resultados similares respecto a la reducción del tamaño de poros se encontraron cuando hidrogeles de poliacrilamida se colocaron en contacto con un fluido simulado del cuerpo, lo cual es indicativo de las interacciones presentes entre el fluido y el material. Además también se observaron la presencia de poros interconectados, lo cual es importante en aplicaciones biomedicas porque se ha reportado que la presencia de poros abiertos es necesaria para asegurar una rapida colonizacion, cuando hay implante, con los vasos sanguineos y las celulas oseas [102], asi como tambien en la liberacion de farmacos, la cual es controlada por la relacion entre el tamano del poro y el tamano de la molecula del farmaco, por otro lado la interconexion de los poros son caracteristicas de los materiales superabsorbentes [103]. La porosidad del material puede modificarse y ajustarse a las caracteristicas de un farmaco en particular, por ejemplo mediante la inclusion de nuevas sustancias durante la sintesis, al respecto Rojas de Gascue et al. [36], han reportado un aumento en el tamano de poro desde 210 nm-1,4 µm hasta 6,9 µm, cuando se incorpora un monomero biodegradable como el acido itaconico a la estructura del gel de poliacrilamida estudiado para la liberacion de un antibiotico.
Es posible realizar un análisis químico de cualquier zona que observemos en el MEB a través de un equipo de dispersión de energía de rayos X (EDX), lo cual, es bastante útil cuando se quiere verificar la absorción en el hidrogel de alguna sustancia o elemento específico. Al respecto Fuentes et al. (2011) [104], estudiaron el tratamiento de muestras acuosas marinas tomadas en distintas estaciones del golfo de Cariaco con hidrogeles de Poliacrilamida, la técnica MEB-EDX permitió determinar que los elementos que absorbió el gel en todas las estaciones fueron Ca y S. El material no absorbió metales tóxicos como Cu, Pb, Cr, Mn entre otros debido posiblemente a las condiciones de pH de cada muestra, que influye tanto en la protonación de los grupos amida del gel como en el estado iónico/no-iónico de los metales.
2.3.3 Microscopía Electrónica de Transmisión (MET)
En hidrogeles tipo híbridos (nanocompósitos) donde está presente una fase inorgánica, la microscopía electrónica de transmisión es una buena herramienta para estudiar la dispersión como el tamaño de partícula de la fase inorgánica distribuida en el material, como ejemplo se cita el trabajo de Huang et al. (2011) [105], con nanocompósitos de polivinilalcohol (PVA) y una fase inorgánica nano estructurada (hidróxidos metálicos). Mediante MET se verificó la dispersión homogénea de las nanopartículas en la matriz de PVA, las cuales no sufrieron aglomeración y mantuvieron un tamaño comprendido entre los 80-100nm. La buena dispersión se debe a las interacciones que ocurren entre ambas fases en la suspensión pre síntesis que prevalecen sobre las otras posibles interacciones que puedan darse entre cada fase individualmente. En la figura 25 se presentan la micrografía tomada a estos hidrogeles.
En la figura 26 se presenta otro ejemplo del trabajo publicado por Xiang y Chen (2007) [106], los cuales formaron nanopartículas de plata mediante reducción in situ en una matriz orgánica hinchada, compuesta por un hidrogel terpolímero de polietilenglicol. En este caso la técnica sirvió para constatar que se obtuvieron partículas más irregulares y agregados de mayor tamaño cuando el índice de hinchamiento empleado en la síntesis fue disminuyendo, por lo cual se concluyó que es posible ajustar el tamaño y la morfología de las nanopartículas cambiando el índice de hinchamiento del hidrogel donde se forman. En la figura 26 se incluyen el tamaño promedio medido y la desviación estándar de las nanopartículas en cada micrografía.
3. CONCLUSIONES
La revisión presentada en este trabajo, demuestra cómo pueden emplearse técnicas de caracterización de uso general, tales como FTIR, DSC, MO, MEB y MET para la obtención de información valiosa sobre estos extraordinarios materiales que son los hidrogeles, paseándose por sus diferentes tipos y clasificación, enfocándose en las diversas aplicaciones que estos tienen. Una misma técnica puede revelar diferentes aspectos de un hidrogel, por ejemplo la FTIR, puede emplearse para esclarecer los diferentes mecanismos de formación de los hidrogeles híbridos (lo cual, es un campo poco explorado), estableciendo las interacciones que ocurren entre ambas fases. Pero simultáneamente, la misma técnica, en el campo ambiental permite también establecer la afinidad química de estos materiales hacia un contaminante acuoso como son algunos elementos (Cd, Hg, Pb, As, entre otros). Mientras que en el área biomédica se puede potenciar esta técnica para caracterizar interacciones con fármacos u iones de interés como el calcio. Respecto a la composición de los hidrogeles, la FTIR es de gran utilidad para verificar y comprobar reacciones de copolimerización y funcionalización, así como también en la cuantificación del polímero semi-interpenetrado en hidrogeles semi-IPN. Mediante DSC es posible obtener la temperatura de transición vítrea característica y el estado del agua en la red, aspecto importante en el área de los fármacos. Finalmente, las técnicas de microscopía permiten observar y determinar cambios dimensionales del material, así como establecer los cambios morfológicos que se derivan de las interacciones gel-agua, gel-ión y la determinación del tamaño de los poros junto con el tamaño de partícula de la fase inorgánica presente en los hidrogeles híbridos. Esta variables observadas por microscopía tienen relación directa y explican las propiedades macroscópicas que exhibe el material. En resumen mediante la revisión se establece que las técnicas expuestas pueden contribuir adecuadamente a la caracterización de las propiedades deseables en un hidrogel ideal como lo son: 1) alta capacidad de absorción en presencia de iones (empleando la FTIR se estudian las afinidades polímero/ion, polímero/agua). 2) rapidez de absorción adecuada dependiendo de la aplicación (rapidez de absorción depende de la porosidad y en el caso de los hidrogeles híbridos también de la distribución uniforme de la fase inorgánica en la matriz orgánica, lo cual se puede estudiar por MEB). 3) ausencia de monómero residual (mediante la FTIR se puede verificar la pureza del producto final).4) alta biodegradabilidad sin formación de especies tóxicas cuando se degrade. 5) incoloro, inodoro y no tóxico. 6) capacidad de reabsorción de solvente o iones (reutilización).
4. AGRADECIMIENTOS
Se agradece el apoyo de la Fundación Empresas Polar por la donación del equipo FTIR-ATR a través del Proyecto FP-112686/2013 y el apoyo de FONACIT a través del proyecto F-2013000395.
Se agradece a los autores citados en el artículo por dar la aprobación para utilizar sus resultados en la redacción del mismo.
5. REFERENCIAS
1. Smith W y Ashemi J. Fundamentos de la Ciencia de Ingeniería de Materiales. Primera Edición: McGraw-Hill Inc., DF México, 2006, 908. [ Links ]
2. Rocha Rangel E. Ciencias. 2010; 98:4-8. [ Links ]
3. Katime I, Katime O, Katime D. Los materiales inteligentes de este milenio: Los hidrogeles macromoleculares. Síntesis, propiedades y aplicaciones. Primera Edición: Universidad del País Vasco, España, 2004, pp. 336. [ Links ]
4. Yoshida R, Okano T. Stimuli-Responsive Hydrogels and Their Application to Functional Materials: Ottenbrite RM, Park K y Okano T. (eds.), Biomedical Applications of Hydrogels Handbook, USA. Springer Science. 2010,19-43. [ Links ]
5. Pinzón N, Espinosa A, Perilla J, Hernáez E, Katime I. Rev. Iberoamer. Polím. 2002;3(2): 38-54. [ Links ]
6. Rojas de Gáscue B, Prin JL, Ramírez M, García A, Arenas F, Bejarano L, Aguilera R, Katime I. Rev. Iberoamer. Polím. 2008; 9(3):158-163. [ Links ]
7. Agüero L, Zaldivar D, Escobar J. Biomecánica. 2000; 8(1): 58-62. [ Links ]
8. Zuluaga F, Valderruten N, Muñoz F. El Hombre y la Máquina. 2006; 27:100-107. [ Links ]
9. Karadag E, Saraydin D, Cetinkaya S, Giiven O. Biomaterials. 1996;17: 67-70. [ Links ]
10. Caykara T, Özyürek C, Kantoglu Ö, Güven O. J. Polym. Sci., Part B: Polym. Phys. 2000; 38:2063-2071. [ Links ]
11. Caykara T. y Dogmus M. Macromol. Mater. Eng. 2004; 289:548-551. [ Links ]
12. Isik B. Turk J. Chem. 2000; 24: 147-156. [ Links ]
13. Escobar J, García D, Valerino A, Zaldivar D y Katime I. Rev. Iberoam. Polim. 2003; 4(4): 1-13. [ Links ]
14. Caykara T, Kiper S y Demirel G. Eur. Polym. J. 2006; 42: 348-355. [ Links ]
15. Rojas de Gáscue B, Ramírez M, Aguilera R, García A, Prin J. L, Lias J, Torres C, Katime I. Rev. Téc. Ing. Univ. Zulia. 2007;30 (1): 74-84. [ Links ]
16. Singh B, Sharma D, Gupta A. J. Hazard. Mater. 2008; 154: 278-286. [ Links ]
17. Katime I, Katime O, Katime D. Anales de la Real Sociedad Española de Química. 2005; 2: 35-50. [ Links ]
18. Ramírez A, Benítez J, Contreras D, Guzmán P, Rojas de Gáscue B. Rev. Iberoamer. Polím. 2011; 12(6):308-316. [ Links ]
19. González N, Prin J, Benítez J, Ramírez A, García A, Ramírez M, Sabino M, Rojas de Gáscue B. Rev. LatinAm. Metal. Mat. 2012; 32(1): 136-144. [ Links ]
20. Nakajima T, Kurokawa T, Furukawa H, Yu Q, Tanaka Y, Osada Y, Gong J. Chin. J. Polym. Sci. 2009; 27 (1): 1-9. [ Links ]
21. Tominaga T, Tirumala V, Lee S, Lin E, Ping Gong J, Wu W. J. Phys. Chem. B. 2008; 112: 3903-3909. [ Links ]
22. Johnson J, Turro N, Koberstein J, Mark J. Prog. Polym. Sci. 2010; 35: 332–337. [ Links ]
23. Haraguchi K. y Takehisa T. Adv. Mater. 2002;14(16):1120-1124. [ Links ]
24. Ramírez A, Prin J, Goméz L, Rojas de Gácue B, Müller A. Síntesis y Propiedades de Hinchamiento de un Compósito de Acrilamida-co-Ácido Itacónico y Lodo Rojo. En: Proceedings del XIII SLAP 2012. Bogotá (Colombia): 2012, p.840-843. [ Links ]
25. Ramírez A, Prin JL, Gómez L, Rojas de Gáscue B, Müller A. Rev. LatinAm. Metal. Mat. 2014;S6: 55-56. [ Links ]
26. Rojas de Gáscue B, Rodriguez R, Prin JL, Ramírez A, Astudillo H, Contreras D, Rojas L, Figueroa Y, Ramírez M, Katime I. Rev. Iberoamer. Polím. 2011;12(6): 342-351. [ Links ]
27. Rojas de Gáscue B, Rodriguez R, Villarroel H, Rojas L, Prin JL, Contreras D, Ramírez A, Gonzalez N, Contreras J. Rev. LatinAm. Metal. Mat. 2012; S5: 16-19. [ Links ]
28. Akkas P, Yýlmaz Z, Sen M. Sep. Sci. Technol. 2007; 42: 1245-1254. [ Links ]
29. Zheng Y, Huanga D, Wang A. Anal. Chim. Acta. 2011; 687:193-200. [ Links ]
30. Yang M, Liu B, Gao G, Liu X, Liu F. Chin. J. Polym. Sci. 2010; 28(6): 951-959. [ Links ]
31. Bajpai A, Shukla S, Bhanu S, Kankane S. Prog. Polym. Sci. JPS. 2008; 549:1-31. [ Links ]
32. Ramírez A, Contreras D, Prin JL, Rojas de Gáscue B. Acta Microscópica. 2013; 22(2): 205-209. [ Links ]
33. Inam R.; Gumus Y. y Caykara T. J. Appl. Polym. Sci. 2004; 94:2401-2406. [ Links ]
34. Saraydin D, Ünver-Saraydin S, Karadag E, Koptagel E, Güven O. Nucl. Instr. and Meth. In Phys. Res B. 2004; 217: 281-292. [ Links ]
35. De Souza M, Rojas de Gáscue B, Otero B, Prin JL, Ramirez A, Figueroa Y, Colina M, Katime I. Rev. Latin Am. Metal. Mat. 2014; S6: 49-50. [ Links ]
36. Rojas de Gáscue B, Contreras D, Ramírez A, Prin JL, Astudillo H, Roja L, Figueroa Y, Palomo C, Müller A, Katime I. Rev. Latin Am. Metal. Mat. 2012; S5: 39-42. [ Links ]
37. Cheng Y, He C, Ding J, Xiao C, Zhuang X, Chen X. Biomaterials. 2013; 34(38):10338-10347. [ Links ]
38. Ozay O.J. Appl. Polym. Sci. 2014; 131:39660. [ Links ]
39. Moreno R, Penott-Chang E, De Souza M, Rojas de Gáscue B, Müller A. Rev. Latin Am. Metal. Mat. 2014; S6: 43-44. [ Links ]
40. Chen J, Ahmad A, O oi B. J. Envr. Chem. 2013; 1(3): 339-348. [ Links ]
41. Mümin E, Iþýl A, Kubilay G, Gamze G. Can. J. Chem. Eng. 2014; 92(1): 52-59. [ Links ]
42. Rojas de Gáscue B, Ramírez M, Prin JL, Torres C, Bejarano L, Villarroel H, Rojas L, Murillo M y Katime I. Rev. Latin Am. Metal. Mat. 2010;30(1):28-39. [ Links ]
43. Döker S, Malci S, Dogan M, Salih B. Anal. Chim. Acta. 2005; 553(1-2):73-82. [ Links ]
44. Döker S, Çelikbiçak Ö, Dogan M, Salih B. Microchem. J. 2006; 84(1-2):80-87. [ Links ]
45. Peng Q, Sun X, Gong T, Wu C, Zhang T, Tan J, Zhang Z. Acta Biomater. 2013; 9(2): 5063-5069. [ Links ]
46. Cheung H, Han T, Marecak D, Watkins J, Amsden B, Flynn L. Biomaterials. 2014; 35(6):1914-1923. [ Links ]
47. Caló E, Khutoryanskiy V. Eur. Polym. J. 2015; 65:252–267. [ Links ]
48. Peppas N, Sahlin J. Biomaterials. 1996;17(16): 1553–1561. [ Links ]
49. Gibas, I, Janik H. Chem. Chem. Technol. 2010;4(4):297–304. [ Links ]
50. Vlierberghe S, Dubrue P, Schacht E. Biomacromolecules. 2011; 12 (5):1387–1408. [ Links ]
51. Kamoun E, Chen X, Mohy M, Kenawy E. Arabian J. Chem. 2015;8:1–14. [ Links ]
52. Billiet T, Vandenhaute M, Schelfhout J, Van Vlierberghe S, Dubruel P. Biomaterials. 2012; 33(26):6020–6041. [ Links ]
53. Peppas N, Hilt J, Khademhosseini A, Langer R. Adv. Mater. 2006;18: 1345–1360. [ Links ]
54. Campbell S, Hoare T. Curr. Opin. Chem. Eng. 2014; 4:1–10. [ Links ]
55. Hoare T, Kohane D. Polymer. 2008; 49: 1993-2007. [ Links ]
56. Hennink W, Van Nostrum S. Adv. Drug Delivery Rev. 2012; 64: 223–236. [ Links ]
57. Kost J, Langer R. Adv. Drug Delivery Rev. 2012; 64: 327–341. [ Links ]
58. Peppas N, Bures P, Leobandung W, Ichikawa H. Eur. J. Pharm. Biopharm. 2000; 50(1):27–46. [ Links ]
59. Bhattarai N, Gunn J, Zhang M. Adv. Drug Delivery Rev. 2010; 62:83–99. [ Links ]
60. Xinming L, Yingde C, Lloyd A, Mikhalovsky S, Sandeman S, Howel C, Liewen L. Contact Lens and Anterior Eye. 2008; 31(2): 57–64. [ Links ]
61. Khanh M, Alsberg E. Prog. Polym. Sci. 2014; 39(7):1235–1265. [ Links ]
62. Qiu Y, Park K. Adv. Drug Delivery Rev. 2012; 64:49–60. [ Links ]
63. Ismail H, Irani M, Ahmad Z. Inter. J. Polym. Mater. Polym. Biomater. 2013; 62(7): 411-420. [ Links ]
64. Chang C, Zhang L. Carbohydr. Polym. 2011; 84(1):40–53. [ Links ]
65. Thakur V, Thakur M. J. Cleaner Prod. 2014;82:1– 15. [ Links ]
66. Samchenko Y, Ulberg Z, Korotych O. Adv. Colloid Interface Sci. 2011;168(1–2):247–262. [ Links ]
67. Jeong B, Wan Kim S, Bae Y. Adv. Drug Delivery Rev. 2012; 64: 154–162. [ Links ]
68. Buwalda S, Boere K, Dijkstra P, Feijen J. J. Controlled Release. 2014; 190: 254–273. [ Links ]
69. Klouda L, Mikos A. Eur. J. Pharm. Biopharm. 2008;68(1) :34–45. [ Links ]
70. Buenger D, Topuz F, Groll J. Prog. Polym. Sci. 2012; 37, (12):1678–1719. [ Links ]
71. Richter A, Paschew G, Klatt S, Lienig J, Arndt K, Adler H. Sensors. 2008; 8(1):561-581. [ Links ]
72. Mathur A, Moorjani S, Scranton A. J. Macromol. Sci. Part A: Polym. Rev. 1996; 36(2): 405-430. [ Links ]
73. Ruel-Gariépy E, Leroux J. Eur. J. Pharm. Biopharm. 2004; 58(2):409–426. [ Links ]
74. Laftaha W, Hashima S, Ibrahima A. Polymer-Plastics Technology and Engineering. 2011; 50(14): 1475-1486. [ Links ]
75. Dragan E. Chem. Eng. J. 2014; 243:572–590. [ Links ]
76. Ahmed E. J. Adv. Res. 2015; 6: 105–121. [ Links ]
77. Ullah F, Othman M.B.H. , Javed F, Ahmad Z, Akil H. Mater. Sci. Eng., C. 2015; 57: 414–433. [ Links ]
78. Hamed O, Jaber F, Hamed E, Adwan K, Jodeh S, Salghi R, Saadeh H. Iran. Polym. J. 2015; 24(10): 849-859. [ Links ]
79. Tally M, Atassi Y. J. Polym. Res. 2015; 22:181. [ Links ]
80. Abedi-Koupai J, Sohrab F, Swarbrick G. J. Plant Nutr. 2008;31(2): 317-331. [ Links ]
81. Laftah W, Hashim S, Ibrahim A. Des. Monomers Polym. 2002; 5(1): 1475-1486. [ Links ]
82. Jiang Y, Chen J, Deng C, Suuronen E, Zhong Z. Biomaterials. 2014; 35(18): 4969–4985. [ Links ]
83. Varsha T, Mini N, Mohan Y, Bajpai S, Bajpai M. J. Macromol. Sci. Part A Pure Appl. Chem. 2007;45(1): 107-119. [ Links ]
84. Zohuriaan-Mehr M, Kabiri K. Iran. Polym. J. 2008;17(6): 451-477. [ Links ]
85. Bucarito J, Fuentes M, Prin JL, García A. Rojas L, Barrios E, Rojas de Gáscue B. Rev. Iberoam. Polim. 2014; 15(1): 7-20. [ Links ]
86. Benítez JL, Contreras D, Guzmán P, Ramírez A, Prin JL, Rojas de Gáscue B. Rev. Iberoam. Polim. 2011; 12(6): 292-299. [ Links ]
87. Saraydin D, Karadag E, Guven O. Polym. Adv. Technol. 1995;6:719-726. [ Links ]
88. Ray D, Mohanta G, Manavalan R, Sahoo P. Int. J. Chem Tech Res. 2009;1(3): 627-633. [ Links ]
89. KaŞgöz H y KaŞgöz A. Polymer-Plastics Technology and Engineering. 2006; 45: 117.124. [ Links ]
90. JolantaKumirska J, Czerwicka M, Kaczyń
91. Bocourt M, Rignack J, Bada N, Peniche C. Ciencias Quimicas. 2008; 39 (2):70-74. [ Links ]
92. Mahdavinia G, Pourjavadi A, Hosseinzadeh H, Zohuriaan MJ. Eur. Polym. J. 2004; 40: 1399.1407. [ Links ]
93. Wu Y, Xia M, Fan Q, Zhang Y, Yu H, Zhu M. J. Polym. Sci., Part B: Polym. Phys. 2011; 49:263.266. [ Links ]
94. Mu J, Zheng S. J. Colloid Interface Sci. 2007; 307:377.385. [ Links ]
95. Kim S, Shin S, Kim N, Kim S. J. Macromol. Sci., Pure Appl. Chem. 2005; 42:1073-1083. [ Links ]
96. Ji S, y Ding J. Polym. J. 2002; 34(4): 267-270. [ Links ]
97. Tanaka T, Sun ST, Hirokawa Y, Katayama S, Kucera J, Amiya YT. Nature, 1987; 325:796. [ Links ]
98. Tanaka T. Physica. 1986; 140A:261 [ Links ]
99. Prin JL, Gonzalez N, Villarroel H, Ramirez M, Rojas de Gascue B. Rev. LatinAm. Metal. Mat.2012; S5: 20-23. [ Links ]
100. Villarroel H, Prin JL, Ramirez M, Bolivar G, Rojas L, Katime I, Laredo E, Rojas de Gascue B. Rev. Iberoam. Polim. 2010;11(7): 625-631. [ Links ]
101. Zhao X, Li Z, Xia B, Bajalis E, Xi X, Lin S. Chem. Eng. J. 2008;142: 263-270. [ Links ]
102. De Souza M, Figueroa Y, Ramirez A, Prin JL, Guzman P, Otero B, Rodriguez C, Katime I, Rojas de Gascue B. Rev. Iber. Polimeros. 2014; 15(4):198-210. [ Links ]
103. Gonzalez N, Contreras J, Lopez-Carrasquero F, El-Halah A, Torres C, Prin JL, Benitez J, Rojas de Gascue B. Interciencia. 2013; 38(6): 430-436. [ Links ]
104. Fuentes M, Rojas de Gascue B, Rojas L, Bucarito J, Prin JL. Rev. Int. Contam. Ambie. 2011; 27(1):5-17. [ Links ]
105. Huang S, Yang Z, Zhu H, Ren L, Tjiu W, Liu T. Macromol. Res. 2011; 20(6): 568-577. [ Links ]
106. Xiang Y, Chen D. Eur. Polym. J. 2007;43: 4178-4187. [ Links ]