Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gaceta Médica de Caracas
versión impresa ISSN 0367-4762
Gac Méd Caracas v.109 n.3 Caracas mar. 2001
La vellosidad placentaria en caso de primigesta infectada
por Plasmodium vivax y tratada con cloroquinaDrs. Olivar C Castejón S*, María P Molinaro V**, María G de Zamora***
*Coordinador General del CIADANA, Prof. Titular en Biología Celular, Fac. Cs. De la Salud, Universidad de Carabobo. Maracay. Edo. Aragua.
**Médico residente del posgrado de Obstetricia y Ginecología, Universidad de Carabobo, Hospital Central de Maracay.
***Investigador asociado del Laboratorio de Microscopia Electrónica del CIADANA, Prof. Asociado de Morfología Microscópica de la Escuela de Medicina Núcleo Aragua-Maracay.
RESUMEN
Se describen los cambios histológicos en una placenta obtenida de paciente primigesta infectada por P. Vivax y tratada con cloroquina antes del parto de un recién nacido de bajo peso. Técnicas de análisis macroscópico y microscópico se aplicaron a vellosidades cerca de la región materna de la placenta. Los hallazgos revelaron la presencia de extensas áreas del parénquima infartadas con bloqueo del flujo sanguíneo intervelloso, ausencia de eritrocitos infectados y de infiltración inflamatoria mononuclear. Presencia de nódulos sinciciales, pérdida de la estructura estromal vellositaria, congestión y vasodilatación de capilares estromales, presencia de eritrocitos nucleados en la luz de estos últimos. Además se notaron cambios degenerativos del trofoblasto, deposición de fibrina o fibrinoide perivelloso y calcificación distrófica. Ellos indican una disfunción placentaria que pronostica retardo del crecimiento intrauterino.
Palabras clave: Lesiones placentarias. P. Vivax. Cloroquina.
SUMMARY
The aim of this work is to determine the histological changes from a placenta obtained of a primigravidae infected by P. Vivax and furtherly treated with chloroquine who presented malaric crisis before delivey with newborn of low weight. Macroscopic and microscopic stains were applied near to maternal region of the placenta. The findings revealed large areas of parenchimal infarcted tissue, with blockade of the blood flow in the intervillous space, lack of infected erythrocytes and of mononuclear inflammatory infiltration. Presence of syncytial knots, loss of villous stromal structure, congestion ad dilatation of stromal capillars and nucleated erythocytes. Besides, degenerative changes in the trophoblast, fibrinoid or fibrin deposition surrounding the villi ad dystrophic calcification. These results indicate a placental dysfunction that predicts intrauterine growth retardation.
Key words: Placental lesions. P vivax. Chloroquine.
INTRODUCCIÓN
Entre 300 y 500 millones de personas, a nivel mundial, padecen de malaria y cada año mueren de 1 a 3 millones de individuos por esta causa (1). En su avance la carga de mortalidad y morbilidad es soportada fundamentalmente por mujeres embarazadas y niños. En las mujeres embarazadas, los efectos se la malaria se deben tanto a la fiebre como al proceso de infección producido por el parásito (2).
Durante el embarazo, la enfermedad febril severa ocasiona aborto, parto de feto muerto, parto prematuro y mortalidad materna. La infección por el propio parásito ocasiona anemia materna y fetal así como peso reducido al nacer.
Estas consecuencias han sido estudiadas de manera muy extensa en la infección por Plasmodium falciparum. Sin embargo, los efectos del Plasmodium vivax en la gestación se conocen muy poco (3). Estudios recientes indican que los parásitos encontrados en la placenta de mujeres embarazadas tienen genotipos diferentes de aquellos encontrados en pacientes no embarazadas (4) lo que ayudaría a entender los efectos fisiológicos de las diferentes especies de Plasmodium sobre la estructura placentaria. Los cambios patológicos placentarios provocados por Plasmodium falciparum han sido muy estudiados (5,6); no así los inducidos por el Plasmodium vivax. Una sola infección por P vivaz (2) durante el embarazo es capaz de producir retraso en el crecimiento intrauterino. En vista de que el peso placentario disminuye (5) en la infección malárica y dado que hay una elevada correlación entre peso placentario y peso fetal (7) nos proponemos realizar el estudio considerando los cambios degenerativos que ocurren en una placenta cuya paciente estuvo infectada por P vivax, en el tercer trimestre del embarazo y quien recibió tratamiento con cloroquina, para discutir así los posibles efectos de estos eventos sobre el peso del recién nacido. En este trabajo se describen los cambios histológicos observados en la vellosidad placentaria, con técnicas de análisis macroscópico y análisis microscópico, de una embarazada primigesta infectada por primera vez con P vivax y tratada de inmediato con cloroquina.
MATERIALES Y MÉTODOS
La placenta se obtuvo de una paciente de 25 años, primigesta, de la zona endémica del Paují, Santa Elena de Uairén, Icaburú, Edo. Bolívar, a las 37s de un embarazo, previo diagnóstico fehaciente positivo de infección por P vivax mediante examen de gota gruesa y extendido de sangre periférica materna por experto malariólogo. A las ocho semanas antes del parto la paciente recibió tratamiento con cloroquina por presentar crisis palúdica que comenzó con escalofríos seguidos de fiebre, sudoración y fiebre intermitente e irregular. La paciente se trató con dosis habitual de 10 tabletas en la fase terapéutica radical y se continuó con la dosis supresiva de 2 tabletas semanales durante 4 semanas, recibió un total de dieciocho tabletas. Dicha paciente se infectaba por primera vez. No hay información de otro evento clínico ocurrido durante el embarazo. No se midieron niveles de parasitemia. La placenta pesó 480 g y su espesor fue de 27 mm. El neonato pesó 2 200 g. No se conocieron las características de madurez y bienestar fetal al nacer. El diagnóstico de P vivax en gota gruesa y extendido resultó negativo para el recién nacido masculino bajo peso cuya madre se retiró de la zona endémica aparentemente sana. El estudio histológico fue realizado con conocimiento de los resultados del examen parasitológico de sangre periférica materna. Por razones obvias no se conocieron valores de parasitemia placentaria. Un técnico especializado de la unidad de malariología del Ministerio de la Salud y Desarrollo Social recibió la placenta en Aragua quien la envió al laboratorio de microscopia electrónica de Barrido del CIADANA para estudio.
Se tomaron diez secciones de tejido para preparar diez bloques de parafina de la zona materna de la placenta correspondiente a cuatro regiones marginales, dos centrales y cuatro intermedias a éstas. De cada sección se realizaron cinco láminas con la técnica de H-E. Secciones de tejidos de las mismas regiones de placenta sin infección malárica, no tratadas con cloroquina, fueron comparadas como control.
RESULTADOS
Análisis macroscópico
La placenta monocorial, monoamniótica se mostró contraída y endurecida, de color marrón obscura, con un coágulo retroplacentario de aproximadamente 2,5 cm y algunos infartos subcoriónicos. En la placa coriónica se observaron vasos coriónicos superficiales con trombos de la íntima que dan un aspecto estriado como de bandas obscuras alternadas con bandas claras.
Análisis microscópico
La observación del espacio intervelloso no reveló la presencia de glóbulos rojos infectados por P vivax ni infiltración de linfomononucleares, granulocitos, macrófagos o depósitos de pigmentos maláricos. Este estuvo representado por eritrocitos sin parásitos (Figura 1); otras secciones observadas semejan un tejido continuo donde el sincitio de una vellosidad toma contacto con el sincitio de la vellosidad vecina (Figura 2). Numerosos nódulos sinciciales fueron encontrados entre los cortes de vellosidades (Figura 1). Se observaron grandes áreas de infartos rojos (Figura 2) en todas las láminas teñidas con H-E así como infartos blancos en algunas secciones (Figura 3). Amplias regiones de parénquima placentario muestran la estructura vellosa semejando los infartos subagudos descritos en la literatura (8).
El estroma de las vellosidades ha perdido elementos estructurales por edema y se notan dilataciones o expansiones de los capilares muy pronunciadas y repletas de glóbulos rojos (Figura 4). Ocasionalmente se observó un glóbulo rojo nucleado por cada sección del capilar (Figura 1). Se observaron cambios degenerativos en la pared de los vasos de vellosidades troncales. La luz de estos vasos no posee glóbulos rojos infectados al igual que la de vellosidades terminales. El trofoblasto se mostró delgado, degenerado y a veces casi liso. La necrosis de regiones de trofoblasto se notó en muchas vellosidades, pérdida de la estructura vellosa y deposición de fibrinoide (Figura 4).
Figura 1. El espacio intervelloso (asteriscos) no contiene elementos celulares diferentes a los eritrocitos maternos. La cabeza de flecha señala regiones muy delgadas de trofoblasto vellositario. Las flechas curvas indican eritrocitos nucleados. Barra: 42 µm. H-E.

Figura 2. Área de infartación vellosa. Congestión vascular y vasodilatación llaman la atención. La flecha señala eritrocitos agregado. La flecha curva indica eritrocitos pegados a la pared del endotelio. Barra: 42 µm. H-E.
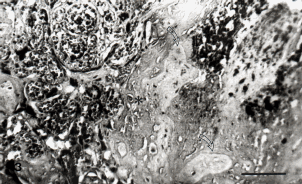
Figura 3. La mitad izquierda exhibe un grado más avanzado de infartación que el observado en la Figura 2. A la derecha se observan vellosidades fantasmales (flechas). Al centro deposición de fibrinoide con infiltración de células x (asterisco) en necrosis y calcificación distrófica en el ángulo superior derecho. Barra: 210 µm. H-E.

Figura 4. La cabeza de flecha demuestra región trofoblástica con porciones de núcleos necróticos. Edema estromal (asterisco) está presente en vellosidades infartadas con deposición de fibrinoide (flecha curva): Barra: 42 µm. H-E.
Se notó una intensa deposición de minerales que contienen calcio en todas las láminas que afecta en general la estructura de la vellosidad en su estroma o capa trofoblástica (Figura 5,6). Esta calcificación distrófica se observó también entre la zona de la decidua y las vellosidades ancorantes. La organización, en general, de la estructura de las vellosidades es diferente a la normal (Figura 7). Vellosidades terminales, intermedias maduras o inmaduras conforman un patrón morfológico caracterizado por vellosidades globulosas íntimamente asociados no existiendo espacio intervelloso. Es difícil identificar el punto de unión de las vellosidades terminales unidas al eje de la vellosidad intermedia madura que sigue una línea en zig-zag y en cuyos recodos se insertan las terminales como corresponde con el patrón normal. La zona de la decidua cuando fue vista presentó infiltración de linfomononucleares y acentuada muerte celular con células en necrosis o apoptosis. La imagen de la decidua semeja la de un tejido con numerosas perforaciones cada una de las cuales corresponde a lugares donde se encontraban las células "in vivo".

Figura 5. La flecha señala eritrocitos asociados a regiones de fibrinoide. Al centro regiones de infartación con deposición de fibrinoide. La zona superior e inferior demuestran calcificación. Barra: 210 µm. H-E.
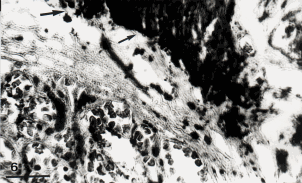
Figura 6. Las flechas señalan regiones densas de depósitos de calcio en una zona de acentuado cambio degenerativo. Restos de capilares estromales todavía se observan. Barra: 42: µm. H-E.
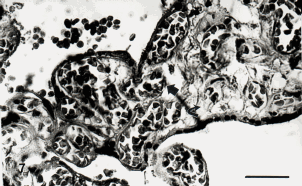
Figura 7. El patrón vellositario deformado respecto al normal muestra vellosidades terminales globulosas con dilatados sinusoides capilares. La cabeza de flecha señala cambio degenerativo de la pared del capilar. La flecha curva indica edema estromal. Barra: 42 µm. H-E.
DISCUSIÓN
La ausencia de glóbulos rojos infectados o de células del sistema inmunológico en el espacio intervelloso es indicativo de la acción de la cloroquina como fármaco antipalúdico eficaz (9). Hay una opinión generalizada y preocupante (2) sobre el descenso a nivel mundial de la eficacia de la cloroquina como antimalárico en la infección por P. falciparum (10) no así en la provocada por P vivax (2). Sin embargo, recientemente también ha sido reportada la resistencia de P. vivax al tratamiento con cloroquina y su comprobación experimental en monos (11). Aquí se reporta la ausencia de eritrocitos infectados de otras células entre las vellosidades; la estructura de estas después de la acción del P. vivax y el efecto de la cloroquina.
Por razones obvias no tenemos imágenes del tejido placentario antes del tratamiento. Los rasgos histopatológicos más resaltantes que han sido encontrados en la placenta infectada por P. Falciparum, no tratada con cloroquina, son los siguientes: numerosos eritrocitos intervellosos infectados por el Plasmodium con pigmentación malárica (12) macrófagos y depósitos de fibrina perivellosa teñida con pigmento malárico (13), depósitos de pigmentos maláricos en el trofoblasto, necrosis local trofoblástica, pérdida parcial de la vellosidad y engrosamiento de la membrana basal trofoblástica (6,14). Se conocen algunos datos sobre los efectos de la infección por P. vivax durante el embarazo (3,15) referidos a disminución de peso en el recién nacido, transmisión materno-fetal y anemia materna, pero a diferencia de la provocada por P. falciparum no está asociada a parto pretérmino, mortinato o aborto.
Estos son los primeros resultados reportados de una placenta de paciente afectada por P. vivax durante el último trimestre del embarazo, por primera vez, quien recibió tratamiento para cura radical y preventivo con cloroquina. Esta se describe como fármaco antipalúdico, seguro (16) y efectivo para embarazadas (17) y no causa toxicidad retiniana (9). Es un potente esquizonticida y gametoticida (15).
Si la cloroquina fue inocua algunos de los cambios observados pertenecen a los provocados por P. vivax desde que se inició la infección. No obstante, la acción farmacológica de la cloroquina impide la polimerización de ferritoprotoporfirina (Fp9), y causa su acumulación dentro del lisosoma del Plasmodium lo cual produce daño membranal, según ha sido descrito para el P. falciparum (18). La cloroquina, según resultados observados eliminó la parasitemia del espacio intervelloso razón por la cual no se observaron elementos celulares inflamatorios. Como no se conocieron los niveles de parasitemia desde que se iniciaron los síntomas de la enfermedad hasta después de aplicar el tratamiento es muy difícil saber el tiempo en que se eliminó la parasitemia lo que sería de interés para entender si la cloroquina está perdiendo efectividad (11,19). Ésta es capaz de eliminar la parasitemia entre 24 y 72 horas cuando no hay resistencia.
La pérdida tisular del estroma vellositario, la degeneración trofoblástica y la deposición de fibrinoide perivelloso observada coinciden con la reportada por otros en humanos (14,20,21) y ratas (22) pero sin el uso de cloroquina. Estos cambios parecen ser irreversibles o permanentes ya que se continúan observando hasta después del uso de la cloroquina. La presencia de nódulos sinciciales, infartos, depósitos de calcio, dilatación y congestión de los capilares de la vellosidad son rasgos similares observables también en desórdenes hipertensivos del embarazo, como preeclampsia, que han sido correlacionados con disminución del flujo sanguíneo en el espacio intervelloso (8). La dilatación y congestión de los capilares es propia de la detención súbita del flujo sanguíneo intervelloso como ocurre en la muerte repentina materna (23). En la malaria la fiebre se acompaña de vasodilatación lo que determina desplazamientos de líquido rápidos y masivos que resultan en edema cerebral y pulmonar (24). Estas observaciones realizadas por otros son consistentes con los resultados vasculares aquí reportados. La extremada vasodilatación observada indica una probable reacción isquémica o hipóxica de los vasos vellositarios confirmada por la presencia de eritrocitos nucleados (25). Estos son indicadores de hipoxia fetal. Es probable que la placenta observada estuvo sometida a una prolongada hipoxia fetal cercana al parto. La observación macroscópica de trombos de fibrina en los vasos superficiales de la placa coriónica soporta también la evidencia de hipoxia sostenida, sufrimiento fetal o asfixia perinatal (25). Sufrimiento fetal y asfixia neonatal son comunes con placentas calcificadas como la aquí demostrada (26).
Para esta paciente la razón de peso del recién nacido y de la placenta pRN/pPL es igual a 4,58. El espesor placentario de 27 mm nos presenta, comparando con los índices de referencia internacionales (27) un nivel de desarrollo alrededor de la semana 32 y si tomamos en cuenta la razón de 4,58 esta se corresponde con la semana 30. Ambos parámetros expresan valores por debajo de la 37s correspondiente a su valor real. Estas cifras sugieren un recién nacido de bajo peso para la edad gestacional que por haberse complicado durante el último trimestre del embarazo con infección por P. vivax probablemente haya nacido con retardo del crecimiento intrauterino (RCIU). Las consecuencias para el feto son más graves si la infección está cercana al parto o se realiza en primigesta como nuestro caso (28).
En la malaria rigurosamente controlada (29) con monos infectados por P coatneyi la parasitemia materna elevada durante el primer y tercer trimestre origina RCIU y recién nacidos de bajo peso. La necropsia revela órganos atrofiados cuando estos mueren a los pocos días de haber nacido. Parasitemia periférica materna y parasitemia placentaria son factores de riesgo para el RCIU asociado a bajo peso del recién nacido (29).
El hecho de que el peso de la placenta se mantuvo acorde con la edad gestacional manteniendo el embarazo hasta el momento del parto y no disminuyó de peso como ha sido reportado (5) probablemente se deba a la acción inmediata del uso de la cloroquina que mejora notablemente el estado hematológico de estas pacientes y eleva el hematocrito en la mujer embarazada mejora su anemia según estudio realizado con primigestas que viven en regiones endémicas (30). Esta observación es consistente con la existencia de pesos similares entre placentas con malaria activa o sin ella (31). Así el peso placentario no está influenciado por parasitemia pero el peso del recién nacido disminuye cuando hay una elevada infiltración de leucocitos mononucleados o macrófagos en el espacio intervelloso. Estas células con su elevada producción de citoquinas son probablemente responsables de este efecto adverso como han sugerido Leopardi y col. (31). Los cambios que observamos no se pudieron comparar con la estructura placentaria infectada con P. vivax, no tratada con cloroquina, por falta de estudios con esta especie. Los resultados de este estudio demuestran el patrón histopatológico de la estructura vellosa para esta placenta después de ser curada radicalmente con cloroquina. Patrón no descrito hasta la fecha en humanos con este tipo de Plasmodium.
Por otro lado, el bloqueo generalizado del espacio intervelloso por fibrina, fibrinoide o eritrocitos estancados, por fusión de vellosidades vecinas que simultáneamente degeneran con deposición de fibrinoide y los cambios degenerativos del trofoblasto prácticamente paralizan el flujo sanguíneo materno intervelloso. Se inactiva de esta manera la transmisión de nutrientes o gases en la superficie del sincitio que provoca probablemente una disminución del peso del recién nacido. Mujeres embarazadas con documentada parasitemia o episodios clínicos de malaria en el período prenatal fueron tres veces más propensas a parir un infante con RCIU (32).
Se ha descrito que la cloroquina no parece afectar el peso del recién nacido (33) de donde se infiere que los cambios placentarios aquí observados fueron provocados quizás por la acción inicial de eritrocitos infectados en el espacio intervelloso ante los cuales una infiltración inflamatoria intervellosa mononuclear masiva ocurrió (34), muy probablemente, con la subsiguiente producción de interleucinas asociadas con bajo peso al nacer. Es posible que el recién nacido de bajo peso es la expresión de un prolongado secuestramiento de eritrocitos infectados por P. vivax en el espacio intervelloso que provoca aquella disfunción placentaria. Falta todavía mucho por conocer sobre la interacción biológica del P. vivax sobre la estructura placentaria. Las lesiones placentarias descritas impiden un suministro de nutrientes adecuado al feto el cual se agrava por hipoxia durante el tiempo de infección lo cual estimula el RCIU. Estos cambios constituyen un pronóstico de RCIU.
En conclusión, cambios degenerativos en las vellosidades placentarias de una paciente primigesta, inicialmente infectada por P. vivax y posteriormente tratada con cloroquina revelan bloqueo del flujo maternal intervelloso que pronostican los mecanismos que aceleran el RCIU.
Agradecimiento
Al Dr. Edinson Vivas por la placenta obtenida en el Ambulatorio AR-1, El Paují, Santa Elena de Uairén; al asistente de enfermería Douglas Scott por facilitar información médica: al inspector de malariología Alex Briceño por diagnóstico específico del P. vivax y personal técnico del servicio de diagnóstico de la sección de malariología del Ministerio de Salud y Desarrollo Social, Maracay, Edo. Aragua. Al fondo fijo institucional de la Fac. Cs de la Salud para el CIADANA, coordinación de Administración Núcleo Aragua.
REFERENCIAS
1. White NJ. Antimalarial drug resistance and combination chemotherapy. Phil Trans Royal Soc London 1999;354:739-749. [ Links ]
2. Mc. Gready R, Nosten F. La malaria y el embarazo. Una vulnerabilidad particular. Orgyn 2000;4:52-56. [ Links ]
3. Nosten F, Mc Gready R, Simpson JA, Thwai KL, Balkan S, Cho T, et al. Effects of plasmodium vivax malaria in pregnancy. Lancet 1999;354:546-549. [ Links ]
4. Fried M, Nosten F, Brockman A, Brain BJ, Duffy PE. Maternal antibodies block malaria (letter). Nature 1988;395:851-852. [ Links ]
5. Walter PR, Garin Y, Blot P. Placental pathologic changes in malaria. Am J Pathol 1982;109:330-342. [ Links ]
6. Matteelli A, Caligaris S, Castelli F, Carosi G. The placenta and malaria. Ann Trop Med Parasitol 1997;91:803-810. [ Links ]
7. Castejón OC, Canache LA, Canache SJ, Castejón OA. La correlación de parámetros entre pesos placentarios y fetales en el tercer trimestre del embarazo. Rev Obstet Ginecol Venez 2000;60:169-174. [ Links ]
8. Castejón OC. La microscopia electrónica de barrido del infarto placentario. Salus 2000;4:19-24. [ Links ]
9. Krogstad DJ. Paludismo. En: Bennett JC, Plum F, editores. Cecil tratado de Medicina Interna. 20 ed México: Mc Graw-Hill Interamericana; 1997.p.2183-2187. [ Links ]
10. Rukaria Kaumbutho RM, OJ Wang SB, Oyieke JB. Resistance to chloroquine therapy in pregnant women with malaria parasitemia. Int J Ginecol Obstet 53:235-241. [ Links ]
11. Collins WE, Sullivan JS, Fryauff DJ, Kendall J, Jennings V, Galland GG, et al. Adaptation of chloroquine resistant strain of Plasmodium vivax from Indonesia to new world monkeys. Am J Trop Med Hyg 2000;62:491-495. [ Links ]
12. Galbraith RM, Faulk WP, Galbraith GM, Holbrook TW, Bray RS. The human materno-foetal relactionship in malaria. Identification of pigment and parasites in the placenta. Trans R Soc Trop Med Hyg 1980;74:52-60. [ Links ]
13. Philippe E, Walter P. Placental lesions in malaria. Arch Fr Pediatric 1985;42:921-923. [ Links ]
14. Yamada M, Steketee R, Abramowsky C, Kida M, Wirima J, Heymann D, et al. Plasmodium falciparum associated placental pathology: A light and electron microscopic and inmunohistologic study. Am J Trop Med Hyg 1989;41:161-168. [ Links ]
15. Schuurkamp GJT, Paika RL, Spicer PE, Kereu RK. Congenital malaria due to plasmodium vivax: A case study in Papua Guinea. Papua New Guinea Med J 1986;29:309-312. [ Links ]
16. Aguilera C. Safety of antimalarial drugs administered at prophylactic doses during pregnancy. Med Clin (Barc) 2000;115:236-237. [ Links ]
17. Mutabingwa TK, Malle LN, Mtui SN. Chloroquine therapy still useful in the managment of malaria during pregnancy in Muheza, Tanzania. Trop Geogr Med 1991;43:131-135. [ Links ]
18. Warhurst DC. A molecular marker for chloroquine resistant falciparum malaria. N Engl J Med 2001;344:292-302. [ Links ]
19. Robson JM, Conroy D, Cremin JM, Hannaford R, Dunn TA. Chloroquine resistant Plasmodium vivax: How common? Med J Australia 1993;158:502-503. [ Links ]
20. Bulmer JN, Rasheed FN, Francis N, Morrison L, Greenwoods BM. Placental malaria I. Pathological classification. Histopathology 1993;22:211-218. [ Links ]
21. Bulmer JN, Rasheed FN, Francis N, Morrison L, Greenwoods BM. Placental malaria II. A semi quantitative investigation of the pathological features. Histopa-thology 1993,22:219-225. [ Links ]
22. Tegoshi T Desowitz RS, Pirl KG, Maeno Y, Aikawa M. Placental pathology in Plasmodium berghei-infected rats. Am J Trop Med Hyg 1992;47:643-651. [ Links ]
23. Krantz KE, Kubli F. Placenta, líquido amniótico y membranas ovulares. En: Käser O, Friedberg V, Ober KG, Thomsen K, Zander J, editores. Ginecología y Obstetricia. Tomo II. Barcelona: Salvat; 1973.p.47-48. [ Links ]
24. Thomson SE. Paludismo y Babesiasis. En: Hurst JW, editor. Medicina interna. Tratado para la práctica médica. 2ª edición. Buenos Aires: Editorial Médica Panamericana SA; 1990.p.378-380. [ Links ]
25. Altshuletr G. Pathology of the placenta. En: Barness-Gilbert E, editor. Pothers pathology of the fetus and infant. Vol I. St Louis: Mosby –Year Book; 1997.p.254-261. [ Links ]
26. Benirschke K, Kaufmann P. Pathology of the human placenta. 3ª edición. New York: Springer-Verlag; 1995.p.210-213. [ Links ]
27. Lewis SH, Perrin E. Pathology of the placenta. New York: Churchill Livingstone; 1999.p.50. [ Links ]
28. Carles G, Bousquet F, Raynal P, Perreau C, Mignot V, Arbeille P. Pregnancy and malaria. J Ginecol Obstet Biol Reprod Paris 1998;27:798-805. [ Links ]
29. Davison BB, Cogswell FB, Baskin GB, Falkenstein KP, Heuson EW, Tarantal AF, et al. Plasmodium coatneyi in the rhesus monkey (Macaca mulatta) as a model of malaria in pregnancy. Am J Trop Med Hyg 1998;59:189-201. [ Links ]
30. Cot M, Le Hesran JY, Miaihes P, Roisin A, Fievet N, Barro D, et al. Effect of chloroquine prophylaxis during pregnancy on maternal haematocrit. Ann Trop Med Parasitol 1998;92:37-43. [ Links ]
31. Leopardi O, Naughten W, Salvia L, Colecchia M, Matteelli A, Zucchi A, et al. Malaric placentas. A quantitative study and clinico-pathological correlations. Path Res Pract 1996;192:892-898. [ Links ]
32. Sullivan Ad, Nyirenda T, Cullinan T, Taylor T, Harlow SD, James SA, et al. Malaria infection during pregnancy: Intrauterine grow retardation and preterm delivery in Malawi. J Infect Dis 1999;179:1580-1583. [ Links ]
33. Ghetea A, Uzcátegui O. Paludismo y embarazo. Rev Obstet Ginecol Venez 1995;55:43-45. [ Links ]
34. Menéndez C, Ordi J, Ismail MR, Ventura PJ, Aponte JJ, Kahigwa E, et al. The impact of placental malaria on gestational age and weight. J Infect Dis 2000;181:1740-1745. [ Links ]
Correspondencia: Prof. Olivar C Castejón S. Coordinador General de CIADANA. Prof. Titular en Biología Celular. Laboratorio de Microscopia Electrónica, Fac Cs. de la Salud. Universidad de Carabobo. Maracay. Edo. Aragua. Apdo 4944.














