Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gaceta Médica de Caracas
versión impresa ISSN 0367-4762
Gac Méd Caracas v.109 n.3 Caracas mar. 2001
Avances en el diagnóstico del cáncer de la mama. Importancia de la pesquisa y diagnóstico precoz. Reflexiones sobre el problema enVenezuela
Dr. José Antonio Ravelo Celis
Academia Nacional de Medicina. Trabajo de Incorporación como Individuo de Número, Sillón XXXIII.
RESUMEN
Uno de los grandes progresos de la medicina moderna es el diagnóstico temprano del cáncer mamario. Resumimos los avances en el diagnóstico, aspectos clínicos-epidemiológicos, factores de riesgo, imagenología, anatomía patológica, carcinoma in situ y lesiones subclínicas. Presentamos resultados de programas de pesquisa mamaria con mamografía en otros países, con disminución de la mortalidad, sus ventajas y desventajas. Analizamos el problema en Venezuela. Llamamos la atención sobre el predominio de casos avanzados en nuestros hospitales públicos en contraste con los centros privados que cuentan con equipos avanzados, a disposición de grupos económicos favorecidos. Señalamos estas diferencias y solicitamos ante la Academia Nacional de Medicina, asesora del gobierno en materia de salud, el desarrollo de una política de Estado en relación con el cáncer. Destacamos la importancia y necesidad de la iniciativa privadas, educación de la población, mejoramiento de la educación médica y aporte de recursos indispensables.
Palabras claves: Cáncer de mama. Pesquisa. Mortalidad. Hospitales Públicos.
SUMMARY
Early diagnosis of breast cancer is a main progress in modern medicine.
We resume advances in clinic, risk factors, radiology, pathology, in situ carcinoma and sub clinic lesions. Results of screening trials using mammography in others countries, decreasing mortality, pros and cons. We analyse the problem in Venezuela and call attention over the great number of advanced lesions seen in our public hospitals in contrast with private institutions only accessible at high costs. We stress for a State police regarding cancer problem, through the Academia National de Medicina and emphasize the importance of private cooperation in education and resources.
Key words: Breast cancer. Screening. Mortality. Public Hospitals.
INTRODUCCIÓN
Uno de los más grandes progresos alcanzados por la medicina durante los últimos años lo constituye el diagnóstico cada vez más precoz de los procesos neoplásicos que se desarrollan en el organismo humano. Esto permite la aplicación de medidas profilácticas y terapéuticas eficaces, cuando las lesiones están localizadas en determinado órgano, se incrementan las posibilidades de curación con los medios que actualmente contamos.
Nuestros conocimientos están muy distantes de descubrir el proceso íntimo que origina el cáncer. A pesar de los notables progresos alcanzados por los estudios genéticos y la biología molecular, todo hace pensar que pasaran varias décadas antes que su aplicación práctica y en gran escala, sean de uso diario. Mientras tales esperanzas no sean realidades, los programas de prevención, pesquisa y diagnóstico precoz constituyen la mejor arma que la medicina moderna puede ofrecer a estos pacientes.
Estos hechos han sido demostrados en numerosas localizaciones tumorales, con pruebas clínicas estadísticamente confiables.
Uno de los mejores ejemplos lo constituye el cáncer de la mama. Considerado como incurable hasta las primeras décadas del siglo XX, la aplicación de un método quirúrgico radical popularizado por Halsted, logró recuperar un porcentaje no despreciable de pacientes con lesiones avanzadas, que eran las diagnosticadas en esa época, sólo con la palpación de la glándula.
Pronto se puso de manifiesto que las lesiones pequeñas tenían un mejor pronóstico en cuanto a recidivas locales y control definitivo de la enfermedad y que era indispensable tener métodos diagnósticos más eficaces y sensibles que la simple exploración clínica.
Se establecieron clasificaciones de la enfermedad por estadios clínicos evolutivos, que se relacionaron con las cifras de sobrevida y de control local. Los datos obtenidos reforzaron la importancia del diagnóstico en etapas iniciales.
Con el desarrollo de las distintas especialidades y los aportes que ellas proporcionaron al diagnóstico del carcinoma mamario, este pasó a ser multidisciplinario y complejo, y depende del concurso de varios especialistas: médicos generales, ginecólogos, cirujanos, radiólogos, anatomopatólogos, etc. quienes hicieron valiosas contribuciones en tal sentido.
He considerado de interés presentar ante esta Ilustre Academia, organismo asesor por excelencia del Estado en materia de salud, un resumen de los logros alcanzados en el diagnóstico del cáncer de la mama durante los últimos años, tema que ha sido motivo de especial atención a lo largo de mi vida profesional.
Destacaremos la disminución de la mortalidad por esta enfermedad gracias a los programas de pesquisa y diagnóstico precoz.
Analizaremos el problema sanitario social del cáncer de la mama en Venezuela, acompañado de reflexiones que puedan contribuir a mejorar las desigualdades que en este aspecto existen en nuestra sociedad.
Avances en la epidemiología y clínica del cáncer mamario
Factores de riesgo
Los estudios epidemiológicos y observaciones clínicas han demostrado la existencia de más de 40 factores de riesgo en relación con el posible desarrollo del cáncer mamario. Son tomados en cuenta en el diario ejercicio clínico y en los programas de pesquisa. Haremos una breve síntesis de los más importantes, sin pretender agotar el tema ya que no es el objetivo principal de este trabajo.
Sexo
Esta es una patología predominantemente del sexo femenino. Raramente puede presentarse en varones, y alcanza en nuestro país sólo el 0,63% de las cifras de mortalidad por cáncer registradas en hombres.
Edad
Hay una clara relación entre este factor y el riesgo de desarrollar un carcinoma de la mama.
Antes de los 25 años son raros, pero existen. Nuestra paciente más joven tenía 22 años. Comienza a incrementarse a partir de los 35 a 40 años; alcanza su máxima frecuencia entre los 45 y 50 y se mantiene elevada hasta los 55 a 60 años, en que comienza a disminuir paulatinamente hasta los 80-90 (1). Nuestra paciente de mayor edad, hasta hoy, tenía 93 años.
En los países de alta incidencia como Estados Unidos, Canadá y Norte de Europa (2-4), este aumento es creciente con la edad. No ocurre lo mismo en los de riesgo intermedio como España en los cuales existe una disminución en las edades avanzadas.
Capote Negrín (5) en trabajo reciente encuentra en Venezuela un crecimiento rápido de la tasa de incidencia hasta los 45 años, seguido de un período de aumento lento, para luego crecer en forma acentuada a partir de los 65 años. Este tipo de curva es la que ha dado origen a la hipótesis de que existe un cáncer de la mujer premenopáusica y otro de la posmenopáusica (Ver Figura 1).
La mayor incidencia en premenopáusicas tiende a explicarse por motivos genéticos hereditarios (oncógenes BrCa1-BrCa2) y desequilibrios hormonales; en posmenopáusicas tardías a factores ambientales.
Figura 1. Distribución etaria entre 102 casos de carcinoma mamario. Experiencia personal. (6)
Herencia
Junto a la edad, mayor de 40 años, constituye los dos factores de riesgo más importantes.
Desde hace muchos años se conoce la tendencia a repetirse el cáncer de la mama en mujeres de una misma familia (7). Algunas veces en forma alarmante: he tenido oportunidad de tratar a 3 y hasta 5 hermanas de esa afección; a la abuela, hija y nietas en edades progresivamente decrecientes. Es cierto, el cáncer familiar con estas características no es frecuente y muchos estiman su incidencia en 5% a 10% de los casos; el tipo familiar esporádico, es mucho más frecuente.
La tendencia familiar de esta afección ha sido revisada y evaluada en múltiples estudios clínicos y epidemiológicos (2,8-11). Cuando se tienen antecedentes familiares el riesgo puede llegar a ser 4 veces mayor; en especial si se trata de parientes en primer grado de consanguinidad, madre y hermanas, en edades premenopáusicas o con cánceres bilaterales. En caso de múltiples consanguíneos el riesgo puede aumentar de 5 a 9 veces (12).
En casos de gemelos los datos epidemiológicos son de interés: 28% de concordancia en monocigóticos y 12% en dicigóticos (13). En los raros casos de cáncer mamario en el hombre los antecedentes familiares han sido señalados en 17% (14). La relación de cáncer de mama en el varón y el síndrome de Klinefelter está bien establecida, asociado a un cariotipo xxy típico de este síndrome y un 3,7% de incidencia de cáncer de mama (15,16).
En la actualidad existe gran interés y muchas esperanzas en los estudios genéticos relacionados con el cáncer de la mama. En especial con los descubrimientos alcanzados con el cáncer familiar (17,18).
La identificación de mutaciones en el gen oncosupresor P53 en el síndrome de Li-Fraumeni, que puede presentar cáncer de mama hereditario en el hombre, y su posible papel en la aparición del cáncer mamario esporádico estimularon las investigaciones. Como consecuencia de lo anterior, se elabora una hipótesis genética en los cánceres familiares que conduce a la identificación por King del gen supresor denominado BrCa1 en el cromosoma 17q21, presente en los casos de carcinoma mamario y de ovario hereditarios, especialmente en mujeres judías de la raza Askenazi, que tienen una alta incidencia de cáncer mamario familiar. El BrCa1 no ha sido detectado con frecuencia en los tumores de aparición esporádica y se encuentra en estudio en cuanto a estructura, funciones y significación. Posteriormente se ha identificado el BrCa2 en el cromosoma 13q13, considerado como un homólogo del BrCa1, asociado al cáncer de la mama familiar pero que no presenta cáncer de ovario. También se han descrito alteraciones de un gen mutante ATM en el cromosoma 11.
Se considera que pueden existir múltiples genes que pueden conferir tendencias hereditarias para el desarrollo del carcinoma mamario, por uno o muchos de ellos, a través de distintos mecanismos no claramente identificados.
Así se han acumulado múltiples estudios sobre cambios genéticos que conducen a alteraciones fenotípicas responsables del crecimiento anormal de los tejidos e incluso predictivos de posible respuesta terapéutica. Se han descrito alteraciones en numerosos cromosomas: 1, 3, 6-9, 11, 13, 15-18, 20 y con las técnicas de hibridización genómica CGH, alteraciones en los cromosomas 10, 12 y 22. Se señala que las numerosas alteraciones genéticas son más comunes en los tumores aneuploides. La investigación en los varios locus señalados (LOH) podría conducir a explicar el carácter recesivo de algunos de ellos. Se ha descrito LOH en 13q y 17p. Además se conocen los antioncógenes Rb1 y p53. Otras alteraciones citogenéticas en cáncer de la mama podrían ser atribuidas al fenómeno de amplificación de los genes, objeto actualmente de múltiples investigaciones.
El estudio de la genética, biología y química celular dominan en la actualidad el interés científico mundial. Con ellos se espera llegar a prevenir y tratar adecuadamente en el futuro el carcinoma mamario. Infortunadamente, "más es lo que queda por descubrir que lo conocido" (19).
Paridad
Desde hace muchos años se tiene claro que el carcinoma mamario ocurre con mayor frecuencia en las mujeres que no han tenido hijos o un número muy reducido de ellos, o lo han hecho después de los 36 años o más (18,20,21). En especial cuando esto se asocia a antecedentes hereditarios positivos.
El embarazo parece tener cierto papel protector para el desarrollo de esta afección (22). Según Wynder (23), esta protección estaría limitada a los que se producen en la pre y perimenopausia.
A pesar de estas investigaciones, en nuestro medio, el cáncer mamario suele verse con mucha frecuencia en multíparas, aun cuando hayan amamantado varios hijos y comenzado a tenerlos a temprana edad.
Larga historia menstrual
Múltiples trabajos señalan un mayor número de cánceres mamarios en pacientes que han tenido una menarquía precoz (24). Este hecho es difícil de demostrar en las mujeres de los países tropicales, donde ocurre con frecuencia a los 11 y a veces a los 9 años.
Un atraso de la menopausia de 2 a 5 años, más allá de los 50 años, ha sido señalado por algunos autores (25,26), como un factor de mayor riesgo moderado (1,2 a 2,3) de cáncer mamario, como consecuencia de una acción estimulante más prolongada de los estrógenos sobre el epitelio mamario.
La castración precoz, antes de los 35 años, ha sido reportada como un factor de clara disminución de desarrollo de estos tumores (27).
La administración de estrógenos en altas dosis en mujeres y en hombres homosexuales, claramente incrementa el desarrollo del cáncer de la mama (28-30).
Terapia hormonal de reemplazo
La administración de estrógenos en la peri y posmenopausia con el objeto de disminuir los síntomas y afecciones que pueden presentarse en estas edades (osteoporosis, afecciones cardiovasculares, etc.) y mejorar la calidad de vida, es motivo de muchas controversias en la actualidad. Aún no está dilucidado, el posible riesgo de promover o acelerar el desarrollo de carcinomas de mama en estas pacientes. Se señala un riesgo ligero o moderado, en dosis no elevadas de estos productos, en pacientes bien controladas y estudiadas, por períodos menores de 10 años, donde los beneficios parecen superar los riesgos calculados (31-34).
Se sabe que el riesgo aumenta con la dosis y tipo de estrógeno, tiempo de administración, edad de las pacientes, riesgo familiar, afecciones mamarias benignas o premalignas preexistentes, que aconsejan la mayor prudencia en su indicación y la adecuada investigación clínica y mamográfica en estas pacientes (34-40).
La evaluación de este riesgo, en pacientes que reciben terapia hormonal sustitutiva, se ha transformado en frecuente motivo de consulta. Numerosas mujeres que se mostraban renuentes a hacerse mamografías de pesquisa sucesivas, anuales y comparativas, hoy las hacen gustosas, a cambio de la mejor calidad de vida que les ofrece la terapia hormonal de reemplazo.
En este aspecto son mejor estudiadas y controladas (41). Esta es una parte positiva de estos tratamientos y constituye lo que he llamado "la pesquisa indirecta del cáncer mamario" y que nos ha permitido descubrir muchas lesiones subclínicas insospechadas, en nuestro medio.
Lesiones mamarias previas. Segundos primarios
Por muchos años se consideró que los cambios fibroquísticos de la mama, incrementaban en general el riesgo a tener posteriormente cáncer de mama (2,42-44). Estudios ulteriores han señalado que no todas las lesiones histológicas allí presentes tienen la misma significación, lo cual se ha reflejado en la denominación progresivamente decreciente de ellas desde displasias a cambios o condición fibroquística, consideradas por muchos como fisiológicas en la mujer cíclica.
Entre todas estas lesiones son las hiperplasias ductales atípicas (45-47), confirmadas en biopsias previas, las que tienen mayor importancia y las que deben ser cuidadosamente investigadas, evaluadas y tratadas. Otras lesiones como las papilomatosis únicas o múltiples, adenosis esclerosantes, metaplasia apocrina y los quistes mamarios (macro o microquistes) tienen menor significación siempre que no cursen con fenómenos de atipias celulares.
De mucha mayor importancia es la existencia de la llamada enfermedad lobulillar por Haagensen (2), hoy mejor conocida como carcinomas lobulillares in situ que sí constituye un factor histológico de alto riesgo de desarrollo de cáncer de la mama infiltrante (2,48-52) como insistiremos más adelante a propósito de ese tema. Este riesgo se ha calculado en 9 a 12 veces mayor y se mantiene hasta por 25 años o más después de haber sido diagnosticado. Haber padecido de cáncer en una mama constituye un claro factor de alto riesgo para presentarlo en la mama opuesta. Este está en relación con la edad en que fue diagnosticado el anterior y el tiempo transcurrido (53).
Igualmente, el antecedente de un tumor maligno previo en otro órgano constituye un factor de mayor riesgo de padecer un cáncer primario de la mama. En especial, si estuvo localizado en ovario, endometrio, colon o tiroides (54). En Venezuela la mayor asociación existe con el cáncer de cuello uterino, posiblemente por la alta incidencia de este tumor en nuestras mujeres.
Raza. Distribución geográfica y status socioeconómico
Es un hecho bien conocido desde hace muchos años que el cáncer de la mama se presenta con mayor frecuencia en mujeres de raza blanca, caucásica, originarias de Europa, países escandinavos, hebreas, anglosajonas, norteamericanas y en general residentes de los países de mayor desarrollo. También existe una alta incidencia en las mujeres blancas de Hawai. En estos países ocupa el primer puesto en incidencia y mortalidad por cáncer en el sexo femenino.
Estas cifras son menores en las mujeres de raza negra, aunque se señala su aumento en las afroamericanas (55). La incidencia es aun menor en las mujeres latinoamericanas y baja en las asiáticas.
Más que con el factor racial, el riesgo parece depender de factores ambientales y en especial de los hábitos de alimentación. Esto se demuestra en grupos étnicos considerados de bajo riesgo como las japonesas y polacas; al trasladarse a países de alta incidencia como Estados Unidos, muestran un incremento creciente de esta afección en sus descendientes (56,57).
En nuestro país de alto mestizaje, este factor racial de riesgo pierde importancia, sin embargo, creemos que predomina en las mujeres blancas, en especial descendientes de inmigrantes europeos con poca o ninguna mezcla.
Factores nutricionales
Entre ellos una dieta rica en grasas saturadas, de origen animal, especialmente presente en la alimentación diaria de los grupos socioeconómicos más favorecidos, ha sido señalado como un factor importante de riesgo de cáncer mamario y de otras localizaciones. La implantación de dietas pobres en grasa se considera como una valiosa recomendación sanitaria al nivel mundial para disminuir el riesgo de esta y otras afecciones.
Hay trabajos (58) que relacionan el acúmulo de grasa en el tronco como un factor de riesgo de cáncer de mama, descritas como mujeres tipo manzana, en comparación con las más esbeltas y longilíneas (tipo peras). El exceso de peso en general constituye un factor de riesgo de esta enfermedad, explicado por la acumulación de estrógenos en la grasa.
Radiaciones
La exposición a las radiaciones ionizantes es capaz de producir carcinoma mamario. Así lo han demostrado los trabajos de Wanebo (59) en las mujeres sobrevivientes expuestas a las radiaciones por la explosión de las bombas atómicas de Nagasaki e Hiroshima, muestran una estrecha relación entre la dosis recibida y el riesgo de cáncer de mama. Este fue el doble para las que recibieron entre 26 y 46 Rads.
Las tuberculosas tratadas con neumotórax y que recibieron múltiples fluoroscopias, tuvieron 9 veces más cánceres de mama que las tratadas con otros métodos (60). El riesgo fue igualmente mayor en las mujeres tratadas con radioterapia con fines antiflogísticos, hace ya algunos años, en los casos de mastitis y hoy totalmente abandonado (61).
El temor al riesgo producido por las radiaciones frenó por algunos años el uso de las mamografías de pesquisa. Este es uno de los motivos para no recomendarlas en mujeres jóvenes, menores de 40 años y en las embarazadas, a menos que existan dudas acerca de la existencia de un carcinoma mamario. Las dosis recibidas con los modernos equipos de mamografía, menores de 0,5 cGy por exposición han contribuido a disipar estos temores y se ha demostrado que la relación riesgobeneficio, se inclina a favor del uso racional de estas exploraciones.
Modelos matemáticos de estimación del riesgo de cáncer mamario
Recientemente se han desarrollado modelos matemáticos que incluyen múltiples variables, y que permiten determinar el riesgo relativo individual y el riesgo acumulativo de sufrir un cáncer mamario para una determinada paciente a lo largo de su vida o en un lapso establecido.
Un modelo multifactorial desarrollado por Gail y col. (62), en 1989, es el método más ampliamente usado para cuantificar y orientar a las mujeres acerca de su probabilidad de desarrollar un carcinoma de la glándula mamaria. Los factores de riesgo usados en este modelo, además de la edad de la paciente incluyen: edad de la menarquía, edad del primer nacimiento vivo, número de biopsias mamarias previas y número de familiares de primer grado con cáncer de mama. La existencia de biopsias con hiperplasia ductal atípica dobla el riesgo.
Estos modelos para estimación del riesgo son imperfectos y no toman en cuenta todos los factores conocidos para cáncer de mama. Aunque han sido validados en grandes estudios de población (63,64) y aplicados en los de quimioprevención a nivel mundial. Consideramos que en la actualidad tienen un valor limitado en la práctica clínica diaria y deben ser transmitidos a las pacientes con cautela.
La información de un riesgo relativo elevado puede tener efectos insospechados en la paciente individual, y se genera ansiedad, culpa, desconfianza y pérdida de la autoestima, así como también importantes problemas sociales. Por el contrario, un riesgo relativo bajo, puede crear una falsa sensación de seguridad que aleje a la paciente del control médico periódico.
Más allá del riesgo cuantitativo, es preferible el uso de términos cualitativos como riesgo promedio, moderado o elevado, y proponer un plan específico de seguimiento y manejo de cada paciente.
Avances en imagenología de la glándula mamaria
Entre las formas de exploración de la glándula mamaria el uso de las radiografías proporcionó resultados prometedores. Después del descubrimiento por Röentgen de los Rayos X, en 1896. Salomon en Berlín en 1913 (65,66), publica las primeras radiografías de piezas operatorias mamarias, y compara las imágenes radiográficas y anatómicas. Señala los primeros signos radiológicos de los cánceres mamarios y llama la atención sobre la presencia de las microcalcificaciones en el interior de las masas cancerosas. Este importante trabajo motivó a numerosos médicos a practicarla en los seres vivos.
Ensayos en tal sentido aparecen en Estados Unidos, Italia, Francia, Alemania, Inglaterra mediante radiografías simples o con inyección de medios de contraste en los conductos galactóforos, los cuales no perduraron.
No es sino hasta 1947 en que Raul Leborgne de Montevideo, estudia la radiografía del seno, publica numerosos trabajos de confrontación anatomoradiológicos y llama la atención sobre la importancia de las microcalcificaciones (67). En 1953 publica su libro en inglés sobre el tema y recibe reconocimiento internacional (68).
Charles Gros en Estrasburgo, Van Ronen en Amsterdam y numerosos radiólogos en su mayoría europeos, de Francia, Alemania e Inglaterra se interesan en el estudio de la radiología mamaria y las confrontaciones radioanatomo-clínicas. Ba-clesse y Chavanne la establecen como examen de rutina en la Fundación Curie de París e igual ocurre en el Instituto Gustav-Roussy por Surmont y Picard desde mediados los años 50. Gershon-Cohen en Estados Unidos junto a otros colaboradores, publican para esa época importantes artículos que demuestran la utilidad de este método.
Con el progreso en la construcción de mejores equipos y tubos de Rayos X, de placas radiográficas de mayor sensibilidad y definición, fue posible obtener mejor correlación entre las lesiones anatomopatológicas y las imágenes. El objetivo fundamental se transforma en descubrir imágenes precisas de las lesiones benignas y malignas de las mamas y descubrir los cánceres en etapas cada vez más tempranas, más curables, con tratamientos menos mutilantes y con respeto a la integridad mamaria.
La evolución tecnológica de los equipos dedicados a la mamografía tiene varias etapas de perfeccionamiento, que para mayor facilidad se ha dividido de acuerdo al año de aparición de cada uno de ellos en el mercado. De las técnicas originales de Gros e Egan, utilizadas al comienzo con placas radiográficas poco sensibles y donde se irradiaba significativamente la mama, en los años 60 aparece el mamógrafo CGR de los franceses, con tubo de molibdeno y ánodo fijo que marca un primer avance tecnológico.
Entre los años 60 y 70 aparece la Xeroxmamografía de fugaz duración. La siguiente innovación corresponde a los años 80 con los equipos de alta resolución (disminución del punto focal) con ánodo rotatorio y parrilla móvil y notable mejoría de las películas y pantallas y la utilización de la estereotaxia digital.
Cada escalón de progreso tecnológico ha significado un avance en el producto final que es la imagen mamográfica. Por eso no se justifica la existencia de mamógrafos de tecnología de los años 60 ó 70. En nuestro país todavía se utilizan estos equipos tanto al nivel público como privado, con perjuicio para las pacientes. (Cárdenas JR 2001, comunicación personal).
Con la utilización de los equipos modernos de alta resolución y el descubrimiento de lesiones mínimas no palpables de las mamas, se han desarrollado notables avances tecnológicos dirigidos a obtener muestras de las lesiones mamarias descubiertas con las mamografías. El método más comúnmente usado, lo representa la localización de las lesiones mediante colocación de agujas percutáneas para orientar al cirujano que realiza la biopsia. Más recientemente los avances tecnológicos permiten de una forma mínimamente invasiva, evitar las biopsias quirúrgicas radioguiadas y disminuir los costos (69,70).
Se toman muestras de citologías por punción con aguja fina o con aguja gruesa tipo tru-cut por estereotaxia o ecoguiadas. Se han desarrollado instrumentos como el mamotomo que permite obtener biopsias guiadas con estereotaxia en un sistema de vacío aspirativo que permite colectar una mayor cantidad de tejido para el diagnóstico (DVAB), o el llamado MIBB, similar al anterior, que son las siglas en inglés del equipo para biopsia mínimamente invasiva de la mama. O como el ABBI (Advanced Breast Biopsy Instrument) que permite retirar un fragmento de tejido de 2 a 3 cm desde la piel hasta la lesión mamaria. Con estos instrumentos se persigue obtener muestras para el diagnóstico con márgenes libres suficientes, capaces de hacer innecesaria las exéresis quirúrgicas ulteriores. Con otros instrumentos, ya diseñados, y la ayuda de la radiología es posible dejar fragmentos de gelfoam y marcas radiopacas que indiquen en futuras mamografías el sitio donde estuvo la lesión biopsiada y extirpada (71).
Hay motivos para pensar que en el futuro estos avances radiológicos y tecnológicos suplanten gran parte de la cirugía del cáncer mamario incipiente, con mínimas cicatrices o deformidades de las mamas y a costos mucho menores.
El ultrasonido moderno de alta resolución es otro método imagenológico de gran desarrollo en el estudio de las afecciones de las mamas (72). Se considera un método complementario de la mamografía, dirigido en especial al estudio de las mamas muy densas, de las masas, que permite diferenciar las lesiones quísticas de las sólidas y útil en la evaluación de los márgenes de las mismas. Se considera el método inicial de estudio en las afecciones mamarias de las mujeres menores de 30 años o en las embarazadas. Sus costos menores y el hecho de no irradiar las mamas constituyen sus mayores ventajas.
El ultrasonido mamario no puede ser considerado como método alternativo a la mamografía para la pesquisa del cáncer mamario (72) debido a sus limitaciones no superadas hasta hoy: menor capacidad de reconocimiento de las calcificaciones pequeñas, el carácter subjetivo y transitorio de las imágenes observadas, en relación con la experiencia y acuciosidad del observador.
Los grandes avances del nuevo milenio parecen ser, la mamografía digital y la resonancia magnética (RM) aplicada a la mama, ambas todavía en fase de desarrollo.
Los avances técnicos que han permitido la digitalización de las imágenes observadas, representan un paso evolutivo importante para el manejo y la interpretación de las mamografías. La posibilidad de obtener imágenes rápidamente, el mejoramiento de la imagen mediante los recursos que ofrecen las computadoras, y una mayor eficiencia en la obtención, reproducción y comparación con imágenes almacenadas, podrían ser las mayores ventajas de la mamografía digital, así como también la posibilidad de telemamografías y teleconsultas. Esto se traduciría en una mayor efectividad en los programas de pesquisa (73,74).
La resonancia magnética sin contraste no ha probado ser de utilidad en la detección o diagnóstico del cáncer de la mama. Sin embargo, su uso con contraste, tales como el Gadolinium, podría ser útil en determinar la extensión de los tumores o en descartar lesiones multicéntricas. Se han señalado sus ventajas en la evaluación de mujeres con implantes de silicón y en mamas radiográficamente densas (75,76).
Cáncer subclínico de la mama. Definición
Los cánceres subclínicos de la mama son aquellos que se diagnostican antes de dar manifestaciones clínicas. Casi siempre mediante el uso de las mamografías.
Tienen una doble connotación: la precocidad diagnóstica y un mejor pronóstico. Sin embargo, algunas lesiones profundamente ubicadas en la glándula mamaria, pueden alcanzar cierto tamaño, no palparse y ser solamente demostradas mediante las imágenes.
Ya desde el comienzo de los años 70, Gallager y Martin del Anderson Cancer Center de Houston (77,78) acuñaron el término de "cáncer mamario mínimo" para designar aquellas lesiones de muy pequeño tamaño y de mejor pronóstico. Ellos incluyeron en ese grupo los carcinomas ductales y lobulillares in situ y los carcinomas infiltrantes menores de 0,5 cm de diámetro sin metástasis axilares palpables. Este concepto, de grupos heterogéneos de lesiones con distinto pronóstico, resultó confuso, recibió diversas interpretaciones por parte de distintos patólogos y cayó en desuso. Igual ha ocurrido con las denominaciones de cánceres precoces o iniciales que se usaron en años anteriores. Hoy en día se les denomina cánceres pre o subclínicos y su pronóstico está en relación con sus características histológicas particulares.
Importancia de las lesiones subclínicas
Se ha demostrado que las lesiones subclínicas de la mama, correctamente tratadas, tienen un excelente pronóstico: 90% de sobrevida a los 10 años y 80% a los 20 años. En muchos casos tienen muy pequeño tamaño y extensión dentro de la glándula.
Representan los estados más precoces de los tumores mamarios, los de menor población celular, todavía localizados en la glándula y por tanto susceptibles de ser erradicados totalmente con los medios terapéuticos de que disponemos.
Recordemos ciertos conceptos fundamentales, antiguos pero aún vigentes y que sirvieron de base para el establecimiento de los programas de pesquisa mamográfica del cáncer.
A partir de la célula o células que inician el proceso neoplásico, en uno o varios focos, con un tiempo de duplicación celular calculado de 100 días, sólo cuando estas alcanzan un volumen celular de 106 y un tamaño de 1 mm, después de 20 duplicaciones celulares, comienzan a ser detectables con la mamografía.
Se hacen palpables al alcanzar un volumen celular de 109, el tamaño de 1 cm, y cerca de 30 o más duplicaciones.
Estos tiempos de duplicación celular son muy variables. Están en función de múltiples factores y mecanismos biológicos inherentes a las células neoplásicas, no totalmente conocidos y que decretan su ritmo de crecimiento, habiendo sido calculado según diferentes autores desde 150 a 900 días, mediante mamografías periódicas comparativas.
Uno de estos factores y quizás el más importante, es la edad de los pacientes, la perimenopausia y los mecanismos inmunológicos.
Según Feig (79), (Ver Figura 2) desde el inicio del proceso biológico neoplásico hasta el momento en que éste se hace evidente clínicamente, después de pasar por una fase no detectable, se llega a la del tumor demostrado por las mamografías de pesquisa (screening). Se inicia así el período llamado preclínico, también de latencia (sojourn time). El tiempo de ganancia para el paciente, es aquel en que se hace el diagnóstico de la lesión mediante mamografías, antes que se haga clínicamente evidente. Concepto de gran importancia en los programas de pesquisa o detección del cáncer de la mama, por las razones anteriormente enunciadas.
Figura 2. Historia natural del cáncer de mama.
Se ha demostrado que los programas de pesquisa han disminuido la mortalidad por cáncer de la mama de un 20% a 50% en mujeres de 50 o más años y se calcula que puede disminuir la mortalidad de un 12% a 24% en mujeres entre 40 a 49 años. Un 43% de los casos detectados estaban en la etapa de carcinomas in situ. De este tipo, sólo se diagnosticaban el 11% mediante la palpación.
Diagnóstico de las lesiones subclínicas
Se hace mediante historia clínica minuciosa, y se toman en cuenta los factores de riesgo. Mamografías comparativas de alta resolución y calidad; ultrasonido de alta resolución; citologías y biopsias mediante radiolocalización, estereotaxia o ecoguiadas según las disponibilidades y preferencias. Radiografías de las pieza quirúrgicas, para asegurar la extirpación total de las lesiones demostradas por la radiología.
Las imágenes en las lesiones subclínicas de la mama, deben ser técnicamente perfectas, obtenidas mediante equipos y placas de máxima calidad, con magnificación y compresión. La interpretación radiológica debe ser correcta y con información topográfica adecuada.
Imágenes en lesiones subclínicas
Se trata frecuentemente de masas, calcificaciones, distorsiones o de combinaciones de las mismas.
Masas: En ellas se destacan su densidad y contornos. Las de alta densidad y contornos irregulares son con mayor frecuencia malignas (Ver Cuadro 1) (80).
Masas subclínicas radiológicas.
Correlación histológica (212 casos)
| Benignas 138 | Malignas 74 | |
| Densidad | ||
| Alta | 45% | 55% |
| Moderada o baja | 71% | 29% |
| Contornos | ||
| Liso | 80% | 20% |
| Irregular | 50% | 50% |
Tomado de Harkins y col. JACS 1994 (80).
Calcificaciones: Reciben distintas designaciones de acuerdo a su forma, número, tamaño, agrupación y distribución. Las compactas gruesas, están frecuentemente en relación con procesos benignos. Las finas lineales y pleomórficas en relación con carcinomas ductales in situ o carcinomas infiltrantes (80) (Ver Cuadro 2)
La correlación entre las biopsias y hallazgos mamográficos, en el estudio de Kaeling y col. (81), se encuentra resumida en el Cuadro 3, donde las masas espiculadas y con microcalficaciones corresponden más frecuentemente a carcinomas invasores y muchas de las lineales a carcinomas ductales in situ..
Calcificaciones en lesiones subclínicas.
Correlación histológica
| Benignas % | Malignas % | |
| Compactas | 81 | 19 |
| Dispersas | 67 | 33 |
| Finas | 62 | 38 |
| Granulosas | 87 | 13 |
| Lineales | 65 | 35 |
| Redondas | 86 | 14 |
| Mixtas | 64 | 36 |
Microcalf. numerosas y extendidas + freq. Malignas. Harkins y col. JACS 1994 (80).
Lesiones no palpables de la mama.
Correlación de biopsia y mamografías (301 casos)
| Tipo | (%) Benignas | (%) Malignas | Invasivas In situ(%) |
| Masas marginadas | 82,8 | 10,5 | 6,7 |
| Microcalcificaciones | 71,2 | 9,4 | 19,4 |
| Masas marg. y microcalf. | 74,2 | 16,1 | 9,7 |
| Masas espiculadas | 11,8 | 88,2 | 0 |
| Masas spiculadas + Microcalf. | 33,3 | 66,7 | 0 |
Resumen de: Kaeling C. JACS 19994 (81).
A similares conclusiones llegan en nuestro medio G. Hernandez-Muñoz, I. Longobardi y col. de la Unidad de Mastología del Centro Clínico de Maternidad Leopoldo Aguerrevere, en su análisis de 141 biopsias para lesiones mamográficas no palpables, entre septiembre de 1992 y enero de 1995 (82). De 36 carcinomas subclínicos por ellos encontrados, 26 fueron menores de 1 cm, y sugieren una importante estrategia para el manejo de los hallazgos mamográficos subclínicos.
Clasificación BIRADS de las lesiones subclínicas de la mama
El Colegio Americano de Radiología en 1993 y 1995 (83) ha emitido recomendaciones para uniformar la terminología empleada en los informes mamográficos de las lesiones subclínicas mamarias. Este sistema se denomina BIRADS derivado de las siglas en inglés: Breast Imaging Reporting and Data System. Incluye términos para describir los hallazgos de las masas (forma y márgenes) y las calcificaciones (morfología y distribución), lo cual establece distintas categorías, que indican el grado de sospecha del radiólogo acerca de las anormalidades mamográficas observadas. Se resumen en el Cuadro 4.
Sistema de reporte en imagenología mamaria (Breast Imaging Reporting and Data Sistem. BIRADS) Categorías de evaluación final (84)
| Categoría | Definición |
| 0 | Estudio incompleto. Requiere estudios complementarios |
| 1 | Mamografía normal. Continuar pesquisa |
| 2 | Hallazgos de benignidad. Continuar pesquisa |
| 3 | Hallazgos probablemente benignos. Se sugiere control frecuente |
| 4 | Sospechoso. Tomar biopsia. |
| 5 | Alta sospecha de malignidad. Se debe tomar biopsia y tratar. |
Aun cuando no se le considera perfecta, la clasificación BIRADS ha recibido validación y también críticas por parte de distintos especialistas (84,85). Se considera que permite cuantificar la frecuencia del cáncer, al usar una terminología uniforme que facilita la comunicación entre radiólogos, médicos y pacientes. En general hay acuerdo en los hallazgos de los grupos 4 y 5 y se sugieren estudios a largo plazo de los pacientes incluidos en grupo 3 (86).
Métodos de localización de las lesiones mamográficas subclínicas
Existen numerosos métodos para localizar y tomar biopsia de las lesiones. Constituye un capítulo todavía en plena evolución, gracias a los múltiples progresos técnicos ya señalados anteriormente. Se busca obtener diagnósticos más exactos, con métodos cada vez menos invasivos y a costos menores.
Entre los menos invasivos, también más antiguos y menos exactos, están los señalamientos externos y la planimetría para guiar las biopsias quirúrgicas.
Entre los invasivos: las inyecciones intersticiales de distintos colorantes en las vecindades de la lesión; la colocación de agujas, una o varias, modernamente agujas arpones guiadas por radiografías para la extirpación quirúrgica de las lesiones; la estereotaxia y las ecodirigidas utilizan agujas tipo tru-cut calibre delgado o grueso.
De todos estos métodos el más usado en nuestro medio es la radiolocalización con agujas tipo Kopans o alguna de sus variantes, que tiene la ventaja de permitir extirpar totalmente las lesiones, con márgenes adecuados, comprobados mediante radiografía del espécimen. Puede hacerse con anestesia local y en forma ambulatoria (81,82). Requiere de un ambiente quirúrgico, lo que la hace más costosa y estaría indicada en las lesiones BIRADS 4 y 5, y en aquellas BIRADS 3 con cambios, en pacientes de mayor riesgo.
Muchas de las imágenes mamográficas subclínicas, resultan benignas (70% a 75%). Se estima que por otros métodos ya mencionados (estereotaxia o ecodirigidas) podrían evitarse muchas biopsias quirúrgicas inútiles. En su trabajo Hernández-Muñoz (82) presenta a este respecto un cuadro comparativo entre biopsias benignas y malignas de 20 autores distintos y la suya propia. Se aprecia una gran variabilidad que va de 1,4:1 (41,08%) en la serie de Arnesson y 7,7:1 ( 11,8%) en la serie de Graham. La suya la estima en 3:1 (25%). Nuestra experiencia, en líneas generales, a este respecto es muy similar.
El cuadro siguiente (Ver Cuadro 5) tomado de Kaeling (81) ilustra lo anteriormente expuesto. Debe destacarse la gran cantidad de carcinomas in situ en las lesiones subclínicas.
Lesiones subclínicas de la mama. Resultados en 301 localizaciones
| No encontradas | 2-2,8% |
| Complicaciones | 2,8-5,5% |
| Benignos | 71,1% |
| Malignos | 28,9% |
| In situ | 43% |
| Ductal | 37% |
| Lobulillar | 6% |
| Invasores | 57% |
| Mt. axila | 25% |
(Kaeling C y col. JACS 1994;179:267) (81).
Numerosas publicaciones recientes señalan la altísima confiabilidad (70% a 99%) y especificidad (100%) del uso de la biopsia por estereotaxia en las lesiones subclínicas mamarias, con cifras de 5% de falsos negativos y con períodos de observación por 10 a 15 años (87-92) (Ver Cuadro 6). Estas cifras mejoran en la medida en que aumenta el número de pacientes, lo que habla de la necesidad de una curva de aprendizaje con este método. La estereotaxia, aparte de equipos especiales, precisa dedicación del personal que interviene, experiencia en el manejo y cooperación del paciente, que se logra mejor con los equipos en decúbito prono. Son de importancia el adecuado seguimiento mamográfico y la toma de varios cilindros de tejidos para biopsia (71,93). Un desacuerdo entre las imágenes y la histología de la biopsia percutánea podría indicar un tumor no identificado (94). Obtener márgenes libres, es el punto crítico de la biopsia por estereotaxia. De resultar positiva la biopsia en opinión de muchos, entre ellas la nuestra, hace necesaria una extirpación más amplia para asegurar márgenes libres, lo que acarrea un doble gasto para el paciente, no siempre comprendido por las empresas de seguros.
Las biopsias con agujas gruesas guiadas por ultrasonido, ya mencionadas, son consideradas por muchos como una alternativa más fácil y económica que la estereotaxia (95).
El uso del mamotomo y otros equipos ya descritos (70,71,96) o guiados por resonancia magnética (97), posiblemente desplazarán en el futuro la cirugía de las lesiones subclínicas de la mama.
Estereotaxia + CAF o biopsia
| Autor | # casos | Confiabilidad |
| Azavedo (87) | 2 594 | 99% |
| Masood (88) | 100 | 85% |
| Fajardo (89) | 100 | 77% |
| Mitnick (9) | 300 | 96% |
| Jackson (91) | 71 | 78% |
| Pressler (92) | 62 | 70% |
| Especificidad 100% Falsos negativos 5% | ||
Avances en anatomía patológica en el cáncer de la mama
Múltiples y de gran importancia han sido los progresos y contribuciones de esta especialidad en el diagnóstico del cáncer de la mama. Solamente enumerarlas es un gran reto. Podríamos decir que es el eje del proceso diagnóstico.
El patólogo hoy en día no se limita a reconocer la existencia del tumor maligno. Su descripción y clasificación permite sacar conclusiones acerca de la dinámica tumoral, su pronóstico y orientar el tratamiento. Se trata de una anatomía patológica dinámica y no estática, como en años anteriores.
Las técnicas para obtener muestras de tejidos se han diversificado y hoy los patólogos entrenados pueden hacerlo con material proveniente de punción-aspiración con aguja fina, con cilindros de tejidos obtenidos con agujas gruesas ya descritas, ya sean guiadas por la palpación o por imágenes. La identificación y estudio del o de los ganglios centinelas provenientes de la axila, reclaman de ellos conocimiento y entrenamiento especial.
La contribución del patólogo es indispensable en los estudios de susceptibilidad genética e identificación de los oncógenes BrCa1 y BrCa2.
Aparte de factores pronósticos de tipo histológico (grado y diferenciación tumoral, invasión vascular o linfática, estado ganglionar, etc.) hoy se hace mediante inmunocitoquímica la determinación de receptores hormonales. Se establecen parámetros de cinética celular: Ki67, índice de timidina, flujocitometría y determinación del PCNa. Determinación del oncogén c-erb2, Catepsina D y del gen oncosupresorP53. Se estudian los factores relacionados con la angiogénesis, tan importantes para el establecimiento de metástasis: factores de crecimiento vascular endotelial (VEGF), epidérmico (EGF) y necrosis tumoral (TNF).
En la actualidad, uno de los capítulos de mayor estudio y no pocas controversias en la anatomía patológica del cáncer mamario, tema preferencial en los congresos de la especialidad, es el de los carcinomas in situ. En especial el ductal in situ, al cual nos referiremos brevemente a continuación. Se trata de un tema eminentemente de diagnóstico anatomopatológico y el más frecuente en las lesiones subclínicas.
Carcinomas in situ de la mama. Progresos.
Definición. Son lesiones constituidas por células malignas, ductales o lobulillares, que no traspasan la membrana basal. Algunos patólogos lo designan con el término genérico de carcinoma intraductal. Se distinguen dos tipos fundamentales: los lobulillares y los ductales, aun cuando muchos de ellos contienen ambos tipos de células (1).
El respeto a la membrana basal fue señalado por Broders en 1932. Bloodgoood en 1910 y 1934 describió el aspecto macroscópico que presentaban algunos carcinomas ductales in situ, y acuña el término de comedo. Lewis y Geschickter los estudiaron en 1938 y Foot y Stewart aportaron la mejor descripción de ellos en 1941.
Frecuencia. Esta ha variado con el tiempo. Los lobulillares descritos primero, antes del uso frecuente de la mamografía, constituían el 48% y los ductales el 33%. En la actualidad, en la llamada era mamográfica, se diagnostican con mucho mayor frecuencia los ductales in situ que alcanzan hasta un 43%, en comparación con el 11%, cuando eran reconocidos sólo por palpación.
Carcinomas lobulillares in situ. Descritos por Foot y Stewart en 1941, reciben también el nombre de neoplasia lobulillar.
Son lesiones de aparición más frecuente en la premenopausia. Se presentan como nódulos palpables, en los cuadrantes supero-externos asociadas a cambios fibroquísticos con macroquistes y desde el punto de vista histológico asociadas a hiperplasias lobulillares atípicas. Muchas veces como hallazgos inesperados en las biopsias mamarias por lesiones supuestamente benignas.
Son multifocales hasta en un 60% de los casos, bilaterales en más de la mitad, con baja tendencia a evolucionar hacia la infiltración y no producen metástasis en los ganglios axilares.
No presentan imágenes características en las mamografías sino las de las lesiones a las cuales se asocia y por tales motivos no son detectadas en los estudios de pesquisa (48-52).
Por sí mismas estas lesiones sólo representan, de acuerdo con su evolución natural, un importante marcador de alto riesgo de desarrollo de cánceres mamarios, que con frecuencia son de tipo ductal infiltrante, de aparición en otros sitios de la misma mama y no raramente en la mama opuesta. Se considera que su asociación con carcinomas infiltrantes aumenta el riesgo de recidivas locales (98).
Por tales motivos son tratados con observación periódica, sin necesidad de obtener márgenes libres cuando se las encuentra, ni con irradiación. Muchas pacientes son sometidas a quimioprevención con antiestrógenos tipo tamoxifen y constituyen una buena indicación para adenomastectomías subcutáneas o totales bilaterales, tipo oncoplásticas.
Carcinomas ductales in situ. Conceptos clínicos. Era premamográfica
La edad de presentación clínica media era aproximadamente 10 años menor que la de los tumores infiltrantes.
Constituían 3% a 5% de los tumores palpables; con un tamaño mayor de 5 cm en 28% de los casos; de ubicación preferencial (52%) en los cuadrantes superoexternos y centro mamarios, presentaban telerragia en un 20% de ellos.
Constituían tan sólo el 10% al 15% de los diagnósticos mamográficos.
Eran bien conocidas su multifocalidad de origen, estimada en el 43%; su bilateralidad de un 15% y su capacidad de infiltración estimada en ese entonces en un 12%. Se señalaba que en el 2,5% podían presentar metástasis ganglionares y el 56% de ellos eran receptores estrogénicos positivos (1).
Desde los estudios de Rosen en 1978 (99,100), en casos no tratados, se sabía que la capacidad de evolución a carcinoma invasor, era más frecuente y ocurría en menor tiempo en los ductales (66% en 9 años de seguimiento) que en los lobulillares (24% hasta por períodos de 24 años de observación). Este autor estimó que el riesgo de mortalidad por cáncer era 11 veces mayor en las pacientes que presentaban carcinomas ductales in situ no tratados (99).
Como consecuencia de este trabajo y otros ulteriores el enfoque terapéutico cambió en el caso de los ductales in situ y se hizo más radical, en la imposibilidad de establecer cuál de ellos podía evolucionar a la infiltración (100-102). El tratamiento era la mastectomía total simple con disección baja de la axila, a fin de evitar reintervenciones en caso de existir zonas de infiltración en el estudio de la pieza quirúrgica.
Con el aumento en número de los carcinomas ductales in situ en los programas de pesquisa, al emplear cada vez más la mamografía, se incrementó el estudio de su historia natural. Se trata de un grupo muy heterogéneo de lesiones histológicas, de distintos pronósticos en ocasiones, con tendencia a extenderse a lo largo de los conductos galactóforos, mucho más allá de los límites macro y microscópicos y a veces con saltos (103-105).
Con el empleo del tratamiento conservador en los carcinomas infiltrantes, desde los años 80, se aduce que es desproporcionado no poder ofrecerle este tipo de tratamiento a las lesiones no infiltrantes, de menor gravedad y casi nula mortalidad, cuando son tratadas adecuadamente (101,102,106-110).
Ante esta posibilidad se ponen de manifiesto numerosos aspectos controversiales en los estudios clínicos y anatomopatológicos de los carcinomas ductales in situ, que van desde variadas clasificaciones histológicas (111,112), significación de los distintos tipos celulares, factores pronósticos, la existencia y significación de la microinfiltración (113,114) y la ya mencionada difusión intraductal extensa.
Todos estos hechos han transformado a este tipo de tumores en motivo de numerosos estudios y controversias (115), no totalmente resueltos todavía y en tema preferencial de los congresos sobre cáncer de la mama.
Se trata fundamentalmente de un problema de diagnóstico histológico que tiene gran influencia en las decisiones terapéuticas e íntimamente vinculado a la historia natural de la enfermedad y por consiguiente a su pronóstico (105).
No siendo invasivos no tienen capacidad de producir metástasis. Constituirían la fase inicial de un proceso neoplásico que puede progresar a cáncer invasor o regresar, sólo en algunos de ellos, todavía no bien identificados.
En 1997 se llevó a cabo una reunión de consenso (116) dedicada a la unificación de criterios de clasificación de los carcinomas ductales in situ. Esta logró solo parcialmente su propósito, en vista de la diversidad de criterios expuestos, se dejan recomendaciones generales que vamos a resumir.
En contraste con las clasificaciones conocidas que eran meramente descriptivas, los nuevos sistemas de clasificación deben basarse en el grado nuclear, la presencia de necrosis, la polarización celular y la arquitectura tumoral. Los reportes anatomopatológicos deben incluir datos como: tamaño, estado de los márgenes de resección, distribución de microcalcificaciones en el tumor y fuera de él y correlación de la pieza quirúrgica, con la radiografía de la misma y los hallazgos mamográficos. Para todos estos fines es indispensable la comunicación entre los distintos especialistas involucrados (radiólogos, cirujanos y patólogos).
Esta clasificación debe reflejar la biología del carcinoma ductal in situ, con una proyección pronóstica del mismo.
Después de definir los términos de grado nuclear, necrosis y polarización celular, al referirse a la arquitectura tumoral, establece los cuadros histológicos de comedo, cribriforme, papilar, micropapilar y sólido, que fueron aceptados. La calificación de comedo se debe aplicar a aquellos crecimientos sólidos intraepiteliales que se extienden desde la membrana basal, con zona central de necrosis y casi invariablemente de un alto grado nuclear.
Al señalar las dificultades y variaciones existentes en la evaluación del tamaño y el estado de los márgenes de resección, la reunión insistió en el adecuado procesamiento de la pieza quirúrgica: su orientación, tinción de los márgenes, correlación con la radiología y estudio secuencial en múltiples bloques y cortes desde la periferia a los conductos centrales. Y el manejo de las ampliaciones de márgenes.
En opinión del panel la llamada microinvasión significa tumor invasivo y le confiere un mayor riesgo, el cual debe ser evaluado y cuantificado.
Al analizar el valor de los marcadores biológicos en estos tumores, señala que ninguno tiene hasta ahora un papel definitivo en la evaluación de las opciones terapéuticas y del pronóstico del paciente. Al considerar el progreso existente en tal sentido y su valor futuro, debe acumularse la información de los receptores de estrógenos y progesterona, el antígeno nuclear Ki67 y los del p53 y C-erbB2. Recomendaron no descartar los bloques de parafina después de cierto tiempo, con el fin de futuras determinaciones de marcadores.
Dejaron abiertas las posibilidades futuras de un sistema de clasificación universalmente aceptable, reproducible y clínicamente útil. También de la identificación de marcadores biológicos y moleculares capaces de predecir recidivas, progresión, invasión y respuesta terapéutica.
Programas de prevención, diagnóstico precoz y pesquisa (screening) en cáncer de mama. Beneficios obtenidos
Prevención primaria
La prevención primaria está dirigida a corregir los agentes iniciadores o promotores que originan la enfermedad. En el caso del cáncer mamario, de causas desconocidas, esto no es posible.
Sobre algunos factores de riesgo ya descritos se han hecho estudios para modificarlos y obtener resultados favorables.
Riesgo familiar
Ante una historia familiar de alto riesgo es posible identificar, mediante estudios genéticos los descendientes que presentan genes oncógenos mutantes BrCa 1 y 2, si los pacientes así lo desean. Sin estos estudios si el riesgo familiar es alto y las pacientes desarrollan cancerofobia se les pueden ofrecer tres posibilidades de prevención, aun en fase de evaluación:
1. Observación clínica y mamográfica más intensa desde los 30 años.
2. Quimioprevención con antiestrógenos tipo tamoxifen.
3. Extirpación total del tejido mamario con técnicas oncoplásticas y las ooforectomías para evitar la acción estimulante de los estrógenos.
Todas estas opciones deben ser individualizadas, acompañadas de evaluación y orientación psiquiátrica, confidenciales, de libre selección por las pacientes, con adecuada información y consentimiento. En especial, por el carácter todavía experimental de muchas de ellas, cuyos beneficios no han sido claramente comprobados y los distintos riesgos que conllevan.
En nuestra experiencia, de estas opciones la de mayor aceptación por las pacientes, la constituye la observación clínica y mamográfica estrecha. En segundo lugar y conjuntamente, la quimioprevención con tamoxifen o sus análogos, en pacientes cercanas a la menopausia o en posmenopausia. Las pacientes más jóvenes con frecuencia escogen la cirugía plástica mamaria, en especial si desean corregir un defecto estético concomitante.
Edad de la menarquía y menopausia. Control estrogénico
La menarquía precoz podría retardarse, con una disminución de grasas en la dieta y con la práctica de ejercicios físicos, tal como se ha demostrado en atletas. La dieta pobre en grasa disminuye la producción de estrógenos de origen endógeno.
Ya mencionamos que la ooforectomía, especialmente antes de los 35 años al producir una menopausia precoz, disminuye el riesgo de cáncer mamario lo cual podría ser recomendado en pacientes con factores de alto riesgo (27).
El uso de anticonceptivos orales de mínimo contenido estrogénico, como algunos existentes actualmente en el mercado, podría tener un efecto protector en las pacientes más jóvenes, al evitar el desarrollo del folículo y la ovulación. Nomura señala que su empleo durante cinco años equivale a adelantar la menopausia y reducir en un 30% el riesgo de cáncer mamario (117).
No administrar estrógenos en la peri y posmenopausia, en aquellas mujeres con factores de riesgo importantes, puede contribuir a disminuir la aparición del cáncer de la mama. El uso de productos sin acción estrogénica para corregir los problemas de la menopausia o antiestrógenos como el tamoxifeno están indicados en estos casos. Igualmente el estudio clínico, selección y control mamográfico anual de las pacientes sometidas a tratamientos hormonales de reemplazo, se hace indispensable.
Las pacientes que padecen cambios fibroquísticos severos, sintomáticos y sobre todo, con cirugías mamarias previas que hayan demostrado la existencia de hiperplasias ductales o lobulillares con atipias, no deben recibir terapia estrogénica. Con mayor razón si han sido tratadas de carcinomas lobulillares o ductales in situ, carcinomas de ovario y endometrio
La primiparidad tardía es un factor de riesgo modificable, con la recomendación y cumplimiento en las mujeres, de quedar embarazadas por primera vez en edades más tempranas a los 25 años.
Prevención secundaria
Tiene como fin principal reducir la mortalidad y morbilidad del cáncer mamario mediante el diagnóstico precoz dirigido a mujeres asintomáticas. En estos casos el tumor estaría localizado en la mama y podría ser curado con medios menos agresivos y de un costo menor. Reciben en inglés el nombre de programas de screening (1,118).
Se basan en exámenes clínicos periódicos, autoexamen de las mamas y mamografías comparativas. Recientemente, se ha añadido el ultrasonido mamario y la resonancia magnética en casos especiales.
A partir de los años 50 del siglo pasado los exámenes clínicos periódicos de las mamas en mujeres asintomáticas, por médicos expertos y paramédicos entrenados, fue el arma inicial de los programas de detección. Puede conducir a diagnosticar lesiones de hasta 0,5 cm, si están ubicados superficialmente, en mamas no voluminosas. Con ellos se incrementó el diagnóstico de estadios 1 en un 17%, se descubrieron un 70% de casos sin metástasis axilares y aumentó significativamente la sobrevida. Muchos cánceres fueron demostrados en el intervalo de las exploraciones (2,119,120).
Para los años 80 muchos lo consideraban el método más útil de pesquisa y se temía a los efectos de las radiaciones recibidas con las mamografías sobre las mamas (59,60).
Pronto se hizo evidente que lesiones menores de 0,5 cm o mayores, de profunda localización, no eran detectables por la palpación o sea lesiones subclínicas.
Con los progresos alcanzados por las mamografías y la disminución al mínimo de la irradiación recibida, cambiaron tales conceptos (121).
El autoexamen de las mamas, recomendado mensualmente y en el período posmenstrual contribuye a que muchas mujeres consulten con rapidez al médico. Este debe ser enseñado a las pacientes y practicado con regularidad. Con él se reportaron aumentos del diagnóstico en estadios I y II y una disminución apreciable de casos con ganglios positivos. Es un procedimiento fácil y útil sobre el cual debe insistirse a las pacientes. Desafortunadamente, muchas no los cumplen con regularidad por descuido, ignorancia o temor, lo cual limita su utilización (122-126). En trabajos procedentes de Shanghai, China, sobre 267 000 mujeres no encontraron beneficio en la reducción de la mortalidad con estudios de pesquisa, con examen físico y autoexamen mamario únicamente (127).
Gershon-Cohen (128) utilizó la mamografía en los estudios de pesquisa desde los años 60 y demostró su eficacia en la detección de tumores no palpables.
Hoy ya se conocen los resultados parciales de 8 estudios hechos al azar, que suman más de 500 000 mujeres estudiadas con mamografías de pesquisa; 180 000 de ellas entre 40-49 años, que representan 1,5 millones de mujeres-años de control en este grupo etario (129).
En 1963, The Health Insurance Plan (HIP) de Nueva York inició un estudio sobre cáncer mamario orientado a investigar el valor de la mamografía como método de detección de estos tumores y si se combinaba a la exploración clínica, en gran número de mujeres se podía disminuir la mortalidad e incrementar la supervivencia. Sesenta y dos mil mujeres sanas fueron invitadas a participar en el estudio con edades entre los 40 y 64 años. Treinta y un mil de ellas fueron sometidas a examen clínico y mamografías (dos placas) anuales por cuatro años y que continuó por 18 años. Un número igual de mujeres sin exploraciones, fueron seguidas como controles comparativos.
Los resultados demostraron una gran reducción de la mortalidad en todos los grupos de edades explorados, que alcanzaba el 36% para el grupo de más de 50 años, que se mantenía hasta por 18 años de seguimiento. El aumento de la supervivencia se atribuyó a un gran porcentaje de tumores sin metástasis axilares en el grupo estudiado, en comparación con los controles.
La mamografía sola, permitió diagnosticar un 33% de los cánceres y asociada a la clínica se incrementó en 22%. El valor de la mamografía era más bajo en las menores de 50 años, y un 79% de los casos diagnosticados por mamografías tenían ganglios axilares negativos (129).
El estudio del HIP estimuló la realización de otros en Estados Unidos. El Breast Cancer Demostration Project (BCDDP), no hecho al azar se realizó en 27 centros de ese país durante los años 70, patrocinado por la American Cancer Society y National Cancer Institute. Cada uno de estos grupos se comprometió a seguir anualmente y por cinco años 10 000 mujeres sanas entre 35 y 74 años. Doscientas ochenta mil voluntarias se sometieron a este estudio con exploración clínica, mamografías y termografía. Se logró demostrar el valor diagnóstico de la mamografía con 48% de los casos de cánceres diagnosticados solamente con este método, mayor que el HIP de Nueva York. También en este estudio se encontró un número mayor de cánceres menores de 1 cm (13,8%). Al no ser al azar incluyó a mujeres de mayor riesgo y eso explica el incremento de cánceres detectados (130-132).
La publicación de estos resultados en 1982 (133), impulsó el uso de la mamografía de pesquisa. Se comenzó a hablar de su abuso en pacientes más jóvenes (134). Se inició una gran controversia sobre los riesgos de la mamografía y su ineficacia en mujeres menores de 50 años. Este último punto es hasta hoy motivo de discusiones.
Estos hechos motivaron publicaciones que recomendaban el uso de la mamografía sólo en mujeres de más de 50 años y limitar la pesquisa a este grupo de pacientes una vez al año. Se aconsejaba no hacerlas en mujeres menores de 40 años, a menos que tuvieran antecedentes familiares de cáncer (135).
Varios estudios similares se realizaron en países europeos, de alta incidencia de cáncer mamario. En Florencia, Italia en 1970 se inició uno de ellos, con exploraciones mamográficas cada dos años y medio en mujeres entre 40 y 70 años y con un 52% de participación. Se obtuvo una importante reducción de la mortalidad en pacientes mayores de 50 años (136).
El estudio de Nigmegen, en Holanda, incluyó mujeres voluntarias entre 35 y 65 años con mamografías cada dos años, se anotó para 1982 una disminución de la mortalidad de 50% en mujeres mayores de 50 años, al inicio del estudio (137).
En 1977 en Suecia, el Swedish National Board of Health and Walfare inició un estudio de casos tomados al azar (aleatorios) en 135 000 mujeres entre 40 y 74 años, con mamografías (1 sola placa lateral), cada 24 meses (por 4 ciclos) en las menores de 50 años y cada 33 meses (por 3 ciclos) en las mayores de 50 años.
A los 7 años reportaron una disminución de la mortalidad en 31,6% entre estas mujeres y una disminución de un 25% de tumores avanzados. Estos beneficios se obtuvieron en pacientes que tenían más de 50 años al iniciarse el estudio (138,139).
En Malmö, en Suecia, en 1976 se inició un estudio con 59 000 mujeres entre 45 y 69 años, con mamografías (2 placas), a intervalos de 18 y 24 meses, por 5 ciclos (140,141).
En otro estudio iniciado en Estocolmo en 1981 (142), hecho al azar, 40 000 mujeres fueron sometidas a mamografías cada 2 años y 20 000 mujeres sirvieron de control. A los 5 años señalaron beneficios de diagnósticos más precoces en pacientes de 50 a 59 años. También en Suecia, Göteborg (143), en otro estudio con 22 000 mujeres de 40 a 59 años, exploradas con mamografías cada y año y medio, al compararlas con 30 000 controles, señalaron beneficios en el porcentaje de carcinomas in situ diagnosticados en las primeras, en tumores menores de 1 cm y un menor número de compromiso axilar (144).
En Edimburgo, Escocia, en 1979 se inició un proyecto hecho al azar que incluyó 23 500 mujeres, entre 45 y 65 años, con exploración clínica anual y mamografías en los años 1, 3, 5 y 7. Sirvieron de grupo control 22 000 mujeres sin exploraciones. La mamografía permitió encontrar un 29% de tumores menores de 1 cm, la clínica sola un 12% y en los controles un 10% (145).
El estudio canadiense se inicia en 1980, patrocinado por el National Breast Screening Study (NBCSS) 1 y 2 (146-149) dirigido a: 1. determinar la utilidad de la pesquisa, con examen clínico y mamografías anuales en mujeres voluntarias entre 40 y 49 años; 2. el valor de la mamografía anual en mujeres entre 50-59 años, en comparación con el examen físico anual; 3. el valor de los factores de riesgo para limitar la pesquisa a grupos más restringidos; 4. la relación costo-beneficio cuando se utiliza la mamografía y 5. estudiar la historia natural de cáncer mamario para evaluar la edad de ingreso en este tipo de estudios. Se conocen sólo resultados parciales y ha sido objeto de críticas (150,151).
Todos estos estudios, en especial los prospectivos hechos al azar, muestran una importante reducción de la mortalidad por cáncer de mama en mujeres mayores de 50 años, con el uso de la mamografía como método de pesquisa, con riesgo relativo calculado menor de 1 (Ver Figura 3). Este beneficio es menor en mujeres entre 40 y 49 años (Ver Figura 4).
Tres de los estudios muestran mayor mortalidad en las menores de 50 años (139,149,152). En relación con las mayores de 70 años, el número incluido es pequeño, pero se aconseja continuar en ellas estudios mamográficos anuales (153,154).
Escala para el 95% del intervalo de confianza
Figura 3. Impacto sobre la mortalidad por cáncer de mama de los estudios clínicos aleatorios (todas las edades): riesgo relativo e intervalos de confianza (118).
Escala para el 95% del intervalo de confianza
Figura 4. Impacto sobre la mortalidad de los estudios clínicos aleatorios (mujeres de 40 a 49 años de edad a la entrada): riesgo relativo e intervalos de confianza (118).
En relación con el punto controversial del beneficio de la pesquisa en mujeres entre 40 y 49 años, los estudios de metanálisis publicados entre 1993 y 1995 (155-157) muestran resultados diferentes y alguno sugiere que el beneficio hubiera sido igual si hubiesen comenzado después de los 50 años (153).
El metanálisis realizado por Smart (156) señala una disminución de 24% en la mortalidad por cáncer mamario en las mujeres entre 40-49 años (118,158).
Esta cifra podría elevarse a un 35%, según Feig (159) si todas mujeres estudiadas hubieran sido incluidas, y se hubieran realizado mamografías de dos placas, a intervalos uniformes de 12 meses, contando con todos los adelantos técnicos de las mamografías modernas.
La investigación sobre este punto continua y es posible que resultados positivos claros en tal sentido aparezcan en el futuro.
Otro punto no claramente definido es el intervalo entre las exploraciones, muy discutido todavía (160-163). Otros estudios se orientan a seleccionar la pesquisa y su frecuencia, tomando en cuenta otros factores de riesgo, calculados mediante fórmulas matemáticas como lo recomienda Chen (164,165) o guiados por estudios computarizados como ha sugerido Michaelson (166).
En resumen puede concluirse, que los estudios de pesquisa mamaria en mujeres asintomáticas mediante el examen clínico, mamografía y autoexamen son altamente útiles para diagnosticar tumores más precoces y lesiones subclínicas, se mejora la mortalidad, con métodos de tratamiento menos agresivos y de menor costo. El beneficio está claramente demostrado en mujeres de más de 50 años. Es menor y discutido en mujeres entre 40 y 49 años y el intervalo entre las exploraciones no es uniforme en los distintos estudios. Es posible que en el futuro pueda demostrarse claramente su beneficio en mujeres menores de 50 años.
La principal desventaja de los programas de pesquisa del cáncer mamario, es su alto costo, no accesible a los grupos sociales de menores recursos económicos, sin la ayuda de sistemas de seguridad social efectivos.
Desde 1983 los progresos de la mamografía de alta resolución permiten obtener imágenes de gran calidad con dosis mínimas de irradiación a la mama (0,5 cGy por cada exposición) (121). Los datos de disminución de la mortalidad hicieron evidentes que las mamografías de pesquisa eran útiles, con mínimo riesgo.
En 1997 la American Cancer Society modificó sus normas generales de pesquisa del cáncer mamario. Sus recomendaciones son:
1. En general:
v Mamografía anual a partir de los 40 años.
v Practicar el autoexamen mensualmente.
v Examen físico cada 3 años entre los 20 y 30 años y anualmente desde los 40 años.
v No se recomienda el estudio de base entre los 35 y 40 años.
2. En pacientes consideradas de alto riesgo:
v Examen clínico y mamografía anual desde los 30 años. Comenzar en ellas 10 años antes de la edad de aparición del cáncer en las madres.
v Practicar el autoexamen mensualmente.
3. En mujeres menores de 30 años, alto riesgo, embarazo, lactancia, o síntomas mamarios:
v Examen clínico, ecosonografía mamaria y una sola proyección mamográfica mediolateral para excluir microcalcificaciones. Si hay sospecha de cáncer mamario hacer mamografías (158).
Datos estadísticos de la disminución de la mortalidad por cáncer mamario en Estados Unidos
Como consecuencia de los progresos en los estudios clínicos, la pesquisa mamaria y la anatomía patológica, las ultimas estadísticas provenientes de Estados Unidos han mostrado una disminución significativa y progresiva de la mortalidad por cáncer de mama en mujeres de ese país a partir de 1990. También han disminuido las cifras de mortalidad por cáncer del útero, estómago, páncreas, ovario, colon y recto de manera muy importante en este mismo sexo. En cambio se ha incrementado en forma alarmante la mortalidad por cáncer pulmonar en ellas (167-169).
Esta disminución de mortalidad por cáncer mamario está relacionada con medidas terapéuticas más eficaces, aplicadas en etapas precoces de la enfermedad, principalmente en lesiones subclínicas diagnosticadas con los métodos de imágenes y la anatomía patológica moderna.
Aproximadamente, entre el 25% al 40% de las lesiones subclínicas están constituidas por carcinomas intraductales, lesiones microinvasivas o invasivas menores de 1 cm (T1a-T1b), la gran mayoría de ellas, sin metástasis en los ganglios axilares.
Esto ha motivado con razón que se piense lo contrario del paradigma popularizado por Bernard Fisher en los años 80 del siglo pasado, que establecía que el cáncer mamario era una enfermedad sistémica desde su comienzo. Esta creencia anularía todos los esfuerzos dirigidos hacia la pesquisa y el diagnóstico precoz.
Estamos presenciando el inicio de un nuevo paradigma más esperanzador en la "era mamográfica" así llamada por Tabar y otros (170-172).
En su historia natural el cáncer mamario tiene una etapa inicial localizado en la mama, variable en su duración, donde intervendrían distintos factores no bien conocidos todavía. En muchos casos puede ser descubierto por la imagenología moderna e identificado por la anatomía patológica. En ellos la terapéutica adecuada conduciría a la curación definitiva de la enfermedad. Esperar a que se haga clínicamente evidente implica un gran riesgo de que exista enfermedad sistémica. De allí la importancia del diagnóstico precoz (173).
Los grandes avances alcanzados en la genética y en la química celular podrían conducir a importantes descubrimientos aplicables al diagnóstico y tratamiento del cáncer de la mama, que modifiquen radicalmente el enfoque actual. Todo hace pensar que esto está lejano todavía y que los avances en tal sentido podrían ser, progresivamente coadyuvantes, de lo que hoy aplicamos.
Síntesis de la epidemiología del cáncer mamario en Venezuela
El cáncer mamario representa la primera causa en incidencia y mortalidad en mujeres de los países desarrollados. En los países en vías de desarrollo, latinoamericanos y asiáticos este riesgo es mucho menor. Nuestro país es considerado de riesgo intermediobajo, con tendencia a un aumento importante en los últimos años, no demostrado por falta de datos estadísticos confiables (5). Las altas cifras de incidencia y mortalidad provenientes de Estados Unidos, que incluyen los cálculos por edad y raza no son aplicables a Venezuela. Este error lo hemos visto en publicaciones de prensa, por parte de médicos recién llegados del exterior o en revistas dirigidas en especial al sexo femenino.
Constituye la primera causa de mortalidad en mujeres por enfermedades malignas, en numerosos países del mundo. Esto es especialmente cierto en países industrializados como Estados Unidos, Holanda, Canadá, Dinamarca, Suecia, Inglaterra, etc. donde se han calculado tasas de riesgo acumulativo de hasta 1 por cada 8 mujeres que alcancen los 74 años de edad.
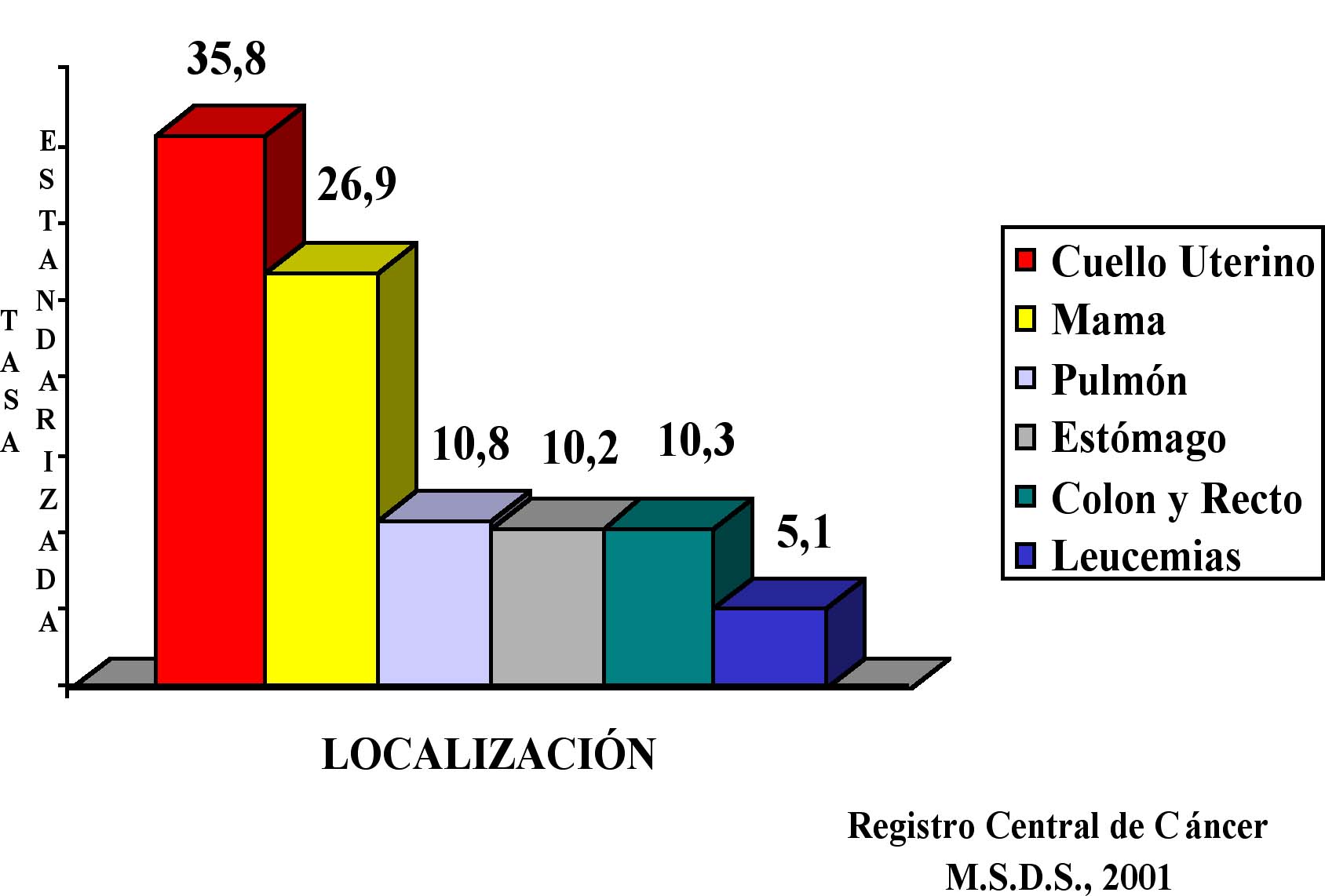
Las seis principales causas de mortalidad por cáncer en el sexo femenino en Venezuela son: cuello uterino en el primer lugar, seguida por cáncer de mama, pulmón, estómago, colon y recto y leucemias. Se nota un aumento sostenido tanto en incidencia como mortalidad por cáncer de mama.
En 1980 el cáncer de la mama representaba la tercera localización más frecuente de tumores malignos en la mujer venezolana, de acuerdo al Anuario de Epidemiología del Ministerio de Sanidad y Asistencia Social. De acuerdo al Registro de Tumores de la División de Oncología, su incidencia era de 1 055 casos por año, 1047 en mujeres y 8 casos en varones. Se estimaba la tasa de incidencia en 15 por 100 000 mujeres. Se registraron 363 muertes por año: 361 mujeres y 2 varones. La tasa de mortalidad reportada fue de 4,8 por 100 000 mujeres.
Para el año de 1993, El Dr. Luis Capote Negrín (5), Jefe de la División de Oncología del mismo Ministerio, la señala como segunda localización más frecuente de cáncer en la mujer venezolana, con una incidencia de 5 000 casos por año y una tasa de incidencia de 25 x 100 000 mujeres. La tasa acumulativa que mide el riesgo porcentual de tener cáncer de mama si se alcanza la edad de 74 años es 3%, o sea 1 por cada 33 mujeres en Venezuela. La mortalidad sube a 590 casos por año: 589 mujeres y 1 varón.
Según este mismo autor, en Venezuela la observación de las tasas de mortalidad ajustada en los últimos 40 años, muestra un aumento lento pero sostenido que ha llegado a triplicar la tasa en ese lapso y agrega: "algo parecido, o posiblemente con mayor crecimiento, es de esperar que haya ocurrido con las tasas de incidencia, lo cual no se ha constatado por falta de datos suficientes".
Esto se confirma en los datos recientes sobre mortalidad e incidencia emanados del Registro Central de Cáncer del Ministerio de Salud y Desarrollo Social, correspondiente a los años 1980-1999. En este último año fallecieron 1 019 mujeres por cáncer de mama para una tasa cruda de mortalidad de 8,65 por 100 000 mujeres. La incidencia estimada en 1999 fue de 2 497 casos para una tasa cruda de incidencia de 21,20. El cáncer de mama ocupa el segundo lugar como causa de mortalidad por cáncer en mujeres en Venezuela, después del cáncer uterino. La tasa de mortalidad estandarizada según población mundial de Segi es de 11,44 y la de riesgo porcentual de morir de cáncer si se alcanza los 74 años de edad es de 1,28. La tasa de incidencia estimada, estandarizada por grupo de edad, según población mundial de Segi es de 26,87 y el riesgo porcentual de morir de cáncer de mama, si se alcanza la edad de 74 años, calculada según el procedimiento de Day es de 2,96. (Ver Figuras 5,6,7,8).
Figura 5. Mortalidad por cáncer en mujeres. Venezuela 1999.
Figura 6. Incidencia estimada de cáncer en mujeres. Venezuela 1999.
Figura 7. Cáncer de mama. Mortalidad en Venezuela.
Figura 8. Cáncer de mama. Insidencia estimada en Venezuela.
Por otra parte en un estudio sobre la población femenina en Venezuela, la Oficina Central de Estadística e Información (OCEI), señala el aumento progresivo de mujeres mayores de 49 años en el país desde 1950 al año 2000, de 65,5 x 1 000 a un 70 x 1 000, lo cual coloca a un mayor número de mujeres en edades de mayor riesgo de padecer de cáncer de mama. Recientemente dicha oficina ha estimado que para el año 2005, existirán en Venezuela 3 500 000 mujeres mayores de 49 años.
En cuanto a la distribución geográfica en Venezuela, estudiada por Capote Negrín (5), explicable por diferentes grados de exposición a factores de riesgo, las mayores tasas de incidencia se presentan en el Distrito Federal y en los estados Miranda, Nueva Esparta, Zulia, Carabobo y Aragua que son las de mayor desarrollo económico e industrial; menor riesgo en estados de menos desarrollo y de actividades preferentemente agropecuarias. En nuestra opinión, esas regiones más desarrolladas son también las que tienen mejores centros de diagnóstico y tratamiento y constituyen áreas de referencia de estos pacientes.
Reflexiones sobre el problema diagnóstico del cáncer mamario en Venezuela
Desde mi época de interno en el Instituto Anticanceroso "Luis Razetti" ubicado en ese entonces en San Martín y aun más, durante mi residencia me llamó mucho la atención la gran cantidad de casos avanzados en todas las localizaciones tumorales, entre ellas de cáncer mamario, que consultaban en el hospital. Casi todas con voluminosas lesiones tumorales, a veces gigantescas, ulceradas, con miasis, muchas de ellas inoperables o fuera de todo tratamiento. Las recidivas locales eran frecuentes y precoces después de las mastectomías y la supervivencia muy baja.
El retardo en la consulta se atribuía a ignorancia, negligencia, temor a la mutilación, pobreza y al pudor de muchas mujeres, frente a una afección indolente en sus comienzos.
En otras oportunidades el retardo era culpa de los médicos que no examinaban las pacientes: médicos generales, gineco-obstetras, internistas y a veces cirujanos que practicaban otros procedimientos sin examinar las mamas. En ocasiones era inexplicable que un esposo médico no se diera cuenta de una lesión importante en las mamas de su mujer.
La situación era menos grave en las pacientes de las clínicas privadas pero el retardo, en general, era la regla. En esos años no existía o estaba en sus comienzos la mamografía, la palpación por parte del médico era la clave del diagnóstico y muchos de ellos no la practicaban o interpretaban incorrectamente. No habían recibido el entrenamiento adecuado durante sus estudios. No habían tenido contacto con la enfermedad a la que consideraban infrecuente y por regla general de consecuencias funestas. Muchos de ellos se graduaban con este criterio.
Lo ocurrido posteriormente es bien conocido y lo hemos destacado muy intencionalmente en el curso de este trabajo: el perfeccionamiento de los métodos de diagnóstico clínico y especialmente de la radiología mamaria y de la anatomía patológica están presentes en nuestro país y han permitido un evidente progreso en los resultados del tratamiento del cáncer mamario. Esto ha sucedido de preferencia en determinados centros privados y a altos costos.
No se han reflejado en la atención hospitalaria de las numerosas pacientes de escasos recursos económicos, que allí acuden. Este hecho, fue motivo de gran preocupación de mi parte y del grupo de colegas que por 25 años me acompañaron en el Servicio de Patología Mamaria del Instituto de Oncología Luis Razetti confinado en Cotiza.
Presentamos desde 1980 las alarmantes cifras de casos estadios IIb, III y IV en distintos Congresos Nacionales y algunos Internacionales de Oncología y Mastología. Revisiones ulteriores sobre el tema del mismo Servicio señalan que esta situación permanece igual después de varios años. Los trabajos provenientes del Hospital Oncológico "Padre Machado" (Hospital Privado), son similares a los nuestros.
Al referirnos al tratamiento del cáncer localmente avanzado de la mama, con los modernos y costosos esquemas de quimioterapia primaria o neoadyuvante, en muchos casos poco útiles, señalamos en simposia, mesas redondas y reuniones de consenso que con los millones de bolívares que costaba uno de estos tratamientos podrían haberse hecho más de 400 mamografías de pesquisa y que era necesario insistir en la pesquisa del cáncer de la mama en Venezuela.
En octubre de 1999 durante el VI Congreso Venezolano de Mastología efectuado en Porlamar, dos meses antes de la tragedia de diciembre que destruyó parcialmente el Instituto Oncológico Luis Razetti, el Servicio de Patología Mamaria de ese Hospital presentó la experiencia acumulada en la consulta de pesquisa mamaria desde 1985 a 1998 (174). Se atendieron 46 876 mujeres, con un promedio anual de 3 348. De 168 mujeres evaluadas por mamografías en 1985 esa cifra subió a 818 en 1998. La sensibilidad diagnóstica fue progresiva al disminuir la cifra de pacientes enviadas para historia clínica de 13,6% a 4,9% en 1995. La proporción de cirugías menores disminuyó desde 10,5% hasta 4,9% en 1995. Y el porcentaje de diagnósticos acertados fue de 81,6% en los últimos tres años del estudio. Sus conclusiones fueron que los esfuerzos de promover y mantener una consulta de pesquisa mamaria se ven recompensados con los resultados obtenidos y el manejo cada vez más racional de los recursos.
Después de la tragedia y al momento de redactar este trabajo la consulta de pesquisa mamaria en el mencionado hospital, continúa muy disminuida sin posibilidades de practicar mamografías. ¿Dónde pueden ir esas pacientes que carecen de recursos económicos?...
La inexistencia de programas organizados y coherentes de pesquisa del cáncer ginecológico y mamario es una falla muy grave de nuestro deficiente sistema sanitario. Lo planificado con anterioridad no se continúa o se hace mal. Estas deficiencias no son nuevas. Podríamos decir que son de larga data, de varias décadas atrás. El retardo en las citas, el gran número de pacientes, aparatos de mamografías que no funcionan adecuadamente por falta de mantenimiento o que son obsoletos, el incumplimiento del personal, el retardo en los informes de las biopsias, las huelgas, etc. son defectos frecuentes y bien conocidos de nuestros hospitales. Señalarlos es una obligación. Contribuir a sus soluciones un compromiso de todos.
Al revisar datos provenientes de otros países latinoamericanos encontramos que la consulta tardía en cáncer de la mama es un factor común (175,176). Se manifiesta entre los grupos étnicos menos favorecidos cultural y económicamente (55,177) de Estados Unidos lo que demuestra que factores educativos, culturales y de costos juegan un importante papel. Un porcentaje significativo de mujeres en países desarrollados no se someten a programas de detección y diagnóstico precoz o los abandonan después de haberlos iniciado.
Es necesario desarrollar y difundir con amplitud entre las mujeres venezolanas los beneficios que pueden recibir de los programas de pesquisa y prevención de los cánceres de cuello uterino y mama; la alta curabilidad de las lesiones tempranas, con tratamientos más conservadores y menos costosos. No esperar la aparición de los síntomas sino acudir anualmente a las consultas y practicarse con regularidad el auto examen de las mamas. Los medios modernos como la radio, televisión e internet deben multiplicar sus programas de información y orientación en tal sentido, sin incurrir en exageraciones o informaciones foráneas, que no son aplicables en Venezuela. En tal sentido es justo señalar la existencia de organizaciones privadas como Fundaseno, de reciente creación, que adelantan útiles campañas de divulgación e información entre las mujeres acerca del problema del cáncer de la mama. El interés de nuestras mujeres en la actualidad, por las enfermedades neoplásicas, se pone de manifiesto en su asistencia masiva a los llamados operativos de diagnóstico precoz de los cánceres de cuello uterino y mama, como el recientemente realizado por el Hospital Vargas de Caracas, al cual asistieron mas de 1 500 mujeres. Igual ocurrió en un operativo similar realizado por la Sociedad Anticancerosa en Barquisimeto.
Si importante es la educación de las mujeres, es aún mucho mayor la adecuada formación del médico. Su deficiente formación en el pregrado en relación con los grandes problemas oncológicos es bien conocida. Sin temor a equivocarme afirmaría que hoy en día es sólo ligeramente mejor a cuando discutimos el tema en este mismo salón en 1969 en una reunión conjunta de esta Academia con la Sociedad Venezolana de Oncología (178). Sus conclusiones fueron ignoradas al nivel universitario y todo siguió igual.
Recientemente conocimos y discutimos en este mismo recinto Académico las conclusiones y recomendaciones del Taller sobre "Enseñanza del cáncer en las Facultades de Medicina" realizado en Caracas el 21-22 de octubre de 1996, presentado por los Drs. Greta de Acquatella, Oscar Rodríguez Grimán y Dimas Hernández y en el que estuvieron representantes de las Universidades del país, de la Academia de Medicina y otras Instituciones nacionales e internacionales interesadas (179). Lo califiqué como un importante y coherente proyecto de enseñanza del cáncer en las facultades de medicina, digno de ser seguido. Al preguntar sobre su aceptación y aplicación, sólo una de las Facultades de Medicina lo había tomado en cuenta. El Dr. Miguel Requena, Decano de la Facultad de Medicina de la Universidad Central de Venezuela define allí acertadamente la enseñanza en el pregrado: "nuestros egresados deben tener una formación integral que los capacite para desempeñarse con alta eficiencia en el primer nivel de atención... que les permita pensar en la enfermedad cancerosa y en la necesidad de referir prontamente los casos sospechosos a los centros especializados, a fin de garantizar el diagnóstico y tratamiento adecuado".
La enseñanza del cáncer de la mama en el posgrado es motivo de particular atención, mediante programas de "educación continua", por parte de las Sociedades Venezolanas de Oncología, Mastología, Cirugía, Radiología, Anatomía Patológica, y Ginecología y Obstetricia, quienes en innumerables congresos y jornadas se han ocupado de actualizar todo lo concerniente a esta enfermedad y traer al país las figuras internacionales más destacadas del momento. Numerosos centros privados de Caracas y del interior del país también han colaborado en ese sentido. Especial reconocimiento merece el Dr. Gerardo Hernández Muñoz, figura internacionalmente conocida, activo profesional dedicado por muchos años a la enseñanza y difusión de la mastología, quien ha publicado múltiples trabajos y dos importantes libros sobre la materia.
La Sociedad Anticancerosa de Venezuela merece una mención muy especial a este respecto. Desde su fundación por los Drs. Alejandro Calvo Lairet y Héctor Rumbos, con el apoyo y trabajo entusiasta del Dr. Rubén Merenfeld, han contribuido con constancia y planificación a desarrollar campañas de divulgación y enseñanza de la población venezolana de los síntomas iniciales del cáncer en sus distintas localizaciones. Mediante sus 26 clínicas de prevención del cáncer distribuidas en numerosas poblaciones del país han colaborado notablemente en la detección y diagnóstico precoz del cáncer de la mama. La mala situación económica que atraviesa Venezuela en la actualidad, ha limitado mucho las donaciones particulares que impulsan sus actividades, en dotación de equipos, formación de personal especializado y en general en la expansión de sus programas de detección precoz del cáncer. Tan solo 11 de sus clínicas de prevención, las de Anaco, Maracay, Cagua, Valencia, Falcón, Mérida, Nueva Esparta, Trujillo y Lagunillas cuentan con mamógrafos. El de La Victoria no funciona todavía y otros tres requieren ser cambiados por modelos nuevos de mayor resolución.
Catorce de sus clínicas de prevención no tienen mamógrafos: las de Tejerías, San Fernando de Apure, Barinas, Upata, Puerto Cabello, San Juan de los Morros, Valle de la Pascua, Zaraza, El Vigía, Guanare, Rubio y Maracaibo. (Ott G. Expresidente de la Sociedad Anticancerosa de Venezuela. Comunicación personal 2001).
La situación de los hospitales públicos de la Región Capital en la detección y diagnóstico precoz del cáncer mamario es desastrosa. En el Instituto de Oncología "Luis Razetti" la consulta de pesquisa mamaria, después de la tragedia de diciembre de 1999 sólo puede funcionar 1 vez a la semana y no cuentan con mamografías (Cárdenas JR. Jefe del Servicio de Radiología IOLR. Comunicación Personal 2001). En el Hospital Universitario de Caracas el mamógrafo no funciona desde hace meses, como lo hemos podido comprobar en visita reciente. Los hospitales Pérez Carreño, Domingo Luciani, Vargas, Carlos Arvelo y de la Guardia Nacional cuentan con mamógrafos, pero sus rendimientos son escasos y sus interrupciones frecuentes por fallas técnicas, de materiales, de personal y otras, propias de nuestro deficiente sistema hospitalario. En general en estos centros no existen programas organizados de pesquisa del cáncer mamario.
En el interior del país muchos hospitales públicos carecen de este método diagnóstico o poseen equipos antiguos que reciben poco uso y casi ningún mantenimiento y control de calidad. En el Estado Bolívar, como ejemplo, los hospitales públicos no hacen mamografías y estas sólo se logran en centros privados.
Uno de los principales obstáculos en la pesquisa del cáncer mamario lo constituye el alto costo de las mamografías. Requiere de aparatos sofisticados y en constante proceso de mejoramiento por parte de las casas comerciales que los producen, con equipos y placas radiográficas de alta resolución, que deben ser periódicamente calibrados, sometidos a pruebas de calidad y manejados por un personal médico y paramédico especializado, altamente calificado. Es una "maestría" dentro de la radiología general en constante evolución y perfeccionamiento.
La mamografía moderna no puede ser sustituida por ningún otro método en los programas de pesquisa, pues es la única capaz de detectar las lesiones subclínicas, y es gracias a ella que se ha logrado la disminución de las cifras de mortalidad en cáncer mamario. El examen físico anual y el autoexamen no son suficientes en tal sentido. Publicaciones recientes a nivel internacional aconsejan no utilizar la mamografía en los países subdesarrollados con baja incidencia de carcinoma mamario en vista de su poca relación costobeneficio (180).
La situación de Venezuela es diferente, la incidencia del cáncer mamario va en aumento al igual que su mortalidad, cada vez más próxima a la del cáncer del cuello uterino. Nuestras costumbres son cada vez más similares a las del mundo occidental al que pertenecemos y estamos sometidos a sus mismas influencias.
Por otra parte muchos de los progresos diagnósticos alcanzados en cáncer mamario están presentes en nuestro país desde hace varios años y son aplicados con éxito en la minoría económica capaz de pagarlos. Existen clínicas privadas de pesquisa mamaria, de óptimo rendimiento (181). Tenemos la obligación de brindar las mismas oportunidades, racionalmente administradas, a quienes no tienen capacidad económica de alcanzarlas. Nuestra Constitución y principios éticos profesionales y humanos así lo imponen.
Señalar estos hechos, que ojalá puedan ser atendidos y solucionados, constituyen los motivos y fines del presente trabajo.
Para terminar, es bueno señalar que estos objetivos deben ser tarea de toda la colectividad y no solamente del Estado. Estudios internacionales han demostrado que los gobiernos por sí solos no son capaces de afrontar este reto.
La sociedad venezolana toda, debe involucrarse en preservar la salud de las mujeres del país. Venezuela es un inmenso matriarcado, donde la mujer constituye el eje fundamental, el sostén y educación de la familia y al desaparecer, por causas que pueden evitarse, dejan en la orfandad un número importante de menores que van a incrementar los graves problemas sociales que todos conocemos y estamos padeciendo.
REFERENCIAS
1. Pérez-Manga G. Cáncer de mama. Barcelona(España): Editorial MCR; 1989. [ Links ]
2. Haagensen CD, Bodian C, Haagensen DE. Breast carcinoma. Risk and detection. Filadelfia: WB Saunders Co.; 1981. [ Links ]
3. Eisenberg H. Cancer in Connecticut. Connecticut tumor registry after 1969 suplied by the Connecticut cancer epidemiology unit.Connecticut: State department of Health; 1969. [ Links ]
4. Neal AJ, Hoskin PJ. Clinical Oncology. Basic Principles and Practice. 2ª edición. New York: Oxford University Press Inc; 1997. [ Links ]
5. Capote-Negrin LG. Epidemiología del cáncer de la glándula mamaria. En: Hernández-Muñoz G, editor. Avances en Mastología. 2ª edición. Caracas: Editorial Cromotip; 1996.p.170-181. [ Links ]
6. Ravelo-Celis JA, Ravelo-Pagés R. Tratamiento preservador del cáncer de la mama. Experiencia personal en 15 años. Gac Méd Caracas 1999;107:32-55. [ Links ]
7. Anderson DE. A genetic study of human breast cancer. J Natl Cancer Inst 1972;48:1029-1037. [ Links ]
8. Penrose LS, Makenzi HJ, Karn MN. A genetical study o human mammary cancer. Br J Cancer 1948;2:168-176. [ Links ]
9. Smithers DW. Family histories of 459 patients with cancer of the breast. Br J Cancer 1948;2:163-169. [ Links ]
10. Woolf CM, Gardner EJ. The familial distribution of breast cancer in an Utha Kindred. Cancer 1951;4:515-525. [ Links ]
11. Kelsey JL, Berkowitz GS. Breast cancer epidemiology. Cancer Res 1988;48:5615-5623. [ Links ]
12. Brein C, Speizer FE, Rosner B. Family history of disease as a risk indicator. Am J Epidem 1989;3:301-308. [ Links ]
13. Knudson AG, Strong LC, Anderson ED. Heredity and cancer in man. Prog Med Genet 1973;9:113-120. [ Links ]
14. Scheike O. Factors provoking male breast cancer. En: Basil Stoll, editor. Risk factors in breast cancer. Vol 2. Londres: William Heinemann Medical Books Limited; 1976.p.173-188. [ Links ]
15. Jackson AW, Muldal SCH. Carcinoma of the male breast in association with the Klinefelter syndrome. Br Med J 1965;1:223-229. [ Links ]
16. Nadel M, Koss LG. Klinefelters syndrome and male breast cancer. Lancet 1967;2:366-371. [ Links ]
17. Hall JM, Lee MK, Newman B. Linkage of early-onset familial breast cancer to chromosome 17q21. Science 1990;250:1468-1479. [ Links ]
18. Lane-Claypton JE. A further report on cancer of the breast, with special reference to its associated antecedents conditions. Report of the Ministry of Health Nº32. Londres: The Ministry; 1926. [ Links ]
19. Dickson R, Lippman M. Genetics familial disease. En: De Vita V, Hellman S, Rosemberg S, editores. Cancer Principles and Practice of Oncology. 5ª edición. Filadelfia: Lippincot-Raven Publisher; 1997.p.1541-1616. [ Links ]
20. Stoks P. The epidemiology of cancer of the breast. The Practitioner 1957;179:223-271. [ Links ]
21. Fraumeni JF, Lloyd JW, Smith EE. Cancer mortality among nuns. Role of marital status in aethiology of neoplastic diseases in women. J Nat Cancer Inst 1969;42:445-459. [ Links ]
22. McMahon B, Cole P, Lin TM, Lowe CR. Age at the first birth and cancer of the breast. A summary of an international study. Bull WHO 1970;43:200-221. [ Links ]
23. Wynder EL, MacCormack FA, Stellman SD. The epidemiology of breast cancer in 785 United States caucasian women. Cancer 1978;41:2341-2349. [ Links ]
24. Staszewski J. Age at menarche and breast cancer. J Natl Cancer Inst 1971;47:935-940. [ Links ]
25. Levine ML, Sheehe PR, Graham S. Lactation and menstrual function as related to cancer of the breast. Am J Public Health 1964;54:580-587. [ Links ]
26. Trichopuolos D, McMahon B, Cole P. Menopause and breast cancer risk. J Natl Cance Inst 1972;48:605-613. [ Links ]
27. Lilienfeld A. The relationship of cancer of the female breast to artificial menopause and marital status. J Natl Cancer Inst 1956;9:927-934. [ Links ]
28. Dickerman HW, Martínez HL, Seger JY, Kumar SA. Estrogen regulation of human breast cancer cell Line MCF7 tissue plasminogen activator. Endoc 1989;125:492-500. [ Links ]
29. Hisson JR, Bowden RT, Moore MR. Effects of progestins, estrogens and antihormones on growth and lactate hydrogenase in human breast cancer cell Line 747D. Endoc 1989;125:418-423. [ Links ]
30. Symmers NS. Carcinoma of the breast in transsexual individuals after surgical and hormonal interference with primary and sexual characteristics. Br Medical J 1968;2:83-85. [ Links ]
31. Mann RD Hormone replacement therapy and breast cancer risk. Proceedings of a special symposium held at The Royal College of Medicine 1991; London, New Jersey: The Parthenon Publishing Group; 1992. [ Links ]
32. Dupont WD, Page Dl, Rogers LW, Parl FF. Influence of exogenous estrogens, proliferative breast disease and others variables on breast cancer risk. Cancer 1989;63:948-957. [ Links ]
33. Dupont WD, Page DL. An overview of the effect of oestrogens replacement therapy on breast cancer risk. En: Mann RD, editor. Hormone replacement therapy and breast cancer risk. New Jersey: The Parthenon Publishing Group; 1992.p.79-92. [ Links ]
34. Colditz GA, Stampfer WC, Willet DJ, Hunter JE, Manson CH, Hennenkens BA, et al. Post menopausal hormone use and risk of breast cancer: 12 years follow-up of the Nurses Health Study. En: Mann RD, editor. Hormone replacement and breast cancer rosk. New Jersey: The Parthenon Publishing Group; 1992.p.63-75. [ Links ]
35. Kelsey JL, Fisher DB, Holford TR, Livolsi VA. Exogenous estrogens and breast cancer. Br J Cancer 1983;47:757-762. [ Links ]
36. Hoover RN, Grey LW, Cole P, McMahon B. Menopausal estrogens and breast cancer. N Engl J Med 1976;295:401-405. [ Links ]
37. Brinton LA, Hoover RN, Fraumeni JF Jr. Menopausal estrogens and breast cancer risk: An expanded case control study. Br J Cancer 1986;54:825-832. [ Links ]
38. Brinton LA, Schairer C. Hormone replacement therapy and breast cancer risk: Studies within the Breast Cancer Detection Proyect. En: Mann RD, editor. Hormone replacement therapy and breast cancer risk. New Jersey: The Parthenon Publishing Group; 1992.p.53-62. [ Links ]
39. Hernández-Muñoz G. Terapia hormonal de reemplazo y riesgo de cáncer de mama. En: Hernández-Muñoz G, editor. Avances en mastología. 2ª edición. Caracas: Editorial Cromotip; 1996.p.196-205. [ Links ]
40. Hernández-Muñoz G, Hernandez-Rasquin J. Iden-tificación y manejo clínico de la mujer con un riesgo aumentado para cáncer de mama. En: Hernández-Muñoz G, editor. Avances en mastología. 2ª edición. Caracas: Editorial Cromotip; 1996.p.206-218. [ Links ]
41. Barros AC, Murta-Nascimineto C, Pinotti JA. Terapia de reposición hormonal y cáncer de mama. En: Hernández-Muñoz G, Bernardello E, Pinotti JA, editores. Cáncer de mama. Caracas: Editorial Mc Graw-Hill Interamericana de Venezuela; 1998.p.25-35. [ Links ]
42. Franz VK, Pickren JW, Melcher GW. Incidence of chronic cystic disease in so-called normal breast. Cancer 1951;4:762-774. [ Links ]
43. Warren S, Monson R, MacMahon B. Long term follow-up of patients with benign cystic masthopathy. Quoted in ethiology of human breast cancer: A review. J Natl Cancer Inst 1973;50:21-33. [ Links ]
44. Lewison EF, Lyons JG. Relationship between benign breast disease and cancer. Arch Surg 1953;66:94-107. [ Links ]
45. Page DL. Manejo clínico del riesgo aumentado y lesiones premalignas de la mama. En: Hernández-Muñoz G, editor. Avances en mastología. 2ª edición. Caracas: Editorial Cromotip; 1996.p.163-169. [ Links ]
46. Dupont WD, Parl FF, Harttman WH. Breast cancer risk associated with proliferative breast disease and atypical hiperplasia. Cancer 1993;71:1258-1265. [ Links ]
47. Tavassoli FA, Norris HJ. Comparison of the results of long-term follow-up for atypical ductal hyperplasia and intraductal hyperplasia of the breast. Cancer 1990;65:518-529. [ Links ]
48. Andersen JA. Lobular carcinoma in situ: A long term follow-up in 52 cases. Acta Pathol Microbiol Scand 1974;88:519-528. [ Links ]
49. Haagensen CD, Lane N, Lattes R. Lobular neoplasia (so-called lobular carcinoma in situ) of the breast. Cancer 1978;42:737-744. [ Links ]
50. Hutter PVP, Foot FW. Lobular carcinoma in situ. Long term follow-up. Cancer 1969;24:1080-1096. [ Links ]
51. Rosen PP, Eieberman PH, Braun DW. Lobular carcinoma in situ of the breast. Am J Surg Pathol 1978;2:225-238. [ Links ]
52. Wheeler JE. Lobular carcinoma in situ of the breast. Long term follow-up. Cancer 1974;34:544-558. [ Links ]
53. Donegan WL, Spratt JS. Cancer of the second breast. Maj Prob Clin 1979;5:464-476. [ Links ]
54. Lynch HT, Krush AJ. Carcinomas of the breast and ovary in three families. Surg Gynecol Obst 1971;133:644-649. [ Links ]
55. Satcher D. The unequal burden of cancer. Cancer 2001;91(Suppl 1):205-207 [ Links ]
56. Buell P. Changing incidence of breast cancer in Japanese -American women. J Natl Cancer Inst 1973;51:1479-1489. [ Links ]
57. Staszewski J, Haenszel WW. Cancer mortality among the Polish-born in the United States. J Natl Cancer Inst 1965;35:291-300. [ Links ]
58. Kumar N, Cantor A, Allen K, Cox Ch. Android obesity and breast carcinoma survival: Evaluation of the effects of anthropometric variables at diagnosis, incluiding body composition and body fat distribution and weight gain during life span, and survival from breast carcinoma. Cancer 2000;88(12):2751-2757. [ Links ]
59. Wanebo GK, Johnson KG, Sato K. Breast cancer after the exposure to the atomic bombings of Hiroshima and Nagasaki. New Engl J Med 1986;279:667-679. [ Links ]
60. MacKenzi I. Breast cancer following multiple fluoroscopies. Br J Cancer 1965;19:1-14. [ Links ]
61. Mettler FA, Hempelmann LH, Duton AM. Breast neoplasm in women treated with X-ray for acute post-partum mastitis. A pilot study. J Natl Cancer Inst 1969;48:803-814. [ Links ]
62. Gail MH, Brinton LA, Byar DP. Projecting indivi-dualized probabilities of developing breast cancer for white females who are being examined annually. J Natl Cancer Inst 1989;81:1879-1890. [ Links ]
63. Bondy ML, Lustbader ED, Halabi S. Validation of a breast cancer risk assessment model in women with a positive family history. J Natl Cancer Inst 1994;86:620-632. [ Links ]
64. Spiegelman D, Colditz GA, Hunter D. Validation of the Gail model predicting individual breast cancer risk. J Natl Cancer Inst 1994;86:600-618. [ Links ]
65. Gros Ch. Maladies du sein: la radiographie. Paris: Masson et Cie; 1963. [ Links ]
66. Egan R. Mammography. New York: Charles C Thomas Publishers; 1964. [ Links ]
67. Leborgne R. Diagnóstico radiológico de las afecciones mamarias. En: Uriburu JV, editor. La mama. Buenos Aires: Editorial Científica Argentina; 1957.p.52-63. [ Links ]
68. Leborgne R. The breast in roentgen diagnosis. Monte-video (Uruguay): Impresora Uruguaya SA; 1953. [ Links ]
69. Parker SH, Burbank F, Jackman RJ. Percutaneous large core breast biopsy: A multi-institutional study. Radiology 1994;193:359-364. [ Links ]
70. Liberman L. Advanced breast biopsy instrumentation: Analysis of published experience. AJR 1999;172:1413-1416. [ Links ]
71. Parker SH. Minimally invasive biopsy of ductal carcinoma in situ of the breast: The transition from diagnosis to treatment. Diagnostic and therapeutic controversis. J Am Coll Surg 2001;192(2):197-199. [ Links ]
72. Cardeñosa G. Breast imaging companion: Breast ultrasound. Filadelfia: Lippincot Williams & Wilkins; 2001. [ Links ]
73. Vyborny C. Can computers help radiologists read mammograms? Radiology 1994;191:315–317. [ Links ]
74. Kopans DB. Breast imaging: Future advances. 2ª edición. Filadelfia: Lippincot Williams & Wilkins; 1998. [ Links ]
75. Heywang SH, Wolf A, Pruss E. Imaging of the breast with Gd-DTPA: Use and limitations. Radiology 1989;171:95-103. [ Links ]
76. Stack JP, Redmond OM, Codd MB. Breast disease: Tissue characterization with Gd-DTPA enhancement profiles. Radiology 1990;174:491-494. [ Links ]
77. Gallager HS, Martin JE. An orientation to the concept of minimal breast cancer. Cancer 1971;28:1505-1509. [ Links ]
78. Gallager HS. Early breast cancer: What is it? Southern Med Bull 1971;59:10-16. [ Links ]
79. Feig SA. Estimation of currently attainable benefit from mammographic screening of women aged 40-49 years. Cancer 1995;75(10):2412-2423. [ Links ]
80. Harkins K, Tartter PI, Hermann G, Squitieri R, Brower S, Keller RJ. Multivariate analysis of roentgenologic characteristics and risk factors for nonpalpable carci-noma of the breast. J Am Coll of Surg 1994;178:149-154. [ Links ]
81. Kaeling CM, Smith TJ, Homer MJ, Taback B, Azurin D, Schmid CH, et al. Safety, accuracy and diagnostic yield of needle localization bioppsy of the breast using local anesthesia. J Am Coll of Surg 1994;179:267-271. [ Links ]
82. Hernández-Muñoz G, Longobardi I, Marín CE, Vallenilla A, Paredes R, Hernández J. Anormalidades mamográficas y la detección de carcinoma mamario subclínico. En: Hernández Muñoz G, editor. Avances en mastología. 2ª edición. Caracas: Editorial Cromotip; 1996.p.276-300. [ Links ]
83. American College of Radiology(US). Breast imaging reporting and data system (BI-RADS). 2ª edición. Reston (Va): The American College of Radiology; 1995. [ Links ]
84. Liberman L, Abramson A, Squires F, Glassman J. The breast imaging reporting and data system: Positive predictive value of mammographic features and final assesment categories. Am J of Radiol 1998;171:35-51. [ Links ]
85. Baker JA, Kornguth PJ, Floyd CE Jr. Breast imaging reporting and data system standardized mammography lexicon: Observer variability in lesion description. Am J Radiol 1966;166:773-779. [ Links ]
86. Sickles EA. Periodic mammographic follow-up of probably benign lesions: Results of 3184 consecutive cases. Radiology 1991;1179:463-478. [ Links ]
87. Azavedo E, Svane G, Auer G. Stereotactic fine needle biopsy in 2 594 mammographically detected of nonpalpable breast lesions. Lancet 1989;1:1033-1045. [ Links ]
88. Masood S, Frykberg ER, McLellan GL. Prospective evaluation of radiologically directed fine needle aspiration biopsy of nonpalpable breast lesions. Cancer 1990;66:1480-1496. [ Links ]
89. Fajardo LL, Davis J, Wiens J, Trego DC. Mammo-graphy-guided stereotactic fine -needle aspiration cytology of nonpalpable breast lesions. Prospective comparison with surgical biopsy results. A J R 1990;155:977-989. [ Links ]
90. Mitnick J, Vasquez MF, Roses DF. Stereotaxic localization for fine-needle aspiration biopsy. Initial experience with 300 patients. Arch Surg 1991; 126:1137-1149. [ Links ]
91. Jackson VP, Reynolds HE. Stereotaxic needle core biopsy and fine-needle aspiration cytologyc evaluation of nonpalpable breast lesions. Radiology 1991;181:633-645. [ Links ]
92. Pressler V, Namiki T, Cieply J, Matsuoka J, Nakashizuka M, Tauchi P, et al. Stereotactic fine needle aspiration of mammographic lesions. J A Coll Surg 1994; 178:54-58. [ Links ]
93. Burbank F. Stereotactic breast biopsy of ADH and DCIS lesion improved accuracy with the mammothome. Radiology 1997;202:643-847. [ Links ]
94. Liberman L, Drotman M, Morris E, La Trenta L, Abramson A, Zakowski MF, et al. Imaging-histologic discordance at percutaneous breast biospsy: An indicator of missed cancer. Cancer 2000;89(12):2538-2546. [ Links ]
95. Veronesi U. The lynn sage memorial lecture: New developments in breast cancer management. J A Coll Surg 2001;92:761-767. [ Links ]
96. Cangiarella J, Waisman J, Fraser Symmans W, Gross J, Cohen JM. Mammotome core biopsy for mammary microcalfication: Analysis of 160 biopsies from 142 women with surgical and radiologic followup. Cancer 2001;91:173-177. [ Links ]
97. Fisher U, Vosshenrich R, Keating D. MR –guided biopsy of suspect breast lesions with a simple stereotaxic add-on device for surface coils. Radiology 1994;192:212-223. [ Links ]
98. Aaron S, Fowble B, Hanlon A, Torosian M, Freedman G, Boraas M, et al. Lobular carcinoma in situ increases the risk of local recurrence in selected patients with stages I and II breast carcinoma treated with conservative surgery and radiation. Cancer 2001; 91(10):1862-1869. [ Links ]
99. Rosen PP, Braun DW, Kinne DW. The clinical significance of pre-invasive breast carcinoma. Cancer 1980;46:919-925. [ Links ]
100. Rosen PP, Senie R, Schottenfeld D, Ashikari R. Noninvasive breast carcinoma: Frecuency of unsuspected invasion and implications for treatment. Ann Surg 1979;189:377-389. [ Links ]
101. Page DL, Dupont WD, Rogers LW, Landenberger M. Intraductal carcinoma of the breast: Follow-up after biopsy only. Cancer 1982;49:751-758. [ Links ]
102. Simpson JF, Page DL. Pathology of preinvasive and excellent-prognosis breast cancer. Curr Opin Oncol 1991;3:1008-1013. [ Links ]
103. Frykberg E, Bland KI. In situ breast carcinoma. Adv Surg 1993;26:29-72. [ Links ]
104. De Vita V. Cancer of the breast: in situ carcinoma. En: De Vita V, Hellman S, Rosemberg S, editores. Cancer Principles and practice of oncology. 4ª edición. Filadelfia: J.B. Lippincott Co; 1993.p.1279-1301. [ Links ]
105. Morrow M. The natural history of ductal carcinoma in situ. Implication for clinical decision making. Cancer 1995;76(7):1113-1115. [ Links ]
106. Paredes R, Hernández JE, Hernández G. Carcinoma in situ. En: Hernández-Muñoz G, editor. Avances en mastología. 2ª edición. Caracas: Editorial Cromotip; 1996.p.317-327. [ Links ]
107. Holland P, Bundred N. The management of ductal carcinoma in situ. The Breast 1994;3:1-2. [ Links ]
108. Solin L, Yen I, Kurtz J,Fourquet A, Recht A, Kuske R, et al. Ductal carcinoma in situ (intraductal carcinoma) of the breast treated with conserving surgery and definitive irradiation. Cancer 1993;71(8):2532-2542. [ Links ]
109. Silvertein M, Gierson E, Colburn W, Cope LM, Furmanski M, Senofsky GM, et al. Can intraductal carcinoma be excised completely by local excision? Clinical and pathologic predictors. Cancer 1994;73(12):2985-2989. [ Links ]
110. Recht A, Van Dongen JA, Fentiman IS. Third meeting of the ductal carcinoma in situ working party of the EORTC (Fundacione Isola S Giorgia. Venezia, 1994): Conference report. Eur J Cancer 1994;30A(12):1895-1901. [ Links ]
111. Holland R, Peters JL. Ductal carcinoma in situ: A proposal for a new clasification. Semin Diag Pathol 1994;11(3):167-180. [ Links ]
112. Silverstein M, Lagios MD, Craig PH, Waisman J, Lewinsky B, Colburn W, et al. A prognostic index for ductal carcinoma in situ of the breast. Cancer 1996;77(11):2267-2274. [ Links ]
113. Wong JH, Kapald KH, Morton DL. The impact of microinvasion on axillary node metastasis and survival in patients with intraductal breast cancer. Arch Surg 1990;125:1298-1301. [ Links ]
114. Rosner D, Lane WW, Penetrante R. Ductal carcinoma in situ with microinvasion: A curable entity usin surgery alone without need for adjuvant therapy. Cancer 1991;67:1498-1503. [ Links ]
115. Swallow C, Van Zee KJ, Sacchini V, Borgen PI. Ductal carcinoma in situ of the breast: Progress and controversy. Current problems in surgery 1996;33(7):553-608. [ Links ]
116. Consensus Conference on the Classification of Ductal Carcinoma In Situ. The Consensus Conference Committee. Cancer 1997;80(9):1798-1802. [ Links ]
117. Nomura AMV, Kolonel LN, Hirorata T. The association of replacement estrogens with breast cancer. Int J Cancer 1986;37:49-63. [ Links ]
118. Rimer B, Schildkraut J. Cancer screening. En: De Vita V, Hellman S, Rosemberg S, editores. Cancer Principles and practice of oncology. 5ª edición. Filadelfia: Lippincot-Raven Publisher; 1997.p.619-631. [ Links ]
119. Bailet A, Davey J, Pentney M. Screening for breast cancer. A report of 11,654 examinations. Clinical Oncology 1976;2:317-326. [ Links ]
120. Mahoney L, Bird B, Cooke G. Annual clinical examination. The best available screening test for breast cancer. N Engl J Med 1980;301:315-324. [ Links ]
121. Feig SA, Ehrlich SM. Estimation of radiation risk from screening mammography: Recent trends and comparison of expected benefits. Radiology 1990;174:638–647. [ Links ]
122. Baines C. Some thoughts on why women dont do self examination. Can Med Assoc J 1983;128:317-325. [ Links ]
123. Foster R, Lang S, Costanza M. Breast self examination practices and breast cancer stage. N Engl J Med 1978;99:265-278. [ Links ]
124. Feldman J, Carter A. Breast self examination rela-tionship to stage of breast cancer diagnosis. Cancer 1981;47:2740-2756. [ Links ]
125. Calnan M, Chamber Lain J, Moss S. Compliance with a class teaching breast self examination. J Epidem Community Health 1981;37:264-277. [ Links ]
126. Huguley C, Brown R. Value of breast self examination. Cancer 1981;47:989-994. [ Links ]
127. Thomas DB, Gao Dl, Self SG, Allison CJ, Mahloch J, Hirorata T. Randomized trial of breast self examination in Shanghai: Methodology and preliminary results. J Nat Cancer Inst 1997;89:355-365. [ Links ]
128. Gershson-Cohen J, Angleby H, Berger SM, Davis J, Layton J. Mammographic screening for breast cancer. Radiology 1967;88:823-836. [ Links ]
129. Fletcher S, Black W, Harris R, Rimer B, Shapiro S. Special article: Report of the international workshop on screening for breast cancer. J Natl Cancer Inst 1993;85:1644-1679. [ Links ]
130. Miller A. Screening clinical practice: Mammography, reviewing the evidence, epidemiology aspect. Can Fam Physician 1993;39:85-96. [ Links ]
131. Morrison A, Brisson J, Khalid N. Breast cancer incidence and mortality in the breast cancer detection demonstration project. J Nat Cancer Inst 1988;80:1540-1554. [ Links ]
132. Miller AB. Routine mammography and the National Breast Screening Study. Can Med Assc J 1984;130:259-267. [ Links ]
133. Larry H, Baker MD. Breast Cancer detection demos-tration project. Five year summary report. Cancer for Clinicians 1982;32:49-56. [ Links ]
134. Bailar JC. Mammography: A contrary view. Ann Intern Med 1976;84:77-84. [ Links ]
135. American Cancer Society (US). Circular Letter MA-35. New York: The American Society; 1983. [ Links ]
136. Palli D, Del Turco MR, Buiatti E. A case control study of the efficacy of a no randomized breast cancer screening program in Florence, Italy. Int J Cancer 1986;38:501-513. [ Links ]
137. Verbeek ALM, Hendriks JM, Holland R. Mammography screening at breast cancer mortality: Age specific effects in Nijmegen project. 1975-1982. Lancet 1985;1:865-879. [ Links ]
138. Tabar L, Fagerberg G, Duffy S, Day N, Gad A, Grontoft O. Breast imaging: Current status and future directions. Update of the Swedish two-country program of mammographic screening for breast cancer. Radiol Clin North Am 1992;30:187-199. [ Links ]
139. Tabar L, Duffy S, Burhenne L. New Swedish breast cancer detection results for women aged 40-49. Cancer 1993;72:1437-1443. [ Links ]
140. Andersson I, Aspegren K, Janzon L, Duffy S, Gad A. Mammographic screening and mortality from breast cancer: The Malmo mammographic screening trial. BMJ 1988;297:943-958. [ Links ]
141. Smart C. The role of mammography in the prevention of mortality from breast cancer. Cancer Prevention 1989;1:100-114. [ Links ]
142. Frisell J, Eklund G, Hellstom L. Five years experience from breast cancer screening program in Stockolm (abstract). 4th meeting of the EORTC Breast Cancer Working Conference. Londres: The Conference; 1987.E.6. [ Links ]
143. Bjurstam N, Cahlim E, Eriksson O. Breast Cancer Screening Project (Göteborg, Sweden.) An efficient program for breast screening by mammography. Experiences from two screening rounds (abstract). 4th meeting of the EORTC Breast Cancer Working Conference. Londres: The Conference; 1987.E16. [ Links ]
144. Tabár L, Fagerberg CJ, Gad A. Reduction in mortality from breast cancer after mass screening with mammography. Lancet 1985;1:829-839. [ Links ]
145. Roberts MM, Alexander FE, Anderson TJ. The Edimburg randomized trial of screening (abstract). 4th meeting of the EORTC Breast Cancer Working Conference. Londres: The Conference 1987.E21.
146. Miller AB. Etude Nationale sur le despistage du cancer du sein: Une ocassion pur le medicins du famile. Cancer Fam Physican 1982;28:590-599. [ Links ]
147. Miller AB. Screening for breast cancer: A review. Eur J Cancer Clin Oncolog 1988;24:49-60. [ Links ]
148. Miller AB, Baines CJ, To T, Wall C. Canadian national breast screening study: (2) breast cancer detection and death rates among women aged 50 to 59 years. Can Med Assoc J 1992;147:1477-1491. [ Links ]
149. Miller AB, Baines CJ, To T, Wall C. Canadian national breast screening study: (1) breast cancer detection and death rates among women aged 40 to 49 years. Can Med Assoc J 1992;147:1458-1479. [ Links ]
150. Burhenne L, Burhenne H. The Canadian national breast screening study: A Canadian critique. AJR 1993;161:761-765. [ Links ]
151. Kopans DB. The canadian screening program: A different perspective (Commentary). AJR 1990;155:748-756. [ Links ]
152. Hurley SF, Kaldor JM. The benefits and risks of mammographic screening for breast cancer. Epidemiol Rev 1992;14:101-119. [ Links ]
153. Costanza ME. The extent of breast cancer screening in older women. Cancer 1994;74(Suppl 7):2046-2058. [ Links ]
154. Van Dijck JA, Holland R, Verbeek AL, Hendriks JH, Mravunac M. Efficacy of mammographic screening of the elderly: A case-referent study in the Nijmegen program in the Netherlands. J Natl Cancer Inst 1994;86:934-949. [ Links ]
155. Eckhardt S, Badellino F, Murphy GP. UICC meeting on breast cancer screening in pre-menopausal women in developed countries. Int J Cancer 1994;56:1-18. [ Links ]
156. Smart CR, Hendrcik RE, Rutledge JH, Smith RA. Benefit of mammography screening in women ages 40 to 49 years: Current evidence from randomized controlled trials. Cancer 1995;75:1619-1636. [ Links ]
157. Kerlikowske K, Grady D, Barclay J, Sickles E, Eaton A, Emster V. Positive predictive value of screening mammography by age and family history of breast cancer. JAMA 1993;270:1-17. [ Links ]
158. Cardeñosa G. Breast imaging companion: Screening mammography. Filadelfia: Lippincot Williams & Wilkins; 2001. [ Links ]
159. Feig S. Estimation of currently attainable benefit from mammographic screening of women aged 40-49 Years. Cancer 1995;75(10):2412-2419. [ Links ]
160. Michelson J, Kopans D, Cady B. The breast carcinoma screening interval is important. Cancer 2000;88:1282-1284. [ Links ]
161. Hunt KA, Rosen EL, Sickles EA. Outcome analysis for women undergoing annual versus biennal screening mammography: A review of 24,211 examinations. AJR Am J Roentgenol 1999;173:285-289. [ Links ]
162. Tabar L, Duffy SW, Vitak B, Chen H-H, Prevost TC. The natural history of breast carcinoma: What have we learned from screening? Cancer 1999;86:449-462. [ Links ]
163. Anderson T, Alexander F, Forrest P. The natural history of breast cancer: What have we learned from sreening? (Correspondence). Cancer 2000;88:1758-1759. [ Links ]
164. Chen HH, Duffy SW, Tabar L, Day NE. Markov chain models for progression of breast cancer. Part I: tumor attributes and the preclinical screen-detectable phase. J Epidemiol Biostat 1997;2:9-23. [ Links ]
165. Chen HH, Duffy SW, Tabar L, Day NE. Markov chain models for pregression of breast cancer. Part II: prediction of outcome for differents screening regimes. J Epidemiol Biostat 1997;2:25-35. [ Links ]
166. Michaelson JS, Halpern E, Kopans DB. Breast cancer computer simulation method for estimating optimal interval for screening. Radiology 1999;212:551-560. [ Links ]
167. Greenlee R, Hill-Harmon MB, Murray T, Thun M. Cancer Statistics 2001 (Corrección en: CA Cancer J Clin 2001;51:144). CA Cancer J Clin 2001;51:15-36. [ Links ]
168. Landis SH, Murray T, Bolden S, Wingo PA. Cancer Statistics 1999. CA Cancer J Clin 1999;49:8-31. [ Links ]
169. Parkin DM, Pisani P, Ferlay J. Global Cancer Statistics. CACancer J Clin 1999;49:33-64. [ Links ]
170. Tabar L, Dean PB, Kaufman CS, Duffy SW, Chen HH. A new era in the diagnosis of breast cancer. Surg Oncol Clinic North Am 2000;9:233-277. [ Links ]
171. Cady B. New era in the breast cancer. Impact of screening on disease presentation. Surg Oncol Clin North Am 1997;6:195-202. [ Links ]
172. Cady B. Traditional and future management of non-palpable breast cancer. Am Surg 1997;63:55-58. [ Links ]
173. Tubiana M, Koscielny S. Natural history of human breast cancer: Recent data and clinical implications. Breast Cancer Res Treat 1991;18:125-140. [ Links ]
174. Gotera G, Alvarez J, Martínez P, Betancourt L, Romero G, Paredes R. Efectividad de la consulta de pesquisa mamaria en el Instituto de Oncología "Luis Razetti". Memorias del VI Congreso Venezolano de Mastología. Porlamar 1999. En prensa 2001. [ Links ]
175. Pinotti JA, Cerri C, Tojal MR, Ruiz CA. Organización de programas de detección y control de cáncer de mama. En: Hernández-Muñoz G, Bernardello E, Pinotti JA, editores. Cáncer de mama. Caracas: Editorial McGraw-Hill Interamericana de Venezuela; 1998.p.12-17. [ Links ]
176. Sampaio J Jr, Sampaio JC. Model for cancer prevention and detection program to be carried out in devoloping countries. Sao Paulo (Brasil): Instituto Brasileiro de Controle de Cancer, Fundaçao "Centro de Pesquisa de Oncología"; 1979. [ Links ]
177. Jacobs E, Lauderdale D. Receipt of cancer screening procedures among hispanic and non-hispanic health maintenance organization members. Cancer 2001; 91(Suppl 1):257-261. [ Links ]
178. Ravelo-Celis JA. Reflexiones sobre docencia en Oncología. Trabajo presentado en la Academia Nacional de Medicina en las sesiones conjuntas con la Sociedad Venezolana de Oncología sobre "Balance Nacional del Cáncer, 12 de Junio de 1969". Act Oncol Venez 1969;2:79-86. [ Links ]
179. Acquatella G de, Rodríguez Grimán O, Hernández D. Enseñanza del cáncer en las Facultades de Medicina. Seminario Taller. Caracas: Gráficas La Bodoniana; 1997. [ Links ]
180. Sankaranarayanan R. Integration of cost-effective early detection programs into the health services for developing countries. Cancer 2000;89:475-481. [ Links ]
181. Acosta V, Longobardi I, Marín E, Pérez JA. Biopsia mamaria por estereotaxia: Experiencia en el Centro Clínico de Estereotaxia (Ceclines). Rev Venez Oncol 1998;10(4):192-197. [ Links ]