Interciencia
versión impresa ISSN 0378-1844
INCI v.31 n.1 Caracas ene. 2006
SISTEMAS NEURALES DE RETROALIMENTACIÓN DURANTE EL CICLO REPRODUCTIVO ANUAL DE LA OVEJA: UNA REVISIÓN
Jaime Arroyo Ledezma, Jaime Gallegos-Sánchez, Alejandro Villa Godoy y Javier Valencia Méndez
Jaime Arroyo Ledezma. M. en C., Programa de Ganadería, Colegio de Postgraduados, México. Candidato a Doctor, Programa de Doctorado en Ciencias de la Producción y de la Salud Animal, Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México (UNAM). Profesor, Departamento de Producción Agrícola y Animal, Universidad Autónoma Metropolitana (UAM), Unidad Xochimilco, México.
Jaime Gallegos-Sánchez. Doctor en Ciencias, Universidad de París VI, Francia. Profesor Investigador, Colegio de Postgraduados, Campus Montecillo, México.
Alejandro Villa Godoy. Doctor en Filosofía, Michigan State University, EEUU. Profesor, Facultad de Medicina Veterinaria y Zootecnia, UNAM, México.
Javier Valencia Méndez. Doctor en Medicina Veterinaria, Tieraerztliche, Hochschule, Hanover, Alemania. Investigador, UNAM, México. Dirección: Facultad de Medicina Veterinaria y Zootecnia, UNAM. Ciudad Universitaria, México D.F., C.P. 04510, México. e-mail: jjvm@servidor.unam.mx
Resumen
El ciclo reproductivo anual de la oveja es regulado por la amplitud del fotoperiodo. La señal luminosa se traduce en una señal hormonal a través de la síntesis de melatonina. La disminución en la duración del fotoperiodo induce la actividad reproductiva y el aumento en las horas luz, inhibe la actividad ovulatoria estral, la conducta de estro y la ovulación (anestro estacional). Durante la época reproductiva, la progesterona (P4) regula los ciclos estrales de la oveja inhibiendo la secreción pulsátil de la hormona liberadora de gonadotropinas (GnRH) a nivel del área preóptica (POA) del hipotálamo, donde ejerce su acción de manera indirecta, posiblemente a través del ácido gama amino butírico (GABA) y los péptidos opioides endógenos (POEs). En la fase folicular del ciclo estral, el estradiol (E2) ejerce un efecto de retroalimentación positiva a nivel del hipotálamo mediobasal (HMB), incrementa la secreción pulsátil de GnRH y de la hormona luteinizante (LH), e induce el pico preovulatorio de ambas hormonas, provocando la conducta de estro y la ovulación. Durante la época de anestro estacional, el patrón de secreción de melatonina favorece el aumento en la sensibilidad del hipotálamo a la concentración basal de E2; este esteroide inhibe la secreción pulsátil de GnRH, actuando específicamente en el núcleo A15 dopaminérgico del área retroquiasmática lateral (Arch) hipotalámica. En este mecanismo, el sistema dopaminérgico participa como intermediario entre el E2 y las neuronas GnRH.
FEEDBACK NEURAL SYSTEMS OPERATING DURING THE CIRCANNUAL REPRODUCTIVE CYCLE OF THE EWE
Summary
The annual reproductive cycle in the ewe is controlled by the changes in the amplitud of photoperiod. The light stimulus is converted into a hormonal signal: the circadian rhytm of melatonin secretion. Short days are inductive whereas long days inhibits the ovulatory activity. During the reproductive season, progesterone regulates the estrous cycle of the ewe inhibiting the GnRH pulsatil secretion. Progesterone exerts its action on the preoptic area of the hypothalamus indirectly, possibly via the gamma aminobutiric acid and the endogeneous opiod peptides. Estradiol (E2) increases the GnRH pulsatile secretion by a positive feedback effect. Increments in GnRH pulses induce the preovulatory peak of LH evoking estrous behaviour and ovulation. During the seasonal anestrus, the secretion pattern of melatonin increases the sensivity of the hypothalamus to the negative effect of E2, then estradiol inhibits the pulsatil secretion of GnRH, acting in the A-15 dopaminergic nucleous of the retrochiasmatic lateral area of the hypothalamus; in this mechanism the dopaminergic system mediates the effect of estradiol on the GnRHergic neurons.
SISTEMAS NEURAIS DE RETROALIMENTAÇÃO DURANTE O CICLO REPRODUTIVO ANUAL DA OVELHA: UMA REVISÃO
Resumo
O ciclo reprodutivo anual da ovelha é regulado pela amplitude do foto período. O sinal luminoso se traduz em um sinal hormonal a través da síntese de melatonina. A diminuição na duração do foto período induz a atividade reprodutiva e o aumento nas horas luz, inibe a atividade ou ciclo estral, a conduta de estro e a ovulação (anestro estacional). Durante a época reprodutiva, a progesterona (P4) regula os ciclos estrais da ovelha inibindo a secreção pulsátil do hormônio liberador de gonadotropinas (GnRH) a nível da área preóptica (POA) do hipotálamo, onde exerce sua ação de maneira indireta, possivelmente a través do ácido gama amino butírico (GABA) e os peptídeos opioides endógenos (POEs). Na fase folicular do ciclo estral, o estradiol (E2) exerce um efeito de retro alimentação positiva a nível do hipotálamo mediobasal (HMB), incrementa a secreção pulsátil de GnRH e do hormônio luteinizante (LH), e induz o pico pré ovulatório de ambos hormônios, provocando a conduta de estro e a ovulação. Durante a época de anestro estacional, o padrão se secreção de melatonina favorece o aumento na sensibilidade do hipotálamo à concentração basal de E2; este esteróide inibe a secreção pulsátil de GnRH, atuando especificamente no núcleo A15 dopaminérgico da área retroquiasmática lateral (Arch) hipotalâmica. Neste mecanismo, o sistema dopaminérgico participa como intermediário entre o E2 e os neurônios GnRH.
Palabras clave / Actividad Reproductiva / Anestro Estacional / Estro / Neuroendocrinología / Oveja /
Recibido: 19/08/2005. Aceptado: 08/11/2005.
La estacionalidad reproductiva es un proceso de adaptación mediante el cual los animales silvestres y algunos domésticos reducen los efectos de los cambios anuales de temperatura y disponibilidad de alimento (Karsch et al., 1984). El patrón reproductivo estacional en muchas especies se regula por el fotoperiodo (Yeates, 1949; Hafez, 1952; Karsch et al., 1984, Malpaux et al., 1999). En bovinos y porcinos, el proceso de domesticación condujo a la pérdida casi total de esta forma de reproducción; sin embargo, se mantiene en la mayoría de las razas ovinas, caprinas y equinas originarias de latitudes >35º (Malpaux et al., 1996).
Los ovinos traducen la señal luminosa a una señal hormonal a través de la melatonina, que se sintetiza durante la noche en la glándula pineal e indica al animal los cambios en el ciclo luz-oscuridad (Williams y Helliwell, 1993; McMillen et al., 1995; Arendt, 1998; Malpaux et al., 2002). En latitudes >35º, la función reproductiva de la oveja involucra una serie de eventos fisiológicos que difieren a través del año (Gallegos-Sánchez et al., 1998). El ciclo reproductivo anual de la oveja se clasifica en una etapa de actividad reproductiva y una de ausencia de reproducción (anestro). En la mayoría de las razas ovinas, la época reproductiva se inicia a finales del verano y se caracteriza por ciclos estrales sucesivos de 17 días. La época de anestro inicia a finales del invierno y se caracteriza por la ausencia de ciclos ováricos regulares y ovulación. Estos cambios fisiológicos se asocian con las variaciones anuales de las horas de luz (Yeates, 1949; Legan y Karsch, 1979; Lincoln and Short, 1980; Karsch et al., 1984; Lehman et al., 2002; Thiéry et al., 2002).
La secreción pulsátil de hormona liberadora de gonadotropinas (GnRH) se correlaciona con la secreción de hormona luteinizante (LH) hipofisiaria; un pulso de GnRH antecede a un pulso de LH (Clarke y Cummins, 1982; Karsch et al., 1993). Estudios posteriores realizados en ovejas mostraron que la GnRH se libera de manera pulsátil al líquido cerebroespinal (CSF) del tercer ventrículo. Este modo de secreción se correlaciona con las concentraciones periféricas de LH (Skinner et al., 1995).
La época de anestro se caracteriza por la disminución en la frecuencia de secreción pulsátil de GnRH y LH, con 1 a 2 pulsos de ambas hormonas en un periodo de 12h (Legan y Karsch, 1979; Barrell et al., 1992). En el anestro estacional, la menor duración de la secreción de melatonina provoca un aumento en la sensibilidad hipotalámica al efecto de retroalimentación negativa del estradiol (E2), inhibiendo la secreción pulsátil de GnRH/LH (Karsch et al., 1984; Viguié et al., 1997; Gallegos-Sánchez et al., 1998; Malpaux et al., 1999). En este proceso se ha demostrado la participación de monoaminas, de las cuales se han descrito con énfasis particular las catecolaminas. Entre éstas, el papel de la dopamina en la inhibición de la secreción pulsátil de GnRH durante el anestro es importante, así como el núcleo hipotalámico A15, donde se lleva a cabo su síntesis (Thiéry et al., 1995). De manera contraria, durante la época reproductiva, el aumento en la duración de secreción de melatonina induce el incremento en la secreción pulsátil de GnRH/LH y restablece los ciclos estrales y la ovulación (Williams y Helliwell, 1993; Viguié et al., 1997; Malpaux et al., 2002). Durante la fase folicular del ciclo estral, el E2 ejerce un efecto de retroalimentación positiva a nivel hipotalámico, aumenta la frecuencia de secreción de pulsos de GnRH/LH y genera el "pico" preovulatorio de ambas hormonas. Durante la fase lútea, la progesterona (P4) ejerce un potente efecto inhibidor de la secreción pulsátil de GnRH/LH y actúa en el área preóptica (POA) del hipotálamo (Robinson y Kendrick, 1992; Evans et al., 2002; Jackson y Kuehl, 2002). Se ha sugerido la participación del ácido gama amino butírico (GABA) como mediador en este proceso inhibitorio (Robinson, 1995).
Aunque la melatonina regula el ciclo reproductivo anual de la oveja y su patrón de secreción determina los eventos neuroendocrinos en la especie, el propósito de esta revisión no es describir de manera detallada y exhaustiva los mecanismos implicados en dichos eventos, pues existen revisiones que describen la participación de esta hormona en la estacionalidad reproductiva de los mamíferos, con enfoque especial en los ovinos (Williams y Helliwell, 1993; McMillen et al., 1995; Malpaux et al., 1996; Arendt, 1998; Malpaux et al., 1999; Chemineau et al., 2002; Malpaux et al., 2002).
Se han realizado numerosos estudios con el propósito de explicar los mecanismos neuroendocrinos que regulan el ciclo reproductivo anual de la oveja y su relación con los cambios en el fotoperiodo, particularmente, los neurotransmisores que regulan la secreción de hormonas reproductivas específicas, tales como la GnRH y LH (Deaver y Dailey, 1982; Thiéry et al., 1989, 1995, 2002; Le Corre y Chemineau, 1993a, b; Tillet, 1995; Lehman et al., 1996; Viguié et al., 1996; Gallegos-Sánchez et al., 1997). Por ello, el propósito de la presente revisión fue analizar y discutir la información disponible referente a los sistemas neurales de retroalimentación y los neurotransmisores que intervienen en el ciclo reproductivo anual de la oveja.
Retroalimentación Positiva del Estradiol durante el Ciclo Estral
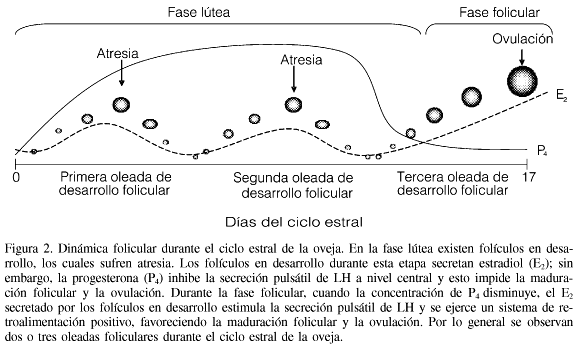
El ciclo reproductivo anual de la oveja incluye un periodo en el cual una secuencia de eventos neuroendocrinos culminan en la ovulación (época reproductiva; Figura 1) y un periodo en el que esto no ocurre (época de anestro o inactividad reproductiva; Barrell et al., 1992). En la época reproductiva, un aumento en la frecuencia de pulsos de GnRH/LH provoca la ovulación, lo cual se conoce como "pico" preovulatorio. Al final de la fase lútea, al iniciarse la luteólisis por efecto de la acción de la prostaglandina F2D (PGF2D) liberada por el endometrio uterino, la concentración plasmática de progesterona desciende. La disminución de la progesterona circulante favorece la secreción tónica de LH, de tal forma que la frecuencia de sus pulsos se incrementa progresivamente, hasta alcanzar un pulso cada hora. El aumento en la frecuencia de secreción de LH estimula la síntesis de E2 en los folículos en proceso de maduración y se incrementa su concentración en la circulación general. El incremento progresivo en los niveles de E2, ejercido por un mecanismo de retroalimentación positiva a nivel hipotalámico, estimula la secreción hormonal y esto origina las descargas preovulatorias de la dupla GnRH/LH (Padilla et al., 1988; Barrell et al., 1992; Gallegos-Sánchez et al., 1999).
Las fluctuaciones en las concentraciones circulantes de E2 tienen su origen en los folículos ováricos, los cuales pueden desarrollarse o sufrir atresia durante el curso de cada ciclo (Figura 2; Legan y Karsch, 1979; McNatty et al., 1984; Noel et al., 1993; Ravindra y Rawlings, 1997; Souza et al., 1997; Bartlewski et al., 2000; Evans et al., 2000).
El pico preovulatorio de LH precede a la ovulación en aproximadamente 24h y se asocia con la conducta de estro (Figura 3; Legan y Karsch, 1979). Este evento requiere un incremento en la secreción de GnRH hipotalámica y el aumento de la sensibilidad hipofisiaria. Ambos eventos son dependientes de E2 (Karsch et al., 1997). Se requiere el estímulo generado por la GnRH para que ocurra el pico preovulatorio de LH. La determinación directa de la concentración y perfil de secreción de GnRH en el sistema porta hipofisiario de ovejas mostraron que los picos preovulatorios de GnRH y LH ocurren paralelamente; sin embargo, el pico de GnRH se extiende por 36 a 48h (tiempo aproximado de la duración del estro; Caraty et al., 2002). La secreción prolongada puede representar un exceso fisiológico que induce cambios en el estímulo hipofisiario; sin embargo, es posible que la GnRH controle la conducta sexual y la ovulación, de manera similar a lo observado en otros mamíferos (Pfaff et al., 1994).
En la oveja, como en otras especies, los cambios conductuales y la secreción preovulatoria de LH se inducen por el incremento en la concentración de E2 secretado por los folículos en desarrollo durante la fase folicular. Otro factor implicado en el control de la conducta de estro es la progesterona presente en la fase lútea, la cual incrementa el número de receptores para E2 en el hipotálamo mediobasal (MBH) y por lo tanto aumenta la sensibilidad a E2 (Blache et al., 1994).
En un estudio realizado durante la época reproductiva con ovejas Ile de France, Caraty et al. (2002) observaron que la GnRH está involucrada en el control de la receptividad sexual en rumiantes y que esta hormona y el E2 actúan de manera secuencial para permitir la expresión del estro. La actividad de las neuronas GnRH se prolonga durante la fase folicular del ciclo estral; el propósito de esta función fisiológica es mantener la receptividad sexual hasta la ovulación, después del efecto inicial de E2. Es posible diferenciar el efecto directo del E2 en la conducta de estro del mecanismo que estimula la secreción de GnRH (Caraty et al., 2002).
A nivel hipotalámico, el E2 estimula la secreción pulsátil de GnRH/LH durante la fase folicular del ciclo estral. Caraty et al. (1998) colocaron implantes de estradiol intracraneales en el POA y en el hipotálamo mediobasal (MBH) de ovejas Ile de France ovariectomizadas, después de simular una fase lútea por administración exógena de progesterona. Los resultados mostraron que el E2 aplicado en el núcleo ventromedial (NVM) del MBH provocó un pico de GnRH/LH, semejante al observado antes de la ovulación. Se concluyó que el E2 actúa en el MBH induciendo el pulso preovulatorio de LH en la oveja. Adicionalmente se observó que el E2 en el POA inhibe la secreción pulsátil de LH (Caraty et al., 1998). La existencia de poblaciones específicas de neuronas que sintetizan receptores a de estradiol (RE2) con proyecciones al área preóptica rostral (rPOA) y a la banda diagonal de Broca (DBB) de la oveja, donde se concentran los cuerpos de las neuronas GnRH (Caldani et al., 1988; Herbison, 1995), explica el efecto inhibitorio del E2 a ese nivel. Estas observaciones proporcionaron las bases del conocimiento de la estructura neuroanatómica a través de la cual se llevan a cabo las acciones de estímulo e inhibición del E2 en la secreción de GnRH en ovinos. Sin embargo, aún no se conoce si estas poblaciones neuronales hacen sinapsis directa con los cuerpos neuronales de GnRH. Existe la posibilidad de que múltiples neuronas con RE2 puedan intervenir en la biosíntesis y secreción de GnRH a nivel de los cuerpos celulares. Se sugiere que en la hembra ovina, grupos neuronales específicos con receptores para estrógeno pueden intervenir a nivel pre y postsináptico en las neuronas productoras de GnRH y, con ello, inhibir la biosíntesis de la hormona (Goubillon et al., 1999).
Sistema de Retroalimentación Negativo de la Progesterona
La progesterona es una hormona esteroide que secreta el cuerpo lúteo del ovario y es fundamental en la regulación de la función reproductiva cíclica (Figura 4). La progesterona inhibe la secreción pulsátil de GnRH, y por lo tanto, de LH. Este esteroide presenta un efecto contrario al de retroalimentación positiva del E2 en la secreción de GnRH y LH (Skinner et al., 2001) y puede considerarse como el regulador del ciclo estral; su acción es a nivel central (Robinson, 1995). Cuando las concentraciones de progesterona son altas, durante la fase lútea del ciclo, la frecuencia de los pulsos de GnRH/LH es baja. La disminución en la concentración de progesterona después de la luteólisis permite que la frecuencia de pulsos de GnRH/LH se incremente y se estimule por el aumento en la concentración de estrógenos (Robinson, 1995).
El mecanismo exacto por medio del cual la progesterona inhibe la secreción pulsátil de GnRH se desconoce (Evans et al., 2002). No se han identificado receptores para progesterona en las neuronas GnRH (Skinner et al., 2001); sin embargo, se han localizado receptores para progesterona en una gran cantidad de neuronas hipotalámicas productoras de neurotransmisores, por lo que es posible que esta hormona regule la actividad del sistema neurosecretor de GnRH durante la fase lútea del ciclo estral de la oveja, de manera indirecta a través de uno o varios sistemas neurotransmisores (Evans et al., 2002).
La participación del GABA como intermediario entre la P4 y las neuronas GnRH en la inhibición de la secreción pulsátil de GnRH se observó al evaluar los cambios en la concentración del neurotransmisor en el POA, utilizando microdiálisis, en la época reproductiva el efecto de retroalimentación negativa ejercido por P4 durante la época reproductiva. Se colocaron implantes subcutáneos de P4 a ovejas ovariectomizadas y se midieron concentraciones circulantes de la hormona similares a las observadas en la fase lútea del ciclo estral. Las dosis administradas inhibieron la concentración media de LH, lo cual se correlacionó con el incremento en la concentración de GABA en el POA. Estas observaciones proporcionaron evidencia de que la acción central inhibitoria de la progesterona en la secreción pulsátil de LH involucra a las neuronas gabaérgicas en las regiones con neuronas GnRH. Este sistema neural participa de manera importante en la organización y regulación de los eventos del ciclo estral ovino (Robinson y Kendrick, 1992). Se ha sugerido también la participación de los péptidos opioides endógenos (POEs) como mediadores en la inhibición de la secreción pulsátil de GnRH durante la fase lútea del ciclo estral, pero este mecanismo debe ser estudiado con más detalle (Goodman et al., 2002).
El efecto inhibitorio de la progesterona en la secreción pulsátil de GnRH a nivel central es agudo, pues esa forma de secreción varía (aumenta o disminuye) al inducir cambios de manera experimental en la concentración circulante de P4 (Evans et al., 2002). Lo anterior indica que la inhibición en la secreción pulsátil de GnRH inducida por la P4 no es mediada por un mecanismo genómico, pues de ser así, el efecto ocurriría después de días e incluso horas (Evans et al., 2002). La acción inhibitoria de la P4 es mediada por el receptor clásico para progesterona (PR) y la administración del antagonista del receptor competitivo para progesterona RU486 incrementa la secreción pulsátil de LH en ovejas durante la fase lútea del ciclo estral (Chabbert-Buffet et al., 2000; Evans et al., 2002; Goodman et al., 2002).
Neurotransmisores y Estructuras Hipotalámicas Involucradas en el Anestro Estacional
Los estudios iniciales acerca del control neuroendocrino de la actividad reproductiva estacional de la oveja se desarrollaron en la década de los 80. Goodman y Meyer (1984) aplicaron un anestésico (pentobarbital) a ovejas en anestro y observaron un incremento en la secreción pulsátil de LH. Posteriormente, Meyer y Goodman (1985, 1986) utilizando ovejas en anestro inducido con tratamientos de fotoperiodo artificial, demostraron la participación de las catecolaminas en la inhibición de la secreción pulsátil de LH durante esta etapa fisiológica. La administración de antagonistas a-adrenérgicos y dopaminérgicos causó un incremento en la secreción pulsátil de LH.
Martin y Thiéry (1987) emplearon estimulación eléctrica en el área retroquiasmática de ovejas ovariectomizadas. Esta área contiene la parte anterior del núcleo infundibular en la posición sagital media (equivalente al núcleo arcuato de la rata) y junto a este, se encuentra el área retroquiasmática lateral (Arch) hipotalámica. La estimulación eléctrica del núcleo infundibular indujo la secreción pulsátil de LH, probablemente por la activación directa de las terminales de las neuronas productoras de GnRH.
La estimulación del Arch reduce la secreción de LH, sugiriendo la presencia de elementos neurales inhibitorios de las neuronas GnRH. Esta área contiene el núcleo A15 dopaminérgico correspondiente a la parte ventral del núcleo A15 de la rata y recibe una rica inervación noradrenérgica. El núcleo mencionado se localiza justo detrás del quiasma óptico y es distinto al área que contiene células dopaminérgicas del sistema tuberoinfundibular, núcleo A12 (Figura 4; Thiéry et al., 1995).
Thiéry et al. (1989) aplicaron una neurotoxina dopaminérgica específica, la 6-hidroxidopamina, dentro del núcleo A15 de ovejas ovariectomizadas tratadas con estradiol y observaron que la destrucción del 20% de los cuerpos de las células dopaminérgicas aumentó la secreción pulsátil de LH. Los resultados sugirieron que el núcleo A15 es una de la áreas hipotalámicas clave involucradas en la inhibición de la secreción pulsátil de LH mediada por el E2 durante la época de días largos (anestro estacional). Havern et al. (1991) colocaron implantes intracraneales de pimozide (antagonista dopaminérgico) en el área retroquiasmática y la eminencia media de ovejas en anestro, observándose un aumento en la secreción pulsátil de LH en los animales experimentales.
Havern et al. (1994) observaron que la frecuencia de secreción de los pulsos de LH aumentó después de lesiones con radiofrecuencia en el núcleo A14 y A15 de ovejas en anestro estacional. Lo anterior demostró que no solo el núcleo A15 interviene en la frecuencia de secreción de LH; el núcleo A14 dopaminérgico, localizado en la parte posteroventral del área preóptica, también tiene un papel inhibitorio en la liberación pulsátil de LH durante el anestro estacional de la oveja (Havern et al., 1994).
Mecanismo de Retroalimentación Negativa del Estradiol y Actividad Dopaminérgica durante el Anestro
El mecanismo de acción del E2 en la actividad dopaminérgica del núcleo A15 se ha estudiado por medio de la técnica de microdiálisis. Gayrard et al. (1992) en un experimento donde se realizaron dos sesiones de diálisis en ovejas ovariectomizadas, una después de un tratamiento con E2 durante 10 días y la otra después de 10 días sin tratamiento, encontraron que el E2 disminuyó la secreción pulsátil de LH, sin afectar la secreción de prolactina. El esteroide también causó un aumento en la concentración de metabolitos catecolaminérgicos, 4-hidroxi-3-metoxifenilglicol, ácido 3,4-dihidroxifenilacético y ácido homovanílico, así como ácido 5-hidroxi-indolacético, un metabolito de 5-hidroxitriptamina. Con lo anterior se demostró que el E2 estimula la actividad dopaminérgica del núcleo A15 durante el anestro estacional.
Gayrard et al. (1994), con el propósito de establecer si el E2 modifica la conversión de catecolaminas en el núcleo A15, aplicaron un inhibidor (NSD1015) de la tirosina hidroxilasa (TH) por microdiálisis en seis ovejas ovariectomizadas en anestro estacional inducido por fotoperiodo artificial, después de 10 días de tratamiento con implante subcutáneo de E2 y después de 10 días sin tratamiento. Cuando las ovejas se trataron con E2 se observó inhibición en la secreción pulsátil de LH, conjuntamente con la acumulación de L-3-4-dihidroxifenilalanina (L-DOPA) en el núcleo A15. Lo anterior demostró que el E2 estimula la actividad de la TH durante el anestro estacional de la oveja. En el mismo estudio se midieron los metabolitos de aminas extracelulares y la actividad de la TH in vivo en el núcleo A15, en el cual el 45% de la actividad de las terminales noradrenérgicas habían sido desactivadas por lesión con una neurotoxina específica (nomifensina), manteniendo las células dopaminérgicas intactas. La lesión resultó en disminución del 4-hidroxi-3-metoxifeniletilenglicol (MHPG) e incremento compensatorio en el ácido 5-hidroxi-indolacético, ambos metabolitos catecolaminérgicos, mientras la inhibición de la LH se mantuvo. La acumulación de L-DOPA después del bloqueo de la TH fue similar en animales lesionados y testigos. Se concluye que el incremento en la actividad de la TH estimulada por el E2 en el núcleo A15 se induce por el aumento específico en los cuerpos celulares dopaminérgicos y no por las terminales noradrenérgicas presentes en este núcleo. Al parecer los terminales noradrenérgicas no participan en la inhibición de la secreción pulsátil de LH.
Los efectos del E2 en los metabolitos catecolaminérgicos se asocian o son precedidos por la reducción en la secreción pulsátil de LH (Stefanovic et al., 2000). Lehman et al. (1996), empleando el factor de transcripción genética c-Fos como indicador de activación neuronal, confirmaron que el E2 estimula la actividad de las células dopaminérgicas. El tratamiento de ovejas ovariectomizadas con E2 incrementó el porcentaje de neuronas dopaminérgicas en el núcleo A15 que expresan la proteína c-Fos durante el anestro. Por el contrario, el mismo tratamiento en la época reproductiva no tuvo efecto (Lehman et al., 1996).
El c-Fos, producto de la protooncogénesis se utiliza de manera extensa como un marcador de activación neuronal. Es uno de varios genes que aparecen cuando ocurren cambios neuronales en respuesta a la activación por neurotransmisores, hormonas o factores de crecimiento. El heterodímero de Fos y Jun, el producto de otro gen similar, puede aumentar la transcripción de genes adicionales, incluyendo aquellos que codifican productos neurosecretores tales como la GnRH (Moenter et al., 1993).
Sitios de Acción del Estradiol durante el Anestro
La localización de receptores a de estradiol (RE2) en el cerebro de la oveja, por métodos histoquímicos, los ubicó en algunos cuerpos de las células dopaminérgicas del núcleo A12, pero no en A15 y A14 (Figura 5; Lehman y Karsch, 1993; Goubillon et al., 1999). Por lo tanto, es poco probable que en la oveja ocurra un efecto estimulador directo del E2 y se sugiere la participación de sistemas neuronales como intermediarios (Thiéry et al., 1995). Podrían estar involucradas las terminales para noradrenalina y 5-hidroxitriptamina y es posible que las terminales noradrenérgicas del núcleo A15 estén involucradas en la inhibición de la secreción de LH dependiente de esteroides (Thiéry et al., 1995). La actividad noradrenérgica precede a la actividad dopaminérgica en una cascada de eventos que conducen a la inhibición de la secreción de LH durante el anestro estacional. Sin embargo, es poco probable que esta cascada ocurra en A15, pues la destrucción del 45% de esta inervación no suprime la estimulación de la actividad de la tirosina hidroxilasa o la inhibición de la secreción pulsátil de LH (Gayrard et al., 1994; Thiéry et al., 1995). Por lo tanto, existe una relación anatómica entre los núcleos A14 y A15 (Havern et al., 1994). Como el POA contiene RE2 es posible que esta sea una vía entre los receptores del POA, el núcleo A14 y el A15 (Thiéry et al., 1995).
En otros estudios, Gallegos-Sánchez et al. (1997) colocaron implantes de estradiol en el área preóptica media (POAm), el área preóptica lateral (POAL), el núcleo ventromedial (NVM), el área retroquiasmática (Arch) y el hipotálamo periventricular posterior (HPVp) de ovejas Romanov y Romanov X Ile de France ovariectomizadas en anestro estacional o días largos constantes, y observaron que el E2 actúa de manera directa en el Arch, específicamente en A15, inhibiendo la secreción pulsátil de LH. Sin embargo, al identificar las neuronas que contienen RE2, éstas se han localizado principalmente en el POA, hipotálamo anterior (AH), septum ventrolateral, la base del núcleo de la estría terminalis, el NVM y el núcleo arcuato, pero no en A15 (Lehman et al., 1993; Kuiper et al., 1997). No hubo expresión del RNAm para RE2 en A15, por lo que no es posible explicar el efecto inhibidor local de esta hormona esteroide en la secreción pulsátil de LH durante los días largos (Thiéry et al., 2002). Por otro lado, se ha sugerido que los cambios en el fotoperiodo pueden modificar la distribución de RE2. Al respecto, Skinner y Herbison (1997) utilizando ovejas bajo regímenes de luz artificial simulando días cortos y días largos, encontraron RE2 en alrededor del 25% de neuronas del núcleo A14 y 15% en el A12, independientemente de los cambios en el fotoperiodo, pero no encontraron receptores en A15. En contraste, el número de células expresando RE2 dentro del POA se elevó alrededor del 20% en las ovejas en anestro, comparado con los animales en fase lútea.
Sitios de Acción de la Dopamina en las Neuronas Productoras de GnRH durante el Anestro
En un primer intento para determinar la posible interacción entre el núcleo A15 y las neuronas productoras de GnRH, se administró una neurotoxina dentro de este núcleo y se observaron los cambios en el contenido de aminas de la región septopreóptica, donde se encuentran los cuerpos celulares de las neuronas productoras de GnRH y en la eminencia media (EM), donde se localizan las terminales de estas neuronas. Se observó disminución en el contenido de dopamina, ácido 3,4-hidroxifenilacético y ácido homovanílico en EM y reducción en el contenido de dopamina, ácido 3,4-hidroxifenilacético y noradrenalina en el núcleo infundibular, lo que sugiere una relación funcional entre el núcleo A15, el hipotálamo mediobasal (HMB) y la EM. La administración periférica de domperidone (antagonista dopaminérgico) indujo un aumento en la liberación de LH (Deaver et al., 1987). El domperidone no atraviesa la barrera hematoencefálica, por lo que este tratamiento tiene efecto sólo a nivel de EM. La participación de la EM sugiere una acción inhibitoria de la dopamina por medio de supresión presináptica en los axones terminales de GnRH. Estudios anatómicos dan sostén a esta hipótesis y permiten sugerir la presencia de terminales catecolaminérgicas cercanas a las terminales GnRH en la EM (Kuljis y Advis, 1989). Posteriormente se determinó (Viguié et al., 1996) que el fotoperiodo controla la actividad de las neuronas catecolaminérgicas a nivel de EM; durante los días largos se observó un incremento en la síntesis de dopamina y aumento en la actividad de la TH, asociados con la disminución en la secreción pulsátil de LH y aumento en la secreción de prolactina. Lo anterior sugiere que la inhibición de la secreción pulsátil de LH, mediada por el sistema dopaminérgico, ocurre también en la eminencia media durante un fotoperiodo largo (Viguie et al., 1996).
Varios estudios realizados en ovejas adultas durante el anestro estacional sugieren que la dopamina actúa sobre la secreción de GnRH a nivel de EM (Thiéry et al., 2002), pues la concentración de dopamina en tejido y la bioactividad de la TH en EM son más altas durante los días largos que durante los días cortos. Por otra parte, la inyección de pimozide, un antagonista de los receptores dopaminérgicos D2 (Havern et al., 1991), y la alfametilparatirosina, un inhibidor de la síntesis de catecolaminas, bloquean la síntesis de TH en EM (Bertrand et al., 1998) y estimula la secreción pulsátil de LH en ovejas ovariectomizadas tratadas con E2 durante los días largos.
En la EM, la estimulación de los receptores D2 inhibe la secreción pulsátil de LH (Bertrand et al., 1999). La inhibición dopaminérgica de la secreción de las células productoras de GnRH puede ser, por lo tanto, presináptica y puede ocurrir en las terminales de las neuronas en EM a través de los receptores D2. Sin embargo, el papel de A15 no se ha establecido en esta inhibición, puesto que las terminales de este núcleo se han encontrado en la neurohipófisis (Thiéry et al., 2002).
En la regulación de la pulsatilidad de LH, el núcleo A15 probablemente sólo proporciona una señal "de paso" hacia EM para amplificar la inhibición de la actividad de las células dopaminérgicas del núcleo infundibular A12, la cual es dependiente del fotoperiodo (Thiéry et al., 2002). De manera alternativa, se sugiere una asociación entre A15 y los cuerpos de las neuronas productoras de GnRH del HMB, las que están involucradas en la regulación de la secreción pulsátil de LH (Boukhliq et al., 1999).
De esta manera se propone que la inhibición de la actividad de las neuronas GnRH durante el anestro estacional de la oveja puede depender de una acción en las terminales de la eminencia media, independiente de E2 y un efecto dependiente de E2 a nivel de los cuerpos neuronales de las células GnRH (Thiéry et al., 2002).
Conclusiones
Una compleja red neural participa en la regulación o sincronización de los eventos reproductivos anuales de la oveja. Es claro que el efecto hormonal sobre la reproducción a nivel central varía dependiendo de la época del año. Es de interés la acción dual del estradiol al inhibir (anestro) o estimular (época reproductiva) la secreción pulsátil de GnRH/LH. La participación de neurotransmisores (dopamina, GABA, POEs) como intermediarios en este mecanismo es fundamental. Sin embargo, aun no es posible explicar de manera definitiva los mecanismos que controlan el ciclo reproductivo anual de la oveja, ni las áreas hipotalámicas implicadas. Actualmente es posible explicar una gran parte de estos procesos, sin embargo son necesarios más estudios para lograr una visión integral del fenómeno.
Implicaciones
Los avances en esta área de conocimiento permiten explicar, desde el punto de vista de la neuroendocrinología, el fenómeno de la estacionalidad reproductiva. El modelo de estudio utilizado es la oveja originaria o que habita en latitudes mayores de 35º, con anestro estacional claro y con duración de seis ó siete meses. Sin embargo, existen ovejas de origen ecuatorial (razas de pelo) que expresan un anestro estacional corto (2-3 meses) e incluso son capaces de mostrar actividad ovulatoria todo el año (Arroyo et al., 2005). El patrón reproductivo anual de las razas de pelo difiere claramente del observado en las razas de origen septentrional y su potencial productivo, al no expresar anestro estacional, es importante. Por esta razón resulta de interés conocer y explicar a nivel neuroendocrino los fenómenos fisiológicos que regulan su actividad reproductiva a través del año y que les permiten mostrar actividad ovulatoria anual continua y determinar las diferencias con las razas estacionales. Por lo tanto, se sugiere utilizarlas como modelo de estudio en futuras investigaciones.
Agradecimientos
Los autores agradecen a DGAPA por el financiamiento otorgado al proyecto IN-205803 a través del Programa de Apoyo a Proyectos de Investigación e Innovación Tecnológica (PAPIIT), UNAM, México.
Referencias
1. Arendt J (1998) Melatonin and the pineal gland: influence on mammalian seasonal and circadian physiology. Rev. Reprod. 3: 13-22. [ Links ]
2. Arroyo LJ, Gallegos SJ, Berruecos JM, Valencia J (2005) Actividad ovulatoria anual en ovejas Pelibuey y Suffolk. XXIX Congreso Nacional de Buiatria. Puebla, México. 8 pp. [ Links ]
3. Bartlewski MP, Vanderpol J, Beard PA, Cook JS, Rawlings CN (2000) Ovarian antral follicular dynamics and their associations with peripheral concentrations of gonadotropins and ovarian steroids in anoestrous Finnish Landrace ewes. Anim. Reprod. Sci. 58: 273-291. [ Links ]
4. Barrell GK, Moenter SM, Caraty A, Karsch FJ (1992) Seasonal changes of gonadotropin-releasing hormone secretion in the ewe. Biol. Reprod. 46: 1130-1135. [ Links ]
5. Bertrand F, Viguié C, Picard S, Malpaux B (1998) Median eminence dopaminergic activation is critical for the early long-day inhibition of luteinizing hormone secretion in the ewe. Endocrinology 139: 5094-5102. [ Links ]
6. Bertrand F, Thiéry JC, Picard S, Malpaux B (1999) Implication of D2-like dopaminergic receptors in the median eminence during the establishment of long-day inhibition of LH secretion in the ewe. J. Endocrinol. 163: 243-254. [ Links ]
7. Blache D, Batailler M, Fabre-Nys C (1994) Oestrogen receptors in the preoptic hyphotalamic continuum: immunohistochemical study of the distribution and cell density during oestrous cycle in ovariectomized ewe. J. Neuroendocrinol. 6: 329-339. [ Links ]
8. Boukhliq R, Goodman LR, Berriman JS, Adrian B, Lehman M (1999) A subset of gonadotropin-releasing hormone neurons in the ovine medial basal hypothalamus is activated during increasing pulsatile luteinizing hormone secretion. Endocrinology 140: 5929-5936. [ Links ]
9. Caldani M, Batailler M, Thiéry JC, Dubois MP (1988) LHRH-immunoreactive structures in the sheep brain. Histochemistry 89: 129-139. [ Links ]
10. Caraty A, Fabre-Nys C, Delaleu B, Locatelli A, Bruneau G, Karsch FJ, Herbison A (1998) Evidence that the mediobasal hypothalamus is the primary site of action of estradiol in inducing the preovulatory gonadotropin releasing hormone surge in the ewe. Endocrinology 139: 1752-1760. [ Links ]
11. Caraty A, Delaleu B, Chesneau D, Fabre-Nys C (2002) Sequential role of E2 and GnRH for the expression of estrous behavior in ewes. Endocrinology 143: 139-145. [ Links ]
12. Chabbert-Buffet N, Skinner DC, Caraty A, Bouchard P (2000) Neuroendocrine effects of progesterone. Steroids 65: 613-620. [ Links ]
13. Chemineau P, Daveau A, Bodin L, Zarazaga L, Gómez-Brunet A, Malpaux B (2002) Sheep as a mammalian model of genetic variability in melatonin. Reprod. Suppl. 59: 181-190. [ Links ]
14. Clarke IJ, Cummins JT (1982) The temporal relationship between gonadotropin releasing hormone (GnRH) and luteinizing hormone (LH) secretion in ovariectomized ewes. Endocrinology 111: 1737-1739. [ Links ]
15. Deaver DR, Dailey RA (1982) Effects of dopamine, norepinephrine and serotonin on plasma concentrations of luteinizing hormone and prolactin in ovariectomized and anestrous ewes. Biol. Reprod. 27: 624-632. [ Links ]
16. Deaver DR, Keisler DH, Dailey RA (1987) Effects of domperidone and thyrotropin-releasing hormone on secretion of luteinizing hormone and prolactin during the luteal phase and following induction of luteal regression in sheep. Domest. Anim. Endocrinol. 4: 95-102. [ Links ]
17. Evans ACO, Duffy P, Hynes N, Boland MP (2000) Waves of follicle development during the estrous cycle in sheep. Theriogenology 53: 699-715. [ Links ]
18. Evans NP, Richter TA, Skinner DC, Robinson JE (2002) Neuroendocrine mechanisms underlying the effects of progesterone on the oestradiol-induced GnRH/LH surge. Reprod. Suppl. 59: 57-66. [ Links ]
19. Gallegos-Sánchez J, Delaleu B, Caraty A, Malpaux B, Thiéry JC (1997) Estradiol acts locally within the retrochiasmatic area to inhibit pulsatile luteinizing-hormone release in the female sheep during anestrus. Biol. Reprod.. 56: 1544-1549. [ Links ]
20. Gallegos-Sánchez J, Malpaux B, Thiéry JC (1998) Control of pulsatile LH secretion during seasonal anoestrus in the ewe. Reprod. Nutr. Develop. 38: 3-15. [ Links ]
21. Gallegos-Sánchez J, Hernández PP, Albarrán A (1999) Neuroendocrinología del ciclo reproductivo de la oveja. En Memorias del curso internacional en fisiología de la reproducción en rumiantes. Colegio de Postgraduados, Montecillo, Texcoco, México. pp. 1-26. [ Links ]
22. Gayrard V, Malpaux B, Thiéry JC (1992) Oestradiol increases the extracellular levels of amine metabolites in the ewe hypothalamus during anoestrus: a microdialisis study. J. Endocrinol. 135: 421-430. [ Links ]
23. Gayrard V, Malpaux B, Tillet Y, Thiéry JC (1994) Estradiol increases tyrosine hydroxylase activity of the A15 nucleus dopaminergic neurons during long days in the ewe. Biol. Reprod. 50: 1168-1177. [ Links ]
24. Goodman RL, Meyer SL (1984) Effects of pentobarbital anesthesia on tonic luteinizing hormone secretion in the ewe: Evidence for active inhibition of luteinizing hormone in anestrus. Biol. Reprod. 30: 374-381. [ Links ]
25. Goodman RL, Gibson M, Skinner DC, Lehman MN (2002) Neuroendocrine control of pulsatile GnRH secretion during the ovarian cycle: evidence from ewe. Reprod. Suppl. 59: 41-56. [ Links ]
26. Goubillon ML, Delaleu B, Tillet Y, Caraty A, Herbison AE (1999) Localization of estrogen-receptive neurons projecting to the GnRH neuron-containing rostral preoptic area of the ewe. Neuroendocrinology 70: 228-236. [ Links ]
27. Hafez ESE (1952) Studies on the breeding season and reproduction of the ewe. J. Agric. Sci. 42: 189-265. [ Links ]
28. Havern LR, Whisnant SC, Goodman LR (1991) Hypothalamic sites of catecholamine inhibition of luteinizing hormone in the anestrous ewe. Biol. Reprod.. 44: 476-482. [ Links ]
29. Havern LR, Whisnant SC, Goodman LR (1994) Dopaminergic structures in the ovine hypothalamus mediating estradiol negative feedback in anestrous ewes. Endocrinology 134: 1905-1914. [ Links ]
30. Herbison AE (1995) Neurochemical identity of neurons expressing oestrogen and androgen receptors in sheep hypothalamus. J. Reprod. Fert., Suppl. 49: 271-283. [ Links ]
31. Jackson GL, Kuehl D (2002) Gamma-aminobutyric acid (GABA) regulation of GnRH secretion in sheep. Reprod. Suppl. 59: 15-24. [ Links ]
32. Karsch FJ, Bittman LE, Foster LD, Goodman LR, Legan JS, Robinson EJ (1984) Neuroendocrine basis of seasonal reproduction. Rec. Progr. Hormone Res. 40: 185-231. [ Links ]
33. Karsch FJ, Dahl GE, Evans NP, Manning JM, Mayfield KP, Moenter SM, Foster DL (1993) Seasonal changes in gonadotropin-releasing hormone secretion in the ewe: Alteration in response to the negative feedback action of estradiol. Biol. Reprod. 49: 1377-1383. [ Links ]
34. Karsch FJ, Bowen JM, Caraty A, Evans NP, Moenter SM (1997) Gonadotropin-releasing hormone requirements for ovulation. Biol Reprod. 56: 303-309. [ Links ]
35. Kuiper GGJM, Carlsson B, Grandien K, Enmark E, Haggblad J, Nilsson S, Gustafsson JA (1997) Comparison of the ligand binding specificity and transcript tissue distribution of estrogen receptors a and b. Endocrinology 138: 863-870. [ Links ]
36. Kuljis RO, Advis JP (1989) Immunocytochemical and physiological evidence of a synapse between dopamine and luteinizing hormone releasing hormone containing neurons in the ewe median eminence. Endocrinology 124: 1579-1581. [ Links ]
37. Le Corre S, Chemineau P (1993a) Serotonergic 5HT2 receptors mediate the inhibitory action of serotonin on luteinizing hormone secretion in ovariectomized, estradiol-treated ewes that are refractory to short days. Biol. Reprod. 49: 140-147. [ Links ]
38. Le Corre S, Chemineau P (1993b) Control of photoperiodic inhibition of luteinizing hormone secretion by dopaminergic and serotonergic systems in ovariectomized Ile-de-France ewes supplemented with oestradiol. J. Reprod. Fert. 97: 367-373. [ Links ]
39. Legan JS, Karsch JF (1979) Neuroendocrine regulation of the estrous cycle and seasonal breeding in the ewe. Biol. Reprod. 20: 74-85. [ Links ]
40. Lehman MN, Karsch FJ (1993) Do gonadotropin-releasing hormone, tyrosine hydroxylase-, and b-endorphin-immunoreactive neurons contain estrogen receptors? A double-label immunocytochemical study in the Suffolk ewe. Endocrinology 133: 887-895. [ Links ]
41. Lehman MN, Ebling PJF, Moenter MS, Karsch FJ (1993) Distribution of estrogen receptor-immunoreactive cells in the sheep brain. Endocrinology 133: 876-886. [ Links ]
42. Lehman MN, Durham DM, Jansen HT, Adrian B, Goodman RL (1996) Dopaminergic A14/A15 neurons are activated during estradiol negative feedback in anestrous, but not breeding season ewes. Endocrinology 137: 4443-4450. [ Links ]
43. Lehman MN, Coolen LM, Goodman RL, Viguié C, Billings HJ, Karsch FJ (2002) Seasonal plasticity in the brain: the use of large animal models for neuroanatomical research. Reprod. Suppl. 59: 149-165. [ Links ]
44. Lincoln GA, Short RV (1980) Seasonal breeding: Natures contraceptive. Rec. Prog. Hormone Res. 36: 1-52. [ Links ]
45. Malpaux B, Viguié C, Skinner DC, Thiéry JC, Pelletier J, Chemineau P (1996) Seasonal breeding in sheep: Mechanism of action of melatonin. Anim. Reprod. Sci. 42: 109-117. [ Links ]
46. Malpaux B, Thiéry JC, Chemineau P (1999) Melatonin and the seasonal control of reproduction. Reprod. Nutr. Develop.. 39: 355-366. [ Links ]
47. Malpaux B, Tricoire H, Mailliet F, Daveau A, Migaud M, Skinner DC, Pelletier J, Chemineau P (2002) Melatonin and seasonal reproduction: understanding the neuroendocrine mechanisms using the sheep as a model. Reprod. Suppl. 59: 167-179. [ Links ]
48. Martin GB, Thiéry JC (1987) Hypothalamic multiunit activity and LH secretion in conscious sheep. Exp. Brain Res. 67: 469-478. [ Links ]
49. McMillen JC, Houghton DC, Young IR (1995) Melatonin and the development of circadian and seasonal rhythmicity. J. Reprod. Fert.. Suppl. 49: 137-146. [ Links ]
50. McNatty KP, Hudson NL, Henderson KM, Lun S, Heath DA, Gibb M, Ball K, McDiarmid JM,Thurley DC (1984) Changes in gonadotropin secretion and ovarian antral follicular activity in seasonally breeding sheep throughout the year. J. Reprod. Fert. 70: 309-321. [ Links ]
51. Meyer SL, Goodman RL (1985) Neurotransmitters involved in mediating the steroid-dependent suppression of pulsatile luteinizing hormone secretion in anoestrus ewes: effects of receptors antagonists. Endocrinology 116: 2054-2061. [ Links ]
52. Meyer SL, Goodman RL (1986) Separate neural systems mediate the steroid-dependent and steroid-independent suppression of tonic luteinizing hormone secretion in the anoestrus ewe. Biol. Reprod. 35: 562-571. [ Links ]
53. Moenter SM, Karsch FJ, Lehman MN (1993) Fos expression during the estradiol-induced gonadotropin-releasing hormone (GnRH) surge of the ewe: Induction in GnRH and other neurons. Endocrinology 133: 896-903. [ Links ]
54. Noel B, Bister JL, Paquay R (1993) Ovarian follicular dynamics in Suffolk ewes at different periods of the year. J, Reprod. Fert. 99: 695-700. [ Links ]
55. Padilla RFJ, Mapes SGE, Jiménez KF (1988) Perfiles hormonales durante el ciclo estral de la oveja. Técnica Pecuaria en México 28: 96-108. [ Links ]
56. Pfaff D, Schwanzel-Fukuda M, Parhar I, Lauber A, McCarty I, Kow I (1994) GnRH neurons and other cellular and molecular mechanisms for simple mammalian reproductive behaviors. Rec. Progr. Hormone Res. 49: 1-25. [ Links ]
57. Ravindra JP, Rawlings NC (1997) Ovarian follicular dynamics in ewes during the transition from anoestrus to the breeding season. J. Reprod. Fert. 110: 279-289. [ Links ]
58. Robinson JE (1995) Gamma amino-butyric acid and the control of GnRH secretion in sheep. J. Reprod. Fert. Suppl. 49: 221-230. [ Links ]
59. Robinson JE, Kendrick KM (1992) Inhibition of luteinizing hormone secretion in the ewe by progesterone: associated changes in the release of gamma-aminobutyric acid and noradrenaline in the preoptic area as measured by intracranial microdialysis. J. Neuroendocrinol. 4: 231-236. [ Links ]
60. Skinner DC, Herbison EA (1997) Effects of photoperiod on estrogen receptor, tyrosine hydroxilase, neuropeptide Y, and b-endorphin immunoreactivity in the ewe hyphotahlamus. Endocrinology 138: 2585-2595. [ Links ]
61. Skinner DC, Malpaux B, Delaleu B, Caraty A (1995) Luteinizing hormone (LH)-releasing hormone in third ventricular cerebrospinal fluid of the ewe: Correlation with LH pulses and the LH surge. Endocrinology 136: 3230-3237. [ Links ]
62. Skinner DC, Caraty A, Allingham R (2001) Unmasking the progesterone receptor in the preoptic area and hypothalamus of the ewe: no colocalization with gonadotropin-releasing neurons. Endocrinology 142: 573-579. [ Links ]
63. Souza JHC, Campbell KB, Baird TD (1997) Follicular dynamics and ovarian steroid secretion in sheep during the follicular and early luteal phases of the estrous cycle. Biol. Reprod. 56: 483-488. [ Links ]
64. Stefanovic I, Adrian B, Jansen HT, Lehman MN, Goodman RL (2000) The ability of estradiol to induce fos expression in a subset of estrogen receptor-a-containing neurons in the preoptic area of the ewe depends on reproductive status. Endocrinology 141: 190-196. [ Links ]
65. Thiéry JC, Martin GB, Tillet Y, Caldani M, Quentin M, Jamain C, Ravault JP (1989) Role of Hypothalamic catecholamines in the regulation of luteinizing hormone and prolactin secretion in the ewe during seasonal anestrus. Neuroendocrinology 49: 80-87. [ Links ]
66. Thiéry JC, Gayrard V, Le Corre S, Viguié C, Martin GB, Chemineau P, Malpaux B (1995) Dopaminergic control of LH secretion by the A15 nucleus in anoestrus ewes. J. Reprod. Fert. Suppl. 49: 285-296. [ Links ]
67. Thiéry JC, Chemineau P, Hernández X, Migaud M, Malpaux B (2002) Neuroendocrine interactions and seasonality. Domest. Anim. Endocrinol. 23: 87-100. [ Links ]
68. Tillet Y (1995) Distribution of neurotransmitters in the sheep brain. J. Reprod. Fert.. Supplement 49: 199-220. [ Links ]
69. Viguié C, Thibault J, Thiéry JC, Tillet Y, Malpaux B (1996) Photoperiodic modulation of monoamines and amino-acids involved in the control of prolactin and LH secretion in the ewe: evidence for a regulation of tyrosine hydroxylase activity. J. Neuroendocrinol. 8: 465-474. [ Links ]
70. Viguié C, Thibault J, Thiéry JC, Tillet Y, Malpaux B (1997) Characterization of the short day-induced decrease in median eminence tyrosine hydroxylase activity in the ewe: temporal relationship to the changes in luteinizing hormone and prolactin secretion and short day-like effect of melatonin. Endocrinology 138: 499-506. [ Links ]
71. Williams LM, Helliwell RJA (1993) Melatonin and seasonality in the sheep. Anim. Reprod. Sci. 33: 159-182. [ Links ]
72. Yeates NTM (1949) The breeding season of the sheep with particular reference to its modification by artificial means using light. J. Agric. Sci. 39: 1-43. [ Links ]












 uBio
uBio