Interciencia
versión impresa ISSN 0378-1844
INCI v.32 n.10 Caracas oct. 2007
La agregación celular en la producción de metabolitos secundarios en cultivos vegetales in vitro.
Gabriela Trejo-Tapia y Mario Rodríguez-Monroy
Gabriela Trejo-Tapia. Doctora en Ciencias, Centro de Investigación y Estudios Avanzados, Instituto Politécnico Nacional (CINVESTAV-IPN), México. Investigadora, Centro de Desarrollo de Productos Bióticos (CeProBi-IPN), México. Dirección: Departamento de Biotecnología, CeProBi-IPN. Km. 8.5 Carretera Yautepec-Jojutla. Colonia San Isidro. Yautepec, Morelos, México 62731. e-mail: gttapia@ipn.mx
Mario Rodríguez-Monroy. Doctor en Ciencias, Universidad Autónoma de México. Investigador, CeProBi-IPN, México. e-mail: mrmonroy@ipn.mx
Resumen
El cultivo de células vegetales es una alternativa biotecnológica para la producción de metabolitos secundarios. Sin embargo, la productividad de los sistemas in vitro es menor a la obtenida de plantas. En esta revisión se ilustra la diferenciación y compartamentalización celular como eventos necesarios para la síntesis de metabolitos secundarios en las plantas. Se discute la inducción de la agregación celular en los cultivos in vitro como una de las estrategias para favorecer la acumulación de estos compuestos químicos. Este efecto positivo podría ser explicado como consecuencia de la formación de estructuras morfogénicas y/o por una condición de estrés por limitaciones de oxígeno al interior de los agregados. Finalmente, se muestra que la combinación de la agregación con otras estrategias tales como la selección de líneas celulares, la elicitación y la adición de precursores constituye una alternativa para desarrollar bioprocesos a partir de células vegetales in vitro para la producción de compuestos químicos de alto valor agregado.
Cellular aggregation in secondary metabolite production in in vitro plant cell cultures.
Summary
Plant cell culture represents a biotechnological alternative to direct extraction of whole plant for production of secondary metabolites. However, the productivity of in vitro systems is lower than that obtained from plants. This review illustratates cell differentiation and compartmentalization as necessary events for the biosynthesis of chemical compounds. The induction of in vitro cell aggregation is discussed as one of the strategies to stimulate the accumulation of the compounds of interest. This positive effect might be explained as a consequence of the development of morphogenic structures and/or a stress condition induced by oxygen limitation in the interior of the aggregates. Finally, it is shown that the combination of aggregation with other strategies such as selection of cell lines, elicitation or precursor addition constitutes an alternative for the development of bioprocesses based on plant cell cultures for the production of high value chemical compounds.
A agregação celular na produção de metabólitos secundários nos cultivos vegetais in vitro.
Resumo
O cultivo de células vegetais é uma alternativa biotecnológica para a produção de metabólitos secundários. No entanto, a produtividade dos sistemas in vitro é menor à obtida de plantas. Nesta revisão se ilustra a diferenciação e compartimentalização celular como eventos necessários para a síntese de metabólitos secundários nas plantas. Discute-se a indução da agregação celular nos cultivos in vitro como uma das estratégias para favorecer a acumulação destes compostos químicos. Este efeito positivo poderia ser explicado como conseqüência da formação de estruturas morfogênicas e/ou por uma condição de estresse por limitações de oxigênio ao interior dos agregados. Finalmente, se mostra que a combinação da agregação com outras estratégias tais como a seleção de linhas celulares, a elicitação e a adição de precursores constituem uma alternativa para desenvolver bioprocessos a partir de células vegetais in vitro para a produção de compostos químicos de alto valor agregado.
Palabras Clave/ Agregación Celular / Compartamentalización / Diferenciación / Metabolitos Secundarios /
Recibido: 16/05/2007. Modificado: 17/09/2007. Aceptado: 18/09/2007.
Las plantas son fuente de una amplia variedad de compuestos químicos, conocidos como metabolitos secundarios, que son utilizados como fármacos, pesticidas, colorantes, saborizantes y fragancias, entre otros. Comúnmente, estos compuestos se extraen de plantas silvestres o cultivadas, lo que tiene una serie de desventajas. Su acumulación en las plantas es baja y lenta, ya que está regulada espacial y temporalmente. Es decir, ocurre en células, órganos y tejidos específicos, en fases determinadas del ciclo de vida de la planta, bajo condiciones estaciónales o de estrés (Verpoorte et al., 2002). Puede existir alta variabilidad entre poblaciones e inclusive entre individuos. En el caso de plantas silvestres, su explotación comercial está basada en la recolección de material en su hábitat natural, frecuentemente incluyendo la raíz, lo que ha provocado que muchas estén amenazadas o en peligro de extinción.
La producción del Taxol®, compuesto de alta demanda por su actividad citotóxica, y la del alcaloide vinblastina, potente antileucémico, son ejemplos de fármacos que se obtienen de plantas cuya demanda es difícil de abastecer. Para preparar 1kg de Taxol, se necesita la corteza de 1000 árboles de Taxus brevifolia L. (Kieran et al., 1997). Asimismo, para obtener 1g de vinblastina, se necesita media tonelada de hojas secas de Catharanthus roseus (L.) G. Don (Sottomayor et al., 2004).
El cultivo masivo de células vegetales se ha propuesto como una alternativa biotecnológica para el desarrollo de sistemas de producción de metabolitos secundarios (Sharp y Doran, 2001). Sin embargo, después de más de 40 años de investigación y desarrollo tecnológico, los casos exitosos que justifican técnica y económicamente su operación a nivel comercial son limitados, pudiéndose citar entre ellos la producción de shikonina por células de Lithospermum erythrorhizon y de Taxol por células de Taxus spp. (Zhao et al., 2005).
El cultivo de células y tejidos vegetales se basa en el principio de totipotencia celular, que establece que a partir de cualquier célula de una planta es posible regenerar un individuo completo. Mediante esta herramienta, es posible obtener cultivos de células no diferenciadas, como callos y suspensiones celulares, además de cultivos de órganos como brotes y raíces. Los sistemas que operan a nivel comercial usan principalmente cultivos de células en suspensión (Zhao et al., 2005) aunque también se reporta un proceso que opera con raíces transformadas (Guillon et al., 2006).
Los cultivos de células no diferenciadas presentan velocidades de crecimiento mayores a los de células diferenciadas u órganos (raíces y brotes); además, los procesos de transferencia de masa son más eficientes y pueden desarrollarse cultivos con densidades celulares más elevadas, lo que representa ventajas para el desarrollo, control y manipulación de procesos a escala industrial. Sin embargo, la falta de diferenciación celular en los cultivos puede ocasionar que la concentración del metabolito en el cultivo sea menor que en la planta. Por ello, la productividad del sistema in vitro puede ser menor tanto en biorreactor como en matraz y, en consecuencia, el proceso no es económicamente renTable (Verpoorte et al., 2002) y el uso de suspensiones celulares agregadas o poco diferenciadas podría representar una de las limitantes para el desarrollo comercial de sistemas biológicos en biorreactores.
En las plantas, la diferenciación consiste en el conjunto de procesos moleculares, bioquímicos y fisiológicos mediante los cuales una célula meristemática adquiere propiedades metabólicas, estructurales y/o funcionales diferentes a las de la célula progenitora. Entre otros cambios, se presentan: 1) el desarrollo de organelos como los plástidos para realizar la fotosíntesis (cloroplastos) o vacuolas en donde se biosintetizen y acumulen metabolitos secundarios, 2) la formación de pared celular secundaria característica de las células que constituyen el tejido vascular, 3) la organización de las células para constituir los diferentes tejidos y órganos de la planta, y 4) la especialización para la biosíntesis y/o acumulación de metabolitos (St-Pierre et al., 1999; De-Luca y St-Pierre, 2000).
La producción y acumulación de metabolitos secundarios es una expresión de un estado particular de diferenciación celular, el cual es influenciado por un número de factores; diferentes clases de metabolitos secundarios requieren diferentes grados de diferenciación celular o tisular. La formación de gradientes físicos o bioquímicos debidos a la organización celular es también un factor importante. Por ejemplo, la acumulación de isoprenoides depende de la diferenciación de plástidos, debido a que la mayoría de las enzimas de la ruta de biosíntesis se localizan en estos organelos. En otros casos es necesario el desarrollo de órganos de almacenamiento, como los pelos glandulares y las células laticíferas en el caso de los alcaloides (Samanani y Facchini, 2006).
Como alternativa a las suspensiones celulares se ha considerado el uso de sistemas in vitro diferenciados como son brotes o raíces, que si bien presentan rendimientos mejores a los de las células en suspensión, desde el punto de vista tecnológico su cultivo a gran escala es más complejo y costoso (Verpoorte et al., 2002); por ello se ha buscado promover la diferenciación de cultivos de células en suspensión para incrementar la producción de metabolitos secundarios. Tal es el caso del establecimiento de cultivos clorófilos, es decir, con cloroplastos funcionales (Taya et al., 1995; Kino-Oka et al., 2001). Pero las alternativas más exploradas han sido la selección de líneas celulares con agregados de "mayor" tamaño y el desarrollo de agregados con células "especializadas" (Jianfeng et al., 1998a). El objetivo del presente trabajo es mostrar la complejidad anatómica y biosintética que representa para la planta la acumulación de metabolitos secundarios, así como revisar el papel de la agregación celular en los cultivos in vitro para la producción de estos compuestos.
Diferenciación Celular y Biosíntesis de Metabolitos Secundarios: Los Alcaloides Indólicos
Para ejemplificar la estrecha relación entre la biosíntesis de un metabolito secundario y la diferenciación celular en las plantas, se presenta el caso de los alcaloides indólicos. Estos compuestos se encuentran principalmente en plantas de las familias Apocinaceae, Loganiaceae, Rubiaceae y Nissaceae y se caracterizan por la presencia de los núcleos indólico e iridoide, los cuales provienen de la triptamina y la secologanina (Roberts y Strack, 1999).
La biosíntesis de los alcaloides indólicos es sumamente compleja y todavía no se conocen todas las enzimas involucradas, ni los mecanismos que regulan su biosíntesis. Uno de los estudios más completos es el correspondiente a la biosíntesis del alcaloide bisindólico vinblastina en C. roseus. La vinblastina resulta de la condensación de los alcaloides catarantina y vindolina; ésta última, a su vez, es sintetizada en seis pasos a partir del alcaloide tabersonina. Mientras que la catarantina se encuentra en cualquier órgano de la planta, la vindolina es sintetizada únicamente en las hojas y tallo (De-Luca y Cutler, 1987; De-Luca y St-Pierre, 2000).
La distribución celular de algunas de las enzimas involucradas en la biosíntesis de los alcaloides indólicos ha sido estudiada en plantas de C. rosesus (St-Pierre et al., 1999). Las enzimas triptofano descarboxilasa (TDC) y estrictosidina sintasa (STR) se localizan en las células epidérmicas de tallos, hojas y botones florales, y en el protodermo y células corticales que rodean el meristemo apical de la punta de las raíces. Por su parte, las enzimas desacetoxivindolina-4-hidroxilasa (D4H) y acetilvindolina 4-O-acetiltransferasa (DAT) están restringidas a células especializadas conocidas como laticíferas e idioblastos de hojas, tallos y botones florales. Los estudios (St-Pierre et al., 1999; Samanani y Facchini, 2006) muestran la separación espacial de la ruta de biosíntesis de vindolina en células particulares de hoja, tallo y flores, e indican que la ruta temprana, la que va a la triptamina, ocurre en las capas epidérmicas de hojas y tallos inmaduros, mientras que las etapas tardías correspondientes a la biosíntesis de vindolina se localizan en células laticíferas e idioblastos (Figura 1).
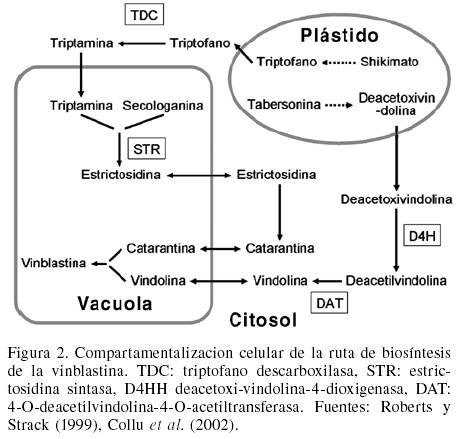
Por otro lado, es importante considerar que al interior de la célula también existe una compartamentalización de la ruta de biosíntesis (Figura 2). La triptamina, el precursor indólico, es sintetizada en el citosol, mientras que su condensación con la secologanina, el precursor iridoide, tiene lugar en la vacuola (Verpoorte, 2000). De manera similar, vindolina y catarantina son sintetizadas en el citosol, pero su condensación para dar lugar a la vindolina ocurre en la vacuola, lo que muestra claramente la necesidad de transporte de intermediarios entre los distintos organelos celulares. Lo anterior muestra en su conjunto que la biosíntesis de la vinblastina requiere células de diferentes tipos y con determinadas características (Figura 1) además de la especialización intracelular que involucra a múltiples compartimentos celulares (Figura 2; Roberts y Strack, 1999; St-Pierre et al., 1999).
La Agregación Celular como Alternativa para la Acumulación de Metabolitos Secundarios en Cultivos In Vitro
Las suspensiones vegetales están formadas por células meristemáticas, es decir células no diferenciadas, que no se separan después de la división y forman agregados multicelulares de diferente tamaño y forma (Figura 3a, Meyer et al., 2002). La tendencia natural a agregarse está regulada por la cohesividad de la pared celular y permite la comunicación célula-célula, que a la vez puede favorecer el transporte de intermediarios, necesario para la biosíntesis de metabolitos secundarios, como se indicó anteriormente.
Las suspensiones celulares son un sistema in vitro utilizado ampliamente en investigación por ser el más práctico para el cultivo a gran escala y presenta múltiples ventajas para el control de parámetros en los biorreactores (Kieran et al., 1997). Para lograr las mejores condiciones de transferencia de masa se prefieren las suspensiones celulares formadas por células individuales o agregados "pequeños". Los agregados tienden a sedimentar más fácilmente que las células libres, lo que dificulta mantenerlos en suspensión, o debido a su adhesión llegan a obstruir las tuberías en los biorreactores, por mencionar algunas dificultades de índole tecnológica.
Las células que conforman una suspensión "fina" son relativamente similares y resulta difícil que en cada una de ellas se lleven a cabo todos los procesos necesarios para la biosíntesis de metabolitos secundarios antes mencionados: síntesis de intermediarios, condensación, transporte y acumulación (Figura 3b). Por ello se plantea que la formación de agregados o el cultivo de órganos puede ser una alternativa más atractiva para la síntesis y acumulación de metabolitos secundarios.
La influencia de la agregación y el tamaño de los agregados celulares en la acumulación de metabolitos secundarios se han estudiado en varias especies, tanto en matraz como en biorreactor (Tabla I). Estos agregados se caracterizan por medir varios milímetros e incluso centímetros de diámetro; son esféricos, de superficie lisa, cohesivos y presentan cierto grado de diferenciación celular o tisular (Figura 3c). En condiciones óptimas, las células que los conforman pueden proliferar sin perder su integridad. Este tipo de agregados son considerados como un grupo de células "auto-inmovilizadas".
Hoekstra (1993) propuso el cultivo de agregados de Cinchona ledgeriana Moens. de 3-6mm de diámetro para la producción de quinina y quinidina. Los agregados de 2-4mm de Rhodiola sachalinensis A. Bor. acumularon hasta diez veces más salidrósidos que agregados de tamaño menor (Jianfeng et al., 1998a, b). Inclusive, en un reactor tipo airlift, suspensiones de agregados de 3-7mm acumularon seis veces más metabolitos que las suspensiones finas. Por otro lado, los agregados de C. roseus de 3-7mm de diámetro produjeron dos veces más alcaloides que las suspensiones finas (Zhao et al., 2001). En otro estudio la producción de jaceosidina e hispidulina en Saussurea medusa fue mayor en agregados de 2-4mm de diámetro (Fu et al., 2005). Se observó una relación directa entre el tamaño de los agregados de Fragaria ananassa R. y la producción de antocianinas; la línea "agregada" produjo 95% más antocianinas que la "fina" (Edahiro y Seki, 2006). En contraste, las células aisladas de Salvia officinalis L. produjeron 50 veces más ácido ursólico (terpeno) que los agregados (Bolta et al., 2003).
Los estudios anteriores muestran que, efectivamente, el grado de agregación y el tamaño de los agregados celulares influyen en el nivel de producción de metabolitos secundarios. Sin embargo, no es claro de qué manera afectan la fisiología y el metabolismo de las células. ¿Por qué agregados "más grandes" (³1mm) producen más metabolitos secundarios que agregados "pequeños" (<1mm)?. La mayoría de las explicaciones apuntan en dos sentidos: 1) la agregación influye sobre las condiciones locales de las células que conforman un agregado celular, y 2) está relacionada con la morfogénesis.
Tamaño de los Agregados y Procesos de Transferencia de Masa
Las diferencias en la producción de metabolitos secundarios observada entre los agregados y las suspensiones "finas" han sido analizadas considerando problemas de difusión de nutrientes. Es decir, el tamaño de los agregados influye en los procesos de transferencia de masa, ya que las células localizadas en el interior de un agregado de un tamaño relativamente grande no están expuestas de manera similar a los nutrientes, iluminación, O2 y otros factores microambientales en comparación a las células localizadas en la periferia (Hulst et al., 1989; Pépin et al., 1999; Meyer et al., 2002). De los factores mencionados, la difusión del O2 ha recibido la mayor atención, lo que podría ser consecuencia de la importancia que tiene el O2 como nutriente para el desarrollo de cultivos aeróbicos, como lo son las células vegetales en suspensión (Kieran et al., 1997). El O2 se constituye como un nutriente fundamental en los procesos de oxidación y para la obtención de energía por parte de las células; sin embargo, es considerado como un nutriente limitante en los cultivos en suspensión debido a su baja solubilidad en agua, de apenas 8mg·l-1.
Como consecuencia de lo anterior, las células del centro de un agregado "grande" pueden llegar a estar limitadas en su disponibilidad de O2, generando una condición de estrés y como la acumulación de metabolitos secundarios. O bien, puede inhibirse la producción del compuesto, si está asociada al O2. Con la finalidad de probar esta hipótesis se ha determinado para una serie de líneas celulares el perfil de concentración de O2 en función del diámetro del agregado, así como el diámetro crítico (dcrit; Tabla II). Este parámetro se define como el diámetro máximo para la respiración ilimitada a través del agregado y se calcula la ecuación 1 (Hulst et al., 1989) como
 (1)
(1)
donde dcrit : diámetro crítico, De : coeficiente de difusión efectiva de O2 (m2·s-1), cs : concentración de O2 en la superficie del agregado (mol·m-3), ceq : concentración de O2 en el equilibrio (mol·m-3), y OUR: velocidad de consumo de O2 (mol·m-3).
Hulst et al. (1989) establecieron líneas celulares de Tagetes patula con agregados de 1,0 a 12,8mm de diámetro y observaron que a partir de los 3,0mm, la producción de tiofeno (metabolito con actividad insecticida) fue proporcional al aumento del diámetro del agregado. Incluso, la cantidad de tiofeno excretada al medio dependió del tamaño del agregado. Los agregados de 1mm no excretaron los metabolitos, mientras que los de 1,4-5,4mm, lo hicieron en niveles de 8-40mmol·cm-3 de células, representando hasta el 90% del total producido. Este resultado lo atribuyeron a que en los agregados de ese tamaño, las células del centro estaban limitadas en su disponibilidad de O2 y por lo tanto "estresadas". Se determinó que en un agregado de 1mm de diámetro, la concentración de O2 en el centro es solo de 30% en comparación a la superficial, y es cercana a cero en agregados de 3mm. Es decir, en los agregados más productivos las células están limitadas por O2.
De manera contraria, en suspensiones de C. roseus cultivadas en un biorreactor tipo tanque agitado, la producción de ajmalicina (alcaloide indólico) está inhibida en agregados con diámetro >250mm (Kebler et al., 1999). Previamente se demostró que existe una correlación positiva entre la concentración de O2 disuelto y la producción del alcaloide (Schlatmann et al., 1995), por lo que se propuso que el comportamiento de los agregados "grandes" (³1000mm) podría explicarse en base a problemas de difusión de O2. Calcularon que un agregado de 250mm está formado por más de 1500 células y que el dcrit era de 3,8mm. Es decir, las células que conformaban esos agregados de 250mm no deberían estar limitadas por O2. Entonces, la limitación de este nutriente no explica la disminución en la acumulación de ajmalicina.
Agregación y Morfogénesis
Como se discutió en la sección anterior, la limitación de O2 no explica en todos los casos las diferencias observadas en el nivel de metabolitos secundarios en función del tamaño del agregado, por lo que se ha intentado determinar si la agregación celular de los cultivos in vitro implica un proceso de diferenciación celular. Para ello se busca generar "agregados compactos" o compact callus aggreggates (CCA) y tratar de evidenciar la formación de estructuras morfogénicas que pudieran asociarse con la producción de metabolitos secundarios.
Los estudios histológicos de los agregados de C. ledgeriana (Hoekstra, 1993), R. sachalinensis (Jianfeng et al., 1998a, b) y C. roseus (Zhao et al., 2001) permitieron conocer que no solo estaban formados por células meristemáticas, como ocurre en las suspensiones "finas" (Figura 3). En particular, los agregados de R. sachalinesis presentaron en su centro tejido de parénquima y en las capas periféricas células meristemáticas rodeadas por una capa epidérmica. Mientras los agregados de C. ledgeriana y C. roseus presentaron tejido vascular, los agregados compactos de S. medusa productores de jaceosidina mostraron potencial para regenerar plantas (Fu et al., 2005). En agregados compactos de Hypericum perforatum L. se observó la acumulación de hipericinas, compuestos con actividad antidepresora, en las células de la superficie del agregado durante la etapa tardía de crecimiento (Song et al., 2007). Estos antecedentes muestran que el grado de agregación y compactación están relacionados con la morfogénesis.
El desarrollo de líneas celulares con las características antes descritas ha sido resultado principalmente de la manipulación de los componentes del medio de cultivo y el tipo de explante. Por ejemplo, 1) la sustitución del ácido 2,4-diclorofenoxiacético por una auxina más débil como el ácido a-naftalenacético o el ácido 3-indol acético (Hulst et al., 1989; Hoekstra, 1993; Chang et al., 2006), 2) la sustitución de la citocinina cinetina por 6-bencilaminopurina (Hoekstra, 1993; Zhao et al., 2001), 3) la modificación en la relación auxina/citocinina (Hoekstra, 1993), 4) el aumento en la concentración de nitrato, y 5) la modificación en la concentración de otros componentes del medio de cultivo como vitaminas o sacarosa (Zhao et al., 2001). En lo que al explante se refiere, en la especie Calophyllum inophyllum Linn. el uso de nodos/internodos favoreció el desarrollo de agregados compactos en comparación a hoja (Pawar et al., 2007), mientras que en R. sachalinensis, se formaron a partir de explantes de cotiledones y no de tallos u hojas (Wu et al., 2003).
Recientemente Montiel et al. (2007) reportaron que la expresión del gen Agl12 de Arabidopsis thaliana en suspensiones celulares de C. roseus promueve el desarrollo de agregados globulares con células tipo parénquima. En estos agregados la producción del alcaloide ajmalicina fue mayor que en las suspensiones no transformadas. El gen Agl12 actúa al nivel de la expresión de genes que codifican para dos enzimas de la ruta de biosíntesis de alcaloides, la geraniol-10-hidroxilasa (G10H) y la 1-deoxi-D-xilulosa 5-fosfato sintasa (DXS), las cuales están involucradas en la biosíntesis de la secologanina (precursor terpénico). Estos resultados muestran que los factores de transcripción involucrados en la diferenciación a tejidos u órganos pueden constituir una nueva herramienta de la ingeniería metabólica para diseñar cultivos in vitro capaces de producir metabolitos secundarios.
Combinación de la Agregación con otras Estrategias
Los trabajos reseñados mostraron que la agregación promueve la producción de metabolitos secundarios. Sin embargo, esto no ha sido suficiente para desarrollar bioprocesos económicamente rentables. Por ello, se ha recurrido a combinar la agregación con otras estrategias como la selección de líneas celulares, la elicitación o la adición de precursores. O bien, a utilizar a los agregados como "bio-transformadores". A continuación se presentan algunos ejemplos.
Rhodiola rosea L. es una especie vegetal de interés medicinal que acumula en su rizoma salidrósidos y los glicósidos de cinamil-alcohol, rosina, rosavina y rosarina. En cultivos de CCA de R. rosea se estimuló la producción de rosina y rosavina mediante la biotransformación del cinamil-alcohol (György et al., 2004). Por otro lado, se observó la formación de nuevos compuestos químicos con potencial biológico. Al adicionar glucosa al medio de cultivo la capacidad de biotransformación a rosina se duplicó (György et al., 2005, 2006). En otro caso, Qu et al. (2006) propusieron que la adición de fenilalanina (30mmol·l-1) y metil jasmonato (218mmol·l-1) a agregados de 50mm de V. vinifera estimulaba hasta en cinco veces la producción de antocianinas. En CCA de R. sachalinensis se observó que una mayor relación auxina:citocininas era benéfica tanto para el desarrollo de los agregados como para la producción de los salidrósidos (Xu et al., 1999). Se observó también que la adición al medio de cultivo de sacarosa (100g·l-1) tuvo un efecto positivo en la síntesis de los compuestos químicos.
Los resultados reseñados muestran que la obtención de agregados celulares es una estrategia que favorece la síntesis y acumulación de metabolitos secundarios en los cultivos in vitro. Estos agregados podrían asemejar hasta cierto punto la compartamentalización que se presenta en las plantas y que permite la biosíntesis de compuestos químicos. La combinación de la agregación con otras estrategias, tales como la selección de líneas celulares, la elicitación y la adición de precursores, constituye una alternativa para desarrollar bioprocesos in vitro para la producción de compuestos químicos de alto valor agregado.
AGRADECIMIENTOS
Este trabajo fue financiado por la Secretaría de Investigación y Posgrado del IPN (Proyecto SIP 20070118). Los autores son becarios COFAA y EDI.
REFERENCIAS
1. Bolta Z, Baricevic D, Raspor P (2003) Biomass segregation in sage cell suspension cultures. Biotechnol. Lett. 25: 61-65. [ Links ]
2. Chang SH, Tsay JY, Ho CK, Huang CY (2006) Callus culture and camptothecin production of Camptotheca acuminate. Taiwan J Sci. 21: 513-521. [ Links ]
3. Collu G, García AA, van der Heijden R, Verpoorte R (2002) Activity of the cytochrome P450 enzyme geraniol 10-hydroxylase and alkaloid production in plant cell cultures. Plant Sci. 162: 165-172. [ Links ]
4. De-Luca V, Cutler A (1987) Subcellular localization on enzyme involved in indole alkaloid biosynthesis in Catharanthus roseus. Plant Physiol. 85: 1099-1102. [ Links ]
5. De-Luca V, St-Pierre B (2000) The cell and developmental biology of alkaloid biosynthesis. Trends Plant Sci. 5: 168-173. [ Links ]
6. Edahiro JI, Seki M (2006) Phenylpropanoid metabolite supports cell aggregate formation in strawberry cell suspension culture. J. Biosci. Bioeng. 102: 8-13. [ Links ]
7. Fu CX, Zhao DX, Huang Y, Ma FS (2005) Cellular aggregate size as a critical factor for flavonoid production by suspension cultures of Saussurea medusa. Biotechnol. Lett. 27: 91-95. [ Links ]
8. Guillon S, Trémouillaux-Guiller J, Pati PK, Rideau M, Gantet P (2006) Hairy root research: recent scenario and exciting prospects. Curr. Opinion Plant Biol. 9: 341-346. [ Links ]
9. György Z, Tolonen A, Pakonen M, Neubauer P, Hohtola A (2004) Enhancing the production of cinnamyl glycosides in compact callus aggregate cultures of Rhodiola rosea by biotransformation of cinnamyl alcohol. Plant Sci. 166: 229-236. [ Links ]
10. György Z, Tolonen A, Neubauer P, Hohtola A (2005) Enhanced biotransformation capacity of Rhodiola rosea callus cultures for glycoside production. Plant Cell Tiss. Org. Cult. 83: 129-135. [ Links ]
11. György Z, Neubauer P, Tolonen A, Hohtola A (2006) Enhancing the biotransformation of Rhodiola rosea callus cultures. Acta Hort. 725: 613-620. [ Links ]
12. Hanagata N, Ito A, Uehara H, Asari F, Takeuchi T, Karube I (1993) Behavior of cell aggregate of Carthamus tinctorius L: cultured cells and correlation with red pigment formation. J. Biotechnol. 30: 259-269. [ Links ]
13. Hoekstra S (1993) Accumulation of indole alkaloids in plant-organ culture. Tesis. Universidad de Leiden. Holanda. [ Links ]
14. Hulst AC, Meyer MMT, Breteler H, Tramper J (1989) Effect of aggregate size in cell cultures of Tagetes patula on thiophene production and cell growth. Appl. Microbiol. Biotechnol. 30: 18-25. [ Links ]
15. Jianfeng X, Jian X, Aiming H, Pusun F, Zhiguo S (1998a) Kinetic and technical studies on large-scale culture of Rhodiola sachalinensis compact callus aggregates with airlift reactors. J. Chem. Technol. Biotechnol. 72: 227-234. [ Links ]
16. Jianfeng X, Zhiguo S, Pusun F (1998b) Suspension culture of compact callus aggregate of Rhodiola sachalinensis for improved salidroside production. Enzyme Microb. Technol. 23: 20-27. [ Links ]
17. Karppinen K, Hohtola A, Gyïorgy Z, Neubauer P, Tolonen A, Jalonen J (2006) Comparison of growth and secondary metabolite accumulation in cultures of compact callus aggregates and shoots of Hypericum perforatum L: in shake flasks and in a bubble column bioreactor. Acta Hort. 725: 605-612. [ Links ]
18. Keßler M, ten Hoopen G, Furusaki S (1999) The effect of the aggregate size on the production of ajmalicine and tryptamine in Catharanthus roseus suspension culture. Enzyme Microb. Technol. 24: 308-315. [ Links ]
19. Kieran P, MacLoughlin P, Malone D (1997) Plant cell suspension cultures: some engineering considerations. J. Biotechnol. 59: 39-52. [ Links ]
20. Kino-Oka M, Nagatone H, Taya M (2001) Characterization and application of plant hairy roots endowed with photosynthetic functions. En Scheper T (Ed.) Advances in Biochemical Engineering/Biotechnology. Vol. 72. Springer. Berlín, Alemania. pp: 183-218. [ Links ]
21. Madhusudhan R, Ravishankar GA (1996) Gradient of anthocyanin in cell aggregates of Daucus carota in suspension cultures. Biotechnol. Lett. 18: 1253-1256. [ Links ]
22. Meyer JE, Pépin MF, Smith MAL (2002) Anthocyanin production from Vaccinium pahalae limitations of the physical microenvironment. J. Biotechnol. 93: 45-57. [ Links ]
23. Montiel G, Breton C, Thiersault M, Burlat V, Jay-Allemand C, Gantet P (2007) Transcription factor Agamous-like 12 from Arabidopsis promotes tissue-like organization and alkaloid biosynthesis in Catharanthus roseus suspension cells. Metab. Eng. 9: 125-132. [ Links ]
24. Pawar KD, Joshi SP, Bhide SR, Thengane SR (2007) Pattern of anti-HIV dipyranocoumarin expression in callus cultures of Calophyllum inophyllum Linn. J. Biotechnol. 130: 346353. [ Links ]
25. Pèpin MF, Smith MAL, Reid JF (1999) Application of imaging tools to plant cell culture: relationship between plant cell aggregation and flavonoid production. In vitro Cell Dev. Biol. Plant 35: 290-295. [ Links ]
26. Qu JG, Zhang W, Jin MF, Yu XJ (2006) Effect of homogeneity on cell growth and anthocyanin biosynthesis in suspension cultures of Vitis vinifera. Chin. J. Biotechnol. 22: 805-810. [ Links ]
27. Roberts MF, Strack D (1999) Biochemistry and physiology of alkaloids and betalains. En Wink M (Ed.) Biochemistry of plant secondary metabolism. Annu. Plant Rev. 2: 17-18. [ Links ]
28. Samanani N, Facchini PJ (2006) Compartmentalization of plant secondary metabolism. En Romeo JT (Ed.) Recent advances in Phytochemistry. Elsevier. Oxford, RU. pp: 5383. [ Links ]
29. Schlatmann JE, Vinke JL, ten Hoopen HJG, Heijnen JJ (1995) Relation between dissolved oxygen concentration and ajmalicine production rate in high density cultures of Catharanthus roseus. Biotechnol. Bioeng. 45: 435-439. [ Links ]
30. Sharp JM, Doran PM (2001) Strategies for enhancing monoclonal antibody accumulation in plant cell and organ cultures. Biotechnol. Progr. 17: 979-992. [ Links ]
31. Song X, Zhu J, Lv HF (2007) The development of secondary cells in the callus of Hypericum perforatum L. and hypericins accumulation. Bull. Exp. Biol. 40: 49-61. [ Links ]
32. Sottomayor M, Lopes Cardoso I, Pereira LG, Barceló A (2004) Peroxidase and the biosynthesis of terpenoid indole alkaloids in the medicinal plant Catharanthus roseus (L.) G. Don. Phytochem. Rev. 3: 159-171. [ Links ]
33. St-Pierre B, Vázquez-Flota FA, De Luca V (1999) Multicellular compartmentation of Catharanthus roseus alkaloid biosynthesis predicts intracellular translocation of a pathway intermediate. Plant Cell. 11: 887-900. [ Links ]
34. Taya M, Miya-Oka M, Toyo-Oka Y, Kino-Oka M, Tone S, Ono K (1995) Growth characteristics of liverwort cells, Marcanthia paleacea var. diptera, in a photoautotrophic suspension culture. J. Ferm. Bioeng. 80: 580-585. [ Links ]
35. Trejo G, Cerda C, Ramos A, Rodríguez M (2005) Producción de alcaloides oxindólicos en agregados celulares de Uncaria tomentosa. Mem. XI Cong. Nacional de Biotecnología y Bioingeniería. Mérida, México. p. CII-29. [ Links ]
36. Verpoorte R (2000) Plant secondary metabolism. En Verpoorte R, Alfermann AW (Eds.) Metabolic Engineering of Plants Secondary Metabolism. Kluwer. Dordrecht, Holanda. pp: 1-29. [ Links ]
37. Verpoorte R, Contin A, Memelink J (2002) Biotechnology for the production of plant secondary metabolites. Phytochem. Rev. 1: 13-25. [ Links ]
38. Wu S, Zu Y, Wu M (2003) High yield production of salidroside in the suspension culture of Rhodiola sachalinensis. J. Biotechnol. 106: 3343. [ Links ]
39. Xu JF, Ying PQ, Han AM, Su ZG (1999) Enhanced salidroside production in liquid-cultivated compact callus aggregates of Rhodiola sachalinensis: manipulation of plant growth regulators and sucrose. Plant Cell Tiss. Org. Cult. 55: 53-58. [ Links ]
40. Yu F, Zhang D, Bai F, An L (2005) The accumulation of isocamptothecin A and B in suspension cell culture of Camptotheca acuminate. Plant Cell Tiss. Organ Cult. 81: 159-163. [ Links ]
41. Yuan X, Zhao B, Wang Y (2004) Cell culture of Saussurea medusa in a periodically submerged air-lift bioreactor. Biochem. Eng. J. 21: 235–239. [ Links ]
42. Zhao J, Hu Q, Guo YQ, Zhu WH (2001) Effects of stress factors, bioregulators, and synthetic precursors on indole alkaloid production in compact callus clusters cultures of Catharanthus roseus. Appl. Microbiol. Biotechnol. 55: 693-698. [ Links ]
43. Zhao D, Huang Y, Jin Z, Qu W, Lu D (2003) Effect of aggregate size in cell cultures of Saussurea medusa on cell growth and jaceosidin production. Plant Cell Rep. 21: 1129-1133. [ Links ]
44. Zhao J, Davis LC, Verpoorte R (2005) Elicitor signal transduction leading to production of plant secondary metabolites. Biotechnol. Adv. 23: 283-333. [ Links ]












 uBio
uBio