Interciencia
versión impresa ISSN 0378-1844
INCI v.33 n.5 Caracas mayo 2008
Obtención de jarabe fructosado a partir de almidón de plátano (musa paradisíaca l.). Caracterización parcial
Juan Pablo Hernández-Uribe, Sandra Leticia Rodríguez-Ambriz y Luis Arturo Bello-Pérez
Juan Pablo Hernández-Uribe. Químico-Industrial, Universidad Autónoma del Estado de Morelos, México. Maestro en Ciencias en Desarrollo de Productos Bióticos, Centro de Desarrollo de Productos Bióticos del IPN. (CEPROBI-IPN) México. Estudiante de Doctorado en Desarrollo de Productos Bióticos, CEPROBI-IPN, México.
Sandra Leticia Rodríguez-Ambriz. Química Farmacobióloga, Universidad Autónoma de Puebla, México. Maestro en Ciencias en Ciencia y Tecnología de los Alimentos, Universidad Autónoma de Querétaro, México. Profesor CEPROBI-IPN, México.
Luis Arturo Bello-Pérez. Ingeniero Bioquímico Instituto Tecnológico de Acapulco, México. Maestro en Ciencias en Bioingeniería Centro de Investigación y de Estudios Avanzados del IPN, México, D.F. y Doctor en Ciencias en Biotecnología de Plantas, Centro de Investigación y de Estudios Avanzados del IPN, Irapuato, Guanajuato, México. Profesor CEPROBI-IPN. Miembro regular de la Academia Mexicana de Ciencias. Dirección: Km 8.5 carr. Yautepec-Jojutla, colonia San Isidro, Apdo. Postal 24, 62731 Yautepec, Morelos, México. e-mail: labellop@ipn.mx
RESUMEN
El consumo de fructosa se ha incrementado en los últimos años, llegando a reemplazar a la sacarosa en diversas aplicaciones industriales. Usualmente, la fructosa se obtiene por isomerización continua de la glucosa obtenida a partir del almidón de maíz. Sin embargo, debido al aumento del precio de este grano, es necesario identificar nuevas fuentes de almidones que puedan ser utilizadas en la producción de fructosa. En este trabajo se reportan algunas propiedades fisicoquímicas del jarabe de fructosa (JFP) obtenido a partir del almidón de plátano Musa paradisíaca L. El JFP se obtuvo mediante dos reacciones secuenciales, catalizadas por enzimas que transformaron el almidón a glucosa y, finalmente, la glucosa a jarabe de fructosa mediante isomerización. En la isomerización se logró una conversión media de 41,3%, obteniéndose un promedio de 63,3mg·ml-1 de fructosa a las 80h de proceso. El color del JFP, medido en unidades de densidad óptica, fue alto (1,78) en comparación con la escala recomendada para jarabe de fructosa (0,025-0,200), lo que probablemente se debió a que el JFP tiene un mayor contenido de cenizas (2,07%) que los jarabes comerciales. La viscosidad del producto fue baja en comparación con los jarabes comerciales. Los resultados demuestran que es posible obtener jarabe fructosado a partir del almidón de plátano, con características comparables a los jarabes comerciales, mediante un procedimiento enzimático.
Obtention of fructose syrup from plantain (musa paradisiaca l.) Starch. Partial characterization
SUMMARY
Fructose consumption has increased in recent years, substituting for saccharose in several industrial applications. It is usually produced by continuous isomerization of glucose syrup obtained from maize starch. However, due to the considerable increase in cost of maize, it is necessary to search for new sources that could be used as raw material for fructose syrup production. This study reports some physicochemical characteristics of fructose syrup obtained from plantain (Musa paradisiacal L.) starch. The transformation of banana starch to sucrose was carried out in two steps. Starch was enzimatically transformed into glucose, followed by its isomerization into fructose. The isomerization process yielded an average concentration of 63.3mg·ml-1 of fructose after processing for 80h, representing an average conversion of 41.3%. The color of the fructose syrup, measured in optical density units, showed a high value (1,78) in comparison with the standard value (0.025-0.200) recommended for fructose syrup. This was probably due to a higher ash content (2.07%) than that of commercial syrups. The viscosity of the fructose syrup obtained from plantain starch was lower than in commercial samples. The results show that it is possible to obtain fructose syrup from banana starch with comparable characteristics to those of commercial syrups employing an enzymatic process.
Obtenção de xarope de frutose a partir de amido de plátano (musa paradisíaca l.). Caracterização parcial
RESUMO
O consumo de frutose tem se incrementado nos últimos anos, chegando a substituir a sacarose em diversas aplicações industriais. Usualmente, a frutose se obtém por isomerização continua da glicose obtida a partir do amido de milho. No entanto, devido ao aumento do preço deste grão, é necessário identificar novas fontes de amidos que possam ser utilizadas na produção de frutose. Neste trabalho se relatam algumas propriedades físico-químicas do xarope de frutose (JFP) obtido a partir do amido de plátano Musa paradisíaca L. O JFP se obteve mediante duas reações seqüenciais, catalisadas por enzimas que transformaram o amido a glicose e, finalmente, a glicose a xarope de frutose mediante isomerização. Na isomerização se conseguiu uma conversão média de 41,3%, obtendo-se uma média de 63,3mg·ml-1 de frutose às 80h de processo. A cor do JFP, medido em unidades de densidade óptica, foi alta (1,78) em comparação com a escala recomendada para xarope de frutose (0,025-0,200), o que provavelmente foi devido a que o JFP tem um maior conteúdo de cinzas (2,07%) que os xaropes comerciais. A viscosidade do produto foi baixa em comparação com os xaropes comerciais. Os resultados demonstram que é possível obter xarope de frutose a partir do amido de plátano, com características comparáveis aos xaropes comerciais, mediante um procedimento enzimático.
PALABRAS CLAVE / Almidón / Plátano / Jarabe Fructosado /
Recibido: 11/06/2007. Modificado: 24/03/2008. Aceptado: 26/03/2008.
Introducción
El aumento de la prevalencia en los países desarrollados y en algunos en vías de desarrollo, como México, de numerosas enfermedades de algún modo relacionadas al consumo excesivo de calorías, tales como las enfermedades cardiovasculares, la diabetes y, especialmente, la obesidad, ha estimulado a la industria a desarrollar y producir diversos edulcorantes de bajo aporte calórico que no alteren el dulzor que los consumidores exigen de los productos. La fructosa, con un poder edulcorante dos veces mayor que la sacarosa, es reconocida como un edulcorante seguro y alternativo a otros azúcares, siendo recomendado su consumo por pacientes que sufren de Diabetes mellitus tipo I y II (Gerrits y Tsalikian, 1993; Uusitupa, 1994; Moore et al., 2001).
La fructosa es producida industrialmente como jarabe de maíz rico en fructosa (HFCS, por sus siglas en ingles; Atiyeh y Duvnjak, 2002), el cual se obtiene por isomerización continua de la glucosa producida a partir de almidón de maíz. El paso de isomerización es realizado mediante catálisis enzimática, para lo cual se usa la enzima glucosa isomerasa inmovilizada en matrices empacadas en columnas (Palazzi y Converti, 2001). El uso de la enzima inmovilizada permite alcanzar concentraciones altas del catalizador, el cual mantiene su actividad durante más tiempo, lo que incrementa el rendimiento del proceso y abarata el producto. Además, se puede realizar recirculación con la finalidad de obtener mayor pureza del producto final (Arroyo, 1998).
En los últimos años el aumento en el precio del maíz (CEFP, 2007) ha estimulado la búsqueda de fuentes alternativas para la producción de fructosa. Flores-Gorosquieta et al. (2003) reportaron un procedimiento para la obtención de almidón a partir de plátano (Musa paradisiaca) var. macho. En el presente trabajo se reporta un método enzimático, desarrollado a nivel de planta piloto para la producción de jarabe de fructosa a partir de este almidón.
Materiales y Métodos
Aislamiento de almidón
El plátano de la variedad macho en estado fisiológico maduro fue adquirido en la central de abasto de Cuautla, Morelos. Se utilizó el método de extracción propuesto por Flores-Gorosquieta et al. (2004), procedimiento que consiste en molienda de la pulpa, tamizado, centrifugado y secado, para la obtención del almidón en polvo.
Licuefacción del almidón de plátano
Se siguió el método utilizado por Flores-Gorosquieta (2003), utilizando un reactor de 20 litros. Se preparó una suspensión de almidón de plátano en agua destilada al 20% (p/v), se ajustó el pH a 7,3 y se gelatinizó a 80°C por 10min. Se disminuyó la temperatura a 70°C, se adicionó a-amilasa (Starzyme TE, actividad de 8,430µg maltosa/min) de ENMEX®, México, al 0,06% (v/v) y se dejó reaccionar por 3h, para posteriormente inactivar la enzima con HCl 0,1N (pH 2,0). A continuación se centrifugó a 1700rpm a fin de separar el almidón no hidrolizado.
Sacarificación del almidón
Una vez separado el almidón no hidrolizado, se sometió al sobrenadante a una temperatura de 60°C y el pH fue ajustado a 4,5 con HCl 0,1N o con NaOH 0,1N. Se adicionó 0,15% (v/v) de amiloglucosidasa (Starzyme TE, actividad de 13,385µg maltosa/min) de ENMEX®, México y se dejó reaccionar por 6h (Bello-Pérez et al., 2002). Al jarabe de glucosa obtenido se le determinó la dextrosa equivalente (DE) empleando el método de Pancoast y Junk (1980). En este paso se realizó una estandarización del método para la obtención de un jarabe con una DE de 80 utilizando un reactor de 20 litros.
Obtención de jarabe fructosado
Antes de llevar a cabo la isomerización del jarabe de glucosa obtenido de la sacarificación del almidón de plátano, se procedió a realizar el proceso de isomerización utilizando glucosa anhidra, con el objeto de verificar la funcionalidad del reactor. Para ello se trabajó un total de 168h, tiempo durante el cual la concentración de fructosa fue variable, lo que indicó que existía inestabilidad en el sistema. Factores como el pH pueden alterar la actividad y la estabilidad de la enzima (Mishra y Debnath, 2002) y en consecuencia causar variaciones en la concentración de fructosa durante el proceso continuo. Para comprobar esta hipótesis se corrió un segundo proceso de isomerización por 48h, monitoreando el pH en el reservorio del sustrato, el cual cambió de 7,5 a 8,14, indicando que el regulador de carbonato no estaba funcionando. Se procedió entonces a cambiar el regulador que contiene el sustrato de la reacción, eligiéndose a partir de la literatura (Kumakura et al., 1979; Zhou et al., 1992; Ge et al., 1999; Bandlish et al., 2002) un regulador de fosfatos y se realizó una prueba de isomerización durante la cual la concentración de fructosa en el efluente se mantuvo constante en 179mg·ml-1 por un total de 28h. Sin embargo, el uso de este regulador provocó que precipitaran cristales de color blanco en el reactor y después de un tiempo se obliteró por el exceso de precipitado.
A partir de estos datos se encontró que el control del pH del sustrato es clave para el proceso de isomerización y que el regulador de fosfato permite controlar el pH en forma adecuada, pero después de un tiempo oblitera el reactor haciendo imposible el flujo del sustrato. Se decidió entonces volver a utilizar el regulador de carbonato monitoreando y controlando el pH del sustrato. Los resultados mostraron que la concentración de fructosa fue constante (205mg·ml-1) a la salida del reactor por 88h y se obtuvo una conversión del 45,7%. Una vez realizada esta caracterización del sistema y conociendo las condiciones de trabajo se procedió a realizar la isomerización del jarabe de glucosa obtenido a partir del almidón de plátano.
La obtención del jarabe fructosado se realizó a 60ºC, en un reactor de columna con camisa para control de temperatura, con una relación 1:20 (diámetro:altura) y se usaron 2,0g de enzima glucosa izomerasa (Sweetzyme IT®, Bagsvaerd, Denmark) con actividad de 160 IGIU/g, donde IGIU son las siglas de immobilized glucose isomerase units (Bandlish et al., 2002). Para activar la enzima se siguió el procedimiento descrito por Novozymes (2002). Se pesaron 2,0g de enzima en un vaso de precipitado de 100ml, se adicionaron 40ml de sustrato de glucosa anhidra al 45% (p/v) preparado bajo las condiciones de Novozymes; pH 7,5 ajustado con H2SO4 0,5M y NaOH 1M; 1g·l-1 MgSO47H2O; 0,18g·l-1 Na2S2O5; 0,21g·l-1 Na2CO3), se dejó reaccionar por 1h agitándose cada 5min, durante los primeros 15min y después con intervalos de 15min. Posteriormente se vertió la enzima en el reactor. A continuación se alimentó de forma continua el reactor con el jarabe de glucosa obtenido a partir del almidón de plátano (también preparado bajo las condiciones de Novozymes), para lo que se empleó una bomba peristáltica (Master Flex C/L, modelo 77120-62, Barrington, IL, EEUU) a una velocidad de flujo de 0,8ml/min (Bandlish et al., 2002) y se mantuvo constante el pH (7,55) con un controlador digital (Modelo pH 7615, B&C Electronics, Italia). La concentración de fructosa se determinó por el método de Ting (1956) y fue monitoreada mediante un programa basado en tomar muestras a diferentes intervalos de tiempos.
Color y estabilidad de color en el jarabe de fructosa
El color y la estabilidad del color se determinaron de acuerdo al método reportado por Pancoast y Junk (1980). El color de los jarabes usualmente se reporta en unidades de densidad óptica (UDO) que se calculan con la fórmula
![]()
donde T: transmitancia.
Las valores de UDO (Tabla I) se relacionaron con una escala de color (Guzmán-Maldonado, 1992).
La estabilidad del color se midió a través del incremento de color originado por el calentamiento de la muestra. La muestra se colocó en tubos de vidrio sellados que se sumergieron en un baño de agua en ebullición por 1h. Los cálculos se realizaron con la fórmula
DDO= Dof - Doi
donde DDO: incremento en el color, Dof: densidad óptica final, Doi: densidad óptica inicial.
Como estándares de comparación para el jarabe fructosado a partir de plátano se utilizaron los jarabes comerciales Miel Carlota® (MC) y la Miel Karo® (MK) (ambas obtenidas a partir de almidón de maíz).
Análisis químicos y fisicoquímicos
Los análisis de densidad, cenizas sulfatadas, grados brix (°Bx), humedad, sólidos se realizaron con los métodos oficiales 945,06; 900,02; 932,14; 925,10 y 945,62; respectivamente; de la AOAC (1990). La viscosidad y el pH se determinaron mediante las técnicas utilizadas por Flores-Gorosquieta (2003) y Guzmán-Maldonado (1992), respectivamente.
Análisis estadístico
Para determinar la significancia estadística de las propiedades fisicoquímicas de los jarabes fructosados, se aplicó un análisis de varianza de una sola vía (p£0,05). Cuando se encontraron diferencias significativas, se aplicó la prueba de comparación múltiple de Tukey (Walpole et al., 1991) usando el paquete estadístico Sigma-Stat, versión 2,1.
Resultados y Discusión
Obtención del jarabe de fructosa
La conversión de glucosa a fructosa llevada acabo durante 117h, a partir de la sacarificación del almidón de plátano (Figura 1) mostró que durante 50h de reacción la conversión de glucosa a fructosa se mantuvo por arriba del 40%, hubo una disminución a las 57h, para después mantenerse constante hasta las 80h y, finalmente, la conversión de glucosa a fructosa disminuyó gradualmente hasta las 117h. Esto se debió a que la actividad de la enzima disminuyó conforme transcurrió el tiempo de reacción, ocasionado por la presencia de impurezas en el jarabe de glucosa alimentado al reactor. Un reactor continuo operado durante un tiempo largo está expuesto a una gran cantidad de sustrato y en consecuencia el efecto acumulado de impurezas en el jarabe de alimentación puede llevar a la reducción significativa de la actividad enzimática. Algunas impurezas solubles, tales como proteínas, aminoácidos y cenizas, son inhibidores potenciales de la enzima glucosa isomerasa inmovilizada y pueden inactivarla químicamente, mientras que otras se absorben en la enzima bloqueando gradualmente los sitios activos (Novozymes, 2002). Estos resultados se corresponden con la cantidad elevada de cenizas encontrada en el jarabe de fructosa obtenido del almidón de plátano.
La concentración de fructosa promedio que se tuvo hasta las 80h fue de 63,3mg·ml-1, lo que representa una conversión media de 41,3%, valor que está dentro de la conversión esperada para esta enzima (40-45%) según las especificaciones del fabricante. Es importante conocer esta conversión utilizando un nuevo sustrato diferente al jarabe de glucosa obtenido a partir de almidón de maíz. A su vez, la concentración de DE utilizada (80%) permitió obtener la velocidad máxima de conversión de la enzima para este nuevo sustrato. Después de las 80h de uso continuo del reactor con la enzima inmovilizada, la actividad de la enzima empezó a disminuir, indicando que debe ser reemplazada, o bien que el flujo de alimentación debe ser ajustado en función de la disminución de la actividad de la enzima (Olsen, 1995; Novozymes, 2002). Se han propuesto modelos con la finalidad de optimizar la productividad neta de jarabes de fructosa (Zhang et al., 2004), así como también se ha buscado el uso de fuentes naturales de edulcorantes (Pontoh y Low, 1995; Sáenz et al., 1998).
Color en el jarabe
fructosado
El valor del color para el jarabe de fructosa a partir de almidón de plátano (JFP) fue de 1,78 UDO (Tabla II), siendo significativamente diferente (a=0,05) a los valores obtenidos para los estándares. Este valor tampoco está dentro de los de la escala de color para los jarabes, lo cual puede deberse al alto contenido de cenizas (Tabla III) que proporciona cierta turbiedad al jarabe. Esto muestra que tan importante es la refinación del producto de la isomerización a través de tratamiento con carbón activado o columnas de intercambio iónico donde se puede eliminar el color y obtenerse un jarabe transparente, aunque esto último dependerá de la aplicación eventual dada al jarabe (Wilson et al., 1995).
Estabilidad del color en los jarabes
Se encontraron diferencias estadísticas significativas (a=0,05) entre los tres jarabes ensayados (Tabla II). Los jarabes comerciales MC y MK, a pesar de estar dentro de la escala de color, no son estables en el tiempo, ya que sus valores aumentaron, respectivamente, de 0,052 a 0,14 y de 0,049 a 0,072. El valor de 3,27 para el JFP pudiera deberse a que el jarabe obtenido de la isomerización contiene rastros de proteína y aminoácidos que logran provocar una reacción de oscurecimiento, ya que el jarabe no fue previamente clarificado antes de concentrarse, pues a simple vista el jarabe presentó ausencia de color. Es conocido que los jarabes purificados contienen rastros de proteínas y aminoácidos que llegan a reaccionar con los azúcares reductores, dando las reacciones de oscurecimiento o reacciones de Maillard, donde se obtienen productos de color oscuro. Otra de las causas de la inestabilidad del color es la caramelización que se produce por el calentamiento de los carbohidratos (Kearsley y Dziedzic, 1995). Por otra parte, el JFP presentó un valor de pH >6 y la estabilidad del color del jarabe se favorece a un pH más ácido (Bostan y Boyacioglu, 1997).
Propiedades fisicoquímicas del jarabe fructosado
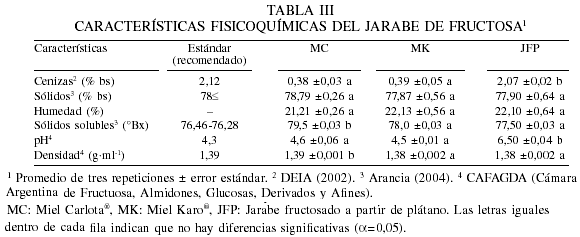
Se encontaron diferencias significativas (a=0,05) en el contenido de cenizas entre el JFP y los jarabes comerciales MK y MC (Tabla III), pero los tres jarabes presentaron un valor menor que el estándar recomendado (DEIA, 2002). El contenido de ceniza para el JFP (2,07%) probablemente fue influenciado por el contenido de sales adicionadas al jarabe de glucosa y las cenizas intrínsecas provenientes de la fuente de almidón, así como también por las soluciones utilizadas en el ajuste de pH durante la reacción de isomerización. Las sales son removidas en los procesos industriales mediante purificación y filtración en columnas de intercambio iónico para que el contenido residual de cenizas sea bajo (Wilson et al., 1995), ya que con esto se evitan problemas muy frecuentes en las bebidas embotelladas, donde el contenido de cenizas puede ocasionar cambios en el sabor y la formación de precipitados y turbiedad en los productos finales, que en ocasiones también presenta la sacarosa.
El contenido de sólidos no fue diferente (a=0,05) entre los tres jarabes y sus valores estuvieron cercanos al valor estándar. En cuanto al contenido de sólidos solubles no se encontraron diferencias estadísticas significativas (a=0,05) entre el JFP y el comercial MK, pero estos sí fueron diferentes a MC. Los valores de los sólidos solubles de los tres jarabes analizados fueron mayores del estándar recomendado (Tabla III), lo cual probablemente se debió a que hay un mayor contenido de azúcares disueltos en esos jarabes con respecto al sugerido en el estándar.
Los valores de pH de los tres jarabes variaron de 4,5 a 6,5 (Tabla III). El mayor valor correspondió a JFP, lo que está relacionado con la ausencia de refinación como se hace a nivel industrial, donde además se ajusta el pH entre 4 y 5 para que haya una calidad final de aceptabilidad y estabilidad durante el almacenamiento del producto.
Viscosidad de los jarabes de fructosa
Los tres jarabes fructosados (MK, MC y JFP) tuvieron un comportamiento de fluido newtoniano, coincidiendo el comportamiento reportados para el jarabe de maíz (Rao, 1986) y la miel (Tello et al., 1996).
La gráfica (Figura 2) de esfuerzo de corte (t) versus la velocidad de deformación (g) muestra una línea recta proporcional entre ambos parámetros, dando un valor del coeficiente de regresión >0,99. La viscosidad del JFP (m= 0,727Pa·s-1) fue menor (a=0,05) que la de los jarabes comerciales MK y MC, de m= 2,71 y 2,88Pa·s-1, respectivamente. Las viscosidades de los tres jarabes fueron diferentes (a=0,05). Se ha reportado que la viscosidad de un jarabe es directamente proporcional a su contenido de humedad y su peso molecular, e inversamente proporcional al contenido de DE (Arancia, 2004). En este caso el contenido de humedad fue el mismo para los tres jarabes; sin embargo, la disminución de la viscosidad podría deberse a la diferencia en el contenido de carbohidratos de bajo peso molecular que pueda contener cada uno. El jarabe de fructosa está formado por carbohidratos de bajo peso molecular, por lo cual presenta una viscosidad baja respecto a otro tipo de edulcorantes, y debido a ello se facilita su manejo (Arancia, 2004). Por otra parte, variando los niveles de viscosidad en los jarabes se tiene un mejor control de la textura de los productos en donde se adiciona, especialmente en alimentos líquidos o semilíquidos (DEIA, 2002).
Conclusiones
El almidón de plátano es una fuente alternativa para la obtención de un jarabe con alto contenido de fructosa. El método propuesto mostró alto rendimiento y permite obtener un producto que cumple con las características necesarias para ser usado como edulcorante. Los resultados obtenidos indican que es factible su aplicación a nivel industrial, en donde debe ser considerada una etapa de refinación del jarabe de fructosa.
AGRADECIMIENTOS
Los autores agradecen el apoyo económico de la SIP-IPN, EDI-IPN, COFAA-IPN, México. El primer autor agradece al IPN la beca de maestría y la beca PIFI.
REFERENCIAS
1. AOAC (1990) Official Methods of Analysis. Association of Official Analytical Chemists. Arlington, VA, USA. 1141 pp. [ Links ]
2. Arancia (2004) Tablas de sólidos para jarabes de maíz de alta fructosa. Arancia Corn Products. México. www.aracornproducts.com.mx (Cons. 17/11/2003). [ Links ]
3. Arroyo M (1998) Immobilized enzymes: Theory, methods of study and applications. Ars Pharm. 39: 23-39. [ Links ]
4. Atiyeh H, Duvnjak Z (2002) Production of fructose and ethanol from sugar beet molasses using Saccharomyces cerevisiae ATCC 36858. Biotechnol. Prog. 18: 234-239. [ Links ]
5. Bandlish RK, Michael-Hess J, Epting KL, Vieille C, Kelly RM (2002) Glucose to fructose conversion at high temperature with xilose (glucose) isomerases from Streptomyces Murinus and two hyperthermophilic Thermotoga species. Biotechnol. Bioeng. 80: 185-194. [ Links ]
6. Bello-Pérez LA, Sánchez-Hernández L, Moreno-Damian E, Toro-Vázquez JF (2002) Laboratory scale production of maltodextrins and glucose syrup from banana starch. Food Technol. 53: 44-48. [ Links ]
7. Bostan A, Boyacioglu D (1997) Kinetic of non-enzymatic colour development in glucose syrup during storage. Food Chem. 60: 581-585. [ Links ]
8. CAFAGDA (2008) Fructosa. Cámara Argentina de Fructosa, Almidones, Glucosas, Derivados y Afines. www.cafagda.com.ar [ Links ]
9. CEFP (2007) México: El Mercado del Maíz y la Agroindustria de la Tortilla. Centro de Estudios de Las Finanzas Públicas. México. www.cefp.gob.mx [ Links ]
10. DEIA (2002) Diccionario de Especialidades para la Industria Alimentaria. Solís Sánchez JA, y Rosenstein Ster E (Eds.) 12ª ed. Thomson PLM. México. pp 80-90. [ Links ]
11. Flores-Gorosquieta E (2003) Obtención de jarabe de glucosa a partir de almidón de plátano empleando un reactor enzimático a nivel planta piloto. Tesis. Instituto Politécnico Nacional. México. 92 pp. [ Links ]
12. Flores-Gorosquieta E, García-Suárez F, Flores-Hiucochea E, Núñez-Santiago MC, Gonzales-Soto RA, Bello-Pérez LA (2004) Rendimiento del proceso de extracción de almidón de frutos de plátano (Musa paradisíaca). Estudios en planta piloto. Acta Cient. Venez. 55: 86-90. [ Links ]
13. Ge Y, Wang Y, Zhou H, Wang S, Tong Y, Li W (1999) Coimmobilization of glucoamylase and glucose isomerase by molecular deposition technique for one-step conversion of dextrin to fructose. J. Biotechnol. 67: 33-40. [ Links ]
14. Gerrits PM, Tsalikian E (1993) Diabetes and fructose metabolism. Am. J. Clin. Nutr. 58: 796S-799S. [ Links ]
15. Guzmán-Maldonado S (1992) Optimización de un procedimiento enzimático para la licuefacción del almidón mediante la metodología de superficie de respuesta. Tesis. Instituto Politécnico Nacional. México. 197 pp. [ Links ]
16. Novozymes (2002) Use of Sweetzyme® T in the production of high fructose syrup. Novozymes A/S, Bagsvaerd, Denmark. [ Links ]
17. Kearsley MW, Dziedzic SZ (1995) Physical and chemical properties of glucose syrups. En Kearleys MW, Dziedzic SZ (Eds.) Handbook of Starch Hydrolysis Products and Their Derivatives. Blackie. Ucrania. pp. 129-154. [ Links ]
18. Kumakura M, Yoshida M, Kaetsu I (1979) Immobilization of glucose isomerase-containing Streptomyces phaeochromogenes cells in fine-particle form. Appl. Env. Microbiol 37: 310-315. [ Links ]
19. Mishra A, Debnath Das M (2002) Effect of pH on simultaneous saccharification and isomerization by glucoamylase and glucose isomerase. Appl. Biochem. Biotechnol. 102: 193-200. [ Links ]
20. Moore MC, Mann SL, Davis SN, Cherrington AD (2001) Acute Fructose Administration Improves Oral Glucose Tolerance in Adults With Type 2 Diabetes. Diabetes Care 24: 1882-1887. [ Links ]
21. Olsen HS (1995) Enzymatic production of glucose syrup. En Kearsley MW, Dziedzic SZ (Eds.) Handbook of Starch Hydrolysis Products and Their Derivatives. Blackie. Ucrania. pp. 26-63. [ Links ]
22. Palazzi E, Converti A (2001) Evaluation of diffusional resistances in the process of glucose isomerization to fructose by immobilized glucose isomerase. Enz. Microb. Technol. 28: 246-252. [ Links ]
23. Pancoast HM, Junk WR (1980) Handbook of Sugar. AVI. Westport, CT, EEUU. 598 pp. [ Links ]
24. Pontoh J, Low NH (1995) Glucose syrup production from Indonesian palm and cassava starch. Food Res. Int. 28: 379-385. [ Links ]
25. Rao MA (1986) Rheological properties of fluid foods. En Rao MA, Rizvi SSH (Eds.) Engineering Properties of Foods. Dekker. Nueva York, EEUU. pp. 1-47. [ Links ]
26. Sáenz C, Estévez AM, Sepúlveda E, Mecklenburg P (1998) Cactus pear fruit: A new source for a natural sweetener. Plant Foods Hum. Nutr. 52: 141-149. [ Links ]
27. Tello E, Pasquel A, Trebejo E (1996) Uso de reometría capilar para la caracterización reológica de néctares de frutas de Solanum topiro. Mem. 1er Cong. Iberoam de Ingeniería de Alimentos. Valencia, España. p. 19. [ Links ]
28. Ting SV (1956) Rapid colourimetric method for simultaneous determination of total reducing sugar and fructose in citrus juices. J. Agric. Food Chem. 4: 263-266. [ Links ]
29. Uusitupa MI (1994) Fructose in the diabetic diet. Am. J. Clin. Nutr. 59: 753S-757S. [ Links ]
30. Walpole ER, Myes HR, Myes LS (1991) Probabilidad y Estadística para Ingenieros. 6ª ed. Printice-Hall Hispanoamericana. México. pp. 688-699. [ Links ]
31. Wilson JA, Mitchell GA, Spruyt DSJ, Vanderbist MJP (1995) Analysis of glucose syrup. En Kearsley MW, Dziedzic SZ (Eds.) Handbook of Starch Hydrolysis Products and Their Derivatives. Blackie. Ucrania. pp. 83-128. [ Links ]
32. Zhang Y, Hidajat K, Ajay KR (2004) Optimal design and operation of SMB bioreactor: production of high fructose syrup by isomerization of glucose. Biochem. Eng. J. 21: 111-121. [ Links ]
33. Zhou H, Kong W, Cha X, Li W, Shen J (1992) Simultaneous saccharification and isomerization by immobilized glucoamylase and glucose isomerase. J. Chem. Technol. Biotechnol. 54: 43-46. [ Links ]












 uBio
uBio