Interciencia
versión impresa ISSN 0378-1844
INCI v.34 n.9 Caracas sep. 2009
Establecimiento de un protocolo de permeabilización con detergentes que incrementa la eficiencia en la producción de betacianinas en cultivos de células de Beta vulgaris L.
Guadalupe Salcedo-Morales, Gabriela Trejo-Tapia, Blanca P. Martínez-Bonfil, Antonia De Jesús-Sánchez, Martha L. Arenas-Ocampo y Antonio R. Jiménez-Aparicio
Guadalupe Salcedo-Morales. Maestra en Ciencias, Centro de Desarrollo de Productos Bióticos-Instituto Politécnico Nacional (CeProBi-IPN), México. Investigadora, CeProBi -IPN, México.
Gabriela Trejo-Tapia. Doctora en Ciencias, Centro de Investigación y de Estudios Avanzados-IPN (CINVESTAV), México. Investigadora, CeProBi -IPN, México.
Blanca. P. Martínez-Bonfil. Maestra en Ciencias, CeProBi -IPN, México. Investigadora, CeProBi-IPN, México.
Antonia De Jesús-Sánchez. Lic. en Nutrición, CeProBi -IPN, México. Investigadora, CeProBi-IPN, México.
Martha Lucía Arenas Ocampo. Doctora en Ciencias, CeProBi -IPN, México. Investigadora, CeProBi-IPN, México.
Antonio R. Jiménez-Aparicio. Doctor en Ciencias, Escuela Nacional de Ciencias Biológicas-IPN, México. Investigador, CeProBi -IPN, México. Dirección: Apdo. Postal Nº 24, C.P. 62730 Yautepec, Morelos, México. e-mail: arjaparicio@hotmail.com
RESUMEN
Se evaluó el efecto de cuatro detergentes, Tween 20, 40 y 80, y Tritón X-100® como agentes químicos permeabilizantes para la liberación de betacianinas (BC) de células en suspensión de Beta vulgaris. Se seleccionó el agente químico permeabilizante con base en la concentración de betacianinas liberadas y el tiempo de contacto. El contenido de BC se estimó usando medición de color por análisis de imágenes. Los resultados mostraron que la adición de Tritón X-100® 0,7mM durante 10min era suficiente para liberar el 36% de BC, con una viabilidad de 60-70%, y permitiendo además un nuevo ciclo de cultivo de las células tratadas y la acumulación paulatina de betacianinas durante el segundo ciclo.
Establishment of a premeabilization protocol with detergents to increase betacianine production efficiency in a Beta vulgaris L. Cell cultures
SUMMARY
Red beet (Beta vulgaris L.) cell suspensions were permeabilized by means of four chemical detergent agents, Tween 20, 40 and 80, and Triton X-100®, to evaluate the recovery of betacianins (BC). The permeabilizating agent was selected as a function of the quantity of BC released and the contact time. Betacianin concentration was measured using digital color image analysis. The results showed that 36% of betacianins was released using Triton X-100® (0.7mM) during 10min; using these extraction conditions, the viability remained at 60-70%. This treatment allowed a second growing-cycle, as well as, an additional accumulation of betacianins.
Estabelecimento de um protocolo de permeabilização com detergentes que incrementa a eficiência na produção de betacianinas em cultivos de células de Beta vulgaris L.
RESUMO
Avaliou-se o efeito de quatro detergentes, Tween 20, 40 e 80, e Tritón X-100® como agentes químicos permeabilizantes para a liberação de betacianinas (BC) de células em suspensão de Beta vulgaris. Selecionou-se o agente químico permeabilizante com base na concentração de betacianinas liberadas e o tempo de contacto. O conteúdo de BC se estimou usando medição de cor por análise de imágens. Os resultados mostraram que a adição de Tritón X-100® 0,7mM durante 10min era suficiente para liberar 36% de BC, com uma viabilidade de 60-70%, e permitindo além disso um novo ciclo de cultivo das células tratadas e a acumulação paulatina de betacianinas durante o segundo ciclo.
Palabras clave / Análisis de Imágenes / Betacianinas / Beta vulgaris / Cultivo de Células / Permeabilización /
Recibido:01/10/2008. Modificado: 09/09/2009. Aceptado: 10/09/2009.
IntroducciónEl análisis de imágenes es una herramienta adecuada para evaluar diversas propiedades de materiales de origen biológico. Una característica que puede ser medida mediante análisis de imágenes es la concentración de compuestos coloreados, a través de la medición del color en imágenes de un material biológico (Trejo-Tapia et al., 2007).
Las betalaínas son pigmentos nitrogenados que comprenden a las betaxantinas de color amarillo y las betacianinas de color rojo. Estos compuestos tienen una limitada distribución biológica. Solo se les encuentra en plantas del orden Caryophyllales y ciertos hongos de los géneros Amanita e Hygrophoruse (Strack et al., 2003). Las betalaínas son hidrosolubles, por lo que son utilizadas en la industria de los alimentos para colorear productos procesados tales como bebidas carbonatadas, lácteos, cárnicos y confites, y en la industria farmacéutica para la manufactura de tabletas (Delgado-Vargas et al., 2000).
El cultivo de células vegetales es una alternativa biotecnológica para producir compuestos químicos de interés. Un ejemplo representativo es en la producción de placlitaxel, compuesto con actividad anticancerígena, ampliamente demandado para usos clínicos y que se obtiene de cultivos celulares de especies de Taxus (Cragg et al., 1993). Diversas metodologías han sido desarrolladas para su obtención, pero es aún escasa su implementación en procesos industriales, siendo el almacenamiento intracelular de estos compuestos una de las principales limitantes para la producción industrial de compuestos generados en células vegetales. La acumulación de pigmentos inhibe la tasa de síntesis en el interior celular. Esto hace necesario el rompimiento celular, aumentando las operaciones de proceso e incrementando los costos, a la vez que imposibilita la reutilización de la biomasa celular (Zhang et al., 2002; Wu y Lin, 2003).
Para permitir la liberación de las betacianinas (BC) y facilitar la extracción de éstas en cultivo se han planteado estrategias alternas a los procesos tradicionales de extracción, como es el caso de la permeabilización. Este proceso implica la formación de poros o microcanales en la membrana plasmática, permitiendo la liberación de los metabolitos secundarios intracelulares al medio de cultivo. La permeabilización facilita tanto la recuperación como la purificación del producto, para aprovechar y favorecer la biosíntesis en las células, dando como resultado un incremento en la eficiencia del bioproceso (Zhang et al., 2002).
La permeabilización puede ser llevada a cabo mediante procedimientos físicos como la electroporación o la ultrasonicación. La primera ha probado favorecer la liberación de berberina y betacianinas en Thalictrum rugosum y Chenopodium rubrum, respectivamente, mientras que la segunda se ha utilizado en cultivos de Taxus chinensis con resultado positivo en la producción de taxol (Wu y Lin, 2003). Sin embargo, la permeabilización física presenta desventajas, como el hecho que la electroporación involucra intensidades de corriente altas que podrían dañar las membranas celulares y reducir la viabilidad de los cultivos. Otra forma es la permeabilización química utilizando sustancias como los detergentes, de tal manera que se formen poros temporales en la membrana, con la ventaja de que es posible la regeneración de ésta, por lo que las células se conservarán viables para continuar realizando los procesos metabólicos correspondientes a crecimiento y biosíntesis (Thimmaraju et al., 2003). Algunos estudios realizados con fines de observar la incorporación de detergentes no-iónicos a membranas de liposomas (monocapa y multicapa) y vesículas de retículo sarcoplásmico, indicaron que estos detergentes se incorporaron a la membrana con movimientos lentos (flip-flop) similar a lo que ocurre con los fosfolípidos (Le Maire et al., 1987).
La permeabilización química con sustancias como el dimetilsulfóxido, glicerol o tritón ha sido aplicada en cultivos in vitro de distinto tipo, tanto de células no-diferenciadas, como órganos e incluso plantas completas. Un agente químico permeabilizante (AQP) es el Tritón X-100® (TX-100®), un detergente no iónico ampliamente utilizado para desnaturalizar membranas y para permeabilizar cultivos celulares de Catharanthus roseus (alcaloides), Thalictrum rugosum (berberina) y Chenopodium rubrum (betanina; Brodelius, 1988). En dicho estudio se observó que tanto T. rugosum como C. rubrum perdieron la capacidad de continuar creciendo y de producir los compuestos de interés. Por el contrario, las células de C. roseus liberaron el 50% de los alcaloides después del tratamiento con el AQP y crecieron nuevamente al ser subcultivadas en medio fresco. Estos resultados muestran que la susceptibilidad a la permeabilización depende de la especie vegetal y la línea celular.
El Tween 20 es otro detergente útil para permeabilizar células vegetales. Fue aplicado a plantas de Datura inoxia Mill. en niveles de 1-5% (v/v), observándose que con 5% se liberaron 40mg·l-1 de los alcaloides hiosciamina y escopolamina, derivados del tropano. Cabe destacar que el rendimiento total fue siete veces mayor al del testigo (8mg·l-1; Gontier et al., 2002). Thimmaraju et al. (2003) observaron que raíces transformadas de Beta vulgaris fueron permeabilizadas con Tween 80 (0,15% v/v) liberando 54% de betalaínas y sin afectar la viabilidad del cultivo.
El principal reto a vencer cuando se establece un protocolo de permeabilización es evitar la disminución o incluso pérdida de la viabilidad de las células permeabilizadas y su capacidad de producir el compuesto de interés (Dörnenburg y Knorr, 1997; Trejo-Tapia et al., 2007). En respuesta a la permeabilización química se pueden presentar cambios significativos e irreversibles en la membrana celular tales como desprendimiento de proteínas y fosfolípidos (Felix, 1982), desnaturalización (Dörnenburg y Knorr, 1992; Park y Martínez, 1992), destrucción de la compartamentalización celular, o liberación de componentes tóxicos y enzimas hidrolíticas como las proteasas que actúan a nivel de proteínas constitutivas de la membrana plasmática.
Recientemente (Trejo-Tapia et al., 2007) fue reportada la utilización de TX-100® para permeabilizar cultivos en suspensión de B. vulgaris. Se observó que las células murieron en su totalidad, después de aplicar 0,9mM del agente por 15min, mientras que con 0,7mM la viabilidad se redujo en un 70%. Los resultados sugirieron que el contacto con el AQP por tiempos mayores tenía un efecto letal para las células. El objetivo del presente estudio fue el de establecer un protocolo para permeabilizar células de B. vulgaris mediante un método químico que no afectara la viabilidad y la producción eficiente de betacianinas.
Materiales y Métodos
Material biológico y medio de cultivo
Se utilizaron cultivos celulares en suspensión de Beta vulgaris L. var. "Crosby Egyptian" (línea celular fenotipo rojo púrpura) crecidos en matraces Erlenmeyer de 500ml (Ontiveros, 1994) con 100ml de medio basal B5 (Gamborg et al., 1968) suplementado con 0,01mg·l-1 de ácido 2,4-diclorofenoxiacético y 0,1mg·l-1 de cinetina. El pH se ajustó a 5,5 antes de la esterilización. Los cultivos fueron incubados a 25 ±2oC, fotoperíodo de 16h de luz (36µmol·m-2·s-1) y agitación orbital (100min-1) constantes.
Determinación de betacianinas y crecimiento celular
Durante el transcurso de la cinética de recrecimiento para cultivos de células permeabilizadas y no permeabilizadas, se tomaron fotomicrografías (4') con un microscopio Eclipse 80i (Nikon, Japón) y una cámara digital 3CCD (MTI, Michigan, EEUU) en campo claro. Las imágenes fueron grabadas en formato JPEG con 620-480 pixeles. Se obtuvieron 10 imágenes para cada tiempo de la cinética. En cada imagen se aisló un agregado celular, tomándolo como un objeto y eliminando el resto de la imagen. Este procedimiento fue realizado con el programa Corel Photo Paint V.11.
Los objetos fueron analizados como color RGB (combinación de rojo, verde y azul) y el color característico de las betacianinas fue evaluado como Rv= R - G, donde, G tiene un valor menor al 10% respecto al componente R (Trejo-Tapia et al., 2007). El contenido de betacianinas se calculó usando la relación [BC]= 23,60Rv – 178,67 proporcionada por Trejo-Tapia et al. (2007), donde: [BC] es la concentración de betacianinas en mg·l-1.
Selección del AQP
Se utilizaron tubos de ensaye de 50ml con 30ml de medio B5 a los que se añadieron 10g de células (en base húmeda) de B. vulgaris de 6 días de iniciados los cultivos. En ensayos separados se añadieron los detergentes Tween 20, 40, 80, y TX-100® (Sigma-Aldrich) en una concentración final de 0,9mM. Los tubos con las células y el detergente se agitaron con un vortex (Thermolyne M37615), se incubaron a 25 ±2oC durante 24h y se determinó la cantidad de BC liberadas al medio de cultivo.
Selección de la concentración del AQP y del tiempo de contacto
Se utilizaron matraces Erlenmeyer de 50ml con 10ml de medio de cultivo a los que se añadió 1g de células (base húmeda) de 6 días de iniciados los cultivos. Se evaluó el efecto del AQP (seleccionado en los experimentos previos) en concentraciones de 0,009; 0,09; 0,23; 0,51; 0,7; 0,78 y 0,9mM, durante 50min de tiempo de contacto. Los cultivos fueron incubados según lo descrito previamente y se determinó la cantidad de betacianinas liberadas al medio de cultivo por análisis de imágenes.
Pruebas de recrecimiento de los cultivos permeabilizados
Tratamiento post-permeabilización. Una vez seleccionado el AQP, la concentración y tiempo de contacto, se realizaron pruebas de recrecimiento. Las células fueron permeabilizadas bajo las condiciones que promovieron la mayor liberación de pigmentos. Posteriormente, para eliminar los restos de detergente, fueron lavadas con medio de cultivo fresco durante 30min en agitación y filtradas a través de un tamiz de acero inoxidable de luz de malla de 60µm y se transfirieron a un matraz de 500ml con 100ml de medio de cultivo fresco, únicamente para dar un enjuague (esta acción se realizó dos veces).
Recrecimiento de las células permeabilizadas. Las células permeabilizadas y lavadas se pusieron en matraces de 50ml con10ml de medio de cultivo. La concentración de BC y el crecimiento celular (en base húmeda) fueron evaluados después de 0, 4, 7, 11 y 15 días. Con estos datos se calcularon el tiempo de duplicación celular (td) y la velocidad específica de crecimiento (μ) y de producción de BC. Como control se utilizaron células que no fueron permeabilizadas.
Cálculo de parámetros cinéticos
El tiempo de duplicación celular (td) se calculó de acuerdo con la ecuación de Brown (1990)
![]() (1)
(1)
donde m: pendiente de la recta. La velocidad específica de crecimiento (m) se calculó a partir de td según la ecuación
 (2)
(2)
y la velocidad de producción de betacianinas (f; mg·l-1·día-1) se calculó como
f = 1/td (3)
Resultados y Discusión
Selección del AQP
Primero se determinó cuál de los cuatro detergentes considerados en el estudio promovía la mayor liberación de betacianinas (BC). Después de 24h de contacto, los detergentes Tween 20, 40 y 80, promovieron la liberación de solo el 5-9% de los pigmentos. Por el contrario, en plantas de Datura inoxia Mill fue reportado (Gontier et al., 2002) que el uso de Tween 20 favoreció la liberación de los compuestos de interés. Esto sugiere que la especie y la edad pudieron ser un factor importante en la respuesta a la permeabilización. Por el contrario, con TX-100® se liberaron 900mg·l-1 de BC, lo cual corresponde al 76,3% del total (1180mg·l-1; Figura 1).
De acuerdo con lo señalado por Le Maire et al. (2000) y Schreier et al. (2000), la permeabilización se basa en diversos factores, entre los cuales se pueden citar principalmente las características hidrofóbica-hidrofílica entre las moléculas del detergente y los fosfolípidos de la membrana, el número de regiones de la membrana plasmática que dichos detergentes pudiesen ocupar y la composición de la membrana en cuanto a fosfolípidos y proteínas. Los factores determinantes pueden variar para las diferentes especies vegetales (Meiners et al., 1991). Por ejemplo, si el número de regiones ocupadas por el detergente es baja o si hay un impedimento estérico debido al tamaño y/o composición de la molécula del detergente (Le Maire et al. 2000; Schreier et al., 2000) permitiendo quizás una mayor formación de poros o microcanales en la membrana plasmática (Zhang et al., 2002). Es posible que la diferencia en la respuesta observada entre los detergentes Tween y el TX-100® se deba a las diferencias en su estructura química. Si bien ambos son no iónicos, los detergentes Tween presentan mayor número de centros polares que el TX-100®, los cuales podrían formar puentes de hidrógeno con el agua e impedir que la molécula del Tween penetre en la bicapa de fosfolípidos. Lo anterior coincide con lo reportado por Le Maire et al. (1987) quien indica que algunos detergentes no iónicos se incorporan en la bicapa de fosfolípidos de manera lenta con movimientos flip-flop similar a como lo hacen los fosfolípidos en las membranas plasmáticas.
Selección de la concentración del AQP y tiempo de contacto
Con base en los resultados anteriores, se seleccionó el TX-100® para continuar el trabajo y en la siguiente etapa se evaluó el efecto de su concentración y del tiempo de contacto sobre la liberación de los pigmentos. Al aplicar 0,009-0,51mM de TX-100® a las células de B. vulgaris no se liberó BC (datos no mostrados). Pero al aumentar la concentración del AQP, a 0,7-0,9mM se observó la liberación inmediata de los pigmentos, alcanzándose el máximo a los 15min (Figura 2). Al aplicar 0,7 y 0,78mM de TX-100® se liberó 59 y 90% del total de BC que contenían las células (1478mg·l-1), respectivamente. Estas proporciones son mayores a las obtenidas mediante métodos físicos para T. chinensis, donde la aplicación de 2min de ultrasonicación favoreció de 1,5 a 1,8 veces el incremento de taxol (Wu y Lin, 2003). Con 0,9mM del AQP, la absorbancia del medio de cultivo fue 27% mayor respecto al control. Es probable que bajo esta condición de permeabilización, se liberen además de las BC, otras sustancias celulares como algunos polifenoles que absorben a una longitud de onda cercana a 540 nm (Kujala et al., 2001).
Bajo las mismas condiciones de permeabilización se determinó que la viabilidad de las células permeabilizadas con 0,78 y 0,9mM de TX-100® durante 15min disminuyó drásticamente hasta el 30% mientras que con 0,7mM se mantuvo en 70%. Este dato, condujo a la selección de 0,7mM de TX-100® para las pruebas de recrecimiento.
Pruebas de re-crecimiento
Con base en los resultados descritos y con el objeto de evitar la pérdida de viabilidad de las células para las pruebas de recrecimiento, se seleccionó la concentración de 0,7mM de TX-100®, la cual mantuvo la viabilidad entre 60 y 70 %. Tales valores, son similares a los reportados por Miranda (2003) y por Trejo-Tapia et al. (2007). Se ensayaron dos tiempos de contacto, 10 y 15minutos. Los resultados mostraron que las células liberaron 40 y 60% de BC a los 10 y 15min, respectivamente.
En la figura 3a se muestra el recrecimiento de las células permeabilizadas con 0,7mM de TX-100® tras 10 y 15min de contacto. Se observa que en las células permeabilizadas tras 15min de contacto no hubo crecimiento y no se registró permeabilización de pigmentos, por lo cual posiblemente se afectó en forma negativa la biosíntesis (Figura 3a-b). De acuerdo a lo reportado por Felix (1982), en respuesta a la permeabilización química se pudieron presentar cambios significativos e irreversibles en la membrana celular por desprendimiento de proteínas y fosfolípidos, así como por desnaturalización (Dörnenburg y Knorr, 1992; Park y Martínez, 1992) y destrucción de la compartamentalización celular. De hecho, las células se observaron oxidadas o necróticas, producto de la degradación de las BC o p-difenoles. Mientras que con el control, se observó un perfil de crecimiento de biomasa (Figura 3a). Las células sin permeabilizar (control) no presentaron fase lag, su mayor crecimiento se observó entre 4-11 días con una velocidad específica de crecimiento (µ) de 0,147 días-1 y una productividad de biomasa máxima de 26g·pf·l-1·día-1 al día 15 (Tabla I). Por su parte, el cultivo permeabilizado presentó dos fases de crecimiento: 1) 0-11 días con una µ= 0,061 días-1 y 2) 11-18 días con una µ= 0,128 días-1. En este caso, la productividad máxima de biomasa fue de 18g·pf·l-1·día-1 al día 18.
Estos datos sugieren que el tratamiento permeabilizante tuvo un efecto de disminución de la velocidad de crecimiento en comparación al control. Es probable que solo una fracción de la población celular haya sido tolerante a la permeabilización, lo cual coincide con lo observado previamente para otras especies como C. rubrum, C. roseus y T. rugosum (Brodelius, 1988). El retraso en el crecimiento de las células permeabilizadas en comparación al control pudiera atribuirse a un proceso de adaptación y reparación de la membrana (Felix, 1982).
En relación con los pigmentos, se observó que el cultivo control presentó la máxima concentración de BC (4000mg·l-1) a los 11 días, la cual permaneció constante hasta el final del experimento (Figura 3b); la productividad máxima fue de 354mg·l-1·día-1 al día 11, con una velocidad específica de producción (f) de 241 días-1 (Tabla I). En contraste, el perfil de producción de los pigmentos de las células permeabilizadas fue diferente. Durante los primeros 10 días la concentración de BC permaneció constante y no fue sino hasta el día 11 cuando se observó un incremento en la cantidad de BC, lo cual sugiere que las células comenzaron a sintetizar betacianinas nuevamente. La concentración máxima se obtuvo al día 18, cuando, alcanzaron un 93% de lo producido por el control, con una velocidad de producción similar al control (Tabla I).
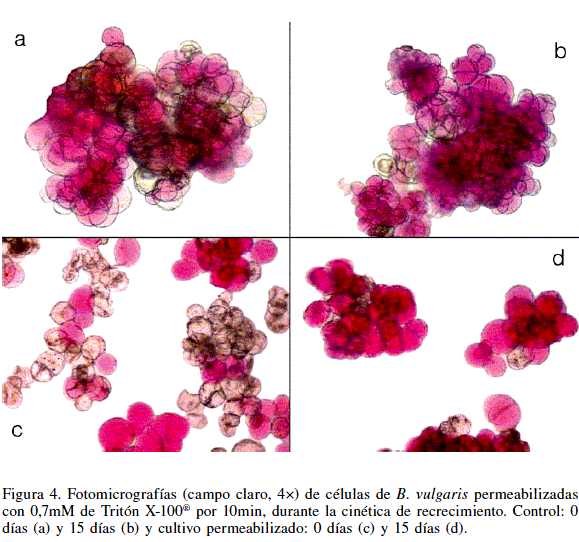
En la Figura 4 se presentan fotomicrografías representativas de las células de B. vulgaris no permeabilizadas al inicio (Figura 4a) y en el día 15 (Figura 4b) de la cinética de recrecimiento. Por el contrario, en el cultivo permeabilizado los cambios son claros; al inicio de la cinética una alta proporción de las células se observaron incoloras (Figura 4c) mientras que en el día 15 ya presentaron betacianinas (Figura 4d). Estos resultados confirman la capacidad de las células de B. vulgaris permeabilizadas con TX-100® para producir pigmentos nuevamente.
Balance de masa
Con el objetivo de mostrar la probable ventaja que representa el proceso de permeabilización se realizó un balance de masa que se presenta en la Figura 5. En este esquema se comparan ambos sistemas, el proceso sin permeabilización (SP) y el proceso sometido a permeabilización (CP).
Proceso SP. Éste consistió en suspender las células, con 6 días de crecimiento, en medio líquido y dejarlas crecer. De acuerdo a los resultados de las cinéticas de crecimiento y producción (Figura 3) a los 11 días se obtuvo tanto el máximo crecimiento celular, como la mayor cantidad de BC; es decir, a los 21 días acumulados (6 días de cultivo del inóculo más 15 días para llegar a su máxima producción y crecimiento). Por lo tanto, se tendría una cantidad de pigmentos sintetizados [BC] correspondiente al nivel máximo de la cinética (38,7mg y productividad es de 1,84mg·día-1).
Si de manera ideal este proceso permaneciera constante para cada ciclo de producción, la cantidad acumulada de BC se podría representar por
 (4)
(4)
donde n: número de ciclos que se llevan a cabo.
En dos ciclos se obtendrían 77,4mg de BC, en tres ciclos 116,1 y así sucesivamente. Sin embargo, la productividad permanecería constante (es decir, 38,7/21 días= 1,84mg·día-1; 77,4/42= 1,84; etc).
Proceso CP. Debido a que se necesitaba una cantidad de masa celular grande para realizar las pruebas de recrecimiento con sus respectivas repeticiones, se trabajó inicialmente con un volumen de 400ml de medio líquido B5 conteniendo 40g de células (en base fresca). Posteriormente, para la etapa de recrecimiento el volumen de cultivo fue de 10ml. Por lo tanto, para realizar el balance de masa correspondiente, se planteó en una base de cálculo de 10ml conteniendo 1g de biomasa y 20mg de BC (Figura 3a).
Al agregar el AQP, las células liberaron una cierta cantidad de betacianinas y posteriormente continuaron su crecimiento celular y biosíntesis de pigmentos. La Figura 3b, muestra los niveles de producción de BC que puede alcanzar un cultivo CP, en donde, a los 24 días se llegó a la máxima producción de Bc, de 35mg. La cantidad total sintetizada sería
[BC]s= [BC]e + [BC]f (5)
donde [BC]s: BC sintetizados, [BC]e: BC extraídas por adición de AQP, y [BC]f: BC al final de la cinética.
Es decir 13,5 + 35= 48,5mg de BC. Por lo tanto, la productividad en este caso es de 2,02mg·día-1, siendo casi un 10% mayor que en el proceso SP. Este valor muestra de manera muy somera la ventaja de la permeabilización. Otra ventaja de los cultivos CP es que puede emplearse como un proceso semicontinuo, puesto que es posible extraer BC sin detener el proceso de cultivo y quizás se puede prolongar el mismo, estableciendo más de un ciclo de permeabilización. En los cultivos SP se requiere detener la cinética (proceso por lote) para la extracción del metabolito.
Es también importante considerar que el almacenamiento intracelular de los metabolitos secundarios que se lleva a cabo en cultivos SP viene a ser una probable limitante para que se produzca una cantidad mayor de pigmentos, debido a dos factores principales: a) los productos acumulados, resultado de la biosíntesis, pueden ocasionar una inhibición de las enzimas involucradas en la vía metabólica de producción de BC (Wu y Lin, 2003) y b) el espacio disponible para almacenar estos compuestos, está limitado por el tamaño de la vacuola lo que representa un impedimento físico para incrementar la cantidad de metabolitos acumulados (Zhang et al., 2002).
Para el caso de la biomasa, el balance se realizó siguiendo el mismo procedimiento que el utilizado para BC. Los resultados mostraron que en los cultivos SP la cantidad de biomasa producida (3,65g) es ligeramente mayor a los cultivos CP (3,3g), y también, la productividad es mayor en un 23,5% (de 0,17g·día-1 en cultivo SP y 0,13g·día-1 en cultivo CP). Esta disminución se puede atribuir al posible daño celular causado por la adición del AQP y, además, como resultado de la permeabilización existe un periodo considerable (~7 días, Figura 3a) cuando aparentemente las células no crecen debido a que están sometidas a un proceso de reparación (Felix, 1982). Sin embargo, estos resultados muestran que la adición controlada de AQP no afecta considerablemente la capacidad de recrecimiento del cultivo ni la capacidad de biosíntesis de las betacianinas.
Conclusiones
Se estableció un protocolo de permeabilización de células de B. vulgaris con TX-100® que permite la reutilización del cultivo. Este protocolo consiste en el tratamiento con 0,7mM de Tritón X-100® durante 10min, seguido de lavado por 30min y dos enjuagues en medio de cultivo fresco. La cantidad de biomasa obtenida en cultivos CP es similar a la del cultivo SP. La permeabilización permite el recrecimiento del cultivo, aumentando un ciclo productivo de pigmentos, con lo cual aumenta la eficiencia final de producción.
Agradecimientos
Los autores agradecen el financiamiento de la Secretaría de Investigación y Posgrado del IPN (SIP20060394) y del Consejo Nacional de Ciencia y Tecnología (CONACYT 39562-Z), así como el apoyo de los sistemas EDI y COFAA-IPN.
REFERENCIAS
1. Brodelius P (1988) Permeabilization of plant cells for release of intracellularly stored products: viability studies. Appl. Microbiol. Biotechnol. 27: 561-566. [ Links ]
2. Brown JT (1990). The initiation and maintenance of callus cultures. En Pollard JW, Walker JM (Eds.) Plant Cell and Tissue Culture. Humana Press. Totowa, NJ, EEUU. 57-63. [ Links ]
3. Cragg MG, Schepartz AS, Suffness M, Grever RM (1993) The taxol supply crisis: New NCl policies for handling the large-scale production of novel natural product anticancer and anti-HIV agents. J. Nat. Prod. 56: 1657-1668. [ Links ]
4. Dörnenburg H, Knorr D (1992) Release of intracellularly stored anthraquinones by enzymatic permeabilization of viable plant cells. Proc. Biochem. 27: 161-166. [ Links ]
5. Dörnenburg H, Knorr D (1997) Challenges and opportunities for metabolite production from plant cell and tissue cultures. Food Technol. 51: 47-54. [ Links ]
6. Delgado-Vargas F, Jiménez-Aparicio AR, Paredes-López O (2000) Natural pigments: Carotenoids, anthocyanins and betalains - characteristics, biosynthesis, processing, and stability. CRC Crit. Rev. Food Sci. Nut. 40: 173-289. [ Links ]
7. Felix H. (1982) Permeabilized cells. Anal. Biochem. 120: 211-234. [ Links ]
8. Gamborg OL, Miller RA, Ojima K (1968) Nutrient requirement of suspension cultures of soybean root cells. Exp. Cell Res. 50: 151-158. [ Links ]
9. Gontier E, Clément A, Trant TG, Liévre A, Guckert A, Bourgaud F (2002) Hydroponic combined with natural or forced root permeabilization: a promising technique for plant secondary metabolite production. Plant Sci. 163: 723-732. [ Links ]
10. Kujala T, Loponen J, Pihlaja K (2001) Betalains and phenolics in red beetroot (Beta vulgaris) peel extracts: extraction and characterization. Z. Naturforsch. 56c: 343-348. [ Links ]
11. Le Maire M, Jesper V, Moller JV (1987) Binding of a nonionic detergent to membrane: Flip-Flop rate and location on the bilayer. Biochemistry 26: 4803-4810. [ Links ]
12. Le Maire M, Champeil P, Moller JV (2000) Interaction of membrane proteins and lipids with solubilizing detergents. Biochim. Acta 1508: 86-111. [ Links ]
13. Meiners S, Gharyal PK, Schindler M (1991) Permeabilization of the plasmalemma and wall of soybean root cells to macromolecules. Planta 184: 443-447. [ Links ]
14. Miranda HL (2003) Análisis de Imágenes para la Medición de Viabilidad y Morfología de Cultivos de B. vulgaris y Chinchona robusta. Tesis. IPN. Yautepec, Mor, México. 94 pp. [ Links ]
15. Ontiveros JA (1994) Aislamiento de Líneas Celulares de Beta vulgaris Productoras de Betalaínas. Tesis. Universidad Nacional Autónoma de México. 100 pp. [ Links ]
16. Park Ch-H, Martínez C (1992) Enhanced release of rosmarinic acid from Coleus blumei permeabilized by dimethyl sulfoxide (DMSO) while preserving cell viability and growth. Biotechnol. Bioeng. 40: 459-464. [ Links ]
17. Schreier S, Malheiros SVP, De Paula E. (2000) Surface active drugs: self-association and interaction with membranes and surfactants. Physicochemical and biological aspects. Biochim. Biophys. Acta 1508: 210-234. [ Links ]
18. Strack D, Vogt T, Schliemann W (2003) Recent advances in betalain research. Phytochemistry 62: 247-269. [ Links ]
19. Thimmaraju R, Bhagyalaksmi N, Narayan MS, Ravishankar GA (2003) Food-Grade chemical and biological agents permeabilized red beet hairy roots, assisting the release of betalains. Biotechnol. Progr. 19: 1274-1282. [ Links ]
20. Trejo-Tapia G, Cuevas-Celis J, Salcedo-Morales G, Trejo-Espino JL, Arenas-Ocampo ML, Jiménez-Aparicio A (2007) Beta vulgaris L. suspension cultures permeabilized with triton X-100 retain cell viability and betacyanines production ability: A digital image analysis study. Biotechnol. Progr. 23: 259-363. [ Links ]
21. Wu J, Lin L (2003) Enhancement of taxol production and release in Taxus chinensis cell cultures by ultrasound, methyl jasmonate and in situ solvent extraction. Appl. Microbiol. Biotechnol. 62: 151-155. [ Links ]
22. Zhang W, Curtin Ch, Franco Ch (2002) Towards manipulation of post-biosynthetic events in secondary metabolism of plant cell cultures. Enz. Microbiol. Technol. 30: 688-696. [ Links ]












 uBio
uBio