Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Agronomía
versión impresa ISSN 0378-7818
Rev. Fac. Agron. v.22 n.4 Caracas oct. 2005
Efecto de extractos vegetales y fungicidas sintéticos sobre el crecimiento micelial in vitro de Sclerotium rolfsii y Thielaviopsis basicola
D. Alcalá de Marcano1, N. Vargas2 y A. Pire1
1Instituto Nacional de Investigaciones Agrícolas (INIA), INIA- Lara. Email: dalcala@inia.gov.ve
2Universidad Central de Venezuela. Facultad de Agronomía.
Resumen
Se probó el efecto antifúngico de extractos de tártago, Ricinus communis L.; albahaca, Ocimum basilicum L.; mastuerzo, Lepidium virginicum L.; ajo, Allium sativum L.; nim, Azadirachta indica A. Juss y los fungicidas benomil (Benlate) e iprodione (Rovral) sobre el crecimiento micelial in vitro de Sclerotium rolfsii y Thielaviopsis basicola. Hipoclorito de sodio al 3% y agua destilada estéril fueron utilizados para la desinfección y el lavado de las partes vegetales. Para la obtención de los extractos acuosos, los materiales fueron macerados, el extracto filtrado con papel Whatman N° 1 y luego esterilizado con filtros Milipore de 0,45 mµ. Todos los extractos y fungicidas probados manifestaron algún tipo de actividad inhibitoria sobre el crecimiento micelial de Sclerotium rolfsii y Thielaviopsis basicola, en medio papa dextrosa (PD), resultando en el caso del ajo, una inhibición total del crecimiento hasta los 7 días. Benomil y ajo redujeron el crecimiento de Thielaviopsis basicola virtualmente a cero durante 21 días. Diferencias significativas fueron encontradas con iprodione (79%), benomil (54,1%) y tártago (8,3%), en relación al testigo. El número de esclerocios fue menor en los tratamientos ajo, nim y benomil en comparación con el testigo (27,6; 49,3; 68,3 esclerocios vs 143,5 esclerocios ). Según estos resultados el ajo podría considerarse como una alternativa a ser incorporada en una estrategia de manejo de estos hongos.
Palabras clave: Extractos vegetales, fungicidas, crecimiento micelial, Sclerotium rolfsii, Thielaviopsis basicola.
Effect of vegetables extracts and synthetics fungicides on the micelial growth of in vitro Sclerotium rolfsii and Thielaviopsis basicola
Abstract
The antifungical effect of castor extracts Ricinus communis L.; sweet basil Ocimum basilicum L.; wild peppergrass Lepidium virginicum L.; garlic Allium sativum L.; neem Azadirachta indica A. Juss and fungicides benomyl (Benlate) and iprodione (Rovral) was proved on the mycelium growth in vitro of Sclerotium rolfsii and Thielaviopsis basicola. Sodium hypochlorite at 3% and distilled water were used to disinfect and to wash the vegetal parts. For the obtaining of juicy extracts, materials were macerated, the extract filtered with Whatman Nº1 paper and then sterilized with Millipore filters of 0.45 mµ. All tested extracts and fungicides showed some inhibit activity on the mycelial growth of Sclerotium rolfsii and Thielaviopsis basicola, in a papa dextrose (PD) mean, resulting in garlic a total inhibition of grow until 7 days. Benomyl and garlic reduced the grow of Thielaviopsis basicola virtually to cero during 21 days. Significant differences were found with iprodione (79%), benomyl (54.1%) and castor (8.3%) in relation to the witness. The number of sclerotium was lower in treatments with garlic, neem and benomyl compare to the witness (27.6, 49.3, 68.3 sclerotium vs 143.5 sclerotium). According to these results garlic might be considered as an alternative to be used in a handle strategy of these fungi.
Key words: Vegetal extracts, fungicides, mycelial growth, Sclerotium rolfsii, Thielaviopsis basicola
Recibido el 2-5-2002 Aceptado 12-5-2004
Introducción
En los últimos años, la sociedad mundial ha priorizado los aspectos ambientales, conduciendo muchas investigaciones hacia el descubrimiento de nuevas materias bioactivas que puedan ser empleadas en el manejo integrado de plagas, con menos efectos negativos al ambiente por tratarse de productos naturales (4, 5, 15).
La producción de sustancias bioactivas o metabolitos secundarios por las plantas ocurre a través de diferentes vías metabólicas, generando gran número de compuestos, muchos de los cuales sólo son detectados en un determinado grupo de plantas y en concentraciones variables. La cantidad y composición de esta clase de compuestos es muy variable y depende del tipo de tejido, edad de la planta, su habitat y el tipo de suelo (7). Muchos de estos compuestos son producidos y almacenados en tejidos jóvenes, particularmente en hojas o tejidos productivos como flores y semillas. (Citado por Costa Mauro J. N. et al. 2001) (6). Numerosos estudios han constatado que muchos de estos compuestos afectan importantes funciones en los vegetales, ya que pueden actuar en la preservación de la integridad de las plantas, contra el ataque de enemigos, como nematodos, bacterias, hongos, insectos y herbívoros o en la atracción de polinizadores y dispersores de semillas (3, 7).
Los cultivos se ven constantemente amenazados por las enfermedades, originadas por agentes infecciosos que atacan a los diferentes órganos de las plantas: raíz, tallo, hojas, inflorescencias y frutos, donde la severidad del daño depende de la susceptibilidad de éstos y las condiciones ambientales favorables que permiten el rápido desarrollo de organismos fitopatógenos.
Muchos de los hongos que ocasionan infecciones en las plantas son parásitos facultativos que viven en el suelo y algunas de las enfermedades más destructivas son causadas por ellos. Las raíces de las plantas son las más atacadas, sobre todo en suelos muy húmedos, pudiendo ser también afectadas hojas, tallos, frutos, semillas, las cortezas y madera central de árboles (1).
En su intento para reducir el daño que estos organismos le ocasionan a las cosechas, el hombre ha provocado desequilibrio, desde el punto de vista ecológico, debido a que en su lucha por controlarlos, también le causa daños a la fauna benéfica reguladora y, desde el punto de vista ambiental, genera contaminación del agua, suelo y de los productos que son consumidos por la población (7, 13, 21).
Entre los patógenos que causan estas afecciones están los hongos de los géneros Sclerotium y Thielaviopsis, capaces de originar pérdidas en la producción debido a los daños que causan a diferentes cultivos (1, 12).
S. rolfsii puede ocasionar marchitez y pudrición de raíces en una amplia gama de hospedantes. El hongo puede sobrevivir, en forma de esclerocios, tanto en el suelo como en restos de cultivos por largo período, siendo ésta la principal fuente de inóculo para el cultivo siguiente (11). La pudrición negra de la raíz ocasionada por T. basicola, está muy distribuida, afectando hortalizas, diversos cultivos anuales, frutales y ornamentales, ocasionando pérdidas importantes en condiciones de temperatura frescas y alta humedad en el suelo (1).
Los diversos métodos de control disponibles, especialmente el control químico, presentan problemas en cuanto a eficiencia, costo e impacto negativo al ambiente (12).
En virtud de esta situación se ha trabajado en la búsqueda de otras alternativas para el control de estos hongos en el campo, como el control biológico, cuya principal propiedad es la estabilidad ecológica. Este medio ofrece grandes perspectivas para minimizar el efecto de las enfermedades en la producción agrícola, sin agudizar los problemas de contaminación ambiental que amenazan el balance ecológico en el presente y en el futuro inmediato. (4, 7, 22).
A nivel mundial, se han realizado varios trabajos que demuestran la acción antifungosa de algunos extractos vegetales tanto a nivel foliar como a nivel del suelo (2, 4, 5, 14, 16, 17, 19, 20, 22).
En la evaluación in vitro del efecto de extractos acuosos y del aceite de nim sobre Sclerotium rolfsii, Singh et al. (17) observaron que el crecimiento del hongo fue inhibido completamente cuando se usó el aceite de nim en concentraciones de 1.500, 2.000, y 5.000 ppm. Cuando se usó el extracto de pulpa del fruto, la concentración requerida para inhibir el crecimiento fue de 12.000 ppm y en el caso de extractos de hojas, la inhibición del crecimiento del hongo, de manera completa, se logró con la utilización de 10.000 ppm).
Delp y Klopping (8) reportan el uso de benomil en el control de S. rolfsii, pero con efectos muy pobres. Por otro lado Edginton et al. (9) señalan al benomil como altamente tóxico para T. basicola, in vitro, con un LDs de 0,2 ppm.
A pesar de existir en Venezuela una gran cantidad de especies de plantas, los estudios orientados a detectar y entender los efectos de sustancias, producto del metabolismo secundario, sobre los hongos, son escasos. En tal sentido, el presente trabajo tuvo como objetivo evaluar, in vitro, el efecto de diferentes extractos vegetales y productos químicos sobre el crecimiento micelial de los hongos Sclerotium rolfsii y Thielaviopsis basicola.
Materiales y métodos
Preparación de los extractos
Muestras de hojas frescas de mastuerzo, Lepidium virginicum L. y de albahaca, Ocimum basilicum L.; semillas maceradas de nim, Azadirachta índica A. Juss. y de tártago Ricinus communis L. y bulbos de ajo, Allium sativum L. descascarados, previamente desinfectadas externamente con hipoclorito de sodio al 3% y lavadas con agua destilada estéril, fueron maceradas en un mortero con 100 ml de agua destilada estéril. El extracto obtenido fue filtrado con filtro Whatman N° 1 y esterilizado por filtración, con filtros Millipore de 0,45 m m.
Los fungicidas sintéticos fueron disueltos en agua destilada estéril, utilizando dosis de 2,5 g de benomil P.C y 3,0 g de iprodione P.C., por litro de agua.
Obtención de los patógenos
Con la finalidad de obtener el material necesario para la preparación de los tratamientos, se utilizaron cepas de S. rolfsii y T. basicola de la colección de fitopatógenos del CIAE
Lara, que crecieron por 15 días en placas petri con agar-papa-dextrosa (APD) en condiciones de laboratorio (22°C- 29°C).
Tratamientos
A partir de las placas previamente preparadas, se seleccionaron, en el caso de S. rolfsii, esclerocios maduros, colocándose 3 esclerocios en cada tubo que contenía 10 ml de medio líquido papa-dextrosa (PD) vertido con un dispensador de medios y 5 ml de cada extracto o producto químico, agregado con la ayuda de una pipeta. Para el hongo T. basícola, a cada tubo que contenía 10 ml del medio PD y 5 ml de cada extracto o producto químico, vertidos como se mencionó, se agregó 1ml de una suspensión acuosa de 4-5 x 105 conidios/ml. Los tratamientos evaluados fueron: 1) papa dextrosa (PD) + agua destilada estéril (testigo); 2) papa dextrosa (PD) + extracto acuoso de hojas de albahaca (30 g/l); 3) papa dextrosa (PD) + extracto acuoso de semillas de nim (30 g/l); 4) papa dextrosa (PD) + extracto acuoso de bulbos de ajo (5 g/l); 5) papa dextrosa (PD) + extracto acuoso de hojas de mastuerzo (30 g/l); 6) papa dextrosa (PD) + extracto acuoso de semillas de tártago (30 g/l); 7) papa dextrosa (PD) + benomil (2,5 g/l) y 8) papa dextrosa (PD) + iprodione (3,0 g/l); disponiéndose de tres tubos de ensayo por tratamiento, con tres repeticiones, para un total de 72 tubos.
De acuerdo a la metodología propuesta por Singh et al. (17), la determinación del crecimiento del hongo se hizo a los 7, 14 y 21 días de sembrado en el medio PD. Para ello se filtraron los tratamientos con filtros Whatman N° 1, se dejó secar el micelio del hongo por 24 h a 70°C en estufa y posteriormente fue pesado. También se contó, en el caso de S. rolfsii, el número de estructuras de resistencia o esclerocios formados en cada tubo, en los diferentes tratamientos y para T. bassicola, se hizo contaje de germinación de los conidios, en cada tratamiento, con ayuda de la cámara de Neubawer.
Se utilizó un arreglo completamente aleatorizado y para su análisis se hizo la transformación de datos por la fórmula Ö1 + x y la comparación de medias según Newman Keuls al 5%.
Resultados y discusión
En la figura 1 se muestra el crecimiento del hongo Sclerotium rolfsii en el medio papa dextrosa (PD), con los extractos naturales y los fungicidas sintéticos.
De acuerdo con estos resultados se observa que a los 7 días todos los extractos y fungicidas inhibieron o retrasaron el crecimiento del hongo en comparación con el tratamiento testigo; resultando en el caso del ajo una total inhibición del crecimiento del mismo durante ese período.

Figura 1. Crecimiento micelial (g) del hongo Sclerotium rolfsii en medio Papa Dextrosa (PD) con extractos vegetales y fungicidas sintéticos.
Estos resultados concuerdan con lo obtenido por otros autores, quienes han señalado el efecto inhibidor del extracto de ajo sobre el crecimiento de diferentes hongos como: Rhizoctonia solani, Alternaria spp y Curvularia spp, cuando utilizaron concentraciones variables entre 8 y 50 g/l (2, 10).
El efecto inhibitorio de los extractos vegetales y de los fungicidas, sobre el crecimiento de S. rolfsii fue variable en el tiempo. Cuando se comparan los efectos de los extractos vegetales que causaron una mayor inhibición del crecimiento de S. rolfsii. (mastuerzo, nim, ajo) con relación a los fungicidas, se puede observar que, estos últimos, sólo fueron superados al inicio del experimento (7 días), reduciéndose a partir de ese lapso, la capacidad inhibitoria de los extractos. Esto podría sugerir la necesidad de utilizar concentraciones mayores; a fin de prolongar su efecto (figura 1).
Es probable que el corto período de inhibición del crecimiento de S. rolfsii, en el caso del extracto de ajo, esté relacionado con la baja concentración utilizada (5 g/l) en comparación con concentraciones de 8, 10 y 50 g/l, utilizada en otros trabajos donde se ha evaluado este producto como fungitóxico (2, 10); no obstante, a los 14 días, cuando cesa este efecto inhibitorio sobre el crecimiento del hongo, se evidencia un crecimiento aún mayor que en el testigo. Por otro lado, en el caso del nim los resultados podrían estar relacionados con la concentración del aceite extraído de la semilla en la emulsión obtenida, como consecuencia del método de extracción utilizado, resultados más eficientes se han obtenido con el uso de aceite de mayor pureza y concentración utilizando un equipo Soxhlet para su obtención (17).
A los 21 días del experimento, se observó un menor crecimiento en los tratamientos iprodione, benomil y tártago, con una inhibición del mismo de 79,1%; 54,1% y 8,3%, respectivamente, sin embargo, el tártago, no mostró diferencias significativas con el testigo, ni con los tratamientos nim, mastuerzo y albahaca (figura 1).
De manera general, el efecto inhibitorio del crecimiento de S. rolfsii, por parte de los diferentes extractos vegetales y fungicidas sintéticos fue disminuyendo en el tiempo, observándose en el caso específico de estos últimos, un mayor efecto sobre la reducción del crecimiento por parte del iprodione con respecto al benomil, estos resultados no concuerdan con las observaciones de Delp y Klopping (8) quienes reportan un pobre efecto de Benomil sobre S. rolfsii (figura 1).
La información referida al promedio de esclerocios maduros a los 21 días del experimento, refleja un menor número de ellos en los tratamientos ajo, nim y benomil (27,67; 49,33 y 68,25 esclerocios, respectivamente) inferior al testigo (143,5) y significativamente inferior al tratamiento con tártago (157,0). Este aspecto es de mucha importancia, si se considera que éstas son las estructuras de resistencia del hongo que le permiten sobrevivir bajo condiciones adversas y que por lo tanto es necesario tomar en cuenta a la hora de dar recomendaciones para su manejo, especialmente si observamos que en todos los tratamientos se formaron esclerocios viables (figura 2).

Figura 2. Formación de esclerocios de Sclerotium rolfsii en medio papa-dextrosa (PD) con extractos vegetales y fungicidas sintéticos a los 21 días de incubación.
La figura 3 muestra el crecimiento del hongo Thielaviopsis basicola en el medio PD con diferentes tratamientos de extractos vegetales y el fungicida benomil. De acuerdo con estos resultados, hasta los 21 días, todos los tratamientos redujeron el crecimiento micelial del hongo, comparado con el testigo. Durante el mismo período, el crecimiento fue virtualmente cero para los tratamientos benomil y ajo, así mismo estos tratamientos provocaron la menor germinación de conidios del hongo (figura 4). Singh (1990) también observó efectos inhibitorios del ajo sobre la germinación de conidios de varias especies de Fusarium y de Colletotrichum, mientras que otros autores no encontraron efecto sobre la germinación de conidios de
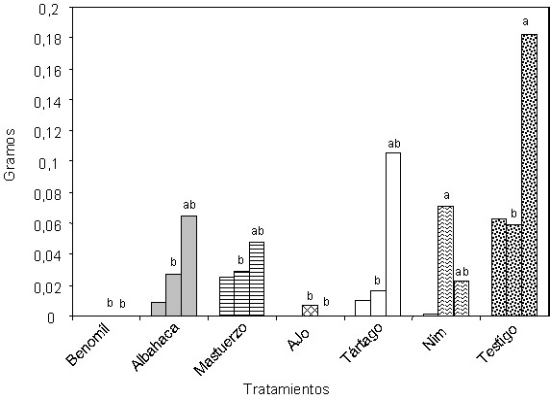
Figura 3. Crecimiento micelial (g) del hongo Thielaviopsis basicola en medio Papa Dextrosa (PD) con extractos vegetales y fungicidas sintéticos.

Figura 4. Germinación de conidos del hongo Thielaviopsis basicola en medio papa dextrosa (PD) con extractos vegetales y fungicidas sinteticos.
Curvularia sp y Alternaria sp (2,18).
En el caso de benomil, la inhibición del crecimiento de T. basicola fue casi total, resultados que concuerdan con los observados, in vitro, por Edginton y colaboradores (1970), quienes reportan al benomil como altamente tóxico para este hongo, en concentración de hasta 0,2 ppm (9) (figura 3). De manera general, los resultados obtenidos in vitro en este estudio, evidencian la presencia de diferentes sustancias fungitóxicas inhibidoras del crecimiento de S. rolfsii y T. basicola en las especies de plantas y partes de éstas utilizadas. Se requieren estudios adicionales con diversas concentraciones de estos productos, in vitro, así como la incorporación de otros, y la definición de una estrategia de aplicación adecuada a nivel de campo, considerando las características de la actuación de cada uno de estos hongos y las condiciones que favorecen el desarrollo de las enfermedades causadas por ellos.
Conclusiones
A los 21 días de sembrado en medio papa dextrosa (PD), se encontró reducción del crecimiento micelial de Sclerotium rolfsii con iprodione, benomil y extracto de Tártago.
El número de esclerocios formados, se redujo en los tratamientos con benomil y con los extractos de nim y ajo.
Todos los tratamientos redujeron el crecimiento micelial y la germinación de conidios de Thielaviopsis basicola.
Literatura citada
1. Agrios, G.N. 1985. Fitopatología. México, LIMUSA. Pág. 36-458. [ Links ]
2. Barros, S. T., N. T. De Oliveira y L. Maia. 1995. Efeito do extrato de alho (Allium sativum) sobre o crecimiento micelial e germinacao de conidios de Curvularia spp e Alternaria spp. Summa Phytopathologica. 21: 168-170. [ Links ]
3. Bennett, R.N. y R.M. Wallsgrove. 1994. Secondary metabolites in plant defense mechanisms. New Phytologist, Philadelphia, 127, (4), 617-633. [ Links ]
4. Bianchi, A., A. Zambonelli, A. Zechini D´Aulerio, y F. Bellesia. 1997. Ultrastructural studies of the effects of Allium sativum on phytopathogenic fungi in vitro. Plant. Dis. 81: 1241-1246. [ Links ]
5. BOWERS, J.H. y J.C.Locke. 2000. Effect of botanical extracts on the populations density of Fusarium oxysporum in soil and control of fusarium wilt in greenhouse. Plant. Dis. 84: 300-305. [ Links ]
6. Costa, M. J.N., V.P. Campos, D.F.Oliveira y L.H. Pfenning. 2001. Toxicidad de extratos vegetais e de estorcos a Meloidogyne incógnita. Summa. Phytopathologica. 27 (2): 245-250. [ Links ]
7. Cruz De Matos, O. 2000. Uso de sustancias naturais de origen vegetal com actividade biológico na proteccao das cultural agrícolas. Agronomía Lusitana. 48 (Suplemento 2) 1-44. [ Links ]
8. Delp, C.A. y H.L. Klopping. 1968. Performance attributes of a new fungicide and mite ovicide candidate. Plant. Dis. Reptr. 52: 95-99. [ Links ]
9. Edginton, L.V. K.L. Khew, y C.L. Barron. 1970. Fungi espectrum of benzimidazole compounds. Phytopathology 61: 42-44. [ Links ]
10. Gasparin, M.D.G., L.M. Morales, G. SchwanEstrada y J.R. Stangarlin. 1998. Efeito do oleo esencial e do extrato bruto de alho (Allium sativum) no crecimiento micelial de Rhizoctonia solani e Alternaria stenia. Summa Phytopathologica 24(1): 74. [ Links ]
11. Ghini, R. W. Bettiol y JR.P. Caldari. 1997. Solarizacao do solo para o controle de Screrotium rolfsii en feijoeiro. Summa Phytopathologica 23 (2): 143-145. [ Links ]
12. Hooker, W. (ed) 1980. Compendio de enfermedades de la papa. 1980. Trad. Por Teresa Ames de Icochea. Lima. Centro Internacional de la papa 166 p. [ Links ]
13. Luchini, L. C. 2000. Agroquímicos: comportamento no solo agua e planta. Summa Phytopatologica. 26 (1): 170-171. [ Links ]
14. Natarajan, N.R. y D. Lalithakumari. 1987. Antifungal activity of the leaf extract of Lawsonia ineranis on Dreslera orysae. Indian Phytopath. 40 (3): 390-395. [ Links ]
15. National Academy Press Research Council. 1992. Neem a tree for solving global problems. Washington. D.C. 141 p. [ Links ]
16. Sarvamangala, H.S, Covindaiah y R.K. Datta. 1993. Evaluation of plant extracts for the control of fungal diseases of mulberry. Indian Phytopath.46 (4): 398-401. [ Links ]
17. Singh, U.P., H.B. Singh, y R.B. Singh. 1980. The fungicidal effect of neem (Azadirachta indica) extracts on some soil-borne pathogens of gram (Cicer arretinum). Micology 72: 1077-1084. [ Links ]
18. Singh, U.P, V.N. Pandey, K.G. Wagner, y K.P. Singh. 1990. Antifungal activity of ajoene, a constituent of garlic (Allium sativun L). Canad. J. Bat. 68:1354-1356 [ Links ]
19. Sobti, A.K., O.P. Sharma, y A.K. Brargava. 1995. A comparative study of fungicidal components and plant extracts against the pathogens of Arachis hipogea Indian phytopathology. 48 (2): 191-193. [ Links ]
20. Subrata, B., N.K. Biswasdas, S.M.H. Qadri y B. Saratchandra, B. 1995. Evaluating different plant extracts against the mayor deseases of mulberry. Indian Phytopath. 48 (3): 342-346. [ Links ]
21. Tomomassa, M. 1997. Aspectos toxicológicos e ambientais envol-vidos na aplicacao do productos fitosanitarios. Tecnología de aplicacao de productos fitosanitarios e suas implicacoes. Summa Phytopathologica. 23(1): 77-78. [ Links ]
22. Wilson, C,L. J.M. Solar, A. El Ghaouth y M.E. Wisniewski. 1997. Rapid evaluation of plant extracts and essential oils for antifungal activity against Botritis cinerea. Plant. Dis. 81: 204-210. [ Links ]













