Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Agronomía
versión impresa ISSN 0378-7818
Rev. Fac. Agron. v.25 n.2 Caracas jun. 2008
Formación in vitro del bulbo del ajo morado (Allium sativum L.)
In vitro formation of purple garlic (Allium sativum L.) bulb
H. Mujica1, M.E. Sanabria2, N. Mogollón2 y Y. Perozo
Autor de correspondencia e-mail: hmujicar@yahoo.com; mesanabria@ucla.edu.ve; norcam@intercable.net.ve
1Universidad Pedagógica Experimental "Libertador", Instituto Pedagógico de Barquisimeto; Departamento de Educación Técnica Agropecuaria.
2Universidad Centroccidental "Lisandro Alvarado"; Postgrados de Agronomía; Laboratorio de Microtecnia e Histopatología Vegetal y Laboratorio de Cultivo in vitro.
Resumen
Para estudiar la bulbificación in vitro del ajo morado (Allium sativum L.) se extrajeron ápices caulinares de los "dientes" del bulbo previamente grelados y desinfectados. Estos ápices se cultivaron en el medio de Murashige y Skoog con 2,0 mg.L-1 de 2 isopenteniladenina (2ip); 0,1 mg.L-1 de ácido naftalenoacético (ANA) y 30 g.L-1 de sacarosa. Los cultivos crecieron a 41,54 mmol.m-2 s-1 de luminosidad, fotoperíodo de 16 horas luz y 23 ±2ºC. Las vitroplantas regeneradas fueron seccionadas a 2 cm de longitud desde la corona de la planta, se eliminaron sus raíces y se cultivaron en un medio para inducir la bulbificación, constituido por los mismos componentes anteriores, excluyendo el ANA y aumentando la sacarosa a 90 g.L-1. Para los estudios histológicos se realizaron cinco muestreos de tres vitroplantas cada uno, entre los 0 y 28 días de cultivo. En la bulbificación in vitro se distinguieron dos etapas de desarrollo. La primera correspondió al estado morfogénico iniciado desde el día 0 hasta los 20 días de cultivo, y la segunda, al llenado y maduración del bulbo a partir del día 7 de la inducción a la bulbificación. El bulbo se desarrolló por organogénesis directa, siendo su estructura similar al de cebolla hasta los 21 días, para luego diferenciarse por la formación de los "dientes". Las raíces adventicias se originaron de los meristemos en una región cerca al ápice del tallo.
Palabras clave: cultivo in vitro, ajo morado, histología, bulbificación.
Abstract
With the purpose of studying the in vitro bulb formation of the purple garlic (Allium sativum L.) shoot tips of the "teeth" of the bulbs were extracted, sprouted, and disinfected. These shoot tips were cultivated in Murashige and Skoog medium with 2.0 mg.L-1 of isopenteniadenine (2ip); 0.1 mg.L-1 of naphthalene acetic acid (ANA) and 30 g.L-1 of sucrose. The cultures grew up at 41.54 mmol.m-2.s-1 luminosity, 16 hours of light, and 23 + 2ºC. The in vitro regenerated plants were cut off at 2 cm of length from the plant neck; their roots were cut off and cultivated in a bulb-formation medium, made up from similar components, but excluding the ANA and incrementing the sucrose to 90 g.L-1. For histological studies, five samplings of three in vitro plants each were conducted between the 0 to the 28 day of culture. In the in vitro bulb formation, two stages of development were observed. The first one corresponding to the morphological stage initiated from the 0 to the 20 day of culture, and the second one, to the filled and maturity begun on the 7 day of the bulb-formation induction. The bulb developed by direct organogenesis, presenting an onion-like structure until the 21 day, differentiating later on by its "teeth" formation. The adventitious roots originated from the meristems in a region near the apex of the stem.
Key words: in vitro culture, purple garlic, histology, bulb formation
Recibido el 10-6-2005 Aceptado el 1-11-2007
Introducción
El ajo (Allium sativum L.) es una planta herbácea constituida por un bulbo subterráneo, formado por "dientes" unidos en su base alrededor del tallo verdadero y recubiertos por catáfilos blancos o morados, cuya tonalidad varia según la variedad y la altura del sitio de siembra (Ramos, 1991). Las hojas son alargadas, planas y envainadoras; las flores de color rosado o verde y no producen semillas. El falso tallo es blando, liso y de hasta 40 cm de longitud, de donde nacen bulbillos aéreos. El sistema radical consta de numerosas raíces adventicias simples, delgadas y poco ramificadas que crecen superficiales en el suelo. Las especies de este género presentan el mismo patrón básico de crecimiento apical, tanto en la raíz como en el tallo y la frecuencia de ramificación del brote apical varía con la especie, el cultivar y las condiciones de crecimiento (Brewster, 1994).
Las diversas metodologías tradicionales utilizadas para los estudios histológicos, han contribuido significativamente en la comprensión de la formación de nuevos individuos propagados por cultivo in vitro, ya que permiten observar los cambios morfológicos y anatómicos que ocurren en el tejido experimental. Además, proveen ideas de los procesos celulares que permiten proponer hipótesis para futuras investigaciones (Yeung, 1999).
Los procesos morfogenéticos en los cuales se logra la propagación in vitro son variables y dependen principalmente de la relación auxina/citocinina (Him y Páez de Cásares, 1998). Considerando que el desarrollo de brotes in vitro tiene alguna variación epigenética, es conveniente realizar estudios histológicos para conocer el origen de los órganos regenerados y también observar los diferentes cambios anatómicos que ocurren durante la organogénesis (Valverde et al., 1992).
Ayabe y Sumi (1998) realizaron estudios histológicos de tallo de ajo y observaron que el desarrollo del brote estaba dividido en cuatro etapas: expansión de la zona rodeada por la parte basal de los primordios foliares, formación de las yemas axilares en forma de domo, diferenciación de la yema directamente de cada domo y el desarrollo del brote. Estos mismos autores señalaron que la formación celular interna y del domo fue similar a la del ápice caulinar.
Evaluaciones histológicos en explantes florales de tulipán (Tulipa gesneriana L.), demostraron que la formación de brotes adventicios se inició a partir de las primeras dos capas celulares subepidérmicas y un número de células del explante original contribuyó a la formación de los mismos (Wilmink et al., 1995).
Considerando lo anteriormente planteado, el objetivo de esta investigación consistió en identificar los cambios morfológicos e histológicos que ocurrieron durante la formación del bulbo de ajo morado (Allium sativum L.) desarrollado in vitro.
Materiales y métodos
Material vegetal
Se utilizaron bulbos de ajo tipo morado cosechados en estado de madurez, provenientes del caserío Volcancito, Municipio Crespo, Estado Lara, ubicado a 1500 msnm y con temperatura media anual de 20 a 25ºC. Dichos bulbos fueron disgregados en sus respectivos "dientes" y se mantuvieron bajo refrigeración (8 a 10ºC) durante 15 días para estimular el proceso de grelación.
Propagación in vitro
Después que los "dientes" alcanzaron la grelación, se les eliminó la túnica protectora externa, y posteriormente, se desinfectaron sumergiéndolos en una solución de Betadineâ (2%), Kasuminâ (20%) e Hipoclorito de sodio (i.a. 5,25%) al 20%, durante 20 minutos en cada uno. Después de cada desinfectante, los propágulos se enjuagaron tres veces con agua destilada estéril.
Bajo la cámara de flujo laminar (IAS-Burbankâ) y con la ayuda de un microscopio estereoscópico (Wild-MSAâ), los "dientes" de ajo desinfectados se seccionaron transversalmente en la mitad, a fin de exponer el ápice caulinar en crecimiento. Posteriormente se eliminaron las hojas envainadoras, extrayendo el domo meristemático con dos primordios foliares. El explante obtenido, de 2,0 mm de longitud aproximadamente, se colocó en una solución de Hipoclorito de sodio al 1% durante 5 minutos y luego se enjuagó tres veces con agua destilada estéril, antes de su cultivo en tubos de ensayo contentivos del medio nutritivo.
Para la obtención de las vitroplantas, el medio empleado estuvo constituido por las sales minerales de Murashige y Skoog (1962), suplementado con 2 isopenteniladenina (2ip) 2,0 mg.L-1; ácido naftalenacético (ANA) 0,1 mg.L-1; tiamina 0,1 mg.L-1; ácido nicotínico 0,5 mg.L-1; piridoxina 0,5 mg.L-1; inositol 100 mg.L-1, 30 g.L-1 de sacarosa y 8 g.L-1 de agar. Este medio se dispensó en tubos de ensayo (25 x 150 mm) en alícuotas de 20 mL por tubo, esterilizándolo en autoclave por 15 minutos a 121ºC y 15 lb.pul-2 de presión. Para el crecimiento y desarrollo de los explantes, los cultivos se colocaron en un cuarto de crecimiento a 41,54 mmol.m-2. s-1 de luminosidad, bajo un fotoperíodo de 16 h diarias y 23 ± 2°C, durante treinta días.
Bulbificación in vitro
Las vitroplantas obtenidas en la fase anterior fueron empleadas para inducir la bulbuficación in vitro. Al respecto, se seleccionaron aquellas que habían alcanzado un desarrollo adecuado (6 a 12 cm de longitud), y bajo la cámara de flujo laminar, los brotes fueron seccionados a 2 cm de longitud desde la corona de la planta y eliminadas sus raíces. Estos explantes se cultivaron en frascos de 250 mL contentivos de 20 mL del medio inductor de la bulbificación, previamente esterilizado en las mismas condiciones descritas para la micropropagación.
El medio para inducir la bulbificación in vitro estuvo constituido por los mismos componentes que el anterior, excluyendo el ANA y aumentando la sacarosa de 30 a 90 g.L-1. Los cultivos se colocaron en un cuarto de crecimiento a 61,58 mmol.m-2.s-1 de luminosidad, bajo un fotoperíodo de 16 h diarias y 23 ± 2°C, durante 60 días.
Estudio histológico
Las plantas inducidas a bulbificar in vitro fueron muestreadas desde el día 0 hasta el día 28, a intervalos de siete días, para un total de cinco muestreos, extrayendo en cada uno de ellos, tres vitroplantas del medio de cultivo. En los dos primeros muestreos se eliminó la parte aérea de las vitroplantas, seccionándolas a 2 cm desde el cuello de la misma; mientras que a partir del día 14 se cortaron por encima del cuello del bulbo (3 a 4 cm aproximadamente). Estos materiales fueron fijados en F.A.A. (formol: alcohol: ácido acético 70%) por un período mínimo de 24 h (Cutter, 1978). Posteriormente se deshidrataron en una batería creciente de glicerina:agua, desde 20 a 100% y luego en otra batería decreciente de etanol-xilol, desde 100 a 25% (Torres y Mogollón, 1997).
Las muestras fueron incluidas en Paraplast X-Tracâ a 56°C, por 24 horas en la estufa. Los bloques con las estructuras se seccionaron transversal y longitudinalmente a 20 mM con un micrótomo de desplazamiento (Leicaâ modelo 820) y la tinción se realizó de forma directa, total, supravital y pancromática con Eosina al 2%. Las secciones se observaron, fotografiaron y describieron bajo un microscopio óptico (Olympusâ BX40).
Resultados y discusión
El estudio de los cambios histológicos que ocurrieron durante la formación in vitro del bulbo de ajo permitió distinguir dos etapas de desarrollo. La primera correspondió al estado morfogénico iniciada desde el establecimiento de los brotes seccionados a 2 cm desde la corona de la planta (día 0), hasta 20 días después de cultivados en el medio de inducción a la bulbificación. Esta etapa se caracterizó por el comienzo de la producción de hojas envainadoras desde el meristemo apical y por un ligero ensanchamiento de la base del brote (figura 1A). La segunda etapa correspondió al llenado y maduración del bulbo, lo cual se observó después del séptimo día de cultivo en el medio de inducción a la bulbificación. Ésta se caracterizó por el crecimiento de las yemas preformadas, ubicadas en las axilas de las hojas. Cada yema formó un "diente" del bulbo, continuando su desarrollo hasta los 60 días (figuras 1B y 1C).
El llenado del bulbo se produjo por la acumulación de fotoasimilados y nutrientes en las hojas envainadoras, contribuyendo al engrosamiento del mismo. También se observó que en esta segunda etapa, continuó la producción de hojas desde el meristemo apical central, ubicado en el tallo en forma de disco y la formación de primordios de raíces a partir de los meristemos. Estos resultados fueron similares a los obtenidos por Goleniowski et al., (2001), al señalar las mismas etapas, e indicaron una máxima actividad de la peroxidasa soluble en la etapa morfogénica y la presencia de peroxidasas iónicas durante el llenado del bulbo, lo cual explicaron como el resultado del proceso de acumulación de fotoasimilados.
Desde los inicios del desarrollo del bulbo (día 7), éste presentó una estructura similar a la descrita en cebolla (Brewster, 1994), es decir, siete hojas envainadoras recubriendo el ápice meristemático ubicado en el centro del tallo. No se observó la diferenciación de las yemas axilares que formarían más tarde los "dientes", pero si se detallaron los haces vasculares en las hojas externas, así como sus 6 a 7 capas de tejido parenquimático correspondientes al mesófilo (figura no mostrada).
En la figura 2 se presentan los cambios anatómicos que ocurrieron durante el proceso de desarrollo del bulbo. En el día 0, las secciones mostraron la típica organización anatómica de tallo, observándose el meristemo apical conformado por dos zonas: una externa que corresponde a la túnica y otra interna al corpus. La primera, constituida por una capa de células que envolvió al corpus, se dividió de manera anticlinal, y la segunda, por una masa de posición central cuyas células se dividieron anticlinal y periclinalmente (figura 2A). Estos patrones de división proporcionaron al ápice cambios cíclicos durante la formación de los primordios foliares. Inicialmente apareció como un pequeño domo que se alargó gradualmente, y luego formó una protuberancia alterna en un lado, lo que correspondió a la base foliar a partir de la cual se formó la yema que inició el "diente". Estas observaciones concuerdan con las descripciones de Ayabe y Sumi (1998), quienes encontraron que la organización celular interna y los procesos de formación de la estructura en forma de domo del ajo in vitro, fueron similares a lo que ocurren in situ.
A partir del día 7 se observaron las primeras manifestaciones de bulbificación por el engrosamiento de la base de las hojas envainadoras y el incremento en el número de éstas. En la región de engrosamiento primario fueron visibles los centros meristemáticos que estaban formados por una agrupación de células pequeñas, de citoplasma denso y núcleos difusos fuertemente teñidos, lo cual es indicativo de una alta división celular (figura 2B).
En el día 14, los meristemos responsables del crecimiento de la raíz se individualizaron y la polarización de las divisiones celulares dieron la forma punteada al primordio radical (figura 2C). Paralelamente las hojas envainadoras continuaron su desarrollo hacia la periferia, incrementando el grosor del bulbo. Así mismo, se diferenciaron los haces vasculares colaterales con elementos traqueales (figura 2D).
El desarrollo del bulbo se produjo por organogénesis directa mediante los procesos de inducción y diferenciación de los tejidos. Esto es comparable con lo descrito por Him y Páez (1998) en la formación in vitro del rizoma del jengibre (Zingiber officinale R.), lo que probablemente puede ser típico de las monocotiledóneas. Las raíces se originaron de manera adventicia, a partir de los centros meristemáticos ubicados en la región de engrosamiento primario, cerca del ápice del tallo. Luego emergieron a un lado de éste y crecieron horizontalmente antes de tornarse curvas y continuar su crecimiento hacia abajo, tal cual lo describieron Nuevo y Bautista (2001).
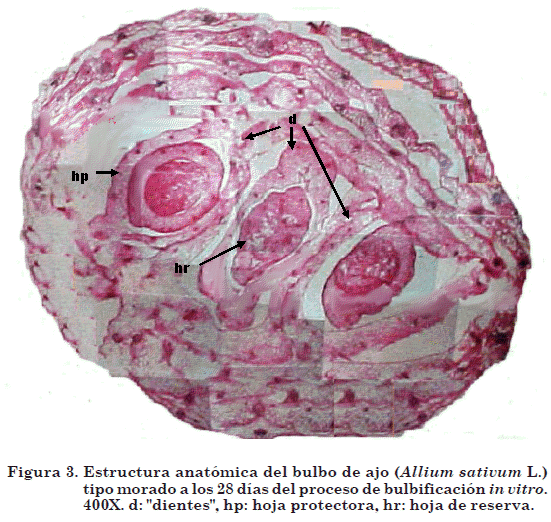
Entre los días 21 y 28 (figura 3), el bulbo se encontró parcialmente desarrollado y adquirió una configuración totalmente diferente a la inicial, debido a la formación de los "dientes". Estos estaban constituidos por una hoja protectora externa y seca, una hoja de reserva engrosada que conformaba la mayor masa y el meristemo apical, similar a las primeras etapas de la formación del bulbo de ajo in situ, descritas por Brewster (1994); Rahin y Fordham (2001).
A los 28 días de la inducción a la bulbificación, los bulbos presentaron de tres a cuatro "dientes", formados a partir del engrosamiento de las yemas axilares ubicadas en la base de las hojas envainadoras, determinando parcialmente su configuración. A partir de este período continuó el proceso de formación de nuevos "dientes" y el desarrollo de los ya existentes, de tal manera que al final del periodo de bulbificación (60 días), los bulbos llegaron a alcanzar un promedio de siete "dientes". Estas observaciones difieren de lo descrito por Câmara et al. (1993), al encontrar que a los 30 días los bulbos de ajo cv. `Gigante Roxo' estaban en estado de cosecha. Esta diferencia podría atribuirse a una respuesta propia del cultivar utilizado y al hecho de que las condiciones nutricionales del medio y las de cultivo en cuanto a luz y temperatura, no fueron exactamente las mismas.
Conclusiones
La formación del bulbo de ajo in vitro comprendió dos etapas de desarrollo: la primera correspondiente al estado morfogénico y la segunda, al llenado y maduración del mismo.
Los primeros indicios de bulbificación in vitro se observaron a partir del día siete, caracterizándose por el engrosamiento de la base de las hojas envainadoras y el cambio en la intensidad de la coloración, a medida que el bulbo fue desarrollándose.
A los 21 días de haberse iniciado el proceso de bulbificación in vitro del ajo, se observó la formación de los "dientes" a partir de las yemas ubicadas en las axilas de las hojas envainadoras.
Las raíces adventicias formadas en los bulbos de ajo in vitro se originaron a partir de los meristemos ubicados en la región de engrosamiento primario, cerca del ápice del tallo.
Agradecimientos
Los autores expresan el agradecimiento al Consejo de Desarrollo Científico, Humanístico y Tecnológico (CDCHT-UCLA) proyecto No. CDCHT-017-AG-2006 por el cofinanciamiento a esta investigación.
Literatura citada
1. Ayabe, M. y S. Sumi. 1998. Establishment of a novel culture method, stem-disc culture, and its practical application to micropropagation of garlic (Allium sativum L.). Plant Cell Reports 17:773-779. [ Links ]
2. Brewster, J.L. 1994. Onions and other vegetables Allium. CAB International. Wellesbourne, U. K. [ Links ]
3. Câmara, F., M. Pasqual, J. Ishida y E. Bastos. 1993. In vitro bulb formation in garlic (Allium sativum L.) cv. Gigante Roxo. Bulbificao in vitro de alho (Allium sativum L.) cv. Gigante Roso. Revista Ceres 40:566-574. [ Links ]
4.Cutter, E.G. 1978. Structure and development of potato plant. p. 70-152. En: Harris, P.M. (Ed.). The Potato Crop. Chapman and Hall. London. [ Links ]
5. Goleniowski, M., O. Del Longo, S.M. De Forchetti y J.A. Arguello. 2001. Relationiships between peroxidases and in vitro bulbification in garlic Allium sativum L. In Vitro Cell. and Dev. Biol. Plant 37(5):683-686. [ Links ]
6. Him, de F.Y. y J. Páez de Cásares. 1998. Origen histológico de los órganos regenerados in vitro del jengibre (Zingiber officinale R.). Proc. Interamer. Soc. Trop. Hort. 42:110-118. [ Links ]
7. Murashige, T. y F. Skoog. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant. 15:473-497. [ Links ]
8. Nuevo, P.A. y O. Bautista. 2001. Morpho-anatomical features and posharvest changes in garlic (Allium sativum L.). Harvested at different maturities. Acta Hort. 555:195-206. [ Links ]
9. Rahin, M.A. y R. Fordham. 2001. Environmental manipulation for controling bulbing in garlic. Acta Hort. 555:181-188. [ Links ]
10. Ramos de S., G. 1991. El cultivo del ajo en el Estado Mérida. Fondo Nacional de Investigaciones Agropecuarias (FONAIAP). Serie de paquetes tecnológicos. Maracay. [ Links ]
11. Torres, J. y N. Mogollón, 1997. Micropropagación clonal masiva de Cattleya lueddemanniana Rchb. Proc. Interamer. Soc. Trop. Hort. 41:92-98. [ Links ]
12. Valverde, R., O. Arias y T. Thorpe. 1992. Estudio histológico en callos de pejibaye (Guilielma gasipaes). Agronomía Costarricense 16(2): 225-229. [ Links ]
13. Wilmink, J., R. Ibrahim y P.C. Debergh. 1995. Factors controlling high efficiency adventitious bud formation and plant regeneration from in vitro floral explants of Tulipa (Tulipa gesneriana L.). Scientia Horticulturae 88:47-57. [ Links ]
14. Yeung, E. 1999. The use of histology in the study of plant tissue culture systems some practical comments. In Vitro Cell. Dev. Biol. Plant. 35:137-143. [ Links ]