Investigación Clínica
versión impresa ISSN 0535-5133
Invest. clín v.45 n.3 Maracaibo set. 2004
Evaluación preliminar de un inmunoanálisis de un solo paso, cualitativo y rápido de Troponina I cardiaca en el diagnóstico del infarto agudo del miocardio.
Damian Mainet-González*1, José A. Galván-Cabrera1, Luis Sorell-Gómez2, Maritza B. Torres-Cabrera3, Anselmo Abdo-Cuza4, R. Castellano-Gutiérrez4, Nolaida Padrón-Brito5, Daniel Palenzuela-Gardón1 y Lidia I Novoa-Pérez1.
1Centro de Ingeniería Genética y Biotecnología de La Habana,
2Instituto de Angiología y Cirugía Cardiovascular,
3Instituto de Cardiología y Cirugía Cardiovascular,
4Hospital CIMEQ, 5Hospital Hermanos Ameijeiras, Ciudad de La Habana, Cuba.
Resumen. La Troponina I cardiaca es considerada el marcador bioquímico de elección para el infarto agudo del miocardio; que es una urgencia médica y es necesario su diagnóstico rápido. En este artículo se estudió la posibilidad de diagnosticar esta entidad nosológica de una manera cualitativa a través de un ensayo inmunocromatográfico de un solo paso de detección de Troponina I cardiaca elaborado en el laboratorio y otro ensayo inmunocromatográfico cualitativo de detección de Troponina I cardiaca Cardiac STATus™. Se evaluaron retrospectivamente 76 plasmas de pacientes con infarto agudo del miocardio y 50 plasmas de donantes sanos. El inmunoensayo del laboratorio no presentó reactividad cruzada con la isoforma esquelética de la Troponina I. Esta prueba detectó 1 ng/mL o mayor de Troponina I cardiaca en forma de complejo terciario en plasma y también reconoció la molécula libre. La sensibilidad clínica del inmunoensayo del laboratorio en pacientes con infarto agudo del miocardio de tipo Q fue 100% y para el inmunoensayo comercial, 85,7% en el período de 6 h a 24 h de inicio del dolor en el pecho. Para ese tipo de infarto se detectó señal hasta las 148 h y la sensibilidad clínica osciló entre 84,2% y 90,9% para ambos sistemas. En el caso de pacientes con infarto agudo del miocardio de tipo no-Q la sensibilidad clínica fue 70% en los dos inmunoensayos. La especificidad clínica del inmunocromatográfico de Troponina I cardiaca preparado en el laboratorio con muestras de donantes sanos fue 90.4% y para el inmunocromatográfico comercial, 100%. Los dos sistemas inmunocromatográficos de un solo paso para la detección de Troponina I cardiaca evaluados en este trabajo diagnostican de una manera rápida y fácil la muerte celular miocárdica importante y en menor grado, aquella necrosis más pequeña, sin signos electrocardiográficos concluyentes y con posibilidades de la ocurrencia de complicaciones a corto y mediano plazo en el paciente con síndrome coronario agudo.
Palabras claves: Inmunoanálisis, oro coloidal, infarto agudo del miocardio y troponina I cardiaca.
Preliminary evaluation of a rapid, qualitative one step immunoassay of cardiac Troponin I in the acute myocardial infarction diagnosis.
Abstract. The cardiac Troponin I is considered the biochemical marker of election to detect acute myocardial infarction, a medical urgency that requires a rapid diagnosis. In this article, the diagnosis of this condition was studied qualitatively through an immunochromatographic assay of a single step detection of cardiac Troponin I elaborated in the laboratory comparing it with another, commercially available, qualitative immunochromatographic assay of detection of cardiac Troponin I, Cardiac STATUS TM. The plasmas of 76 patients with acute myocardial infarction and 50 plasmas obtained from healthy donors were evaluated retrospectively. The laboratory’s immunoassay did not present cross reactivity with the skeletal isoform of Troponin I. This test detected 1 ng/mL or more of cardiac Troponin I in the form of a tertiary complex in plasma and it also recognized the free molecule. The clinical sensitivity of the immunoassay of the laboratory in patients with Q wave type acute myocardial infarction was 100% and for the commercial immunoassay was 85.7% in the period of 6 h to 24 h following the onset of chest pain. For this type of infarction, the signal was detected up to 148 h after the onset of symptoms and the clinical sensitivity oscillated between 84.2% and 90.9% for both assays. The clinical sensitivities of the two immunoassays were 70% in the case of patients with non-Q wave acute myocardial infarction. With healthy donor’s samples, the clinical specificity of the immunochromatographic assay prepared in the laboratory was of 90.4% and for commercial immunoassay was 100%. The immunochromatographic immunoassays of a single step for the detection of cardiac Troponin I evaluated in this work, diagnosed in a quick and easy way, important myocardial cell death and to lesser extent smaller necrosis, in patients without concluding electrocardioghraphic signs and with the possibility of the occurrence of complications.
Key words: Immunoassay, colloidal gold, acute myocardial infarction, cardiac troponin I.
Recibido: 23-09-03. Aceptado:20-05-04
INTRODUCCIÓN
EL infarto agudo del miocardio (IAM) es la primera causa de muerte en Cuba y de muchos países de mundo. En Cuba provoca más de 10 000 muertes al año para una tasa relativa de 0,19% (1). El síndrome coronario agudo engloba tres formas clínicas: la angina inestable aguda, el IAM de tipo no-Q y el IAM de tipo Q. En las dos primeras formas clínicas existe oclusión parcial del vaso coronario afectado que provoca daño celular que puede evolucionar a microfocos de muerte celular o de IAM de tipo no-Q. En la última forma clínica existe una oclusión total de la arteria coronaria afectada y existe un daño celular considerable que origina una necrosis celular al cabo de 4 a 6 horas de evolución de la hipoxia. El índice de mortalidad aguda en el IAM de tipo no-Q es de 2 al 3% comparado con el 10% para el IAM de tipo Q. Las complicaciones del IAM de tipo no-Q son mínimas comparadas con aquellas después de un IAM de tipo Q. Existe la experiencia clínica de una buena respuesta al tratamiento trombolítico en los pacientes con IAM que presentan una elevación del segmento ST, los cuales en su mayoría evolucionan a IAM de tipo Q. Sin embargo, un 50% de todos los pacientes con IAM presentan un electrocardiograma sin elevación del segmento ST, que en su mayoría evolucionan a angina inestable aguda y a IAM de tipo no-Q, sólo una pequeña porción de estos pacientes derivan a IAM de tipo Q. En este grupo de pacientes con IAM sin elevación de ST electrocardiográfico, el tratamiento trombolítico no está indicado, sino los inhibidores de la trombogénesis como son: la heparina de bajo peso molecular y los inhibidores de la glicoproteína IIb/IIIa. Ambos tipos de tratamientos deben ser aplicados lo más rápido posible; el tratamiento trombolítico debe ser antes de las 12 horas del inicio del dolor en el pecho (2) y el tratamiento con inhibidores de la trombogénesis antes de las 24 horas de inicio del cuadro clínico (3, 4). Cuanto más rápida es la intervención trombolítica mejor es la evolución del paciente y menor el daño miocárdico. El tratamiento entre 1-2 horas del inicio del dolor en el pecho se evita el daño irreversible y entre 4-6 horas, ese daño es relativamente pequeño. Se ha reportado que aproximadamente sólo un 50% de los pacientes con IAM son diagnosticados correctamente a tiempo para recibir una intervención terapéutica útil (5) y del total de pacientes que se presentan en el cuerpo de guardia con sospecha de síndrome coronario agudo el 10% presentan elevación del segmento electrocardiográfico ST y el 90% restante se necesita la confirmación bioquímica de su diagnóstico (6, 7).
Con el desarrollo tecnológico en la instrumentación han aparecido análisis rápido de una magnitud bioquímica o varias de ellas que pueden ser realizadas simultáneamente para el diagnóstico de daño miocárdico en formato cualitativo o cuantitativo en el laboratorio central, en los laboratorios satélites o al lado de la cama de paciente por un personal clínico o del laboratorio. Estas pruebas reciben el nombre de análisis en unidades de cuidados. Entre los marcadores bioquímicos utilizados para este tipo de pruebas rápidas y simples de un solo paso para ser realizadas próximo a la cama del paciente están las determinaciones seriadas de la creatinaquinasa (CK, EC 2.7.3.2), la isoenzima MB de la creatinaquinasa (CKMB) y la mioglobina. Todo estos marcadores favorecen el diagnóstico de IAM no-Q cuando el electrocardiograma no es útil. Pero las troponinas cardiacas (I y T) son de mayor cardioespecificidad que las enzimas y la Troponina I (TnI) cardiaca es más cardioespecífica que la Troponina T cardiaca que ha estado moderadamente aumentada en pacientes con insuficiencia renal crónica sin un síndrome coronario agudo (8). Las troponinas presentan mayores sensibilidades que los marcadores enzimáticos (incluyendo la CKMB) ya que detecta mayor números de pacientes con angina inestable aguda cuando las enzimas son negativas. Se ha demostrado anatomopatológicamente que esos pacientes con angina inestable han presentado focos muy pequeños de necrosis miocárdica. Por último, las troponinas positivas en pacientes con angina inestable aguda brindan información pronóstica con respecto al desarrollo de un IAM o de muerte en los 30 días siguientes del inicio de dolor en el pecho (7).
La TnI cardiaca conjuntamente con la troponina T cardiaca y la troponina C forman el complejo de troponina cardiaca que participa en la regulación de la contracción muscular del corazón. Existen 3 isoformas de la TnI: la TnI cardiaca, la TnI esquelética rápida y la TnI esquelética lenta. La TnI cardiaca es liberada hacia el plasma en forma de complejo binario con la troponina C, después le sigue la forma terciaria de la troponina (C-T-I) y sólo un 6% es liberada en forma de libre (9). La TnI cardiaca se eleva a partir de 4 a 6 horas hasta un pico que se obtiene entre 12-24 h y vuelve a la normalidad de 5 a 7 días. La TnI cardiaca puede ser detectada en plasmas de pacientes, usando anticuerpos monoclonales específicos (AcM). Los anticuerpos deben discriminar la isoforma cardiaca de TnI de la isoforma esquelética y debe ser capaz de reconocer la molécula en la forma libre y formando complejo.
Se han reportado diferentes umbrales de corte de la TnI cardiaca para el IAM en suero que oscilan desde 2,5 ng/mL (10) a 1 ng/mL (11). También se han descritos diferentes sistemas inmunocromatográficos de diagnóstico rápido de TnI cardiaca para la realización al lado de la cama del paciente que utilizan diferentes combinaciones de anticuerpos para el diagnóstico de esta enfermedad. En este artículo describimos la elaboración de un análisis inmunocromatográfico rápido de un solo paso para la detección de TnI cardiaca en plasma humano, usando una nueva combinación de anticuerpos. Además evaluamos restropectivamente dos grupos de pacientes con IAM, uno de tipo Q y otro no-Q con el sistema inmunocromatográfico de detección de TnI cardiaca Cardiac STATus™ y con aquel preparado en el laboratorio.
MATERIAL Y MÉTODOS
Material de calibración
El calibrador del immunoanálisis fue el complejo de troponina cardiaca natural humana (Hytest, Turku, Finlandia). Este reactivo se diluyó en una mezcla de sueros humanos de donantes sanos filtrada en membrana de acetato de celulosa con un tamaño de poro de 0.45 µm (Sartorious AG, Gottingen, Alemania) hasta una concentración de 1 ng/mL de complejo de troponina cardiaca natural humana y se alicuotó convenientemente. La concentración de TnI cardiaca dentro de ese complejo terciario es 300 ng/mL. Las alícuotas se conservaron a –70°C como calibradores primarios durante 3 años (12). Las alícuotas de uso frecuente o calibradores secundarios se conservaron a –20° por menos de 2 meses y se descongelaban a temperatura ambiente antes de usar en el análisis. Cada alícuota se usó en menos de 5 ciclos de congelación y descongelación (13).
Anticuerpos
Los hibridomas del AcM CBTnI.16 fueron obtenidos por el método de fusión con polietilenglicol de los mielomas P3X63-Ag8- 653 y los linfocitos esplénicos de los ratones inmunizados en una relación 10 a 1 (14).
Los AcM CBTnI.16 y el 19C7 (Hytest, Turku, Finlandia) no tienen reactividad cruzada con la TnI esquelética. Ambos anticuerpos reconocen a la TnI cardiaca libre y cuando está formando complejo con la troponina T y la troponina C. El anticuerpo 19C7 reconoce el epitopo –SASRKLQLK– (15) y el CBTnI.16, el epitopo –FAELQD– (14) que corresponden al grupo de aminoácidos desde la posición 41 a la 49 y de la posición 89 a la 94 de la secuencia aminoacídica de la TnI cardiaca, respectivamente. Esos dos anticuerpos reconocen la parte central de la TnI cardiaca que constituye la parte más estable de esta molécula.
El AcM CBTnI.16 fue purificado de la ascitis por cromatografía de afinidad usando una columna de proteina A sefarosa CL 4B (Pharmacia, Upsala, Suecia). El anticuerpo policlonal de anti-IgG de ratón en carnero (Centro de Ingeniería Genética y Biotecnología de Sancti Spiritus, Sancti Spiritus, Cuba) fue aplicado en la mancha control del inmunoanálisis de un solo paso.
Preparación del coloide de oro
Se preparó mediante el protocolo descrito por De Mey (16). Brevemente se preparó una solución de 200 mL de solución de ácido tetracloroáurico (Riedel de Haën, Seelze, Alemania) al 2%. Se calentó con agitación suave y constante (300 rpm) hasta que hirvió (100°C). Cuando comenzó a ebullir, se incrementó la agitación a 900 rpm, se destapó el recipiente y se adicionó rápidamente y de una sola vez 1.5 mL de la mezcla reductora de citrato trisódico. Se observó que se producen cambios de color, primero de amarillo pálido a azul oscuro e inmediatamente a rojo oscuro. Luego, se dejó en agitación y calor durante 15 min. Después se retiró la solución del calor, y se colocó a temperatura ambiente. Se conservó a 4°C, siendo estable por 3 meses. Se midió el tamaño de las partículas de oro coloidal, según algunas modificaciones del protocolo de Smith y Seegan (17) en un microscopio electrónico de transmisión JEM 2000EX (JEOL, Akishima, Japón) con un voltaje de aceleración de 80 kv. El aumento primario fue de 40 000X ó 50 000X. Las muestras de oro coloidal fueron absorbidas en hojas de carbón fino y embebidas con 2% de acetato de uranilo. El tamaño de la partícula de oro coloidal fue de un diámetro promedio de 30 nm. Los parámetros longitud de onda máximo (lmáximo) y la variación de la longitud de onda (Dl) se determinaron a cada uno de los coloides a través de la espectrofotometría (Pharmacia, Uppsala, Suecia) y el programa Wavescan, con el objetivo de realizar el control de la calidad de esas soluciones.
Conjugación del anticuerpo CBTnI.16 con oro coloidal
Se siguió el método descrito por Beesley (18) con algunas modificaciones. El conjugado CBTnI.16 fue preparado determinando el pH óptimo y la mínima cantidad protectora. La menor cantidad de proteína necesaria para proteger la solución de oro coloidal de la floculación en presencia de sales se denomina: mínima cantidad protectora. En una placa de microtitulación Polysorp (Nunc, Roskilde, Dinamarca) a las diluciones seriadas de 50 µL del AcM diluido en agua destilada fue añadido 200 µL de solución de oro coloidal a diferentes pH. El pH fue cambiado con 0,1 M de carbonato de potasio (BDH chemicals, Inglaterra, Gran Bretaña). La absorción del AcM ocurrió en 5 min a temperatura ambiente (20-24°C). Después de esto, 25 µL de cloruro de sodio al 10% fue añadido y la floculación fue vista por cambio de color rojo (coloide protegido) a color azul (coloide no protegido). La lectura de la placa de microtitulación fue realizada a 620 nm –que detecta el cambio de coloración azul– en el lector de placa PR-521 (Tecnosuma Internacional, Ciudad de La Habana, Cuba). Conociendo el pH y la cantidad mínima protectora del AcM CBTnI.16 por el coloide; esta proteína fue absorbida al coloide de oro en un volumen de interés. El conjugado fue bloqueado con 1% de albúmina sérica bovina y 0,05% de polivinilpirrolidona 10 000 por 5 min a temperatura ambiente. El exceso de AcM y de albúmina fueron eliminados por una centrifugación a 18 000 rpm durante 1 h a 4°C. El sobrenadante y el precipitado duro incrustado en la pared del tubo de centrífuga fueron descartados. El precipitado duro corresponde al oro no conjugado con la proteína y no migra al fondo del tubo de centrífuga. El precipitado blando asentado en el fondo del tubo de centrífuga fue resuspendido en el tampón de almacenamiento y conservada a 4°C. El tampón de almacenamiento es una solución de Tris/HCL 10 mM pH 8,5, 1% de albúmina sérica bovina, 0,05% de polivinilpirrolidona 10 000 y 0,1% de azida sódica filtrada por una membrana de acetato de celulosa con un tamaño de poro de 0,2 µm (Sartorious AG, Gottingen, Alemania). A los conjugados de AcM - oro se les ajustó la densidad óptica a 0.125 para una longitud de onda 520 nm (19). Este mismo método fue utilizado para conjugar el anticuerpo CBTnI.16 a las soluciones coloidales comerciales de partículas de oro con diámetro promedio de 40 nm y la otra de 20 nm (Ted Pella, California, USA).
Principio del inmunocromatográfico de detección de la TnI cardiaca
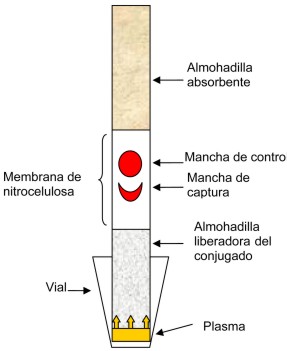
En esta prueba se usó una combinación única de dos anticuerpos monoclonales murinos, uno es el 19C7 absorbido en la fase sólida y el otro anticuerpo CBTnI.16 conjugado a partículas de oro coloidal, además un anticuerpo policlonal anti-IgG de ratón inmovilizado como control del funcionamiento de la prueba. La prueba comienza cuando se introduce la tira en un vial de 1,5 mL (Polylabo, París, Francia) que contiene 200 µL de plasma heparinizado humano (Fig. 1). La TnI cardiaca plasmática se combina con el anticuerpo CBTnI.16-oro. Debido a la capilaridad comienza a migrar el complejo de TnI cardiaca-CBTnI.16-oro a través de la tira. Cuando llega a la zona de captura donde se encuentra el AcM 19C7 (1,5 µg por tira) inmovilizado es atrapado dicho complejo antígeno-anticuerpo. La concentración de las partículas de oro da origen a una mancha rojo púrpura en esa región. Al continuar migrando en el frente de corrida, el anticuerpo conjugado con oro que no reaccionó con el antigeno es atrapado en una segunda línea captura inespecífica donde está el anticuerpo anti-IgG de ratón en carnero inmovilizado en la fase sólida. En este momento se origina una segunda señal que funciona como control de que hubo migración del conjugado CBTnI.16- oro en la matriz biológica a través de la línea de captura específica. La prueba demora 20 minutos. Se considera un resultado positivo si aparecen dos manchas visibles en la zona de reacción. El resultado es negativo si sólo aparece una mancha correspondiente al control. El ensayo no válido fue considerado si no aparece la mancha correspondiente al control y la prueba debe ser repetida. Debido a la cinética de liberación de la TnI cardiaca, se evaluaron las muestras de plasmas a partir de las 6 horas. La lectura visual de los resultados de los ensayos inmunocromatográficos se realizaron con una adecuada iluminación y se evaluaron por tres observadores independientes, sin un conocimiento previo del diagnóstico de la muestra con el objetivo de controlar la variación interobservador. Todos los experimentos fueron llevados a cabo a temperatura ambiente (21 a 25°C).
Fig. 1. Vista frontal de una prueba inmunocromatográfica preparada en el laboratorio de flujo lateral en funcionamiento y se señalan las diferentes partes que la componen.
En algunos experimentos descritos más adelante se realizó la lectura de la mancha de captura específica de los ensayos inmunocromatográficos en un Analizador personal para pruebas rápidas PART™ (LRE Technology Partner GmbH, München, Alemania) y se utilizó el programa de evaluación de pruebas rápidas para ese analizador PART ES™. Ese equipo es un fotómetro que hace incidir un rayo de luz (a una determinada longitud de onda) sobre la membrana de nitrocelulosa de la tira inmunocromatográfica. La luz reflejada es captada por un sistema de lente que tiene acoplado un sensor lineal eléctrico. La señal captada por ese sensor es convertida por el programa de computación en una curva que varía su altura en dependencia de la intensidad del color de la mancha específica, siempre y cuando no exista variación en la extensión de la mancha. El resultado final es mostrado como el área de bajo de esa curva.
Comparación de los conjugados de AcM-oro realizados con diferentes coloides
Los conjugados del CBTnI.16 con el coloide de oro preparado en nuestro laboratorio y el coloide de Ted Pella fueron ajustados a una misma densidad óptica (0,125 a una longitud de onda 520 nm) y se aplicaron diferentes volúmenes de los mismos desde 1 µL hasta 6 µL en las almohadillas del conjugado de cada tira. Las muestras fueron una mezcla de plasmas de donantes sanos y esa misma mezcla que se le añadió 4 ng/mL de TnI cardiaca en forma de complejo terciario. Se hizo una corrida de 20 minutos y luego se realizó la lectura.
Experimentos de termoestabilidad de los componentes de la prueba inmunocromatográfica de TnI cardiaca.
Una vez que los tres componentes principales de este inmunoanálisis –el anticuerpo policlonal anti-IgG ratón, el anticuerpo anti-TnI cardiaca 19C7 y el conjugado CBTnI.16-oro– fueron optimizados sus condiciones de recubrimiento en la membrana de nitrocelulosa y la aplicación en la almohadilla de conjugado se procedió a los experimentos de estabilidad. La tira de nitrocelulosa fue recubierta con 1 µL (1 µg) del anticuerpo policlonal en la solución de Tris 10 mM, cloruro de sodio 150 mM pH 7,4.y de 1µL (1 µg) del anticuerpo monoclonal 19C7 en diferentes soluciones. Se dejaron secar a 37°C durante 16 h (toda la noche). Se aplicó en la almohadilla de conjugado 2 µL del conjugado CBTnI.16-oro diluido en igual volumen de soluciones con diferentes aditivos estabilizantes a estudiar. Se dejó secar durante 1 h a 37°C. Después las tiras de membrana de nitrocelulosa por un lado y las almohadillas de conjugado por otra fueron introducidas en un envase sellado de nilón metalizado y con una bolsita desecante de gel de sílice Minipax® (Multiform Desiccants Inc, Nueva York, USA) adentro. Se introdujeron dentro de un horno a 60°C y otras a 25°C (control) durante 4 días. Los diferentes componentes en estudio de las pruebas inmunocromatográficas fueron ensamblados con los otros componentes preparados en el mismo día. Para analizar la estabilidad de la tira inmunocromatográfica en su conjunto cada uno de los componentes principales se le añadió sus correspondientes aditivos y se aplicaron a la tira de nitrocelulosa o a la almohadilla de conjugado. Se dejaron secar, luego se ensambló la tira completamente incluyendo la almohadilla absorbente y se guardó dentro de un envase sellado de nilón metalizado y una bolsita desecante de gel de sílice adentro a 37°C durante 40 días. En todos los casos se probó el funcionamiento de la prueba inmunocromatográfica de un solo paso como se ha descrito anteriormente.
El detergente Pluronic® L64, los polímeros: PVP K-90® y Viscarin® GP 309 (Pragmatics Inc, Indiana, USA) y la trehalosa (Sigma, St Louis, USA) fueron utilizados en los experimentos de estabilidad de los componentes del sistema inmunocromatográfico. Todos los demás reactivos utilizados no especificados fueron de la firma MERCK (Darmstadt, Alemania).
Especificidad analítica
La TnI cardiaca natural humana (Biodesign International, Kennebruck, USA) y la TnI esquelética natural humana (Hytest, Turku, Finlandia) eran altamente purificadas. La TnI cardiaca en forma de complejo terciario y la TnI cardiaca natural se incluyeron como controles positivos y la TnI esquelética se diluyó en la mezcla de plasmas de donantes sanos en 3 concentraciones: 2000 ng/mL, 200 ng/mL y 20 ng/mL. Se aplicó la mezcla de plasmas de donantes sanos como control negativo de la muestra. A nivel de la mancha de control se aplicó anti-IgG de ratón en carnero.
Límite de detección y efecto prozona
Se prepararon diferentes concentraciones de TnI cardiaca en forma de complejo terciario: 4 ng/mL, 2 ng/mL, 1 ng/mL, 0,5 ng/mL y 0 ng/mL en una mezcla de plasma de donantes sanos. Esos patrones fueron evaluados por el sistema inmunocromatográfico de detección de TnI cardiaca preparado en el laboratorio y el Cardiac STATusä y luego se realizó la lectura de ambas pruebas. Para analizar si en esta prueba de un solo paso existe efecto prozona se aplicaron concentraciones mayores de la TnI cardiaca en forma de complejo terciario –llegando a 300 ng/mL– en la mezcla de plasmas de donantes sanos. Se midió el tiempo en que aparecía cada señal y su intensidad.
Obtención y procesamiento de las muestras de los pacientes y de los donantes sanos
Las muestras patológicas fueron recolectadas de pacientes ingresados en las Unidades de Cuidados Coronarios de 3 Hospitales de Ciudad de La Habana en el período del 1999 al 2002 y las muestras de donantes sanos del Banco de Sangre de Marianao (Ciudad de La Habana). El IAM fue diagnosticado cuando se cumplieron con 2 de los 3 criterios enunciados por la Organización Mundial de la Salud (OMS) para esta enfermedad. El criterio clínico consistió en una historia clínica de dolor en el pecho de 20 min o más que no se alivia con nitroglicerina. El criterio electrocardiográfico cuando existe elevación del segmento electrocardiográfico ST de más de 1 mm de 2 derivaciones: DI, DII, DIII, aVL y aVF que registran la misma zona anatómica o de más de 2 mm en 2 o más derivaciones precordiales contiguas o bloqueo de rama izquierda o la presencia de una Q patológica en esas derivaciones. El criterio bioquímico consistió en la elevación de las enzimas en al menos 2 determinaciones por encima de sus respectivos límites de referencias superiores y sus ventanas diagnósticas. Los pacientes con dolor en el pecho sugestivo de isquemia miocárdica y con un electrocardiograma no útil se diagnosticaron como IMA no Q cuando cumplieron con el criterio bioquímico enzimático.
Las muestras de plasmas fueron obtenidas desde las 6 horas de inicio del dolor en el pecho hasta las 148 horas. El tiempo promedio transcurrido de 21 pacientes desde el inicio del dolor en el pecho hasta la admisión en el hospital fue 2 h y 44 min (± 2 h y 23 min). Se tuvieron en cuenta los aspectos recogidos en la Declaración de Helsinki para la evaluación de seres humanos como sujeto de investigación (52da Asamblea General de Asociación Médica Mundial, Edimburgo, Escocia, Octubre 2000). Se utilizó el volumen de plasma descartado en el laboratorio después de realizados los análisis indicados por el facultativo del paciente, por lo que no se hizo una nueva punción de la vena. Las muestras de plasmas fueron codificadas para la realización del estudio y luego se convirtieron en muestras anónimas. Se guardó la confidencialidad de los datos personales de cada uno de los pacientes.
Los 50 plasmas de donantes sanos fueron recogidos del banco del sangre sin historia previa ni actual del daño cardiaco y con los siguientes datos: edad promedio de 30 años (18-43 años), peso promedio de 74 Kg (62-99 Kg). En todos los casos, se tomó 1,5 mL de sangre del paciente, se le añadió heparina (Imefa, Ciudad de La Habana, Cuba) a una concentración final de 2 unidades internacionales/mL como anticoagulante, después se centrifugó 2 000 g durante 15 minutos y por último, se recogió el sobrenadante, obteniéndose el plasma. Los plasmas con hemólisis fueron descartados. Todas las muestras recogidas fueron debidamente alicuotadas y conservadas a –70 0C por un período de 3 años (12). Se usaron en menos de 4 ciclos de congelación y descongelación (13). Después de cada descongelación a temperatura ambiente, las alícuotas de cada muestra fueron homogenizadas y centrifugadas a 4 000 g antes de usar para eliminar los restos de fibrinas.
Otros análisis biológicos
La prueba rápida de detección de Troponina I cardiaca Cardiac STATus™ se realizó según las instrucciones de los fabricantes (Spectral Diagnostic Inc, Princenton, USA) y con un tiempo de análisis de 15 min. El umbral de corte de IAM para ese ensayo es 1,5 ng/mL de TnI cardiaca. Algunas muestras de plasmas de pacientes con IAM o donantes sanos que en su evaluación con los dos inmunoanálisis de un solo paso fueron discordantes; se evaluaron con el inmunoensayo de cuantificación de TnI cardiaca en plasma elaborado en el laboratorio que presenta un límite de detección de 0.1 ng/mL (14). La CKMB (Slavo diagnostics, Siena, Italia) y la CK, la transaminasa glutámico- oxalacética o TGO (EC 2.6.1.1) y la lactato deshidrogenasa o EC 1.1.1.27 (Roche- Boehringer, Mannheim, Alemania) fueron realizadas según las indicaciones de los fabricantes en un analizador automático hematológico 912 (Hitachi, Tokio, Japón). Los límites de referencias superiores fueron: para la CK, 195 UI/L; para la CKMB, 18 UI/L; para la TGO, 40 UI/L y para la LDH, 450 UI/L. Se tomó en cuenta la cinética de liberación al torrente sanguíneo de cada una de esas enzimas para el diagnóstico de IAM.
Análisis estadístico
Sensibilidad clínica = [PV/(NF+PV)] *100;
Especificidad clínica = [NV/(PF+NV)] *100;
Valor predictivo positivo = [PV/(PF+PV)] *100;
Valor predictivo negativo = [NV/(NF+NV)] *100;
Eficiencia diagnóstica = [(PV+NV)/(PV+NF+PF+ NV)]*100,
donde PV es un resultado realmente positivo o más brevemente un positivo verdadero, PF: positivo falso, NV: negativo verdadero, NF: negativo falso. Las variables clínicas recogidas y calculadas se informan como el promedio de ellas y entre paréntesis el intervalo de confianza para un 95% de confiabilidad. El intervalo de confianza de las variables clínicas estudiadas se calculó según la fórmula de estimaciones del intervalo de confianza al 95% para proporciones donde p ± 1.96 *(p*(1-p)/n)1/2, donde n es el tamaño de la muestra y la p corresponde a las variables clínicas. Se utilizaron las pruebas de significación de una cola de proporciones muestrales y de diferencias de medias muestrales y proporciones muestrales. En todos los casos se consideró la existencia de diferencias significativas para una probabilidad igual o menor de 0,05. Estos cálculos fueron realizados en el programa Microsoft Excel (Microsoft Corporation, USA).
RESULTADOS
Optimización del ensayo rápido de un solo paso de TnI cardiaca con el conjugado CBTnI.16-oro coloidal de 30 nm
En la Fig. 2 se muestra que existe un pH óptimo entre 8 y 9, donde se obtiene la mayor estabilidad del coloide elaborado en el laboratorio cuando existe un aumento de la fuerza iónica. El pH 8,5 fue seleccionado para la conjugación del anticuerpo CBTnI.16 a las partículas de oro. La cantidad de 8 µg del anticuerpo CBTnI.16 es la mínima cantidad que protege al coloide del efecto de la adición de la sal. Se utilizó en los siguientes procesos de conjugación del anticuerpo a la partícula de oro un ligero exceso de esa proteína por encima de la mínima cantidad de protectora: 10 µg/mL de coloide de oro. Las condiciones de conjugación de este anticuerpo a las partículas de oro coloidal de Ted Pella fueron similares a las anteriormente descritas.
Fig. 2. Condiciones óptimas de conjugación del anticuerpo monoclonal CBTnI.16 con oro según el pH del coloide (a) y la cantidad mínima de proteína que estabiliza el coloide en un aumento de la fuerza iónico (b).
El conjugado del CBTnI.16 con el coloide elaborado en el laboratorio presentó un fondo inespecífico a partir de 3 µL de volumen de aplicación a la almohadilla de conjugado del sistema inmunocromatográfico y a 2 µL se obtuvo una buena señal específica sin dicho fondo (Fig. 3a). Por lo que, el volumen de 2 µL presentó una mejor relación señal/fondo y fue seleccionado para realizar los siguientes experimentos que se mencionan. El conjugado CBTnI.16 - oro coloidal preparado en el laboratorio con un tamaño de partícula de 30 nm produjo manchas específicas más fuertes que el conjugado CBTnI.16-oro coloidal de Ted Pella con un tamaño de partícula de 40 nm. Sin embargo, este último conjugado comercial no presentó fondo inespecífico (Fig. 3b). El volumen de aplicación del conjugado del anticuerpo con el coloide comercial a la almohadilla de conjugado fue 4 µL, que se utilizó en los experimentos de evaluación de la prueba inmunocromatográfica preparada en el laboratorio con las muestras de donantes sanos con una señal falsamente positiva. Previamente se había comprobado que el conjugado del anticuerpo CB TnI.16 con el coloide comercial de 40 nm aumentaba la sensibilidad analítica de este ensayo con respecto al de 20 nm de esa misma firma. El aumento del tamaño de partícula a 40 nm no produjo un impedimento estérico.
Fig. 3. Determinación del volumen de trabajo del conjugado CB TnI.16-oro realizado con el coloide de 30 nm elaborado en el laboratorio (a) y con el coloide comercial de la firma Ted Pella de 40 nm (b). Las columnas blancas corresponden a una mezcla de plasmas de donantes sanos y las columnas grises a 4 ng/mL de Troponina I cardiaca en forma de complejo terciario diluida en esa mezcla de plasmas.
En los experimentos de estabilidad térmica acelerada de los componentes de la prueba inmunocromatográfica se utiliza un factor de conversión como posible predictor de la estabilidad real de los componentes a la temperatura de almacenamiento. Esa predicción es un cálculo aproximado orientador de que sus componentes podrían ser estables a tiempo real con los diferentes aditivos añadidos, pero no es una garantía de la estabilidad real de la tira reactiva. El AcM de recubrimiento ni el anticuerpo policlonal anti-IgG de ratón en la tira de nitrocelulosa no disminuyeron su capacidad de capturar el antígeno a 60°C durante 4 días (Fig. 4a), cuando el primer anticuerpo se disolvió en solución salina de fosfato 25 mM pH 7,2 con trehalosa 8%, Pluronic® 0,05% y azida sódica 0,02% y el segundo anticuerpo, en la solución que se aplicó. Ese resultado predice una posible estabilidad del AcM 19C7 de recubrimiento y del anticuerpo policlonal en carnero a temperatura ambiente durante 12 meses (20). La azida sódica a 0,02% interfiere en la estabilidad del AcM de recubrimiento, pero cuando se añade trehalosa 8% y Pluronic® 0,05% se bloquea ese efecto. El conjugado CBTnI.16 con el oro coloidal preparado en el laboratorio fue estable a 60°C en los experimentos de estabilidad térmica durante 4 días en la almohadilla del conjugado, cuando se le añadió albúmina sérica bovina 5%, trehalosa 10%, Pluronic® 0,05% (Fig. 4b). Ese resultado indica una posible estabilidad de ese reactivo a temperatura ambiente durante 12 meses. En la Fig. 4b se muestra que en algunas condiciones no se produjo el desprendimiento y la migración del conjugado de sus respectivas almohadillas a las concentraciones de los aditivos utilizadas. Los demás experimentos de la prueba inmunocromatográfica elaborada en el laboratorio para la detección de TnI cardiaca se realizaron con las condiciones en la que se logró la estabilidad térmica de sus 3 componentes principales. La estabilidad de las tiras inmunocromatográficas de TnI cardiaca ensambladas completamente presentaron un adecuado funcionamiento después de 40 días a 37°C, lo cual sugiere una estabilidad a tiempo real de 400 días a temperatura de 20-25°C (21); o sea mayor de 12 meses.
Fig. 4a. Estudio de la estabilidad térmica durante 4 días del recubrimiento del anticuerpo monoclonal 19C7 y del anticuerpo policlonal de anti-IgG de ratón en carnero sobre la nitrocelulosa a 25 °C (tiras 1-6) y a 60 °C (tiras 7-12). El anticuerpo monoclonal se diluyó en la solución salina de fosfato 25 mM pH 7,2 (tiras 1,2), en la solución salina de fosfato 25 mM pH 7,2 con azida sódica 0,02% (tiras 3, 4) y en la solución salina de fosfato 25 mM pH 7,2 con trehalosa 8% Pluronic® 0,05% y azida sódica 0,02% (tiras 5, 6). Las tiras se introdujeron en una mezcla de plasmas de donantes sanos con 1 ng/mL de Troponina I cardiaca en forma de complejo terciario (a) y otras, en una mezcla de plasmas de donantes sanos (b). El anticuerpo policlonal se aplicó en la solución de Tris 10 mM, cloruro de sodio 150 mM pH 7,4.
Fig. 4b. Estudio de la estabilidad térmica durante 4 días del conjugado CBTnI.16-oro en la almahadilla del conjugado a dos temperaturas: 25 °C y 60 °C. El conjugado se diluyó en Tris 10 mM pH 8,5 con los siguientes aditivos: albúmina bovina sérica 5%-sacarosa 10% y Pluronic® 0,05% (tiras 1,2,3), caseína 5%-sacarosa 10% y Pluronic® 0,05% (tiras 4,5,6), PVP® k 90 3,8%-sacarosa 10% y Pluronic® 0,05% (tiras 7,8,9), Viscarin® 0,8% PVP® k 90 0,08%-sacarosa 10% y Pluronic® 0,05% (tiras 10,11,12), albúmina bovina sérica 5%-trehalosa 10%-Pluronic® 0,05% (tiras 13,14,15) y albúmina bovina sérica 5%-sacarosa 10% y Pluronic® 0,05% (tiras 16,17,18). Las tiras se analizaron en 3 concentraciones de Troponina I cardiaca en forma de complejo diluida en una mezcla de plasmas de donantes sanos: 5ng/mL (tiras 1,4,7,10,13,16), 1 ng/mL (tiras 2,5,8,11,14,17) y 0 ng/mL (tiras 3,6,9,12,15 y 18).
Características de ejecución de la prueba inmunocromatográfica de TnI cardiaca
Este ensayo no presentó reactividad cruzada con la TnI esquelética y reconoce a la molécula libre y formando complejo ternario con la troponina C y troponina T cardiaca (Fig. 5). La TnI cardiaca en el daño miocárdico es predominantemente liberada en forma de complejo. La TnI cardiaca en forma libre es la de menor porcentaje de liberación debido a que se encuentra en menor proporción en el equilibrio establecido con las otras formas moleculares de la TnI cardiaca (complejo binario C-I y complejo terciario C-T-I).
Fig. 5. Cardioespecificidad de la prueba inmunocromatográfica elaborada en el laboratorio de detección de Troponina I cardiaca en plasma. la prueba inmunocromatográfica A) corresponde a 4 ng/mL de Troponina I cardiaca en forma de complejo terciario; la B), a la mezcla de plasmas de donantes sanos y la C), a 100 ng/mL de Troponina I cardiaca natural purificada. La Troponina I esquelética natural purificada se aplicó a 2000 ng/mL (D), 200 ng/mL (E) y 20 ng/mL (F). Todos los analitos fueron diluidos en una mezcla de plasmas de donantes sanos.
El inmunoensayo obtenido en el laboratorio detecta 1 ng/mL ó mayor de TnI cardiaca en forma de complejo terciario en plasma debido a que la señal de 0,5 ng/mL no fue vista por los 3 observadores (Fig. 6). No existió diferencia en el límite de detección de la TnI cardiaca entre el inmunocromatográfico elaborado en el laboratorio y el comercial Cardiac STATusä. La señal específica del sistema inmunocromatográfico preparado en el laboratorio presentó mayor área que el sistema inmunocromatográfico Cardiac STATus™, eso no significa que el primero tenga mayor sensibilidad que el segundo. La señal del primer sistema es una mancha semiredondeada más ancha y la del segundo sistema es una delgada línea.
Fig. 6. Comparación del límite de detección de Troponina I cardiaca entre el sistema inmunocromatográfico preparado en el laboratorio y el cardiac STATusä. Las columnas blancas corresponden a la concentración de 0 ng/mL, las columnas con puntos a 0,5 ng/mL, las columnas con rayas verticales a 1 ng/mL, las columnas con rayas horizontales a 2 ng/mL y las columnas cuadriculadas a 4 ng/mL de Troponina I cardiaca en forma de complejo terciario en una mezcla de plasmas de donantes.
Debido a que es un inmunoensayo de doble sitio en un solo paso existe la posibilidad de una saturación de los sitios de unión del anticuerpo conjugado al oro, provocando que altas concentraciones de TnI cardiaca en forma de complejo terciario no sean detectadas (efecto prozona). Ese efecto sería origen de falsos negativos. Se aplicaron concentraciones mayores de TnI cardiaca en forma de complejo terciario hasta 300 ng/mL y se detectó la señal específica. Esas concentraciones añadidas de TnI cardiaca en forma de complejo terciario a muestras de donantes sanos son un 53% mayor al promedio de las concentraciones reportadas en el pico de liberación de TnI cardiaca en pacientes con IAM (22). A concentraciones mayores de TnI cardiaca en forma de complejo terciario se observó la señal más rápidamente y más fuerte (Fig. 7). Esa rapidez de la señal a concentraciones superiores del analito también sucedió en el experimento del límite de detección de TnI cardiaca con el inmunoensayo Cardiac STATus™ en las concentraciones analizadas.
Fig. 7. Percepción visual en el tiempo de la señal del sistema inmunocromatográfico preparado en el laboratorio a partir de aplicada la mezcla de donantes sanos con diferentes concentraciones de Troponina I cardiaca en forma de complejo terciario. El nivel de percepción visual 0 corresponde a una señal no visible; el 1, a una señal débilmente visible; el 2, a una señal visible y el 3, a una señal fuertemente visible. Las columnas blancas corresponde al intervalo de concentración de 0,9 a 1 ng/mL, las columnas con puntos, de 2 a 3 ng/mL, las columnas con rayas verticales, de 4-9 ng/mL y las columnas cuadriculadas, de 75 a 300 ng/mL.
Evaluación clínica retrospectiva de la prueba inmunocromatográfica de la TnI cardiaca
Los 76 pacientes con IAM tuvieron un promedio de edad de 59 años (33-85 años) y un peso promedio de 69 Kg (49-85 Kg), eran de ambos sexos, 31 de ellos recibieron tratamiento trombolítico en un período de 30 minutos hasta 9 horas del inicio del dolor en el pecho. En la Tabla I se muestran las características clínicas fundamentales de las muestras de pacientes con IAM no-Q e IAM Q, solamente se encontró una diferencia significativa entre ellas. Las concentraciones de TGO fueron mayores en los pacientes con IAM de tipo Q que no-Q. Las complicaciones de los pacientes con síndrome coronario agudo encontradas fueron: arritmias, hipotensión arterial, insuficiencia aguda coronaria, choque cardiogénico, aumento de la extensión del infarto de miocardio, edema agudo de pulmón, neumonía, isquemia cerebral transitoria y muerte.
TABLA I
COMPARACIÓN DE LAS CARACTERÍSTICAS CLÍNICAS DE LOS PACIENTES
CON INFARTO AGUDO DEL MIOCARDIO (IAM) DE TIPO Q CON RESPECTO A LOS DE TIPO NO-Q
| Características | Pacientes con | Pacientes con |
| Número de pacientes | 66 | 10 |
| Edad | 59,0 (12) | 58,8 (13)ns |
| Tiempo de inicio del dolor | 46,7 (39) | 40,2 (24)ns |
| % de pacientes complicados | 28,8 (18-40) | 20 (0 - 45)ns |
| Creatina quinasa | 1296,4 (1590) | 1591,0 (2155)ns |
| Isoforma MB de la creatina quinasa | 27,9 (20) | 21,2 (8)ns |
| Transaminasa Glutámico Oxalacética | 155,6 (170) | 99,1 (63)* |
| Lactato deshidrogenasa | 1293,1 (1147) | 1033,2 (455)ns |
Los datos representan la media aritmética (DS). ns: no significativo. * diferencia significativa para una p<0,05.
La Tabla II muestra que la sensibilidad clínica del ensayo inmunocromatográfico preparado en el laboratorio fue mayor que el comercial en el intervalo de 6 h a 24 h de inicio del dolor en el pecho donde se encontró diferencias significativas. En los intervalos de 25 h a 148 h se detectó TnI cardiaca en los dos ensayos de manera similar. También ambos ensayos presentaron una sensibilidad clínica para detectar IAM de tipo no-Q de 70%. Todos los pacientes con IAM que presentaron complicaciones en esos intervalos de tiempo –17 pacientes con IAM tipo Q y un paciente con IAM tipo no-Q– fueron detectados en el inmunoensayo elaborado en el laboratorio. Mientras que el ensayo comercial no detectó señal en uno de los pacientes complicados con el IAM tipo Q. La diferencia entre los dos ensayos en la detección de infarto de tipo Q en el intervalo de 6 h a 24 h no influyó significativamente en la detección global de la necrosis miocárdica entre los dos sistemas. En ambos sistemas inmunocromatográficos hubo una menor sensibilidad clínica para diagnosticar el IAM de tipo no-Q con respecto al IAM de tipo Q, algo similar sucedió con los niveles de actividad enzimática de la TGO entre los dos grupos de pacientes con IAM. Aunque esa diferencia en la sensibilidad clínica del CARDIAC STATusä no fue significativamente diferente para ambos grupos de pacientes con IAM, si lo fue en la sensibilidad clínica del inmunocromatográfico elaborado en el laboratorio y en la actividad enzimática de la TGO. Los 3 falsos negativos en el inmunoensayo cualitativo comercial tuvieron los 3 criterios de la OMS para el diagnóstico del IAM; siendo positivos para las enzimas CK y TGO. Uno de ellos tuvo complicaciones clínicas con las concentraciones de TnI cardiaca detectadas en un inmunoensayo que cuantifica la TnI cardiaca en plasma elaborado en el laboratorio y los otros 2 presentaron valores negativos de TnI cardiaca en ese inmunoensayo cuantitativo. Cuando se aumentó el tamaño de la muestra a evaluar por el sistema inmunocromatográfico preparado en el laboratorio a 113 plasmas, pertenecientes a 66 de pacientes con IAM de tipo Q; la sensibilidad clínica promedio de la prueba en los diferentes intervalos de tiempos desde inicio del dolor en el pecho para muestras de pacientes con IAM de tipo Q aumentó a 95,8% (con un intervalo de confianza al 95% de 92% a 99%). Se obtuvo una sensibilidad clínica del 100% en el intervalo de 6 h a 24 h de inicio del dolor en el pecho para 37 plasmas de 30 pacientes con IAM de tipo Q. La sensibilidad clínica de este sistema inmunocromatográfico osciló entre el 90,9% y el 95,4% en los intervalos de tiempos: 25-48 h, 49-72 h y 73-148 h, cuando el número de plasmas evaluados en esos 3 intervalos de tiempos estuvo entre 21 y 35 de 16 a 33 pacientes con IAM de tipo Q.
TABLA II
COMPARACIÓN DE LA SENSIBILIDAD CLÍNICA DE DOS ENSAYOS INMUNOCROMATOGRÁFICOS, UNO ELABORADO EN EL LABORATORIO Y EL CARDIAC STATUS PARA LA DETECCIÓN DE TROPONINA I CARDIACA EN PACIENTES CON INFARTO AGUDO DEL MIOCARDIO (IAM)
| Formas clínicas | IAM Q | IAM | IAM | ||||
| 6 - 24 | 25 - 48 | 49 - 72 | 73 -148 | Subtotal | |||
| Total de pacientes Total de muestras | 17 18 | 15 16 | 12 12 | 10 10 | 44 56 | 10 14 | 54 70 |
| Ensayo del laboratorio Muestras positivas Sensibilidad (%) (IC) | 18 100 | 13 84,2 (66-100) | 10 85,7 (66-100) | 9 90,9 (73-100) | 50 90,3 (82-98) | 8 70* (46-94) | 58 85,4 (77-94) |
| Cardiac STATus Muestras positivas Sensibilidad (%) (IC) | 15 85,7* (69-100) | 13 | 10
| 9 | 47 86,1 (77-95) | 8 | 55 82,3 (73-91) |
* diferencias significativas para una p<0,05 entre los dos ensayos inmunocromatográficos o entre las dos formas clínicas para un inmunoanálisis. IC: intervalo de confianza al 95%.
En la Fig. 8 se muestra la comparación de las variables clínicas de los dos sistemas inmunocromatográficos en el diagnóstico de IAM para una muestra de 70 plasmas de 54 pacientes con IAM y 19 plasmas de igual número de donantes sanos. Se aumentó el número de muestras a evaluar con el sistema inmunocromatográfico elaborado en el laboratorio a 127 plasmas de 76 pacientes con IAM y 50 plasmas de igual número de donantes sanos. No se encontraron diferencias significativas en las variables clínicas analizadas entre los dos sistemas inmunocromatográficos. El ensayo comercial Cardiac STATus™ presentó una especificidad clínica de un 100% y el sistema inmunocromatográfico realizado en el laboratorio, 90,4% debido a la presencia de 2 falsos positivos. Esos 2 falsos positivos se probaron en el sistema inmunocromatográfico elaborado en el laboratorio con el conjugado CBTnI.16-oro coloidal de 40 nm de Ted Pella y no se eliminó la señal positiva. Sin embargo, esas dos muestras dieron negativas a TnI cardiaca cuando fueron evaluadas por el inmunoanálisis de cuantificación de TnI cardiaca elaborado en el laboratorio que usa los mismos anticuerpos CBTnI.16 y 19C7-biotinilado. Esos anticuerpos en ese inmunoanálisis enzimático cuantitativo de TnI cardiaca se incuban con el plasma al mismo tiempo. Ambos sistemas inmunocromatográficos presentaron un valor predictivo negativo muy bajo con respecto a las demás variables clínicas. El valor predictivo negativo para el análisis inmunocromatográfico preparado en el laboratorio fue 61,3% y para el Cardiac STATus™ fue 55,9%. La eficiencia diagnóstica para la prueba inmunocromatográfica preparada en el laboratorio fue 86,4% y para el Cardiac STATus™: 85,6%. El valor predictivo negativo aumentó significativamente a 80,6% y la eficiencia diagnóstica a 92,6% en el inmunocromatográfico preparado en el laboratorio cuando se aumentó el tamaño de la muestra de la poblaciones de donantes sanos y de los pacientes con IAM y dentro de esta última, fundamentalmente aquella con IAM de tipo Q. El inmunoanálisis preparado en el laboratorio debe ser evaluado con un número de muestra mayor de pacientes con IAM de tipo no-Q y de otras muestras representativas de pacientes con angina inestable aguda y pacientes con dolor en el pecho de causa no cardiaca para profundizar en las posibilidades de esta prueba rápida de TnI cardiaca en el diagnóstico de necrosis miocárdica.
Fig. 8. Comparación de las variables clínicas entre los sistemas inmunocromatográficos de un solo paso para la detección de Troponina I cardiaca Cardiac STATus™ (columnas blancas)con respecto al preparado en el laboratorio (columnas con puntos) en el diagnóstico de 70 plasmas de pacientes con IAM y 19 plasmas de donantes sanos. Se presentan esas variables clínicas del sistema inmunocromatográfico elaborado en el laboratorio cuando se evalúan 127 muestras de plasmas de pacientes con IAM y plasmas de donantes sanos (columnas con rayas verticales). La abreviatura SC corresponde a sensibilidad clínica; EC, especificidad clínica; VPP, valor predictivo positivo; VPN, valor predictivo negativo y ED, eficiencia diagnóstica. Las barras representan el intervalo de confinza al 95%.
DISCUSIÓN
La ausencia de pasos de lavados y de sustratos; la reducción del tiempo total del ensayo; la no necesidad del uso de equipamiento (agitadores de placas, incubadoras y lectores electrónicos de placas de ELISA) y la realización de las incubaciones a temperatura ambiente (22-25°C) son algunas características que garantizan la obtención de los resultados de los ensayos inmunocromatográficos de flujo lateral de un solo paso para la detección de TnI cardiaca en las unidades de cuidados coronarios al lado del paciente en un tiempo menor de 1 hora; conjuntamente con la utilización de plasma o sangre total como matriz biológica. La utilización del plasma en el inmunoensayo elaborado en el laboratorio nos garantiza una manipulación más rápida de la muestra de sangre y un reporte más rápido del resultado que cuando se usa suero, a pesar que en este último caso las concentraciones de TnI cardiaca tienden a ser mayores.
Las existencias de falsos positivos en los inmunoensayos de doble sitio pueden ser debido a factores dependientes o no de la muestra. Entre los factores no dependientes de las muestras están: los anticuerpos a utilizar no presenten reactividad cruzada con otro analito, el punto isoeléctrico del anticuerpo de captura y el pH de funcionamiento del sistema, la concentración del anticuerpo de recubrimiento, el uso de un preservativo inadecuado o el exceso de sales en el recubrimiento, la calidad del coloide de oro usado para conjugar, el conjugado del AcM con el oro está dañado o reacciona inespecíficamente con el recubrimiento y la ausencia de detergentes en el inmunoensayo (23). Con respecto a los anticuerpos utilizados en este ensayo no presentaron reactividad cruzada cuando se añadieron concentraciones de TnI esquelética que corresponde a 10 000 veces las concentraciones del limite de referencia normal de este analito en sangre de donantes sanos y a 80 veces superior a la concentración que se ha reportado en pacientes con enfermedad muscular degenerativa (24). Las demás factores fueron estudiados y una vez corregidos influyeron en la eliminación de algunos falsos positivos en el ensayo rápido; excepto dos que no fueron radicados ni con el conjugado del AcM con el oro coloidal de Ted Pella. Entre los problemas de interferencia dependiente del plasma están: el detritus de eritrocitos hemolizados en la extracción de sangre (25), la presencia de anticuerpos anti-IgG de ratón o del factor reumatoide, los restos de fibrina y los metabolitos, las drogas y otras sustancias con reactividad cruzada. La existencia del factor reumatoide puede presentarse en la población normal, donde la positividad del factor es de un 4% en menores de 60 años y puede llegar a un porcentaje mayor en personas que sobrepasen esa edad (26). La prevalencia de anticuerpos anti-IgG de ratón en grupos de donantes sanos ha sido reportado oscilar desde 0,72% para una muestra de 10 000 casos a 76% para una muestra de 67 casos (27). Las 2 muestras con resultados falsos positivos no tuvieron signos visuales evidentes de hemólisis. Estos son elementos que deben ser estudiados en detalle con el ensayo rápido desarrollado en el laboratorio, ya que pueden ser responsables de errores en el diagnóstico.
El tiempo de vida útil de los sistemas inmunocromatográficos depende sobretodo de la estabilidad de las moléculas de anticuerpos que tienden a ser inactivadas por los cambios en la conformación estructural durante la deshidratación y el almacenamiento. En la prevención de la inactivación de los anticuerpos se han utilizado algunos estabilizantes como son: proteínas, suero animal o humano, aminoácidos, azúcares y polímeros. En este trabajo usamos azúcares (sacarosa y trehalosa) y los polímeros estabilizantes de enzimas (el PVP K 90® y el Viscarín®). La trehalosa fue el reactivo que aportó mayor estabilidad. Se plantea que cuando una proteína es deshidratada en presencia de trehalosa, las moléculas de agua unidas en la estructura proteica por puentes de hidrógeno son evaporadas y los sitios son reemplazados por el azúcar manteniendo la conformación estructural intacta (28).
Ha sido descrita la posibilidad de que la TnI cardiaca en forma de complejo terciario disminuya las diferencias en los límites de detección o umbrales de corte entre 5 diferentes estuches comerciales de cuantificación de TnI cardiaca que utilizan diferentes patrones propios, que incluyen las formas purificadas natural y recombinante de la TnI cardiaca libre o formando complejo después de ser reconstituida in vitro con la troponina T cardiaca y la troponina C (29). En nuestro trabajo la TnI cardiaca en forma de complejo terciario como material de calibración eliminó la diferencia en los límites de detección de los dos inmunoensayos cualitativos utilizados. El límite de detección reportado para el ensayo comercial de Spectral Diagnostic es ligeramente mayor que el inmunoanálisis elaborado en el laboratorio (1,5 ng/mL vs. 1 ng/mL).
Las concentraciones de TnI cardiaca determinadas a través de un inmunoensayo cuantitativo con un límite de detección de 0,09 ng/mL en los períodos de 0 a 4 h, de 5 a 11 h y de 12 a 23 h después de la presentación del dolor en el pecho en los pacientes con elevación del segmento electrocardiográfico ST (n= 60) no presentaron diferencias significativas con una p > 0,5 con respecto a los que no tuvieron elevados ese segmento electrocardiográfico (n= 29) (30), aunque se observó una tendencia hacia concentraciones de TnI cardiaca más baja en el último grupo de pacientes. Para los 2 sistemas inmunocromatográficos de flujo lateral para la detección de TnI cardiaca con un límite de detección de 1 ng/mL del presente trabajo se encontró una mayor sensibilidad clínica entre los pacientes con el signo electrocardiográfico de onda Q con respecto a los pacientes sin ese signo electrocardiográfico. En uno de los sistemas inmunocromatográficos esa diferencia en la sensibilidad clínica entre los dos grupos de pacientes con IAM fue significativa (p < 0,05) al igual que la actividad enzimática de la TGO. En este resultado puede haber influido el umbral de corte de TnI cardiaca empleada (1 ng/mL y no 0,09 ng/mL) y el pequeño tamaño de la muestra de los pacientes con IAM no Q que no se pudo comparar con el otro grupo de pacientes en diferentes intervalos de tiempo después del inicio de los síntomas. Sería de interés la determinación de las concentraciones de las troponinas cardiacas (T o I) que pudieran coexistir en los pacientes con IMA con elevación del segmento ST, IAM Q e IAM no Q con vista a que las concentraciones de esos analitos pudieran servir como una guía en la implantación del tratamiento trombolítico en los pacientes con síndrome coronario agudo.
Los dos sistemas inmunocromatográficos de un solo paso evaluados para la detección de TnI cardiaca tuvieron una aparición de la señal más rápida a medida que la concentración de TnI cardiaca en forma de complejo en el plasma es mayor. Algunos autores sugieren que esa información se tenga en cuenta a la hora de valorar el pronóstico del paciente con síndrome coronario agudo. La rapidez en que aparece la mancha en la prueba es un elemento subjetivo en el que influye las condiciones de lectura de la prueba (cuerpo de guardia con mucho trabajo asistencial, realización simultánea de varias pruebas, las condiciones de iluminación, etcétera) y del personal que realiza la lectura: las enfermeras de las unidades de cuidados coronarios producen mayor número de falsos negativos que los técnicas de laboratorio (31). Por otra parte, la realización de la lectura de este tipo de prueba con un fotómetro como el utilizado en este artículo aumentaría los costos en su compra, el gasto de tiempo en los entrenamientos y en el mantenimiento y control de la calidad de los instrumentos accesorios con vista a garantizar su funcionamiento confiable y la alta calidad de los resultados. Se puede definir mejor la relación costo -beneficio de los análisis realizados al lado de la cama del paciente de tipo cualitativo con respecto a los análisis cuantitativos del laboratorio central no sólo por la disminución de la estadía de los pacientes en los hospitales (6) sino, que al establecer el diagnóstico urgente de esta entidad, se ayuda a la toma de decisiones con respecto a la conducta terapéutica más adecuada e inmediata para el paciente. Otro aspecto a tener en cuenta al evaluar el beneficio de esta magnitud bioquímica consiste en la limitación que impone la TnI cardiaca en el diagnóstico rápido de la necrosis en el síndrome coronario agudo, porque se comienza a detectar en plasma y suero a partir de las 3 h si el umbral de corte es de 0,1 ng/mL y los pacientes llegan como promedio a los hospitales estudiados a las 2 h y 42 min, por lo que el diagnóstico usando este marcador cardioespecífico en los primeros momentos puede ser negativo.
Se debe evaluar el impacto de este tipo de análisis realizables al lado de la cama del paciente en la toma de decisiones médicas y desde el punto de vista financiero a través de estudios prospectivos, donde su introducción se compara con las estrategias establecidas en el diagnostico bioquímico del IAM en los laboratorios satélites presente en las unidades de cuidados coronarios o intensivos de los hospitales estudiados. Se puede valorar si la TnI cardiaca que es una magnitud bioquímica cardioespecífica de larga duración en la sangre después de la necrosis miocárdica pudiera sustituir la lactato deshidrogenasa y la TGO como enzimas no cardioespecíficas de larga duración. La TGO se comienza a elevar desde las 8 a 12 h del inicio del dolor en el pecho, presenta un pico a las 24 h y regresa al intervalo de referencia a los 4 y 7 días (32) y la lactato deshidrogenasa aparece desde las 8 a 12 h, presenta un pico a las 48 h y regresa al intervalo de referencia entre los 6 y 10 días (33). Así como, se debe seleccionar el umbral de corte para el diagnóstico de esta enfermedad en que la sensibilidad diagnóstica garantice detectar aquellos pacientes con síndrome coronario agudo en la primeras 24 h ó 48 h de evolución que se puedan complicar a corto y largo plazo y qué concentraciones de TnI cardiaca pudieran estar relacionada con una aceptada implantación del tratamiento trombolítico u otra medida terapéutica.
Este artículo describe el desarrollo y la evaluación preliminar de una prueba inmunocromatográfica para la determinación cualitativa de TnI cardiaca en muestras de plasmas de pacientes con IAM con una nueva pareja de anticuerpos. Los dos sistemas inmunocromatográficos de un solo paso para la detección de TnI cardiaca usados en este trabajo con un límite de detección similar diagnostican bien una necrosis miocárdica cualitativamente importante, pero no a pacientes con áreas de necrosis miocárdica menor y signos electrocardiográficos no concluyentes. Se debe continuar la evaluación del análisis de un solo paso desarrollado en el laboratorio con otros grupos de pacientes con dolor en el pecho de causa cardiaca o no, qué sustancias pueden interferir en sus resultados y definir el límite de detección más adecuado de TnI cardiaca teniendo en cuenta las normas de diagnóstico de esta enfermedad en las salas de cardiología y laboratorios de cuidados coronarios o intensivos de las instituciones médicas seleccionadas para el estudio.
AGRADECIMIENTOS
Agradecemos al personal técnico de laboratorio y de enfermería de las Unidades de Cuidados Coronarios de los Hospitales Hermanos Ameijeiras, y CIMEQ y del Instituto de Cardiología y Cirugía Cardiovascular por suministrar las muestras de los pacientes ingresados y al personal técnico del laboratorio SUMA del Banco de Sangre del municipio de Marianao por suministrar las muestras de donantes sanos. Los autores dan las gracias a la Dra. Viviana Falcon Cama por la determinación del diámetro de la partícula de oro coloidal a través de la microscopia electrónica.
REFERENCIAS
1. Dirección Nacional de Estadística del Ministerio de Salud Pública de Cuba. Mortalidad de 1998. Anuario estadístico de salud 1999: 21-62. [ Links ]
2. Mainet D, del Rosario M, Toruncha A, Prats P, Valenzuela C, López Saura P. Similar, more than 6 months persisted, antibody and neutralizing activity responses in patients with acute myocardial infarction treated recombinant or natural streptokinase. Fibrin Proteol 1998; 12 (5): 301-309. [ Links ]
3. Hsu LF, Koh TH, Lim YL. Cardiac marker point of care testing: Evaluation of rapid on-site biochemical marker analysis for diagnosis of acute myocardial infarction. Ann Acad Med Singapore 2000; 29: 421-427. [ Links ]
4. Morrow DA, Antman EM, Tanasijevic M, Rifai N, de Lemos JA, McCabe CH, Cannon CP, Braunwald E. Cardiac troponin I for stratification of early outcomes and the efficacy of enoxaparin in unstable angina: a TIMI-11B substudy. J Am Coll Cardiol 2000; 36: 1812-1817. [ Links ]
5. Bosker G, Robinson DJ, Jerrard DA. Acute Myocardial Infarction: Laboratory assessment and stabilization. Consultado 18 agosto 2003. dirección electrónica: http://www.clinicalconsensusreports.com/Secure/articles/Textbook/60_acuteMI.htm. [ Links ]
6. Collinson PO. The need for a point of care testing: an evidence-based appraisal. Scand J Clin Lab Inv 1999; 59(Suppl 230): 67-73. [ Links ]
7. Hamm CW, Brita UG, Heeschen C, Kreymann G, Berger J, Meinertz T. Emergency room triage of patients with acute chest pain by means of rapid testing for cardiac Troponin T or Troponin I. N Engl J Med 1997; 337: 1648-1653. [ Links ]
8. Keffer JH. The cardiac profile and proposed practice guideline for acute ischemic heart disease. Am J Clin Pathol 1997; 107 (4): 398-409. [ Links ]
9. Wu AHB, Feng YJ, Moore R, Apple FS, McPherson PH, Buechler KF, Bodor G. Characterizacion of cardiac troponin subunit release into serum after acute myocardial infarction and comparison of assays for troponin T and I. Clin Chem 1998; 44(6): 1198-1208. [ Links ]
10. Wu AHB, Feng YJ, Contois JH, Pervais S. Comparison of mioglobin, creatine kinase, and cardiac Troponin I for diagnosis of acute myocardial infarction. Ann Clin Lab Sci 1996; 26(4): 291-300. [ Links ]
11. Zaninotto M, Altinier S, Lachin M, Carraro P, Plebani M. Fluoroenzimometric method to measure cardiac troponin I in sera of patients with myocardial infarction. Clin Chem 1996; 42(9): 1460-1466. [ Links ]
12. Collinson PO, Wiggins N and Gaze DC. Clinical evaluation of the ACS:180 cardiac troponin I assay. Ann Clin Biochen 2001; 38: 509-519. [ Links ]
13. Lars-Peter K, Hannsjörg B, Schweigert R, Hafner G, Prellwitz W, Neumeier D. Evaluation of a rapid, quantitative cardiac Troponin I immunoassay. Eur J Clin Chem Clin Biochem 1997; 35(5): 399-404. [ Links ]
14. Mainet González D, Sorell Gómez L, Pichardo Díaz D, Reyes Acosta O, Torres Cabrera MB, Abdo Cuza A, y col. Evaluación de un inmunoensayo rápido de cuantificación de Troponina I cardiaca en el diagnóstico de infarto agudo del miocardio. Rev Quím Clín 2003; 22(6): 419-430. [ Links ]
15. Katrukha AG, Bereznikova AV, Filatov VL, Esakova TV, Kolosova OV, Pettersson K, Lovgren T, Bulargina TV, Trifonov IR, Gratsianski NA, Pulkki K, Voipio Pulkki LM, Gusev NB. Degradation of cardiac troponin I: implication for reliable immunodetection. Clin Chem 1998; 44(12): 2433-2440. [ Links ]
16. De Mey DJ: The preparation and use of gold probes.In Polak JM, Van Noorden S, eds, Immunochemistry. 2nd ed. Bristol Wright PSG. 1986: 1150. [ Links ]
17. DiScipio RG. Preparation of colloidal gold particles of various sizes using sodium borohydride and sodium cyanoborohydride. Anal Biochem 1996; 236: 168-170. [ Links ]
18. Beesley J. "Colloidal Gold. A new perspective for cytochemical marking": Royal Microscopical Society Handbook No 17. Oxford Science Publications. Oxford University Press. 1989. [ Links ]
19. Brada D, Roth J. "Golden blot"-detection of polyclonal and monoclonal antibodies bound to antigens on nitrocellulose by protein A-gold complexes. Anal Biochem 1984; 142(1): 79-83. [ Links ]
20. Gunter RG. Rational use of polymers, surtactants in dry reagent test systems. Course about theory and practice of rapid immunodiagnostic test; 1999 May 12-13; Milan, Italy: Biodot and Schleicher & Schuell, 1999. [ Links ]
21. Jones KD. "Troubleshooting protein binding in nitrocellulose membranes, Part 1: Principles". IVD Technology 1999; 5(2): 32-41. [ Links ]
22. Bodor GS, Porter S, Landt Y, Ladenson JH. Development of monoclonal antibodies for an assay of cardiac troponin I and preliminary results in suspected cases of myocardial infarction. Clin Chem 1992; 38: 2203-2214. [ Links ]
23. Chandler J, Robinson N, Whiting K. Handling false- signals in gold. based rapid tests. IVD Technology 2001; March: 34. [ Links ]
24. Takahashia M, Leea L, Qinweia S, Gawada Y, Jackowskia G. Use of Enzyme Immunoassay for measurement of skeletal Troponin-I utilizing isoform-specific monoclonal antibodies. Clin Biochem 1996; 29(4): 301-308. [ Links ]
25. Wenk RE. Mechanism of Interference by hemolysis in immunoassays and requirements for sample quality. Clin Chem 1998; 44(12): 2554. [ Links ]
26. Roca Goderich R, Smith Smith VV, Paz Presilla E, Lozada Gómez J, Pérez Paz HM, Serret Rodríguez B y col. Artritis Reumatoidea. En Temas de Medicina Interna Tomo III. Editorial Pueblo y Educación. Ciudad de La Habana 1985: 43-53. [ Links ]
27. Kricka LJ. Human anti-animal antibody interferences in immunological assays. Clin Chem 1999; 45(7): 942-956. [ Links ]
28. Se Hwan P, Seung Hwa L, Joung-Hwan C and young-Sang K. Development of rapid one-step immunochromatographic assay. Methods 2000; 22: 53-60. [ Links ]
29. Katrukha AG, Bereznikova AV, Pettersson K. New approach to standardization of human cardiac troponin I. Scand J Clin Lab Invest 1999; 59(suppl 230): 124-127. [ Links ]
30. Apple FS, Anderson FP, Collinson PO, Jesse RL, Kontos MC, Levitt MA, Miller EA, Murukami MM. Clinical evaluation of the first medical whole blood,. point-of-care testing device for detection of myocardial infarction. Clin Chem 2000; 46(10): 1604-1609. [ Links ]
31. Schouten Y, de Winter RJ, Gorgels JPMC, Koster RW, Adams R, Sanders GT. Clinical evaluation of the CARDIAC STATus™, a rapid immunochromatographic assay for simultaneous detection of elevated concentrations of CKMB and myoglobin in whole blood. Clin Chem Lab Med 1998; 36(7): 469-473. [ Links ]
32. Roca Goderich R, Smith Smith VV, Paz Presilla E, Lozada Gómez J, Pérez Paz HM, Serret Rodríguez B y col. Cardiopatía isquémica. En Temas de Medicina Interna Tomo I. Editorial Pueblo y Educación. Ciudad de La Habana 1985: 267-81. [ Links ]
33. Wong SS. Strategic utilization of cardiac markers for the diagnosis of acute myocardial infarction. Ann Clin Lab Sci 1996; 26: 301-312. [ Links ]












 uBio
uBio