Investigación Clínica
versión impresa ISSN 0535-5133versión On-line ISSN 2477-9393
Invest. clín v.47 n.3 Maracaibo sep. 2006
Efectos del cadmio sobre el parénquima ovárico en ratones albinos suizos.
Adonías Lubo-Palma1, Carmen Nava-Leal2, Víctor Villasmil2, Ana Luisa Quevedo1, María Montiel1, David Simoes3 y Clarisa Faría2.
1Instituto de Medicina del Trabajo e Higiene Industrial, 2Cátedra de Histología y Embriología, Facultad de Medicina, 3Facultad de Ciencias Veterinarias, Universidad del Zulia. Maracaibo, Venezuela. Correo electrónico: alupalma@latinmail.com
Resumen. Con el objeto de determinar el efecto del cadmio sobre el parénquima ovárico, se realizó un estudio experimental en 27 ratones albino suizo hembras, sanas, durante 50 días bajo condiciones controladas de laboratorio. Veintiuno de ellas escogidas al azar se distribuyeron en tres grupos (B,C,D), con igual número de individuos y se expusieron respectivamente a 50, 100 y 150 partes por millón de cloruro de cadmio por vía oral, mediante agua ad libitum y se compararon con el grupo control A, constituido por los congéneres restantes. A partir de la tercera semana se observaron en las expuestas cambios progresivos físicos y de comportamiento como coloración amarillenta del pelo, caída del mismo, oscurecimiento del color de los ojos, hipotonía, flacidez muscular, irritabilidad, agresividad e indiferencia. Al comparar los preparados histológicos ováricos de expuestos y controles mediante examen de microscopía óptica, previo sacrificio, se encontró en los expuestos a nivel del epitelio, proliferación, proyecciones a manera de dedo, hiperplasia, degeneración y necrosis; en la corteza, aumento del número de folículos atrésicos, disminución del número de folículos en diferentes etapas de maduración, desorganización, edema y disminución del número de cuerpo amarillo, en la zona ínterfolicular áreas de desorganización, edema y necrosis, principalmente en los preparados del grupo D y en la médula, congestión, hiperemia y gran vasodilatación sanguínea tendente a la hemorragia. Debido a que los efectos se fueron acentuando a medida que aumentaba la concentración de cloruro de cadmio, estos resultados pueden interpretarse como producto de la acción tóxica de la sal suministrada.
Palabras clave: Cadmio, ovario, efectos tóxicos.
Effects of cadmium on the ovarian parenchyma in Swiss albino mice.
Abstract. The aim of this work was to evaluate the effects of cadmium on the ovarian parenchyma. An experimental study was designed with 25 Swiss albino mice (healthy females) living 50 days under controlled laboratory conditions. For the experimental group, 21 mice were selected at random and divided into 3 groups (B, C, and D) of 7 animals each; thereafter they were exposed, respectively, to 50, 100 and 150 ppm of cadmium chloride dissolved in water offered ad libitum. They were compared with the control group A (6 remaining mice). Beginning on week three, physical and behavioral changes were observed: darkening of the eyes, yellowish discoloration of hair, flaccid and hypotonic muscles, irritability, aggressiveness and indifference. Ovaric histological findings were compared among the groups through optic microscopy and they were the following in cadmium exposed mice: 1) in the epithelium, proliferation, finger-like projections, hyperplasia, degeneration and necrosis; 2) in the ovary cortex, increased numbers of atresic follicles, decreased number of follicles in different stages of maturation, disorganization, edema and decreased number of yellow bodies; 3) in the interfollicular zone, areas of disorganization, edema and necrosis, mainly in the samples belonging to group D; 4) in the ovaric medulla, congestion, hyperemia and large sanguineous vasodilatation tending to haemorrhage. Since these effects increased with increasing concentrations of cadmium chloride, we may conclude that cadmium chloride is a highly toxic agent on the ovaric parenchyma of Swiss albino mice.
Key words: Cadmium, ovary, toxicity.
Recibido: 28-01-2005. Aceptado: 16-02-2006.
INTRODUCCIÓN
El cadmio es uno de los cinco metales más tóxicos presentes en la naturaleza, no es un elemento esencial para el hombre y cuando se encuentra en los tejidos biológicos es por exposición ocupacional y/o ambiental. Sus numerosas aplicaciones industriales y su capacidad de combinación con otros elementos metálicos (Zn, Pb) favorece la ocurrencia de la contaminación ambiental laboral y general, por no existir procesos para reciclarlo, siendo liberado al ambiente, originando deterioro de las condiciones del medio, particularmente en aquellas zonas industriales en las cuales existe una utilización masiva del mismo, dadas sus características fisicoquímicas (1-7).
En la industria, el cadmio tiene cada vez más aplicaciones y los trabajadores que laboran con él o con los minerales que lo contienen están expuestos a su acción tóxica, la cual debe ser prevenida por ser uno de los contaminantes ambientales considerado como riesgo químico importante en la producción de alteraciones sistémicas a nivel respiratorio, digestivo, cardiaco, renal, óseo, urogenital y hemático en los individuos expuestos (8-18).
Estudios realizados en animales de experimentación evidencian efectos deletéreos en diferentes órganos de los especimenes expuestos (2, 19-21). También, se han reportado estudios in vitro e in vivo, en diferentes animales de experimentación (ratas, hámster dorado) en los cuales los ovarios han sido expuestos a diversos compuestos de cadmio, con la finalidad de evidenciar los efectos sobre la producción de las hormonas reguladoras del ciclo ovárico y la esteroidogénesis específica de la gónada, presentándose alteraciones en la reproducción como mortinatos e infertilidad, entre otros (15, 20-22). Sin embargo, en la literatura exhaustivamente revisada, no se han encontrado estudios donde se reporten cambios del parénquima ovárico en animales expuestos a cualquier compuesto del metal.
El proceso industrial que se realiza en nuestro país requiere la utilización de elementos como el cadmio que pueden ser potencialmente tóxicos para los trabajadores, quienes generalmente desconocen los riesgos que pueden ocasionar esos materiales mediante el deterioro creciente de las condiciones ambientales de los puestos de trabajo y por consiguiente de la calidad de vida.
Siendo conocida la gravedad de las alteraciones ocasionadas por la exposición ocupacional y ambiental a cadmio y existiendo pocos reportes a nivel nacional y regional sobre las consecuencias que trae dicha exposición en el hombre, se hizo necesario realizar un estudio experimental en ratones albino suizo expuestos a este riesgo químico, como método importante para determinar las modificaciones histológicas que suceden en el parénquima ovárico inducidos por cadmio para establecer la correspondiente correlación a fin de proteger a la mujer.
El propósito del presente trabajo de investigación fue determinar mediante microscopía óptica, el efecto tóxico del cadmio sobre el parénquima ovárico de los ratones albino suizo expuestos experimentalmente a diferentes concentraciones de cloruro de cadmio, establecer la correlación entre la exposición a cadmio con las alteraciones del parénquima ovárico y extrapolar los resultados obtenidos a las posibles consecuencias sobre la especie humana.
MATERIAL Y MÉTODO
Se seleccionaron al azar 27 ratones albinos suizos hembras de 21 días de nacidas, destetadas, sanas, con una talla media de 15,13 cm y un peso medio de 28,88 g.Los mencionados especímenes fueron mantenidos durante los 50 días del experimento en un ambiente acondicionado a una temperatura promedio de 28°C, permaneciendo a la sombra durante el día y en la oscuridad durante la noche. Se identificaron mediante cortes en las orejas y se distribuyeron en cuatro grupos (A, B, C y D), colocando un número de 3 y 4 ratones en jaulas metálicas provistas de bebederos de vidrio, con tapa de goma y pitillos de cobre y acero inoxidable.
El Grupo A o Grupo control, estuvo constituido por 6 hembras, los grupos B, C y D fueron conformados por 7 hembras cada uno, a los que se les suministró cloruro de cadmio en el agua a una concentración de 50, 100 y 150 ppm respectivamente.
Durante el estudio, cada hembra tuvo una hoja de seguimiento con los siguientes datos: fecha de inicio de la administración de la solución de cloruro de cadmio, talla y peso al inicio de la experiencia, signos físicos como diarrea, deshidratación, cambios en la coloración del pelo, convulsiones, coma y muerte, cambios en la conducta como agresividad, aislamiento y movimientos bruscos, entre otros, fecha de finalización del experimento.
Al final del período de experimentación, sobrevivieron todas las hembras de los grupos mencionados. Estas fueron anestesiadas y sacrificadas en número de 4 por día, hasta completar la totalidad.
Se tomaron muestras de ovario para microscopía óptica, las cuales se disecaron inmediatamente realizando cortes sagital y transversal y fueron colocadas en envases plásticos con tapas de rosca, previamente rotulados, que contenían formaldehído al 10%, tamponado con buffer fosfato 0,1 M a un pH de 7,6 durante 3 a 5 días para su fijación; luego fueron deshidratados en concentraciones crecientes de alcohol isopropílico puro, aclaradas con xilol, infiltradas e incluidas en parafina hasta la confección e identificación del bloque. Posteriormente, se realizaron cortes por duplicado de 4 a 6 micras de espesor, mediante un microtomo rotatorio, Jung Heideberg, y fueron colocados en baño de maría para su extensión y fijación en láminas porta-objetos, para ser coloreados con hematoxilina-eosina (H/E) y ácido peryódico-reactivo de Schiff (PAS), procediendo luego al montaje del cubre objeto con Martex.
Las preparaciones histológicas de ovario de los diferentes grupos de ratones se examinaron al microscopio óptico y las muestras seleccionadas se fotografiaron mediante un fotomicroscopio Zeis II, utilizando objetivos de 2,5X, 10X, 25X, 40X.
RESULTADOS
Finalizado el experimento sobrevivieron los 27 ratones iniciales, 6 del Grupo A y 21 de los Grupos B, C y D. En los expuestos a 50, 100 y 150 ppm de cloruro de cadmio, se determinó mediante la observación, una serie de cambios físicos como hipotonía y flacidez muscular, pérdida y pigmentación amarillenta del pelo y oscurecimiento y opacidad del color rojo de los ojos, además se observó cambio en el comportamiento como inquietud, agresividad e indiferencia. Ambas modificaciones se presentaron progresivamente a partir de la 3ª semana en la mayoría de la población expuesta, acentuándose al término de la exposición sobre todo en los grupos C y D, correspondientes a las concentraciones de 100 y 150 ppm de cloruro de cadmio, respectivamente.
Al examen microscópico de los preparados histológicos de ovario de los ratones control y expuestos se encontraron los siguientes resultados:
1) Ovario de ratones control: epitelio simple cúbico, conservado con características típicas y bien conformado en toda su extensión. Así mismo, se observó que la corteza lucía bien estructurada y en casi todos los cortes se contaron entre 13 y 15 folículos en diferentes etapas del desarrollo, algunos primordiales, otros en vías de maduración, otros maduros, algunos rotos, otros transformándose en cuerpo amarillo y entre 3 y 4 cuerpos lúteos formados. En la mayoría de los folículos se observó el ovocito primario, sólo en raras excepciones no se visualizó el ovocito primario, lo que se interpretó como atresia folicular. La medula estaba bien conformada con numerosos vasos sanguíneos y abundante cantidad de tejido fibroconectivo, no existiendo límites precisos entre la corteza y la medula (Fig. 1), confirmándose la estructura histológica normal del ovario de los ratones control.
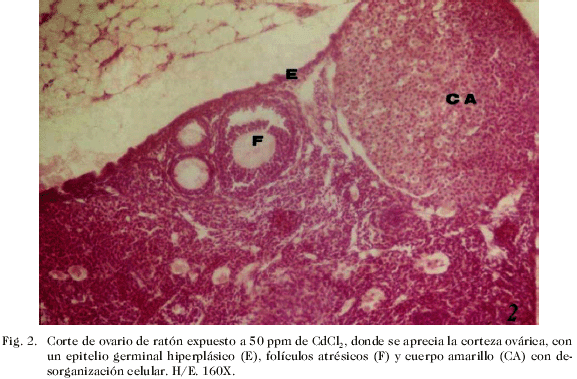
2) Ovario de ratones expuestos a 50 ppm de cloruro de cadmio: epitelio superficial generalmente bien constituido y conformado, desprendido en algunas regiones y en otras con ligera proliferación celular que tendía a la estratificación, lo que se interpretó como hiperplasia, en otros sitios lucía desorganizado por completo, probablemente era el lugar de ruptura para la expulsión del gameto. En la corteza se determinó la presencia de numerosos folículos en diferentes etapas del desarrollo, pero en la mayoría de los casos el número de folículos (10-12) fue menor que en el grupo control, algunos folículos se observaron con desorganización celular, otros se atresiaron en su desarrollo (no presentaban el ovocito primario), asimismo, se observó que continuaban su proceso de crecimiento folicular, maduraban, se rompían y se transformaban en cuerpo amarillo los cuales se evidenciaron con desorganización de células granulosoluteínicas y ligero edema (Fig. 2); mientras que la medula lucía, ligeramente edematosa, evidenciando congestión e hiperemia de algunos vasos con dilatación tendente a la hemorragia. Sin embargo, a pesar de la ligera desorganización observada, la medula mostraba abundante tejido fibro-conectivo (Fig. 3).
3) Ovario de ratones expuestos a 100 ppm de cloruro de cadmio: aumento y dilatación del espacio periovárico como también proliferación o hiperplasia del epitelio superficial en algunas áreas, aunque en otras lucía degenerado y roto, probablemente en los sitios de ruptura para la expulsión del gameto (Fig. 4).
En la corteza el número de folículos fue menor, disminución que se evidenció al contar en los cortes observados de 8 a 10 folículos (Fig. 5).
Además la degeneración y el edema intersticial fue más notable y por consiguiente mayor que en el caso anterior, algunos folículos se mostraban degenerados con abundante edema y disgregación celular; así mismo, se evidenciaron escasos cuerpos amarillos (1-2) (Fig. 6).
La medula lucía edematosa con vasos sanguíneos muy dilatados con marcada tendencia a la hemorragia (Fig. 7).
4) Ovario de los ratones expuestos a 150 ppm de cloruro de cadmio: degeneración epitelial, hiperplasia tendente a formar proyecciones a manera de dedos dentro del espacio periovárico (Fig. 8), áreas de necrosis y ruptura epitelial (Fig. 9).
La corteza con menor número de folículos (7-9) en diferentes etapas de su desarrollo, evidenció una disminución más acentuada que en los grupos anteriores; también se determinó mayor número de folículos atrésicos, además escasos cuerpos amarillos (1-2) y la medula muy edematosa con exagerada dilatación vascular (Fig. 10), en la cual se identificaron áreas de hemorragia y trombosis de pequeños vasos.
También se observa atrofia, degeneración, desorganización y daño del tejido ovárico (Fig.11).
DISCUSIÓN
Al analizar los resultados se evidenció que los ratones expuestos al cloruro de cadmio (50, 100 y 150 ppm) durante 50 días, presentaron modificaciones caracterizadas principalmente por cambios en la coloración de la piel, oscurecimiento del color de los ojos, hipotonía y flacidez muscular, caída del pelo y alteraciones en el comportamiento comenzando con irritabilidad, agresividad y finalmente indiferencia.
Así mismo, diferentes autores como Bako y col. (23) en estudios realizados en carcinoma de próstata reportaron que el cadmio presentaba una prolongada vida media y un poder de acumulación alto, lo que puede explicar la toxicidad producida en este caso, por las altas concentraciones de cloruro de cadmio a que fueron sometidos los mencionados especímenes durante 50 días.
En el estudio microscópico de ovario de los ratones expuestos se identificaron cambios en el epitelio, en la corteza y médula. A nivel del epitelio, se observó en los ovarios de los ratones expuestos a mayor concentración de cloruro de cadmio (100 y 150 ppm) ligera proliferación epitelial, que incluso tiende a formar proyecciones a manera de dedos dentro del espacio periovárico, asimismo, degeneración y ruptura del epitelio, probablemente debido a la acción tóxica directa del cloruro de cadmio.
Hallazgos similares han sido reportados por Paksy y col. (24), en un trabajo sobre efectos del cadmio en la morfología y esteroidogénesis de células granulosas de ovario humano cultivadas, donde observaron que el cadmio interfería en las uniones intercelulares y en la adhesión celular, como también, retracción del citoplasma, lo cual puede explicar la tendente degeneración y ruptura del epitelio que se observó en algunos casos; cambios que también pueden explicarse por fenómenos de cicatrización debido a la regeneración del epitelio por la ruptura del mismo durante el fenómeno de ovulación, sin embargo, como éstos fueron observados en corteza y epitelio superficial en ovario de ratones expuestos a 150 ppm de cloruro de cadmio (Fig. 9), se interpreta que se trata de una lesión ovárica producto de la acción tóxica del elemento y no un proceso de cicatrización, por ser la lesión muy grande acompañada de desorganización, edema y necrosis e incluso otros cambios en la misma corteza y médula que pueden confirmar el efecto tóxico, como ha sido sugerido por Lin y col. (18), en un estudio realizado sobre efectos citostáticos y genotóxicos del nitrato de cadmio y plomo en células ováricas de hámster chino, en los cuales observaron daño de diferentes grados sobre la célula, afectando también al núcleo y los cromosomas.
Al comparar los ovarios de controles con los expuestos se observó que en ambos grupos se continuaba produciendo la proliferación y maduración de folículos, por la identificación de folículos en diferentes etapas del desarrollo, primordiales, primarios, secundarios, en vías de maduración y maduros, como también los cuerpos amarillos; sin embargo, existían diferencias entre los grupos. En los expuestos, los folículos presentaron problemas de desorganización celular, edema y una gran mayoría tendía a la paralización de su desarrollo, pues no se observó ovocito I dentro de los mismos, catalogándose entonces como folículos atrésicos.
De igual manera, el número de folículos fue menor en los expuestos que en los controles, pero aún así la transformación en cuerpo amarillo, se siguió observando, lo cual es un indicador de que continúa el proceso biológico, no obstante de las diferencias observadas.
Esta alteración tanto cualitativa como cuantitativa observada en la corteza de ovario de ratones expuestos a diferencia de los controles, se puede interpretar como cambios tróficos en el desarrollo folicular, probablemente debidos a falta de influencia en las hormonas hipotálamo hipofisiario gonadales, lo cual, no sucedió en este caso por cuanto el proceso de crecimiento y maduración folicular continuó desarrollándose.
Posiblemente, esto se debe a un trastorno en la irrigación que originó déficit de oxigenación y produjo las alteraciones que se observaron en el desarrollo folicular, con grandes áreas de desorganización celular, edema y necrosis en la corteza interfolicular y dilatación, congestión, hiperemia de vasos sanguíneos en la médula con tendencia a la hemorragia, lo que demuestra morfológicamente la existencia de un trastorno de tipo circulatorio afectando al ovario.
A nivel de la médula en ovario de ratones expuestos a diferentes concentraciones de cloruro de cadmio, se observó una gran dilatación de los vasos sanguíneos, congestión e hiperemia, trombosis de pequeños vasos y en algunas áreas hemorragia. Como ha sido demostrado por Piasek y col. (25, 26), en sus estudios referentes a los efectos de la exposición aguda de cadmio sobre la esteroidogénesis ovárica en ratas embarazadas y no embarazadas, en el cual reportaron moderada congestión de la teca en ovario de ratas embarazadas.
En resumen, se concluye que la exposición crónica a elevadas concentraciones de cloruro de cadmio produce: 1) Cambios en el aspecto físico y en el comportamiento tales como coloración amarillenta del pelo, caída del mismo, oscurecimiento del color de los ojos, hipotonía y flacidez muscular, irritabilidad, agresividad e indiferencia. 2) Degeneración, hiperplasia y proyección a manera de dedo del epitelio superficial ovárico. 3) Disminución del número de folículos ováricos, desorganización y atresia folicular. 4) Edema, necrosis y desorganización en corteza interfolicular. 5) Dilatación vascular exagerada, congestión e hiperemia con tendencia a la hemorragia en la médula.
REFERENCIAS
1. Bernard A, Lauwerys R, Arled A. Loss of glomerular poyanion correlated with albuminuria in experimental cadmium nephropathy. Arch Toxicol. 1992; 66:272-278. [ Links ]
2. Bernard A, Thiclemens N, Roels, H, Lauwerys R: Association between NAG-B and Cadmium in urine with no evidence of a threshold. Occup Envirom Med 1995; 52:177-180. [ Links ]
3. Cassarett and Doull´s. Toxic effects of metals Cadmium. En Toxicology. The Basic Science of Poisons. Fifth Edition. New York. U.S.A. International Edition. McGraw-Hill. 1996. pp. 699-702. [ Links ]
4. Desoille H, Martí J, Scherrer J, Truhaut R. Factores químicos nocivos. Cadmio. En Medicina del Trabajo. Primera Edición. Barcelona-España. Editorial Masson S.A. 1986. pp. 317-319. [ Links ]
5. La Dou J. Metales. Cadmio. En Medicina Laboral y Ambiental. Segunda Edición. México-México: Editorial El Manual Moderno. 1997. pp. 455-458. [ Links ]
6. Ladrón De Guevara J, Moya V. Cadmio y sus compuestos. En Toxicología Médica. Clínica y Laboral. Primera Edición. Madrid-España: Editorial Interamericana McGraw-Hill. 1995. pp. 161-167. [ Links ]
7. Organización Panamericana de la Salud (OPS). Riesgos Químicos. Cadmio y sus compuestos. En Enfermedades Ocupacionales. Guía para su Diagnóstico. Primera Edición en Español. Washington D.C. EUA Editorial O.P.S. 1986. pp. 204-205. [ Links ]
8. Cotran R, Kumar V, Robbins S. En Patología Estructural y Funcional. Quinta Edición. Madrid-España. Editorial McGraw Hill. 1997. pp. 1-23, 173-204, 240-265, 548-562. [ Links ]
9. Dreisbach R, Roberston W. Envenenamiento por metales. Cadmio. En Manual de Toxicología Clínica. Prevención, Diagnóstico y Tratamiento. Sexta Edición. México-México. Editorial El Manual Moderno, SA. 1998. pp. 211-212. [ Links ]
10. Friis L, Petersson L, Edling C. Reduced Cadmium levels in human kidney cortex in Sweden. Environ Health Perspect 1998; 106(4):175-178. [ Links ]
11. Gavett S, Oberdörster G. Cadmium Chloride and Cadmium Metallothionein induced pulmonary injury and recruitment of Polymorphonuclear leukocytes. Exp Lung Res 1994; 20:517-537. [ Links ]
12. González E. Toxicocinética y Evaluación de riesgos para la salud producidos por la exposición a Cadmio. Medicina y Seguridad del Trabajo. 1998. tomo XXXV. No. 140:3-17. [ Links ]
13. Jamall I, Spowls J. Effects on cadmium and dietary selenium on cytoplasmic and mitochondrial antioxidant defense systems in the heart of rats fet high dietary cooper. Toxicol Appl Pharmacol 1987; 87:102-110. [ Links ]
14. Koop S, Perry H, Perry E, Erlanger M. Cardiac physiologic and tissue metabolic changes following chronic low-level cadmium and cadmium plus lead ingestion in rat. Toxicol. Appl. Pharmacol. 1983. 69: 149-160. [ Links ]
15. Lars L, Persson B, Gustaf C. Blood Cadmium as an indicator of dose in a long term follow up of workers previously exposed to Cadmium. Scand J Work Environ Health.1887; 2:31-36. [ Links ]
16. Lauwerys R. Cadmium and its compounds. En Occupational Medicine Third Edition. St. Louis Missouri 63146. E.U.A. Editorial Mosby. 1994. pp. 481-485. [ Links ]
17. Lauwerys R, Raels H, Bernard A, Buchet J. Significance of Cadmium concentration in blood and urine in workers exposed to Cadmium. Environ Res 1979; 20:375-391. [ Links ]
18. Lin R, Lee C, Chen W, Lin S. Studies on cytotoxic and genetoxic effects of Cadmium Nitrate and Lead Nitrate in Chinese Hamster ovary cells. Environ Mol Mutagen 1994; 23(2):143-149. [ Links ]
19. Lu F. Carcinogenia. Estudios de Carcinogenia a largo plazo. En Toxicología Básica. Primera Edición. México-México: Editorial Harla. 1992. pp. 119. [ Links ]
20. Martí J, Desoille H. Factores químicos nocivos en el trabajo. Cadmio. En Medicina del Trabajo. Segunda Edición. Barcelona-España. Editorial Masson, S.A. 1993. pp. 213-216. [ Links ]
21. Nava- Leal C, Villalobos H, Faría-Rodríguez C. Alteraciones de la reproducción femenina, inducidas por el metavanadato de amonio en ratón albino suizo. Invest Clin 1998; 39(1):99-122. [ Links ]
22. Nishijo M, Nakagawa H, Morikawa Y, Tabata M, Senma M, Miura K, Takahara H, Kawano S, Nishi M, Mizukoshi K, Kido T, Nogawa K. Mortality of inhabitants in an area polluted by Cadmium: 15 year follow up. Occup Environ Med 1995, 52:181-184. [ Links ]
23. Bako G, Smith E, Hansen J, Dewar R. The geographical distribution on high cadmium concentration in the environment and prostate cancer Aberta. Can J Public Health 1982, 73:96-98. [ Links ]
24. Pasky K, Vargas B, Lazar P. Zinc protection against Cadmium-induced infertility in female rats. Effect of zinc and cadmium on the progesterone production of cultured granulose cell. Biometals 1997; 10(1):27-35. [ Links ]
25. Piasek M, Laskey J. Acute cadmium exposure and ovarian steroidogenesis in cycling and pregnant rats. Reprod Toxicol 1994; 8(6): 495-507. [ Links ]
26. Piasek M, Laskey J. Effect of in vitro Cadmium exposure on ovarian steroidogenesis in rats. J Appl Toxicol 1999; 19(3):211-217. [ Links ]
Autor de correspondencia: Adonias Lubo Palma. Instituto de Medicina del Trabajo e Higiene Industrial, Facultad de Medicina, Universidad del Zulia. Maracaibo, Venezuela. Correo electrónico: alupalma@latinmail.com. Teléfono: (0261) 7781686/ 7597291/7597291












 uBio
uBio