Investigación Clínica
versión impresa ISSN 0535-5133
Invest. clín vol.53 no.4 Maracaibo dic. 2012
Determinación de cobre, magnesio y zinc en leucocitos mononucleares mediante espectrometría de absorción atómica con llama.
Kareem Rahn-Chique, Nereida Carrión y Miguel Murillo.
Centro de Química Analítica, Escuela de Química, Facultad de Ciencias, Universidad Central de Venezuela. Caracas, Venezuela.
Autor de correspondencia: Kareem Rahn-Chique. Actualmente en el Instituto Venezolano de Investigaciones Científicas (IVIC). Centro de Estudios Interdisciplinarios de la Física (CEIF), Carretera Panamericana Km. 11, Apdo. 20632, Caracas, Venezuela. Telf: +58 2125041980. Fax: +58 2125041915. Correo electrónico: krahn@ivic.gob.ve
Resumen.
En este trabajo se evaluó un nuevo microinyector de inyección en flujo para la determinación de Cu, Mg y Zn en células mononucleares de la sangre. Este dispositivo permitió analizar muestras en el orden de microlitros mediante espectrometría de absorción atómica con llama, es fácil de construir y adaptar al inyector convencional del espectrofotómetro de absorción atómica. En la determinación de Cu, Mg y Zn se obtuvieron límites de detección de 106, 65 y 37 µg L–1, respectivamente. En las pruebas de recuperación de estos elementos en leucocitos mononucleares se encontraron porcentajes de recuperación entre 98 y 110%.
Palabras clave: leucocitos mononucleares, elementos traza, microinyector, espectrometría de absorción atómica.
Determination of copper, magnesium and zinc in mononuclear leukocytes by flame atomic absorption spectrometry.
Abstract.
In this paper we evaluated a new micro-flow injector for the determination of the concentrations of Cu, Mg and Zn in mononuclear blood cells. This device analyzed sample volumes in the order of microliters by flame atomic absorption spectrometry; it is inexpensive, and easy to build and to adapt to the conventional injector of the atomic absorption spectrophotometer. Detection limits of 106, 65 and 37 µg L–1 for Cu, Mg and Zn were obtained, respectively. The percentages of recovery tests were found between 98 and 110%.
Keywords: mononuclear leukocytes, trace elements, micro-flow injector, atomic absorption spectrometry.
Recibido: 27-02-2012. Aceptado: 27-09-2012
INTRODUCCIÓN
El cobre, el magnesio y el zinc son elementos traza esenciales involucrados en procesos indispensables en el crecimiento y reproducción de los seres vivos. El cobre está presente en un gran número de enzimas, por lo que las manifestaciones clínicas de su deficiencia están asociadas a fallas enzimáticas (1). Está involucrado en procesos fundamentales como la producción de energía, el metabolismo del oxígeno y del hierro, la maduración de la matriz extracelular y los neuropéptidos, y la señalización neuroendocrina (2). El magnesio es un cofactor para cerca de 300 enzimas que participan en el metabolismo de los alimentos y en la síntesis de muchos productos, así mismo, toma parte en la transmisión y actividad neuromuscular. Interviene en la síntesis de ácidos grasos y proteínas, la fosforilación de la glucosa y sus derivados en las vías glucolíticas y las reacciones transcetolasa (1). El zinc se encuentra en el organismo casi exclusivamente como Zn2+ enlazado a numerosas proteínas celulares. Es el oligoelemento intracelular más abundante (3). Es fundamental para el crecimiento y la diferenciación celular. Su déficit provoca efectos adversos muy pronunciados en los tejidos de rápido recambio celular, en especial, el sistema inmunitario (4). Los niveles de los elementos traza en el cuerpo humano se han estudiado con el propósito de relacionar las deficiencias de estos elementos con enfermedades crónicas y mala absorción (5-15). Los valores de concentración de estos elementos en eritrocitos, plasma y suero, conducen a conclusiones contradictorias con respecto a los niveles intracelulares, especialmente en enfermedades metabólicas como la diabetes mellitus (9, 16-20). Kruse-Jarres y col. (9), han indicado que la evaluación de los niveles de los elementos traza en células sanguíneas puede ser más útil para relacionarlos con una patología clínica que si son determinados en plasma, debido a que elementos como el zinc y el cobre participan en varios procesos enzimáticos a nivel celular y además el Mg2+ es un catión intracelular (7). Mielcarz y col. (20), sugirieron que los leucocitos podrían ser considerados mejores indicadores de los niveles de los elementos traza que los eritrocitos, el plasma o el suero, porque son células nucleadas homogéneas, además de ser metabólicamente más activas por tener un mayor intercambio de minerales que los eritrocitos (21) y por su estrecha relación con el sistema inmunológico.
La literatura sobre la determinación de Cu, Mg y Zn en leucocitos mononucleares, es reducida. De ellos, el Mg ha sido el más estudiado en esta matriz. Se ha determinado por espectrometría de absorción atómica con llama (EAA-LL) (7, 11-13, 22), por activación de neutrones (INAA) (23) y espectrofotometría de fluorescencia atómica (6, 8). El Cu (9, 13, 14, 21, 24) y el Zn (9, 13, 21, 25) han sido determinados por espectrometría de absorción atómica con horno de grafito (EAA-HG).
Debido a que la EAA-LL requiere de volúmenes en el orden de los mililitros de muestra para determinar la concentración de un elemento, se han desarrollado algunos dispositivos de inyección de flujo para analizar muestras de bajo volumen (26, 27). En este trabajo se diseñó un microinyector en flujo y se optimizaron las condiciones experimentales para la determinación de Cu, Mg y Zn en muestras de leucocitos mononucleares.
MATERIALES Y MÉTODOS
Materiales
Todos los reactivos utilizados fueron de grado analítico: buffer fosfato salino (PBS) (pH 7,4 a 25 °C); Ficoll® 400 tipo 400; Tritón X-100 (Sigma); Uromirón 300 mgI mL–1 (Schering AG); heparina sódica 1000 unidades mL–1 (Farmionni Scalpi); ácido nítrico (HNO3) 65% v/v (Riedel de Häen); solución patrón 1g L–1 de Zn (Fixanal ®); solución patrón de 1 g L–1 de Cu y Mg (Fluka Chemic); peróxido de hidrógeno (H2O2) 35% p/v (Riedel de Häen) y agua desionizada 18 W cm–1.
Instrumentación
Las medidas de absorbancia fueron realizadas con un espectrofotómetro de absorción atómica con llama (GBC Scientific Equipment, modelo Avanta P, Australia) bajo las condiciones instrumentales mostradas en la Tabla I y empleando una llama acetileno/aire. Se usó una bomba peristáltica (Instrument S.A. modelo PETEC). Se utilizó una centrífuga (IEC Centra modelo GP8R) para la separación de los leucocitos mononucleares. El conteo celular se realizó con un microscopio (Zeiss ICS model Standard 25) empleando una cámara de Neubauer.
TABLA I. CONDICIONES INSTRUMENTALES DE LECTURA DE LA ABSORBANCIA
| Condiciones Instrumentales | Cu | Mg | Zn |
| Longitud de onda, nm | 324,7 | 285,2 | 213,9 |
| Ancho de banda espectral, nm | 0,2 | 0,5 | 0,5 |
| Intensidad de la lámpara, mA | 5 | 3 | 5 |
| Rango Lineal, µg mL–1 | 0,1-2,0 | 0,1-1,0 | 0,1-1,5 |
Dispositivo de introducción de muestras
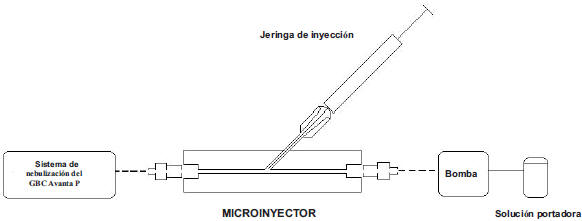
Debido al bajo volumen de muestras de células mononucleares (1 mL) que se obtiene de una muestra de 10 mL de sangre, se diseñó un microinyector en flujo cuyo esquema se muestra en la Fig. 1. El microinyector se insertó en el capilar del nebulizador del espectrofotómetro a fin de permitir la inyección de microlitros de muestras. Constó de un cilindro de nylon con un conducto central de un milímetro de diámetro, al cual se le incorporó un canal lateral de acero inoxidable formando una “Y”. Este canal se insertó perforando el cilindro principal de nylon y fijándolo con pegamento. Por este canal se introdujeron las soluciones con una inyectadora de 1 mL de capacidad (Hamilton, USA) a través de un septo ubicado en uno de los extremos del canal de acero inoxidable. El canal central del cilindro principal transportaba la solución portadora (agua desionizada) impulsada por una bomba peristáltica, con el objeto de mantener un flujo de solución constante. A ambos lados del dispositivo, se colocaron conectores de plástico que permitieron la inserción de mangueras a través de las cuales circulaban las soluciones de entrada y de salida del dispositivo. Para mayor información, en la Fig. 2 se muestra una foto del dispositivo conectado al espectrofotómetro de absorción atómica de llamas.
Fig. 1. Esquema del microinyector en flujo para la introducción de la muestra en el espectrofotómetro.
Fig. 2. Foto del microinyector conectado al nebulizador del equipo de AA-LL.
Preparación de reactivos
La solución de Ficoll® se preparó a partir de 11,25 g de Ficoll® 400 y diluyéndolos en un volumen de 125 mL de agua desionizada. Esta solución se mantuvo durante 24 horas a una temperatura de 4°C a fin de solubilizar el sólido. Sobre esta solución, se añadieron de 18 a 20 mL de solución contrastante de Uromiron hasta ajustar la densidad de la solución final a un valor de 1,077 g mL–1. Esta solución se mantuvo refrigerada a 4°C hasta su uso. Las soluciones patrones fueron preparadas por diluciones sucesivas de una solución de 1g L–1 de cada elemento. Los rangos de los patrones de calibración para Cu, Mg y Zn fueron 0,1-2; 0,1-1 y 0,1-1,5 µg mL–1 respectivamente; conteniendo HNO3 al 0,1% p/v y Triton X-100 al 0,5% p/v.
Muestras
Las muestras de sangre fueron recolectadas de donantes voluntarios del Servicio de Endocrinología del Hospital José María Vargas (Caracas, Venezuela). A cada donante se le extrajeron 20 mL de sangre completa en tubos recolectores que contenían 0,5 mL de heparina sódica como anticoagulante.
Procedimiento de separación de leucocitos mononucleares de sangre completa
La separación de leucocitos mononucleares se realizó mediante el gradiente de densidad generado por el Ficoll® (28). Una vez obtenido el botón celular de leucocitos mononucleares, se procedió a eliminar los glóbulos rojos residuales agregando 1 mL de agua desionizada y dejándolo reposar durante 40 segundos a 25°C, induciendo de esta manera la ruptura de la membrana celular. Seguidamente se adicionaron 3 mL de PBS a la suspensión celular, se centrifugó a 1400 rpm durante 10 minutos a 4°C y posteriormente se desechó el sobrenadante. Este último proceso se repitió tres veces, para finalmente obtener el botón de leucocitos mononucleares limpio, el cual fue suspendido en 5 mL de solución PBS. De esta suspensión se realizó el conteo celular. Una vez finalizado esto, la suspensión fue centrifugada a 1400 rpm durante 10 min a 4°C y se extrajo el sobrenadante para conservar el botón celular a –10°C hasta su análisis.
Digestión de la muestra de leucocitos mononucleares
El botón de leucocitos mononucleares fue descongelado dejándolo a temperatura ambiente (25°C). Este cambio brusco de temperatura facilitó la ruptura de la membrana celular y con ello la liberación de los componentes contenidos dentro de ellas. Esta ruptura celular dejó residuos sólidos suspendidos en las muestras, por lo que fue necesario tratarlas con 20 µL de H2O2 (35% p/v) por 24 horas hasta obtener una solución homogénea. Pasado este tiempo, se añadieron 200 µL de Tritón X-100 al 0,5% p/v. Posteriormente, la muestra fue llevada hasta un volumen final de 1 mL con agua desionizada. El Cu fue determinado directamente en esta solución, mientras que para el análisis de Mg la muestra fue diluida 10 veces y para el Zn 3 veces.
Optimización de las variables operacionales
Las variables operacionales consideradas fueron las siguientes: tiempo de lectura, modo de lectura, flujo de solución portadora (velocidad de aspiración del nebulizador), volumen de inyección y efecto del flujo forzado con bomba peristáltica. Dichas variables fueron optimizadas de manera univariada, utilizando patrones acuosos de 1 µg mL–1 para Cu y 0,4 µg mL–1 para Mg y Zn. Para optimizar cada una de las variables se tomó en cuenta tanto la sensibilidad (magnitud de la señal de absorbancia) como la reproducibilidad de los resultados, medida como desviación estándar relativa (RSD) de cinco (5) determinaciones.
Análisis estadístico
Consistió en el cálculo del promedio y de la desviación estándar de cinco (5) determinaciones. La significancia estadística de diferencias entre valores promedios fue calculada con la prueba t de Student. Las pruebas que resultaron con p<0,05 fueron consideradas significativas. La reproducibilidad fue evaluada por medio de la desviación estándar relativa (RSD). La exactitud fue estudiada mediante pruebas de recuperación, ya que no se encontró un material certificado de este tipo de muestras para validar el método. Se calculó la concentración característica (Co) para cada uno de los elementos, como un parámetro de evaluación de la sensibilidad del método. La evaluación del efecto matriz se hizo comparando los valores de la concentración de Cu, Mg y Zn en una muestra de leucocitos mononucleares obtenida por el método de adición de estándar y el método de calibración directa. Los límites de detección (LOD) fueron determinados a partir de tres curvas de calibración de cada uno de los elementos empleando el método descrito por Miller y Miller (29) tomando en cuenta la ecuación:
![]() (1)
(1)
donde yB es la señal del blanco determinada a partir del valor de la ordenada al origen del ajuste de regresión lineal y sB es calculado como el dato estadístico, sy/x.
 (2)
(2)
Aquí el término ![]() representa los residuales de y y n es el número de mediciones realizadas.
representa los residuales de y y n es el número de mediciones realizadas.
RESULTADOS
Optimización de las condiciones operacionales del microinyector
Modo de lectura: Se ensayaron dos modos de lectura: altura de pico y área de pico. Se observó una señal de absorbancia completa para realizar una lectura confiable a los 5 y 7 segundos, respectivamente.
Flujo de solución portadora (Velocidad de aspiración del nebulizador): En la Fig. 3 se presenta la señal de absorbancia de 50 µL de soluciones patrón de 1 µg mL–1 de Cu, y 0,4 µg mL–1 para Mg y Zn en función del flujo de solución portadora. Este flujo fue modificado variando la velocidad de aspiración del nebulizador. Se encontró que para el Cu la señal de absorbancia no varió significativamente al modificar el flujo de solución portadora, mientras que para el Mg y el Zn se obtuvo una máxima absorbancia a un flujo a partir del cual la señal comenzó a descender suavemente. Además, se observó que la reproducibilidad de la señal disminuyó a medida que aumentó este flujo, llegando a ser superiores al 5% de RSD. Se seleccionó el flujo de 3,60 mL min–1, ya que con este flujo se obtuvo una buena señal de absorbancia junto con una alta precisión (RSD < 3%) para los tres elementos.
Fig. 3. Efecto del flujo de solución portadora sin bomba peristáltica sobre la señal de absorbancia del Cu, Mg y Zn.
Influencia del modo de lectura en la señal de absorbancia: En la Tabla II se presentan las medidas promedios de absorbancia en los modos de altura y área de pico. Se observó una mayor señal con el modo de área de pico. Para el Cu y el Mg ambos modos de lectura fueron igualmente reproducibles a diferencia del Zn que presentó una mejor reproducibilidad en modo de área de pico.
TABLA II. ESTUDIO DE LAS VARIABLES INSTRUMENTALES SOBRE LA SEÑAL DE ABSORBANCIA
| Cu | Mg | Zn | ||||
| Modo de lectura | Absorbancia | RSD (%) | Absorbancia | RSD (%) | Absorbancia | RSD (%) |
| Altura de pico | 0,012 | 2 | 0,048 | 1 | 0,046 | 12 |
| Área de pico | 0,028 | 2 | 0,167 | 3 | 0,086 | 2 |
| Volumen de muestra (µL) | Absorbancia | RSD (%) | Absorbancia | RSD (%) | Absorbancia | RSD (%) |
| 25 | 0,012 | 11 | 0,077 | 4 | 0,045 | 3 |
| 50 | 0,028 | 5 | 0,164 | 4 | 0,086 | 2 |
| 100 | 0,058 | 3 | 0,342 | 2 | 0,169 | 2 |
| Inyección de la muestra | Absorbancia | RSD (%) | Absorbancia | RSD (%) | Absorbancia | RSD (%) |
| Con bomba | 0,047 | 2 | 0,096 | 7 | 0,097 | 4 |
| Sin bomba | 0,028 | 4 | 0,104 | 2 | 0,080 | 5 |
RSD: desviación estándar relativa. Número de determinaciones: 5.
Influencia del volumen de inyección en la reproducibilidad de la señal: En la Tabla II se observa que en general se obtuvo una mejor precisión a mayor volumen de inyección. Para el Mg y el Zn aún con 25 µL de solución se obtuvo una buena reproducibilidad. Para el Cu se deben utilizar al menos 100 µL para obtener una reproducibilidad aceptable, debido a que exhibió una menor sensibilidad.
Uso de la bomba peristáltica para impulsar la solución portadora: En la Tabla II se presenta la señal de absorbancia con y sin el uso de la bomba peristáltica. Para el Cu y el Zn se logró una mejor sensibilidad y reproducibilidad con el uso de la bomba peristáltica. En el caso del Mg, no existieron diferencias significativas en la señal de absorbancia con o sin bomba peristáltica, sin embargo, la reproducibilidad disminuyó con el uso de ésta.
En la Tabla III se sumarizan las condiciones óptimas para la determinación de Cu, Mg y Zn con el microinyector.
TABLA III. CONDICIONES EXPERIMENTALES ÓPTIMAS PARA LA DETERMINACIÓN DE Cu, Mg Y Zn CON EL MICROINYECTOR EN FLUJO ACOPLADO AL EQUIPO DE EAA-LL
| Condiciones operacionales | Cu | Mg | Zn |
| Modo de Lectura | Área de pico | Altura de pico | Área de pico |
| Tiempo de Lectura, s | 7 | 5 | 7 |
| Flujo de solución portadora, mL min–1 | 3,60 | 3,60 | 3,60 |
| Volumen de Inyección, µL | 100 | 50 | 50 |
| Flujo impulsado con bomba peristáltica, mLmin–1 | 3,75 | N/A | 3,67 |
N/A: No aplica.
Los resultados de la concentración de Cu, Mg y Zn obtenidos por curva de calibración directa y adición del estándar, respectivamente fueron: Cu (182 ± 34; 193 ± 52), Mg (1040 ± 98; 1037 ± 80) y Zn (1350 ± 220; 1400 ± 160) en unidades de µg L–1.
En la Tabla IV se muestran los valores promedios de LOD obtenidos para los tres elementos calculados a partir de tres curvas de calibración y los valores de concentración característica (Co) determinados para cada uno de los elementos. En este último caso, si los comparamos con los valores reportados en el manual de operaciones del equipo (Co*), se puede apreciar que las concentraciones características obtenidas fueron más altas que las reportadas.
TABLA IV. LÍMITES DE DETECCIÓN, CONCENTRACIÓN CARACTERÍSTICA Y ECUACIÓN DE LA CURVA DE CALIBRACIÓN
| Elemento | Co (µg L–1) | Co * (µg L–1) | LOD (µg L–1) | Ecuación de la curva de calibración | R2 |
| Cu | 29 | 25 | 106 | A= 0.056 [Cu] + 0.008 | 0.9987 |
| Mg | 11 | 3 | 65 | A= 0.096 [Mg] – 0.001 | 0.9983 |
| Zn | 45 | 8 | 37 | A= 0.109 [Zn] + 0.008 | 0.9991 |
A: Absorbancia. Co: concentración característica determinada. Co*: concentración característica reportada en el manual de operaciones del equipo.
En la Tabla IV también se muestra una ecuación de la curva de calibración obtenida para cada elemento, además del coeficiente de correlación (R2) correspondiente.
Los factores de recuperación determinados fueron para el Cu (98-108 %), el Mg (104-105%) y para el Zn (104-110%).
Determinación de la concentración de Cu, Mg y Zn en muestras de leucocitos mononucleares
En la Tabla V se muestran los resultados de las concentraciones de Cu, Mg y Zn en muestras de leucocitos mononucleares. En esta tabla se observa una baja reproducibilidad en los niveles de Cu (RSD < 28%),
TABLA V. CONCENTRACIONES DE Cu, Mg Y Zn EN MUESTRAS DE LEUCOCITOS MONONUCLEARES
| Elemento | ID | Concentración de los elementos en células | RSD (%) | ||
| Mcel mL–1 | µg L–1 | ng Mcel–1 | |||
| Cu | M1 | 52,2 | <20 | <0,4 | - |
| M2 | 17,9 | 31 | 1,7 ± 0,5 | 28 | |
| M3 | 15,1 | 33 | 2,2 ± 0,5 | 22 | |
| M4 | 14,2 | 29 | 2,0 ± 0,5 | 25 | |
| M5 | 35,5 | 98 | 2,8 ± 0,6 | 24 | |
| M6 | 26,6 | <20 | <0, 8 | - | |
| M7 | 15,5 | <20 | <0,13 | - | |
| Mg | M1 | 52,2 | 4180 | 80 ± 1 | 10 |
| M2 | 17,9 | 2920 | 163 ± 15 | 8 | |
| M3 | 15,1 | 1750 | 116 ± 11 | 10 | |
| M4 | 14,2 | 2110 | 149 ± 22 | 15 | |
| M5 | 35,5 | 4790 | 86 ± 10 | 12 | |
| M6 | 26,6 | <100 | 4 | - | |
| M7 | 15,5 | 740 | 48 ± 2 | 4 | |
| Zn | M1 | 52,2 | 725 | 14 ± 1 | 8 |
| M2 | 17,9 | 267 | 15 ± 2 | 11 | |
| M3 | 15,1 | <100 | <7 | - | |
| M4 | 14,2 | 408 | 29 ± 5 | 16 | |
| M5 | 35,5 | 443 | 13 ± 2 | 12 | |
| M6 | 26,6 | 478 | 18 ± 2 | 10 | |
| M7 | 15,5 | <100 | <6 | - | |
Mcel mL–1: Millón de células por mL de suspensión de leucocitos mononucleares. ng Mcel–1: nanogramo del elemento por millón de células de leucocitos mononucleares.
DISCUSIÓN
En la evaluación de las condiciones operacionales del microinyector, se encontró que factores como el flujo de solución portadora, el volumen de inyección y el uso de una bomba peristáltica fueron los más determinantes en la obtención de una alta reproducibilidad y sensibilidad. En el estudio del flujo de solución portadora, la disminución de la señal y la reproducibilidad con el incremento del flujo observado, posiblemente se debió a un aumento en el régimen de turbulencia cuando se incrementó el flujo, trayendo como consecuencia que la muestra saliera del régimen de difusión a través de la columna de solvente y pasara a un régimen de transición o turbulento. Esto produjo una dispersión de la muestra en la columna del fluido portador, favoreciendo su dilución y en consecuencia, una disminución de la señal y la reproducibilidad. Con respecto al volumen de muestra a inyectar, dependió de la sensibilidad del método para cada elemento. El uso de la bomba peristáltica mejoró la reproducibilidad y sensibilidad del método, debido a que permitió una introducción de la muestra de manera más constante.
Una vez optimizadas las condiciones operacionales del microinyector en flujo, se logró determinar la concentración por triplicado de Cu, Mg y Zn con menos de 1 mililitro de muestra, sin efecto memoria ni interferencias. Esto se ve reflejado en los resultados del análisis estadístico: comparando las concentraciones obtenidas por calibración directa y estándar, se encontró que los valores de p para los tres elementos fueron mayores de 0,05; por lo tanto no hubo diferencias estadísticamente significativas entre ambos métodos. Esto indica que la matriz de la muestra no alteró el comportamiento de los analitos. Por otro lado, se obtuvo una buena linealidad entre la absorbancia y la concentración. Asimismo, los estudios de recuperación realizados presentan porcentajes de recuperación entre 98 y 110%, los cuales están dentro del rango aceptado para este tipo de muestras (30). La determinación de la concentración característica permitió concluir que el uso del microinyector disminuyó la sensibilidad del método debido al efecto diluyente del flujo portador al arrastrar la muestra hacia la llama. A pesar de esta pérdida de la sensibilidad, los LOD obtenidos permitieron la determinación de Cu, Mg y Zn en la matriz de leucocitos mononucleares con buena exactitud y reproducibilidad en un volumen inferior a 1 ml de solución de la muestra, sin la influencia de factores que afecten significativamente al analito durante el procedimiento de tratamiento y medición de las muestras. Las concentraciones determinadas de estos elementos se encuentran en los mismos órdenes de las reportadas en trabajos anteriores para Cu (2, 13, 14, 16, 21), Mg (7, 13, 22, 23) y Zn (9, 13, 14, 16, 25) (Tabla VI). En general, se observó una baja reproducibilidad en la determinación de Cu, lo cual puede atribuirse a los bajos niveles de este elemento en las muestras.
El nuevo microinyector en flujo desarrollado en este trabajo presentó claras ventajas con respecto al modo de inyección convencional usado en espectrometría de absorción atómica con llama: su construcción es muy económica y se puede adaptar a la instrumentación básica del espectrofotómetro de absorción atómica.
AGRADECIMIENTOS
Al FONACIT Proyectos LAB- 1998003690 y G-2001000916, por el financiamiento parcial de este estudio. Los autores desean agradecer la colaboración de los Dres. Leopoldo Duarte y Flanklin Ablan del Departamento de Endocrinología del Hospital Vargas quienes facilitaron la obtención de las muestras de sangre.
REFERENCIAS
1. Mahan LK, Escott-Stump S. Nutrición y Dietoterapia. 9na Ed. México: Krause; 1998. [ Links ]
2. Failla ML, Johnson MA, Prohaska JR. Cobre. En: Conocimientos actuales sobre nutrición. Bowman BA, Russell RM, Eds. 8va. Ed. Washington: Organización Panamericana de la Salud e Instituto Internacional de Ciencias de la Vida; 2003, p 409-419. [ Links ]
3. Williams RJP. Zinc: what is its role in biology?. Endeavour 1984; 8: 65-70. [ Links ]
4. Dibley MJ. Zinc. En: Conocimientos actuales sobre nutrición. Bowman BA, Russell RM, Eds. 8va Ed. Washington: Organización Panamericana de la Salud e Instituto Internacional de Ciencias de la Vida; 2003, p 360-376. [ Links ]
5. Nasli-Esfahani E, Faridbod F, Larijani B, Reza Ganjali M, Norouzi P. Trace elements analysis od hair, nail, serum and urine of diabetes mellitus patients by inductively coupled plasma atomic emission spectroscopy. Iranian J Diabetes Lipid Dis. 2011; 10: 1-9. [ Links ]
6. Delva P, Degan M, Trettene M, Lechi A. Insulin and glucose mediate opposite intracellular ionized magnesium variations in human lymphocytes. J Endocrinology 2006; 190: 711-718. [ Links ]
7. Thomas J, Millot JM, Sebille S, Delabroise MD, Thomas E, Manfait M, Arnaud MJ. Free and total magnesium in lymphocytes of migraine patients-effects of magnesium-rich mineral water intake. Clin Chim Acta 2000; 295: 63-75. [ Links ]
8. Delva P, Pastori C, Degan M, Montesi G, Brazzarola P, Lechi A. Intralymphocyte free magnesium in patients with primary Aldosteronism. Hypertension 1999; 35: 113-117. [ Links ]
9. Kruse-Jarres JD, Rükgauger M. Trace elements in diabetes mellitus. Peculiarities and clinical validity of determinations in blood cells. J Trace Elem Med Biol 2000; 14: 21-27. [ Links ]
10. Ruiz C, Alegría A, Barberá R, Farré E, Lagarda J. Selenium, Zinc and Cooper in plasma of patients with type I diabetes mellitus in different metabolic control states. J Trace Elem Med Biol 1998; 12: 91-95. [ Links ]
11. Kisters K, R Wealau, Tokmak F, Westermann, Köneke J, Hausberg M, Lang D, Zidek W, Rahn KH. Increased intracellular calcium and decreased intracellular magnesium in lymphocytes as a cell model in the pathogenesis of essential hypertension: a possible calcium magnesium antagonism. Trace Elem Electrolytes 1998; 15: 116-119. [ Links ]
12. Kisters K, Spieker C, Tepel M, Zidek W. Plasma magnesium and total intracellular magnesium on content of lymphocytes in untreated normotensive and hypertensive patients. Trace Elem Electrolytes 1996; 13: 163-166. [ Links ]
13. Rohn RD, Pleban P, Jenkins LL. Magnesium, zinc and copper in plasma components in children with IDDM. Clin Chim Acta 1993; 215: 21-28. [ Links ]
14. Williams NR, Rajput-Williams J, West JA, Nigdikar SV, Foote JW, Howard AN. Plasma, granulocyte and mononuclear cell copper and zinc in patients with diabetes mellitus. Analyst 1995; 120: 887-890. [ Links ]
15. Pidduck HG, Keenan JP, Evans DAP. Leukocyte in zinc in diabetes mellitus. Diabetes 1971; 20: 206-213. [ Links ]
16. Ekmekcioglu C, Prohaska C, Pomazal K, Steffan I, Schernthaner G, Marktl W. Concentrations of seven trace elements in different hematological matrices in patients with type 2 diabetes as compared to healthy controls. Biol Trace Elements Res 2001; 79: 205-219. [ Links ]
17. MacRury SM, Gordon D, Wilson R, Bradley H, Gemmell CG, Paterson JR, Rumley A, MacCuish AC. A comparison of different methods of assessing free radical activity in type 2 diabetes and peripheral vascular disease. Diabet Med 1993; 10: 331-335. [ Links ]
18. Car N, Car A, Granic M, Skarabalo Z, Momcilovic B. Zinc and copper in the serum of diabetic patients. Biol Trace Elem Res 1992; 32: 325-329. [ Links ]
19. Pai LH, Prasad AS. Cellular zinc in patients with diabetes mellitus. Nutr Res 1988; 8: 889-897. [ Links ]
20. Mielcarz G, Howard AN, Mielcarz B, Williams NR, Rajput-Williams J, Nigdigar SV, Stone DL. Leucocyte copper, a marker of copper body status is low in coronary artery disease. J Trace Elem Med Biol 2001; 15: 31-35. [ Links ]
21. Hinks LJ, Colmsee M, Delves HT. Determination oz zinc and copper in isolated leucocytes. Analyst 1982; 107: 815-823. [ Links ]
22. Reinhart RA, Marx JJ, Haas RG, Desbiens NA. Intracellular magnesium of mononuclear cells from venous blood of clinically healthy subjects. Clin Chem Acta 1987; 167: 187-195. [ Links ]
23. Admans LL, Spyrou NM. The determination of Se, Mg, and Mn concentrations in leukocyte subfractions. J Radioanal Nuc Chem 2004; 209: 441-445. [ Links ]
24. Prohaska C, Pomazal K, Steffan I. ETAAS method for thr determination of Cd, Cr, Cu, Mn and Se in blood fractions and whole blood. Fresenius J Anal Chem 2000; 368: 627-635. [ Links ]
25. Whitehouse RC, Prasad AS, Rabbani PI, Cossack ZT. Zinc in plasma, neutrophils, lymphocytes, and erythrocytes as determined by flameless atomic absorption spectrophotometry. Clin Chem 1982; 28: 475-480. [ Links ]
26. Burguera M, Burguera JL. Recent on-line processing procedures for biological samples for determination of trace elements by atomic spectrometric methods. Spectrochimica Acta Part B 2009; 64: 451-458. [ Links ]
27. Riley C, Rocks BF, Sherwood A. Flow inyection analisys in clinical chemistry. Talanta 1984; 31: 879-888. [ Links ]
28. Bøyum A. Isolation of mononuclear cells and granulocytes from human blood (Paper IV). Scand J Clin Lab Invest 1968; 21 (Suppl 97): 77-89. [ Links ]
29. Miller JC, Miller JN. Estadística para química analítica. 2da. Ed. Wilmington: Addison-Weley Iberoamerican, S. A; 1993, p 100-103. [ Links ]
30. The Royal Society of Chemistry. The use of recovery factors in trace analysis. Parkany M Eds. USA: Organización Internacional para la Estandarización; 1996, p 3-4. [ Links ]












 uBio
uBio