Investigación Clínica
versión impresa ISSN 0535-5133
Invest. clín vol.57 no.2 Maracaibo jun. 2016
Subclasificación de los tipos moleculares de cáncer de mama de acuerdo a la expresión de marcadores inmunohistoquímicos y evolución.
Aldo Reigosa1, David Hardisson2, Francisco Sanz3, Eduardo Caleiras4, Felipe Saldivia5 y Ángel Fernández1.
1 Centro de Investigaciones Médicas y Biotecnológicas de la Universidad de Carabobo. Facultad de Ciencias de la Salud. Universidad de Carabobo. Valencia, Venezuela.
2 Departamento de Anatomía Patológica, Facultad de Medicina, Universidad Autónoma de Madrid, España.
3 Departamento de Biología, Facultad de Ciencias, Universidad Autónoma de Madrid, España.
4 Unidad de Diagnóstico Anatomopatológico. Hospital Metropolitano del Norte. Valencia, Venezuela.
5 Instituto de Oncología Dr. Miguel Pérez Carreño, Valencia, Venezuela.
Autor de correspondencia: Aldo Reigosa. Centro de Investigaciones Médicas y Biotecnológicas de la Universidad de Carabobo. Facultad de Ciencias de la Salud. Universidad de Carabobo. Valencia, Venezuela. Teléfono: +58-0241-8666243. Correo electrónico: aldo.reigosa@gmail.com
Resumen. Los carcinomas de la mama se han clasificado desde el punto de vista molecular en cuatro grupos mayores (Luminal A, Luminal B, HER2 y triple negativo). Sin embargo, estos grupos no son homogéneos y existe la necesidad de establecer subcategorías que puedan ser identificadas mediante inmunohistoquímica (IHQ), para así predecir mejor su pronóstico y llevar a cabo un tratamiento más efectivo. El presente estudio se realizó en 354 pacientes diagnosticadas de carcinoma ductal infiltrante de mama. Se analizó la expresión de 22 moléculas por matrices de tejidos y se compararon los resultados obtenidos con las clases moleculares definidas por IHQ, de acuerdo a la expresión de receptores de estrógeno (RE), receptores de progesterona (RP) y HER2, y con la supervivencia global. Con la clase molecular Luminal A se pueden establecer varios subgrupos de significado pronóstico: el subgrupo con expresión exclusiva de RE y RP, con Ki-67 ≤14%, con mejor pronóstico, y el subgrupo de Luminal A con Ki-67 >14%, o con expresión de otros marcadores relacionados con el fenotipo basal. El grupo Luminal B puede ser dividido en subtipos de acuerdo a la expresión de Ki-67 (punto de corte en el 25%). En la clase HER2, parece importante el índice de Ki-67 para el pronóstico (punto de corte en 25%). La clase de TN puede ser dividida según el índice de proliferación en dos categorías pronósticas, con un mejor pronóstico para aquellos tumores con un índice de Ki-67 ≤25%.
Palabras clave: cáncer de mama; clase molecular; inmunohistoquímica.
Subclassification of the molecular types of breast cancer based on the expression of immunohistochemical markers and evolution.
Abstract. Breast carcinomas have been classified from the molecular point of view into four major groups (Luminal A, Luminal B, HER2 and triple negative). However, these groups are not homogeneous and there is a need to establish subcategories that can be identified by immunohistochemistry (IHC), to better predict prognosis and carry out treatments that are more effective. This study was conducted in 354 patients diagnosed with invasive ductal breast carcinoma. The expression of 22 molecules was analyzed by tissue matrices and the results obtained were compared with molecular classes defined by IHC, according to the expression of estrogen receptor (ER), progesterone receptor (PR) and HER2, and the overall survival. The Luminal A molecular class can set various prognostic subgroups: the subgroup with exclusive expression of ER and PR, with Ki-67 ≤14%, with a better prognosis, and the subgroup of Luminal A with Ki-67> 14% or other expression related to the basal phenotype markers. Luminal B group can be divided into subtypes according to the expression of Ki-67 (cutoff at 25%). In the HER2 class it seems important the Ki-67 index for forecasting (cutoff at 25%). The TN class can be divided according to the rate of proliferation into two prognostic categories, with a better prognosis for tumors with Ki-67 index ≤25%.
Key words: breast cancer; molecular class; immunohistochemistry.
Recibido: 08-12-2015. Aceptado: 03-03-2016
INTRODUCCIÓN
El cáncer de mama representa un problema de salud pública en muchos países desarrollados y en vías de desarrollo. Considerando los dos sexos, es el segundo en frecuencia en el mundo después del cáncer de pulmón. En Venezuela, constituye la primera causa de muerte por cáncer en la mujer, ocupando el segundo lugar el cáncer de cuello uterino (1,2).
Los carcinomas de la mama se han clasificado recientemente desde el punto de vista molecular en cuatro grupos mayores, que presentan un pronóstico y tratamiento muy diferentes. Por tal motivo, el cáncer de mama es considerada una enfermedad heterogénea que presenta una variabilidad sustancial en la evolución de la enfermedad dentro de cada categoría. Generalmente se acepta que los cursos clínicos variados de pacientes con tumores histológicamente semejantes, son el resultado de diferencias moleculares. Se deduce que el análisis molecular detallado del cáncer pudiera aportar información que mejoraría la predicción pronóstica (3).
Perou y col. (4) y Sorlie y col. (5) fueron los primeros en mostrar que los carcinomas mamarios pueden también subdividirse en base al análisis de la expresión génica. Estos estudios determinaron que existían al menos cuatro clases moleculares de cáncer de mama denominadas tipo luminal, tipo basal, tipo parecido a mama normal y tipo HER2 (receptor del factor de crecimiento epidérmico 2) positivo. El tipo parecido a mama normal fue descartado posteriormente de las clases moleculares, al comprobarse que representaba características de tejido normal de la mama y no tejido tumoral (6).
Actualmente, desde el punto de vista inmunohistoquimico (IHQ), se reconocen las clases moleculares Luminal A, Luminal B, HER2 y triple negativo (TN), subdividiéndose esta última clase a su vez en tipo TN basal (TNB) y TN no basal (TNnB), de acuerdo a la expresión de marcadores característicos de células basales tales como la citoqueratina 5/6, p63, el receptor del factor de crecimiento epidérmico 1 (EGFR) y otros (7-12). El pronóstico y sensibilidad a la quimioterapia de los subgrupos moleculares es diferente. El tipo luminal tiende a tener mejor pronóstico que los otros, mientras los tumores tipo basal y HER2 positivos son de peor pronóstico (5,13).
En los últimos años se ha avanzado mucho en la comprensión del origen del carcinoma de mama. La teoría de las células madre cancerosas, los mecanismos de la transformación epitelio-mesénquima y el papel de las células mioepiteliales han aportado información muy valiosa en este sentido y han ayudado a entender mejor el carácter heterogéneo de la enfermedad (14-18).
Numerosos trabajos han confirmado la utilidad de las clases moleculares en cuanto a su capacidad de predecir la evolución y la respuesta a diferentes tratamientos en el cáncer de mama. Sin embargo, es evidente que esas clases moleculares no son grupos homogéneos y que existen grupos híbridos o subtipos con importancia pronóstica y terapéutica, que pueden definirse mediante la IHQ.
Finalmente y considerando que existen subcategorías en las clases moleculares del cáncer de mama, esta investigación tuvo como objetivo general determinar a través de IHQ el perfil de inmunoexpresión de diversos marcadores en el tumor primario, relacionando su expresión con las clases moleculares de carcinoma de mama y la supervivencia global de las pacientes evaluadas, considerando que una mejor caracterización inmunofenotípica de los tumores permitirá avanzar en el establecimiento de diferentes categorías con distinto pronóstico y con ello, un abordaje terapéutico más efectivo.
PACIENTES Y MÉTODOS
Sujetos del estudio
Con la aprobación del Comité de Ética y de la Comisión de Investigación del IOMPC, se conformó una muestra no aleatoria, de tipo intencional, con 354 pacientes, de acuerdo a los siguientes criterios de inclusión: a) diagnóstico de carcinoma ductal infiltrante de mama sin otra especificación, o mixto, con componente ductal predominante y b) disponibilidad de las preparaciones histológicas y bloques de parafina respectivos correspondientes al diagnóstico inicial en el archivo del Servicio de Anatomía Patológica del Instituto.
Construcción de la matriz de tejidos
El bloque receptor (o bloques únicamente de parafina) se colocó en la base del equipo tissuearrayer (estación de trabajo Beecher Instruments, Silver Spring, MD, USA). El tissue arrayer consta de dos agujas de distintos calibre con las que se realiza el troqueleado de los bloques. Con la aguja de mayor calibre se extrae un cilindro de parafina del bloque receptor dejando el espacio donde se introducen los cilindros obtenidos de los bloques donantes. Con la aguja de menor calibre se obtiene el cilindro de 1 mm con el material de la zona marcada del bloque donante que se introduce en el bloque receptor.
Finalmente, se realizaron cortes histológicos de 4 μm en un micrótomo de rotación (Microm HM350S) y cada uno fue recogido en láminas portaobjetos tratadas previamente, para evitar el desprendimiento de los cortes.
Inmunohistoquímica
La desparafinación y la recuperación antigénica se realizaron en el equipo PT Link (Dako) con un buffer Tris-EDTA pH=9 (Dako) a 95°C durante 20 min. Las muestras se lavaron en agua destilada y a continuación en tampón Tris pH=7,4 a temperatura ambiente. Se realizó la incubación con el anticuerpo primario. Las muestras se lavaron en tampón Tris pH=7,4 y se añadió el anticuerpo secundario (Envision, Dako). Por último, las muestras se lavaron en tampón Tris pH=7,4 y se revelaron mediante la aplicación del cromógeno diaminobencidina durante 5 minutos. Con el fin de visualizar los núcleos, se realizó la tinción nuclear con hematoxilina.
Los anticuerpos primarios utilizados, la dilución, clon y fuente se muestran en la Tabla I.
Hibridización in situ fluorescente (FISH)
Para esta prueba se utilizó el kit de PathVysion HER-2. Las secciones histológicas se colocaron en una estufa a 56°C toda la noche. Las secciones sin teñir se desparafinaron en CitriSolv (Vysis), se deshidrataron en etanol al 100% y se secaron al aire. Se procedió entonces a una digestión con proteasa durante 60 minutos, desnaturalización, e hibridización con sondas precalentadas para el gen HER-2 y el centrómero del cromosoma 17 (sonda Her2/neu/CEP17 SG, Vysis) durante toda la noche a 37°C. A continuación se lavaron con tampón de lavado poshibridización a 72°C y se contratiñeron con 4.6-diamidino-2-fenilindol en solución antifade. Por último, se montaron y analizaron en un microscopio de fluorescencia. La tasa de amplificación de HER-2 se determinó mediante el cociente: número de copias de HER-2 (señales rojas)/número de copias de centrómeros (señales verdes). Una tasa >2,2 indica amplificación del gen HER-2, si la tasa es ≤ 2,2 se considera que no hay amplificación.
Interpretación de los resultados del estudio inmunohistoquímico
Para la mayoría de los marcadores se consideró positivo cualquier tipo de inmunoexpresión, refiriendo el resultado como positivo o negativo. En la valoración de las moléculas de adhesión se consideró positiva a la tinción de membrana conservada en más del 50% de las células neoplásicas y negativa cuando la tinción se encontraba ausente o reducida.
La expresión de HER2 se evaluó de acuerdo al patrón establecido en el Kit comercial Herceptest®, por lo que se consideraron positivos los casos con inmunotinción valorada como 3+. En los casos con tinción equívoca (valorados con 2+) se corroboró la amplificación de HER2 mediante FISH. Para la evaluación del EGFR se utilizaron los parámetros del kit PharmDx® utilizado.
Para la cuantificación de Ki-67 (índice de proliferación) se tomaron cuatro microfotografías de cada caso, dos de cada cilindro, en un microscopio Zeiss Axiostar plus, con cámara Canon incorporada y conectada a ordenador con el programa Axiovision. Luego se contaron los núcleos positivos y negativos en cada imagen. Finalmente, se sumaron las cifras de los cuatro contajes y se obtuvo el índice de proliferación como promedio del porcentaje de positividad para cada caso.
El índice de proliferación (Ki-67) se interpretó de la siguiente manera: a) bajo: porcentaje de núcleos positivos de las células tumorales <14%, b) intermedio: porcentaje de núcleos positivos de las células tumorales ≥15% y ≤24% y c) alto: porcentaje de núcleos positivos de las células tumorales >25%.
Con base a los resultados obtenidos del análisis de RE, RP y HER2, y de acuerdo a los criterios aceptados (19-21) se clasificaron los casos como sigue: Luminal A: RE+ RP+; Luminal B: Positivo a RE o RP, independientemente del marcaje de HER2; HER2+: RE- RP- HER2+ y TN: RE- RP- HER2-.
Para el análisis de los casos, se agruparon los 22 marcadores utilizados en cuatro grupos: a) marcadores de la clasificación molecular (ER, PR y HER2), b) marcadores de proliferación celular y otros (EGFR, C-Kit, p63, survivina, ALDH1, CD10 y Ki-67), c) marcadores de filamentos intermedios (CK5/6, CK8/18, CK14, CK17, CK APM y vimentina), d) marcadores de adhesión celular y citoesqueleto (cadherina E, cadherina P, p120, actina de músculo liso, alfa actina y calponina).
Se consideraron como marcadores basales: EGFR, C-Kit, p63, CD10, CK 5/6, CK14, CK17, vimentina, cadherina P, actina de músculo liso, alfa-actina y calponina. Asimismo, los siguientes subtipos para cada clase molecular: Luminal A: a) según grupos de Ki-67 y b) según la expresión de marcadores de tipo basal. Luminal B: a) según grupos de Ki-67, b) según expresión de HER2 y c) según la expresión de marcadores de tipo basal. HER2: a) según grupos de Ki-67 y b) según la expresión de marcadores de tipo basal. Triple negativo: a) según grupos de Ki-67 y b) según la expresión de marcadores de tipo basal.
Análisis estadístico
El análisis de los datos recogidos se realizó mediante el paquete estadístico SPSS versión 19 (IBM Statistical Package for Social Sciences, Inc., Chicago, IL). La asociación entre las clases moleculares y marcadores inmunohistoquímicos se analizó con la prueba de Chi cuadrado y el test exacto de Fisher. El estudio de supervivencia se realizó mediante el método de Kaplan-Meier y el ajuste de modelos de regresión de Cox. Se consideraron significativos valores de p<0,05.
RESULTADOS
La edad media de las pacientes en el momento del diagnóstico fue de 51,28 años, con un rango de 58 años (27-85 años). Un 52% tenían 50 años de edad o menos y un 48% eran mayores de 50 años.
El estadio clínico más frecuente fue el III (58,8%), seguido por el II (33,7%), abarcando entre ambos el 92,5% de los casos. Histológicamente, un 15,5% fue grado I, un 49,7% grado II y un 34,7% grado III.
Se logró obtener el seguimiento de 321 pacientes. El tiempo de seguimiento para las pacientes no fallecidas varió de 36 a 112 meses. Para la supervivencia global (SG) en meses se tomó como punto de corte un seguimiento de 60 meses (5 años), con un mínimo de 36 meses. Se estableció el tiempo de supervivencia como el tiempo transcurrido desde el diagnóstico hasta la fecha de la muerte en caso de haber ocurrido antes de los 60 meses. La SG media en la serie estudiada fue de 46,11 meses, con rango de 58 meses (2 a 60) y desviación típica de ± 16,21 meses.
Un 57,3% de los pacientes fallecieron por la neoplasia a lo largo del seguimiento, mientras que un 42,7% permanecieron vivas durante el lapso del mismo.
Los principales datos clínico-patológicos de las pacientes incluidas en este estudio se detallan en la Tabla II.
En esta serie de 354 tumores, el porcentaje de expresión positiva para RE fue de 57,9% (205 de 354), 49,4% (175 de 354) para RP y 14,7% (52 de 354) para HER2. En base a estos resultados se establecieron las clases moleculares clásicas de acuerdo a los siguientes porcentajes: Luminal A 42,4% (150 de 354), Luminal B 20,3% (72 de 354), HER2 9% (32 de 354) y TN 28,2% (100 de 354).
La expresión de los restantes marcadores, con sus respectivos porcentajes, casos válidos y no valorables (por desgaste del bloque de parafina), se muestra en la Tabla III.
Las Figs. 1 a 5 muestran ejemplos representativos de los patrones de expresión inmunohistoquimica observados en alguno de los marcadores analizados en este estudio.



Análisis de la relación de los marcadores analizados por inmunohistoquímica con las clases moleculares
La expresión de los restantes marcadores (diferentes a RE, RP y HER2), de acuerdo a las clases moleculares, con sus respectivos porcentajes, así como el significado estadístico se muestran en la Tabla IV. Se observa como la expresión de C-Kit, CD10 y la media de Ki-67 para cada clase molecular, presentaron un valor de p<0,05, mientras que la expresión de EGFR, p63, survivina y ALDH-1, no mostraron relación significativa con las clases moleculares.
Además, se aprecia la relación estadísticamente significativa de la expresión de todos los filamentos intermedios analizados, CK5/6, CK8/18, CK14, CK17, CK APM y vimentina con las clases moleculares. Se observa mayor expresión de citoqueratinas relacionadas con las células basales/mioepiteliales, como CK5/6, CK14, CK17 y CK APM en los tumores TN, al igual que la vimentina. La expresión de CK8/18 se presentó en todos los casos Luminal A, 98% de los tumores Luminal B, 96% de los HER2 y 93% de los TN.
En relación a los marcadores de adhesión celular y citoesqueleto, no se evidenció asociación significativa con la expresión de p120 y calponina, mientras si se presentó tal relación con la expresión de cadherina P, la actina de músculo liso y la alfa-actina con los tumores TN. La expresión de cadherina E también se relacionó, aunque en este caso fue la ausencia de expresión, con los tumores de fenotipo TN.
Análisis de la supervivencia en relación a las clases moleculares
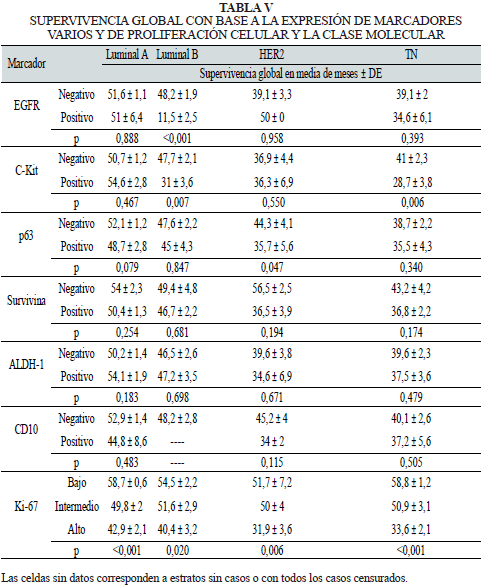
En cuanto a las diferentes clases moleculares, se observó mejor supervivencia para el tipo Luminal A, seguido del tipo Luminal B y prácticamente emparejadas con peor supervivencia los tipos HER2 y TN (Fig 6).
La SG media fue de 51,6 ± 1 meses para la clase Luminal A; de 47,3 ± 1,9 meses para los Luminal B; de 39,5 ± 3,2 meses para la clase HER2 y 38,9 ± 1,9 meses para los TN (p<0,001).
Análisis de la supervivencia en relación a la expresión de marcadores y la clase molecular
Al relacionar la SG en cada clase molecular según la expresión de los diferentes marcadores, se observó una relación de la expresión de EGFR en la clase Luminal B con SG significativamente menor para las pacientes cuyos tumores presentaron ese marcaje; igualmente la expresión de C-Kit en las clases Luminal B y TN se asoció con menor SG, así como la expresión de p63 en la clase HER2; y de los distintos grupos de expresión de Ki-67 con las cuatro clases moleculares. En todos estos marcadores, su expresión, o en el caso del Ki-67 el mayor porcentaje de células positivas, se asoció con peor supervivencia (Tabla V).
En la Tabla VI se evidencia la asociación estadísticamente significativa de la expresión de CK5/6 con una supervivencia menor en las clases Luminal B y HER2; del mismo modo, la expresión de CK14 en la clase TN; la expresión de CK17 en las clases Luminal B y TN; y de la vimentina en las clases Luminal A y TN.
La expresión de cadherina E solo presentó asociación estadística significativa con la clase molecular Luminal B, en el sentido que las pacientes con tumores con expresión ausente o reducida presentaron menor supervivencia media (Tabla VII).
Por su parte, la inmunoexpresión de cadherina P presentó relación estadísticamente significativa con la clase TN; la expresión de p120 con la clase HER2; y la expresión de calponina con la clase Luminal A. La expresión de estas moléculas se asoció con una media de SG menor.
Análisis de la supervivencia en relación a la expresión de marcadores moleculares analizados por inmunohistoquímica y la clase Luminal A
El índice de proliferación (Ki-67) fue determinante en la evolución de esta clase molecular. Si se divide en dos grupos con un punto de corte del 14%, se obtiene una SG media de 58,7 ± 0,6 meses para los que presentaron un ≤14% y de 46,5 ± 1,5 para >14%, con p<0,001. Del mismo modo, al establecer el punto de corte en el 25% se obtuvieron diferencias estadísticamente significativas p<0,001, aunque con un valor de chi cuadrado menor. La SG fue en este caso de 55 ± 1 para los tumores con un índice de proliferación <25% y de 42,9 ± 2,1 para los tumores con un índice de proliferación ≥25% (Fig. 7).
En cuanto a la relación entre la supervivencia y los subtipos de cada clase molecular para marcadores con posible significación pronóstica particular, se encontraron diferencias significativas para la clase Luminal A según la expresión de marcadores relacionados con el tipo basal. La SG media fue de 54,3 ± 1 meses para los casos sin expresión de marcadores basales y de 42,2 ± 1,2 meses para los casos que presentaron expresión de uno o varios marcadores basales (p<0,001) (Fig. 7).
Análisis de la supervivencia en relación a la expresión de marcadores moleculares analizados por inmunohistoquímica y la clase Luminal B
La expresión de Ki-67 permite separar dos grupos con SG media diferentes, con un índice proliferativo con punto de corte en 25%. Los tumores con un índice de proliferación ≤25% presentaron una SG media de 52,8 ± 1,2 meses frente a 40,4 ± 3,2 meses para los tumores con un índice de proliferación >25% (p=0,005). Con el punto de corte en 14% las diferencias en la SG no fueron estadísticamente significativas (p=0,145), a pesar de una SG de 54,5 ± 2,2 y 45,1 ± 2,4 para los casos con índices de proliferación ≤14% y >14%, respectivamente (Fig. 8).
Para esta clase molecular no se lograron obtener diferencias significativas entre los casos que expresaron HER2 comparados con los que no lo hicieron (SG media en meses de 48,6 ± 2,3 vs 45,7 ± 1; p=0,150), ni al agrupar a los casos con expresión de marcadores basales (SG media en meses de 49,4 ± 2,1 vs 45,5 ± 1; p=0,100) (Fig. 8).
SG media fue en este caso de 50,8 ± 4,1 para los tumores con un índice de proliferación ≤25% y de 31,9 ± 3,6 (p=0,002) para aquellos tumores con un índice de proliferación >25% (Fig. 9).
No se apreciaron diferencias significativas entre los casos que expresaron marcadores basales y aquellos que no (SG media en meses de 46,4 ± 0,9 vs 42,6 ± 3,7; p=0,178) (Fig. 9).
Análisis de la supervivencia en relación a la expresión de marcadores moleculares analizados por inmunohistoquímica y la clase triple negativo. El índice de proliferación (Ki-67) mostró diferencias estadísticamente significativas para la SG tanto con punto de corte en el 14%, con una SG media de 58,8 ± 1,2 meses para los tumores que presentaron un índice de proliferación ≤14% y de 37 ± 1,9 para los tumores con un índice de proliferación >14% (p=0,003), como cuando el punto de corte se establece en el 25%. La SG media fue en este caso de 53,5 ± 2,3 para los tumores que presentaron un índice de proliferación ≤25% y de 33,6 ± 2,1 (p<0,001) para los tumores con un índice de proliferación >25% (Fig. 10). Sin embargo, en esta clase se presentaron solamente 8 casos con un índice de proliferación ≤14% frente a 81 casos con un índice de proliferación >14%.
La expresión de marcadores basales influyó significativamente en la SG, con media de 34,3 ± 2 meses comparada con una media de SG de 55,5 ± 2 meses para aquellos casos sin expresión de marcadores basales (p<0,001) (Fig 10).
DISCUSIÓN
En el presente estudio se observó que el fenotipo molecular predominante fue el Luminal A, con el 42,4%; el Luminal B representó el 20,3%, con un total de 62,7% de casos luminales (222 casos, 67,6% de Luminal A y 32,4% de Luminal B).
Estos porcentajes difieren de lo reportado por Blows y col. (22), en un estudio que incluye doce centros que comprenden más de diez mil casos, en donde refieren un total de 77% de casos luminales, repartidos en un 71% de casos Luminal A y un 6% de Luminal B. Solo en uno de los doce centros participativos en ese estudio se refieren porcentajes similares a los obtenidos en este trabajo, con un 42% de casos con fenotipo Luminal A y un 15% de casos con fenotipo Luminal B.
El 9% (32 casos) de los pacientes de este estudio correspondió a carcinomas de mama de tipo HER2, siendo este porcentaje comparable al publicado en los otros estudios (22-26). En cuanto a los casos TN, basales y no basales juntos, el porcentaje fue de un 28,2% (100 casos), bastante mayor que la frecuencia en mujeres caucásicas, en quienes la media es de 16% (22), pero comparable con las cifras referidas en mujeres afroamericanas e hispánicas (23,24).
Las clases moleculares mostraron curvas de supervivencia similares a las descritas en los estudios pioneros de Perou y Sorlie (4,5), validados por la gran mayoría de las publicaciones posteriores. La clase molecular Luminal A presentó el mejor pronóstico con respecto a las otras clases moleculares. La clase Luminal B mostró una supervivencia intermedia y las clases HER2 y TN, peor pronóstico, con diferencias estadística significativas (p<0,001).
Desde la publicación de Perou y Sorlie en el año 2000 (4), proponiendo las clases moleculares del cáncer de mama, hemos asistido a una verdadera revolución en el campo de la patología mamaria. Sin embargo, después de cierto tiempo, quedó claro que esas clases moleculares no eran homogéneas y existían grupos híbridos o subtipos (27-32).
La heterogeneidad del carcinoma de mama es un hecho bien reconocido y aceptado. Esta variabilidad se ha tratado de explicar por el origen de las células madre cancerosas con potenciales evolutivos diferentes y un significativo número de alteraciones genéticas posibles, que se traduce en distintos patrones de expresión de moléculas proteicas detectadas por IHQ (33-36). En este estudio se verifica esta heterogeneidad tumoral al observar porcentajes de expresión muy variados para los 22 marcadores utilizados.
Entre los marcadores varios y de proliferación celular, el EGFR presentó positividad en muy pocos casos de esta serie, muy por debajo de lo reportado en la literatura (31,37). El EGFR constituyó en esta serie un factor de mal pronóstico, al presentar los casos con expresión positiva una supervivencia global significativamente menor que los casos negativos (p=0,011). Blows y col. (22), en su revisión de más de 10.000 casos, señalan que la presencia de los marcadores basales utilizados (EGFR y/o CK5/6) le confiere peor pronóstico a las clases Luminal A y TN.
La expresión positiva para las moléculas C-Kit, p63 y CD10 estuvo dentro del rango encontrado en otros estudios (37-39). La expresión de C-Kit y de CD10 predominó en los casos TN, con relación estadísticamente significativa (p<0,001 y p=0,028), de acuerdo con las publicaciones consultadas (38,39). Igualmente, se observó asociación estadísticamente significativa de estos dos marcadores con la supervivencia global, siendo su expresión un factor pronóstico desfavorable.
En cambio, la expresión de p63 se observó en todas las clases moleculares, sin diferencia estadísticamente significativa en este estudio. Aunque se ha reportado su positividad en otras clases moleculares aparte de los tipos basales, ésta es siempre significativamente más baja que en ellos (20,40). Su expresión positiva confirió peor supervivencia a las pacientes (p=0,014).
El índice de proliferación basado en la expresión de Ki-67 presentó una relación estadísticamente significativa con las clases moleculares (p<0,001). Estos valores se encuentran cercanos a los valores de la mayoría de las publicaciones consultadas (41).
La survivina, por su parte, se expresó también en la mayoría de los casos, en concordancia con lo publicado previamente (42-44). No presentó relación estadísticamente significativa con las clases moleculares ni presentó en este trabajo asociación con la supervivencia global. Hay algunas publicaciones como la de Lee y col. (45) que señalan una fuerte asociación de la expresión de survivina con los carcinomas basales y su expresión en ellos se relaciona con un peor pronóstico.
La expresión de ALDH-1 se observó en el 26,4% de los tumores estudiados. Park y col. (34) encontraron la siguiente distribución de casos positivos de acuerdo al tipo molecular: 19% en los basales, 22% en HER2, 1% en Luminal A, y 6% en Luminal B. Los porcentajes de casos positivos de esta serie son comparables para los TN y HER2 (25,3% y 18,5%), mientras que para las clases luminales se encontraron porcentajes de expresión muy superiores (26,6% y 31,3%). No se encontró asociación estadística con las clases moleculares ni con la supervivencia global en este estudio, datos que no concuerdan con otras publicaciones que refieren una significación negativa a su expresión (34,46).
En relación a los marcadores de filamentos intermedios, la CK8/18 resultó positiva en la mayoría de los casos (97,3%). Kim y col. (47) utilizando un punto de corte en 1% describen resultados muy similares a este estudio, con 84% de positividad en los casos basales.
La CK5/6 es uno de los marcadores basales. Su expresión positiva se ha publicado entre 50-80% de los casos TN y en pocos casos de las clases moleculares Luminal A, Luminal B y HER2 (19,20,48). En el presente estudio solamente fue positiva en el 8% de los casos (26 casos) de los cuales 20 eran TN, lo cual representó el 21,5% de estos últimos. Esta asociación fue estadísticamente significativa (p<0,001) y presentó también valor pronóstico significativo con respecto a la supervivencia global (p=0,007). Al estar relacionado con la clase TN, se asocia también a un peor pronóstico.
Las CK14 y CK17 presentaron resultados similares, con expresión en un porcentaje bajo de casos, relacionadas con la clase TN y peor supervivencia global. En la literatura el porcentaje de casos positivos para estas proteínas se encuentra entre un 20 a 40% de los casos basales y en escasos casos no TN, igualmente con un valor pronóstico desfavorable (37,47).
La CK APM, que es un coctel de citoqueratinas que incluye las CKs 1, 5, 10 y 14, fue expresada en el 65,5% de los casos examinados, en mayor proporción en las clases de receptores hormonales negativos que en las clases luminales (p=0,002). No encontramos referencias bibliográficas respecto al uso y relación de este marcador con las clases moleculares.
La vimentina se expresó en un número importante de casos, el 26,9% del total de casos, y aunque se encontró en todas las clases, estuvo principalmente relacionada a la clase TN. De la misma forma, presentó relación altamente significativa con la supervivencia global (p<0,001). Algunas publicaciones describen que la vimentina no aumenta la sensibilidad para la identificación de los casos basales (37,49). Sin embargo, en esta serie sí resultó de utilidad, ya que la expresión de CK5/6 y de EGFR fue baja.
En relación a los marcadores de adhesión celular y del citoesqueleto, la expresión de cadherina E se observó conservada en la mayoría de los casos de esta serie. Los tumores de fenotipo TN presentaron un porcentaje elevado (42,9%) con expresión ausente o reducida, siendo esta diferencia estadísticamente significativa con respecto a las otras clases moleculares. No se apreció en la serie estudiada en este trabajo valor pronóstico significativo al analizar la SG a 5 años de las pacientes con tumores con ausencia o expresión reducida de cadherina E, a pesar de su asociación con los tumores TN y en general de una menor supervivencia media (no significativa estadísticamente). En otros estudios publicados si se ha encontrado valor pronóstico a la falta de expresión de esta molécula (50-52).
La cadherina P, por su parte, aunque expresada en todas las clases, la proporción fue significativamente mayor en los casos TN (p<0,001), tal como lo indican varias publicaciones (40,53). En nuestro estudio la expresión de cadherina P presentó relación negativa con la supervivencia global (p<0,001).
La expresión de la proteína p120 o la ausencia/reducción de su expresión no presentó relación estadísticamente significativa con las clases moleculares o con la SG, en nuestro trabajo. En cuanto a las actinas muscular lisa y alfa, se expresaron en muy pocos casos de esta serie, en relación con la clase molecular TN y relacionadas con la SG como factor de mal pronóstico. Hay pocas publicaciones que hacen referencia a su asociación con las clases moleculares del cáncer de mama, la mayoría de ellas solo para hacer la diferencia entre tumores TN de tipo basal o de tipo no basal (37,54).
La calponina es un marcador de células mioepiteliales y es una proteína cuya expresión se ha relacionado con el carcinoma de tipo basal de la mama. Únicamente hemos encontrado un trabajo que describe la expresión positiva de calponina en el 54% de una serie de 33 casos de carcinoma metaplásico (55). En este estudio se expresó en el 10,9% de los casos, distribuidos en todas las clases y sin relación con alguna de ellas. Presentó relación estadística significativa con la supervivencia global (p=0,023).
En relación a las clases moleculares, en el tipo luminal A se encontraron dos grandes discriminantes de valor pronóstico de evolución en este grupo. El índice proliferativo determinado a través de la expresión de Ki-67 y la presencia de marcadores basales tales como CK5/6, calponina y vimentina. La importancia del índice proliferativo se ha reportado previamente como un factor pronóstico importante (28,29), tanto así que hasta se sugiere que aquellos casos con un índice mayor a 14% deben ser clasificados como Luminal B en lugar de Luminal A (29,56). En este estudio se observaron diferencias significativas en la evolución, tanto cuando el punto de corte era de un 14% como cuando era de un 25%.
De igual forma, al dividir los casos de este grupo en aquéllos que presentaron positividad o negatividad para cualquier otro marcador de tipo basal, se evidenció una mejor supervivencia, con diferencia significativa, para el grupo sin expresión de marcadores basales.
La expresión de estos marcadores basales en la categoría de los carcinomas Luminal A y el hallazgo de su relevancia pronóstica merece especial atención. Su expresión pudiera explicarse ya sea bien porque en un clásico Luminal A se produzca una transformación epitelio-mesenquima y por ende de mayor capacidad metástasica, o de una población celular neoplásica mixta por diferenciación divergente de las células progenitoras o de células madre cancerosas diferentes (33,48,57).
En relación con el Luminal A, se pueden establecer varios subgrupos de significado pronóstico, el grupo con expresión solo de RE y RP, con Ki-67 ≤14%, con mejor pronóstico, y los grupos de Luminal A con Ki-67 ≥15%, >25%, o con expresión de otros marcadores basales, con peor pronóstico.
En la clase molecular Luminal B, la expresión de Ki-67 también demostró valor pronóstico, aunque el punto de corte del índice proliferativo que establece una diferencia fue de un 25%. En la literatura consultada el Ki-67 ha mostrado relevancia pronóstica y se ha utilizado para la clasificación de los casos catalogados como Luminal A (28,29,58), pero no se encontraron referencias en relación al grupo Luminal B y un punto de corte en esta clase.
En relación a los diferentes marcadores utilizados en este estudio, se evidenciaron diferencias significativas en la supervivencia global para CK17 (4 casos), EGFR (2 casos), C-Kit (3 casos) y cadherina P (22 casos). Dado el escaso número de casos positivos para estos marcadores, estos datos deben interpretarse con prudencia, aunque parece haber una asociación significativa de la cadherina P con el pronóstico en este grupo, que puede ser biológicamente relevante. La cadherina P es un marcador de la TEM, inversamente relacionado con la cadherina E e indicativo de mayor potencial metastásico, por tanto es lógico que se encuentre relacionado con peor pronóstico (53), aunque en la literatura se ha reportado en relación con los casos TN y no en las otras clases moleculares.
Los diferentes subtipos de esta clase, establecidos según la expresión de HER2 y de marcadores de tipo basal, no mostraron diferencias estadísticamente significativas en su supervivencia a los 5 años. Estos resultados contrastan con otros estudios que han reportado un peor pronóstico para los casos con expresión de HER2 (24,29,59).
La clase molecular HER2 presentó una supervivencia a los 5 años significativamente menor que las clases luminales, comparable al grupo de TN, tal como se ha señalado en la literatura, desde los trabajos de Perou y Sorlie (4,5) y validado por la gran mayoría de trabajos posteriores (11,37,52,60).
Con relación a la expresión de Ki-67 en este grupo, los resultados evidencian diferencias significativas (p=0,006), cuando el punto de corte se establece, al igual que en la clase Luminal A, tanto en un 14% como en un 25%, aunque debe señalarse que son pocos casos (6 tumores) con índice de proliferación bajo. Este hallazgo no se ha encontrado descrito en la literatura consultada.
Por otra parte, en esta clase no se encontraron diferencias significativas en la supervivencia en cuanto a la expresión o no de otros marcadores de tipo basal, al agrupar los casos que presentaban expresión de estos marcadores. Individualmente, sí se observaron diferencias significativas en la supervivencia con la expresión de p120 (un solo caso negativo de quince analizados), CK5/6 (un solo caso positivo de treinta analizados) y p63 (7 casos positivos de los 27 analizados). Igualmente, no se encontraron publicaciones que describieran resultados al respecto.
Parece importante en esta clase molecular el índice de proliferación con Ki-67 en relación al pronóstico. Sin embargo, en cuanto a la expresión de otros marcadores consideramos que fueron pocos el número de casos analizados y que hace falta estudiar series con mayor número de casos, ya que se trata de una clase molecular poco frecuente.
Finalmente, la clase molecular triple negativo es la que ha recibido mayor atención en la literatura, en parte por el mal pronóstico que tiene, así como por la ausencia de terapia específica, a diferencia de lo que ocurre con las otras clases moleculares. Recientemente ha quedado demostrado, tanto en la literatura publicada como en este trabajo, que no todos los casos con el fenotipo TN son de tipo basal, existiendo al menos dos grandes subtipos: TN con expresión de marcadores basales (TNB) y TN con ausencia de expresión de marcadores relacionados con el tipo basal (TNnB) (7-12).
Para separar estos dos subtipos de TN, se han utilizado diferentes marcadores, siendo la CK5/6 y EGFR los usados por la mayoría de los grupos (31,61,62); otros trabajos se basan en la expresión, además, de otras citoqueratinas como la CK14 y CK17 (48,52,63); mientras otros estudios han descrito otra gran variedad de marcadores, entre ellos la vimentina, actina, p63, C-Kit, CD10, p120, calponina, ALDH1, BRCA1 y BRCA2 (del inglés breast cáncer 1 y 2) o cadherina P para su caracterización o para predecir el pronóstico en este grupo (20,46,49).
En cuanto a la expresión de Ki-67 en este grupo, la media de expresión fue de 42,84%, muy superior a la de los otros grupos, tal como señalan otros trabajos (8,64). Se observaron diferencias significativas en la supervivencia (p<0,001) para los tres grupos de Ki-67, aunque con pocos casos en el grupo con un índice menor al 14%. En la literatura no se encontró referencia que establezca un punto de corte con valor pronóstico de Ki-67 para este grupo. En nuestro trabajo el punto de corte se obtuvo en un 25%.
El análisis de la expresión de los marcadores relacionados con el fenotipo basal, la CK5/6 solo se expresó en el 21,5% (20/93) de los casos TN, un porcentaje sumamente inferior en relación a otros trabajos publicados cuyos porcentajes oscilan en general entre un 59 y 76% (19,20,48,65). El EGFR por su parte se expresó en el 7,2% (7/97) de los casos, cifra también mucho menor a lo generalmente descrito (19,20,64); lo cual indica que si en este trabajo se hubieran utilizado solo estos dos marcadores para definir al grupo TNB, el número de casos incluidos estaría muy por debajo de la realidad.
Los marcadores relacionados con el tipo basal que presentaron una asociación significativa con el grupo TN en este trabajo fueron: CK5/6, CD10, CK17, CK14, C-Kit, vimentina, CK APM, actina de músculo liso y alfa actina. Todo esto coincidiendo con lo publicado (62,65,66). Sin embargo, la vimentina fue el marcador que individualmente presentó mayor utilidad, no solo para discriminar al subgrupo TNB, sino con relevancia pronóstica independiente (p<0,001). Este hallazgo se ha sugerido en algunos trabajos (20,40,67).
En cuanto a la supervivencia, los marcadores que demostraron valor pronóstico individual en esta clase, fueron la cadherina P (p=0,043), la CK14 (p=0,044), CK17 (p=0,046) y C-Kit (p=0,006).
Al agrupar los casos TN en aquéllos con expresión de marcadores basales versus aquéllos sin ella, la diferencia en la supervivencia global a 5 años fue altamente significativa (p<0,001), con pronóstico peor para el subtipo TNB, lo cual, como se ha señalado ya en otros trabajos, destaca la importancia de esta subdivisión (68-70). Es de señalar que existe un trabajo publicado con una mejor supervivencia para el subtipo TNB que el TNnB (31).
Para la clase de TN, es importante la determinación del índice proliferativo basado en la expresión de Ki-67, con estratificación de los casos en un 25% (mejor pronóstico para aquéllos con un índice menor) y de acuerdo a la expresión de otros marcadores relacionados con el fenotipo basal. Sin embargo, como no resulta práctico realizar un gran número de reacciones de IHQ, tal vez con el uso de cuatro de ellos, CK5/6, y EGFR, tal como lo señala la literatura, y la inclusión de vimentina y cadherina P, se abarcaría a la gran mayoría de los casos TNB, además con un valor pronóstico.
Una vez clasificado cada caso en su respectiva clase molecular, pudiera utilizarse un nuevo grupo de marcadores de valor pronóstico para subclasificar el caso. Un modelo de subclasificación, basado en los resultados de este trabajo y con el fin de obtener grupos de pronóstico diferente, que posiblemente requieran terapias distintas, pudiera ser el siguiente esquema (Fig 11).
En relación con la clase molecular Luminal A, se pueden establecer varios subgrupos de significado pronóstico: el subgrupo con expresión exclusiva de RE y RP, con Ki-67 ≤14%, con mejor pronóstico, y el subgrupo Luminal A con Ki-67 >14%, o con expresión de otros marcadores relacionados con el fenotipo basal.
El grupo Luminal B puede ser dividido en subtipos de acuerdo a la expresión de Ki-67 (índice proliferativo con punto de corte en el 25%).
En la clase HER2, parece importante el índice proliferativo de Ki-67 para el pronóstico, pero en cuanto a la expresión de otros marcadores consideramos que hace falta estudiar series con mayor número de casos, ya que al ser la clase menos frecuente y teniendo en cuenta las muestras no valorables en cada marcador, en este estudio se ha analizado un número bajo de casos.
La clase de TN puede ser dividida según el índice de proliferación en dos categorías pronósticas, con un mejor pronóstico para aquellos tumores con un Ki67 <25%. La combinación de CK5/6, EGFR y vimentina, detecta la gran mayoría de los casos TNB.
Las cuatro grandes clases moleculares del carcinoma de mama reconocidas, Luminal A, Luminal B, HER2 y TN, han demostrado su valor pronóstico al presentar diferencias significativas en su evolución.
AGRADECIMIENTOS
A todo el personal que labora en el Departamento de Anatomía Patológica del Hospital Universitario La Paz de Madrid (España).
REFERENCIAS
1. Ferlay J, Soerjomataram I, Ervik M, Dikshit R, Eser S, Mathers C, Rebelo M, Parkin DM, Forman D, Bray, F. Cancer Incidence and Mortality Worldwide: IARC Cancer Base No. 11. GLOBOCAN 2012. International Agency for Research on Cancer 2013. [ Links ]
2. Ministerio del Poder Popular para la Salud. Anuario de mortalidad 2011. [Documento en línea, consultado en febrero 2014]. Disponible en: http://www.mpps.gob.ve/index.php?option=com_phocadownload & view=category & id=11:anuarios-de-mortalidad. [ Links ]
3. Pusztai L, Mazouni C, Anderson K, Wu Y, Symmans WF. Molecular classification of breast cancer: limitations and potential. Oncologist 2006; 11:868-877. [ Links ]
4. Perou CM, Sorlie T, Eisen MB, van de Rijn M, Jeffrey SS, Rees CA, Pollack JR, Ross DT, Johnsen H, Akslen LA, Fluge O, Pergamenschikov A, Williams C, Zhu SX, Lonning PE, Borresen-Dale AL, Brown PO, Botstein D l. Molecular portraits of human breast tumours. Nature 2000; 406:747-752. [ Links ]
5. Sorlie T, Perou CM, Tibshirani R, Aas T, Geisler S, Johnsen H, Hastie T, Eisen MB, van de Rijn M, Jeffrey SS, Thorsen T, Quist H, Matese JC, Brown PO, Botstein D, Lonning PE, Borresen-Dale AL. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. Proc Natl Acad Sci USA 2001; 98:10869-10874. [ Links ]
6. Sorlie T, Tibshirani R, Parker J, Hastie T, Marron JS, Nobel A, Deng S, Johnsen H, Pesich R, Geisler S, Demeter J, Perou CM, Lonning PE, Brown PO, Borresen-Dale AL, Botstein D. Repeated observation of breast tumor subtypes in independent gene expression data sets. Proc Natl Acad Sci USA 2003; 100:8418-8423. [ Links ]
7. Anders CK, Carey LA. Biology, metastatic patterns, and treatment of patients with triple-negative breast cancer. Clin Breast Cancer 2009; 9:73-81. [ Links ]
8. Bhargava R, Striebel J, Beriwal S, Flickinger JC, Onisko A, Ahrendt G, Dabbs DJ. Prevalence, morphologic features and proliferation indices of breast carcinoma molecular classes using immunohistochemical surrogate markers. Int J Clin Exp Pathol 2009; 2:444-455. [ Links ]
9. Cheang MC, Chia SK, Voduc D, Gao D, Leung S, Snider J, Watson M, Davies S, Bernard PS, Parker JS, Perou CM, Ellis MJ, Nielsen TO. Ki67 index, HER2 status, and prognosis of patients with luminal B breast cancer. J Natl Cancer Inst 2009; 101:736-750. [ Links ]
10. Loi S, Sotiriou C, Haibe-Kains B, Lallemand F, Conus NM, Piccart MJ, Speed TP, McArthur GA. Gene expression profiling identifies activated growth factor signaling in poor prognosis (Luminal-B) estrogen receptor positive breast cancer. BMC Med Genomics 2009; 2:37. [ Links ]
11. Choi YL, Oh E, Park S, Kim Y, Park YH, Song K, Cho EY, Hong YC, Choi JS, Lee JE, Kim JH, Nam SJ, Im YH, Yang JH, Shin YK. Triple-negative, basal-like, and quintuple-negative breast cancers: better prediction model for survival. BMC Cancer 2010; 10:507. [ Links ]
12. Sircoulomb F, Bekhouche I, Finetti P, Adélaïde J, Ben Hamida A, Bonansea J, Raynaud S, Innocenti C, Charafe-Jauffret E, Tarpin C, Ben Ayed F, Viens P, Jacquemier J, Bertucci F, Birnbaum D, Chaffanet M. Genome profiling of ERBB2-amplified breast cancers. BMC Cancer 2010; 10:539. [ Links ]
13. Rouzier R, Perou CM, Symmans WF, Ibrahim N, Cristofanilli M, Anderson K, Hess KR, Stec J, Ayers M, Wagner P, Morandi P, Fan C, Rabiul I, Ross JS, Hortobagyi GN, Pusztai L. Breast cancer molecular subtypes respond differently to preoperative chemotherapy. Clin Cancer Res 2005; 11:5678-5685. [ Links ]
14. Cariati M, Purushotham AD. Stem cells and breast cancer. Histopathology 2008; 52:99-107. [ Links ]
15. Charafe-Jauffret E, Ginestier C, Iovino F, Wicinski J, Cervera N, Finetti P, Hur MH, Diebel ME, Monville F, Dutcher J, Brown M, Viens P, Xerri L, Bertucci F, Stassi G, Dontu G, Birnbaum D, Wicha MS. Breast cancer cell lines contain functional cancer stem cells withmetastatic capacity and a distinct molecular signature. Cancer Res 2009; 69:1302-1313. [ Links ]
16. Rosen JM, Jordan CT. The increasing complexity of the cancer stem cell paradigm. Science 2009; 324:1670-1673. [ Links ]
17. Pandey PR, Saidou J, Watabe K. Role of myoepithelial cells in breast tumor progression. Front Biosci 2010; 15:226-236. [ Links ]
18. Katz E, Dubois-Marshall S, Sims AH, Gautier P, Caldwell H, Meehan RR, Harrison DJ. An in vitro model that recapitulates the epithelial to mesenchymal transition (EMT) in human breast cancer. PLoS One 2011; 6:e17083. [ Links ]
19. Nielsen TO, Hsu FD, Jensen K, Cheang M, Karaca G, Hu Z, Hernandez-Boussard T, Livasy C, Cowan D, Dressler L, Akslen LA, Ragaz J, Gown AM, Gilks CB, van de Rijn M, Perou CM. Imunohistochemical and clinical characterization of the basal-like subtype of invasive breast carcinoma. Clin Cancer Res 2004; 10:5367-5374. [ Links ]
20. Livasy CA, Karaca G, Nanda R, Tretiakova MS, Olopade OI, Moore DT, Perou CM. Phenotypic evaluation of the basal-like subtype of invasive breast carcinoma. Mod Pathol 2006; 19:264-271. [ Links ]
21. Carey LA, Dees EC, Sawyer L, Gatti L, Moore DT, Collichio F, Ollila DW, Sartor CI, Graham ML, Perou CM. The triple negative paradox: primary tumor chemosensitivity of breast cancer subtypes. Clin Cancer Res 2007; 13:2329-2334. [ Links ]
22. Blows FM, Driver KE, Schmidt MK, Broeks A, van Leeuwen FE, Wesseling J, Cheang MC, Gelmon K, Nielsen TO, Blomqvist C, Heikkilä P, Heikkinen T, Nevanlinna H, Akslen LA, Bégin LR, Foulkes WD, Couch FJ, Wang X, Cafourek V, Olson JE, Baglietto L, Giles GG, Severi G, McLean CA, Southey MC, Rakha E, Green AR, Ellis IO, Sherman ME, Lissowska J, Anderson WF, Cox A, Cross SS, Reed MW, Provenzano E, Dawson SJ, Dunning AM, Humphreys M, Easton DF, García-Closas M, Caldas C, Pharoah PD, Huntsman D. Subtyping of breast cancer by immunohistochemistry to investigate a relationship between subtype and short and long term survival: a collaborative analysis of data for 10,159 cases from 12 studies. PLoS Med 2010; 7:e1000279. [ Links ]
23. Carey LA, Perou CM, Livasy CA, Dressler LG, Cowan D, Conway K, Karaca G, Troester MA, Tse CK, Edmiston S, Deming SL, Geradts J, Cheang MC, Nielsen TO, Moorman PG, Earp HS, Millikan RC. Race, breast cancer subtypes, and survival in the Carolina Breast Cancer Study. JAMA 2006; 295:2492-2502. [ Links ]
24. OBrien KM, Cole SR, Tse CK, Perou CM, Carey LA, Foulkes WD, Dressler LG, Geradts J, Millikan RC. Intrinsic breast tumor subtypes, race, and long-term survival in the Carolina Breast Cancer Study. Clin Cancer Res 2010; 16:6100-6110. [ Links ]
25. Salhia B, Tapia C, Ishak EA, Gaber S, Berghuis B, Hussain KH, DuQuette RA, Resau J, Carpten J. Molecular subtype analysis determines the association of advanced breast cancer in Egypt with favorable biology. BMC Womens Health 2011; 11:44. [ Links ]
26. Irigoyen MA, García FV, Iturriagagoitia AC, Beroiz BI, Martínez MS, Grima FG. Molecular subtypes of breast cancer: prognostic implications and clinical and immunohistochemical characteristics. An Sist Sanit Navar 2011; 34:219-233. [ Links ]
27. Niwińska A, Olszewski W, Murawska M, Pogoda K. Triple-negative breast cancer with brain metastases: a comparison between basal-like and non-basal-like biological subtypes. J Neurooncol 2011; 105:547-553. [ Links ]
28. Bhargava R, Striebel J, Beriwal S, Flickinger JC, Onisko A, Ahrendt G, Dabbs DJ. Prevalence, morphologic features and proliferation indices of breast carcinoma molecular classes using immunohistochemical surrogate markers. Int J Clin Exp Pathol 2009; 2:444-455. [ Links ]
29. De Azambuja E, Cardoso F, De Castro G, Colozza M, Mano MS, Durbecq V, Sotiriou C, Larsimont D, Piccart-Gebhart MJ, Paesmans M. Ki-67 as prognostic marker in early breast cancer: a meta-analysis of published studies involving 12155 patients. Br J Cancer 2007; 96:1504-1513. [ Links ]
30. Jacquemier J, Charafe-Jauffret E, Monville F, Esterni B, Extra JM, Houvenaeghel G, Xerri L, Bertucci F, Birnbaum D. Association of GATA3, P53, Ki67 status and vascular peritumoral invasion are strongly prognostic in luminal breast cancer. Breast Cancer Res 2009; 11:R23. [ Links ]
31. Bauer KR, Brown M, Cress RD, Parise CA, Caggiano V. Descriptive analysis of estrogen receptor (ER)-negative, progesterone receptor (PR)-negative, and HER2-negative invasive breast cancer, the so-called triple-negative phenotype: a population-based study from the California Cancer Registry. Cancer 2007; 109:1721-1728. [ Links ]
32. Sircoulomb F, Bekhouche I, Finetti P, Adélaïde J, Ben Hamida A, Bonansea J, Raynaud S, Innocenti C, Charafe-Jauffret E, Tarpin C, Ben Ayed F, Viens P, Jacquemier J, Bertucci F, Birnbaum D, Chaffanet M. Genome profiling of ERBB2-amplified breast cancers. BMC Cancer 2010; 10:539. [ Links ]
33. Melchor L, Saucedo-Cuevas LP, Muñoz-Repeto I, Rodríguez-Pinilla SM, Honrado E, Campoverde A, Palacios J, Nathanson KL, García MJ, Benítez J. Comprehensive characterization of the DNA amplification at 13q34 in human breast cancer reveals TFDP1 and CUL4A as likely candidate target genes. Breast Cancer Res 2009; 11:86. [ Links ]
34. Park SY, Lee HE, Li H, Shipitsin M, Gelman R, Polyak K. Heterogeneity for stem cell-related markers according to tumor subtype and histologic stage in breast cancer. Clin Cancer Res 2010; 16:876-887. [ Links ]
35. Munirah MA, Siti-Aishah MA, Reena MZ, Sharifah NA, Rohaizak M, Norlia A, Rafie MK, Asmiati A, Hisham A, Fuad I, Shahrun NS, Das S. Identification of different subtypes of breast cancer using tissue microarray. Rom J Morphol Embryol 2011; 52:669-677. [ Links ]
36. Reis-Filho JS, Pusztai L. Gene expression profiling in breast cancer: classification, prognostication, and prediction. Lancet 2011; 378:1812-1823. [ Links ]
37. Rakha EA, Elsheikh SE, Aleskandarany MA, Habashi HO, Green AR, Powe DG, El-Sayed ME, Benhasouna A, Brunet JS, Akslen LA, Evans AJ, Blamey R, Reis-Filho JS, Foulkes WD, Ellis IO. Triple-negative breast cancer: distinguishing between basal and nonbasal subtypes. Clin Cancer Res 2009; 15:2302-2310. [ Links ]
38. Tsutsui S, Yasuda K, Suzuki K, Takeuchi H, Nishizaki T, Higashi H, Era S. A loss of c-kit expression is associated with an advanced stage and poor prognosis in breast cancer. Br J Cancer 2006; 94:1874-1878. [ Links ]
39. Charpin C, Giusiano S, Charfi S, Secq V, Carpentier S, Andrac L, Lavaut MN, Allasia C, Bonnier P, Garcia S. Quantitative immunohistochemical expression of c Kit in breast carcinomas is predictive of patients outcome. Br J Cancer 2009; 101:48-54. [ Links ]
40. Sarrió D, Rodriguez-Pinilla SM, Hardisson D, Cano A, Moreno-Bueno G, Palacios J. Epithelial-mesenchymal transition in breast cancer relates to the basal-like phenotype. Cancer Res 2008; 68:989-997. [ Links ]
41. Fasching PA, Heusinger K, Haeberle L, Niklos M, Hein A, Bayer CM, Rauh C, Schulz-Wendtland R, Bani MR, Schrauder M, Kahmann L, Lux MP, Strehl JD, Hartmann A, Dimmler A, Beckmann MW, Wachter DL. Ki67, chemotherapy response, and prognosis in breast cancer patients receiving neoadjuvant treatment. BMC Cancer 2011; 11:486. [ Links ]
42. Chu JS, Shew JY, Huang CS. Immunohistochemical analysis of survivin expression in primary breast cancers. J Formos Med Assoc 2004; 103:925-931. [ Links ]
43. Hinnis AR, Luckett JC, Walker RA. Survivin is an independent predictor of short-term survival in poor prognostic breast cancer patients. Br J Cancer 2007; 96:639-645. [ Links ]
44. Nassar A, Lawson D, Cotsonis G, Cohen C. Survivin and caspase-3 expression in breast cancer: correlation with prognostic parameters, proliferation, angiogenesis, and outcome. Appl Immunohistochem Mol Morphol 2008; 16:113-120. [ Links ]
45. Lee CW, Simin K, Liu Q, Plescia J, Guha M, Khan A, Hsieh CC, Altieri DC. A functional Notch-survivin gene signature in basal breast cancer. Breast Cancer Res 2008; 10:97. [ Links ]
46. Nalwoga H, Arnes JB, Wabinga H, Akslen LA. Expression of aldehyde dehydrogenase 1 (ALDH1) is associated with basal-like markers and features of aggressive tumours in African breast cancer. Br J Cancer 2010; 102:369-375. [ Links ]
47. Kim HR, Appel S, Vetterkind S, Gangopadhyay SS, Morgan KG. Smooth muscle signalling pathways in health and disease. J Cell Mol Med 2008; 12:2165-2180. [ Links ]
48. Laakso M, Loman N, Borg A, Isola J. Cytokeratin 5/14-positive breast cancer: true basal phenotype confined to BRCA1 tumors. Mod Pathol 2005; 18:1321-1328. [ Links ]
49. Kusinska RU, Kordek R, Pluciennik E, Bednarek AK, Piekarski JH, Potemski P. Does vimentin help to delineate the so-called basal type breast cancer?. J Exp Clin Cancer Res 2009; 28:118. [ Links ]
50. Koo JS, Jung W, Jeong J. The predictive role of E-cadherin and androgen receptor on in vitro chemosensitivity in triple-negative breast Cancer. Jpn J Clin Oncol 2009; 39:560-568. [ Links ]
51. Hudis CA, Gianni L. Triple-negative breast cancer: an unmet medical need. Oncologist 2011; 16(Suppl 1):1-11. [ Links ]
52. Lerma E, Barnadas A, Prat J. Triple negative breast carcinomas: similarities and differences with basal like carcinomas. Appl Immunohistochem Mol Morphol 2009; 17:483-494. [ Links ]
53. Paredes J, Correia AL, Ribeiro AS, Albergaria A, Milanezi F, Schmitt FC. P-cadherin expression in breast cancer: a review. Breast Cancer Res 2007; 9:214. [ Links ]
54. Sousa B, Paredes J, Milanezi F, Lopes N, Martins D, Dufloth R, Vieira D, Albergaria A, Veronese L, Carneiro V, Carvalho S, Costa JL, Zeferino L, Schmitt F. P-cadherin, vimentin and CK14 for identification of basal-like phenotype in breast carcinomas: an immunohistochemical study. Histol Histopathol 2010; 25:963-974. [ Links ]
55. Yilmaz KB, Pak I, Irkkan C, Ozaslan C, Atalay C. Metaplastic carcinoma of the breast: Clinicopathological features and immunohistochemical analysis. J BUON 2011; 16:652-656. [ Links ]
56. Piccart-Gebhart MJ. New developments in hormone receptor-positive disease. Oncologist 2011; 16:40-50. [ Links ]
57. Korsching E, Packeisen J, Liedtke C, Hungermann D, Wülfing P, van Diest PJ, Brandt B, Boecker W, Buerger H. The origin of vimentin expression in invasive breast cancer: epithelial-mesenchymal transition, myoepithelial histogenesis or histogenesis from progenitor cells with bilinear differentiation potential?. J Pathol 2005; 206:451-457. [ Links ]
58. Gerdes J. Ki-67 and other proliferation markers useful for immunohistological diagnostic and prognostic evaluations in human malignancies. Semin Cancer Biol 1990; 1:199-206. [ Links ]
59. Payne SJL, Bowen RL, Jones JL, Wells CA. Predictive markers in breast cancer – the present. Histopathology 2008; 52:966-978. [ Links ]
60. Albergaria A, Ricardo S, Milanezi F, Carneiro V, Amendoeira I, Vieira D, Cameselle-Teijeiro J, Schmitt F. Nottingham Prognostic Index in triple-negative breast cancer: a reliable prognostic tool?. BMC Cancer 2011; 11:299. [ Links ]
61. De Ruijter TC, Veeck J, de Hoon JP, van Engeland M, Tjan-Heijnen VC. Characteristics of triple-negative breast cancer. J Cancer Res Clin Oncol 2011; 137:183-192. [ Links ]
62. Reis-Filho JS, Tutt AN. Triple negative tumours: a critical review. Histopathology 2008; 52:108-118. [ Links ]
63. Laakso M, Tanner M, Nilsson J, Wiklund T, Erikstein B, Kellokumpu-Lehtinen P, Malmström P, Wilking N, Bergh J, Isola J. Basoluminal carcinoma: a new biologically and prognostically distinct entity between basal and luminal breast cancer. Clin Cancer Res 2006; 12:4185-4191. [ Links ]
64. Trihia H, Murray S, Price K, Gelber RD, Golouh R, Goldhirsch A, Coates AS, Collins J, Castiglione-Gertsch M, Gusterson BA. Ki-67 expression in breast carcinoma: its association with grading systems, clinical parameters, and other prognostic factors a surrogate marker?. Cancer 2003; 97:1321-1331. [ Links ]
65. Reigosa A, Fernández A, Gutiérrez D, Caleiras E, Hardisson D, Espig H, Saldivia F, Juarranz A, Sanz F. Expresión de p63 y citoqueratina 5/6 en los diferentes tipos moleculares del carcinoma de mama. Rev Esp Patol 2010; 43:79-85. [ Links ]
66. Cheang MC, Voduc D, Bajdik C, Leung S, McKinney S, Chia SK, Perou CM, Nielsen TO. Basal-like breast cancer defined by five biomarkers has superior prognostic value than triple-negative phenotype. Clin Cancer Res 2008; 14:1368-1376. [ Links ]
67. Rodríguez-Pinilla SM, Sarrió D, Honrado E, Moreno-Bueno G, Hardisson D, Calero F, Benítez J, Palacios J. Vimentin and laminin expression is associated with basal-like phenotype in both sporadic and BRCA1-associated breast carcinomas. J Clin Pathol 2007; 60:1006-1012. [ Links ]
68. Bertucci F, Finetti P, Cervera N, Birnbaum D. Prognostic classification of breast cancer and gene expression profiling. Med Sci (Paris) 2008; 24:599-606. [ Links ]
69. Fadare O, Tavassoli FA. The phenotypic spectrum of basal-like breast cancers: a critical appraisal. Adv Anat Pathol 2007; 14:358-373. [ Links ]
70. Anders CK, Johnson R, Litton J, Phillips M, Bleyer A. Breast cancer before age 40 years. Semin Oncol 2009; 36:237-249. [ Links ]












 uBio
uBio