Investigación Clínica
versión impresa ISSN 0535-5133
Invest. clín vol.58 no.2 Maracaibo jun. 2017
Mecanismos inmunológicos involucrados en la obesidad.
Carmen Paulina Rodríguez López1, María Cristina González Torres1, Carlos A. Aguilar Salinas2 y Oralia Nájera Medina3.
1 Departamento de Ciencias de la Salud, CBS. UAM-Iztapalapa. Ciudad de México, México.
2 Departamento de Endocrinología y Metabolismo, INCMNSZ. Ciudad de México, México.
3 Departamento de Atención a la Salud, CBS. UAM- Xochimilco. Ciudad de México, México.
Autor de Correspondencia: Oralia Nájera Medina. Departamento de Atención a la Salud, CBS. UAM- Xochimilco. Ciudad de México, México. Correo electrónico: onajera@correo.xoc.uam.mx.
Resumen. La obesidad es un problema de salud pública creciente a nivel mundial. Se ha clasificado como una enfermedad ocasionada por acumulación excesiva de triglicéridos en el tejido adiposo (TA). El TA visceral (TAV), se considera un factor importante en el desarrollo de enfermedades crónicas no transmisibles. Esto principalmente porque el adipocito aumenta en tamaño y número, lo cual lleva a hipoxia, liberación de ácidos grasos, movilización y activación de subpoblaciones leucocitarias (linfocitos T, B, macrófagos, neutrófilos y eosinófilos), liberación de mediadores proinflamatorios (factor de necrosis tumoral- α (TNF-α), interleucina (IL)-6, resistina) y disminución en la secreción de antiinflamatorios (adiponectina, IL-10, IL-4 e IL-13). Estos cambios en el TAV generan un estado de inflamación crónica de baja intensidad, que se ha relacionado con resistencia a la insulina (RI). La RI es el signo fundamental para el desarrollo del Síndrome Metabólico (SM), que inicialmente se presenta localmente en el TAV y después se vuelve sistémica. En la investigación de la obesidad y el desarrollo de sus comorbilidades, la trascendencia del TAV en la interacción entre células adiposas e inmunitarias, así como de liberación de mediadores para desencadenar el proceso inflamatorio crónico, es clave para el desarrollo de RI y SM; sin embargo, se ha observado que la masa músculo-esquelética está implicada en este proceso, aparte de las células y mediadores de los que se sabe su participación. De esta manera a los linfocitos T CD4 y T CD8 se les señala como proinflamatorios, en cambio a los eosinófilos y a la adiponectina se les clasifica como protectores del proceso.
Palabras clave: obesidad; inflamación; tejido adiposo visceral; resistencia a la insulina.
Immune mechanisms involved in obesity.
Abstract. Obesity is a widespread public health problem worldwide. This disease has been classified as a condition caused by excessive accumulation of triglycerides in adipose tissue (TA). Visceral TA is an important factor in the development of several chronic diseases, since the adipocyte increases in size and number, leading to hypoxia, fatty acid release, mo-bilization and activation of leukocyte subpopulations (macrophages, neutrophils, eosinophils, NK cells, T lymphocytes and B); release of pro-inflammatory mediators (TNF-á, IL-6, PAI-1, resistin and visfatin), and decreased secretion of anti-inflammatory cytokines (adiponectin, IL-10, IL-4 and IL-13). These changes in TAV generate a chronic inflammation state of low inten-sity, that has been linked to insulin resistance (IR), initially local and then becomes systemic, which represents the determining factor for the development of metabolic syndrome (SM). The transcendence of TAV in the interaction between adipose and immune cells, as well as the release of mediators that trigger the chronic inflammatory process, is key for the development of IR and SM. However, in the investigation of obesity and the development of its comorbidities, it has been observed that the skeletal-muscle mass is involved in this process, apart from the cells and mediators of which their participation is known. In this way, TCD4 and TCD8 lymphocytes are recognized as pro-inflammatory. In contrast, eosinophils and adiponectin are considered as protective of the process.
Keywords: obesity; inflammation; visceral adipose tissue; insulin resistance.
Recibido: 20-10-2016 Aceptado: 09-03-2017
INTRODUCCIÓN
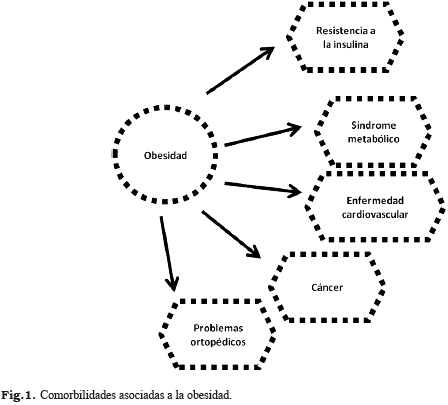
La obesidad es un problema de salud pública creciente a nivel mundial. Desde 1980, alrededor del mundo, poco menos de 1 de cada 10 personas eran obesas, en las décadas siguientes, estas cifras se duplicaron o triplicaron, pero desde el año 2000 el incremento de este padecimiento ha sido más lento que en las décadas anteriores; sin embargo, se ha pronosticado que para el año 2025 la probabilidad de cumplir la meta mundial de reducir las cifras de obesidad es prácticamente cero. En países como México, EUA y Nueva Zelanda, 1 de cada 3 personas presenta obesidad (1, 2). La Organización Mundial de Salud (OMS) señala a este problema como la epidemia del siglo XXI (3).La obesidad se clasifica como una enfermedad que ocasiona acumulación de energía en forma de triglicéridos en el tejido adiposo (TA) corporal (3-6). El tejido adiposo visceral (TAV), en particular, se considera como un factor importante en el desarrollo de varias enfermedades crónicas no transmisibles, entre ellas la resistencia a la insulina (RI), la hipertensión, las dislipidemias, el Síndrome Metabólico (SM), la diabetes mellitus tipo 2(DM2) y las enfermedades cardiovasculares(ECV) (Fig. 1) (7-10).
El acúmulo de lípidos por el TA, causa aumento en el tamaño y número de los adipocitos (3, 4). Al mismo tiempo, el aumento en el tamaño del adipocito requiere de mayor cantidad de oxígeno, lo cual ocasiona hipoxia y pierde la capacidad de almacenar triglicéridos, lo que propicia liberación de ácidos grasos (3).
La presencia de estos fenómenos en el TA, provoca un flujo dinámico en el número y tipo de células del sistema inmune (SI) dentro del TA, como son la participación de monocitos y granulocitos (neutrófilos, eosinófilos y basófilos) y de subpoblaciones linfocitarias (células naturales asesinas NK, por sus siglas en inglés y linfocitos T y B), las cuales presentan un fenotipo activado. Se ha documentado que existe una compleja interacción entre las células del SI innato y del adaptativo y el balance entre estas células inmunes, parece ser importante para la homeostasis y el control de la inflamación del TA en obesidad (11).
También, en el TAV se observa liberación de mediadores proinflamatorios (TNF-α, IL-6, PAI-1, resistina y visfatina), así como disminución en la secreción de citocinas con acción antiinflamatoria (adiponectina, IL-10, IL-4 e IL-13)(8, 12-16). La combinación de todos estos fenómenos observados en el TAV de personas con obesidad, ayuda a que se establezca el estado de inflamación crónico de baja intensidad característico de esta población. A este estado inflamatorio, se le ha atribuido una concomitante pérdida de la sensibilidad a la insulina inicialmente local (12-14,17).Sin embargo, recientemente se ha observado que otros tejidos, aparte del tejido adiposo, participan en este proceso, ayudando a la pérdida de la sensibilidad a la insulina sistémica; tal es el caso del hígado, el páncreas y el músculo esquelético (11, 18).
Al ser este proceso tan complejo, se pretende realizar una revisión de los diferentes aspectos relacionados con la inflamación que se desencadena en el tejido adiposo y cómo influyen en el desencadenamiento de la RI y el SM, para posteriormente hablar del papel que juegan las células del SI (innato y adquirido) y de algunas adipocitocinas.
Inflamación del tejido adiposo en la obesidad
En la obesidad se incrementa el tamaño del adipocito por el acúmulo de ácidos grasos en forma de triglicéridos, hasta que llega un momento en el que no puede hipertrofiarse más y es cuando se forman nuevos adipocitos (hiperplasia). La ganancia de peso puede ser el resultado de la hipertrofia, de la hiperplasia o de una combinación de ambas (6, 19, 20).
Para el diagnóstico de la obesidad, la OMS propone el cálculo del índice de masa corporal (IMC) (Tabla I); sin embargo, el IMC no refleja la adiposidad general y no permite obtener la contribución relativa de la masa grasa y la masa músculo-esquelética (MME) (21), por esta razón y para realizar un diagnóstico más preciso, se necesita hacer evaluación de la composición corporal, que busca a través de técnicas y equipos, detectar anormalidades fisiológicas en el cuerpo humano (22).
Muchas de las consecuencias metabólicas de la obesidad, como la presencia de RI, son resultado de la disfunción del TA (23). Se ha observado que son los condicionantes biológicos, genéticos y metabólicos los que determinan en aproximadamente un 70%, la acumulación de masa grasa en la región abdominal, en las vísceras y en la cadera (24).
El aumento en el tamaño del adipocito demanda mayor cantidad de oxígeno (O2); sin embargo, en muchas ocasiones no obtiene la cantidad de O2 necesaria, lo que propicia su muerte. Esto genera la remodelación del TA, con la consiguiente movilización de macrófagos para eliminar las células muertas y retirar su contenido lipídico. Esto incrementa la presencia de los mediadores de la inflamación en el tejido (Fig. 2)(3, 13).
El aumento en la acumulación de macrófagos, desempeña un papel determinante en el fenotipo de los linfocitos acumulados por el proceso inflamatorio (13, 25). En este sentido, la mayor proporción de macrófagos que reside en el TA de individuos con peso normal, son macrófagos M2 que secretan citocinas antiinflamatorias (IL-10, receptor antagonista de IL-1 [IL-1Ra]) y que juegan un papel crítico en mantener la sensibilidad a la insulina en el TA. En la obesidad, la mayoría de los macrófagos cambian a un fenotipo M1 que promueven la secreción de citocinas proinflamatorias (TNF- α, IL-6, IL-12), que desencadenan la fibrosis del TA y la RI local (26, 27).
Además de los macrófagos, principalmente M1, en este proceso inflamatorio actúan otras subpoblaciones leucocitarias (linfocitos T CD8, linfocitos T CD4 Th1, linfocitos B ygranulocitos, entre otros). Estas células se activan y empiezan a secretar citocinas (TNF-α, INF-g, IL-6), que amplifican la respuesta inmunológica y con esto la inflamación local (Figs. 2 y 3) (12, 25, 28, 29).
Aunado a lo anterior, se ha observado que la obesidad crónica lleva a la fibrosis del TA, con excesiva deposición de matriz extracelular, que físicamente también impide la habilidad del adipocito para expandirse y almacenar lípidos, ocasionando la liberación de ácidos grasos como diacilglicéridos, ceramidas y palmitato (28). Los ácidos grasos saturados liberados, se depositan en forma de triglicéridos en los órganos blanco de la insulina, como el músculo esquelético o actúan a nivel local como antígenos, activando vías proinflamatorias en las células (7,30-33), lo que agrava el estado proinflamatorio y contribuye significativamente al aumento de la RI (Figs. 2 y 3) (7, 13, 32).
La grasa visceral contribuye con solo el 15% de los ácidos grasos libres sistémicos totales, mientras que la mayoría de los ácidos grasos libres, son aportados por el tejido subcutáneo (TS). Esta observación, plantea la duda sobre la noción de que el TAV, es el único determinante de la sensibilidad a la insulina (34). Además, recientemente se ha observado que el TA, libera grandes cantidades de especies reactivas de oxígeno, lo cual también puede ser causalmente vinculado a la RI y al SM (34).
La hipoxia, la lipólisis, el mayor grado de estrés oxidante, el incremento de mediadores de inflamación, junto a la alteración en el perfil secretor de adipocinas en el tejido adiposo, tendrán como posible consecuencia, la aparición de enfermedades crónico degenerativas, como se documentará en el siguiente apartado (Fig. 2) (13, 25).
La inflamación es causante de resistencia a la insulina y de síndrome metabólico
La obesidad como un proceso inflamatorio crónico de baja intensidad, es el desencadenante de la RI. Esta resistencia juega un papel crítico en la fisiopatología del SM, pudiéndose considerar a la obesidad visceral, como el componente detonante tanto de la RI como del SM (3, 7, 35).
Para este fin, todos los cambios que ocurren en el TAV, como se describieron anteriormente, van a influir en la liberación de mediadores proinflamatorios (factor de necrosis tumoral (TNF)-α, interleucina (IL)-1β e IL-6), que actúan de una manera autocrina, paracrina o endocrina, que promueven la RI, por interferir con la señalización de la insulina a través de la activación de c-JUN cinasa N-terminal (JNK) y el factor nuclear kappa B (NF-kB) a nivel local (tejido adiposo y macrófagos). Estos mediadores escapan a la circulación en los tejidos diana de la insulina (músculo esquelético e hígado), propiciando la RI sistémica y reduciendo el efecto de la insulina en estos órganos, proceso clave que precede al desarrollo de enfermedades metabólicas, como el SM (11, 36).
De esta manera, la resistencia a la insulina se define clínicamente, por la incompetencia de una concentración determinada de insulina (endógena o exógena) para incrementar la utilización celular de glucosa. Por tanto, a idéntica cantidad de insulina en sangre, menor retirada de glucosa circulante y peor rendimiento celular como combustible metabólico en los órganos diana, ocasionando un mal rendimiento celular (TA, muscular y hepático, especialmente) (37).
Por otro lado, el SM es una entidad clínica que se caracteriza por un conjunto de factores de riesgo que incluyen obesidad visceral, alteraciones en el metabolismo de lípidos (aumento de triglicéridos y disminución de HDL-C) y de la insulina, hipertensión y presencia de factores protrombóticos e inflamatorios (38-41).
En distintos estudios realizados tanto en niños como en adultos, se ha observado una correlación positiva entre IMC y presencia de SM, donde a mayor IMC, mayor presencia de SM (38,42,43). A su vez, el SM determina un mayor riesgo de padecer DM2, ECV isquémica y muerte prematura (11, 44).
El proceso inflamatorio desencadenado por la obesidad involucra la participación del músculo esquelético y del hígado en el desarrollo de la RI sistémica y del SM (11, 36). Se ha propuesto que la proporción de la masa músculo esquelética (MME) podría jugar un papel importante en la progresión de SM. Aunque el TAV es el determinante más importante de la RI, que va a contribuir al desarrollo de SM, distintos estudios han puesto de manifiesto a la MME como otro sitio que contribuye a la RI en la obesidad (11, 45).
En un estudio de la proteómica de las fibras musculares (C2C12 myotubes) in vitro, a las cuales se les indujo RI, se encontró que el músculo es capaz de liberar cerca de 1073 proteínas putativas (en las que se incluyen: 32 factores de crecimiento, 25 citocinas y 29 metaloproteinasas), de las cuales cerca del 40% fueron reguladas bajo condiciones de RI (46, 47).
En animales de experimentación se ha mostrado una infiltración de macrófagos dentro del músculo esquelético de ratones obesos, particularmente en el depósito adiposo intramuscular. Estos macrófagos muestran un fenotipo proinflamatorio M1,acompañado de un incremento en la expresión de factores inflamatorios, contribuyendo a la RI local (Fig. 3) (11).Sin embargo, el contenido de macrófagos en el músculo esquelético en la obesidad, es mucho menor que en el TA o en el hígado y se necesita más investigación para determinar si el músculo esquelético es principalmente un blanco de la RI inducida por la inflamación o si cascadas inflamatorias locales, pueden también desempeñar un papel en la RI (11).
De esta manera, se resalta la importancia de la presencia e interacción de las células que residen en el TA y de acuerdo a estudios recientes, también de la MME sobre el desarrollo de RI y con ello de las enfermedades metabólicas que inicialmente se presentan como SM. Es por tal, que en la sección siguiente se mostraran resultados de algunos estudios sobre la relación de las células tanto del sistema inmune adaptativo como innato en la participación del desarrollo de estas patologías.
Las células del sistema inmunitario están asociadas a la obesidad y a la resistencia a la insulina
El tejido adiposo contiene entre 1 y 2 millones de adipocitos, pero 4 a 6 millones son células de la fracción vascular estromal, de las cuales el 65% son leucocitos (28). Desde hace décadas, se tienen datos que muestran que las células inmunes forman parte del TA (48). Sin embargo, la primera asociación entre obesidad e inflamación se propuso en 1901 cuando se observó que la administración de salicilato de sodio mejoraba la DM2. Pero, no fue sino hasta principios de los años 90 cuando llegó a establecerse la evidencia de un papel causal de la inflamación en la obesidad, la cual induce RI (32). Trabajos más recientes, han comenzado a descubrir los vínculos reguladores entre los sistemas metabólicos e inmunológicos que se originan principalmente en el TAV (16, 32).
Ahora es bien sabido que la expansión de las células del SI y su sostenida activación en el TA durante la obesidad, causa inflamación y disfunción del TA, lo que puede llevar al desarrollo de la RI (Fig. 4) (28).
Se han observado cambios en las subpoblaciones linfocitarias tanto del SI innato como el adaptativo, de pacientes obesos. Estas células del SI se acumulan en el TAV de personas obesas y esto puede deberse a varios procesos, como aumento de la supervivencia y proliferación de las células inmunes residentes, así como a un mayor reclutamiento hacia el TAV o a la disminución en el retorno hacia la sangre periférica (30, 32). Incluso existen diferencias en la proporción de estas células entre los distintos depósitos de grasa, tanto en el TAV como en el TS. Se han observado más macrófagos, linfocitos T y moléculas inflamatorias en el TAV, en comparación con el tejido subcutáneo de individuos obesos (11, 49). Además, en el TAV de individuos obesos con SM se encontró un bajo número de linfocitos T reguladores (Fig. 4) (11).
A nivel de sangre periférica, son pocos los estudios que hay y los resultados son contradictorios, en cuanto a su asociación con el proceso inflamatorio desencadenado por la obesidad y su relación con la RI y el SM. En un estudio realizado en una población de adultos jóvenes obesos, se encontraron cambios en los linfocitos totales y en los granulocitos de personas con TAV incrementado y con SM, en comparación con personas con TAV normal y SM. También se observó, una correlación positiva entre linfocitos B y MME y entre linfocitos T y TS, poniendo de manifiesto la importancia de estos tejidos en la inflamación de bajo grado, desencadenada por la obesidad (50).
1. Participación de células del sistema inmune innato en la inflamación crónica de baja intensidad, desencadenada por la obesidad
Muchos tipos de células del SI innato están involucradas en el desarrollo de la inflamación del TA. Las más estudiadas son los macrófagos y es por tal razón que en esta revisión nos enfocaremos a las otras células del SI innato.
Los mastocitos, mediadores primarios de reacciones alérgicas (12, 51), han sido implicados en la obesidad y la RI. Los mastocitos están distribuidos en microvasos, así como regiones fibróticas en el TA. Se ha observado que las personas obesas, tienen un incremento de mastocitos y el TA ha sido identificado como una fuente de células progenitoras de mastocitos, sugiriendo una relación sinérgica entre el TA y la propagación de mastocitos (12, 29).
La relación entre basófilos y comorbilidades asociadas a la obesidad son menos claras, ya que en 2 estudios realizados en humanos, no encontraron basófilos significativamente incrementados en personas con obesidad, mientras otros dos estudios encontraron una relación positiva entre basófilos circulantes e IMC y marcadores del síndrome metabólico (12, 52-55).
Los neutrófilos son los primeros en migrar a los lugares de infección y son de corta vida. También son bien conocidos como un tipo de célula efectora primaria en la respuesta inflamatoria aguda (26, 56). Incluso este papel se mantiene en la inflamación ocasionada por la obesidad, ya que en 2012 Talukdar y col. encontraron que los neutrófilos son las primeras células en responder a la inflamación y que estas infiltran el TAV aproximadamente 3 días después de consumir una dieta alta en grasa y la infiltración puede mantenerse hasta por 90 días (36, 57-59). En un estudio realizado en mujeres adolescentes, encontraron que el número de neutrófilos está asociado positivamente con el IMC, la circunferencia de cintura y el TA total (52).
Por su parte, los eosinófilos han mostrado un papel protector contra la obesidad y la RI a través de la disminución de la inflamación del TA. El número de eosinófilos disminuye con la presencia de obesidad y se ha observado que es esencial para mantener macrófagos M2 (mediante la liberación IL-4 e IL-13) y sensibilidad a la insulina in vivo (12, 29, 60, 61). Incluso se ha demostrado en modelos murinos que ratones deficientes de eosinófilos, han presentado incremento de peso corporal y pérdida de la sensibilidad a la insulina, sugiriendo que estas células ayudan a preservar la regulación metabólica normal (29).
En cuanto a las células asesinas naturales (NK, por sus siglas en inglés), se ha reportado que en pacientes con obesidad, la proporción de estas células se encuentra disminuida en sangre periférica (62); así mismo, se ha señalado que en sujetos obesos con niveles altos de TG y glucosa, la disminución de células NK fue más marcada y los autores lo interpretaron como la causa de alta incidencia de infecciones en individuos obesos (63), aunque su rol en la obesidad aún no está bien definido. También se ha observado que la ablación sistémica de células NK en ratones, disminuye el flujo de macrófagos hacia el TAV y promueve sensibilidad a la insulina (32, 64).
2. Participación de células del sistema inmune adaptativo en la inflamación crónica de baja intensidad desencadenada por la obesidad
Similar a las células del SI innato, las células del SI adaptativo, tales como las células T y B, juegan un rol importante en la transición de la homeostasis metabólica en TA sano a un estado de inflamación crónica y de RI en personas con obesidad (12). Incluso en estudios a nivel de sangre periférica, se ha observado una asociación entre el incremento de linfocitos totales en pacientes con SM que presentaron TAV incrementado en comparación con aquellas con TAV normal y con SM (65).
Asimismo, se ha demostrado que los linfocitos T CD4Th1 y T CD8 infiltran el TA inflamado y promueven la actividad clásica proinflamatoria de los macrófagos M1, así como la producción de citocinas proinflamatorias en personas obesas (66-68). También se ha observado, que los linfocitos T CD8 infiltran el TAV antes de la migración de macrófagos al tejido (69); además, la ausencia de linfocitos se ha asociado con disminución en la acumulación de macrófagos y citocinas proinflamatorias en el TAV (32). Por otro lado, se ha observado que la infiltración de linfocitos T CD8 parece ser un evento clave que precede a la ausencia de células reguladoras (16). Es bien conocido que los linfocitos T CD4 Th1, secretan INF-g, el cual maneja la inflamación y la polarización de macrófagos hacia el fenotipo M1 en TA e hígado de personas que presentan obesidad (Fig. 2)(12).
Las células reguladoras (T reg), son linfocitos antiinflamatorios, que se encuentran en el TA sano y disminuidas con el incremento de la obesidad y de linfocitos CD4 Th1 (65). De hecho estas células reguladoras juegan un rol integral en prevenir la inflamación adiposa y la RI (12).
Los linfocitos B han sido considerados como reguladores sistémicos y locales del TA inflamado, durante la RI relacionada con la obesidad. Se explicaba esta regulación sistémica, a través de la presentación del antígeno, de la secreción de citocinas antiinflamatorias y de la producción de anticuerpos. Por lo que a los linfocitos B se les había atribuido una habilidad única para modular la producción de citocinas en células T y macrófagos, ofreciéndose así como un atractivo blanco en la terapia inmune para la RI (66). Sin embargo, en estudios recientes, se ha encontrado evidencia que contradice estos primeros descubrimientos, pues se ha observado que ratones con RI, que presentan reducción o pérdida de los linfocitos B, han desarrollado menos RI relacionada con la obesidad y la inflamación, con lo que se sugiere que los linfocitos B promueven disfunción metabólica asociada con la obesidad (64).
De igual manera, a nivel de sangre periférica, se ha demostrado que los linfocitos B de sujetos con DM2 secretan un perfil de citocinas proinflamatorias, que incluye una elevada producción de IL-8 y una extraordinaria inhabilidad de secretar la IL-10, comparado con células B de sujetos no diabéticos (70). También se ha observado que a mayor cantidad de linfocitos B, se presenta mayor proporción de masa músculo esquelética en personas obesas con TAV incrementado y sin SM (65), apoyando la asociación entre MME y la presencia de RI. Así mismo, un estudio realizado en ratones, señaló que los linfocitos B pueden promover la obesidad hipertrófica, al impulsar la inflamación sistémica y cambios perjudiciales en la homeostasis de la glucosa (71).
Además de las células inmunitarias y sus citocinas, en este proceso inflamatorio participan los mediadores inflamatorios que secreta el adipocito, a los que se les ha denominado adipocitocinas. Estas adipocitocinas juegan un papel importante sobre la sensibilidad y secreción de la insulina en órganos blanco como TA, hígado, músculo y células β pancreáticas (10, 29, 48), por lo que se analiza la participación de estas moléculas en el proceso inflamatorio en personas con obesidad.
Adipocitocinas
Las adipocitocinas son pequeñas hormonas secretadas por el adipocito, que participan en la homeostasis del organismo, pueden tener propiedades inflamatorias o antiinflamatorias. La pérdida del equilibrio en esta estrecha relación, se observa frecuentemente en estados tales como la obesidad, propiciando que el ambiente que rodea al adipocito fomente la RI y se desarrolle el SM (8, 72-77).
Al mismo tiempo, se ha observado que ciertas adipocitocinas dirigen la expresión y función de la compleja red de quimiocinas como MCP-1y CCL20, que regulan la acumulación de células inflamatorias en el TAV y de esta forma, fomentan el desarrollo de la inflamación local (30, 78).
Algunas adipocitocinas y citocinas secretadas por el adipocito se encuentran en la Tabla II, varias han sido ampliamente estudiadas. En el presente artículo se revisan las que se ha considerado que tienen un importante efecto en el proceso inflamatorio y que están relacionadas con la génesis de la obesidad, con la RI y con enfermedades inflamatorias crónicas (8, 74-77).
1. Adiponectina
La adiponectina es una adipocitocina codificada por el gen Adipoq. Es también conocida como Acrp30, ap M1 y GBP28 (79). Circula en varias isoformas oligoméricas tres de las cuales son las más comunes: trímeros, hexámeros y complejos oligoméricos de alto peso molecular. Esta última representa la forma activa de la adiponectina. En el suero también puede existir como adiponectina globular, molécula que se puede trimerizar pero no forma oligómeros de alto peso molecular. Cada una de estas isoformas tiene efectos diferentes, en esta revisión se analizan los efectos de la molécula de alto peso molecular, pues es la que se encarga de regular la sensibilidad a la insulina (80).
La adiponectina tiene una actividad antiinflamatoria, antiaterogénica y sensibiliza a la insulina en los tejidos. Se libera exclusivamente del TA y tiene como órganos blanco el hígado, los músculos, el cerebro y el endotelio vascular principalmente (72, 81, 82). El intervalo de sus niveles en plasma es de 5 a 30 mg/L, en individuos con peso normal (76, 82). Sus acciones metabólicas en los tejidos, consisten en incremento de la oxidación de ácidos grasos y reducción de la gluconeogénesis, con lo que se previene la acumulación de grasa ectópica (73, 83)(Tabla II).
Se ha propuesto que los efectos antiinflamatorios de la adiponectina, probablemente ocurren por inhibición de la expresión de moléculas de adhesión (84). La insulina, la leptina y las citocinas proinflamatorias reducen su secreción y a su vez, la adiponectina modula la producción de citocinas por parte del TA y de otras células (85).
Se ha observado que los niveles de adiponectina en plasma, son inversamente proporcionales a la masa del TA y están reducidos en pacientes con SM, DM2, hipertensión, dislipidemia y aterosclerosis (72, 73, 76, 82). Por lo que se ha considerado, que las personas con altos niveles de adiponectina circulante, tienen menos posibilidad de desarrollar DM2 que aquellos que presentan bajas concentraciones de adiponectina. Además, las concentraciones de adiponectina se correlacionan positivamente con las concentraciones de HDL-C y negativamente con las concentraciones de TG. Se ha observado en pacientes con mutaciones del gen de la adiponectina, que presentan baja concentración de adiponectina y que desarrollan SM y DM2 (72, 86).
Los efectos de la adiponectina en la sensibilidad a la insulina, se han demostrado en estudios in vivo en animales (ratones) deficientes de adiponectina, donde se observó un marcado incremento de los niveles de glucosa e insulina en sangre, así como RI. Por el contrario, la suplementación de adiponectina redujo el desarrollo de RI en estos animales (72).
La actividad de la adiponectina, se produce a través de los receptores denominados AdipoR1 y AdipoR2; el primero de expresión en el músculo esquelético y el segundo, en el hígado principalmente (72, 73, 76, 82). Estos receptores por activación de la vía proteína cinasa AM (AMPK) y por los receptores activados por proliferadotes peroxisomales α (PPAR-α) permiten a la adiponectina mediar los efectos sensibilizantes a la insulina (72). Sin embargo, la expresión de estos receptores disminuye significativamente en tejido adiposo, hígado y músculo esquelético de personas con obesidad y DM2, debido principalmente a mediadores inflamatorios como el TNF-α e IL-6 (87).
Se ha observado que la adipoR1 mejora la sensibilidad a la insulina mediante AMPK al promover activación del sustrato del receptor de la insulina 2 (Irs2) y PPARα por ayudar con la oxidación de ácidos grasos (88). Estudios realizados con ratones deficientes de ambos receptores, revelaron el papel que estas proteínas tienen con respecto a la sensibilización de la insulina y la supresión de inflamación y del estrés oxidativo. En particular, el ratón knockout de AdipoR1 resultó en reducida activación de AMPK inducida por adiponectina, mientras el knockout de AdipoR2 presentó disminuida la actividad de la vía de PPARα (72).
2. Resistina
La resistina es una citocina que se descubrió en 2001 como proinflamatoria, involucrada con marcadores inflamatorios (TNF-α e IL-6), la RI y la obesidad (71, 89-92).
Circula en dos estados, en hexámeros de alto peso molecular que tienen una concentración más alta que los de bajo peso molecular. Los hexámeros de bajo peso molecular son más bioactivos. Las células mononucleares (macrófagos) de sangre periférica son las principales productoras de la resistina (80, 93), y su expresión es incrementada por una variedad de estímulos inflamatorios como la presencia de lipopolisacáridos (LPS) (14). Los valores normales en humanos sanos van de 4-12 ng/mL (89).
La resistina también se expresa en células musculares, pancreáticas y adipocitos (5, 92). Recientemente se ha propuesto que el mecanismo por el cual la resistina genera RI es por la activación directa del receptor TLR4 en el adipocito, el cual activa a las cinasas inhibidoras de cinasas (IKK) y JNK que previenen la activación de fosfatidilinositol-3 cinasa (PI3K) por fosforilar residuos de serina (12, 81, 94).
Así mismo, se ha observado que la depleción de resistina circulante mejora la acción de la insulina en ratones obesos, además, se ha observado que la resistina está implicada en la regulación de la función de las células β del páncreas, así como manteniendo una adecuada cantidad de estas células en estos animales. En humanos, en un estudio se observó que la resistina se expresó en células β, pero no en células α, y esta expresión incrementó en individuos con DM2 (79, 95).
En diferentes estudios se ha observado que la producción de esta adipocitocina, se incrementa en estados inflamatorios crónicos y que en personas con obesidad se muestran valores de la resistina en suero mayores que en sujetos con un IMC normal. Lo que muestra una correlación positiva entre IMC y la resistina (71,73,91). También en niños se han relacionado los niveles de la resistina en suero con obesidad central y RI (96).
Varios autores (71, 92, 95) indican que los niveles de la resistina incrementados en suero están vinculados con la grasa visceral, la RI, la DM2, marcadores inflamatorios (TNF-α e IL-6), el infarto al miocardio y la aterosclerosis; es por tal que algunos autores dicen que los niveles de la resistina podrían servir como marcador informativo para enfermedades metabólicas en humanos.
En un estudio realizado en pacientes adultos jóvenes con obesidad, se observó una asociación entre la concentración sanguínea de la resistina en pacientes sin SM y con TAV incrementado, en comparación con aquellas sin SM y con TAV normal, relación que no se pudo observar en personas con presencia de SM. Los autores concluyeron que el encontrar el aumento de la resistina en pacientes con TAV incrementado sin SM, de alguna manera podrían indicar, que estas personas pueden presentar alteraciones metabólicas en un futuro, ya que se ha visto que la resistina promueve la producción de citocinas inflamatorias y se ha señalado como un marcador de enfermedad metabólica (50).
Sin embargo, otros investigadores (71, 75, 95, 97) no han observado relación entre marcadores metabólicos con los niveles de esta adipocitocina), incluso se le ha encontrado disminuida en personas con obesidad (90). De la misma manera, en otras investigaciones con niños obesos no se encontró correlación de los niveles de la resistina con la reducción de peso ponderal, respuesta a la actividad física, con el contenido graso corporal, ni con los índices de RI (98). Por otro lado, en un estudio igual en niños con obesidad, si se relacionaron los niveles de la resistina en suero con obesidad central y resistencia a la insulina (96).
3. Visfatina
La visfatina es una citocina que es expresada en un gran número de células incluyendo las de la médula ósea, el músculo, el hígado, el riñón y el tejido adiposo blanco y marrón. Se ha observado que sus concentraciones en suero son impulsadas por secreciones provenientes del adipocito de la grasa visceral (4, 74, 75, 79, 86).
Otros estudios han señalado que la fuente principal de esta adipocitocina son los leucocitos bajo el estímulo proinflamatorio del TA, lo que implica que sus acciones estarían relacionadas mayoritariamente con la inflamación y no con la regulación metabólica (99, 100).
De todas formas, se propone como un marcador temprano de disfunción de los adipocitos. Se ha observado que aumenta en forma rápida con el deterioro metabólico, el aumento de peso y el incremento de la circunferencia abdominal (73). Se estima que la concentración fisiológica en plasma de la visfatina es de 15 ng/mL (76). Se ha descrito la existencia de una correlación positiva entre los niveles séricos de la visfatina y el contenido graso corporal, obesidad, DM2 y con el SM; así como un descenso de los mismos tras la reducción de peso ponderal (75, 80, 98, 101).
Además, se ha encontrado que los niveles de la visfatina son altos en la hipercolesterolemia total y de LDL incrementados; y son directamente proporcionales a los niveles de TNF-α y de la resistina, pero en otros estudios se han observado sus niveles disminuidos en pacientes obesos y en la hiperlipidemia (73, 79, 101), así como, en el embarazo y en la diabetes gestacional (102). Por otro lado, en un estudio se encontró una clara asociación positiva entre las concentraciones circulantes de la visfatina y la adiposidad en hombres, pero no en mujeres (79).
También se ha propuesto una asociación de la visfatina con alteraciones en la glucosa. Esto mediante la respuesta inflamatoria, la disminución de la función de las células β pancreáticas y del ritmo circadiano, en animales de experimentación; sin embargo, aún no hay datos disponibles en humanos (79, 86, 103).
Se le ha relacionado con la inflamación a través de su capacidad para: inhibir la apoptosis de los neutrófilos, por un mecanismo mediado por las caspasas 3 y 8; el aumento de la expresión del factor de transcripción NF-κB en las células endoteliales y producción de TNF-α e IL-6. Los efectos mediadores de los niveles de glucosa en sangre, se realizan mediante su unión al receptor de la insulina (mimetiza a la insulina), lo que induce una disminución de los niveles de glucosa plasmática, permitiendo su entrada en el adipocito y el músculo esquelético, lo que suprime la producción de la misma por el hígado (13, 14, 104).
En humanos se ha visto que la visfatina se produce en los islotes pancreáticos y es secretada en respuesta a la estimulación de la glucosa, lo que sugiere que esta citocina podría actuar como una señal autócrina/parácrina en los islotes pancreáticos, para regular la función de células β; sin embargo, los mecanismos potencialmente pleiotrópicos por los cuales la visfatina modula y protege la función de las células β, no están bien establecidos (79).
Con todo lo que se ha señalado, se podría decir que la acumulación excesiva de grasa corporal produce un alto impacto en la salud de los individuos obesos afectando negativamente su condición física, vitalidad y en general su calidad de vida (44). Estas alteraciones pueden evitarse para tratar de contener la epidemia de la obesidad y prevenir el incremento de las consecuencias negativas asociadas a la obesidad, ya que se ha pronosticado que si las tendencias del aumento de este padecimiento continúan como lo han hecho después del año 2000, el mundo no cumplirá el objetivo global para detener esta epidemia (2). La prevención debe ser efectiva para lograr la restauración de la homeostasis (cardiovascular y metabólica) (44).
CONCLUSIÓN
En esta revisión se analizó la inflamación crónica de bajo grado que desencadena el TA como consecuencia de la obesidad, como un factor principal en la patogénesis de resistencia a la insulina que propicia la aparición del SM, el cual puede continuar y provocar el desarrollo de DM2, ECV e incluso cáncer.
Los cambios estructurales en el TAV, ocasionan la liberación por parte de los adipocitos de citocinas denominadas adipocitocinas, así como movilización y activación de subpoblaciones leucocitarias, las cuales también pueden liberar varios mediadores, ayudando a establecer el proceso inflamatorio y daños sobre la sensibilidad a la insulina a nivel local. A su vez estas moléculas logran llegar a la circulación sistémica, donde dañan otros órganos como el hígado y el músculo esquelético, provocando afectación en el metabolismo de los macronutrientes, lo cual provoca el desarrollo de enfermedades metabólicas como el SM, que a su vez incrementa la posibilidad de desencadenar enfermedades crónico degenerativas. Además, esta revisión pone de manifiesto a la MME como otro tejido que participa en la patogénesis de la obesidad, la RI y el SM, aparte de todas las células y de los mediadores liberados por el TA.
Asimismo, al revisar varios componentes que participan en este proceso se puede señalar que aún hay muchos aspectos a dilucidar, como puede ser el papel que juegan algunas células, como los linfocitos B, o de citocinas como la visfatina, donde algunos autores los describen como protectores ante la inflamación y otros como participantes del proceso inflamatorio. En cambio a los linfocitos T CD4 y T CD8 se les ha señalado como células proinflamatorias, y a la resistina como citocina participante. En cambio a las células eosinófilas y a la adiponectina se les clasifica como células y citocina protectoras del proceso inflamatorio.
Referencias
1. Organisation for Economic Co-operation and Development (OECD). Obesity update. Secretary-General of the Organisation for Economic Co-operation and Development. 2014; 1-8. [ Links ]
2. Collaboration N C D R F. Trends in adult body-mass index in 200 countries from 1975 to 2014: a pooled analysis of 1698 population-based measurement studies with 19.2 million participants. Lancet 2016; 387: 1377-1396. [ Links ]
3. Nava H, Zamudio P, García A, Noyola M, Pizaña A, Hernández C, Reynoso R. Papel del adipocito en la expresión del factor inducible por hipoxia (HIF) asociado a la obesidad. Neumol Cir Torax 2011; 70: 261-266. [ Links ]
4. Sarvottam K, Yadav R. Obesity-related inflammation & cardiovascular disease: Efficacy of a yoga-based lifestyle intervention. Indian J Med Res 2014; 139: 822-834. [ Links ]
5. Álvarez-Castro P, Sangiao-Alvarellos S, Brandón-Sandá I, Cordido F. Función endocrina en la obesidad. Endocrinologia y Nutrición 2011; 58: 422-432. [ Links ]
6. Haro M, Antonio M, Ponce y Ponce G, Andrés Núñez A, Ruiz- Esparza J, Soria C, Clarck I, Maciel G. Hipertrofía ventricular en el paciente con obesidad. Salud Pública y Nutrición 2012; 13: 1-8. [ Links ]
7. Suganami T, Yuan X, Shimoda Y, Uchio-Yamada K, Nakagawa N, Shirakawa I, Usami T, Tsukahara T, Nakayama K, Miyamoto Y, Yasuda K, Matsuda J, Kamei Y, Kitajima S, Ogawa Y. Activating transcription factor 3 constitutes a negative feedback mechanism that attenuates saturated Fatty acid/toll-like receptor 4 signaling and macrophage activation in obese adipose tissue. Circ Res 2009; 105: 25-32. [ Links ]
8. Balistreri C, Caruso C, Candore G. The role of adipose tissue and adipokines in obesity-related inflammatory diseases. Mediators Inflamm 2010; 2010: 802078. [ Links ]
9. Derosa G, Fogari E, DAngelo A, Bianchi L, Bonaventura A, Romano D, Maffioli P. Adipocytokine levels in obese and non-obese subjects: an observational study. Inflammation 2013; 36: 914-920. [ Links ]
10. Bocca G, Corpeleijn E, Stolk R, Wolffenbuttel B, Sauer P. Effect of obesity intervention programs on adipokines, insulin resistance, lipid profile, and low-grade inflammation in 3- to 5-y-old children. Pediatr Res 2014; 75: 352-357. [ Links ]
11. Esser N, Legrand-Poels S, Piette J, Scheen A, Paquot N. Inflammation as a link between obesity, metabolic syndrome and type 2 diabetes. Diabetes Res Clin Pract 2014; 105: 141-150. [ Links ]
12. Johnson A, Milner J, Makowski L. The inflammation highway: metabolism accelerates inflammatory traffic in obesity. Immunol Rev 2012; 249: 218-238. [ Links ]
13. Gómez J, Rodriguez A, Catalan V, Fruhbeck G. Papel del tejido adiposo en la inflamación asociada a la obesidad. Rev Esp Obes 2008; 6: 264-279. [ Links ]
14. Aguilar-Valles A, Inoue W, Rummel C, Luheshi G. Obesity, adipokines and neuroinflammation. Neuropharmacology 2015; 96: 124-134. [ Links ]
15. Fresno M, Alvarez R, Cuesta N. Toll-like receptors, inflammation, metabolism and obesity. Arch Physiol Biochem 2011; 117: 151-164. [ Links ]
16. Makki K, Froguel P, Wolowczuk I. Adipose tissue in obesity-related inflammation and insulin resistance: cells, cytokines, and chemokines. ISRN Inflamm 2013; 2013:139239, 12 pags. [ Links ]
17. Boulet N, Esteve D, Bouloumie A, Galitzky J. Cellular heterogeneity in superficial and deep subcutaneous adipose tissues in overweight patients. J Physiol Biochem 2013; 69: 575-583. [ Links ]
18. Marette A, Liu Y, Sweeney G. Skeletal muscle glucose metabolism and inflammation in the development of the metabolic syndrome. Rev Endocr Metab Disord 2014; 15: 299-305. [ Links ]
19. Kathleen L, Escott-Stump S. Krause Dietoterapia. 12. Barcelona, España: 2009. [ Links ]
20. Coelho M, Oliveira T, Fernandes R. Biochemistry of adipose tissue: an endocrine organ. Arch Med Sci 2013; 9: 191-200. [ Links ]
21. Kim S, Valdez R. Metabolic risk factors in U.S. youth with low relative muscle mass. Obes Res Clin Pract 2015; 9: 125-132. [ Links ]
22. Ripka W, Rotta C, Ulbricht L, Neves E. Body composition evaluated by skinfolds, bioimpedance and body mass index in adults. Rev int med cienc act fís deporte 2014; 14: 279-289. [ Links ]
23. Anderson E, Gutierrez D, Kennedy A, Hasty A. Weight cycling increases T-cell accumulation in adipose tissue and impairs systemic glucose tolerance. Diabetes 2013; 62: 3180-3188. [ Links ]
24. González G, Hernandez S, Pozo P, Garcia D. Asociación entre tejido graso abdominal y riesgo de morbilidad: efectos positivos del ejercicio físico en la reducción de esta tendencia. Nutr Hosp 2011; 26: 685-691. [ Links ]
25. Kalupahana N, Moustaid-Moussa N, Claycombe K. Immunity as a link between obesity and insulin resistance. Mol Aspects Med 2012; 33: 26-34. [ Links ]
26. Huh J, Park Y, Ham M, Kim J. Crosstalk between adipocytes and immune cells in adipose tissue inflammation and metabolic dysregulation in obesity. Mol Cells 2014; 37: 365-371. [ Links ]
27. Seijkens T, Kusters P, Chatzigeorgiou A, Chavakis T, Lutgens E. Immune cell crosstalk in obesity: a key role for costimulation? Diabetes 2014; 63: 3982-3991. [ Links ]
28. Kanneganti T, Dixit V. Immunological complications of obesity. Nat Immunol 2012; 13: 707-712. [ Links ]
29. Lumeng C. Innate immune activation in obesity. Mol Aspects Med 2013; 34: 12-29. [ Links ]
30. Chatzigeorgiou A, Karalis K, Bornstein S, Chavakis T. Lymphocytes in obesity-related adipose tissue inflammation. Diabetologia 2012; 55: 2583-2592. [ Links ]
31. Dunmore S, Brown J. The role of adipokines in beta-cell failure of type 2 diabetes. J Endocrinol 2013; 216: T37-45. [ Links ]
32. Kammoun H, Kraakman M, Febbraio M. Adipose tissue inflammation in glucose metabolism. Rev Endocr Metab Disord 2014; 15: 31-44. [ Links ]
33. Tchkonia T, Thomou T, Zhu Y, Karagiannides I, Pothoulakis C, Jensen M D, Kirkland J. Mechanisms and metabolic implications of regional differences among fat depots. Cell Metab 2013; 17: 644-656. [ Links ]
34. Patel P, Abate N. Body fat distribution and insulin resistance. Nutrients 2013; 5: 2019-2027. [ Links ]
35. Caimi G, Hopps E, Noto D, Canino B, Montana M, Lucido D, Lo Presti R, Averna M. Protein oxidation in a group of subjects with metabolic syndrome. Diabetes Metab Syndr 2013; 7: 38-41. [ Links ]
36. Winer D, Winer S, Chng M, Shen L, Engleman E. B Lymphocytes in obesity-related adipose tissue inflammation and insulin resistance. Cell Mol Life Sci 2014; 71: 1033-1043. [ Links ]
37. Costa B, Cabré J, Martín F. Metabolic syndrome, resistance to insulin and diabetes. What is hidden beneath the tip of the iceberg? Aten Primaria 2003; 31: 436-445. [ Links ]
38. Nájera-Medina O, Villanueva Arriaga R, Figueroa-Valverde L, Rodríguez López C, Muñozcano-Skimore O, González Torres M, Irigoyen Camacho E, García-López S. Prevalence of metabolic syndrome in overweight and obese schoolchildren. Ciencias Clínicas 2015; 16: 18-25. [ Links ]
39. García-López S, Villanueva Arriaga R, Nájera-Medina O, Rodríguez López C, Figueroa-Valverde L, García Cervera E, Muñozcano-Skimore O, Rosas-Nexticapa M. One month of omega-3 fatty acid supplementation improve lipid profiles, glucose levels and blood pressure in overweight schoolchildren with metabolic syndrome. J Pediatr Endocr Met 2016; 29:1143-1150. [ Links ]
40. Perez-Idarraga A, Valencia Gomez K, Gallo Villegas J, Arenas Sosa M, Quintero Velasquez M. Intervention with rumba and nutrition education to modify cardiovascular risk factors in adults with metabolic syndrome. Rev Panam Salud Publica 2015; 37: 29-37. [ Links ]
41. Gotthelf S. Prevalencia de síndrome metabólico según definición de la International Diabetes Federation (IDF) en adolescentes escolarizados de la provincia de Salta, Argentina. Rev Fed Arg Cardiol 2013; 42: 119-126. [ Links ]
42. Nájera-Medina O, Villanueva Arriaga R, Rodríguez López C, Figueroa-Valverde L, Muñozcano-Skimore O, González Torres M, Irigoyen Camacho E, García López S. Prevalencia de síndrome metabólico en niños escolares con riesgo de sobrepeso, sobrepeso y obesidad (Resumen). Memorias del II Encuentro de Investigación y Servicio del Departamento de Atención a la Salud, 2015. Ciudad de México. P 36. [ Links ]
43. Nájera-Medina O, Abarca-Vargas A, García López S, Villanueva Arriaga R, Rodríguez López C, Figueroa-Valverde L, Muñozcano-Skimore O, González Torres M, Palacios-Martínez M. Omega 3 como protector en escolares con síndrome metabólico (Resumen). Memorias del II Encuentro de Investigación y Servicio del Departamento de Atención a la Salud, 2015. Ciudad de México. P 94. [ Links ]
44. Vásquez F, Diaz E, Lera L, Vásquez L, Anziani A, Leyton B, Burrows R. Evaluación longitudinal de la composición corporal por diferentes métodos como producto de una intervención integral para tratar la obesidad en escolares chilenos. Nutr Hosp 2013; 28: 148-154. [ Links ]
45. Rodríguez López C, González Torres M, Cruz Bautista I, Nájera-Medina O. Composición corporal en pacientes con síndrome metabólico (Resumen). Memorias del XX Simposio del Departamento de Ciencias de la Salud, 2015. Ciudad de México. P 46. [ Links ]
46. Gregor M, Hotamisligil G. Inflammatory mechanisms in obesity. Annu Rev Immunol 2011; 29: 415-445. [ Links ]
47. Deshmukh A, Cox J, Jensen L, Meissner F, Mann M. Secretome analysis of lipid-induced insulin resistance in skeletal muscle cells by a combined experimental and bioinformatics workflow. J Proteome Res 2015; 14: 4885-4895. [ Links ]
48. Hellman B, Larsson S, Westman S. Mast cell content and fatty acid metabolism in the epididymal fat pad of obese mice. Acta Physiol Scand 1963; 58: 255-262. [ Links ]
49. Cancello R, Henegar C, Viguerie N, Taleb S, Poitou C, Rouault C, Coupaye M, Pelloux V, Hugol D, Bouillot J, Bouloumie A, Barbatelli G, Cinti S, Svensson P, Barsh G, Zucker J, Basdevant A, Langin D, Clement K. Reduction of macrophage infiltration and chemoattractant gene expression changes in white adipose tissue of morbidly obese subjects after surgery-induced weight loss. Diabetes 2005; 54: 2277-2286. [ Links ]
50. Rodríguez López C. Relación de adipocitocinas y subpoblaciones linfocitarias en pacientes con síndrome metabólico con y sin obesidad visceral. [Tesis de Maestría]. México, D.F.: Universidad Autónoma Metropolitana unidad Xochimilco; 2015. [ Links ]
51. Rao K, Brown M. Mast cells: multifaceted immune cells with diverse roles in health and disease. Ann N Y Acad Sci 2008; 1143: 83-104. [ Links ]
52. Kim J, Park H. White blood cell count and abdominal fat distribution in female obese adolescents. Metabolism 2008; 57: 1375-1379. [ Links ]
53. Johannsen N, Priest E, Dixit V, Earnest C, Blair S, Church T. Association of white blood cell subfraction concentration with fitness and fatness. Br J Sports Med 2010; 44: 588-593. [ Links ]
54. Laurson K, McCann D, Senchina D. Age, sex, and ethnicity may modify the influence of obesity on inflammation. J Investig Med 2011; 59: 27-31. [ Links ]
55. Suzukawa M, Nagase H, Ogahara I, Han K, Tashimo H, Shibui A, Koketsu R, Nakae S, Yamaguchi M, Ohta K. Leptin enhances survival and induces migration, degranulation, and cytokine synthesis of human basophils. J Immunol 2011; 186: 5254-5260. [ Links ]
56. Abbas A, Lichtman A, Pillai A. Inmunología celular y molecular. Séptima. México, D.F.: 2012, 316. [ Links ]
57. Talukdar S, Oh da Y, Bandyopadhyay G, Li D, Xu J, McNelis J, Lu M, Li P, Yan Q, Zhu Y, Ofrecio J, Lin M, Brenner M, Olefsky J. Neutrophils mediate insulin resistance in mice fed a high-fat diet through secreted elastase. Nat Med 2012; 18: 1407-1412. [ Links ]
58. Xu X, Su S, Wang X, Barnes V, De Miguel C, Ownby D, Pollock J, Snieder H, Chan W, Wang X. Obesity is associated with more activated neutrophils in African American male youth. Int J Obesity 2015; 39: 26-32. [ Links ]
59. Kredel L, Siegmund B. Adipose-tissue and intestinal inflammation - visceral obesity and creeping fat. Front Immunol 2014; 5: 462. [ Links ]
60. Fearnside J, Dumas M, Rothwell A, Wilder S, Cloarec O, Toye A, Blancher C, Holmes E, Tatoud R, Barton R, Scott J, Nicholson J, Gauguier D. Phylometabonomic patterns of adaptation to high fat diet feeding in inbred mice. PLoS One 2008; 3: e1668. [ Links ]
61. Wu D, Molofsky A B, Liang H, Ricardo-Gonzalez R, Jouihan H, Bando J, Chawla A, Locksley R. Eosinophils sustain adipose alternatively activated macrophages associated with glucose homeostasis. Science 2011; 332: 243-247. [ Links ]
62. Duffaut C, Zakaroff-Girard A, Bourlier V, Decaunes P, Maumus M, Chiotasso P, Sengenes C, Lafontan M, Galitzky J, Bouloumie A. Interplay between human adipocytes and T lymphocytes in obesity: CCL20 as an adipochemokine and T lymphocytes as lipogenic modulators. Arterioscler Thromb Vasc Biol 2009; 29: 1608-1614. [ Links ]
63. Lynch L, OConnell J, Kwasnik A, Cawood T, OFarrelly C, OShea D. Are natural killer cells protecting the metabolically healthy obese patient? Obesity (Silver Spring) 2009; 17: 601-605. [ Links ]
64. Ip B, Hogan A, Nikolajczyk B. Lymphocyte roles in metabolic dysfunction: of men and mice. Trends Endocrin Met 2015; 26: 91-100. [ Links ]
65. Rodríguez López C, González Torres M, Cruz Bautista I, Palacios-Martínez M, Nájera-Medina O. Relación de subpoblaciones linfocitarias y composición corpora en pacientes con obesidad y síndrome metabólico (Resumen). Memorias del V Congreso Internacional. Avances de las Mujeres en las Ciencias, las Humanidades y todas las disciplinas. Globalización y tecnologías de vanguardia, 2016. Ciudad de México. Unversidad Autónoma Metropolitana Unidad Azcapotzalco. P 63. [ Links ]
66. Winer D, Winer S, Shen L, Wadia P, Yantha J, Paltser G, Tsui H, Wu P, Davidson M, Alonso M, Leong H, Glassford A, Caimol M, Kenkel J, Tedder T, McLaughlin T, Miklos D, Dosch H, Engleman E. B cells promote insulin resistance through modulation of T cells and production of pathogenic IgG antibodies. Nat Med 2011; 17: 610-617. [ Links ]
67. Deng T, Lyon C, Minze L, Lin J, Zou J, Liu J, Ren Y, Yin Z, Hamilton D, Reardon P, Sherman V, Wang H, Phillips K, Webb P, Wong S, Wang R, Hsueh W. Class II major histocompatibility complex plays an essential role in obesity-induced adipose inflammation. Cell Metab 2013; 17: 411-422. [ Links ]
68. Priceman S, Kujawski M, Shen S, Cherryholmes G, Lee H, Zhang C, Kruper L, Mortimer J, Jove R, Riggs A, Yu H. Regulation of adipose tissue T cell subsets by Stat3 is crucial for diet-induced obesity and insulin resistance. Proc Natl Acad Sci USA 2013; 110: 13079-13084. [ Links ]
69. Rausch M, Weisberg S, Vardhana P, Tortoriello D. Obesity in C57BL/6J mice is characterized by adipose tissue hypoxia and cytotoxic T-cell infiltration. Int J Obes (Lond) 2008; 32: 451-463. [ Links ]
70. Jagannathan M, McDonnell M, Liang Y, Hasturk H, Hetzel J, Rubin D, Kantarci A, Van Dyke T, Ganley-Leal L, Nikolajczyk B. Toll-like receptors regulate B cell cytokine production in patients with diabetes. Diabetologia 2010; 53: 1461-1471. [ Links ]
71. DeFuria J, Belkina A, Jagannathan-Bogdan M, Snyder-Cappione J, Carr J D, Nersesova Y, Markham D, Strissel K, Watkins A, Zhu M, Allen J, Bouchard J, Toraldo G, Jasuja R, Obin M, McDonnell M, Apovian C, Denis G, Nikolajczyk B. B cells promote inflammation in obesity and type 2 diabetes through regulation of T-cell function and an inflammatory cytokine profile. Proc Natl Acad Sci U SA 2013; 110: 5133-5138. [ Links ]
72. Matsuda M, Shimomura I. Roles of adiponectin and oxidative stress in obesity-associated metabolic and cardiovascular diseases. Rev Endocr Metab Disord 2014; 15: 1-10. [ Links ]
73. Sánchez J, López D, Pinzón O, Sepúlveda J. Adipokines and metabolic syndrome: multiple aspects of a complex pathophysiological process. Rev Colomb Cardiol 2010; 17: 167-176. [ Links ]
74. Tilg H, Moschen A. Adipocytokines: mediators linking adipose tissue, inflammation and immunity. Nat Rev Immunol 2006; 6: 772-783. [ Links ]
75. Al-Suhaimi E, Shehzad A. Leptin, resistin and visfatin: the missing link between endocrine metabolic disorders and immunity. Eur J Med Res 2013; 18: 1-13. [ Links ]
76. Briffa J, McAinch A, Poronnik P, Hryciw D. Adipokines as a link between obesity and chronic kidney disease. Am J Physiol Renal Physiol 2013; 305: F1629-1636. [ Links ]
77. Kadoglou N, Fotiadis G, Kapelouzou A, Kostakis A, Liapis C, Vrabas I. The differential anti-inflammatory effects of exercise modalities and their association with early carotid atherosclerosis progression in patients with type 2 diabetes. Diabet Med 2013; 30: e41-50. [ Links ]
78. Trayhurn P. Hypoxia and adipose tissue function and dysfunction in obesity. Physiol Rev 2013; 93: 1-21. [ Links ]
79. Cantley J. The control of insulin secretion by adipokines: current evidence for adipocyte-beta cell endocrine signalling in metabolic homeostasis. Mamm Genome 2014; 25: 442-454. [ Links ]
80. Stojsavljevic S, Gomercic Palcic M, Virovic Jukic L, Smircic Duvnjak L, Duvnjak M. Adipokines and proinflammatory cytokines, the key mediators in the pathogenesis of nonalcoholic fatty liver disease. World J Gastroenterol 2014; 20: 18070-18091. [ Links ]
81. Fortis A, Garcia-Macedo R, Maldonado-Bernal C, Alarcon-Aguilar F, Cruz M. The role of innate immunity in obesity. Salud Pública de México 2012; 54: 171-177. [ Links ]
82. Reis C, Bressan J, Alfenas R. Effect of the diet components on adiponectin levels. Nutr Hosp 2010; 25: 881-888. [ Links ]
83. Loureiro C, Mota A, Muc M, Vale S, Angelo F, Todo-Bom A. Valores de resistina, adiponectia e leptina em doentes com asma e excesso de peso. Rev Port Imunoalergol 2012; 20: 121-128. [ Links ]
84. Fernández-Bergés D, Consuegra-Sánchez L, Peñafiel J, Cabrera A, Vila J, Félix-Redondo F, Segura-Fregoso A, Lapetra J, Guembe M, Vega T, Fitó M, Elosua R, Díaz O, Marrugat J. Perfil metbólico-inflamatorio en la trnsición obesidad, síndrome metabólico y diabetes mellitus en población mediterránea. Estudio DARIOS inflamatorio. Rev Esp Cardiol 2014; 67: 624-631. [ Links ]
85. Ajuwon K, Spurlock M. Adiponectin inhibits LPS-induced NF-kappaB activation and IL-6 production and increases PPARgamma2 expression in adipocytes. Am J Physiol Regul Integr Comp Physiol 2005; 288: R1220-1225. [ Links ]
86. Bluher M. Adipokines - removing road blocks to obesity and diabetes therapy. Mol Metab 2014; 3: 230-240. [ Links ]
87. Cui X B, Wang C, Li L, Fan D, Zhou Y, Wu D, Cui Q, Fu F, Wu L. Insulin decreases myocardial adiponectin receptor 1 expression via PI3K/Akt and FoxO1 pathway. Cardiovasc Res 2012; 93: 69-78. [ Links ]
88. Tachibana N, Yamashita Y, Nagata M, Wanezaki S, Ashida H, Horio F, Kohno M. Soy beta-conglycinin improves glucose uptake in skeletal muscle and ameliorates hepatic insulin resistance in Goto-Kakizaki rats. Nutr Res 2014; 34: 160-167. [ Links ]
89. López A. Determinación de los niveles de resistina en sangre en respuesta al tratamiento con electroacupuntura en pacientes obesos. [Tesis de Especialidad en acupuntura humana]. México, D.F.: Instituto Politecnico Nacional.; 2011. [ Links ]
90. Carvalho A, Rocha D, McIntyre R, Mesquita L, Kohler C, Hyphantis T, Sales P, Machado-Vieira R, Berk M. Adipokines as emerging depression biomarkers: a systematic review and meta-analysis. J Psychiatr Res 2014; 59: 28-37. [ Links ]
91. Giby V, Ajith T. Role of adipokines and peroxisome proliferator-activated receptors in nonalcoholic fatty liver disease. World J Hepatol 2014; 6: 570-579. [ Links ]
92. Muse E, Feldman D, Blaha M, Dardari Z, Blumenthal R, Budoff M, Nasir K, Criqui M, Cushman M, McClelland R, Allison M. The association of resistin with cardiovascular disease in the Multi-Ethnic Study of Atherosclerosis. Atherosclerosis 2015; 239: 101-108. [ Links ]
93. Chao W, Yen C, Wu Y, Chen S, Hsieh C, Chang T, Ou H, Shieh C. Increased resistin may suppress reactive oxygen species production and inflammasome activation in type 2 diabetic patients with pulmonary tuberculosis infection. Microbes Infect 2014; 17: 195-204. [ Links ]
94. Tarkowski A, Bjersing J, Shestakov A, Bokarewa M. Resistin competes with lipopolysaccharide for binding to toll-like receptor 4. J Cell Mol Med 2010; 14: 1419-1431. [ Links ]
95. Cao H. Adipocytokines in obesity and metabolic disease. J Endocrinol 2014; 220: T47-59. [ Links ]
96. Sypniewska G. Laboratory assessment of cardiometabolic risk in overweight and obese children. Clin Biochem 2015; 48: 370:376. [ Links ]
97. De Luis D, Gonzalez Sagrado M, Conde R, Aller R, Izaola O. Resistin levels and inflammatory markers in patients with morbid obesity. Nutr Hosp 2010; 25: 630-634. [ Links ]
98. Martos-Moreno G, Kopchick J, Argente J. Adipokines in healthy and obese children. An Pediatr (Barc) 2013; 78: 189.e181-189.e115. [ Links ]
99. Friebe D, Neef M, Kratzsch J, Erbs S, Dittrich K, Garten A, Petzold-Quinque S, Bluher S, Reinehr T, Stumvoll M, Bluher M, Kiess W, Korner A. Leucocytes are a major source of circulating nicotinamide phosphoribosyltransferase (NAMPT)/pre-B cell colony (PBEF)/visfatin linking obesity and inflammation in humans. Diabetologia 2011; 54: 1200-1211. [ Links ]
100. Chen L, Liu W, Lai S, Li Y, Wang X, Zhang H. Insulin resistance, serum visfatin, and adiponectin levels are associated with metabolic disorders in chronic hepatitis C virus-infected patients. Eur J Gastroenterol Hepatol 2013; 25: 935-941. [ Links ]
101. De Luis D, Aller R, Gonzalez Sagrado M, Conde R, Izaola O, de la Fuente B. Serum visfatin levels and metabolic syndrome criteria in obese female subjects. Diabetes Metab Res Rev 2013; 29: 576-581. [ Links ]
102. Telejko B, Kuzmicki M, Zonenberg A, Szamatowicz J, Wawrusiewicz-Kurylonek N, Nikolajuk A, Kretowski A, Gorska M. Visfatin in gestational diabetes: serum level and mRNA expression in fat and placental tissue. Diabetes Res Clin Pract 2009; 84: 68-75. [ Links ]
103. Marseglia L, Manti S, DAngelo G, Nicotera A, Parisi E, Di Rosa G, Gitto E, Arrigo T. Oxidative stress in obesity: a critical component in human diseases. Int J Mol Sci 2015; 16: 378-400. [ Links ]
104. Gomez R, Conde J, Gomez Reino J, Lago F, Gualillo O. Adipocytokines: emerging mediators of the immune response and inflammation. Reumatol Clin 2009; 5 Suppl 1: 6-12. [ Links ]












 uBio
uBio