Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT v.21 n.2 Caracas jul. 2002
Receptores Sur y Sulfonilureas en el tratamiento de la Diabetes Mellitus Tipo 2
F Contreras1, B Romero2, N Suárez1, M González1, C Fouillioux2, E Guevara2, MC Betancourt2, D Torres 2 y M Velasco1.
1.
Unidad de Farmacología Clínica, Facultad de Medicina. Escuela Vargas de la Universidad Central de Venezuela.2. Interno de Post grado del Hospital Victorino Santaella Ruiz.
RESUMEN
Las Sulfonilureas son hipoglicemiantes orales usados en el tratamiento de la Diabetes Mellitus tipo 2, que actúan estimulando la secreción de insulina por parte de las células b del páncreas. Estudios recientes revelaron que estos fármacos se unen a receptores específicos en la membrana celular de los islotes pancreáticos induciéndose el cierre de los canales de potasio sensibles a ATP, lo que provoca aumento en el contenido intracelular de potasio y despolarización de la célula conduciendo a la apertura de los canales de calcio voltaje dependiente entrando este al intracelular y liberándose insulina a partir de los gránulos maduros.
Los canales de potasio sensibles a ATP están formados por la subunidad KIR6, 2 la cual forma el poro del canal y la subunidad receptora de sulfonilureas (SUR) que actúa como reguladora. Tres subtipos de receptores SUR han sido reconocidos hasta ahora: el tipo pancreático SUR1, cuya inhibición facilita la secreción de insulina; el tipo cardiaco SUR2A el cual suministra protección miocárdica y un tercer tipo en el músculo liso vascular SUR2B el cual juega un rol en la tonicidad vascular.
Palabras Clave: Diabetes tipo 2, Hipoglicemiante oral, Receptor SUR, Sulfonilureas.
ABSTRACT
The sulfonylureas are well-known insulin secretagogues widely used as oral hypoglycemic agents in the treatment of type 2 diabetes mellitus. Recent studies have revealed that their principle target is the sulfonylurea receptor, a component of the ATP-sensitive potassium channel (K-ATP). Closure of the K+-ATP channel causes membrane depolarization which, in turn, triggers calcium influx through voltage-gated Ca2+ channels, and thereby stimulates the exocytosis of insulin-containing secretory granules. K+ - ATP channels are formed from KIR6, 2 and sulfonylurea receptor (SUR) subunits. KIR6, 2 forms the channel pore, while the sulfonylurea receptor acts as a regulatory subunit.
Three subtypes of SURs have been recognized to date: pancreatic type (SUR1), the inhibition of which facilitates insulin secretion; cardiac type (SUR2A), which provides myocardial protection; and vascular smooth muscle type (SUR2B), which plays a role in vasorelaxation.
Key Words: Type 2 diabetes, Oral hypoglycemic, Receptor SUR, Sulfonylureas.
INTRODUCCIÓN
La Diabetes Mellitus es un conjunto heterogéneo de síndromes de etiopatogenia multifactorial. El nexo común es el trastorno metabólico, fundamentalmente la hiperglucemia crónica, aunque también las alteraciones en el metabolismo lipídico y proteico. Dichas alteraciones son debidas a un déficit relativo o absoluto de insulina y/o a una resistencia periférica a la acción de la insulina. Es característico el desarrollo de complicaciones crónicas a largo plazo; macrovasculares, microvasculares y neuropatía autonómica causantes de disfunción vascular(1).
La forma más frecuente de diabetes mellitus es la diabetes tipo 2, que representa el 85% del total. Hay que destacar que el 50% de los individuos con diabetes mellitus tipo 2 no han sido diagnosticados y que el 20% de los pacientes que se diagnostican de diabetes tipo 2 presentan datos de complicaciones crónicas ya en el momento del diagnóstico. Es la enfermedad endocrina más frecuente y una de las principales causas de mortalidad y morbilidad en la sociedad contemporánea, es por si misma un frecuente y creciente problema de salud pública.
En el ámbito mundial el predominio de la Diabetes Mellitus tipo 2 se ha incrementado dramáticamente en los últimos años debido a la poca actividad física, el aumento en la obesidad y los cambios en los hábitos alimenticios.
La prevalencia real es difícil de estimar, oscilando entre un 2 y un 6% en la mayoría de los países occidentales(1).
Los pilares del tratamiento del diabético son la dieta, el ejercicio, la educación (el autocontrol) y el tratamiento farmacológico. El diabético tipo 2 cuenta hoy en día con un arsenal de fármacos a su disposición, entre los que tenemos los hipoglicemiantes orales y entre ellos uno de los grupos más utilizados son las sulfonilureas, las cuales son utilizadas para el control de la hiperglucemia en aquellos pacientes diabéticos tipo 2 en los que no es posible lograr el control apropiado solo con la dieta y la practica de ejercicios físicos.
El descubrimiento de las sulfonilureas fue, como el de otros muchos fármacos, accidental. En 1942, Janbon y col, observaron que algunas sulfonamidas causaban hipoglucemia en animales de experimentación. Estas observaciones se extendieron rápidamente y la 1-butil-3-sulfonilurea (carbutamida) fue la primera sulfonilurea clínicamente útil en el tratamiento de la diabetes. Posteriormente, este compuesto dejo de utilizarse por sus efectos sobre la médula ósea, pero condujo al desarrollo de toda una clase de sulfonilureas.
Desde estas primeras observaciones un buen número de sulfonilureas de primera y segunda generación han sido sintetizadas y hoy día, una gran cantidad de ellas tienen amplia utilización clínica en el tratamiento de la diabetes tipo 2.
A principio de los años 80 se descubrió que la acción de las sulfonilureas se debe a la ocupación de un receptor de la membrana de la célula b del páncreas, el SUR1. En la actualidad, se han hechos enormes avances en el conocimiento del mecanismo de acción de estos fármacos dilucidándose no solo la existencia de los receptores de sulfonilurea (SUR); sino también su funcionamiento.
SULFONILUREAS
Química
Las sulfonilureas son arilsulfonilureas substituidas, difieren por el substituyente en la posición para del ciclo bencénico y en un residuo nitrogenado de la fracción urea. Las sulfonilureas se dividen en tres generaciones, encontrando algunas como la Tolazamida y la Tolbutamida en la primera generación, otras como Glibenclamida, Gliclazida y Glimepiride en la segunda generación (ver Tabla 1).
Tabla 1: Sulfonilureas actualmente disponibles
| Droga (Marca Registrada) | Dosificación diaria (mg) | Duración de la acción (h) |
| Sulfonilureas de Segunda Generación |
|
|
| Glibenclamida (Euglucon) Comp. 5m | 2.5-20 | 16-24 |
| Gliburida (Glynase) | 1.5-12 | 12-24 |
| Glipizida (Minidiab)* Comp. 5mg | 2,5-40* | 12-24 |
| Gliclazida 80mg/ 30MR | 40-320 | 12-15 |
| Glimepiride (Amaryl) Comp. 2 y 4mg | 1-8 | 16-24 |
| Sulfonilureas de Primera Generación |
|
|
| Cloropropamida (Dabinese) Tab. 250mg | 100-500 | 60 |
| Tolazamida | 100-1000 | 12-24 |
| Acetohexamida (Dymelor) | 250-1500 | 12-18 |
| Tolbutamida | 500-3000 | 6-12 |
* La dosificación máxima eficaz es de 20 mg/d, aún cuando la droga ha sido aprobada para ser utilizada en dosificaciones de hasta 40 mg/d.
Farmacocinética
Las sulfonilureas se absorben en el tracto gastrointestinal, en el plasma 90 a 99% de ellas se encuentran unidas a proteínas, especialmente albúmina. Los volúmenes de distribución de la mayoría de las sulfonilureas son de alrededor de 0,2 L/Kg. Son metabolizados en el hígado y eliminadas en la orina. En vista del tiempo necesario para alcanzar una concentración óptima en el plasma, la mayoría de las sulfonilureas son más efectivas cuando se administran media hora antes de la comida. Las características más destacadas de las sulfonilureas usadas en clínica se muestran en la tabla 2.
Tabla 2: Comparación de las sulfonilureas y no sulfonilureas cuando se administran como monoterapia*
| Efecto | Sulfonilureas y Repaglinida | Metformina | Troglitazona |
| Mecanismo de Acción | Incremento en la secreción de insulina en las células beta pancréaticas | Disminución en la producción de glucosa hepática; incremento en sensibilidad muscular a la insulina | Disminución en la producción de glucosa hepática; incremento en sensibilidad muscular a la insulina |
| Disminución en el nivel de FPG, mmol/L (mg/dl) | 3.3-3.9 (60-70) | 3.3-3.9 (60-70) | 1.9-2.2 (35-40) |
| Disminución en el valor de la hemoglobina A1c,puntos porcentuales. | 1.5-2.0 | 1.5-2.0 | 1.0-1.2 |
| Nivel de Triglicéridos | Sin efecto | Disminución | Disminución |
| Nivel de Colesterol HDL | Sin efecto | Incremento leve | Incremento |
| Nivel de Colesterol LDL | Sin efecto | Disminución | Incremento |
| Peso Corporal | Incremento | Disminución | Incremento |
| Insulina en plasma | Incremento | Disminución | Disminución |
| Eventos Adversos | Hipoglucemia | Trastornos GI, acidosis láctica+ | Anemia, toxicidad hepática** |
FPG: glucosa en plasma en ayunas, GI: gastrointestinal, HDL: lipoproteina de alta densidad, LDL: lipoproteina de baja densidad. + Incidencia de 0.03 casos por 1000 pacientes-año (raro). **Con troglitazona se ha reportado a veces insuficiencia hepática irreversible, pero la incidencia precisa se desconoce. Los niveles elevados de enzimas hepáticas se presentan en aproximadamente un 2% de los pacientes.
Mecanismo de acción de las sulfonilureas
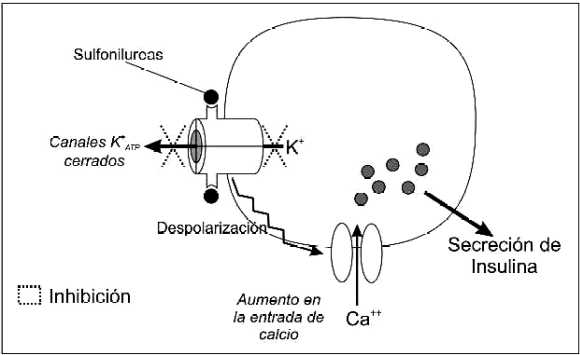
Las sulfonilureas estimulan la liberación de insulina por las células beta del páncreas y el aumento de la sensibilidad de los tejidos periféricos a esta hormona, siendo útiles en el tratamiento de diabéticos tipo 2. Su principal blanco es el receptor de sulfonilureas, especificamente un componente del canal de potasio ATP-sensible(2), inhibiendo la salida de potasio de la célula beta pancreática lo que conduce a la despolarización de la membrana y a la entrada de calcio extracelular que a su vez favorece la exocitosis de los gránulos de insulina(3), (Figura 1).
Figura 1: Mecanismo de acción de las sulfonilureas
IK ATP corriente de potasio sensible al ATP: Este canal se encuentra cerrado en condiciones fisiológicas y se abre cuando las concentraciones de ATP intracelular caen por debajo de 1mM. Es corresponsable del acortamiento del potencial de acción y de la salida de K+ de la célula que ocurre durante la isquemia miocardica. Este canal presenta rectificación hacia adentro y puede abrirse con drogas como los activadores de los canales de potasio (minoxidil) o bloquearse con antidiabéticos orales y antiarritmicos como la quinidina.
Canales de K-ATP son también encontrados en alta densidad en una variedad de otros tipos celulares incluyendo músculo liso vascular, cardíaco y esquelético, así como en algunas neuronas del sistema nervioso central(4). Los efectos extra pancreáticos de las sulfonilureas han sido reconocidos(5). Recientemente estudios usando técnicas de biología molecular mostraron que los SUR están expresados en una gran variedad de tejidos, incluyendo otros órganos endocrinos(6), posteriormente estudios demostraron que SUR ARNm esta presente en adenoma pituitario humano sugiriendo que los SUR están expresados en células de la adenohipófisis(7). Más recientemente, se demostró que los SUR ARNm están presente en células corticotropicas, sugiriendo los resultados de los estudios realizados que las sulfonilureas podrían influenciar la expresión de Proopiomelanocortina así como la secreción de Adrenocorticotropina(8). Sin embargo, es necesaria la realización de otros estudios clínicos acerca del efecto de las sulfonilureas sobre la síntesis y secreción de hormonas pituitarias para clarificar el rol fisiológico de las sulfonilureas en los tejidos extra pancreáticos, incluyendo la glándula pituitaria anterior.
En el transcurso de los meses iniciales de la terapéutica con sulfonilureas hay un aumento de la concentración plasmática de insulina en ayuno, así como de la respuesta con insulina ante la exposición de glucosa por vía oral. La insulina liberada por el páncreas entra a la vena porta, y la hiperinsulinemia portal resultante suprime la tasa basal elevada de producción de glucosa hepática. Además del nivel elevado de insulina arterial, aumenta la captación de glucosa por parte del tejido muscular, llevando esto a una reducción en los niveles de glucosa en plasma después de las comidas. Con la administración crónica, las cifras circulantes de insulina declinan hasta llegar a las cifras previas al tratamiento. Estudios realizados actualmente encontraron en el tratamiento crónico con glibenclamida un defecto en la secreción aguda de insulina inducida por esta, confirmándose estudios previos que mostraban que la exposición de los islotes pancreáticos a sulfonilureas causaba disminución en la sensibilidad para el mismo estímulo(9-10), se sugiere que esto se debe a que el tratamiento crónico con sulfonilureas podría causar un defecto en la secreción de insulina inducida por sulfonilureas por reducción del número de canales K-ATP funcionales sobre la superficie celular(11).
Los factores que predicen una buena respuesta incluyen diabetes mellitus recién diagnosticada, hiperglucemia en ayunas de leve a moderada, una buena función de la célula beta tal como lo refleja un alto nivel de péptido C en ayunas, ausencia de anticuerpo contra la célula de islote a la descarboxilasa del ácido glutámico y que no exista historia de terapia con insulina.
Ciertos pacientes hasta un 20% no responden desde el inicio del tratamiento con sulfonilureas (fallo primario), el cual parece estar relacionado con el nivel de hiperglucemia; estos pacientes presentan una respuesta inicial pobre, es decir, una disminución del nivel de glucosa en ayunas menor de 20mg/dl, presentando usualmente estos pacientes niveles disminuidos de péptido C. Otros pacientes (3-5% por año) que responden inicialmente a tratamiento con sulfonilureas, a lo largo del tiempo normalmente entre 5 y 7 años, pueden presentar una falta de respuesta (fallo secundario), las razones no son completamente conocidas y parece ser multifactorial; así puede deberse al agotamiento de la capacidad de la célula beta para segregar insulina, mal cumplimiento dietético, obesidad o la aparición de infecciones o stress. Estudios realizados han sugerido que la disminución de la secreción basal de insulina y no la estimulada, es probablemente uno de los mayores factores asociados con la resistencia secundaria a sulfonilureas en Diabéticos tipo 2(12).
En la mayoría de los estudios se ha reportado que las sulfonilureas poseen efectos neutros o ligeramente beneficiosos sobre los niveles de lípidos en plasma. Este efecto hipolipémico, se debe aparentemente tanto al efecto directo de las sulfonilureas sobre el metabolismo de las lipoproteínas de muy baja densidad, como a una acción indirecta de la droga secundaria a niveles reducidos de glucosa en plasma(13). Estudios han demostrado el rol del calcio intracelular sobre los adipositos, lipogénesis, lipólisis y aumento de triacilglicéridos. Compuestos que actúan sobre los receptores pancreáticos de sulfonilureas (SUR), para incrementar (Ej. Glibenclamida) o disminuir (Ej. Diazoxido) los niveles de Calcio intracelular, causan aumento o disminución respectivamente, en la ganancia de peso. Estos datos sugieren que los adipositos humanos expresan receptores SUR que regulan el calcio intracelular y en consecuencia tienen influencia sobre la lipogénesis y lipólisis. Por consiguiente, los SUR 1 de los adipositos podrían representar un importante blanco para el desarrollo de intervenciones terapéuticas en obesidad(14).
Los estudios clínicos no han demostrado superioridad de una sulfonilurea respecto a otra cuando se administran en dosis óptimamente eficaces(15-16). Por el contrario, estudios prospectivos, controlados con placebo, a gran escala, han demostrado que la glipizida, gliburida y glimepiride, ejercen efectos equipotentes de disminución de la glucosa(15-17).
Otros estudios realizados que comparan las sulfonilureas de primera y segunda generación han obtenido resultados similares. Aunque los estudios realizados a corto plazo indican que la glipizida libera insulina más rápidamente que la gliburida y, que la gliburida suprime la producción de glucosa hepática más que la glipizida(18), ambas sulfonilureas producen perfiles glucémicos promedios similares a lo largo del día cuando se utilizan por un largo período en diabéticos tipo 2. Las ventajas teóricas asociadas a absorción rápida, duración corta, metabolismo hepático y metabolitos inactivos no suelen traducirse en beneficios claros de unas sobre otras, salvo en situaciones clínicas muy concretas.
Aproximadamente el 75% de los pacientes con diabetes tipo 2 tratados con una sulfonilurea no alcanzan el objetivo deseado (nivel de glucosa en plasma en ayunas < 7.8 mmol/L [< 140 mg/dL]) y requieren la adición de un segundo agente oral o insulina a la hora de dormir(19). Dichos pacientes usualmente presentan un nivel bajo de péptido-C en ayunas y un nivel de glucosa en 300 mg/dL)(20). En algunos de estos pacientes, la enfermedad representa una diabetes tipo 1 de evolución lenta. Un 50% a un 60% de los pacientes con diabetes tipo 2, presentan una buena respuesta inicial a la sulfonilureas, es decir, una disminución del nivel de glucosa en plasma en ayunas > 30 mg/dL]), pero ellos no alcanzan el objetivo deseado del tratamiento, un nivel de glucosa en plasma en ayunas < 140 mg/dL]).
Después de una buena respuesta inicial a la terapia con sulfonilureas, la tasa de fracaso secundario es de aproximadamente 3% a 5% por año(21,22), y después de 10 años, la mayoría de los pacientes tratados con sulfonilureas requieren un segundo agente oral(21,22). Comúnmente se asevera que la tasa alta de fracaso secundario está relacionada con la incapacidad del páncreas en mantener su tasa aumentada de secreción de insulina en respuesta a la estimulación a largo plazo de las sulfonilureas. Sin embargo, el UKPDS(21,22) ha arrojado dudas sobre esta teoría ya que se observó una tasa similar de fracaso secundario en la terapia con metformina. La metformina, por el hecho de mejorar la sensibilidad de la insulina y disminuir los niveles de insulina en plasma, se habría esperado que preservara la función de las células-b (20). Los resultados del UKPDS sugieren que una vez que el nivel de glucosa en plasma en ayunas excede un cierto valor (> 7.8 a 8.9 mmol/L [> 140 a 160 mg/dL]), la falla de las células-b progresa inexorablemente.
Reacciones adversas
Los efectos adversos de las sulfonilureas son poco frecuentes y se observan en aproximadamente un 4% de los pacientes que toman las de primera generación y en un porcentaje algo menor en los que toman las de segunda o tercera generación.
La hipoglucemia constituye el principal efecto adverso asociado a el tratamiento con sulfonilureas, más frecuentemente con aquellas de acción prolongada como glibenclamida y clorpropamida, esta puede oscilar entre cuadros leves hasta otros graves que incluso pueden llevar al coma. En especial las personas mayores parecen ser más susceptibles a la aparición de la hipoglucemia como consecuencia del declive en su funcionamiento hepático y renal y del tratamiento con múltiples fármacos.
El riesgo de hipoglucemia puede minimizarse iniciando el tratamiento con la mínima dosis eficaz e incrementándola progresivamente en función de la respuesta.
Otro efecto adverso asociado a las sulfonilureas es la ganancia de peso, que puede tener especial importancia en los pacientes obesos.
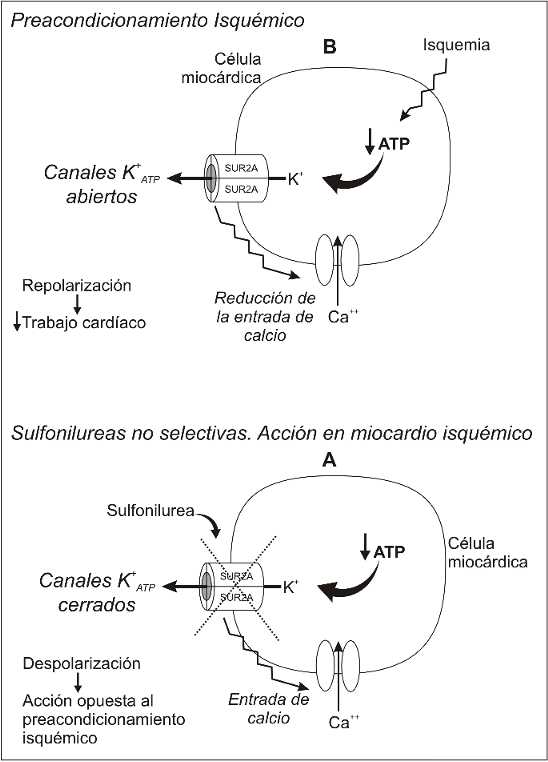
A nivel cardiaco es bien conocido que durante la isquemia miocárdica la apertura de los canales K-ATP produce repolarización que conlleva a la reducción de la entrada de calcio y menor trabajo cardiaco (Figura 2). Esto es lo que se conoce como preacondicionamiento isquémico, el cual no es más que un mecanismo de adaptación endógeno en el cual pequeños períodos de isquemia subletal protegen significativamente al miocardio de ataques isquémicos subsecuentes letales.
Las sulfonilureas no selectivas tienen acción opuesta al preacondicionamiento isquémico (Figura 2), favoreciendo la despolarización del miocardio isquémico con el consiguiente aumento del riesgo de arritmias, sin embargo, aun, hoy en día existe controversia sobre el aumento de mortalidad cardiovascular en pacientes tratados con sulfonilureas, encontrándose resultados contradictorios en algunos de los estudios realizados al respecto. En pacientes con diabetes y enfermedad de las arterias coronarias el rol potencialmente negativo de las sulfonilureas esta bajo intensiva investigación. En estudio realizado por el departamento de medicina clínica y experimental de la Univ. De Padua (Italia) se encontró que en pacientes diabéticos tipo 2 con enfermedad de las arterias coronarias, disfunción miocárdica isquémica inducida por infusión de dipiridamol es menos severa durante tratamiento con insulina que con glibenclamida. Se concluyó en este estudio que la restitución de un mecanismo de pre-acondicionamiento en pacientes tratados con insulina podría ser el mecanismo potencialmente beneficioso(23). Se ha visto que la glibenclamida podría tener peligrosos efectos cardiovasculares usada bajo condiciones de isquemia(24); sin embargo, en un estudio recientemente realizado se demostró que glibenclamida utilizada a dosis de 0,05 mg/kg intravenosa es efectiva en aumentar la insulina sérica, sugiriendo un efectivo bloqueo de las células beta del páncreas sin comprometer la circulación coronaria y la vasodilatación en respuesta a adenosina y papaverina en post-estenosis coronaria(25). Otros estudios han postulado que Glimepiride y Glibenclamida se unen con diferente afinidad al receptor SUR a nivel cardiaco, resultando en diferente influencia sobre el preacondicionamiento(26), Glimepiride ha mostrado menos efectos cardiovasculares que Glibenclamida, posiblemente debido a que se cree posee baja afinidad por el canal K-ATP mitocondrial(27). Aunque otros estudios mostraron que el tratamiento crónico de la diabetes tipo 2 con glimepiride o metformina presentan efectos similares en los canales K-ATP vasculares comparados con los el tratamiento crónico con glibenclamida(24). Por otro lado, se ha visto un aumento en la mortalidad de diabéticos tipo 2 en tratamiento con sulfonilureas admitidos por infarto agudo de miocardio cuando son tratados por angioplastia directa; sin embargo, no se ha visto asociación con resultados adversos cuando estos pacientes son tratados con trombolíticos corrientes(28).
El agente ideal debe tener una alta selectividad por las células beta para evitar interacciones potenciales con el corazón o con los vasos sanguíneos. La gliclazida al contrario que la glibenclamida o glimepiride se une selectivamente a los receptores SUR1 de las células b no interactuando con los receptores SUR2A cardiacos(29).
Otros efectos menos frecuentes atribuidos a las sulfoniureas son náuseas y vómitos, ictericia colestásica, reacciones de hipersensibilidad generalizadas y reacciones dermatológicas; así como también reacciones hematológicas como anemia hemolítica y rash cutáneo.
Figura 2: Acción de las sulfonilureas durante la isquemia cardíaca
Receptores a las Sulfonilureas
Tres subtipos de SURs han sido reconocidos hasta la fecha, el tipo pancreático SUR1 cuya inhibición facilita la secreción de insulina. El tipo cardiaco SUR2A quien provee protección miocárdica durante la isquemia, y el SUR2B del músculo liso vascular quien juega un rol en la tonicidad vascular(30).También, se han llamado receptores de alta y de baja afinidad, encontrándose los primeros en las membranas de las células beta del páncreas y los segundos en tejido cardiaco, nervioso y muscular.
Los receptores SUR han sido objeto de numerosos estudios, demostrándose su implicación en la génesis de patologías tal como la hipoglucemia hiperinsulinemica de la infancia (PHHI), donde una mutación en los genes del canal K-ATP de las células b del páncreas (SUR1 y KIR6.2) constituye la mayor causa conocida(31,32).
Se ha sugerido que hay una asociación entre polimorfismos en el locus del gen del SUR1 o Kir6.2 y la diabetes de tipo 2, lo que contribuye a una susceptibilidad genética en algunas poblaciones(33).
Por otra parte, otros autores no han conseguido alteraciones en la región del cromosoma que incluye los genes del SUR1 y Kir6.2 en sujetos con diabetes de tipo 2 tanto de raza blanca como japoneses(34,35). Por lo tanto, el rol de la mutación genética en el receptor SUR no se ha podido vincular de manera categórica, con el desarrollo de diabetes mellitus tipo 2.
Topología
Se ha postulado que los SUR podrían ser miembros de la superfamilia de proteínas llamadas casetes de fijación al ATP (ATP-binding-cassette) o ABC(35), proteínas que suelen tener una función transportadora o de bombeo, empleando ATP como fuente de energía. Esta superfamilia de proteínas posee dos dominios intracelulares de unión de nucleótidos (NBDS), y múltiples dominios transmembrana (TMS), postulándose que posee17 TMS, organizados en tres grupos de 6(36).
Estos receptores son estructuras octaméricas de 4+4, (Figura 3), constituidas por cuatro poros formados por subunidades Kir6.2 complementadas por cuatro subunidades receptoras de sulfonilureas (SUR1 en células beta pancreáticas y SUR2A en corazón)(3), Kir6.2 forma el poro del canal, mientras que el receptor de sulfonilureas actúa como subunidad reguladora, dotando al canal con sensibilidad a la inhibición por sulfonilureas de alta afinidad y activación por Mg-nucleótidos y sustancia que abren el canal K-ATP(37-38). Los canales de potasio tipo Kir con rectificación hacia dentro tienen la estructura que se observa en la figura 4; tienen sólo dos segmentos transmembrana, llamados M1 y M2. El segmento M1 tiene una cadena amino terminal y el M2 una cadena C-terminal orientadas hacia el espacio intracelular. Entre ambos segmentos hay un asa P que conforma la pared interior del canal. Este último queda delimitado por cuatro de estos pares de segmentos transmembrana. Este canal de potasio puede sufrir alteraciones adquiridas que cambian la expresión de los mismos, tal es el caso de la fibrilación auricular y la hipertrofia ventricular en ratas.
La sensibilidad de las diferentes sulfonilureas por los canales depende de la isoforma de SUR, así encontramos que canales formados por coexpresión de KIR6.2 con SUR1 o SUR2 exhiben respuestas diferentes a las sulfonilureas, como se ha observado previamente en canales nativos K-ATP de células beta y corazón. Tolbutamida bloquea KIR6.2-SUR1, pero no KIR6.2-SUR2A, con alta afinidad, mientras que glibenclamida bloquea ambos tipos de canales con alta afinidad, pero mientras este efecto es reversible para KIR6.2-SUR2A la inhibición de KIR6.2-SUR1 es realmente lento de revertir(39).
Figura 3: Estructura del receptor de sulfonilureas
Figura 4: Estructura de los canales de potasio:
A) Unidad básica de los canales que rectifican hacia adentro, Kir (2tTm 1P). A este grupo pertenecen IK1, IKACH, IKATP. Solo tienen dos segmentos transmembrana, M1 y M2.
B) Canal de potasio formado por la unión de cuatro dominios transmembrana.
Mecanismo de acción
En condiciones normales los canales de K-ATP de las células beta del páncreas permanecen abiertos, regulados por el potencial de membrana. El flujo de potasio es regulado por el ATP intra celular, un aumento en la circulación de glucosa aumenta la producción de ATP bloqueando el canal de potasio y despolarizando la célula, generando entrada de calcio al espacio intracelular lo que desencadena la liberación de insulina.
El complejo SUR1 - Kir6.2 dispone de dos áreas BNF (pliegues de fijación a nucleótidos) en los cuales se pueden unir el ATP y el ADP. Matsuo y col. han propuesto el siguiente mecanismo: en condiciones normales, las BNFs están libres y el canal está inactivo. Cuando se unen a los BNFs una molécula de ADP y otra de ATP, el canal se abre. La glibenclamida ocasionaría la disociación del ATP quedando un BNF libre y el otro unido a ADP provocando la inactivación del canal. En otros tejidos tal como el cardiaco los canales K-ATP bajo condiciones normales permanecen cerrados y solo se abren cuando la concentración de ATP disminuye.
Para definir y clasificar los canales K-ATP se han utilizado dos criterios farmacológicos fundamentales: su capacidad para fijar las sulfonilureas impidiendo la salida del potasio intracelular y su capacidad para fijar una serie de fármacos conocidos como agonistas potásicos (pinacidil, diazoxido, cromokalim y p1075), fármacos que aumentan el tiempo de apertura del canal. Sin embargo, no todos estos fármacos tienen la misma afinidad hacia los SUR. Mientras que las sulfonilureas actúan preferentemente sobre los SUR1 de las células pancreáticas, los agonistas potásicos actúan sobre los SUR2A y 2B del músculo cardíaco y esquelético.
En conclusión, se puede afirmar que un mayor conocimiento del papel del canal K-ATP en la homeostasis de la glucosa podría ayudar a entender mejor el metabolismo de la glucosa, mientras que el estudio de la estructura y funciones del mismo podrían ser de utilidad para diseñar nuevos fármacos capaces de regular la actividad eléctrica de la célula pancreática.
REFERENCIAS BIBLIOGRÁFICAS
1. Contreras F, Rivera M, Vásquez J, et al. Diabetes and hypertension physiopathology and therapeutics. J human hypertension 2000; 14: S26-S31. [ Links ]
2. Ashcroft F-M, Gribble F-M. Tissue specific effects of sulfonylureas: lessons from studies of cloned K(ATP) channels. J-Diabetes-complications. 2000; 14(4): 192-6. [ Links ]
3. Ashfield R, Gribble F, Ashcroft S, Ashcroft F. Identification of the high affinity tolbutamide site on the SUR1 subunit of the K-ATP channel. Diabetes 1999; 48: 1341-1347. [ Links ]
4. Ashcroft F, Ashcroft S. Properties and functions of ATP-sensitive K-Channel. Cell sig 1990; 2: 197-214. [ Links ]
5. Kaku K, Inoue Y, Kaneko T. Extrapancreatic effects of sulfonylurea drugs. Diabetes Res Clin Pract (suppl) 1995; 28: S105- S108. [ Links ]
6. Hernandez C, Wood TL, Le Roith D. Developmental and tissue specific sulfonylurea receptor gene expression. Endocrinology 1997; 138: 705-711. [ Links ]
7. Zhu Z, Mc Cutcheon I, Lopes M, et al. Sulfonylurea receptor mRNA expression in pituitaria macroadenomas. Endocrine 1998; 8: 7-12. [ Links ]
8. Morishita M, Iwasaki Y, Yamamori E, et al. Antidiabetic Sulfonylurea Enhances Secretagogue Induced Adrenocorticotropin Secretion and Proopiomelanocortin Gene Expresión in Vitro. Endocrinology 2000; 141: 3313-3318. [ Links ]
9. Gullo D, Rabuazzo AM, Vertí M, Gatta C, et al. Chronic exposure to glibenclamide impairs insulin secretion in isolated rat pancreatic islets. J Endocrinol Invest 1991; 14: 287-291. [ Links ]
10. Rabuazzo AM, Buscema M, Vinci C, Caltabiano V, et al. Glybride and Tolbutamide induce desensitization of insulin release in rat pancreatic by different mechanism. Endocrinology 1992; 131: 1815-1820. [ Links ]
11. Kawaki J, Nagashima K, Tanara J, Takashi M, et al. Unresponsiveness to glibenclamide during chronic treatment induced by reduction of ATP- sensitive K channel activity. Diabetes 1999; 48: 2001-2006. [ Links ]
12. Rattarasarn C, Thamprasit A, Leelawattana R, Soonthornon S, Setasuban W. the role of diminished beta cell reserve and insulin resistance in secondary sulfonylurea failure of type 2 diabetes mellitus. J. Med. Assoc.Thai 2002; 84(12): 1754-62. [ Links ]
13. Jeppesen J, Zhov MY, Chen YD, Readven CM. Effects of glipizide on post pandrial lipaemia in patients with N2IDDM. Diabetología 1996; 37: 781-7. [ Links ]
14. Shi H, Moustaid-Moussa N, Wilkison WO, Zemel M. Role of the Sulfonylurea receptor in regulating human adipocyte metebolism. FASEB-J 1999; 13(13): 1833-8. [ Links ]
15. Simonson DC, Kourldes IA, Feinglos M, Shamoon H, Fischette CT. Efficacy, safety, and dose-response characteristics or glipizide gastrointestinal therapeutic system on glicemic control and insulin secretion in NIDDM. Results of two multicenter, randomized, placebo-controlled clinical trials. The Glipizide Gastrointestinal Therapeutic System Study Group. Diabetes Care. 1997; 20: 597-606. [ Links ]
16. Rosenstock J, Samols E, Muchmore DB, Schneider J. Glimepride, a new once-daily sulfonylurea. A double-blind placebo-controlled study of NIDDM patients. Glimepiride Study Group. Diabetes Care. 1996; 19: 1194-9. [ Links ]
17. Groop L, Groop PH, Stenman S, Saloranta C, Totterman KJ, Fyhrquist F, et al. Comparison of pharmacokinetics, metabolic effects and mechanisms of action of glyburide and glipizide during long-term treatment. Diabetes Care. 1987; 10: 671-8. [ Links ]
18. Groop L, Luzi L, Melander A, Groop PH, Ratheiser K, Simonson DC, et al. Different effects of glibenclamide and glipizide on insulin secretion and hepatic glucose production in normal and NIDDM subjects. Diabetes. 1987; 36: 1320-8. [ Links ]
19. Contreras F, Jiménez S, García M, Rocafull J, Montero E, González M, Fouillioux C, Bolívar A, Lezama Y y Velasco M. Nuevos aspectos en el tratamiento de la diabetes mellitus tipo 2. Arch Venez Farm y Terap. 2001; 20(1): 6-26. [ Links ]
20. DeFronzo Ralph A. Ann Intern Med. 1999; 131: 281-303. [ Links ]
21. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study Group Lancet. 1998; 352: 837-53. [ Links ]
22. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34) UK Prospective Diabetes Study Lancet. 1998; 352: 854-65. [ Links ]
23. Scognamiglio R, Avogaro A, Vigili S, et al. Effects of treatment with sulfonylurea drugs or insulin on ischemia-induced myocardial dysfunction in type 2 diabetes. Diabetes 2002; 51(3): 808-12. [ Links ]
24. Abbink EJ, Pickkers P, Jansen Van Rosendaal L, Lutterman J. Vascular effects of glibenclamide vs glimepiride and metformin in type 2 diabetic patients. Diabet Med 2002; 19(2): 136-43. [ Links ]
25. Reffelmann T, Klues HG, Hanrath P, Schwarz ER. Post – Stenotic coronary blood flow at rest is not altered by therapeutic closes of the oral antidiabetic drug glibenclamide in patients with coronary artery disease. Heart 2002; 87 (1): 54-60. [ Links ]
26. Nieszner E, Posa I, Kocsis E, Pogatsa G, et al. Influence of diabetic state and that of different sulfonylureas on the size of myocardial infarction with and without ischemic preconditioning in rabbits. Exp. Clin. Endocrinol. Diabetes 2002; 110(5): 212-218. [ Links ]
27. Horimoto H, Nakai Y, Nomura Y, Nakahara K, Sasaki S. Oral hipoglycemic sulfonylurea glimepiride preserves the myoprotective effects of ischemic preconditioning. J. Surg .Res 2002; 105(2): 181-8. [ Links ]
28. Halkin A, Roth A, Jonas M, Behar S. Sulfonylureas are not associated with increased mortality in diabetics treated with thrombolysis for acute myocardial infarction. J Thromb Thrombolysis 2001; 12 (2): 177-84. [ Links ]
29. Michironi M, Kowishi T, Nomiyuri K, Ternao A, Kazwits D. Different binding properties and affinities for ATP and ADP among sulfonylurea receptor subtypes, sur1a, sur2a, sur2b. The American Society for Biochemistry and Molecular Biology 2000; 37: 28757-28762. [ Links ]
30. Li M, Marubayashi A, Nakaya Y, Fukui K. Minoxidil – induced hair growth is mediated by adenosine in culture dermal papilla cells: possible involvement of sulfonylurea receptor 2b as a target of minoxidil. J. Invest. Dermatol 2001; 117: 1594-1600. [ Links ]
31. Kassem S, Ariel I, Thornton P, Hussain K, et al. p57 (KIP2) expression in normal islet cells and in hyperinsulinism of infancy. Diabetes 2001; 50(12): 2763-9. [ Links ]
32. Otonkoski T, Ämmälä C, Huopio H, et al. A point mutation inactivating the sulfonylurea receptor causes the severe form of persistent hyperinsulinemic hypoglycemia of infancy in Finland. Diabetes 1999; 48: 408-415. [ Links ]
33. Reis A, Velho G. Sulfonylurea receptor-1 (SUR1): genetic and metabolic evidences for a role in the susceptibility to type diabetes mellitus. Diabetes-Metab 2002; 28(1): 14-9. [ Links ]
34. Ohta Y, Tanizawa Y, Inoue H, Osaka T, et al. Identification and functional analysis of sulfonylurea receptor 1 variants in Japanese patients with NIDDM. Diabetes 1998; 47(3): 476-81. [ Links ]
35. Conti L, Radeke C, Shyng S, Vandenberg C. Tran membrane topology of the sulfonylurea receptor SUR1. J-Biol-Chem 2001; 276 (44): 41270-8. [ Links ]
36. Huopio H, Vauhkonen I, Komulainen J, Niskanen J, et al. Carriers of an inactivating beta-cell ATP-sensitive K+ channel mutation have normal glucose tolerance and insulin sensitivity and appropriate insulin secretion. Diabetes-Care 2002; 25(1): 101-6. [ Links ]
37. Shyng S, Ferrigni T, Nichols C. Regulation of K-ATP channel activity by diazoxide and MgADP: distinct function of the two nucleotide binding folds of the sulfonylurea receptor. J Gen Physiology 1997; 110: 643-654. [ Links ]
38. Gribble F, Tuckers S, Ashcroft F. The essential role of the walker a motifs of SUR1 in K-ATP channel activation by MgADP and Diazoxide. EMBO J 1997; 16: 1145-1152. [ Links ]
39. Gribble F, Tucker S, Seino S, Ashcroft F.Tissue specificity of sulfonylureas: studies on cloned cardiac and â-cell K-ATP channels. Diabetes 1998; 47: 1412-1418. [ Links ]