Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT v.21 n.2 Caracas jul. 2002
Nuevas Opciones en el tratamiento de la Diabetes Mellitus Tipo 1: Células Madre y Diabetes
V Bermúdez1, C Cano1, M Medina1, M Ambard1, A Souki1, E Leal1, M Lemus1, S Espinoza1, H Seyfi1, J Andrade1 y F Bermúdez Arias1.
- Centro de Investigaciones Endocrino-Metabólicas "Dr. Félix Gómez". Facultad de Medicina. Universidad del Zulia. Maracaibo, Venezuela.
RESUMEN
La diabetes mellitus tipo 1 es el resultado de la destrucción autoinmune de las células b de los islotes de Langerhans lo que produce deficiencia absoluta de la secreción de insulina y dependencia de la administración exógena de esta hormona. La carencia de fuentes estables de páncreas humanos para ser usados como material de transplante ha generado una intensa investigación en la búsqueda de fuentes alternas de material transplantable. Estos problemas pueden ser solucionados mediante el uso de una fuente renovable de islotes de Langerhans provenientes de la diferenciación de células madre.
Las células madre se definen como células clonigénicas capaces de auto-renovarse y diferenciarse en diferentes líneas de desarrollo. Estas células pueden expandirse in Vivo o in Vitro y diferenciarse hacia un tipo celular deseado. Diferentes tipos de células madre pueden generar muchos tipos celulares: 1) células madre embrionarias, 2) células madre fetales y 3) células madre de individuos adultos. Con métodos de diferenciación y selección in Vitro, las células madre embrionarias pueden ser guiadas hacia la diferenciación en tipos celulares específicos que luego pueden ser identificados mediante selección genética gracias a la expresión de marcadores proteicos específicos. Recientemente gracias al uso de estas técnicas se han podido generar células y agrupaciones celulares con características de islotes de Langerhans y capacidad de secretar insulina que al ser implantadas en animales diabéticos revierten la enfermedad.
La investigación a partir de células madre derivadas de individuos adultos posiblemente resuelva parte del problema ético planteado sobre el uso de células embrionarias en la investigación humana y permita en corto tiempo encontrar una solución viable para la diabetes mellitus tipo 1.
Palabras Clave: Diabetes tipo 1, Células madre y diabetes, Tratamiento.
ABSTRACT
Usually Type 1 diabetes results from autoimmune destruction of pancreatic islet ß-cells, with consequent absolute insulin deficiency and complete dependence on exogenous insulin treatment. The relative paucity of donations for pancreas or islet allograft transplantation has prompted the search for alternative sources for b-cell replacement therapy. Recent advances in molecular and cell biology may allow for the development of novel strategies for the treatment and cure of type 1 diabetes by using a renewable source of cells, such as islet cells derived from stem cells. Stem cells are defined as clonogenic cells capable of both self-renewal and multilineage differentiation. This means that these cells can be expanded in vivo or in vitro and differentiated to produce the desired cell type. There exist several sources of stem cells that have been demonstrated to give rise to pluripotent cell lines: 1) embryonic stem cells; 2) fetal stem cells; 3) adult stem cells. By using in vitro differentiation and selection protocols, embryonic stem cells can be guided into specific cell lineages and selected by applying genetic selection when a marker gene is expressed. Recently, differentiation and cell selection protocols have been used to generate embryonic stem cell-derived insulin-secreting cells that normalise blood glucose when transplanted into diabetic animals. Some recent reports suggest that functional plasticity of adult stem cells may be greater than expected. The use of adult stem cells will circumvent the ethical dilemma surrounding embryonic stem cells and will allow autotransplantation. These investigations have increased the expectations that cell therapy could be one of the solutions to diabetes.
Key Words: Type 1 diabetes, Stem cells and diabetes, Treatment.
INTRODUCCIÓN
Durante décadas se ha investigado profundamente con la finalidad de encontrar un método que reemplace las células b de los islotes de Langerhans perdidas como consecuencia de la agresión autoinmune observada en la Diabetes mellitus tipo 1 (DM1)(1).
Cada año la diabetes afecta mas personas y causa más muertes que el cáncer de mama y el SIDA juntos. Si se considera además que alrededor del 50% de los pacientes con enfermedad coronaria son diabéticos, es obvio el impacto de esta enfermedad sobre los sistemas de salud de todos los países del mundo(2).
Actualmente se considera a la diabetes como una enfermedad que compromete a múltiples sistemas como consecuencia de niveles anormalmente elevados de glucosa sanguínea, el cual es responsable de la mayoría de las complicaciones observadas en la enfermedad(3).
La diabetes tipo 1 (antiguamente denominada diabetes juvenil) afecta típicamente a niños y adultos jóvenes es producida por un ataque autoinmune contra las células b de los islotes pancreáticos que ocasiona una hiperglicemia manifiesta cuando un 80-90% de las células b han sido eliminadas(4).
Hasta el momento no se ha desarrollado ningún tratamiento efectivo que bloquee la cascada autoinmunológica e impida el desarrollo de la enfermedad durante el periodo pre-patogénico ni tampoco una manera efectiva de sustituir las células perdidas. Alternativas como al transplante pancreático, implante de islotes de Langerhans y el páncreas bioartificial no han llenado las expectativas debido al alto costo, dificultad en la obtención de un donante, morbimortalidad del procedimiento y el uso de terapia inmunosupresora de por vida(5).
No se puede negar sin embargo que desde los tiempos de Banting y Best, fecha en la que se introdujo la insulina en la práctica clínica ha habido grandes progresos en el manejo de esta condición tanto en los tipos de insulina disponibles como en las formas de administración. Así, en la actualidad se dispone insulinas humanas de origen recombinante (NPH y cristalina) así como análogos de origen recombinante de inicio de acción ultra-rápida (LisPro y AspArt) y de acción prolongada (Garline). Lamentablemente, la administración exógena de insulina dista mucho de alcanzar la extremadamente bien regulada maquinaria secretora y sensora de la célula b, que durante las 24 horas del día es capaz de producir una dosis basal precisa de insulina así como de aumentar su producción en el caso de una elevación súbita de los niveles plasmáticos de glucosa.
DESARROLLO DEL PÁNCREAS
En los mamíferos el páncreas contiene tres tipos celulares principales: las células ductales, las células acinares y las células endocrinas. Las células endocrinas producen las hormonas glucagón (células a), insulina (células b), somatostatina (células d) y polipéptido pancreático (células P), las cuales son secretadas al torrente sanguíneo con la muy especial particularidad que llegan en primer término al hígado, hecho que determina la gran influencia de éstas sobre el control de funciones metabólicas de crucial importancia como la glucogenolisis/glucogenosístesis y la glucólisis/gluconeogénesis.
Las células acinares son parte del sistema exocrino, el cual sintetiza las enzimas digestivas y las células ductales forman el sistema que conecta los acinos con los órganos digestivos.
En los seres humanos el páncreas se origina de una excrescencia del duodeno. Aparentemente las células del sistema endocrino y exocrino se originan de las células ductales embrionarias al formar acúmulos que se separan de éstas células formando ulteriormente los islotes de Langerhans. El páncreas al ser considerado como órgano completo es la combinación de una glándula acinar lobulada que forma una sección exocrina con islotes embebidos en esta superestructura.
Durante el desarrollo fetal, las nuevas células endocrinas se originan de células progenitoras en los ductos pancreáticos. Muchos investigadores en esta área sostienen que se pueden encontrar células madre de islotes intercaladas con células acinares y ductales, que son las verdaderas responsables del origen de nuevos islotes durante el desarrollo del feto(6).
Las células ductales primordiales pueden distinguirse de las de los islotes por su estructura y por los genes que cada una de ellas expresan. Por ejemplo, las células ductales expresan el gen conocido como citoqueratina-9 (CK-9). Por otro lado, la célula b expresa el gen PDX-1 que codifica una proteína que inicia la transcripción del gen de la insulina(7).
Después del nacimiento y en la vida adulta, no se conoce alguna fuente de nuevas células de los islotes, permaneciendo controversial si existen células madre de islotes en humanos adultos. Algunos investigadores sostienen que estas células madre se pueden encontrar en los ductos pancreáticos y en los mismos islotes(7,8), aunque algunas líneas de investigación soportan la idea que después del nacimiento la principal fuente de células madre es a través de la línea de células madre hematopoyéticas.
DEFINICIONES BÁSICAS UTILIZADAS EN LA TERAPIA DE CÉLULAS MADRE
Una célula madre es una célula que tiene la capacidad de dividirse indefinidamente a través de toda la vida del organismo. Las células madre son capaces de diferenciarse en muchos tipos diferentes de células siempre y cuando se mantengan bajo condiciones adecuadas y se les suministre las señales endocrinas adecuadas. De esta manera, las células madre tienen el potencial de generar células maduras y diferenciadas con funciones especializadas como células miocárdicas, células nerviosas e incluso células b, (Figura 1).
Muchos de los términos utilizados para definir una célula madre dependen de la conducta de estas células en el organismo intacto o después de su transplante in vivo o de las condiciones de cultivo en el laboratorio (in vitro).
Un óvulo fertilizado se acepta como una célula totipotencial (del latín totus = todo)) que tiene el potencial de generar todas las células de todos los tejidos que forman parte del embrión y aquellos que dan soporte al desarrollo del mismo dentro del útero como la placenta. Los mamíferos adultos (y esto incluye al hombre) poseen más de 200 tipos diferentes de células que proceden de la misma célula totipotencial: el zigoto, (Figura 2).
La mayoría de los investigadores usan el término pluripotencial (del latín plures = muchos) para describir células madre que pueden dar origen a cualquier célula de las tres capas germinales embrionarias: Endodermo, mesodermo y ectodermo, las cuales originan todas las células del organismo. En conclusión, estas células tienen el potencial de originar cualquier tipo de célula, una propiedad observada de manera natural en el curso del desarrollo del embrión y bajo ciertas condiciones de laboratorio.
Célula madre unipotencial es un término que se refiere a una célula de un organismo adulto que solo puede generar células hijas que se diferencian a lo largo de una sola línea celular, tal como su nombre lo refiere (del latín unus = uno). La mayoría de las células madre de un tejido específico que no ha sufrido ningún tipo de agresión o daño son del tipo unipotencial y son las responsables del estado estacionario de auto-renovación tisular, donde la cantidad de células perdidas es igual al número de nuevas células. Sin embargo, si el tejido es alterado en su estructura básica a través de un fenómeno lesivo y se requiere de diversos tipos celulares para su reparación se pueden activar células del tipo pluripotencial para reparar el daño.
Las células madre embrionarias que son utilizadas en los estudios actuales se derivan de la masa celular interna embriones en la fase de blastocisto antes de su implantación en el útero, (Figura 3). Estas células madre embrionarias son por definición pluripotenciales y pueden dar origen a cualesquiera de las células de las tres capas germinales (Tabla 1).
Las células madre de los organismos adultos es una célula indiferenciada (no especializada) que se encuentra en un tejido diferenciado (especializado) que tiene la capacidad de auto-renovarse de por vida y de generar cualquier célula del tejido donde se encuentra. Se han encontrado muchas fuentes tisulares de células madre en organismos adultos como por ejemplo médula ósea, torrente circulatorio, córnea, retinal, pulpa dental, hígado, piel, tracto gastrointestinal y páncreas. A diferencia de las células madre embrionarias, hasta la fecha no se ha aislado ninguna célula madre de individuos adultos que sean capaces de formar todas las células del cuerpo, es decir, que sean pluripotenciales o totipotenciales, (Figuras 4 y 5).
Figura 1: Utilidad de las células madre en la investigación y en el tratamiento de patologías humanas

Figura 2: Desarrollo de un organismo mamífero adulto a partir de diferentes tipos de células madre
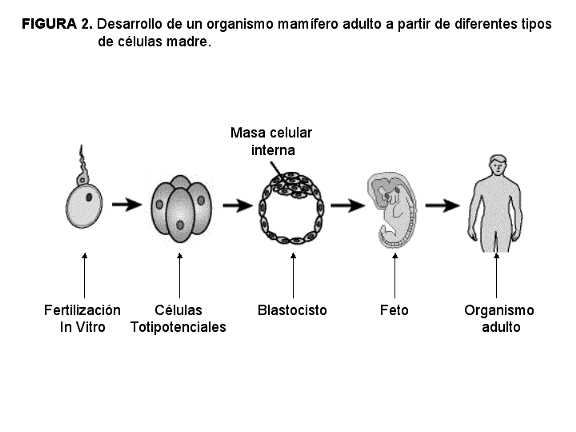
Figura 3: Esquema general para el aislamiento y expansión de células madre embrionarias

Figura 4: Las fuentes de células madre pueden ser muy diversas. La investigación hasta la fecha se ha centrado en el estudio de células madre embrionarias, fetales y de individuos adultos

Figura 5: Generación de diferentes líneas celulares a partir de células totipotenciales. Obsérvese que cada grupo de células madre conserva la capacidad de auto-renovación

Tabla 1:Capas germinales y los tejidos derivados de éstas
| Capa Embrionaria Germinal | Tejido Diferenciado |
| Endodermo | -Timo -Glándulas tiroides y paratiroides -Laringe, tráquea y pulmones -Vejiga urinaria, vagina y uretra -Órganos gastrointestinales (páncreas) |
| Mesodermo | -Médula ósea (sangre) -Corteza suprarrenal -Tejido linfático -Músculo cardíaco, esquelético y liso -Tejido conectivo -Sistema urogenital (excepto vejiga y uretra) -Corazón y vasos sanguíneos |
| Ectodermo | -Piel -Tejido nervioso -Médula suprarrenal -Hipófisis -Tejido conectivo de la cabeza y cara -Ojos, oídos |
TERAPIA DE LA DIABETES MELLITUS TIPO 1 BASADA EN CÉLULAS MADRE
Para el desarrollo de una terapia potencial de tipo celular para pacientes diabéticos se deben cumplir una serie de criterios básicos. De manera ideal, las células madre deben tener la manera de multiplicarse fielmente en cultivo. Esto quiere decir que las células deben ser capaces de auto renovarse sin perder sus características originales. Igualmente, estas células deben ser capaces de diferenciarse in vivo para producir las células especializadas del tejido en cuestión. Sin embargo, para la terapia de la diabetes mellitus tipo 1 aún no está claro si la célula madre debe ser guiada hacia la producción de células b aisladas o islotes completos(5,9). Trabajos recientes como el conducido por Bernat Soria y colaboradores(10) apoyan la tesis de las ventajas de la generación de islotes completos, ya que las células aisladas responden de forma anómala ante un estímulo hiperglicémico, ya que son incapaces de reproducir la respuesta bifásica de secreción de insulina además de presentar un patrón de secretorio tipo "todo o nada".
Tejido fetal como fuente de células madre de islotes de Langerhans
Varios grupos de investigadores trabajan en el uso de tejido fetal como fuente potencial de células progenitoras de islotes(11-16). Tomando como modelo experimental al ratón se ha comparado la capacidad de producción y secreción de insulina de varias fuentes de células madre al ser implantados en ratones inmunológicamente desnudos (tejido humano fetal fresco, islotes humanos purificados, islotes cultivados) encontrándose que el contenido y la producción de insulina era inicialmente mayor en el tejido fetal fresco y en los islotes purificados. Sin embargo, con el tiempo la concentración de insulina se mantuvo en el implante de islotes purificados y disminuyó en el de tejido crudo. Cuando se implantaron los islotes cultivados, la producción de insulina empezó a aumentar progresivamente en el curso de 3 meses. Tomando estos resultados en conjunto, se aprecia que el cultivo previo al implante mejora las condiciones globales al ser transplantadas además de ser capaz de estimular la actividad de células madre que generan nuevas células b y/o islotes. A pesar de estos promisorios elementos, la mayoría de las investigaciones han concluido en que es bastante difícil lograr la expansión celular en cultivos de islotes fetales.
Tejido adulto como fuente de células madre de islotes de Langerhans
Muchos investigadores se han centrado en el cultivo de islotes derivados de cadáveres humanos adultos para su uso como material transplantable(7,8,10). A pesar que las células b diferenciadas son difíciles de hacer proliferar, algunos grupos han tenido éxito en utilizar técnicas de ingeniería genética para mejorar su capacidad proliferativa(17). Por ejemplo, Fred Levine, et al(18) transformaron islotes obtenidos de cadáveres humanos al insertar un gen que estimula la proliferación celular. Lamentablemente, cuando estas células proliferan son incapaces de producir insulina, así que posteriormente las células fueron nuevamente transformadas al introducir el gen PDX-1 para estimular la transcripción del gen de la insulina. Estas líneas celulares han demostrado propagarse y luego diferenciarse a células productoras de insulina y al ser transplantadas a ratones inmunológicamente desnudos retienen la capacidad insulinosecretoria en respuesta a la glucosa.
Otra fuente prometedora de células progenitoras de islotes son las células madre de los conductos pancreáticos(9,10). Muchos investigadores sostienen la tesis que a nivel ductal se encuentran cantidades suficientes de células multipotenciales mezcladas con células maduras ductales. Igualmente, desde hace tiempo se investiga la posibilidad de des-diferenciar a células ductales maduras hasta un periodo en el cual (luego de las señales endocrinas adecuadas) se puedan conducir hacia la diferenciación a islotes pancreáticos(7-10,19-21).
En otro orden de ideas Joel Habener, et al actualmente investigan la presencia de células madre dentro del tejido pancreático adulto, bien sea dentro de los islotes mismos, en el estroma o en el sistema ductal. Estos investigadores han encontrado células que no expresan los marcadores típicos de las células ductales ni de los islotes maduros, pero dependiendo de los factores de crecimiento introducidos al medio de cultivo se pueden diferenciar a diferentes tipos celulares, incluyendo hepatocitos, neuronas, células acinares pancreáticas e islotes de Langerhans(20-26).
Células embrionarias como fuente de células madre de islotes de Langerhans
El descubrimiento de métodos de aislamiento y de crecimiento de células madre embrionarias en 1988, ha renovado las esperanzas para el desarrollo de una cura para la diabetes mellitus tipo 1(13). En teoría, las células madre embrionarias pueden ser cultivadas y guiadas hacia el desarrollo de células productoras de insulina e incluso, islotes completos(13,15). Una idea que surge como una gran esperanza es la posibilidad de transformar genéticamente este tipo de células de tal forma que no expresen proteínas de membrana que estimulen su identificación y rechazo por parte del sistema inmune, cuestión que haría innecesaria la administración de inmunosupresores(11,18,22), (Figura 6).
Figura 6: La clonación representa una nueva forma de generar una cantidad casi ilimitada de células madre
Recientemente, investigadores en España(11) insertaron el gen de la insulina a células embrionarias de ratón unido a un gen que confería resistencia a antibióticos. Al cultivar dichas células en presencia del antibiótico, las que no lograron expresar eficientemente el gen de resistencia (y por ende el de insulina) murieron y las que expresaron dichos genes lograron sobrevivir. Este método es una forma muy eficiente de seleccionar aquellas células en las que ha sido insertado con éxito un gen que se desea expresar en una célula madre. Las células sobrevivientes fueron luego cultivadas y clonadas a una baja concentración de glucosa, posterior a lo cual se diferenciaron a células productoras de insulina.
Por otro lado, Ron McKay, et al(13). Describieron una serie embrionarias de ratón a diferenciarse a estructuras secretoras de insulina parecidas a islotes de Langerhans. Estos investigadores comenzaron con células madre embrionarias (embrión trilaminar) seleccionando aquellas células que expresaban la proteína Nestina. Usando un nuevo método de cultivo en cinco pasos fueron capaces de inducir la formación de estructuras tipo islotes. Estas células respondieron con secreción de insulina a un incremento en la concentración de glucosa en el medio, aunque de manera menos potente que un islote normal. Cuando se inyectaron estas células en ratones diabéticos tipo 1, los niveles de glucosa plasmática disminuyeron de forma apreciable.
De acuerdo con estos resultados se puede apreciar que es posible desarrollar sistemas secretores de insulina completos que pueden incluso reaccionar a señales neurológicas autonómicas.
Los resultados mas recientes reportados por el grupo de la Universidad Hebrea de Jerusalén(27) muestran que las células madre embrionarias pueden ser manipuladas con la finalidad de que expresen el gen PDX-1. En esta experiencia experimental estos investigadores cultivaron embriones humanos hasta la etapa trilaminar, momento en el cual fueron tratadas con factor de crecimiento derivado de nervios observando que eran capaces de expresar el PDX-1. Debido que la expresión de este gen se asocia con la formación de células b se sugiere que estas células se derivan de manera espontánea de este tipo de células madre. Actualmente se conoce bien que el factor de crecimiento de nervios es una señal clave para la inducción de la diferenciación de todas las células de los islotes y que puede ser explotada de forma experimental en el laboratorio.
REFERENCIAS BIBLIOGRAFICAS
1. Undlien DE, Thorsby E. HLA associations in type 1 diabetes: merging genetics and immunology. Trends Immunol 2001; 22(9): 467-469. [ Links ]
2. Mazzone T. Increased prevalence of significant coronary artery calcification in patients with diabetes. Diabetes Care 2001; 24(8): 1508. [ Links ]
3. Prasad S, Kamath GG, Jones K. Prevalence of blindness and visual impairment in a population of people with diabetes. Eye 2001; 15(5): 640-643. [ Links ]
4. Mathis D, Vence L, Benoist C. beta-Cell death during progression to diabetes. Nature 2001; 414(6865): 792-798. [ Links ]
5. Berna G, Leon-Quinto T, Ensenat-Waser R, Montanya E, Martin F, Soria B. Stem cells and diabetes. Biomed Pharmacother 2001; 55(4): 206-212. [ Links ]
6. Edlund H. Factors controlling pancreatic cell differentiation and function. Diabetologia 2001; 44(9): 1071-1079. [ Links ]
7. Pattou F, Kerr-Conte J, Gmyr V, Vandewalle B, Vantyghem MC, Lecomte-Houcke M, Proye C, Lefebvre J. human pancreatic stem cell and diabetes cell therapy. Bull Acad Natl Med 2000; 184(9): 1887-1899. [ Links ]
8. Smaglik P. Diabetes therapy boosts stem-cell campaign. Nature 2000; (20) 406:422. [ Links ]
9. Ramiya VK, Maraist M, Arfors KE, Schatz DA, Peck AB, Cornelius JG. Reversal of insulin-dependent diabetes using islets generated in vitro from pancreatic stem cells. Nat Med 2000; 6(3): 278-282. [ Links ]
10. Soria B, Skoudy A, Martin F. From stem cells to beta cells: new strategies in cell therapy of diabetes mellitus. Diabetologia 2001; 44(4): 407-415. [ Links ]
11. Soria B, Roche E, Berna G, Leon-Quinto T, Reig JA, Martin F. Insulin-secreting cells derived from embryonic stem cells normalize glycemia in streptozotocin-induced diabetic mice. Diabetes 2000; 49(2): 157-162. [ Links ]
12. Pfeiffer AF. Current perspectives of biotechnological replacement of insulin secreting cells. Exp Clin Endocrinol Diabetes 2000; 108(8): 494-497. [ Links ]
13. Lumelsky N, Blondel O, Laeng P, Velasco I, Ravin R, McKay R. Differentiation of embryonic stem cells to insulin-secreting structures similar to pancreatic islets. Science 2001; 292(5520): 1389-1394. [ Links ]
14. Zwillich T. Diabetes research. Islet transplants not yet ready for prime time. Science 2000 28; 289(5479): 531-533. [ Links ]
15. Assady S, Maor G, Amit M, Itskovitz-Eldor J, Skorecki KL, Tzukerman M. Insulin production by human embryonic stem cells. Diabetes 2001; 50(8): 1691-1697. [ Links ]
16. Fernandes A, King LC, Guz Y, et al. Differentiation of new insulin-producing cells is induced by injury in adult pancreatic islets. Endocrinology 1997; 138(4): 1750-1762. [ Links ]
17. Rosenberg L. In vivo cell transformation: neogenesis of beta cells from pancreatic ductal cells. Cell Transplant 1995; 4(4): 371-383. [ Links ]
18. Beattie GM, Hayek A, Levine F. Growth and genetic modification of human beta-cells and beta-cell precursors. Genet Eng 2000; 22: 99-120. [ Links ]
19. Peshavaria M, Pang K. Manipulation of pancreatic stem cells for cell replacement therapy. Diabetes Technol Ther 2000; 2(3): 453-460. [ Links ]
20. Guz Y, Nasir I, Teitelman G. Regeneration of pancreatic beta cells from intra-islet precursor cells in an experimental model of diabetes. Endocrinology 2001; 142(11): 4956-4968. [ Links ]
21. Soria B. In-vitro differentiation of pancreatic beta-cells. Differentiation 2001; 68(4-5): 205-219. [ Links ]
22. Shapiro AM, Lakey JR. Future trends in islet cell transplantation. Diabetes Technol Ther 2000; 2(3): 449-452. [ Links ]
23. Rao MS, Mattson MP. Stem cells and aging: expanding the possibilities. Mech Ageing Dev 2001 31; 122(7): 713-734. [ Links ]
24. Peck AB, Chaudhari M, Cornelius JG, Ramiya VK. Pancreatic stem cells: building blocks for a better surrogate islet to treat type 1 diabetes. Ann Med 2001; 33(3): 186-192. [ Links ]
25. Serup P, Madsen OD, Mandrup-Poulsen T. Islet and stem cell transplantation for treating diabetes. BMJ 2001 6; 322(7277): 29-32. [ Links ]
26. Gavaghan H. The promise of stem cells. Bull World Health Organ 2001; 79(8): 800-801. [ Links ]
27. Ferber S. Can we create new organs from our own tissues? Isr Med Assoc J 2000; 2: 32-36. [ Links ]














