Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT v.23 n.2 Caracas jul. 2004
Receptores de glutamato.- Implicaciones terapéuticas
C Fouillioux1, F Contreras2, M Rivera2, A Terán3 y M Velasco4.
1 Prof. Bioquímica, EEE - UCV.
2 Prof. Fisiopatología, EEE - UCV.
3 Residente Posgrado, Hospital Victorino Santaella, Los Teques, Edo. Miranda
4 Unidad de Farmacología, Escuela de Medicina JM Vargas, UCV.
E-mail: sicontreras@cantv.net
Resumen
El glutamato, uno de los neurotransmisores más abundantes en el sistema nervioso, realiza su acción excitadora actuando sobre receptores específicos localizados en la membrana neuronal. Los receptores de glutamato se han clasificado en dos grupos principales: receptores ionotrópicos y metabotrópicos. El receptor NMDA es una proteína muy compleja y tremendamente regulada. Su conductancia al Ca2+ es notablemente alta y es quizá su característica más destacable y la responsable de muchas de sus funciones. Distintas combinaciones de la subunidad fundamental NR1 con las otras subunidades dan lugar a receptores NMDA con propiedades funcionales diferentes, que pueden estar distribuidas en áreas encefálicas específicas y/o que pueden definir respuestas fisiológicas o patológicas distintas en respuesta al glutamato. Se han localizado receptores de glutamato en SNC, páncreas, hipófisis, glándulas adrenales y gónadas. Particularmente en páncreas, se demostró que GluR1 y GluR4 se hallan limitadas a células secretoras de insulina en la masa central de los islotes pancreáticos. Se conoce que hay receptores de NMDA en osteoclastos y osteoblastos, postulándose que puedan participar en el desarrollo de enfermedades como la osteoporosis. En vista de la amplia participación del glutamato en la neurotransmisión así como en el desarrollo de varias patologías, se han intentado ensayos clínicos con varias drogas bloqueantes de los receptores NMDA, principalmente antagonistas ionotrópicos, con resultados prometedores en cuanto a dolor, depresión y Parkinson.
Palabras Clave: Receptores, Glutamato, Receptores ionotrópicos y metabotrópicos, Neurodegeneración, Dolor, ACV.
ABSTRACT
Glutamate, one of the most prevailing neurotransmitters on the nervous system, acts on specific receptors on the neuronal membrane where exerts an excitatory action. The glutamate receptors had been classified in two main groups: ionotropic and metabotropic receptors. The NMDA receptor is a highly regulated and very complex protein. Its high Ca2+ conductance is maybe the most meaningful characteristic and also responsible for many functions. Different combinations of the fundamental subunit NR1 with others subunits give place for others NMDA receptors with different attributes, with possible distinct localizations and that may define different physiological responses. Glutamate receptors have been found in the Central Nervous System, pancreas, pituitary, adrenal glands and gonads. In pancreas, it was shown that GluR1 and GluR4 are distributed on insulin secretor cells on the central mass of pancreatic islets. There are glutamate receptors also in osteoclasts and osteoblasts, which may play a role in the development of osteoporosis. Given the main participation of glutamate on neurotransmission and several pathologies, many clinical studies had evaluated drugs mainly glutamate ionotropic antagonists with promising results in pain, depression and Parkinsons disease.
Key Words: Glutamate receptors, Ionotropic and metabotropic, Neurodegeneration, Pain, Stroke.
Introducción
En estos momentos se toma como un hecho irrebatible que las neuronas se comunican a través de sinapsis. Pero hace aproximadamente 100 años cuando Ramón y Cajal en España describió que las neuronas se comunican unas con otras a través de contactos especializados, nunca se imaginó las consecuencias de su descubrimiento, menos aún del camino que a partir de ese momento tomaría el estudio del cerebro. En la actualidad, técnicas de patch clamp(1) que nos permiten el estudio aislado de canales iónicos, conjugadas con el inmenso desarrollo de la biología molecular, nos han permitido comprender de forma cada día más transparente las sinapsis y sus vehículos principales: los neurotransmisores y sus receptores.
El aminoácido glutamato, es el neurotransmisor excitatorio principal del cerebro, siendo usado en aproximadamente dos tercios de las sinapsis(2,3). Está involucrado en la plasticidad sináptica en el adulto, la neurogénesis y neurodegeneración(4,5). Pero además, muchos otros estudios han demostrado que el repertorio funcional del glutamato va más allá de su función dentro del sistema nervioso central, comprobándose la existencia de receptores de glutamato en una gran variedad de células no excitables, como por ejemplo tejido pancreático, osteoclastos y osteoblastos(6). El mecanismo por el cual estos receptores se activan o cuál papel ejercen dentro del metabolismo celular en otros tejidos es en la mayoría de los casos un misterio y tema de intenso estudio.
Metabolismo
En el cerebro, el glutamato proviene de dos fuentes principales: desde glucosa a través del ciclo de Krebs y transaminación de α-cetoglutarato y desde glutamato que es tomado desde el espacio sináptico tanto por neuronas como astrocitos(7).
Ácido glutámico o glutamato, es un aminoácido dicarboxílico que desempeña un papel central en relación con los procesos de transaminación y en la síntesis de distintos aminoácidos que necesitan la formación previa de este ácido, como es el caso de la prolina, oxiprolina, ornitina y arginina. Se acumula en proporciones considerables en el cerebro (100-150 mg por 100 gr de tejido fresco). De todos los posibles precursores, la glutamina es la más importante en la síntesis de este neurotransmisor y, por consiguiente, la glutaminasa mitocondrial de los terminales nerviosos sería la enzima responsable de su formación. De hecho, la regulación de esta enzima está estrechamente ligada a la actividad del terminal nervioso. Debido a que se inhibe por glutamato, el producto de la reacción, en condiciones de reposo o inactividad de los altos niveles de glutamato intraterminales (3-10 mM) mantienen la enzima inactiva. Tras la llegada de un potencial de acción se produce liberación de glutamato desapareciendo, por tanto, la inhibición existente sobre la enzima (ver Figura 1), lo que equivale a una activación de la formación de glutamato que restaura los niveles del neurotransmisor en el terminal sináptico.
Secuencia de liberación y recaptación de ácido glutámico y aspártico en las hendiduras sinápticas

Clasificación de los receptores glutaminérgicos
Los receptores de glutamato se han clasificado en dos grupos principales: receptores ionotrópicos y metabotrópicos. En los primeros la unión del glutamato a su receptor resulta en un cambio conformacional que permite el paso de cationes de calcio y sodio a través de un poro. Los receptores metabotrópicos, por otro lado, no son permeables a iones, al contrario, estos receptores están acoplados por medio de proteínas G a segundos mensajeros intracelulares, los cuales pueden regular actividades celulares como trascripción de genes, pero también fosforilación de canales iónicos dependientes de voltaje o dependientes de ligandos(5). Cada uno de estos grupos tiene aún más diversidad molecular, lo cual resulta en la existencia de diferentes subunidades o subtipos, (ver Tabla 1)(4,8).
Receptores ionotrópicos de glutamato
Típicamente los canales iónicos se encuentran cerrados en el estado de reposo, pero se abren en respuesta a la unión del agonista, permitiendo que iones específicos fluyan a través de sus gradientes electroquímicos a través de un poro interno(9). Tras la activación, los canales pasan por una desensibilización espontánea, cerrándose incluso en la presencia continua del agonista. En la sinapsis la función de estos canales iónicos es la despolarización o hiperpolarización de la membrana plasmática, dependiendo de la selectividad iónica del canal y la naturaleza de los gradientes transmembrana correspondiente.
Las tres familias de receptores ionotrópicos fueron definidas en principio por su farmacología y posteriormente por su biología molecular, esto último a finales de los años 80s(10). Posterior a la caracterización de las subunidades, y al hallazgo de su papel primordial en cuanto a las sinapsis excitatorias del cerebro, se le comenzó a dar mayor importancia a la investigación de antagonistas y agonistas.
Es así entonces que se definieron tres subtipos de receptores en razón de su afinidad por agonistas sintéticos: NMDA, AMPA y Kainato.
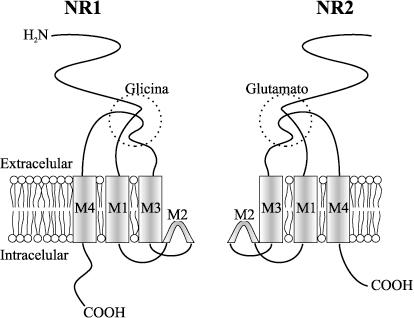
El receptor de NMDA tiene como característica especial ser voltaje - bloqueado por el Mg2+, y debido a este mismo aspecto se le resta importancia dentro de las neurotransmisiones del SNC. Otra característica específica de este receptor es su necesidad de Glicina como coagonista(2,11). Estos receptores están compuestos de un ensamble heterómero de subunidades NR1 y NR2. Son permeables al influjo de Ca2+ y al flujo retrógrado de K+. El sitio de unión del glutamato está localizado en la subunidad NR2, mientras que el sitio de unión de su coagonista obligatorio glicina está situado en la subunidad NR1, (ver Figura 2)(5,7).
Estructura de un receptor NMDA
El receptor AMPA está compuesto de cuatro subunidades, cada subunidad está compuesta a la vez de 3 dominios transmembrana y una solo dominio intra citoplasmático (ver Figura 3). Cada receptor puede existir como un receptor homomérico, es decir con cada subunidad del mismo tipo (ya sea GluR1, GluR2, GluR3 o GluR4), o como un heterómero conformado por 4 subunidades distintas.
Estructura de un receptor AMDA

Los receptores de Kainato, comparten la misma topología y estoiquiometría que los receptores AMPA, por lo que están compuestos de tetrámeros, con cada monómero conteniendo cuatro segmentos transmembrana (M1-M4). El segmento M2 ayuda a formar el poro como en los otros receptores.
Receptores metabotrópicos de glutamato
Los receptores metabotrópicos comprenden una familia heterogénea de receptores que están vinculados a varias vías de señales de transducción vía proteínas G. A diferencia de los receptores ionotrópicos, la unión de glutamato a receptores metabotrópicos, no activa la apertura de un canal intrínseco sino que regula la transmisión sináptica y excitabilidad neuronal a través de la activación o inhibición de varios sistemas efectores acoplados a proteínas G. Por esta razón, los efectos de la activación de esta clase de receptores son considerablemente más lentos al inicio y su duración de acción es mayor, por lo cual pueden modular actividad neuronal a través de un mayor período de tiempo(5). La estructura de estos receptores es la típica estructura de los receptores acoplados a proteína G, y consta de siete dominios transmembrana, separados por pequeñas asas intra y extracelulares (ver Figura 4).
Estructura de un receptor metabotrópico

Se denominan mGluR, y hasta la fecha se han descrito 8 subtipos, divididos en tres grupos. El grupo I, lleva a la activación de la Fosfolipasa C, resultando en la generación de dos segundos mensajeros: el DAG (diacilglicerol) que activa a la Proteína Cinasa C, y el inositol 3 fosfato, que media la liberación de iones de Calcio de los depósitos intracelulares. Este mecanismo lleva a la excitación neuronal, y a su vez, esto produce un feedback positivo que puede llevar a sobreexcitación causando posible muerte celular por apoptosis. Esto se ha denominado "excitotoxicidad" (ver más adelante). En contraste, la activación de los grupos II y III, cuya activación a su vez inhibe a la adenilciclasa, resulta en una menor producción de AMPc y en una menor liberación de glutamato, siendo entonces neuroprotectivos(4,8).
Transporte de glutamato
Los trasportadores de glutamato son primordialmente dependientes de sodio. Se han identificado hasta la fecha cinco isoformas en el humano; EAAT1-5(12). Los transportadores de glutamato exhiben un patrón único de acoplamiento de iones inorgánicos que les permite bombear glutamato eficientemente hacia el interior de las células. El transporte es electrogénico y la captación de una molécula de glutamato está acoplada al cotransporte de tres iones de sodio y un protón y al contra transporte de un ión de potasio. Esto ocasiona que resulte en una translocación neta de dos cargas positivas por ciclo de transporte, produciendo finalmente acidificación intracelular. El transporte de glutamato es un factor clave en la reutilización y acumulación del mismo en el espacio sináptico, influyendo por ende en la generación de excitotoxicidad por defectos en los mecanismos aún no esclarecidos(2,3,13,14), (ver Tabla 2).
Localización en otros tejidos
En 1987, ocurrió una epidemia letal en Canadá debido al consumo de mariscos contaminados con fitoplancton que contenía ácido domoico(15). Las personas que en ese entonces sufrieron la intoxicación presentaron severas convulsiones, pero además trastornos gastrointestinales y arritmias cardíacas. Siendo el ácido domoico un análogo del glutamato, se comenzó a estudiar la existencia de receptores glutamatérgicos en otras localizaciones además del SNC. Actualmente, se ha demostrado su existencia en múltiples tejidos y que la activación de estos obedece a los mismos parámetros que en SNC(6).
Corazón
La localización preferencial de receptores glutamatérgicos está demostrada en el tejido de conducción y células ganglionares intramurales. La presencia de GluRs en el corazón sugiere su participación en el control del ritmo cardíaco(15-17), y esto explicaría la aparición de arritmias en los pacientes intoxicados por el ácido domoico.
Riñón y homeostasis hidroelectrolítica
Se han encontrado receptores glutamatérgicos en el aparato juxtaglomerular y en los túbulos proximales(15). No es de extrañar su existencia, dado que otros neurotransmisores como la Dopamina se han demostrado ampliamente en dicho sistema(18), así como se ha comprobado su participación en los procesos de regulación de la presión arterial y control hidroelectrolítico. Se puede predecir entonces que el glutamato juega también un papel en la regulación de la presión arterial, y esto quedó claro en un estudio reciente publicado en Clinical Science(19), donde se estudió el efecto de la infusión de glutamato en pacientes a ser sometidos a bypass coronario rutinario. Ellos plantean este trabajo debido a observaciones previas que datan de principios de los años 80 donde se observaba que tras la infusión de glutamato, disminuía la demanda energética del mismo y mejoraba el ritmo. En el estudio antes mencionado, no se apreciaron cambios en el consumo energético del miocardio, pero sí se observó una mejoría significativa en el performance hemodinámico. Ellos atribuyen esto último gracias a una disminución de la postcarga constatándose vasodilatación periférica. Esto concuerda muy bien con la hipótesis de receptores periféricos funcionales de glutamato.
Tejidos neuroendocrinos y secreción hormonal
Se han localizado receptores de glutamato en páncreas, hipófisis, glándulas adrenales y gónadas(15). Particularmente en páncreas, se demostró que GluR1 y GluR4 se hallan limitadas a células secretoras de insulina en la masa central de los islotes pancreáticos, mientras que GluR 2 y 3, se restringían periféricamente a éstas(20). Mediciones de electrofisiológicas de Ca2+ intracelular han mostrado que kainato, AMPA y NMDA ocasionan incrementos de Ca2+ en células β, y las despolarizan. Estas observaciones añaden evidencia que el glutamato y sus receptores están involucrados en la regulación de la secreción hormonal.
Otros tejidos
Se conoce que hay receptores de NMDA en osteoclastos y osteoblastos, postulándose que puedan participar en el desarrollo de enfermedades como la osteoporosis(21,22). Más aún, se han encontrado receptores en los pequeños terminales nerviosos no mielinados de la piel(21).
Neurodegeneración
El glutamato posee un especial interés para la investigación neurológica, dado que puede formar parte del desarrollo de procesos de neurodegeneración crónica y aguda. Se plantean tres posibles mecanismos para este punto(2):
a.La posibilidad de que el glutamato exógeno consumido en la dieta actuando sobre receptores de glutamato dañe el cerebro u otros tejidos.
b.La posibilidad de que glutamato endógeno liberado por las neuronas contribuya a la neurodegeneración aguda relacionado con isquemia cerebral o traumatismos.
c.La posibilidad de que la activación de los receptores de glutamato contribuya al proceso de muerte celular en enfermedades neurodegenerativas crónicas como la enfermedad de Parkinson, Alzheimer o Huntington.
Glutamato como toxinas en la dieta
Con respecto al consumo en la dieta, desde los años 70 se describió que el GMS (Glutamato monosódico) impartía un sabor único por sí solo y se denominó "umami" (sabor delicioso)(8,21). También se descubrió que potenciaba el sabor de otras comidas, como el dulce y lo salado, por lo cual se inició su utilización masiva en la industria alimentaría, particularmente en la cocina oriental.
En humanos se conoce solo un ejemplo de intoxicación por el consumo de glutamato o sus análogos y es el caso del ácido domoico antes mencionado. En animales como las ratas, hay más casos descritos como los trabajos iniciados por Lucas y Newhouse en 1957(23) quienes observaron que las inyecciones subcutáneas de glutamato en ratones infantes causaba degeneración de las neuronas de las capas más internas de la retina. Más tarde se determinó que esas lesiones ocurrían también en el cerebro, particularmente en el hipotálamo. Se inició entonces una investigación extensa en cuanto a la seguridad del consumo del GMS, hasta que una revisión por la FDA en 1987 lo catalogara como uno de los ingredientes consumibles más seguros en el mundo. En el año 2002 recayó nuevamente interés sobre el GMS al ser publicado el trabajo de Ohguro(24), quien al administrar una dieta estándar, una dieta con un exceso moderado de GMS y una dieta conteniendo un gran exceso de GMS durante 6 meses a ratas, encontró que las que consumieron GMS tenían capas retinales neuronales más delgadas comparadas con las ratas cuya dieta fue estándar. La extrapolación de estos resultados a los humanos son aparentemente exagerados(25), dado que para tener la proporción de consumo que tuvieron las ratas, la comida debería contener tal cantidad de GMS que sería imposible consumir por su sabor.
De todos modos, en vista de la evidencia parcial en humanos, queda planteada la incógnita si la ingesta lenta y progresiva de glutamato causa daños a largo plazo.
Glutamato endógeno y neurotoxicidad aguda
El mecanismo principal que parece mediar la neurotoxicidad aguda es el desequilibrio iónico relacionado con la entrada excesiva de Na+ y Ca2+, a través de canales iónicos. Para los receptores de glutamato esto se ha llamado excitotoxicidad; y se ha demostrado como un mecanismo fisiopatológico en el desarrollo de neurodegeneración tras traumatismos, isquemia y otras enfermedades neurológicas(26).
Debido a que los GluRs son canales iónicos selectivos a Na+, K+ y Ca2+, cualquier estimulación sostenida resulta en daño osmótico debido a la entrada excesiva de iones y agua. Los receptores NMDA tienen una participación particularmente importante al conducir iones de Ca2+, que son cruciales determinantes del daño(4). Es esta alta concentración de Ca2+ que activa a varias cascadas enzimáticas que incluyen a las fosfolilapasas, proteínas cinasa C (PKC), proteasas, sintetasas de ácido nítrico y la generación de radicales libres. Tras la activación de la fosfolipasa A2, se genera ácido araquidónico, en conjunto con sus metabolitos y factores activadores de plaquetas. Los factores activadores de plaquetas incrementan los niveles de calcio neuronal, debido a que estimulan la liberación de glutamato. El ácido araquidónico potencia las corrientes evocadas por NMDA e inhibe la reabsorción de glutamato por astrocitos y neuronas. Esto exacerba aún más la situación, creando un feedback positivo donde se forman radicales libres (durante el metabolismo del ácido araquidónico), que lleva a mayor activación de fosfolipasa A2. La consecuencia es mayor glutamato extracelular, que contribuye a una activación sostenida de los GluRs(15).
La concentración elevada de Ca2+, eleva el óxido nítrico por la vía de la activación de sintetasas de óxido nítrico por calmodulinas, lo cual genera radicales de oxígeno. En vista de que los receptores AMPA son permeables al Ca2+, y el mecanismo de activación del óxido nítrico es Ca2+ dependiente, se ha postulado que la activación del mismo puede formar parte de mecanismos de lesión en todos los tejidos(15,20).
Se ha planteado que la enzima GPT (transaminasa glutamato-piruvato, también conocida como alanino aminotransferasa) es capaz de degradar bajo condiciones fisiológicas, concentraciones neurotóxicas de glutamato(27) con lo cual evitaría el desarrollo de excitotoxicidad en algunos tejidos.
Neurodegeneración crónica
En cultivos organolépticos de médula espinal, los inhibidores del transporte de glutamato causan degeneración de motoneuronas, por acumulación del mismo en el espacio sináptico. Esto puede ser revertido por antagonistas de AMPA como GYKI 52466(2). Este experimento es una señal de la toxicidad crónica del glutamato. Una de las patologías mayormente estudiadas es la enfermedad de Alzheimer, donde existe muerte neuronal ya sea por apoptosis o por necrosis sobre un período prolongado de años y en regiones muy específicas de la corteza cerebral. Existe muerte celular en neuronas glutamatérgicas de la corteza frontal, temporal y parietal y se ha propuesto que un exceso en el glutamato endógeno es la causa. Esto podría ocurrir si los transportadores dependientes de energía carecieran de suficiente ATP o si la proteína es dañada por el estrés oxidativo. En ambos casos se llegaría a una hiperestimulación por la acumulación de glutamato en el espacio sináptico, con la consiguiente excitotoxicidad descrita antes(3).
Los receptores de glutamato están implicados además en la llamada sinaptogénesis durante las fases de crecimiento. Se ha demostrado que los conos de la médula espinal de Xenopus cambian de dirección y se mueven hacia un gradiente de mayor concentración de glutamato. Esto formaría parte de la fisiopatología de la epilepsia, donde un trastorno en la organización durante el crecimiento, con la formación de sinapsis anormales propicia la aparición de focos epilépticos(7,28).
Implicaciones terapéuticas
En vista de la amplia participación del glutamato en la neurotransmisión así como en el desarrollo de varias patologías, se han intentado varias drogas, principalmente antagonistas ionotrópicos, con un éxito relativo. Esto se debe a que el antagonismo de los receptores ionotrópicos de glutamato, concretamente el NMDA, tiene un número de efectos adversos sobre el SNC, incluyendo alucinaciones, incremento en la presión arterial, y a altas dosis, catatonia y anestesia. Estos efectos colaterales basados en el mecanismo de acción de los receptores han limitado las dosis de estos agentes utilizados en clínica. Además de esto, la dificultad de conducir estudios clínicos en enfermedades con resultados tan variables como los accidentes cerebro vasculares o enfermedades crónicas como el Alzheimer es considerable(26). Aún así, durante los últimos años se han visto resultados prometedores en cuanto a dolor, depresión y Parkinson, que se describen a continuación, (ver Tabla 3).
Agonistas y antagonistas de los receptores ionotrópicos de glutamato
| NMDA | AMPA | KAINATO | |
| Agonistas | Glutamato, L-Aspartate, L-glutamato, Glicina. | Glutamato, Kainato, Derivados carboxilos: (RS)-2-amino-3-(3-carboxy-5-metil-4-isoxazolyl)-Ácido propiónico, Derivados feniles: (S)2-amino-3-hidroxi-5 fenil-4 isoxazolyl- Ácido propiónico, 5-fluwillardiine a nivel del hipocampo, Ácido domoico1, N-methylamino-L-alanino2, (S) 5-iodowillardiine3 | Ácido kaínico, 2-carboxi-4-isopropenil-3-pirrolidina acetato Glutamato, AMPA (GluR5, GluR6, GluR7, KA1, Ka2), N-methylamino-L-alanino2 (GluR5, GluR6), (2S4R)-4 metilglutamato (SYM 2081), (S) 5-iodowillardiine3, DZKA, tert-butil-AMPA (GluR5), (ATPO) fosforo-isoxazol(GluR5)4 |
| Antagonistas competitivos | Quinoxalinedionas halogenadas, Derivados del ácido quinurenico4(NR1), Derivados del fósforo: aa AP5 y AP72(NR1), Derivados de ftalazinadiona.3(NR1), Derivados de benzazepinadiona.7(NR1), (CGP61594) Derivado del ácido: dicloro-tetrahidroquinolona-2-carboxílico (NR2B). | Quinoxalinedionas, Quinoxalinas, LY294486 (GluR5), ATPO fosforo-isoxazol (GluR1). | Quinoxalinedionas, Quinoxalinas, LY293558 (GluR5), LY294486 (GluR5) |
| Antagonistas no competitivos | Ifenprodilo (NR2B) (feniletanolamida), Protones (Zn2+, Mg2+), Eliprodil9, haloperidol9, CP101,606.10, Ro25-698110, Ro8-4304210, Altas dosis de Etanol (NR2A, NR2B), Tricloroetanol (concentraciones anestésicas), Péptido de dinorfina Dyn A (1-13), Dyn A (1-17), DynA (1-32) (NR2A), Toxinas del caracol marino | 2,3 benzodiacepinas, 1,4 benzodiacepinas, GIKI 53655 (LY300168). | GIKI 53655 (LY300168) Ciclotiazida |
| Bloqueantes no competitivos | *Mg+2, Poliaminas: ketamina, dextrometorfan, dextrorfan, amantadina, memantina, metabolito derivado de la desglicina, Fenciclidina (MK-801), 9-aminoacrididina. |
1 Agonista potentes en los flagelados.
2 Agonista potente en los cycad seeds.
3 Más potente para Kainato que para AMPA.
4 Agonista parcial.
5,6,7,8 Antagonista competitivo de la glicina.
9 Bloqueo no selectivo. Bloquea receptores de serotonina y canales de calcio.
10 Derivados del Ifenprodil.
Dolor
El dolor crónico no es una versión prolongada del dolor agudo. Ante señales que se generan repetidamente las vías nerviosas presentan cambios físico-químicos que las hacen hipersensibles a las señales de dolor y resistentes al impulso antinociceptivo. En un sentido real las señales se fijan en la médula espinal como una memoria de dolor. Se produce hipersensibilidad en la médula espinal. La activación sostenida de los receptores AMPA siempre expuestos en terminales nerviosas aferentes agota los iones Mg2+, los cuales actúan como frenos en los canales transmembrana de Na+ y Ca2+ en el complejo receptorial NMDA. Se produce como consecuencia una activación de las neuronas espinales con menor estímulo periférico (menos glutamato produce mayor estimulación). El mecanismo encefalinérgico antinociceptivo no es capaz de contrarrestar este efecto. Asimismo, las endorfinas y otros neurotransmisores inhibitorios tampoco pueden mantenerse con la demanda y pierden efectividad. En el dolor crónico se establecen los siguientes cambios:
1. La constante actividad de los receptores NMDA ocasiona que las células nerviosas generen nuevas terminaciones conectivas. Ocurre una remodelación neuronal que da nuevas dimensiones a nuevas sensaciones; conse-cuentemente el componente emocional del dolor aumenta.
2. Existen evidencias de que los receptores NMDA activados pueden estimular mecanismos apoptóticos normales, lo que sugiere que el dolor crónico es un proceso destructivo que requiere tratamiento a tiempo para limitar los daños que produce, tanto en la médula espinal como en la periferia (para una revisión detallada, ref. 29 y 30).
En experimentos con voluntarios sanos, los antagonistas de NMDA, ketamina y dextrometorfan, disminuyen la intensidad del dolor tras estimulación eléctrica o química. En un reciente estudio publicado en Cephalalgia(31), se demostró en humanos, la implicación de eventos mediados por el GMPc y el óxido nítrico en el desarrollo de cefalea crónica diaria a través del estudio del LCR de estos pacientes. Actualmente, se utilizan antagonistas de NMDA (como memantine, amantadine y ketamina) para tratar dolor en pacientes, que no responden al tratamiento convencional, como los opioides con resultados variables.
El ión metálico Mg2+, que también bloquea al canal NMDA ha sido examinado clínicamente con pobres resultados. Por ejemplo la anestesia suplementada con Mg2+ durante histerectomía abdominal o Mg2+ previo a la cirugía, no tuvo efectos beneficiosos. De hecho, se observó que algunos de los pacientes experimentaron hiperalgesia(29).
Convulsiones y epilepsia
Durante la pasada década, se aprobaron ocho nuevas drogas para el tratamiento de la epilepsia en los Estados Unidos(32), de las cuales dos son antagonistas de receptores glutamatérgicos, ellas son el felbamate y el topimarato. El primero, además de ser un antagonista NMDA, bloquea canales de Na+ y Ca2+. Este ha demostrado tener una eficacia del 30% en disminuir las crisis convulsivas. Posee como efectos adversos comúnmente documentados, trastornos gastrointestinales, anorexia e insomnio, pero lo más grave es el desarrollo de anemia aplásica en 1 de cada 8000 exposiciones(33).
Por otra parte el topimarato, se ha aprobado por la FDA como tratamiento adyuvante en adultos y niños de más de 2 años con convulsiones parciales, primarias generalizadas y convulsiones asociadas con el síndrome de Lennox-Gastaut. Las tasas de respuesta al medicamento varían entre 35 a 48% con dosis diarias entre 300 a 800 mg. Las reacciones adversas más frecuentes incluyen: ataxia, disminución en la concentración, mareos y fatiga más frecuentemente en aquellos pacientes con dosis superiores a 600 mg/día o aquellos que sufrieron una titulación rápida a dosis de mantenimiento en 3 a 4 semanas(32).
Enfermedad de Parkinson
Estudios experimentales con animales han sugerido que la neurotransmisión mediada por los receptores NMDA pueda ofrecer una estrategia alterna para el tratamiento de parkinsonismo(34). Entre ellos se encuentra la budipina, dextrometorfan, memantine y amantadine, que son antagonistas no competitivos de los receptores NMDA y tienen efectos antiparkinsonianos en humanos, en especial cuando se administran con medicación dopaminérgica convencional. El problema principal es la aparición de efectos adversos, siendo la más común ataxia, sedación y limitación cognitiva(34).
Enfermedad de Alzheimer
En un estudio realizado recientemente (2004)(35), con la utilización de memantine 20 mg/día en 404 pacientes con enfermedad de Alzheimer se demostró la mejoría de 55% en la sintomatología de los mismos, siendo esta dosis segura y bien tolerada, con sólo 7,4% de interrupción del tratamiento por efectos adversos. Esta misma dosis ha sido revisada extensamente en otros trabajos(36) y se ha comprobado una mejoría notable en la reducción del deterioro cognitivo a las 28 semanas de tratamiento.
Depresión
Riluzole, afecta el sistema glutamatérgico reduciendo la liberación de glutamato, y ha probado ser de utilidad en el tratamiento de depresión refractaria al tratamiento convencional, con una tasa del 31% de mejoría(37).
Alcoholismo – adicción
Existen mecanismos glutamatérgicos que actúan paralelos a los de la dopamina en lo que significa el desarrollo de adicción, por drogas o alcohol, a través de mecanismos de recompensa(38,39). El acamprosato, un antagonista de los receptores NMDA, puede reducir las tasas de reincidencia en alcohólicos(40).
Accidente cerebro vascular (ACV)
Se ha descrito desde el desarrollo de la tomografía axial computarizada, que en los ACV hemorrágicos se forma un área de hiperperfusión alrededor del hematoma que continua causando muerte celular. Se ha sugerido que la aparición de esta área es debido a la presencia de acidosis metabólica. En un trabajo muy reciente(41) se planteó que este hecho tenía relación directa con el glutamato, puesto que se incrementa debido al daño celular y al no haber recantación por los astrocitos, lo cual podría producir excitotoxicidad.
Conclusión
Existe amplia evidencia que el glutamato tiene un rol más importante aún del que se le implica, con innumerables aplicaciones terapéuticas posibles, en patologías comunes y en otras que son de tratamiento muy complejo. Queda por ver si se podrán desarrollar agentes que no presenten reacciones adversas tan severas o que por lo menos sean tolerables. Aún hay mucho que esperar del glutamato.
Referencias bibliográficas
1. Neher E y Sakmann B. The patch clamp technique. Scientific Am. 1992; 28-35. [ Links ]
2. Meldrum BS. Glutamate as a neurotransmitter in the brain: Review of physiology and pathology. J Nutr. 2000; 130: 1007S-1015S. [ Links ]
3. Francis PT. Glutamatergic systems in Alzheimers disease. Int J Geriatr Psychiatry. 2003; 18: S15-S21. [ Links ]
4. Bleich S, Römer K, Wiltfang J y Kornhuber J. Glutamate and the glutamate receptor system: a target for drug action. Int J Geriatr Psychiatry. 2003; 18: S33-S40. [ Links ]
5. Simeone TA, Sanchez RM y Rho JM. Molecular biology and ontogeny of glutamate receptors in the mammalian central nervous system. J Child Neurol. 2004; 19: 343-360. [ Links ]
6. Nedergaard M, Takano T y Hansen AJ. Beyond the role of glutamate as a neurotransmitter. Nature Rev Neuroscience. 2002; 3: 748-755. [ Links ]
7. Barnes GN y Slevin JT. Ionotropic glutamate receptor biology: Effect on synaptic connectivity and function in neurological disease. Current Medicinal Chemistry. 2003; 10: 2059-2072. [ Links ]
8. Garattini S. Glutamic Acid, Twenty years later. J Nutr. 2000; 130: 901S-909S. [ Links ]
9. Madden DR. The structure and function of glutamate receptor ion channels. Nature Rev Neuroscience. 2002; 3: 91-101. [ Links ]
10. Dingledine R, Borges K, Bowie D y Tarynelis SF. The glutamate receptor ion channels. Pharm Rev. 1999; 51(1): 7-61. [ Links ]
11. López-Corcuera B, Geerlings A y Aragón C. Glycine neurotransmitter transporters: an update. Molecular Membrane Biology. 2001; 18: 13-20. [ Links ]
12. Hediger MA. Glutamate transporters in kidney and brain. Am J Physiol (Renal Physiol). 1999; 277(46): F487-492. [ Links ]
13. Hediger MA y Welbourne TC. Introduction: Glutamate transport, metabolism, and physiological responses. Am J Physiol (Renal Physiol). 1999; 277(46): F477-480. [ Links ]
14. Welbourne TC y Matthews JC. Glutamate transport and renal function. Am J Physiol (Renal Physiol). 1999; 277(46): F501-505. [ Links ]
15. Gill SS y Pulido OM. Glutamate receptors in peripheral tissues: Current knowledge, future research and implications for toxicology. Toxicological Pathology. 2001; 29(2): 208-223. [ Links ]
16. Gill SS, Pulido OM, Mueller RW y McGuire PF. Immunological characterization of the metabotrophic glutamate receptors in the rat heart. Brain Res Bull. 1999; 48: 143-146. [ Links ]
17. Gill SS, Pulido OM, Mueller RW y McGuire PF. Molecular and immunological characterization of the ionotropic glutamate receptors in the rat heart. Brain Res Bull. 1998; 46: 429-435. [ Links ]
18. Contreras F, Fouillioux C, Bolivar A, Simonovis N, Hernández-Hernández R, Armas-Hernandez MJ y Velasco M. Dopamine, hypertension and obesity. Journal of Human Hypertension. 2002; 16(S1): S13–S17. [ Links ]
19. Langenberg CJ, Pietersen HG, Geskes G, Wagenmakers AJ, De Lange S y col. The effect of glutamate infusion on cardiac performance is independent of changes in metabolism in patients undergoing routine coronary artery bypass surgery. Clinical Science. 2001; 101: 537-580. [ Links ]
20. Liu PH, Tay SSW, Leong SK. Localization of glutamate receptors subunits of the α-amino-3-hydroxy-5-methyl-4-isoxazolepropionate (AMPA) type in the pancreas of newborn guinea pig. Pancreas. 1997; 14: 360–368. [ Links ]
21. Dingledine R y Conn JP. Peripheral glutamate receptors: Molecular biology and role in taste sensation. J Nutr. 2000; 130: 1039S-1042S. [ Links ]
22. Chenu C, Serre CM, Raynal C, Burt-Pichat y Delmas PD. Glutamate receptors are expressed by bone cells and are involved in bone resorption. Bone. 1998; 22: 295–299. [ Links ]
23. Lucas DR, Newhouse JP. The toxic effect of sodium L-glutamate on the inner layers of the retina. AMA Arch. Ophthalmol. 1957; 58: 193. [ Links ]
24. Ohguro H, Katsushima H, Maruyama I y col. A high dietary intake of sodium glutamate as flavoring (ajinomoto) causes gross changes in retinal morphology and function. Experimental Eye Research. 2002; 75: 307-315. [ Links ]
25. McKevith B. Glutamate – giving us the evil eye? British Nutrition Foundation- Nutrition Bulletin. 2003; 28: 7-9. [ Links ]
26. Kemp JA y McKernan RM. NMDA receptor pathways as drug targets. Nature Neuroscience. 2002; 5: 1039-1042. [ Links ]
27. Matthews CC, Zielke HR, Wollack JB y Fishman PS. Enzymatic degradation protects neurons from glutamate excitotoxicity. J Neurochemistry. 2000; 75: 1045-1052. [ Links ]
28. Doherty J y Dingledine R. The roles of metabotropic glutamate receptors in seizures and epilepsy. Current Drug Targets-CNS & Neurological Disorders. 2002; 1: 251-260. [ Links ]
29. Fundytus ME. Glutamate receptors and nociception. CNS Drugs. 2001; 15(1): 29-58. [ Links ]
30. Petrenko AB y Shimoji K. A possible role for glutamate receptor-mediated excitotoxicity in chronic pain. J Anesth. 2001; 15: 39-48. [ Links ]
31. Gallai V, Alberti A, Gallai B, Coppola F, Floridi A y Sarchielli P. Glutamate and nitric oxide pathway in chronic daily headache: evidence from cerebrospinal fluid. Cephalalgia. 2003; 23: 166-174. [ Links ]
32. LaRoche SM y Helmers SL. The new antiepileptic drugs: Scientific review. JAMA. 2004; 291(5): 605-614. [ Links ]
33. Pellock JM y Brodie MJ. Felbamate: 1997 update. Epilepsia. 1997; 38: 1261-1264. [ Links ]
34. Cooper AJ, Carroll CB y Mitchell IJ. Glutamate antagonists for Parkinsons disease. CNS Drugs. 1998; 6: 421-429. [ Links ]
35. Tariot PN, Farlow MR, Grossberg GT, Graham SM, McDonald S y Gergel I. Memantine treatment in patients with moderate to severe Alzheimer Disease already receiving Donepezil. JAMA. 2004; 291(3): 317-324. [ Links ]
36. Sastre A, McShane R y Sherriff F. Memantine for dementia (Cochrane Review). En: The Cochrane Library, John Wiley & Sons. 2004; 4. [ Links ]
37. Zarate CA Jr, Payne JL, Quiroz J y col. And open-label trial of Riluzole in patients with treatment-resistant major depression. Am J Psychiatry. 2004; 161(1): 171-174. [ Links ]
38. Tzschentke TM y Schmidt WJ. Glutamatergic mechanisms in addiction. Molecular Psychiatry. 2003; 8: 373-382. [ Links ]
39. Lovinger DM. NMDA receptors lose their inhibitions. Nature Neuroscience. 2002; 5(7): 614-616. [ Links ]
40. Littleton J y Zieglgänsberger W. Pharmacological mechanisms of Naltrexone and Acamprosate in the prevention of relapse in alcohol dependence. Am J Addictions. 2003; 12: S3-S11. [ Links ]
41. Ardizzone TD, Lu A, Wagner KR, Tang Y, Ran R y Sharp FR. Glutamate receptor blockade attenuates glucose hypermetabolism in perihematomal brain after experimental intracerebral hemorrhage in rat. Stroke. 2004; 35: 2587-2591. [ Links ]















