Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT v.26 n.2 Caracas 2007
Ácidos grasos trans y riesgos cardiovascular
▪Almarza J ▪Souki A, ▪Cano C, ♦Fuenmayor E, ▪Albornoz A, ▪Aguirre M. ▪Reyna N.
▪ Centro de Investigaciones Endocrino – Metabólicas "Dr. Félix Gómez". Facultad de Medicina. Universidad del Zulia (LUZ). Maracaibo, Venezuela.
♦ Hospital Universitario de Maracaibo, Venezuela.
Recibido: 28/06/2007 Aceptado: 04/08/2007
Resumen
Ácidos grasos Trans y Riesgo Cardiovascular
Los ácidos grasos trans (TUFAS) son una variante isomérica producida durante los procesos industriales de hidrogenación y calentamiento de aceites vegetales ricos en ácidos grasos poliinsaturados cis (PUFAS). Se ha demostrado epidemiológicamente la relación de su consumo con el desarrollo de cardiopatía isquémica, sin embargo los mecanismos fisiopatológicos implicados no han sido establecidos por completo. Los TUFAS participan en el desarrollo de un perfil lipídico aterogénico, expresado por elevación de las lipoproteínas de baja densidad, y disminución de las lipoproteínas de alta densidad e hiperlipoproteinemia (a), aumentando la probabilidad de desarrollo de procesos aterogénicos y en consecuencia el infarto del miocardio. Adicionalmente los TUFAS antagonizan el metabolismo de los eicosanoides contribuyendo a un estado protrombótico. En virtud de lo anteriormente expuesto, esta revisión pretende describir los mecanismos moleculares implicados en el desarrollo de un estado aterogénico como la consecuencia de la ingesta de ácidos grasos trans.
Palabras claves: Lipoproteínas, ácidos grasos trans, ateroesclerosis.
Abstract
Trans Fatty acids and cardiovascular risk
Trans fatty acids are an isomeric variant produced during hydrogenation and heating of non saturated fats industrial processes. It has been established an epidemiological relationship between Trans fatty acids and the development of isquemic cardiac atack, but the underlying mechanisms have not been clarified completely. The atherogenic effects of trans fatty acids are related to a lipid profile expressed by high levels of Low Density Lipoproteins (LDL), low levels of High Density Lipoproteins (HDL) and hyperlipoproteinemia (a), increasing the risk for the development of atherogenic processes and miocardial infarction. They also interfere in metabolism of eicosanoids contributing to a prothrombotic state. This review pretends to illustrate molecular mechanisms related to the paper of trans fatty acids on elevation of cardiovascular diseases risk.
Key words: Lipoproteins, Trans fatty acids, atheroesclerosis.
Introducción
Los procesos industriales de hidrogenación de los ácidos grasos poliinsaturados (PUFA), presentes en los aceites vegetales, se utilizan para la obtención de ácidos grasos parcialmente hidrogenados o grasas semisólidas como la margarina y mantecas vegetales, modificándose algunas de sus características fisicoquímicas (aumenta el punto de fusión y disminuye el enranciamiento), lo que permite su utilización como sustitutos de la grasa animal en el área de la repostería, en la elaboración de preparaciones alimenticias, principalmente en restaurantes de comida rápidas y en la manufactura de alimentos a nivel industrial, con ahorro de materia prima y aumento sustancial de las ganancias. Como resultado del mismo procedimiento químico, ocurren cambios en la conformación geométrica de los dobles enlaces presentes en los PUFAS, transformándose los isomeros "cis" naturales a sus isomeros "trans".
La producción de grasas parcialmente hidrogenadas viene desde principios del siglo 20, pero su utilización no se incrementa hasta los años sesenta, donde la grasa vegetal hidrogenada desplaza a la grasa animal en la dieta en los países industrializados. La motivación principal para la fabricación de estas grasas fue el bajo costo, sin considerar los efectos en la salud del hombre. El consumo promedio de ácidos grasos hidrogenados en los Estados Unidos es de 2 a 3% de la ingesta calórica y su uso principal es en la elaboración de comidas rápidas (1-3).
Mensink R y col a principios de los años noventa publicaron un estudio epidemiológico donde se muestra una correlación significativa entre el consumo de ácidos grasos insaturados trans (TUFAS) y el desarrollo de un perfil lipídico aterogénico en humanos, lo que a su vez estaría asociado a un aumento del riesgo para el desarrollo de enfermedades cardiovasculares. Más adelante se realizaron otros estudios con resultados similares (5-7). En virtud de lo anterior, actualmente las recomendaciones dietéticas de la American Heart Association declaran los efectos nocivos de la ingestión de TUFAS y mantienen una posición negativa respecto a su consumo (4-11). En este mismo orden de ideas el comité "Dietary Guidelines Advisory" estableció en las guías de alimentación para los Estados Unidos, que el consumo de TUFAS debe mantenerse por debajo del 1% del total de la energía consumida(12).
Hasta los momentos, los efectos bioquímicos de los TUFAS solo se han demostrado epidemiológicamente y muy poco se ha descrito sobre su efecto metabólico y los mecanismos fisiopatológicos implicados en el desarrollo de un perfil lipídico aterogénico. En virtud de la importancia que tiene el conocimiento y manejo de estos aspectos moleculares para un buen desempeño en la práctica clínica, el objetivo de esta revisión es describir el papel de los TUFAS en las alteraciones del metabolismo de las lipoproteínas, en el desarrollo de un estado protrombótico y en la contribución de ambos factores en el progreso de las enfermedades cardiovasculares.
Factores de riesgo cardiovascular
Relación de los TUFA con un perfil lipídico aterogénico
Diversos estudios metabólicos demuestran que los TUFAS tienen un efecto similar a las grasas saturadas en la elevación de los niveles de colesterol en especial, en el aumento del colesterol-LDL (LDL-c), sin embargo un efecto extra que podemos encontrar con el consumo de los TUFAS es la disminución de los niveles de colesterol-HDL (HDL-c) lo que estaría contribuyendo al desarrollo del proceso aterogénico y la probabilidad del desarrollo de una cardiopatía isquémica. En este sentido Ascherio y colaboradores observaron que el reemplazo de ácido oleico por ácidos grasos trans aumento la LDL-c unos 14 mg/dl y disminuyo la HDL-c unos 7 mg/dl, y por lo tanto se produjo un incremento del índice LDL-c/HDL-c, el cual fue significativo en comparación al consumo de grasas saturadas. Esto evidencia que la ingesta de TUFAS contribuye al desarrollo de un perfil lipídico aterogénico. Así mismo, este estudio mostró que un aumento del 2% en la ingesta de ácidos grasos trans en la dieta provoca el incremento de 0.1 unidad en el índice LDL-c/HDL-c. Esto se relaciona directamente con los reportes que señalan que el aumento de 1 unidad incrementa 53% el riesgo de desarrollar una enfermedad cardiovascular. Estos serian los primeros hallazgos que expresan cuantitativamente el efecto de los TUFAS en el perfil lipídico en humanos. Por otra parte, otros estudios demuestran de manera epidemiológica el efecto de los ácidos grasos trans en los niveles de Lipoproteína (a), otro factor que estaría favoreciendo el riesgo cardiovascular (1,13-22).
1. Aumento de las LDL
Diversos hallazgos explican el papel de la ingesta de TUFAS en la alteración de los niveles de LDL-c. Uno de ellos es la regulación en baja de los receptores hepáticos para LDL (21) lo que provocaría aumento sustancial de estas lipoproteínas en el plasma. Este efecto es estimulado por una acción inhibitoria de la enzima acil - CoA: colesterol acil transferasa (enzima encargada de la esterificación del colesterol en el hepatocito) lo cual estaría contribuyendo a la acumulación intracelular de colesterol libre y así vía receptores nucleares ocurre una regulación en baja de los receptores de LDL (21). Por otro lado, el enriquecimiento de los fosfolípidos de la membrana del hepatocito con TUFAS altera la funcionalidad del receptor lo que también provoca una baja depuración plasmática de las LDL (23-25).
Por otra parte Nassrin Dashti y colaboradores (26), indican que el aumento de LDL se debe a que los TUFAS aumentan la secreción de las lipoproteínas ricas en ApoB-100 lo que contribuye a la producción de LDL. Sin embargo, también reportan que existe un aumento en la actividad del receptor de LDL pero este aumento de la actividad no compensa el incremento de la síntesis de esta lipoproteína.
2. Disminución de HDL
Numerosos estudios y metanálisis (1-2, 4-11) realizados tanto en animales como en humanos, demuestran una disminución sustancial de la HDL-c con la ingesta de TUFAS. Esta lipoproteína cumple funciones vitales en el organismo entre las cuales se destacan, el transporte en reverso del colesterol (27-31), la prevención de la oxidación de la LDL (32) y su efecto antiinflamatorio (33) lo que indica que su disminución (por debajo de los 35 mg/dl) estaría relacionada con el aumento del riesgo de cardiopatía isquémica.
Se han descritos dos mecanismos bioquímicos que explican la razón de la disminución de las HDL, la primera es la de la inhibición competitiva de la enzima lecitin: colestesterol acil transferasa (LCAT) (20). En condiciones fisiológicas dicha enzima utiliza el acido graso insaturado de la posición sn-2 de la fosfatidilcolina para la esterificación del colesterol libre que se encuentra en la superficie celular. Se ha demostrado in vitro que los TUFAS ocupan el lugar sn-2 de la fosfatidilcolina lo cual contribuye a:
1. La acumulación celular de colesterol en especial en la membrana plasmática
2. Cambios en la depuración plasmática de las HDL. En general se nota una disminución de las HDL2 que son producidas por la acumulación de colesterol esterificado (producto de la reacción de la LCAT) en el núcleo de las HDL3 , pero como veremos más adelante, las HDL3 son también depurables por otra vía.
3. Cuando hay inhibición de su actividad, la LCAT accede a la utilización del acil sn-1 del fosfolípido el cual esta ocupado por un ácido graso saturado, conllevando a la formación de colesterol esterificado con ácido graso saturado (CE-sat) (Figura 1), el cual ha demostrado ser más aterogénico (34-35) provocando el desarrollo del proceso de ateroesclerosis en los sitios de prelesión arterial. A su vez este tipo de colesterol esterificado es mejor sustrato para la proteína transportadora de colesterol esterificado (CETP) (26) contribuyendo a la depuración plasmática de las HDL3.
Figura 1. Inhibición de la actividad de la LCAT por TUFAS
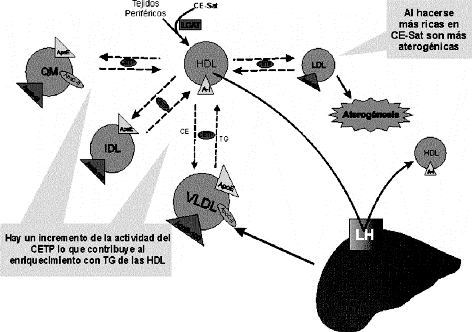
El segundo mecanismo implica el aumento de la actividad enzimática de la CETP (15-18, 20,22) debido a la presencia de CE-Sat el cual se ha demostrado ser un mejor sustrato para esta enzima (35-36), lo que explica los hallazgos que demuestran una correlación significativa entre la ingesta de ácidos grasos saturados y un aumento de la actividad del CETP en primates (37). Este aumento de la actividad enzimática provoca un incremento en el intercambio de Colesterol esterificado (CE) de las HDL3 con las lipoproteínas de muy baja densidad (VLDL), Quilomicrones (QM) y LDL y transferencia de Triacilglicéridos (TG) en dirección opuesta. Este fenómeno tendría los siguientes efectos.
1. Enriquecimiento de las HDL3 en TG lo que la convierte en buen sustrato para la lipasa hepática (38) y la hace menos afín por su receptor escavenger B-1 a nivel hepático, ya que carece de su núcleo de colesterol que la hace reconocible por este receptor
2. Enriquecimiento de CE-Sat de las LDL potenciando su poder aterogénico (figura 2).
Figura 2. Aumento de la actividad de la CETP
3. Hiperlipoproteinemia (a)
Los trabajos de varios investigadores14,16 demuestran una correlación entre el aumento de las concentraciones de Lp(a) plasmática y el aumento de la ingesta de TUFAS contribuyendo de esta manera al aumento de la probabilidad de accidentes vasculares.
La Lp(a) está formada por una lipoproteína de baja densidad o LDL que contiene un núcleo de colesterol, triacilglicéridos y fosfolípidos rodeado de una proteína apoB-100 a la cual se une la glicoproteína apo(a). La apo(a) y el plasminógeno, el precursor de la plasmina tienen una estructura análoga. Dicha similitud molecular es responsable de una inhibición competitiva de la activación del plasminógeno a plasmina por la uroquinasa o el factor tisular activador del plasminógeno (liberados en procesos de lisis tisular). De esta manera en un estado trombótico donde se requiera la reperfusión sanguínea, esta inhibición competitiva provocaría la permanencia del trombo, exacerbando los daños producidos por las complicaciones de la placa ateroesclerótica (40).
TUFAS. y su papel en la estructura y función de la célula endotelial. efecto protrombótico.
Las células endoteliales tiene la función principal de mantener la estructura de la pared vascular y de conservar el equilibrio entre los factores que favorecen e impiden el proceso de trombogénesis e inflamación. Diversos estudios relacionan la ingesta de TUFAS con la endotelitis. Esto es expresado por el aumento de marcadores de disfunción endotelial incluyendo moléculas de adhesión solubles intercelular, moléculas de adhesión y E-selectina (41).
Ha sido reportado que altas concentraciones en el medio de TUFAS sumado a un estado de deficiencia de magnesio (42-43), produce inhibición de la actividad de la delta 5 y delta 6 desaturasa, las cuales son enzimas claves en el proceso de elongación y desaturación de ácidos grasos, lo que produciría alteraciones en la membrana plasmática (44), interfiriendo con el metabolismo de los ácidos grasos y con el balance de las prostaglandinas favoreciendo un estado protrombótico y un aceleramiento de la disfunción endotelial (41,43-46).
Conclusiones
En síntesis, los TUFAS aumentan el riesgo de enfermedad cardiovascular a través de los siguientes mecanismos:
1. Alteración en el metabolismo de las lipoproteínas expresado por un perfil lipídico caracterizado por tener HDL-c bajas: por un aumento de la actividad del CETP e inhibición de la LCAT; LDL-c altas por regulación en baja de receptores hepáticos y un aumento de la síntesis de lipoproteínas de Apo B-100 y aumento de los niveles de lipoproteína (a) lo que contribuye a un estado protrombótico y proaterogénico.
2. Modificación en la estructura física de la membrana de las células endoteliales lo cual altera la fisiología vascular.
En la practica clínica es importante restringir el consumo de margarinas sólidas o mantecas vegetales o de productos alimenticios en cuyo proceso de elaboración estuvo incluido el uso de aceites hidrogenados (el consumo no debe sobrepasar del 2-3% de los requerimientos) en especial en aquellos pacientes con elevado riesgo de enfermedades cardiovasculares o tendencia a presentar estados de dislipidemia cuya prescripción dietética tiene que ser hipocalórica y en especial baja en grasas. Por otra parte es necesario prescribir el consumo de aceites vegetales ricos en ácidos grasos monoinsaturados los cuales deben representar como mínimo 10% de los requerimientos calóricos diarios de cada individuo.
Referencias
1. Ascherio A, Katan M. Trans Fatty Acids and Coronary Heart Disease, N Engl J of Med 1999; 340:1994-1998. [ Links ]
2. Innis S, Green T, Halsey Thomas K. Variability in the Trans Fatty Acid Content of Foods within a Food Category: Implications for Estimation of Dietary Trans Fatty Acid Intakes. J. Am. Coll. Nutr 1999; 18: 255–260. [ Links ]
3. Cordain L, Eaton B, Sebastian A, Man N, Lindberg S, Watkins B, OKeefe J, Brand-Miller J. Origins and evolution of the western diet: health implications for the 21st century. Am Clin Nutr 2005;81:341-54 [ Links ]
4. Mensink R, Katan M. Effect of dietary trans fatty acids on high-density and low-density lipoprotein cholesterol levels in healthy subjects. N Engl J of Med 1990; 323:439-445. [ Links ]
5. Baylin A, Kabagambe E, Ascherio A, Spiegelman D, Campos H. High 18:2 Trans-Fatty Acids in Adipose Tissue Are Associated with Increased Risk of Nonfatal Acute Myocardial Infarction in Costa Rican Adults. Am J of Clin Nutr 2003; 133:1186-1191. [ Links ]
6. Krauss R, Eckel R, Howard B, Appel L, Daniels S, Deckelbaum R., Erdman J, Kris P, et al. Goldberg I, Kotchen T, Lichtenstein A, Mitch W Mullis, Robinson K, Rosett,J, Jeor S, Suttie J, Tribble D, Bazzarre T. A Statement for Healthcare Professionals From the Nutrition Committee of the American Heart Association. J Nutr 2001; 131: 132–146. [ Links ]
7. Judd J, Clevidence B, Muesing R, Wittes J, Sunkin M, Podczasy J. Dietary trans fatty acids: effects on plasma lipids and lipoproteins of healthy men and women. Am J of Clin Nutrition1994; 59:861-868. [ Links ]
8. Sundram K, Ismail A, Hayes K, Jeyamalar R, Pathmanathan R. Trans (Elaidic) Fatty Acids Adversely Affect the Lipoprotein Profile Relative to Specific Saturated Fatty Acids in Humans. J Nutr 1997; 127: 514 – 514 [ Links ]
9. Khosla P., Hayes K. Dietary trans-monounsaturated fatty acids negatively impact plasma lipids in humans: critical review the evidence. J. Am. Coll. Nutr 1996; 15: 325–339. [ Links ]
10. Etherton K. Trans fatty acids and coronary heart disease risk, Am. J. Clin Nutr 1995; 62: S651–S708. [ Links ]
11. Lichtenstein A. Trans Fatty Acids, Plasma Lipid Levels, and Risk of Developing Cardiovascular Disease. Circulation 1997; 95:2588. [ Links ]
12. 2005 Dietary Guidelines Advisory Committee Report. Link de internet: http://www.health.gov/dietaryguidelines/dga2005/report/ [ Links ]
13. Jackson R, Morrisett J, Pownall H, Gatto, Kamio A, Imai H; Tracy R, Kummerow F. Influence of dietary trans-fatty acids on swine Lipoprotein composition and structure. J of lip res 1977; 18:182-190. [ Links ]
14. Gatto L, Sullivan D, Samman S. Postprandial effects of dietary trans fatty acids on apolipoprotein(a) and cholesteryl ester transfer. Am J of Clin Nutr 2003; 77: 1119-1124. [ Links ]
15. Abbey M., Nestel P. Plasma cholesteryl ester transferprotein activity is increased when trans-elaidic acid is substitutedfor cis-oleic acid in the diet. Atherosclerosis 1994; 106: 99–107. [ Links ]
16. Van Tol A, Zock P, Van Gent T, Scheek M, Katan. Dietary trans fatty acids increase cholesteryl ester transfer protein activity in man. Atherosclerosis1995; 115: 129–134. [ Links ]
17. Pramod K, Tahar H, Andrzej P, Hayes K Replacing. Dietary Palmitic Acid with Elaidic Acid (t-C18:1D9) Depresses HDL and Increases CETP Activity in Cebus Monkeys J. Nutr 1997;127: 531S–536S. [ Links ]
18. Matthan N, Ausman L, Lichtenstein A, Jones P. Hydrogenated fat consumption affects cholesterol synthesis in moderately hypercholesterolemic women. J of lipid res 2000; 41: 834–839. [ Links ]
19. Gatto L, Lyons M, Brown A, Samman S. Trans Fatty Acids Affect Lipoprotein Metabolism in Rats. J. Nutr 2002; 132: 1242–1248. [ Links ]
20. Subbaiah P, Subramanian V, Liu Ming. Trans unsaturated fatty acids inhibit lecithin: cholesterol acyltransferase and alter its positional specificity. J. Lipid res 1998; 39: 1438–1447. [ Links ]
21. Fusegawa Yuichi, Kelley K, Sawyer J, Shah R, Rudel L. Influence of dietary fatty acid composition on the relationship between CETP activity and plasma lipoproteins in monkeys. J. Lipid Res 2001. 42: 1849–1857. [ Links ]
22. Woollett L, Daumerie C, Dietschy. Trans-9-octadecenoic acid is biologically neutral and does not regulate the low density lipoprotein receptor as the cis isomer does in the hamster. J. Lipid Res1994; 35: 1661–1673. [ Links ]
23. Kuo, P, Weinfeld M, Loscalzo J. Effect of membrane fatty acyl composition on LDL metabolism in Hep G2 hepatocytes. Biochemistry 1990; 29: 6626–6632. [ Links ]
24. Fernández Maria Luz. Mechanism by which dietary fatty acids modulate plasma lipids. Journal of Nut 2005; 135: 2075–2078. [ Links ]
25. Woldseth B, Retterstll, Christophersen B. Monounsaturatedtrans fatty acids, elaidic acid and trans-vaccenicacid, metabolism and incorporation in phospholipid molecularspecies in hepatocytes. Scand. J. Clin. Lab. Invest 1998; 58: 635–645. [ Links ]
26. Nassrin Dashti, Feng Qing, Franklin Frank. Long-term effects of cis and trans monounsaturated (18:1) and saturated (16:0) fatty acids on the synthesis and secretion of apolipoprotein A-I- and apolipoprotein B-containing lipoproteins in HepG2 cells. J of Lipid res 2000; 41: 1980–1990. [ Links ]
27. Duriez P, J.C. Fruchart. The High-density lipoprotein subclasses and apolipoprotein A-I. Clinica Chimica Acta 1999 286 97–114 [ Links ]
28. Ginsberg H. Lipoprotein Phisiology. Endocrinology and Metabolism Clinics 1998; 27:503-519. [ Links ]
29. Tulenko T. Sumner. The physiology of lipoproteins. J Nucl Cardiol 2002;9:638-49 [ Links ]
30. Fidge N, High density lipoprotein receptors, binding proteins, and ligands. J of lipid res 1999; 40: 187-201. [ Links ]
31. Santamarina-Fojo S, Lambert G, Hoeg J, and H. Brewer B. Lecithin-cholesterol acyltransferase: role in lipoprotein metabolism, reverse cholesterol transport and atherosclerosis. Current Opinion in Lipidology 2000; 11:267-275. [ Links ]
32. Watson A, Berliner J, Hama S, La Du B, Faull K, Fogelman A. Protective effect of high density lipoprotein associated paraoxonase. J Clin Invest 1995; 96: 2882-2891. [ Links ]
33. Alain Tedgui, Ziad Mallat, Anti-Inflammatory Mechanisms in the Vascular Wall. Circ Res 2001; 88:877-887. [ Links ]
34.Swell, L., Field H, Treadwel. Correlation of arachidonic acid of serum cholesterol esters in different species with susceptibility to atherosclerosis. Proc. Soc. Exp. Biol Med 1960; 104:225-228. [ Links ]
35.Liu M Subbaiah, Bagdade I. Specificity of lecithin cholesterol acyltransferase and atherogenic risk 1. Comparative studies on the plasma composition and in vitro synthesis of cholesteryl esters in 14 vertebrate species J. Lipid Res 1995; 36: 1813– 1824. [ Links ]
36. Glick J, Adelman S, Phillips M, Rothblat G. Cellular cholesteryl ester clearance. Relationship to the physical state of cholesteryl ester inclusions. J. Biol. Chem 1983; 258:13425–13430. [ Links ]
37. Green S, Pittman R. Comparative acyl specifici-tiesfor transfer and selective uptake of high density lipoprotein cholesteryl esters. J. Lipid Res 1991; 32: 457–467. [ Links ]
38. Ginsberg H, Insulin resistance and cardiovascular disease. J of Clin Invest 2000; 106: 453-458. [ Links ]
39. Quinet, Tall E, Ramakrishnan R, Rudel L. Plasma lipid transfer protein as a determinant of the atherogenicity of monkey plasma lipoproteins. J Clin Invest 1999; 87: 1559–1566. [ Links ]
40. Peña A, Izaguirre R, Anglés-Cano E. Lipoproteína (a), ¿es un factor de riesgo en la enfermedad aterotrombótica coronaria? Arch Cardiol Mex 2001; 71:188-192. [ Links ]
41. Dariush Mozaffarian. Trans Fatty Acids and Cardiovascular Disease. N Engl J Med 2006;354:1601-13. [ Links ]
42. Brenner R. The oxidative metabolism of unsaturated fatty acids. Treatment Mol Cell Biochem 1974; 3:41–52. [ Links ]
43. Mahfouz M, Kummerow F. Effect of magnesium deficiency on D 6 desaturase activity and fatty acid composition of rat liver microsomes. Lipids 1989; 24:727–32. [ Links ]
44. Kummerow F, Zhou Q, Mahfouz M. Effect of trans fatty acids on calcium influx into human arterial endothelial cells. Am J Clin Nutr 1999; 70:832–8. [ Links ]
45. Hill E, Johnson S, Lawson L, Mahfouz M, Holman R. Perturbation of the metabolism of essential fatty acids by dietary partially hydrogenated vegetable oil. Proc Natl Acad Sci 1982; 79:953–957. [ Links ]
46. Kinsella J, Bruckner G, Mai J, Shimp J. Metabolism of trans fatty acids with emphasis on the effects of trans, trans-octadecadienoate on lipid composition, essential fatty acid, and prostaglandins: an overview. Am J Clin Nutr 1981; 34:2307–2318. [ Links ]