Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT vol.33 no.2 Caracas jun. 2014
Acné conglobata: A propósito de un caso
Acne conglobata: a case report
Cecilia Gutiérrez, MD1,2*, Raquel Ávila, MD, MSc3, Milagros Rojas, BSc4, Luis Carlos Olivar, BSc4, José Carlos Mejías, BSc4, Mervin Chávez-Castillo, Bsc4, Basilio Bucete, MD5, Ismael Contreras, MD6, Valmore Bermúdez, MD, MSc, MPH, PHD4, Joselyn Rojas, MD, MSc4
1 Cursante Máster en Dermatología, Universidad Alcalá de Henares, Madrid – España. Director: Dr. Melchor Álvarez de Món Soto, MD, PHD.
2 Secretaría de Salud del Estado Zulia, Hospital I San José de Perijá, Servicio de Dermatología Machiques de Perijá, Estado Zulia.
3 Departamento de farmacología. Facultad de Medicina. Universidad del Zulia. Venezuela
4 Centro de Investigaciones Endocrino-Metabólicas Dr. Félix Gómez Facultad de Medicina, Universidad del Zulia, Venezuela
5 Hospital de Especialidades Pediátricas. Servicio de Dermatología Pediátrica. Maracaibo, Venezuela.
6 Hospital Militar de Maracaibo. Servicio de Dermatología. Maracaibo, Venezuela.
Resumen
Introducción: El acné conglobata (AC) es una forma infrecuente de acné, caracterizada por desarrollo de un foco infeccioso crónico, con manifestaciones inflamatorias locales severas, y pérdida de la estructura funcional de la piel, con abscesos confluentes y tejido cicatricial extenso.
Descripción del Caso: Paciente masculino de 18 años de edad quien consulta por presentar lesiones cutáneas en cara y tórax de 6 meses de evolución, de carácter nodular, con signos de flogosis y fistulizadas con secreción purulenta fétida, que dejan cicatriz. Previo a la consulta, las lesiones fueron tratadas con trimetropim/sulfametoxazol e ibuprofeno vía oral, y amikacina tópica, sin resultados satisfactorios. El cultivo bacteriológico de la secreción resultó positivo para Staphylococcus epidermidis y Streptococcus pyogenes; mientras que el estudio histopatológico confirmó el diagnóstico de AC con hallazgos de infiltrado inflamatorio crónico de la pared folicular, y neutrófilos perifoliculares, en dermis superficial y profunda. Se inició el tratamiento con administración sistémica de moxifloxacina durante 2 semanas; y posteriormente se inicia uso tópico de eritromicina, clindamicina, y ácido azelaico, acompañados de isotretinoína vía oral. De manera paralela, se inicia manejo nutricional y psicológico de apoyo. Tras 2 meses de tratamiento se observa mejoría significativa de las lesiones, que se resuelven en su totalidad tras 6 meses.
Discusión: El AC es una enfermedad que acarrea consecuencias física y psicosociales para el individuo que la padece, especialmente en casos refractarios al tratamiento, el manejo apropiado de esta condición, incluye el correcto diagnóstico, y posteriormente el uso de antibioticoterapia y retinoides, así como terapia psicosocial.
Palabras clave: acné conglobata, Staphilococcus ssp, isotretinoína, macrólidos, psicoterapia.
Abstract
Introduction: Acne conglobata (AC) is a rare form of acne and it is characterized by the development of a chronic infectious focus with severe local signs and the loss of the functional structure of the skin with confluent abscess and extensive scar tissue.
Case description: A 18 year old male patient attended a medical consult due to skin lesions in face and thorax of 6 months of evolution, which were nodular with signs of inflammation and fistula accompanied by a purulent and fetid secretion, with important scaring tissue once resolved. Previously, the lesions were treated with thrimetropim/sulfametoxazol, ibuprofen and topic amikacin without satisfactory results. Bacteria cultures of the secretions were positive for Staphylococcus epidermidis and Streptococcus pyogenes. Meanwhile, hystopathologic studies confirmed the diagnosis of AC with findings corresponding with chronic inflammatory infiltration in the follicular wall in deep and superficial dermis. Treatment began with administration of systemic moxifloxacine for 2 weeks, and afterwards, topic erythromycin, clindamycin and azelaic acid, accompanied by orally administrated isotetrinoin. Nutritional and psychological support was also provided. After 2 months of treatment, significant improvement of the lesions could be seen and after 6 months they were completely resolved.
Discussion: AC is a disease that has got physical and psychological consequences for the patient, especially in cases that show resistance to treatment. Proper care of this condition includes correct diagnosis and the use of antibiotics and retinoids as well as psychosocial therapy.
Key words: Acne conglobata, Staphilococcus ssp, isotretinoin, macrolides, psychotherapy.
Recibido: 20/10/2013 Aceptado: 21/11/2013
Introducción
El acné conglobata (AC) es una forma de acné severa e inusual caracterizada por abscesos interconectados y cicatrices irregulares con un foco inflamatorio crónico severo acompañado de un componente infeccioso en las regiones foliculares y perifoliculares del cuerpo1. En conjunto con la hidradenitis supurativa (HS), la celulitis disecante del cuero cabelludo (o perifolicullitis capitis abscedens et suffodiens) y el quiste pilonidal forman la tétrada de oclusión folicular2, síndrome que agrupa estas afecciones a través de rasgos clínicos comunes y procesos patogénicos que se desempeñan en la unidad pilosebácea, principalmente los folículos terminales3. Desde el punto de vista epidemiológico, el acné severo afecta principalmente a la población comprendida en edades de 15-44 años4, afectando a ambos sexos si bien con cierta predilección por los hombres, en una relación 1,6:1 5. Aunque la epidemiología del AC per se es poco conocida, se estima una prevalencia <1% a nivel mundial, y tan baja como 0,3% en regiones industrializadas, usualmente asociada a HS6.
El desarrollo de AC se considera multifactorial, con participación de componentes ambientales, hormonales, nutricionales, inmunológicos, infecciosos y genéticos7. Este último parece ser especialmente importante, y está presente tanto en los casos esporádicos como en patrones familiares3,8. En este sentido, los reportes de familias con generaciones consecutivas con individuos que desarrollan AC asociada a HS sugiere la presencia de un posible patrón de herencia mendeliano autosómico dominante9. De manera paralela, la proliferación de bacterias como Staphylococcus, Pseudomonas y Proteus es fundamental en la etiología del AC, a menudo exhibiendo grados preocupantes de multirresistencia antimicrobiana10. Por último, otros factores ambientales –particularmente, la presencia de estresores psicosociales– suele actuar como detonantes del AC, subrayando un papel clave para la esfera psiconeuroinmunoendocrinológica11.
En esta enfermedad, el folículo piloso terminal es la principal estructura afectada12. A diferencia del acné vulgar, el AC no se limita a las áreas ricas en glándulas sebáceas –cara, cuello, pecho y espalda–, sino que puede extenderse a otras regiones, incluyendo miembros superiores, axilas, abdomen, glúteos, ingle y periné13. Clínicamente, se caracteriza por múltiples pústulas y comedones, pápulas, nódulos y quistes muy dolorosos, con secreción sebopurulenta maloliente. La confluencia de esta constelación de lesiones conlleva a la formación de abscesos de contenido purulento y serohemático, que finalmente se fistulizan para formar sinus drenantes13. Las lesiones tienden a cicatrizar pobremente, favoreciendo la perpetuación del cuadro clínico14.
El AC es una entidad que afecta la salud global del paciente, acarreando consecuencias psicosociales severas en virtud de la carga económica que representan los gastos de su manejo, y los efectos severos que determina sobre la imagen corporal y autoestima de los pacientes, por lo cual amerita intervención terapéutica precoz15. Este reporte concierne la descripción de un caso de AC en un paciente que mostró resistencia a diversos tratamientos y su evolución a lo largo del mismo.
PRESENTACIÓN DEL CASO
Se trata de paciente masculino de 18 años de edad, quien consulta por presentar lesiones cutáneas en cara, tórax y espalda de 6 meses de evolución. Como antecedentes pertinentes, el paciente refiere que ambos padres tuvieron de acné. El padre padeció acné pápulo pustuloso leve a los 16 años para el cual le fue indicada tetraciclina de 500mg vía oral, una dosis diaria por 1 mes y clindamicina en gel tópico todas las noches por 1 mes en el área afectada. La madre sufrió acné comedogénico a los 13 años y recuerda haber utilizado ácido azelaico al 20% tópico en crema todas las noches de lunes a sábado con descanso los domingos. Previo a la consulta, el paciente fue tratado no satisfactoriamente con trimetropin/sulfametoxazol (80/400 mg) por 3 meses, amikacina tópica aplicada en horario nocturno por 2 meses, e ibuprofeno (400mg) 8 horas por 15 días.
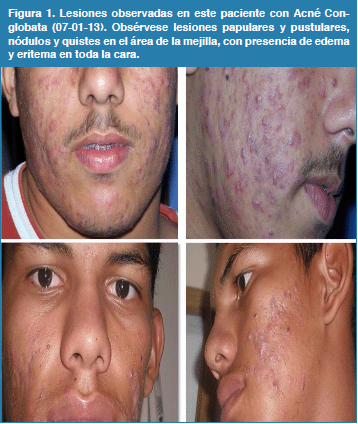
La exploración dermatológica se realizó utilizando una lámpara de de Wood, observándose fototipo cutáneo III e hipersecreción seborreica en piel de frente, nariz y mejillas acompañado de nódulos de tamaño variable fistulizados, dolorosos y profundos con secreción purulenta en mejilla derecha y cuello. En el tórax el paciente presenta nódulos y quistes con signos de flogosis con fluidos que forman un absceso y cicatrices rojas recientes que se extienden por el esternón y ambas clavículas (ver Figura 1).
Los análisis de laboratorio solicitados evidenciaron niveles elevados de testosterona total (100 ng/ml) los cuales se normalizaron en exámenes subsiguientes, mientras que el resto de parámetros evaluados se encontraron dentro de los límites normales (Tabla 1). Se realizó un cultivo bacteriológico de la secreción purulenta del absceso de la mejilla derecha, que resultó positivo para Staphylococcus epidermidis y Streptococcus pyogenes. Se realizó una biopsia del nódulo de la hemicara derecha en la región malar, que reveló un proceso inflamatorio crónico supurativo que compromete la porción superior e inferior de la pared folicular, e infiltrados inflamatorios perifoliculares con cúmulos de neutrófilos que involucran la dermis superficial y profunda, estableciendo el diagnóstico de Acné Conglobata (ver Figura 2).
Para el tratamiento de este paciente se trabajó con un equipo multidisciplinario que incluyó manejo dermatológico, nutricional y psicológico. El enfoque del tratamiento dermatológico fue la eliminación de las obstrucciones de los folículos pilosos, disminución de la producción de sebo, y control de la colonización bacteriana. Para ello, en primera instancia (07-01-13) se indicó moxifloxacina 1 ampolla de 250 mg EV cada 12 horas por 7 días. Al término de este esquema y tras evidenciarse ausencia de secreción en las lesiones, se indica moxifloxacina en tabletas 500 mg cada 12 horas por una semana. Quince días después (23-01-13) el paciente acude nuevamente a la consulta, sin hallazgos clínicos de edema, dolor ni secreción, por lo que se decide implementar isotretinoina 30 mg cada 12 horas, adapaleno más peróxido de benzoilo en horario nocturno de lunes a viernes en las áreas afectadas, y antibióticos tópicos: Eritromicina gel al 4% durante horario nocturno en los fines de semana, y clindamicina gel durante horario diurno dos veces a la semana evitando exposición solar. Asimismo, se indica ácido azelaico dos veces a la semana durante horario diurno en el fin de semana, y uso diario de protector solar (Umbrella®) y labial. Un mes después, se realiza limpieza de cutis, con extracción de comedones y corrección de nódulos y quistes.
Dos meses más tarde (23-03-13) el paciente acude nuevamente a la consulta evidenciándose disminución de los signos de flogosis, así como desaparición de pápulas y pústulas en frente, mejilla, mentón, región dorsal del tórax y escápulas. Para Abril-2013 el paciente no presenta signos de flogosis, y se observa disminución del tamaño de los quistes y desaparición total de los nódulos. Dicha mejoría clínica se mantiene en Mayo y para Junio del mismo año no se observan lesiones en ninguna área del cuerpo, por lo que se suspende el tratamiento (ver Figura 3).

En cuanto al manejo nutricional, la orientación dietética consistió en evitar alimentos ricos en grasas, lácteos, huevos, refrescos, jugos pasteurizados, cítricos o con colorantes y chocolate de cualquier tipo lo cual conllevó a mejoría en el control del peso y su perfil lipídico se mantuvo normal. Por otro lado, con respecto al abordaje psicológico, se establecieron visitas de carácter mensual al psicólogo debido a que el paciente presentaba un cuadro clínico depresivo, ansiedad social, y síntomas psicosomáticos como hiperalgesia y alodinia. Los aspectos psicológicos mejoraron de manera paralela a la evolución médica ya que al tratamiento del paciente se agregó psicoterapia.
Discusión
El acné es una enfermedad crónica inflamatoria que en su presentación típica se presenta en la cara, el cuello, el torso, los hombros y espalda, y está caracterizado por comedones, pápulas, e hipersecreción sebácea16. Este incluye un amplio espectro de presentaciones clínicas (Tabla 2), entre las cuales una de las más severas es el AC, caracterizada por abundantes lesiones quísticas de contenido purulento, confluentes con tendencia a la fistulización. En los casos en los cuales hay compromiso sistémico se le denomina acné fulminans y puede incluir fiebre, artralgia y leucocitosis17. El AC forma parte de la tétrada de oclusión folicular, que incluye quistes pilonidales, HS y celulitis disecante18.
También ha sido asociado con artritis piogénica y pioderma gangrenoso, desorden agrupado como síndrome de artritis piogénica estéril, pioderma gangrenoso y acné (PAPA)19. Este es un síndrome hereditario de tipo autosómico dominante, siendo el gen afectado el de la proteína de unión 1 al CD2 (CD2BP1). La CD2BP1 interactúa con la pirina, proteína encargada de regular la apoptosis y el procesamiento de la IL-1β, modulando así la respuesta inflamatoria20-22. Una mutación del CD2BP1 puede aumentar su capacidad de unión a la pirina, reduciendo el efecto inhibitorio de esta última, la pirina activa la producción de IL-1β vía un complejo conocido como inflamasoma23-25, por otro lado se ha propuesto un mecanismo alternativo en el cual la interacción entre la PSTPIP1, pirina y ASC se encuentra alterada en los monocitos por variantes E250Q y A230T de la PSTPIP1, conllevando a la activación del piroptosoma, que termina en muerte celular y liberación de citocinas como la IL-1β 26,27.
Los andrógenos y receptores de andrógenos han sido implicados en el desarrollo de enfermedades de la piel, esto basado en la expresión en la piel de múltiples enzimas androgénicas involucradas en la esteroidogénesis, y la presencia de un dimorfismo sexual en la arquitectura y enfermedades de la piel28. Estas hormonas son claves en el desarrollo de AC, ya que promueven el crecimiento y diferenciación de las glándulas sebáceas, así como también crecimiento del pelo, homeostasis de la barrera epidermal y curación de heridas29. En este sentido, la hipertrofia y producción de sebo son andrógenos dependientes, durante la pubertad la producción de sebo predomina moderadamente en el sexo masculino30, de manera que la transición a altos niveles de andrógenos en la pubertad hace de esta etapa vital, un escenario óptimo para el desarrollo de acné28. Durante la pubertad, el factor de crecimiento insulínico tipo 1 (IGF-1) –hormona clave en el crecimiento durante esta etapa- induce la síntesis de andrógenos y aumenta la actividad de la 5α-reductasa en la piel (31), igualmente la actividad de la IGF-1/PI3K/AKT estimula la fosforilación de FOXO1, un co-represor del receptor de andrógenos, de esta manera, el FOXO1 es translocado del núcleo al citosol, dejando libre al receptor de andrógenos para su transactivación ulterior32.
Por otro lado, bacterias oportunistas pertenecientes a la flora normal como Propionibacterium acnes, Propionibacterium granulosum y Propionibacterium avidis son agentes infecciosos típicos del acné33,34, las cuales al multiplicarse causan inflamación cutánea así como lesiones inflamatorias posiblemente a través de la inducción de la expresión de IL-17 en células mononucleares sanguíneas periféricas y en el infiltrado perifolicular de los comedones35. Estas bacterias junto con el sebo y las células muertas forman las lesiones del acné. Específicamente, el Propionibacterium acnes se encuentra usualmente en el folículo pilosebáceo normal así como cuando hay presencia de acné y, si bien no es patogénico por sí solo y es considerado una bacteria comensal, al haber incremento en la producción de sebo, P. acnés metaboliza los triacilglicéridos del mismo36 e inicia la secreción de hialuronidasa, proteasa, lipasa y factores quimiotácticos para neutrófilos, linfocitos, y macrófagos y, por su interacción con los anticuerpos y sistema de complemento, ha sido asociado a la inflamación observada en el acné37. Esta activación del sistema de complemento puede ser responsable de la producción de los comedones38. Existen otras bacterias que agravan las condiciones de acné como es el caso de Staphylococcus aureus, Pseudomonas aeruginosa y Eschericia coli,39 sí como Staphylococcus epidermidis, el cual fue encontrado en el cultivo realizado al paciente del presente caso, sin embargo, la acción de esta última bacteria en la patogénesis del acné no ha sido aún del todo esclarecida40.
Otros factores de menor importancia son el uso de cosméticos y drogas con ingredientes comedogénicos, como lanolina y sus derivados, isopropil mistrato y sus análogos como isopalmitato, butil estearato, isopropil isostearato, entre otros, pigmentos rojos D y C (xanthene, monoazonilinas e indigoides)41 que causan una obstrucción del flujo normal del sebo hacia la superficie, principalmente por la inducción de hiperqueratosis folicular42,43. Aunque la lista de condiciones asociadas al AC es larga, su etiología no está totalmente definida, convergiendo de esta manera en un modelo multifactorial.
Primer objetivo: Delimitar el problema-Diagnóstico diferencial del Acné conglobata En este caso se describe a un paciente masculino joven que acude a la consulta con 6 meses de evolución de acné con sintomatología clásica de alta sospecha de acné conglobata. El AC ocurre principalmente en jóvenes adolescentes, sin embargo, en ocasiones puede ser confundido con Hidradenitis Supurativa44, aunque difícilmente los 4 componentes de la tétrada de oclusión folicular se presenten de forma simultánea45. Diversos factores ambientales potenciadores, inducción de la enfermedad por litio y típica asociación con la depresión son similares tanto en AC como en HS, lo que demarca cierta similitud46-48. Asimismo, se ha observado la coexistencia de ambas patologías junto con celulitis en el cuero cabelludo formando así la triada de oclusión folicular. Diferenciar entre ambas patologías y determinar si ambas se encuentran presentes en la tríada es de suma importancia ya que ésta ha sido asociada con carcinoma de células escamosas49. La diferencia en el diagnóstico es preponderantemente clínica ya que se observan los característicos comedones en las regiones del cuello, los miembros superiores, el abdomen, los glúteos, las axilas, la ingle, y el periné en el caso de AC mientras que en el caso de HS se observan las lesiones principalmente en axila y en menor cantidad en la región perianal, labia, escroto y alrededor de los senos50.
Existen otras patologías altamente miméticas, uno de los diagnósticos diferenciales más importantes es el acné fulminans el cual es un trastorno raro, severo y de aparición muy similar al AC51. Sin embargo los puntos a diferenciar son críticos para la debida demarcación de los trastornos52: 1) el acné fulminans es de inicio súbito; 2) las lesiones son primordialmente ulcerosas con costras; y 3) Mayor frecuencia de síntomas sistémicos, indicios no encontrados a pleno en el paciente reportado. El diagnóstico es confirmado a través de la biopsia. En el caso de acné fulminans, los hallazgos de la misma son infiltración vascular linfocitaria, inflamación de los lóbulos sebáceos y en ciertos casos espongiosis53. A diferencia de esto, en el paciente del presente caso, por ejemplo, se puede observar en una biopsia de AC inflamación supurativa con infiltración perifolicular con cúmulos de neutrófilos en dermis superficial y profunda.
Segundo objetivo: Inicio del manejo farmacológico – Antibioticoterapia y retinoides como manejo de primera línea
La Asociación Americana de Dermatología recomienda el uso de retinoides en conjunto al peróxido de benzoilo y antimicrobianos como terapia de primaria línea para el acné, combinación que disminuye el riesgo de resistencia bacteriana53. Los dos principales –retinoides y antimicrobianos- deben a su vez ser administrados sistémicamente en el acné severo por su máxima efectividad54. Con respecto a la antibióticoterapia, uno de los medicamentos utilizados en este caso fue moxifloxacina, la cual es un antibiótico de amplio espectro que actúa inhibiendo la enzima ADN girasa y ADN topoisomerasa IV formando un complejo fármaco-bacteria y teniendo un efecto bactericida55. Por otra parte, la clindamicina y la eritromicina fueron utilizadas como antibióticos por su efectividad en la inhibición de la proliferación de P. acnes y su función antiinflamatoria ampliamente demostrada (56). El último componente del armamento bactericida fue el peróxido de benzoílo que, al igual que los anteriores, reduce la población de P. acnes al generar especies reactivas de oxígeno (ROS) en el folículo sebáceo, mejorando rápidamente las lesiones inflamatorias y no inflamatorias57.
Otro de los fármacos ampliamente indicados para el manejo del acné y utilizado con éxito en el presente caso es la isotretinoina; que constituye la única terapia que ejerce un impacto en todos los principales factores etiológicos del acné obteniéndose como resultado la reducción de la producción de sebo, influencia en la comedogénesis, aumento en el grado de separación de los corneocitos dentro del ducto pilosebáceo, disminuye la población de P. acnes y actúa de forma antiinflamatoria58. La isotretinoina es un fármaco que posee la misma estructura química de la forma transcripcional del Acido retinocio –el all-trans acido retinoico- pero modificado isomericamente al 13-cis ácido retinoico, metabolito que es farmacocinéticamente más estable que su isómero59. Aunque no se sabe con certeza como lo hace, la isotretinoina modula la progresión del ciclo celular, la diferenciación celular, su sobrevivencia y finalmente la apoptosis60, generando en el foco comedogenico el aumento de los esteroides libres y ceramidas, disminución de glicéridos y ácidos grasos libres y disminución del tamaño de la glándula sebácea61. Otro retinoide utilizado es el adapaleno el cual modula también la diferenciación celular, queratinización y procesos inflamatorios, con un mecanismo de acción similar a los demás retidoides aunque a diferencia de éstos, posee a su vez efectos antiinflamatorios57. Otro de los fármacos empleados fue el ácido azelaico el cual es un ácido no fenol, saturado, de uso tópico, que utilizado al 20% inhibe la síntesis de enzimas mitocondriales y síntesis de ADN lo cual tiene como consecuencia citotoxicidad62.
El uso de estos fármacos en combinación, parece ser más adecuado en pacientes con lesiones inflamatorios papulopustulares típicas del acné severo, ya que posee un alto perfil de seguridad y tolerabilidad63,64, con un menor riesgo de resistencia bacteriana al tratamiento,65 y con una eficacia mayor comparada a la monoterapia (66). Uno de estos, fue el realizado por Wolf y cols.67 de metodología prospectiva con una duración de 12 semanas en el cual participaron 249 pacientes en los cuales se indició como esquema terapéutico el uso combinado de adapaleno y peróxido de benzoílo, obteniendo mayor efectividad que el de peróxido de benzoílo solo67,68. Asimismo, en un meta análisis de 3 estudios que involucraron a 1259 pacientes en el cual se demostró que la combinación de clindamicina con peróxido de benzoílo fue más efectivo que el uso de cualquiera de estas drogas independientemente69. Además la terapia combinada con el uso de fármacos vía oral parece ser una de las más efectivas70,71, demostrado en el estudio comandado por Cunliffe72 y cols, en el cual el uso de limeciclina oral más adapaleno tópico exhibió una mejoría marcada del 75.5 % de los pacientes, a comparación de un 51.18 % en aquellos que se les indicó solo limeciclina con un gél vehiculo (p<0.001).
En la consulta final, luego del tratamiento con isotretinoina oral y antibioticoterapia sistémica y tópica, la mejoría fue significativa. Resultados similares han sido reportados con el uso de isotretinoina como es el caso del estudio de 4 casos realizado por Mehra y cols.73 en los cuales el tratamiento con isotetrinoina en bajas dosis combinado con prednisolona oral dio como resultado una mejoría dramática tanto en casos de acné conglobata como de acné fulminans. La isotretinoina ha sido considerada desde su aprobación por parte de la FDA en 1982, como la terapia anti-acné más efectiva clínicamente ya que tiene efectos positivos en la producción de sebo, comedogénesis, en la disminución de P. acnés tanto superficial como ductal y tiene propiedades antiinflamatorias58, e igualmente tiene la capacidad de disminuir los niveles de receptores de andrógenos en piel así como de suprimir la producción de 5-α-dihidrotestosterona74. Sin embargo, es de suma importancia que se tengan presentes los efectos secundarios de la misma tales como su teratogenicidad por lo cual no se debe indicar durante el embarazo y se ha recomendado la utilización de anticonceptivos durante el tratamiento y hasta un mes después de suspendido el mismo75.
A su vez, el uso de isotretinoina ha sido asociado en ocasiones a depresión y suicidio, sin embargo, no se encuentra contraindicado en caso de depresión preexistente, por el contrario, se recomienda que al indicarse dicha terapia, apoyo psicológico adicional sea proveído tal como fue manejado en el caso de este paciente76.
Tercer objetivo: Inclusión a la vida social-Manejo de la dieta y rehabilitación psicológica
El acné es una de las condiciones patológicas que más se relacionan con problemas psicosociales como estrés, depresión e ideas suicidas durante la adolescencia, por lo que su manejo debe ser considerado como pilar fundamental para un tratamiento integral del paciente y una adecuada inclusión a la sociedad77. La consulta con un psicólogo o psiquiatra es esencial en los casos donde esté presente hallazgos positivos de depresión, bien sea antes o durante el tratamiento53.
Además la isotretinoina, uno de los fármacos con mayor efectividad en el tratamiento del acne ha sido asociada estadísticamente a depresión78. La FDA recibió entre 1982 y 2000, 431 reportes de pacientes con tratamiento actual de isotretinoina que presentaron depresión e ideas suicidas en Estados Unidos, de los cuales 37 cometieron suicidio, hecho que la consagró en el puesto 10 del ranking de los 10 fármacos con este tipo de reportes79. En un estudio realizado en Canadá, el 25% de las reacciones adversas en individuos con el uso de isotrotinoina fueron de causa psiquiátrica80, sugiriendo otros estudios a su vez, una asociación causal en individuos de alto riesgo81. Por estas razones se ha recomendado que en casos donde la isotretinoina esté presente dentro del manejo farmacológico, el paciente sea advertido de que la depresión es uno de los posibles efectos secundarios para poder resolver cualquier eventualidad futura82,83.
Con respecto a la dieta, la academia americana de dermatología indica que la restricción de ciertos alimentos no genera algún beneficioso en el manejo del acné53. Sin embargo esta recomendación fue hecha con a una reducida base de estudios que evaluaran el efecto directo de la restricción dietaria de ciertos grupos alimentarios cobre la patogénesis del acné, además de poseer diversas limitaciones entre ellas, tamaño muestrales bajos, por lo que nuevos estudios debían realizarse para clarificar esta asociación53,84,85.
En cambio, otros estudios asocian buenos hábitos nutricionales con mejorías en las lesiones relacionadas al acné86. Un estudio realizado en 43 individuos masculinos con acné durante 12 semanas comparó a un grupo control con un grupo que fue sometido a una dieta baja en glucosa. El grupo que realizó la dieta presentó una mayor disminución en la cantidad de lesiones que el grupo control lo cual podría deberse a una asociación entre el estilo de vida y la nutrición con la patogénesis del acné.87. Estudios epidemiológicos de tipo observacional han reportado una asociación positiva entre la incidencia de acné y la ingesta de lecha tanto completa como descremada88. Esto se debe a que la leche contiene hormonas, como la betacelulina en altas cantidades. La betacelulina sobrevive el proceso de pasteurización y es capaz de llegar a la circulación por medio de su unión al receptor del factor de crecimiento epidérmico (EGFR) presente en el tracto gastrointestinal. En la circulación la betacelulina se puede unir a los EGFR de los keratinocitos induciendo la proliferación celular de los mismos y disminuyendo a su vez la apoptosis de estos89. Otra de las características de la leche es que tiene propiedades insulinotrópicas así como la papa, la azúcar refinada y los granos. La combinación de leche y otros productos con potencial hiperglicémico puede ocasionar respuestas hiperinsulínicas y se ha comprobado que la leche eleva la insulina postprandial así como los niveles basales de IGF-1 en plasma lo cual juega un rol en la patogénesis del acné90.
Por último, uno de los factores más importantes en la etiopatogenia del AC son las fluctuaciones y desbalances hormonales, es por ello que la mayor parte de las personas comienzan a padecer de acné al iniciar la pubertad ya que la producción de andrógenos iniciada en esta etapa conduce al crecimiento de las glándulas sebáceas y aumenta la cantidad de sebo producida que al relacionarse con las células muertes y bacterias presentes en la superficie de la piel ocasionan el bloqueo de los poros iniciándose así el proceso inflamatorio91. Esto se puede ver empeorado cuando existe deficiencia de vitamina A, B, C, E y zinc ya que estas tienen función antioxidante y participan en la eliminación de toxinas y radicales libres en la piel por lo cual su ausencia aumente la vulnerabilidad de la piel a las bacterias que contribuyen al desarrollo del acné92.
Conclusiones
El acné en todas sus formas y especialmente el acné conglobata, trae consigo una serie de consecuencias que afecta la vida de los pacientes que la padecen en todas sus esferas, desde su salud física así como interacciones psicosociales. El uso de derivados retinoides y terapia antibiótica combinada ha demostrado amplia eficacia, tal como es el caso de nuestro paciente el cual presentó una mejoría significativa a sólo semanas desde el inicio del tratamiento, no obstante los efectos secundarios tales como exacerbación del acné u otras manifestaciones cutáneas o sistémicas, deben ser tomados en consideración durante el tratamiento para evitar mayores complicaciones; además de la terapéutica medica es necesario complementar con el uso de terapia emocional, debido a las alteraciones psicológicas que esta enfermedad podría ejercer sobre estos pacientes.
Referencias
1. Patterson W, Stibich A, Dobke M, Schwartz R. Mutilating facial acne conglobata. Cutis. 2000;66 (2):139-40. [ Links ]
2. Lim D, James N, Hassan S, Khan M. Spodyloarthritis associated with acne conglobate, hidradenitis suppurativa and dissecting cellulitis of the scalr: A review with illustrative cases. 2013; 15: 346. [ Links ]
3. Wollenberg A, Wolff H, Jansen T. Acne conglobata and klinefeter`s syndrome. Br J Dermatol 1997; 136:421-423. [ Links ]
4. Bhate K, Williams H. Epidemiology of acne vulgaris. Br J Dermatol. 2013; 168 (3): 474-485. [ Links ]
5. Rojas R, Martínez G, Almaguer L. Posible anticipación genética en familias cubanas con acné conglobata. Dermatol Rev Mex 2013;57: 313-318. [ Links ]
6. Zouboulis C. Acne as a chronic systemic disease. Climics in Dermatology. 2014; 32 (3): 389-396. [ Links ]
7. Weiss J, Wilder E. Acne Conglobata. Acneiform Eruptions in Dermatology. 2014; 107-110. [ Links ]
8. Maintz L, Betz RC, Alla JP, Wenzl J y cols. Keratitis-ichthyosis-deafness síndrome in association with folicular occlusion triad. Eur J Dermatol 2005; 15:347-352. [ Links ]
9. Prasad PV, Kaviarasan PK, Joseph JM y cols. Familial acné inversa with acne conglobata in three generations. Indian J Dermatol Venereol Leprol. 2008;74(3):283-5. [ Links ]
10. Rojas R, Socarrás L, Trinchet R y cols. Cambios cualitativos en la familia afectada por acné conglobata después de una intervención médica integral. Ciencias Holguín. 2012;18(1): 1-12. [ Links ]
11. Rojas R, Trinchet R, Trinchet C. Acné conglobata. Protocolo para la atención integral. Ciencias Holguín. 2012;18 (1):1-12. [ Links ]
12. Shimomura Y, Nomoto S, Yamada S, Ito A, Ito K, Ito M. Chronic glomerulonephritis remarkably improved after surgery for acne conglobata of the buttocks. Br J Dermatol. Aug 2001;145(2):363-4. [ Links ]
13. Myers J, Mason A, Gillespie L, Salkey K. Treatment of Acne Conglobata with modern external beam radiation. 2010; 62 (5): 861-863. [ Links ]
14. Kaminsky A. Síndrome de oclusión de los folículos terminales. Act Terap Dermatol 2007; 30: 78. [ Links ]
15. Harth W, Hillert A, Hermes B, Seikowski K, Niemeier V, Freudenmann RW. Suicidal behavior in dermatology. Hautarzt. 2008;59(4):289-96. [ Links ]
16. Degitz K, Placzek M, Borelli C, Plewig G. Pathophysiology of acne. J Dtsch Dermatol Ges. 2007, 5 (4): 316-323. [ Links ]
17. James WD. Clinical practice. Acne. N Engl J Med. 2005, 325 (14): 1463-1472. [ Links ]
18. Patel S, Jared R, Robbins JR and Iltefat Hamzavi2 Patel, et al. Radiation Therapy for Chronic Hidradenitis Suppurativa. J Nucl Med Radiat Ther 2013, 4:1 10.4172/2155-9619. [ Links ]
19. Smith EJ, Allantaz F, Bennett L, Zhang D, Gao X, Wood G, Kastner DL, et al. Molecular, and Genetic Characteristics of PAPA Syndrome: A Review. Current Genomics, 2010, 11: 519-527 519 Clinical. [ Links ]
20. Srinivasula SM, Poyet JL, Razmara M, Datta P, Zhang Z, Alnemri ES. The PYRIN-CARD protein ASC is an activating adaptor for caspase- 1. J Biol Chem. 2002 Jun 14;277(24):21119-22. [ Links ]
21. Bertin J, DiStefano PS. The PYRIN domain: a novel motif found in apoptosis and inflammation proteins. Cell Death Differ. 2000 Dec;7(12):1273-4. [ Links ]
22. Staub E, Dahl E, Rosenthal A. The DAPIN family: a novel domain links apoptotic and interferon response proteins. Trends Biochem Sci. 2001 Feb;26(2):83-5. [ Links ]
23. Osamu Tago, Yayoi Nagai, Yoichiro Matsushima and Osamu Ishikawa. A Case of Acne Fulminans Successfully Treated with Cyclosporin A and Prednisolone. Acta Derm Venereol 2011; 91: 337–378. [ Links ]
24. Wise C, Gillum J, Seidman C, Lindor N, Veile R, Bashiardes S and Michael Lovett M. Mutations in CD2BP1 disrupt binding to PTP PEST and are responsible for PAPA syndrome, an autoinflammatory disorder. Hum Mol Genet. 2002 Apr 15;11(8):961-9. [ Links ]
25. Nitza G. Shoham, Michael Centola, Elizabeth Mansfield, Keith M. Hull, Geryl Wood, Carol A. Wise and Daniel L. Kastner. Pyrin binds the PSTPIP1_CD2BP1 protein, defining familial Mediterranean fever and PAPA syndrome as disorders in the same pathway. Proc Natl Acad Sci U S A. 2003 Nov 11;100(23):13501-6. [ Links ]
26. Yu JW, Fernandes-Alnemri T, Datta P, Wu J, Juliana C, Solorzano L, McCormick M, Zhang Z, Alnemri ES. Pyrin activates the ASC pyroptosome in response to engagement by autoinflammatory PSTPIP- 1mutants. Mol. Cell. 2007;28:214–227. [ Links ]
27. Fernandes-Alnemri T, Wu J, Yu JW, Datta P, Miller B, Jankowski W, Rosenberg S, Zhang J, Alnemri ES. The pyroptosome: a supramolecular assembly of ASC dimers mediating inflammatory cell death via caspase-1 activation. Cell Death Differ. 2007;14:1590–1604. [ Links ]
28. Lai JJ, Chang P, Lai KP, Chen L, Chang C. The role of androgen and androgen receptor in skin-related disorders. Arch Dermatol Res. 2012 Sep;304(7):499-510. [ Links ]
29. Zouboulis CC, Chen WC, Thornton MJ, Qin K, Rosenfield R. Sexual hormones in human skin. Horm Metab Res. 2007;39(2):85–95. [ Links ]
30. Deplewski D, Rosenfield RL. Role of hormones in pilosebaceous unit development. Endocrine Rev. 2000; 21: 363-392. [ Links ]
31. Melnik BC, Schmitz G. Role of insulin, insulin-like growth factor-1, hyperglycaemic food and milk consumption in the pathogenesis of acne vulgaris. Exp Dermatol. 2009;18(10):833–841. [ Links ]
32. Fan W, Yanase T, Morinaga H, Okabe T, Nomura M, Daitoku H, et al. Insulin-like growth factor 1/insulin signaling activates androgen signaling through direct interactions of Foxo1 with androgen receptor. J Biol Chem. 2007;282(10):7329–7338. [ Links ]
33. Perry A, Lambert P. Propionibacterium acnes: infection beyond the skin. Expert Rev Anti Infect her. 2011;9(12):1149-56. [ Links ]
34. Deepak Singh, Bhushan Hatwar and S. Nayak. HERBAL PLANTS AND PROPIONIBACTERIUM ACNES: AN OVERVIEW. IJBR 2 [9] [2011]486-498. [ Links ]
35. Thiboutot DM, Layton AM, Eady EA. IL-17: A Key Player in the P. acnes Inflammatory Cascade?. J Invest Dermatol. 2014 Feb;134(2):307-10. [ Links ]
36. Guy F Webster. Acne vulgaris. BMJ 2002;325(7362):475-479. [ Links ]
37. Craig G Burkhart, Craig N Burkhart, Paul F Lehmann. Acne: a review of immunologic and microbiologic factors. Postgrad Med J 1999;75:328–331. [ Links ]
38. Basal, E.,1 Jain, A.1 and Kaushal, G.P Antibody Response to Crude Cell Lysate of Propionibacterium acnes and Induction of Pro-Inflammatory Cytokines in Patients with Acne and Normal Healthy Subjects. The Journal of Microbiology. 2004:42(2):117-125. [ Links ]
39. Bhatt D, Kumar A, Jain S, Barik R. Studies on inhibitory effect of Eucalyptus oil on sebaceous glands for the manaegement of acne. Indian J nat prod resou. 2011; 2 (3):345-349. [ Links ]
40. Anna Białecka, Monika Mak, Rafał Biedroń, Małgorzata Bobek, Andrzej Kasprowicz and Janusz Marcinkiewicz. Different pro-inflammatory and immunogenic potentials of Propionibacterium acnes and Staphylococcus epidermidis: implications for chronic inflammatory acne. Arch Immunol Ther Exp, 2005, 53, 79–85. [ Links ]
41. Katoulis A, Kakepis, Kintziou H, Kakepis M, Stavrianeas N. Comedogenicity of cosmetics: a review. Journal of the European Academy of Dermatology and Venereology. 1996;7(2):115-119. [ Links ]
42. Draelos ZD, DiNardo JC. A re-evaluation of the comedogenicity concept. J Am Acad Dermatol. 2006;54(3):507-12. [ Links ]
43. Nguyen SH, Dang TP, Maibach HI. Comedogenicity in rabbit: some cosmetic ingredients/vehicles. Cutan Ocul Toxicol. 2007;26(4):287-92. [ Links ]
44. Leybishkis B, Fasseas P, Ryan KF, Roy R. Hidradenitis suppurativa and acne conglobata associated with spondyloarthropathy. Am J Med Sci. Mar 2001;321(3):195-7. [ Links ]
45. Scheinfeld N. Diseases associated with hidranitis suppurativa: part 2 of a series on hidradenitis. Dermatol Online J. 2013 Jun 15;19(6):18558. [ Links ]
46. Darley CR. Acne conglobata of the buttocks aggravated by mechanical and environmental factors. Clin Exp Dermatol. 1990 Nov;15(6):462-3. [ Links ]
47. Aithal V, Appaih P. Lithium induced hidradenitis suppurativa and acne conglobata. Indian J Dermatol Venereol Leprol. 2004 Sep- Oct;70(5):3079. [ Links ]
48. Misery L, Feton-Danou N, Consoli A, Chastaing M, Consoli S, Schollhammer M; pour Le Groupe psychodermatologie de Société française de dermatologie. Isotretinoin and adolescent depression. Ann Dermatol Venereol. 2012 Feb;139(2):118-23. [ Links ]
49. Min Gao, Pei-Guang Wang, Yong Cui, Sen Yang, Yu-Hui Zhang, Da Lin, Kai-Yue Zhang, Yan-Hua Liang, Liang-Dan Sun, Kai-Lin Yan, Feng-Li Xiao, Wei Huang2 and Xue-Jun Zhang. Inversa Acne (Hidradenitis Suppurativa): A Case Report and Identification of the Locus at Chromosome 1p21.1–1q25.3. Journal of Investigative Dermatology. 2006;126. [ Links ]
50. J S Fitzsimmons and P R Guilbert. A family study of hidradenitis suppurativa. J Med Genet 1985 22: 367-373. [ Links ]
51. Rafael Bandeira LagesI; Sebastião Honório BonI; Flávia Veríssimo Melo e SilvaI; Andressa Karoline Lima GomesI; Viriato Campelo. Acne fulminans successfully treated with prednisone and dapsone. An Bras Dermatol. 2012 Jul-Aug;87(4):612-4. [ Links ]
52. Mehrany K, Kist J, Weenig R, Witman P. Acne fulminas morphology. Int J Dermatol 2005; 44:132-3. [ Links ]
53. Strauss JS, Krowchuk DP, Leyden JJ, Lucky AW, Shalita AR, Siegfried EC, et al. Guidelines of care for acne vulgaris management. J Am Acad Dermatol. 2007 Apr;56(4):651-63. [ Links ]
54. Leyden JJ. A review of the use of combination therapies for the treatment of acne vulgaris. J Am Acad Dermatol. 2003 Sep;49(3 Suppl):S200-10. [ Links ]
55. Smith J. The mode of action of 4-quinolones and possible mechanisms of resistance. J Antimicrobial Chemother. 1986;18 (D):21. [ Links ]
56. Nelson A, Zhao W, Thiboutot y cols. Temporal changes in gene expression in the skinf of patients treated with isotretinoin provide insight into its mechanism of action. Dermatoendocrinol. 2009;1(3):177-187. [ Links ]
57. Thiboutot D. New Treatments and Therapeutic Strategies for Acne. Arch Fam Med. 2000;9:179-187. [ Links ]
58. Layton A. The use of isotretinoin in acné. Dermato-Endocrinology 2009; 1 (3): 162-169. [ Links ]
59. Wiegand UW, Chou RC. La farmacocinética de la isotretinoína oral. J Am Acad Dermatol 1998 Aug; 39 (2 Pt 3): S8-12. [ Links ]
60. Tsukada M, Schröder M, Roos TC, Chandraratna RA, Reichert U, Merk HF, et al. 13-cis-retinoic acid exerts its specific activity on human sebocytes through selective intracellular isomerization to alltrans- retinoic. J Invest Dermatol. 2000 Aug;115(2):321-7. [ Links ]
61. Piquero J. Isotretinoína: su uso en el acné del Adolescente. Dermatol Pediatr Lat 2004; 2(1): 72-81. [ Links ]
62. Nguyen QH, Bui TP. Azelaic acid: pharmacokinetic and pharmacodynamic properties and its therapeutic role in hyperpigmentary disorders and acne. Int J Dermatol 34(2)75-84 (1995 Feb). [ Links ]
63. Chalker DK, Shalita A, Smith JG Jr, Swann RW. A double-blindstudy of the effectiveness of a 3% erythromycin and 5% benzoyl peroxide combination in the treatment of acne. J Am Acad Dermatol 1983;9:933-6. [ Links ]
64. Eichenfield LF, Alió Sáenz AB. Safety and efficacy of clindamycin phosphate 1.2%-benzoyl peroxide 3% fixed-dose combination gel for the treatment of acne vulgaris: a phase 3, multicenter, randomized, double-blind, active- and vehicle-controlled study. J Dermatol Drogas 2011 Dec; 10 (12): 1382-1396. [ Links ]
65. Toyoda M, Morohashi M. An overview of topical antibiotics for acne treatment. Dermatology. 1998;196(1):130-4. [ Links ]
66. Tschen EH, Katz HI, Jones TM, Monroe EW, Kraus SJ, Connolly MA, Levy SF. A combination benzoyl peroxide and clindamycin topical gel compared with benzoyl peroxide, clindamycin phosphate, and vehicle in the treatment of acne vulgaris. Cutis. 2001 Feb;67(2):165-9. [ Links ]
67. Wolf J, Kaplan D, Kraus S, Loven K, Rist T, Swinyer L, Baker M, Liu Y, Czemielewski. Efficacy and torelability of combined topical treatment of acne vulgaris with adapalene and clindamycin: a multicenter, randomized, investigator-blinded study. J Acad Dermatol 2003; 49 (3): 211-7. [ Links ]
68. Kraft J, Freiman A. Management of acné. CMAJ 2011;183 (7). [ Links ]
69. Ellis C, Leyden J, Katz H, et al. Therapeutic studies with a new combination benzoyl peroxide/clindamycin topical gel in acne vulgaris. Cutis 2001;67(2): 13-20. [ Links ]
70. Kligman AM, Mills OH, McGinley KJ, Leyden JJ. Acne therapy with tretinoin in combination with antibiotics. Acta Derm Venereol Suppl (Stockh) 1975;74:111-5. [ Links ]
71. Mills OH, Marples RR, Kligman AM. Acne vulgaris. Oral therapy with tetracycline and topical therapy with vitamin A. Arch Dermatol 1972;106:200-3. [ Links ]
72. Cunliffe WJ, Meynadier J, Alirezai M, George SA, Coutts I, Roseeuw DI, et al. Is combined oral and topical therapy better than oral therapy alone in patients with moderate to moderately severe acne vulgaris? A comparison of the efficacy and safety of lymecycline plus adapalene gel 0.1%, versus lymecycline plus gel vehicle. J Am Acad Dermatol. 2003 Sep;49(3 Suppl):S218-26. [ Links ]
73. Mehra T, Borelli C, Burgdorf W, Röcken M, Schaller M. Treatment of Severe Acne with Low-dose Isotretinoin. Acta Derm Venereol 2012; 92: 247–248. [ Links ]
74. Boudou P, Soliman H, Chivot M, Villette JM, Vexiau P, Belanger A, Fiet J. Effect of oral isotretinoin treatment on skin androgen receptor levels in male acneic patients. J Clin Endocrinol Metab. 1995 Apr;80(4):1158-61. [ Links ]
75. Goodfield M, Cox N, Bowser A, McMillan J, Millard L, Simpson N, et al. Advice on the safe introduction and continued use of isotretinoin in acne in the UK. Br J Dermatol 2010; 162: 1172–1179. [ Links ]
76. Sundstro¨m A, Alfredsson L, Sjolin-Forsberg G, et al. Association of suicide attempts with acne and treatment with isotretinoin: retrospective Swedish cohort study. BMJ 2010; 341: c5812. [ Links ]
77. Halvorsen JA, Stern RS, Dalgard F, Thoresen M, Bjertness E, Lien L. Suicidal ideation, mental health problems, and social impairment are increased in adolescents with acne: a population-based study. J Invest Dermatol. 2011 Feb;131(2):363-70. [ Links ]
78. Azoulay L, Blais L, Koren G, LeLorier J, Bérard A. Isotretinoin and the risk of depression in patients with acne vulgaris: a case-crossover study. J Clin Psychiatry. 2008 Apr;69(4):526-32. [ Links ]
79. Wysowski DK1, Pitts M, Beitz J. An analysis of reports of depression and suicide in patients treated with isotretinoin. J Am Acad Dermatol. 2001 Oct;45(4):515-9. [ Links ]
80. Wooltorton E. Review Accutane (isotretinoin) and psychiatric adverse effects. CMAJ. 2003; 168 (1): 66. [ Links ]
81. Friedman T, Wohl Y, Knobler HY, Lubin G, Brenner S, Levi Y, et al. Increased use of mental health services related to isotretinoin treatment: a 5-year analysis. Eur Neuropsychopharmacol. 2006 Aug;16(6):413-6. [ Links ]
82. Kaymak Y, Taner E, Taner Y. Comparison of depression, anxiety and life quality in acne vulgaris patients who were treated with either isotretinoin or topical agents. Int J Dermatol. 2009 Jan;48(1):41-6. [ Links ]
83. Misery L, Feton-Danou N, Consoli A, Chastaing M, Consoli S, Schollhammer M; pour Le Groupe psychodermatologie de Société française de dermatologie. Isotretinoin and adolescent depression. Ann Dermatol Venereol. 2012 Feb;139(2):118-23. [ Links ]
84. Fulton JE Jr, Plewig G, Kligman AM. Effect of chocolate on acne vulgaris. JAMA. 1969 Dec 15;210(11):2071-4. [ Links ]
85. Bett DG, Morland J, Yudkin J. Sugar consumption in acne vulgaris and seborrhoeic dermatitis. Br Med J. 1967 Jul 15;3(5558):153-5. [ Links ]
86. Pappas A. The relationship of diet and acne A review. Dermatoendocrinol. 2009;1(5):262-267. [ Links ]
87. Robyn N Smith, Neil J Mann, Anna Braue, Henna Mäkeläinen, and George A. Varigos. A low-glycemic-load diet improves symptoms in acne vulgaris patients: a randomized controlled trial. Am J Clin Nutr. 2007 Jul;86(1):107-15. [ Links ]
88. Danby FW. Acne and milk, the diet myth, and beyond. J Am Acad Dermatol. 2005 Feb;52(2):360-2. [ Links ]
89. Gollnick H. Current concepts of the pathogenesis of acne. Drugs. 2003;63:1579–1596. [ Links ]
90. Hoppe C, Mølgaard C, Dalum C, et al.: Differential effects of casein versus whey on fasting plasma levels of insulin, IGF-1 and IGF-1/ IGFBP-3: results from a randomized 7-day supplementation study in prepubertal boys. Eur J Clin Nutr 2009;63:1076–1083. [ Links ]
91. Azman L S, Rahim A A, Fan S K, Abd Kadir M H, Abdul Hamid N A, Muhammad S K, Wong A W, Abdul Majid A M The Action of Tetracycline on Acne. [ Links ]
92. Burkhart CN, Gottwald L. Assessment of etiologic agents in acne pathogenesis. Skinmed. 2003;2:222–228. [ Links ]