Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT vol.36 no.1 Caracas feb. 2017
En busqueda del hipnótico ideal: tratamiento farmacológico del insomnio
Searching for the ideal hypnotic: pharmacological treatment of insomnia
Mervin Chávez, MD1,2, Manuel Nava, BCs1, Jim Palmar, BCs1, María Sofía Martínez, MD1*, Modesto Graterol Rivas, MgSc, PhD1,3, Julio Contreras, MgSc3, Juan Diego Hernández, MgSc3, Valmore Bermúdez, MD, MPH, MgSc, PhD1,3
Título Corto: En búsqueda del hipnótico ideal
1 Centro de Investigaciones Endocrino-Metabólicas Dr. Félix Gómez, Escuela de Medicina, Universidad del Zulia, Maracaibo, Venezuela.
2 Hospital Psiquiátrico de Maracaibo. Edo Zulia, Venezuela.
3 Grupo de Investigación Altos Estudios de Frontera (ALEF), Universidad Simón Bolívar, Cúcuta, Colombia
*Autor de Correspondencia: María Sofía Martínez, MD. Universidad del Zulia. Escuela de Medicina, Centro de Investigaciones Endocrino-Metabólicas Dr. Félix Gómez, Maracaibo, Venezuela. Fax: 58-261-7597279. Email: mmartinez@fmed.luz.edu.ve
Resumen
El insomnio es un trastorno del sueño caracterizado por dificultad para la conciliación o mantenimiento del sueño, por disminución del tiempo, fragmentación o mala calidad del sueño, y sensación de cansancio al día siguiente. Se trata de un problema con gran prevalencia en países industrializados y representa uno de los motivos de consulta más frecuente en atención primaria. Su terapéutica incluye medidas farmacológicas y no farmacológicas. Las drogas hipnóticas incluyen un amplio rango de moléculas, como benzodiacepinas, compuestos Z, antidepresivos, antihistamínicos, entre otros, cada una con propiedades farmacodinámicas y farmacocinéticas particulares. Basada en evidencia clínica-epidemiológica, esta revisión discute la eficacia y seguridad de los fármacos hipnóticos, con el objetivo de establecer el prototipo de hipnótico ideal para cada tipo de insomnio, considerando las necesidades o condiciones del paciente.
Palabras clave: insomnio, hipnótico ideal, arquitectura del sueño, drogas Z, benzodiacepinas.
Abstract
Insomnia is a sleep disorder characterized by difficulty for the onset or maintenance of sleep, as well as shortening, fragmentation or bad quality of sleep, and feeling unrested the following day. Insomnia boasts a high prevalence in industrialized countries, and represents one of the most frequent chief complaints in primary care. Treatment involves pharmacologic and non-pharmacologic measures. Hypnotic drugs include a wide range of molecules, such as benzodiazepines, z compounds, antidepressants, antihistamines and several others, each with distinct pharmacodynamic and pharmacokinetic properties. Based on clinical and epidemiologic evidence, this review discusses the efficacy and safety of hypnotic drugs, with the objective of establishing the prototype of the ideal hypnotic for each type of insomnia, according to the specific needs of each kind of patient.
Key words: insomnia, ideal hypnotic, sleep architecture, Z drugs, benzodiazepines.
Introducción
El insomnio, según la American Psychiatric Association, es un trastorno del sueño que se caracteriza por dificultad en la conciliación y mantenimiento del sueño, por disminución del tiempo, fragmentación o mala calidad del sueño, así como por sensación de cansancio al día siguiente1. Esta entidad constituye un problema de salud pública que afecta a millones de personas en los países industrializados2 y es uno de los motivos de consulta más frecuente en atención primaria3,4. La prevalencia de este trastorno varía según los criterios de diagnóstico (insomnio primario o secundario, síntomas de insomnio, duración, etc.) así como del tipo de cuestionarios empleados para evaluar y definir al insomnio, sin embargo ésta oscila entre 15-25% a nivel mundial5. En Latinoamérica, el estudio PLATINO6 determinó la prevalencia del insomnio en cuatro grandes ciudades, siendo de un 31% para la población de Caracas y Montevideo, del 36% para la ciudad de México y 42% para la ciudad de Santiago de Chile.
El insomnio como problema de salud pública ya era prominente desde mediados del siglo XIX, siendo los fisiólogos William Hammond e Ivan Pavlov los primeros en estudiar y describir formalmente este trastorno del sueño7. Es precisamente para esta época en que se inicia la terapéutica del insomnio, al emplearse los primeros fármacos dotados de cierta especificidad hipnótica o sedativa, es decir, fármacos o sustancias que inducen un sueño semejante al fisiológico8, entre los cuales resaltan el paraldehído, el uretano, el sulfonal, el bromuro y el hidrato de cloral9,10. Sin embargo, debido a las reacciones secundarias como confusión, irritación estomacal, elevada toxicidad o vida media prolongada, estos fármacos fueron eventualmente sustituidos por otras medidas terapéuticas11-13.
Durante la primera década del siglo pasado, la introducción de los barbitúricos revolucionó la terapéutica de los trastornos psiquiátricos, siendo utilizados en el tratamiento farmacológico del insomnio y de la ansiedad hasta la década de los 5014, sin embargo, el riesgo de sobredosis, su bajo índice terapéutico y el desarrollo de síndrome de abstinencia15, llevó a los científicos a desarrollar un nuevo fármaco con mayor eficacia y seguridad. Es así como surgen en los años 60 las benzodiacepinas, que al tener menor riesgo de dependencia y de muerte por sobredosis, representó un gran avance en comparación a los barbitúricos14. No obstante, se trataba de un fármaco que igualmente desarrollaba adicción, alteración en la arquitectura del sueño, pérdida de memoria y deterioro de la vigilancia16,17.
Posteriormente, durante la década de los 80, se introducen a la práctica clínica nuevos fármacos que actúan como agonistas no benzodiacepínicos del receptor benzodiacepinas, conocidos como compuestos o drogas Z (Zolpidem, Zopiclona, Zaleplon)14,18. Estas moléculas parecen ser más eficaces en cuanto la ausencia de somnolencia diurna, duración del sueño y preservación de la arquitectura del sueño4, aunque persisten preocupaciones respecto a sus efectos adversos como deterioro psicomotor, problemas cognitivos y depresión19- 21.
En vista de la alta prevalencia del insomnio y la carencia actual de un abordaje farmacológico consensuado en la práctica general, esta revisión tiene como objetivo explorar la eficacia y seguridad de los distintos hipnóticos, y determinar así cuál de ellos reúne las características del hipnótico ideal.
INSOMNIO: ASPECTOS GENERALES.
El insomnio es un trastorno del sueño caracterizado por la dificultad para la conciliación o mantenimiento del sueño, frecuentes despertares o imposibilidad para dormir luego de un pronto despertar. Igualmente, se consideran como síntomas de insomnio al sueño no reparador y la insatisfacción en relación al tiempo o calidad del sueño. Adicionalmente, el insomnio sólo toma relevancia bajo criterio clínico cuando tiene implicaciones en el desempeño cotidiano del afectado22,23. El paciente con insomnio suele quejarse de deterioro diurno: fatiga, cefaleas, dificultades cognitivas, irritabilidad, hiperacusia y fotofobia, disfunción social u ocupacional, somnolencia diurna excesiva, propensión a accidentes, entre otros24,25.
La clasificación del insomnio varía en función del criterio considerado para su estudio. En este sentido, según su etiología, el insomnio se puede clasificar en primario cuando se han descartado otras patologías que puedan condicionarlo; mientras que el insomnio secundario o comórbido es el que se origina en asociación con otros cuadros clínicos o de diferentes situaciones adaptativas, ya sea por mala higiene del sueño, trastornos psiquiátricos, enfermedades médicas o fármacos22,26.
Asimismo el insomnio puede catalogarse según el momento de la noche en que aparece la dificultad para dormir, ya sea al inicio (insomnio de conciliación), durante el periodo de sueño (insomnio de mantenimiento), o un despertar precoz. Finalmente, se le puede clasificar según su duración como insomnio transitorio, cuando dura menos de una semana, insomnio agudo, cuando dura entre una y tres semanas e insomnio crónico, cuando el trastorno prevalece por más de cuatro semanas22.
ARQUITECTURA DEL SUEÑO Y EL INSOMNIO.
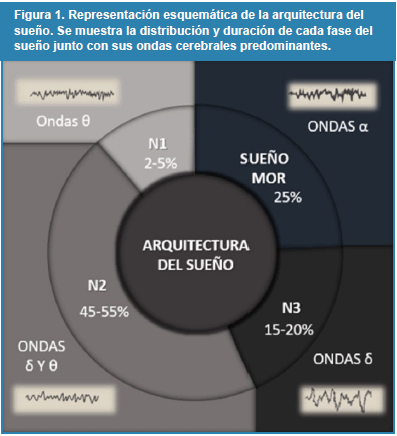
El sueño es un estado fisiológico activo en el que existe una disminución de la consciencia y en donde es posible identificar distintas actividades orgánicas que le son propias, como la disminución de la actividad eléctrica cerebral, el movimiento rápido de los ojos o la hipotonía/atonía muscular27,28. En este sentido, al considerar la progresiva expresión de estas actividades, es posible distinguir distintas etapas o fases durante el sueño, las cuales pueden ser diferenciadas mediante estudios polisomnográficos (electroencefalograma, electrooculograma y electromiograma)29. La descripción global de la organización básica de estas fases en el sueño normal es conocida como arquitectura del sueño30. De forma general, el sueño se divide en dos grandes fases: sueño sin movimientos oculares rápidos o sueño No MOR, que a su vez está estructurado por varias etapas, y sueño con movimientos oculares rápidos o sueño MOR (figura 1)31.
El sueño No MOR se caracteriza por la predominancia de hipotonía muscular, por la disminución de la excitabilidad sensorial y por mantenimiento de los reflejos autonómicos32. Comprende a su vez, tres fases:
1. Fase N1 (sueño superficial): esta fase se caracteriza por la disminución paulatina del tono muscular, por durar poco tiempo (2-5 % del tiempo total de sueño) y por la presencia de ondas con frecuencias mixtas, prevaleciendo las ondas theta (4–7Hz)29.
2. Fase N2 (sueño intermedio): ocupa el 45-50% del tiempo total del sueño en sujetos sanos y se caracteriza por la presencia de los husos del sueño y los complejos k, fenómenos que reflejan la actividad sincronizada entre la corteza cerebral y el tálamo. Durante este sueño predominan las ondas tipo theta aunque esporádicamente ya empiezan a aparecer las ondas delta (<4Hz), el tono muscular suele estar disminuido y no se evidencian movimientos oculares importantes27,33.
3. Fase N3 (sueño de ondas lentas o SOL): etapa en la que predominan las ondas tipo delta (<4 Hz) y la que se asocia con el descanso y recuperación corporal. El SOL se caracteriza por una marcada hipotonía muscular, en donde los movimientos oculares son menos frecuentes y tiene una duración del 15-20% del tiempo total del sueño27,32,33.
Por su parte, durante el sueño MOR las frecuencias y amplitudes de las ondas cerebrales aumentan a valores similares registrados en la vigilia (ondas alfa >13 Hz), por lo que a esta fase se le conoce también como sueño activo o paradójico. Esta fase tiene una duración aproximadamente del 20-25% del sueño y se caracteriza por eventos fásicos y eventos tónicos; entre los eventos fásicos se puede mencionar los movimientos oculares rápidos y las mioclonías distales, mientras que entre los eventos tónicos destaca la atonía muscular y la desincronización cortico-talámica27,29,32,33.
En el trascurso de una noche normal de sueño, el ciclo entre el sueño No MOR y el MOR se presenta 4-6 veces y cada uno de ellos tiene una duración aproximada de 60 a 90 minutos. Durante la primera mitad de la noche suele predominar el sueño No MOR a expensas del sueño de ondas lentas, mientras que en la segunda mitad de la noche predomina el sueño MOR, el cual solo alterna con la fase N2 del sueño No MOR (figura 2)32.
Al evaluar la macroestructura del sueño en el insomne, se observan diferencias en varios parámetros polisomnográficos al compararla con la del individuo normal. En este sentido, estudios han demostrado que las personas con insomnio crónico tienen una mayor latencia para la conciliación del sueño (hasta de 60 minutos), y un aumento en la duración de la fases N1 y N2 a expensas de un detrimento del sueño de onda lentas (fase N3), aunque la latencia y densidad del sueño MOR suele estar conservada. Además, el número de ciclos No MOR/ MOR suele disminuir a menos de 4 (figura 2)36,37.
MANEJO DEL INSOMNIO
El tratamiento del insomnio está orientado a mejorar la calidad del sueño del paciente, disminuyendo la latencia, el número de despertares nocturnos y proporcionando un sueño reparador de por lo menos 6 horas, lo que favorece un óptimo desempeño psicomotor diurno. En forma general, el tratamiento varía según la causa, tipo de insomnio y grado de afectación de la vida cotidiana. Es importante enfatizar que, antes de recurrir a las medidas farmacológicas, siempre se debe emplear el tratamiento no farmacológico, identificando los factores desencadenantes, tratando las enfermedades subyacentes y mejorando la higiene del sueño37.
Las medidas no farmacológicas del insomnio contribuyen a mejorar las condiciones ambientales y conductuales del paciente, como eliminar los elementos distractores o evitar la ingesta de alimentos y bebidas estimulantes. En este grupo se incluyen técnicas que forman parte de las terapias cognitivo- conductuales, dirigidas a resolver el factor predisponente al insomnio, siendo la higiene del sueño, la técnica de restricción del sueño, meditación, hipnosis, técnicas de relajación y la técnica conductual, solo algunas de las medidas más empleadas4,37.
Fármacos Hipnóticos
Existe gran variedad de fármacos y sustancias, tanto naturales como sintéticas, capaces de sedar o inducir el sueño en las personas, al actuar sobre distintos grupos nucleares o vías nerviosas responsables del sueño38,39, con distintos mecanismos de acción, efectos secundarios y efectos sobre la arquitectura del sueño. A continuación, se estudian las características más importantes de los hipnóticos disponibles en la actualidad.
1) Benzodiacepinas
Las benzodiacepinas son un grupo heterogéneo de fármacos que actúan como moduladores alostéricos positivos no selectivos de los suptipos ω1 (BZ1) y ω2 (BZ2) del receptor GABA-A, que facilitan su unión al neurotransmisor inhibidor ácido γ-aminobitírico (GABA), lo que incrementa la frecuencia de apertura del canal de cloro. El receptor pentamérico GABA-A está constituido por 5 subnidades proteicas (α,β,γ ) que a su vez poseen distintas isoformas, α1, α2, α3, que le confieren su actividad. El subtipo BZ1 del receptor GABA-A contiene las subunidades α1β1-3γ2, mientras que el suptipo BZ2 está conformado por las subunidades α2,3,5β1-3γ2 (figura 4). Los efectos ansiolíticos, anticonvulsivantes, sedativos, hipnóticos y miorrelajantes de las benzodiacepinas se deben a su acción sobre el sistema nervioso central, mientras que la vasodilatación coronaria y el bloqueo de la placa neuromuscular se deben a sus efectos a nivel periférico40-42.
En función del tiempo de vida media plasmática (t1/2), las benzodiacepinas se pueden clasificar en: las de acción corta, aquellas que poseen una vida media inferior a las 6 horas (triazolam, midazolam), las de acción intermedia son las que duran entre 6 y 24 horas (alprazolam) y las de acción larga son aquellas con una vida media superior a las 24 horas (Cuadro 1)4,43.
Distintos estudios han demostrado la eficacia a corto plazo de las benzodiacepinas para el tratamiento del insomnio. Estos hipnóticos disminuyen la latencia para el inicio del sueño, reducen el número de despertares nocturnos e incrementan el tiempo total de sueño, sin embargo, tienden a alterar la arquitectura del sueño aumentando la fase N2 del sueño No REM, disminuyendo el sueño de ondas lentas y el sueño REM a largo plazo (ver figura 2)4,22,38,44.
Por otra parte, el uso de este tipo de hipnóticos está relacionado con somnolencia diurna, vértigo, dolor de cabeza, retardo motor y cognitivo, desarrollo de tolerancia, dependencia física y psíquica, pérdida de la memoria (amnesia anterógrada)44,47, e inclusive a miocardiopatía de Takotsubo y catatonia, últimos efectos que pueden aparecer como consecuencia del síndrome de abstinencia que se produce con la interrupción brusca del tratamiento48.
2) Compuestos Z
La búsqueda de nuevos fármacos igualmente efectivos que las benzodiacepinas pero con menos efectos colaterales en caminó el desarrollo de una nueva generación de hipnóticos denominados compuestos Z: zaleplon, zolpidem, zoplicona, y el más reciente integrante del grupo, eszoplicona (enantiómero activo de zopiclona). Inicialmente, los compuestos Z se presentaron como hipnóticos prometedores que revolucionarían el tratamiento del insomnio, debido a su efectividad, baja incidencia de efectos adversos y su potencial reducido para dependencia y abuso. No obstante, con el auge de su uso a nivel mundial incrementaron los reportes de efectos adversos, llevando a la restricción de su uso, prescripción y disposición41.
En efecto, algunos estudios aseguran que estos hipnóticos son eficaces contra el insomnio y que poseen un perfil clínico más seguro al compararlo con sus predecesores5,39,49-51, mientras que otros estudios demuestran que no existe suficientes niveles de evidencias como para aseverar su seguridad21,52-56.
Al igual que las benzodiacepinas, estos compuesto poseen diferentes perfiles farmacológicos, teniendo solo en común su acción sobre el subtipo BZ1 de receptor GABA-A. En este sentido, los efectos sedativos de los compuestos Z se deben a su mayor afinidad por la subunidad α1, mientras que los escasos efectos ansiolíticos y relajantes se deben a su poca afinidad por las subunidades α2, α3 y α5 41.
En un sentido amplio, las drogas Z se caracterizan por ser absorbidas rápidamente por vía oral y por tener una vida media plasmática corta, lo que las hace ideales por reducir la latencia del sueño y disminuir los efectos residuales. Del grupo, la Zopiclona es la que tiene mayor latencia y vida media con potencial a efectos residuales, solo siendo superada por la Eszopiclona que tiene un metabolito activo que prolonga su vida media. Luego, le sigue el Zolpidem con una vida media de 2,5 horas aproximadamente y su inicio de acción es más rápido que la de Zopiclona. Finalmente, el Zaleplon es el compuesto Z con la latencia y vida media más corta, lo que hace de ella un hipnótico sin efecto residuales (ver cuadro 2)41,50,57.
Por otra parte, estudios polisomnográficos reflejan que las drogas Z muestran un mínimo impacto sobre las distintas fases del sueño y que, contrario a lo que se esperaría, tienden a mejorar la arquitectura del sueño en los insomnes22,46,49, aunque, algunos autores afirman que la fase N2 del sueño No MOR se ve alargada con el uso de estos compuestos4.
Si bien en general los compuestos Z son mejor tolerados que las BZD, los efectos adversos incluyen cefalea, mareos, vértigos, náuseas, astenia, trastornos de la percepción, diplopía, temblor y ataxia. Igualmente, tienden a causar efectos residuales relacionados con la memoria, cognición y parasomnias, pueden afectar el rendimiento psicomotor y causar depresión, alucinaciones y psicosis. Al igual que las BZD, se han reportado casos de tolerancia, dependencia y abusos a las drogas Z, especialmente con Zolpidem y Zopiclona22,41.
3) Antidepresivos
Algunos antidepresivos con acción hipnótica y sedativa pueden ser una segunda línea de tratamiento para el insomnio, particularmente, para aquellos pacientes insomnes crónicos y depresivos57. Entre los utilizados con mayor frecuencia están los tricíclicos, los agonistas e inhibidores selectivos de la recaptación de serotonina (ISRS) y los agentes atípicos (cuadro 3).
En el grupo de los tricíclicos, la amitriptilina, nortriptilina, doxepina y clomipramina, son las más efectivas para el tratamiento del insomnio, al mejorar la continuidad del sueño, acortar la latencia del sueño, disminuir los despertares nocturnos y al incrementar el tiempo total del sueño, no obstante, tienden a suprimir el sueño MOR58. Actualmente, este grupo de fármacos se indica con menor frecuencia debido a los efectos anticolinérgicos, riesgo de sobredosis, ganancia de peso, cardiotoxicidad a altas dosis y la tendencia a desarrollar tolerancia e insomnio de rebote59.
En relación a los ISRS, se ha comprobado que tienen un efecto negativo sobre la arquitectura del sueño, disminuyen la eficacia del sueño, incrementan los despertares nocturnos y exacerba los problemas asociados al insomnio, siendo el escitalopram la excepción del grupo58,60.
Por su parte, los antagonistas e inhibidores de la recaptación de serotonina, tienen un efecto regulador en el sueño. Así, la trazodona ha demostrado mejorar la calidad del sueño, incrementar el tiempo del sueño y la fase N3 del sueño No MOR, ofreciendo de esta forma un sueño restaurativo a los insomnes. Es importante destacar, que los efectos hipnóticos de la trazodona se consiguen a dosis menores que las necesarias para sus efectos como antidepresivo (Hipnótico: 50-150mg/ día vs. Antidepresivo: 300-600 mg/día). Entre sus efectos adversos cabe mencionar la hipotensión ortostática, somnolencia diurna, riesgo de arritmias, taquicardias, bradicardias y priapismo. Igualmente, la nefazodona mejora la eficacia del sueño, disminuye los despertares nocturnos y mejora la arquitectura del sueño con mínima somnolencia diurna y sin evidencia de efectos sobre el desempeño cotidiano59,61.
Finalmente, dentro del grupo de los antidepresivos atípicos, la mirtazapina es la que mayor importancia clínica tiene, debido a que es capaz de disminuir la latencia del sueño, mejorar la eficacia y promover el sueño continuo, además de incrementar el sueño de ondas lentas y la latencia del primer episodio MOR, sin embargo, este antidepresivo está asociado a somnolencia diurna excesiva y a ganancia de peso, lo que dificulta la adherencia al tratamiento. Los efectos hipnóticos y ansiolíticos de la mirtazapina se deben a su actividad como antagonista de los receptores pre-sinápticos α2 y de los receptores 5-HT2 y 5-HT3, aunque su relativa actividad antihistaminérgica (H1) podría explicar mejor sus efectos sedativos59,61.
4) Agonistas del receptor de melatonina
En este grupo se encuentran los fármacos con afinidad por los distintos receptores de melatonina (MT1, MT2 y MT3), como es el caso de la melatonina exógena, el ramelteón y la agomelatina. Los receptores melatoninérgicos se encuentra distribuidos en el núcleo suprequiasmático del hipotálamo, siendo el receptor MT1 el responsable de la inducción del sueño, mientras que el receptor MT2 está involucrado en la regulación del ritmo circadiano del ciclo vigilia-sueño62.
La melatonina ha demostrado inducir el sueño al atenuar los impulsos promotores del despertar en el núcleo suprequiasmático, no obstante, su eficacia es debatible. En este sentido, algunos estudios arrojan que la melatonina tiene buena eficacia al reducir la latencia e incrementar el tiempo del sueño63,64, mientras que otros ensayos no encuentra diferencias estadísticamente significativas al compararla con el placebo65,66. De ahí que, el uso de la melatonina como hipnótico está limitado a altercaciones del ritmo circadiano, en los casos de ancianos con insuficiencia de la glándula pineal y en personas ciegas sin percepción de la luz67,68.
El ramelteón es un potente agonista selectivo de los receptores MT1 y MT2, sin afinidad por los receptores benzodiazepinicos, dopaminérgicos o serotoninérgicos. Su uso está asociado con disminución de la latencia y aumento del tiempo total de sueño, incremento de la fase N3 del sueño No MOR y del sueño MOR, no muestra riesgo de abuso ni efectos motores o cognitivos. Dolores de cabeza, somnolencia, fatiga, nausea y vómitos son alguno de los efectos adversos más comunes. Durante su uso es recomendado el control de los niveles séricos de prolactina y testosterona, debido a que tiene potencial de incrementar los niveles de estas hormonas38,69,70.
Otro potente agonista de los receptores MT1 y MT2, la agomelatina, que adicionalmente es antagonista del receptor serotoninégico 5-HT2c, es un compuesto relacionado estructuralmente a la melatonina. Ha demostrado mejorar la calidad del sueño influyendo positivamente sobre las fases del sueño, favoreciendo el sueño reparador y la alerta diurna, y a diferencia de otros antidepresivos inhibidores de la recaptación de monoaminas, la agomelatina no reduce el sueño MOR en pacientes depresivos ni en personas sanas (cuadro 4)71,72.
5) Antihistamínicos
Actualmente, se conocen tres subtipos de receptores histaminérgicos: H1, H2 y H3. En el sistema nervioso central, la histamina actúa como un neurotransmisor excitador al unirse al receptor H1, sustrato sobre el que actúan los fármacos antihistamínicos como la difenhidramina y la doxilamina, produciendo así su efecto sedativo. Evidencia acerca de su eficacia sobre el insomnio y seguridad es escasa, aunque se conoce el riesgo potencial de efectos adversos en ancianos (cuadro 4). Su uso está asociado a somnolencia diurna, alteraciones psicomotoras, delirium, tolerancia con uso repetido, mareos, mucosas resecas, visión borrosa, retención urinaria, estreñimiento entre otros efectos anticolinérgicos38,57,73.
6) Valeriana
La valeriana (Valeriana officinalis) es una planta perenne nativa de Europa y Asia, a la que se le ha atribuido efectos sedativos desde los tiempos de Hipócrates. El mecanismo de acción aún sigue siendo desconocido, aunque se ha propuesto su acción como agonista gabaérgico o su posible efecto a través de la actividad agonista sobre el receptor de adenosina (A1) y receptores 5-HT5a 74-76. Su uso no es recomendado para el insomnio agudo debido a que tarda de 2 a 4 semanas en ejercer su efecto hipnótico57 (cuadro 4).
Un meta-análisis de ensayos clínicos que evaluaban los efectos de la valeriana sobre la calidad y latencia del sueño, demostró que este fitofármaco puede ser efectivo para el mejoramiento subjetivo del insomnio, aunque esta eficacia no fue demostrada cuantitativamente o a través medidas objetivas77. En contraposición, una reciente revisión sistemática de estudios sobre el empleo de hierbas medicinales como hipnóticos, arrojó que la valeriana no era más eficaz que el placebo para el mejoramiento del insomnio, además, asoció algunos efectos secundarios indeseados a su uso78.
Nuevos fármacos hipnóticos
1) Moduladores del receptor GABA-A.
El lorediplon se trata de un nuevo hipnótico no benzodiacepínico de acción prolongada que actúa como modulador del receptor GABA-A. En un estudio de Fase I realizado con 34 hombres sanos, demostró beneficios clínicos dosis-dependientes, buena tolerancia y ningún efecto adverso luego de 13 horas de la administración. A dosis de 5 y 10 mg de lorediplon se incrementa el tiempo total de sueño y disminuyen significativamente los despertares nocturnos, además, incrementa la fase N2 y N3 del sueño No MOR en la segunda mitad de la noche79.
El EVT-201 (Evotec) es un modulador alostérico positivo parcial del receptor GABA-A que ha sido evaluado en dos estudios concluidos de Fase II, demostrando a dosis de 1,5 y 2,5 mg un incremento del tiempo total del sueño, reducción de despertares nocturnos y de latencia del sueño, buena tolerancia y sin ningún efecto adverso serio o inesperado. Asimismo, ambas dosis demostraron mejorar la calidad y eficacia del sueño medidas subjetivamente, lo que hace de este hipnótico una buena medida para el insomnio primario en adultos y ancianos80,81.
2) Antagonistas del receptor de orexina
En marco de la teoría de que al disminuir la actividad de la orexina debería promoverse efectos hipnóticos, es desarrollado el primer antagonista dual de los receptores 1 y 2 de la orexina, Almorexant (ACT-078573), para el tratamiento del insomnio primario. Distintos estudios preclínicos y ensayos clínicos en Fase I han demostrado que este compuesto disminuye el estado de alerta y aumenta la somnolencia en animales y humanos al administrarlos durante la fase activa del ciclo circadiano. Dosis matutinas de almorexant fueron bien toleradas, sin efectos en el estado de ánimo, tranquilidad, percepción subjetiva interna y externa o sensación de flotar, sin embargo, somnolencia diurna, fatiga, náuseas y dolores de cabezas fueron frecuentemente reportadas, al igual que debilidad muscular a altas dosis82-84.
En un estudio de Fase II, el filorexant (MK-6096), antagonista del receptor de orexina, demostró mejorar la eficacia del sueño y tener buena tolerancia en pacientes adultos con insomnio. Al compararse con el placebo, todas las dosis de filorexant (2,5/5/10/20 mg) mejoraron el sueño de los sujetos al medir la eficacia del sueño y el estado de vigilia luego de un sueño persistente85.
3) Agonista del receptor de melatonina/serotonina 5-HT1A
a piromelatina (Neu-P11) es nuevo hipnótico desarrollado para el insomnio primario y secundario. Se trata de un agonista multimodal del receptor de melatonina y de los receptores serotoninérgicos 5-HT1A y 5-HT1D. Estudios en Fase I y II han demostrado que la piromelatina tiene buena absorción, distribución y buena tolerabilidad. En este sentido, dosis de 20 y 50 mg de piromelatina mejoran la eficacia del sueño, el tiempo total de sueño y disminuye el número de despertares nocturnos, mientras que la ausencia de efectos psicomotor y de detrimentos en la arquitectura del sueño, le confiere un perfil clínico seguro86.
¿EXISTE EL HIPNÓTICO IDEAL?
En general, el insomnio es un trastorno del sueño que debe ser tratado en función de su origen etiológico, siempre considerando como primera opción a las medidas no farmacológicas, y en caso de cronicidad o presencia de comorbilidades, se recurrirá a la indicación de hipnóticos. Debido a sus efectos secundarios y a los problemas de seguridad clínica que conlleva su uso, nunca deben utilizarse como terapia única en el tratamiento del insomnio67.
El concepto de hipnótico ideal ha sido la base sobre la cual se han desarrollo nuevos fármacos somníferos con mayor seguridad y eficacia, hecho que se puede comprobar al comparar las propiedades y efectos de los hipnóticos de primera generación (barbitúricos) y de segunda generación (benzodiacepinas) con los de tercera generación (compuestos Z)87. Ahora bien, ¿cuáles son las características del hipnótico ideal? En un sentido amplio, es aquel fármaco hipnótico de acción rápida, que promueve un sueño de calidad durante toda la noche y sin efectos residuales al día siguiente, entre otras características descritas en el cuadro 5 67.
A pesar de que la idea de un hipnótico ideal es realmente atractiva y su existencia implicaría un avance extraordinario en la terapéutica del insomnio, de acuerdo a lo analizado en los apartados anteriores, resulta evidente que todavía no se ha diseñado el fármaco que cumpla con todas las características descritas (cuadro 6). Por tal razón, al momento de indicar un hipnótico se debe tener en cuenta las necesidades del paciente y las características del fármaco, para perfilar así la terapéutica farmacológica ideal en esa persona. Independientemente del agente a utilizar, siempre se debe comenzar con la dosis mínima eficaz, se debe administrar máximo media hora antes de acostarse a dormir, se recomienda utilizarlos durante 3 o 4 semanas como máximo y es trascendental tener prudencia al momento de indicarlos en niños, adolescentes, ancianos, embarazadas y pacientes con comorbilidades como ansiedad, depresión, adicción y daño hepático22,23.
UN HIPNÓTICO IDEAL PARA CADA INSOMNIO.
En función de las propiedades farmacológicas y de las características principales del hipnótico ideal, se describen los hipnóticos empleados en cada tipo de insomnio, ya sea según su duración, según el momento de la noche en que aparece, o según las situaciones especiales en que puede surgir este trastorno (Cuadro 7). A pesar de que la nueva generación de hipnóticos resulta prometedora en los ensayos clínicos iniciales, no son considerados en este apartado, debido a la falta de estudios a gran escala que demuestren su eficacia y seguridad. Una vez más, se advierte la importancia de tratar al insomnio con medidas no farmacológicas, que usualmente resuelven los casos agudos o transitorios. De hecho, se ha comprobado que la combinación de medidas farmacológicas y no farmacológicas, produce resultados beneficiosos y duraderos55.
Tratamiento para el insomnio según su duración
En el caso del insomnio transitorio y en el agudo, se puede indicar benzodiacepinas de acción corta como lormetazepam, midazolam o triazolam, a dosis bajas durante unas tres noches (transitorio) hasta máximo dos semanas (agudo), siempre y cuando las medidas no farmacológicas no resuelven la situación. Por su parte, en el insomnio crónico se indican benzodiacepinas de acción más larga como alprazolam, lorazepam o temazepam si está asociado a ansiedad diurna o despertar precoz, mientras que si hay somnolencia diurna se recomienda el uso de BZD de acción corta. Igualmente, se recomienda administrarlo en periodos cortos de tiempo como tratamiento complementario a las medidas no farmacológicas37,45,47.
Tratamiento para el insomnio según el momento de la noche en que aparece
Básicamente, en estos tipos de insomnios se suelen utilizar los compuestos Z debido a su rápida acción, siempre y cuando la sintomatología no tenga una duración mayor de 3 semanas. Así, Zaleplon está indicada para el insomnio de conciliación debido a su ultra rápida acción y corta vida media, mientras que el Zolpidem está indicado en pacientes con insomnio de mantenimiento o de despertar precoz, ya que ejerce su acción rápidamente y su vida media ronda las 6 horas. En caso de insomnio de conciliación o de mantenimiento que tienden a la cronicidad, se prefiere el empleo de BZD, siguiendo el protocolo anteriormente explicado88,89.
Tratamiento del insomnio en casos especiales
En niños y adolescentes
El insomnio en niños y adolescentes, usualmente está relacionado con deficiencias de higiene del sueño o trastornos del ritmo circadiano, aunque en ocasiones puede presentarse como comorbilidad de desórdenes psiquiátricos o neurológicos como ansiedad, depresión, trastorno de déficit de atención, autismo o epilepsia, por lo que resulta imperante la determinación de agente causal del insomnio antes de indicar cualquier medida farmacológica. En este sentido, la terapéutica en estos grupos etarios está orientada a la implementación de rutina de higiene del sueño y técnicas conductuales, y solo en caso particulares, se indicará tratamiento farmacológico90.
El uso de hipnótico en niños y adolescentes, está basado más en la experiencia clínica y empírica que en evidencias científicas, de hecho, ningún somnífero ha sido aprobado para su uso en niños. Las benzodiacepinas, son el principal hipnótico indicado en niños con problemas neuropsiquiátricos, con efectos beneficioso y adversos similares a los observado en el adulto, solo que se administra a dosis dependientes de la edad. Del grupo de las drogas Z, el Zolpidem y Zaleplon son las más indicadas en individuos mayores de 12 años, a dosis de 5-10mg antes de irse a dormir. Igualmente, se ha reportado el uso de antidepresivos tricíclicos, de melatonina y agentes antihistaminérgicos91.
En ancianos
En general, los casos crónicos son el tipo de insomnio más común en este grupo etario. En ellos, los efectos adversos se potencian debido a la disminución de la tasa de eliminación y aumento de distribución corporal del fármaco, por lo que es importante evaluar las dosis a utilizar, además de las comorbilidades para elegir el tipo de hipnótico. Se recomienda el uso de benzodiacepinas de acción intermedia como lorazepam, a dosis de 0,5-1mg/día, o bien se pueden indicar alguna de las drogas Z (zolpidem, Zaleplon) o Ramelteon, siempre teniendo en cuenta empezar el tratamiento con la menor dosis efectiva posible37,92,93.
En depresivos
Frecuentemente, el insomnio se presenta como una comorbilidad en pacientes depresivos, o bien, la depresión puede presentarse como consecuencia del insomnio. En cualquier de los casos, el uso de antidepresivos con efectos sedativos está indicado en estos pacientes, siendo mirtazapina la de elección, administrándose entre 7,5-30 mg/noche. A pesar de sus potenciales efectos adversos, la trazodona es el antidepresivo más usado en el tratamiento del insomnio, en dosis que van desde los 25 hasta los 150 mg/noche4,58,59.
En embarazadas
Es común que pacientes embarazadas presenten dificultades para iniciar o mantener el sueño, sobre todo durante las últimas semanas de gestación. Usualmente, para tratar estos problemas se recomienda el uso de medida no farmacológicas como la terapia cognitivo conductual, el ejercicio y la meditación94.
Una revisión realizada sobre 16 estudios en el 201495, arroja que no fueron observado malformaciones congénitas o riesgo significativo de malformaciones con el uso de hipnóticos. No obstante, si se evidenció un aumento en el riesgo de partos prematuros, cesáreas e infantes con bajo peso/talla al nacer con el uso de benzodiacepinas y de agonistas del receptor benzodiacepínico96,97. Igualmente, arrojó que antidepresivos y antihistamínicos utilizados durante el embarazo, no produjeron efectos adverso significativos en la madre o en el niño98,99. Estudios epidemiológicos y ensayos clínicos de mayor envergadura son necesarios para corroborar tales observaciones, por lo que no se recomienda el uso de estos fármacos en mujeres gestantes.
Conclusión
A pesar de los avances que la terapéutica del insomnio ha tenido durante los últimos años, todavía no se ha logrado diseñar el hipnótico ideal, que si bien es cierto, las drogas de tercera generación son lo más cercana al gold estándar, todavía no cumplen con el 100% de las características que debe reunir el hipnótico idóneo. Los nuevos fármacos en desarrollo resultan prometedores, ya sea por su acción sobre distintos circuitos neurales o por su mayor especificidad a determinados receptores (disminuyendo el abanico de efectos secundarios), por lo que es necesario el diseño de ensayos clínicos a mayor escala que comparen su eficacia con los hipnóticos de referencia actual.
Finalmente, la selección de un hipnótico dependerá de los distintos factores implicados en la terapéutica, ya sean los propios del fármaco o los del paciente, es decir, se puede afirmar que existe un hipnótico ideal para cada insomne, que según su sintomatología (latencia de sueño aumentada, despertares nocturnos frecuentes, somnolencia diurna excesiva, etc) y las características farmacocinéticas del hipnótico (tiempo de acción, vida media, efectos adversos, etc.), abre el camino para la indicación de una terapéutica farmacológica personalizada, recordando acompañarla con las medidas no farmacológicas.
Referencias
1.- American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders: DSM-5. 5.a ed. Washington: American Psychiatric Association; 2013. [ Links ]
2.- State of the Sciencie Conference Statetment NIH. On manifestations and management of chronic insomnia in adults. NIH Consens State Sci Statements. 2005; 22:1-30. [ Links ]
3.- Morin Charles M., Denise C. Jarrin. Epidemiology of Insomnia Prevalence, Course, Risk Factors, and Public Health Burden. Sleep Med Clin. 2013; 8:281–297. [ Links ]
4.- Contreras A. Insomnio: generalidades y alternativas terapéuticas de última generación. Rev. Med. Clin. CONDES. 2013; 24(3): 433-441. [ Links ]
5.- Fernández O, López F, Villarín A, Tena J, Morales M, Rodriguez C. Tratamiento del insomnio. Boletin Farmacoterapeutico de Castilla La Mancha. 2010; 11(1). [ Links ]
6.- Ka-Fai C, Wing-Fai Y, Fiona Yan-Yee H, Kam-Ping Y, Yee-Man Y, Chi-Wa K. Cross-cultural and comparative epidemiology of insomnia: the Diagnostic and Statistical Manual (DSM), International Classification of Diseases (ICD) and International Classification of Sleep Disorders (ICSD). Sleep Medicine 16 (2015) 477–482. [ Links ]
7.- Ohayon M. Epidemiology of insomnia: what we know and what we still need to learn. Sleep Med Rev 2002;6:97–111. [ Links ]
8.- Menezes AM, Perez-Padilla R, Jardim JR, et al. Chronic obstructive pulmonary disease in five Latin Americancities (the PLATINO study): a prevalence study. Lancet. 2005;366:1875-1881. [ Links ]
9.- Kryger, M. History of sleep medicine and physiology. In: Kruger M, Avidan A. Berry R. Atlas of Clinical Sleep Medicine: Expert Consult-Online. 2 ed. Elsevier Health Sciences; 2013. p. 8-19. [ Links ]
10.- Mosbys medical, nursing, and allied health dictionary. 9th ed. St. Louis: Mosby; 2011. Hipnótico; p. 706. [ Links ]
11.- Barros J. Tranquilizantes benzodiazepínicos: ¿instrumento de cura o de medicalización?. AIS-Bol. 1999; 14(16): 33-37. [ Links ]
12.- Sourkes TL. Early clinical neurochemistry of CNS-active drugs. Chloral hydrate. Mol Chem Neurophath 1992;17:21-30. [ Links ]
13.- Balme R. Early medicinal uses of bromides. J R Coll Phys 1976;10:205-8. [ Links ]
14.- Willis G, Arendt E. Relative efficacy of sodium amytal, chloral hydrate and dichloralphenazone. Canad. M. A. J. 1954;71:126-128. [ Links ]
15.- Campo M, Albiñama M, Ferrari J, Herreros A. Utilización del hidrato de cloral en pediatría. Usos clínicos, preparaciones calénicas y experiencia en un hospital. Farm Hosp. 1999; 23(3):170-175. [ Links ]
16.- Sierra JC, Martín J, Poveda J. Efectos de una dosis de diazepam sobre el estado emocional en una muestra no clínica. Psicología y Salud, 2003; 13(1):103-110. [ Links ]
17.- Doghramji PP. Trends in the pharmacological management of insomnia. J Clin Psychiatry. 2006;67(13):5-8. [ Links ]
18.- Ebert B, Wafford KA, Deacon S. Treating insomnia: current and investigational parmacological approaches. Pharmaco Ther. 2006;112(3):612-629. [ Links ]
19.- Harrison N. Mechanisms of sleep induction by GABAA receptor agonists. J Clin Psychiatry. 2007; 68(suppl 5):6-12. [ Links ]
20.- Jufe GS. Nuevos hipnóticos: perspectivas desde la fisiología del sueño. Rev. Arg. de Psiquiat. 2007;18:294-299. [ Links ]
21.- Siriwardena AN, Qureshi MZ, Dyas JV, Middleton H, Orner R. Magic bullets for insomnia? Patients use and experiences of newer (Z drugs) versus older (benzodiazepine) hypnotics for sleep problems in primary care. Br J Gen Pract 2008; 58: 417–422. [ Links ]
22.- López F, Fernández O, Maraque MA, Fernández L. Abordaje terapéutico del insomnio. Semergen. 2012;38(4):233-240. [ Links ]
23.- Buysse D. Insomnia. JAMA. 2013; 309(7): 706-716. [ Links ]
24.- Morin Charles M., Benca Ruth. Chronic insomnia. Seminar. Lancet 2012; 379:1129–41. [ Links ]
25.- Durand–Arias So, Rojas-Avila Cynthia, Jimenez-Genchi Alejandro. Evaluación clínica de los síntomas relacionados con el dormir. Psiquis. (Mexico) 2011; 20 (1):17-22. [ Links ]
26.- M. Singh, CL Drake. Insomnio comorbido con condiciones medicas. Assessment, Methodology, Training, and Policies of Sleep. Encyclopedia of Sleep.2013:1;236-238. [ Links ]
27.- Contreras A. Sueño a lo largo de la vida y sus implicaciones en salud. Rev. Med. Clin. CONDES. 2013; 24(3): 341-349. [ Links ]
28.- Aguirre-Navarrete R. Bases anatómicas y fisiológicas del sueño. Rev. Ecuat. Neurol. 2007;15 (2). [ Links ]
29.- Wickboldt AT, Bowca AF, Kaye AI, Kaye AM, Rivera F, Kaye AD. Sleep physiology, abnormal states and therapeutic interventions. The Ochsner Journal, 2012; 12(2): 122-134. [ Links ]
30.- Colten H, Altevogt B (2006) Sleep Disorders and Sleep Deprivation: An Unmet Public Health Problem. Institute of Medicine (US) Committee on Sleep Medicine and Research. Washington (DC): National Academies Press (US). [ Links ]
31.- American Academy of Sleep Medicine. The AASM manual 2007 for the scoring of sleep and associated events rules, terminology and technical specifications. Westchester, IL. American Academy of Sleep Medicine; 2007. [ Links ]
32.- Ocampo-Garcés A, Castro J, Espinoza D. Mecanismos neuronales en el control del dormir. Rev Hosp Clin Univ Chile. 2012; 23: 5-12. [ Links ]
33.- Talero-Gutiérrez C, Durán-Torres F, Pérez I. Sueño: características generales. Patrones fisiológicos y fisiopatológicos en la adolescencia. Rev Cienc Salud. 2013;11(3):333-48. [ Links ]
34.- Reynolds C, Taska L, Sewitch D, Restifo K, Coble P, Kupfer D. Persistent psychophysiologic insomnia: Preliminary research diagnostic criteria and EEG sleep data. Am J Psychiurry. 1984; 141(6):804-805. [ Links ]
35.- Hudson J, Pope H, Sullivan L, Waternaux C, Keck P, Broughton R. Good Sleep, ad Sleep: A Meta-Analysis of Polysomnographic Measures in Insomnia, Depression, and Narcolepsy. BIOL PSYCHIATRY. 1992;32:958-975. [ Links ]
36.- Hoffmann R, Paterok B, Müller T, Becker-Carus C. Patients of an ambulatory sleep center--critical variables of insomniacs. Wien Med Wochenschr. 1995;145(17-18):478-80. [ Links ]
37.- Rius R, Gironella D. Tratamiento Farmacológico del Insomnio. Butlletí dinformació terapèutica del Departament de Salut de la Generalitat de Catalunya, 2009; 21(2): 7-12. [ Links ]
38.- Tariq S., Pulisetty S. Pharmacotherapy for insomnia. Clin Geriartr med. 2008; 24: 93-105. [ Links ]
39.- Sanger D. The Pharmacology and Mechanisms of Action of New Generation, Non-Benzodiazepine Hypnotic Agents. CNS Drugs. 2004; 18 (1): 9–15. [ Links ]
40.- Diaz MA, Pareja J. Tratamiento del insomnio. Inf Ter Sist Nac Salud. 2008; 32(4): 116-122. [ Links ]
41.- Gunja N. The Clinical and Forensic Toxicology of Z-drugs. J. Med. Toxicol. 2013; 9(2):155-162. [ Links ]
42.- Verster JC, Veldhuijzen DS, Volkerts ER. Residual effects of sleep medication on driving ability. Sleep Med Rev 2004; 8(4):309–325. [ Links ]
43.- Preskorn SH. A way of conceptualizing benzodiazepins to guide. Journal of Psychiatric Practice, 2015; 21(6):436-441. [ Links ]
44.- Cano J, Garcìa J. Insomnio: enfoque diagnòstico y terapéutico. IATREIA. 2005;18(1): 60-70. [ Links ]
45.- Holbrook AM, Crowther R, Lotter A, Cheng C, King D. Meta-analysis of benzodiazepine use in the treatment of insomnia. CMAJ. 2000;162(2):225–33. [ Links ]
46.- Grupo de Trabajo de la Guía de Práctica Clínica para el Manejo de Pacientes con Insomnio en Atención Primaria. Guía de Práctica Clínica para el Manejo de Pacientes con Insomnio en Atención Primaria. Plan de Calidad para el Sistema Nacional de Salud del Ministerio de Sanidad y Política Social. Unidad de Evaluación de Tecnologías Sanitarias. Agencia Laín Entralgo. Comunidad de Madrid. Ed. Ministerio de Ciencia e Innovación, Ciempozuelos (Madrid) 2009. Guías de Práctica Clínica en el SNS:UETS N. 2007/5-1. [ Links ]
47.- Rienmann D, Perliz M. The treatments of chronic insomnia: A review of benzodiazepine receptor agonists and psychological and behavioral therapies. Sleep Medicine Reviews, 2009; 13: 205–214. [ Links ]
48.- Peng T, Patchett N, Bernard S. Takotsubo Cardiomyopathy and Catatonia in the Setting of Benzodiazepine Withdrawal. Case Reports in Cardiology. Volume 2016, Article ID 8153487, 3 pages. dx.doi.org/10.1155/2016/8153487. [ Links ]
49.- Hausken A, Furu K, Skurtveit S, Engeland A, Bramness J. Starting insomnia treatment: the use of benzodiazepines versus z-hypnotics. A prescription database study of predictors. Eur J Clin Pharmacol 2009; 65:295–301. [ Links ]
50.- Quera-Salva M, McCann C, Boudet J, Frisk M, Borderies P, Meyer P. Effects of zolpidem on sleep architecture, night time ventilation, daytime vigilance and performance in heavy snorers. Br J clin Pharmac 1994; 37: 539-543. [ Links ]
51.- Cirignotta F, Mondini S, Zucconi M, Gerardi R, Farolfi A, Lugaresi E. Zolpidempolysomnographic study of the effect of a new hypnotic drug in sleep apnea syndrome. Pharmac Biochem Behav 1988; 29: 807-809. [ Links ]
52. Mahoney JE, Webb MJ, Gray SL. Zolpidem prescribing and adverse drug reactions in hospitalized general medicine patients at a Veterans Affairs hospital. Am J Geriatr Pharmacother 2004; 2(1): 66-74. [ Links ]
53.- Hoffmann F. Benefits and risks of benzodiazepines and Z-drugs: comparison of perceptions of GPs and community pharmacists in Germany. GMS Ger Med Sci. 2013;11:Doc10. DOI: 10.3205/000178, URN: urn:nbn:de:0183-0001780. [ Links ]
54.- Kripke DF. Greater incidence of depression with hypnotic use than with placebo. BMC Psychiatry 2007; 7: 42. [ Links ]
55.- Qaseem A, Kansagara D, Forciea M, Cooke M, Denberg T. Management of Chronic Insomnia Disorder in Adults: A Clinical Practice Guideline From the American College of Physicians. Ann Intern Med. 2016;165(2):1-9. doi:10.7326/ M15-2175. [ Links ]
56.- Pompeia S, Lucchesi LM, Bueno OF, et al. Zolpidem and memory: a study using the process-dissociation procedure. Psychopharmacology (Berl). 2004; 174(3): 327–333. [ Links ]
57.- Goa KL, Heel RC. Zopiclone. A review of its pharmacodynamic and pharmacokinetic properties and therapeutic efficacy as an hypnotic. Drugs 1986; 32:48–65. [ Links ]
58.- Gursky J, Krahn L. The Effects of Antidepressants on Sleep: A Review. Harvard Rev Psychiatry. 2000; 8(6): 298-306. [ Links ]
59.- Holshoe J. Antidepressants and Sleep: A Review. Perspectives in Psychiatric Care, 2009; 45(3): 191-197. [ Links ]
60.- Winokur A, Gary K, Rodner S, Rae-Red C, Fernando A, Szuba M. Depression, Sleep Physiology, and Antidepressant Drugs. Depression and Anxiety, 2001; 14:19–28. [ Links ]
61.- McCall C, McCall W. What Is the Role of Sedating Antidepressants, Antipsychotics, and Anticonvulsants in the Management of Insomnia?. Curr Psychiatry Rep. 2012; 14:494–502. [ Links ]
62.- Hirai K, Kita M, Ohta H, et al. Ramelteon (TAK-375) accelerates reentrainment of circadian rhythm after a phase advance of the light-dark cycle in rats. J Biol Rhythms 2005;2027-37. [ Links ]
63.- Zhdanova IV, Wurtman RJ, ReganMM, et al. Melatonin treatment for age-related insomnia. J Clin EndocrinolMetab 2001;86(10):4727–30. [ Links ]
64.- Brzezinski A, Vangel MG, Wurtman RJ, et al. Effects of exogenous melatonin on sleep a meta-analysis. Sleep Med Rev 2005;941-50. [ Links ]
65.- Montes LGA, Ontiveros Uribe MP, Cortes Sotres J. Treatment of primary insomnia with melatonin a double-blind, placebo-controlled, cross-over study. J Psychiatry Neurosci 2003;286. [ Links ]
66.- Singer C, Tractenberg RE, Kaye J, et al. Amulticenter, placebo-controlled trial of melatonin for sleep disturbance in Alzheimers disease. Sleep 2003;26(7):893– 901. [ Links ]
67.- Escobar F, Echeverry J, Lorenzana P. Tratamiento farmacológico del insomnio 2ª parte. Rev Fac Med UN Col. 2001; 49(3): 147-154. [ Links ]
68.- Ioachimescu O, El-Solh A. Pharmacotherapy of insomnia. Expert Opin. Pharmacother. 2012; 13(9):1243-1260. [ Links ]
69.- Liu J, Wang L. Ramelteon in the treatment of chronic insomnia: systematic review and meta-analysis. Int J Clin Pract. 2012; 66(9): 867–873. [ Links ]
70.- Pandi-Perumal S, Warren D, Verster J, Srinivasan V, Brown G, Cardinali D, et al. Pharmacotherapy of Insomnia with Ramelteon: Safety, Efficacy and Clinical Applications. Journal of Central Nervous System Disease, 2011;3:51–65. [ Links ]
71.- Demyttenaere K. Agomelatine a narrative review. Eur Neuropsychopharmacol. 2011;21(4): S703-9. [ Links ]
72.- Leproult R, Van Onderbergen A, LHermite-Baleriaux M, et al. Phase-shifts of 24-h rhythms of hormonal release and body temperatura following early evening administration of the melatonin agonist agomelatine in healthy older men. Clin Endocrinol 2005;63:298-304. [ Links ]
73.- Zisapel N. Drugs for insomnia. Expert Opin. Emerging Drugs [Early Online]. DOI: 10.1517/14728214.2012.690735. [ Links ]
74.- Santos MS, Ferreira F, Cunha AP, et al. Synaptosomal GABA release as influenced by valerian root extract-involvement of the GABA carrier. Arch Int Pharmacodyn Ther 1994;327:220–31. [ Links ]
75.- Dietz BM, Mahady GB, Pauli GF, et al. Valerian extract and valerenic acid are partial agonist of the 5 HT [5a] receptors in vitro. Brain Res 2005;138:191–7. [ Links ]
76.- Schumacher B, Scholle S, Holzl J, et al. Lignans isolated from valerian: identification and characterization of a new olivil derivative with partial agonistic activity at A [1] adenosine receptors. J Nat Prod 2002;65:1479–85. [ Links ]
77.- Fernández M, Masa R, Palacios L, Sancho P, Calbó C, Flores G. Effectiveness of Valerian on insomnia: A meta-analysis of randomized placebo-controlled trials. Sleep Medicine, 2010; 11: 505–511. [ Links ]
78.- Leach M, Page A. Herbal medicine for insomnia: A systematic review and metaanalysis. Sleep Medicine Reviews, 2015; 24: 1-12. [ Links ]
79.- Horoszok L, Baleeiro T, DAniello F, Gropper S, Santos B, Guglietta A, et al. A single-dose, randomized, double-blind, double dummy, placebo and positivecontrolled, five-way cross-over study to assess the pharmacodynamic effects of lorediplon in a phase advance model of insomnia in healthy Caucasian adult male subjects. Hum. Psychopharmacol Clin Exp. 2014; 29: 266–273. [ Links ]
80.- Walsh J, Thacker S, Knowles L, Tasker T, Hunneyball I. The partial positive allosteric GABAA receptor modulator EVT 201 is efficacious and safe in the treatment of adult primary insomnia patients. Sleep Medicine, 2009; 10: 859–864. [ Links ]
81.- Walsh J, Salkeld L, Knowles L, Tasker T, Hunneyball I. Treatment of elderly primary insomnia patients with EVT 201 improves sleep initiation, sleep maintenance, and daytime sleepiness. Sleep Medicine, 2010;11:23–30. [ Links ]
82.- Sukys L, dos Santos W, Tufik S, Poyares D. Novos sedativos hipnóticos. Revista Brasileira de Psiquiatria, 2010;32(3): 288-293. [ Links ]
83.- Hoever P, Hay J, Rad M, Cavallaro M, Van Gerven J, Dingemanse J. Tolerability, Pharmacokinetics, and Pharmacodynamics of Single-Dose Almorexant, an Orexin Receptor Antagonist, in Healthy Elderly Subjects. J Clin Psychopharmacol. 2013;33(3): 363-370. [ Links ]
84.- Neubauer D. Almorexant, a dual orexin receptor antagonist for the treatment of insomnia. Curr Opin Investig Drugs. 2010 Jan;11(1):101-10. [ Links ]
85.- Connor K, Mahoney E, Jackson S, Hutzelmann J, Zhao X, Jia N, et al. A Phase II Dose-Ranging Study Evaluating the Efficacy and Safety of the Orexin Receptor Antagonist Filorexant (MK-6096) in Patients with Primary Insomnia. International Journal of Neuropsychopharmacology, 2016; 1–10. [ Links ]
86.- Zisapel N. Current Phase II investigational therapies for insomnia. Expert Opin. Investig. Drugs. 2014; 24(4): 1-11. [ Links ]
87.- Ma Y, Dong M, Mita C, Sun S, Peng CK, Yang A. Publication analysis on insomnia: how much has been done in the past two decades?. Sleep Medicine, 2015;16:820–826. [ Links ]
88.- Nissen C, Frase L, Hajak G, Wetter TC. Hypnotika – Stand der Forschung. Nervenarzt. 2014; 85(1):67–76. [ Links ]
89.- Lie J, Tu K, Shen D, Wong B. Pharmacological Treatment of Insomnia. P & T. 2015; 40 (11):759-771. [ Links ]
90.- Nunes ML, Bruni O. Insomnia in childhood and adolescence: clinical aspects, diagnosis, and therapeuticapproach. J Pediatr (Rio J). 2015;91:S26-35. [ Links ]
91.- Meltzer L, Mindell J. Systematic Review and Meta-Analysis of Behavioral Interventions for Pediatric Insomnia. Journal of Pediatric Psychology, 2014; 39(8):932–948. [ Links ]
92.- Glass J, Lanctôt KL, Herrmann N, Sproule BA, Busto UE. Sedative hypnotics in older people with insomnia: meta-analysis of risks and benefits. BMJ. 2005;331:1169-73. [ Links ]
93.- Krystal AD. A compendium of placebo-controlled trials of the risks/benefits of pharmacological treatments for insomnia: The empirical basis for U.S. clinical practice. Sleep Medicine Reviews, 2009;13: 265–274. [ Links ]
94.- Stremler R, Hodnett E, Lee K, et al. A behavioral-educational intervention to promote maternal and infant sleep: a pilot randomized, controlled trial. Sleep 2006;29:1609-15. [ Links ]
95.- Okun M, Ebert R, Saini B. A review of sleep-promoting medications used in pregnancy. Am J Obstet Gynecol. 2015; 428-441. [ Links ]
96.- Wikner BN, Kallen B. Are hypnotic benzodiazepine receptor agonists teratogenic in humans? J Clin Psychopharmacol 2011;31:356-9. [ Links ]
97.- Eros E, Czeizel AE, Rockenbauer M, Sorensen HT, Olsen J. A populationbased case-control teratologic study of nitrazepam, medazepam, tofisopam, alprazolum and clonazepamtreatment during pregnancy. Eur J Obstet Gynecol Reprod Biol 2002;101147-54. [ Links ]
98.- Reis M, Kallen B. Combined use of selective serotonin reuptake inhibitors and sedativehypnotics during pregnancy risk of relatively severe congenital malformations or cardiac defects a register study. BMJ Open 2013;3. [ Links ]
99.- Gilboa SM, Strickland MJ, Olshan AF, Werler MM, Correa A. Use of antihistamine medications during early pregnancy and isolated major malformations. Birth Defects Res A Clin Mol Teratol 2009;85137-50. [ Links ]
100.- Gámez M, Irala C. Selección de benzodiazepinas. Bases para su utilización en el hospital. Farm Hosp 1996; 21 (2): 117-122. [ Links ]
101.- Adán MA, Acín MT, Díaz J, Alejandre G, Pérez J. ¿Cómo utilizamos los hipnóticos en atención primaria?. Semergen. 2010;36(7):372–376. [ Links ]
102.- Huedo-Medina TB, Kirsch I, Middlemass J, Klonizakis M, Siriwardena N. Effectiveness of non-benzodiazepine hypnotics in treatment of adult insomnia: meta-analysis of data submitted to the Food and Drug Administration. BMJ 2012;345:e8343. [ Links ]
103.- Fabre Jr LF, Brachfeld J, Meyer LR, Slowe IA, Calvo R, Metzler C. Multiclinic double-blind comparison of triazolam (Halcion) and placebo administered for 14 consecutive nights in outpatients with insomnia. J Clin Psychiatry 1978;39(8):679–82. [ Links ]
104.- Scharf MB, Sachais BA. Sleep laboratory evaluation of the effects and efficacy of trazodone in depressed insomniac patients. J Clin Psychiatry. 1990;51 (suppl):7-13. [ Links ]
105.- Ware JC, Pittard JT. Increased Deep sleep after trazodone use: a dobleblind placebo-controlled study in healthy Young adults. J Clin Psychiatry. 1990;51(suppl):18-22. [ Links ]
106.- Winokur A, Sateia MJ, Hayes JB, Bayles-Dazet W, MacDonald MM. Effects of mirtazapine on sleep architecture in patients with major depression: a pilot study. Biol Psychiatry. 1998; 43(8):106-7. [ Links ]
107.- Ruigt GS, Kemp B, Groenhout CM, Kamphuisen HA. Effect of the antidepressant Org 3770 on human sleep. Eur J Clin Pharmacol. 1990;38:551-4. [ Links ]
108.- Elie R, Ruther E, Farr I, Emilien G, Salinas E. Sleep latency is shortened during 4 weeks of treatment with zaleplon, a novel nonbenzodiazepine hypnotic. Zaleplon Clinical Study Group. J Clin Psychiatry 1999;60(8):536–44. [ Links ]
109.- Walsh JK, Vogel GW, Scharf M, Erman M, William Erwin C, Schweitzer PK, et al. A five week, polysomnographic assessment of zaleplon 10 mg for the treatment of primary insomnia. Sleep Med 2000;1(1):41–9. [ Links ]
110. Perlis ML, McCall WV, Krystal AD, Walsh JK. Long-term, non-nightly administration of zolpidem in the treatment of patients with primary insomnia. J Clin Psychiatry 2004;65(8):1128–37. [ Links ]
111.- Scharf MB, Roth T, Vogel GW, Walsh JK. A multicenter, placebo-controlled study evaluating zolpidem in the treatment of chronic insomnia. J Clin Psychiatry 1994;55(5):192–9. [ Links ]
112.- Walsh JK, Roth T, Randazzo A, Erman M, Jamieson A, Scharf M, et al. Eight weeks of non-nightly use of zolpidem for primary insomnia. Sleep 2000;23(8):1087–96. [ Links ]
113.- Glass J, Lanctôt KL, Herrmann N, Sproule BA, Busto UE. Sedative hypnotics in older people with insomnia: meta-analysis of risks and benefits. BMJ 2005;331:1169-73. [ Links ]
114.- Scharf M, Erman M, Rosenberg R, et al. A 2-week efficacy and safety study of eszopiclone in elderly patients with primary insomnia. Sleep 2005;28(6): 720–7. [ Links ]
115.- Morin CM, Colecchi C, Stone J, Sood R, Brink D. Behavioral and pharmacological therapies for late-life insomnia: a randomized controlled trial. JAMA 1999;281(11):991–9. [ Links ]
116.- Ancoli-Israel S, Walsh JK, Mangano RM, Fujimori M. Zaleplon, a novel nonbenzodiazepine hypnotic, effectively treats insomnia in elderly patients without causing rebound effects. Prim Care Companion J Clin Psychiatry 1999;1(4):114–20. [ Links ]
117.- Hedner J, Yaeche R, Emilien G, Farr I, Salinas E. Zaleplon shortens subjective sleep latency and improves subjective sleep quality in elderly patients with insomnia. The Zaleplon Clinical Investigator Study Group. Int J Geriatr Psychiatry 2000;15(8):704–12. [ Links ]
118.- Roth T, Seiden D, Wang-Weigand S, Zhang J. A 2-night, 3-period, crossover study of ramelteons efficacy and safety in older adults with chronic insomnia. Curr Med Res Opin 2007;23(5):1005–14. [ Links ]
119.- Dundar Y, Boland A, Strobl J, Dodd S, Haycox A, Bagust A, et al. Newer hypnotic drugs for the short-term management of insomnia: a systematic review and economic evaluation. Health Technol Assess 2004;8(24). [ Links ]
120.- Buscemi N, Vandermeer B, Friesen C, Bialy L, Tubman M, Ospina M, et al. The Efficacy and Safety of Drug Treatments for Chronic Insomnia in Adults: A Metaanalysis of RCTs. Society of General Internal Medicine, 2007;22:1335–1350. [ Links ]