Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Medicina
versión impresa ISSN 0798-0469
RFM v.25 n.2 Caracas dic. 2002
M de L Freitas1 y LE Fernández1.
RESUMEN:
Para evaluar la exactitud del recuento diferencial leucocitario realizado por los autoanalizadores Coulter STKS y Coulter MAXM se emplearon un total de 184 muestras, de una población aparentemente sana de la Escuela de Bioanálisis de la UCV. El diferencial manual de referencia se realizó según los procedimientos descritos en el protocolo H20-A. Con envoltura binomial encontramos que para: neutrófilos sobresale 12% de los limites, linfocitos 47% cae por debajo del limite inferior, monocitos 74% cae por encima del limite del 95%, eosinófilos 5%, basófilos 48,5%. Los errores sistemáticos para neutrófilos, linfocitos y eosinófilos fueron menores que los errores permitidos; para monocitos y basófilos los errores sistemáticos fueron mayores que los permitidos. La correlación para todos los subtipos celulares fue buena excepto para monocitos y basófilos. La exactitud del contaje diferencial leucocitario realizado por el Coulter STKS y el Coulter MAXM resultó ser satisfactoria para la mayoría de los subtipos celulares.
Palabras Clave: Diferencial leucocitario, Coulter STKS y MAXM.
ABSTRACT:
To Evaluate the accuracy of differential leukocyte performance by Coulter STKS and Coulter MAXM a total of 184 blood samples, from a population of the Bioanálisis School UCV who were without known hematological disease were examined. Differential of reference was determined following the H20-A protocol recommendations. Binomial envelope was found for Neutrophil a 12% fall outside of the limits, Lymphocytes 47% fall bellow lower limit, Monocytes a 74%, fall upper of 95% limit, Eosinophils a 5% and Basophiles a 48,5%. The systematic error for neutrophil, lymphocyte and eosinophils were smaller that the allowable error; for Monocytes and Basophiles the systematic error were larger than the allowable error. A good correlation was obtained for all leukocyte subtypes except for monocytes and basophiles. The accuracy of the Differential Leukocyte count performed with the Coulter STKS and Coulter MAXM appears to be satisfactory for the majority of leukocytes subtypes.
Key Words: Differential leukocyte count, Coulter STKS, Coulter MAXM.
INTRODUCCIÓN
Uno de los aspectos más importantes en la hematología es la cuidadosa evaluación de los elementos formes de la sangre. Esto incluye la cuantificación de cada elemento celular y un meticuloso estudio microscópico de su morfología. En 1970 se introducen los primeros autoanalizadores con capacidad de elaborar diferenciales en lámina, y desde entonces el avance vertiginoso de la tecnología ha buscado combinar diferentes principios a fin de perfeccionar la identificación celular, pero hasta ahora el método manual/visual, a pesar de su variabilidad y demostrada imprecisión, sigue siendo el método de referencia, lo cual es atribuible, en gran parte, a la incapacidad de obtener estándares para el adecuado ajuste y/o calibración de los autoanalizadores.
El método manual representa "la verdad" en cuanto al diferencial leucocitario se refiere, siendo el empleado como referencia para estudios de comparación de la metodología automatizada, tal como se establece en el protocolo H20-A(1), estándar aprobado por el National Committee for Clinical Laboratory Standards (NCCLS) para tal fin.
Es indiscutible el aporte de los instrumentos automatizados, con capacidad para cinco poblaciones, en el campo del diferencial leucocitario. En el comercio, a nivel nacional e internacional, existe una gran variedad de autoanalizadores entre ellos el Coulter STKS Y MAXM con capacidad para la determinación de los 8 parámetros hematológicos básicos, recuento de plaquetas y diferencial de 5 sub-poblaciones. Dentro de las ventajas, cabe destacar que ha disminuido el tiempo que el observador dedicaba al estudio microscópico de un gran número de frotis coloreados en la rutina hematológica; a la vez que ha aumentado la precisión de estos recuentos diferenciales. Conocer la exactitud y precisión del instrumental que se maneja es de vital importancia para garantizar la confiabilidad de los resultados emitidos. La exactitud sólo se conoce cuando se realizan comparaciones entre el instrumento objeto de estudio y un método de referencia, que en el caso del recuento diferencial leucocitario es la metodología manual realizada según las recomendaciones de los organismos internacionales, tal como se describe en el protocolo H20-A del NCCLS.
MATERIALES Y METODOS
Muestras
Las muestras para el estudio de comparación entre los dos autoanalizadores hematológicos y el método manual de referencia, y para el establecimiento de los rangos de referencia, fueron obtenidas de la población, aparentemente sana, de la escuela de Bioanálisis: estudiantes, profesores, personal obrero y administrativo. Se tomó en cuenta como parámetros de normalidad lo establecido en el protocolo H20-A del NCCL. Todos los donantes fueron interrogados para conocer de posibles desórdenes clínicos y hematológicos.
Un total de 184 muestras fueron extraídas. Cada muestra fue recolectada en tubos vacutainer (Becton and Dickinson) que contienen K3EDTA como anticoagulante. Fueron procesadas, una sola vez, en cada uno de los instrumentos en estudio dentro de las cuatro horas de extraída la muestra y los frotis se realizaron dentro de la primera hora de extraída.
Se eliminaron 51 muestras: 25 por no tener la hematimetría y el recuento diferencial dentro de los rangos de referencia, 8 por presentar infecciones, 7 por haber sufrido recientemente infecciones respiratorias superiores, 4 por ser asmáticos, 3 por estar tomando hormonas, 3 por no emitir reporte del diferencial leucocitario en alguno de los instrumentos, y 1 por estar coagulada, quedando así un total de 133 muestras.
Método de referencia
El diferencial manual de referencia se llevó a cabo siguiendo los procedimientos descritos en el protocolo H20-A(1).
Proceso de calificación
El proceso de calificación lo llevó a cabo un coordinador, quien se encargó de analizar y preparar los correspondientes gráficos de un grupo de 10 muestras procesadas por cada observador siguiendo lo estipulado en el protocolo H20-A del NCCLS(1).
Método automatizado
Coulter STKS: Dispone de muestreador automático de tubo cerrado, muestreador manual para tubo abierto, identificación de las muestras por lectura de códigos de barras, capacidad de archivo de resultados para 1000 muestras, archivo de datos de calibración, controles y media de Bull(2,3). Los datos generados por el instrumento son manejados por el Data Management System (DMS). El software (versión 1G1) es capaz de almacenar toda la información, incluyendo los diagramas de dispersión de hasta por lo menos 1000 muestras.
Ya sea de modo automatizado (primario) o manual (secundario), la sangre aspirada es dividida en tres porciones, una de ellas para realizar el diferencial leucocitario.
Después de la lisis de las células rojas y la estabilización del tamaño natural de los leucocitos, éstos, suspendidos en un fluido envolvente, son alineados para pasar a través de una cámara de flujo y simultáneamente se ejecutan las medidas de volumen, conductividad y dispersión de la luz láser, para cada célula. El diferencial es elaborado en la celda de flujo que analiza alrededor de 8.192 células en cada muestra y es controlado con partículas Coulter Latron, como material de control(4). Además del diagrama de dispersión de las sub-poblaciones leucocitarias normales, se generan alarmas de sospecha para la detección de muestras patológicas. El STKS también genera alarmas para la morfología de glóbulos rojos y plaquetas anormales.
Coulter MAXM: Es un autoanalizador similar al STKS, pero está empaquetado en una pequeña y simple máquina. Suministra alarmas para la presencia de células blancas anormales, morfología de glóbulos rojos anormales y plaquetas anormales(5,6).
El MAXM mide el volumen, contenido y tipo celular por una combinación de impedancia, conductividad electromagnética y citometría de flujo con láser de la misma manera que el STKS. El MAXM, a diferencia del STKS, analiza la misma alícuota de muestra tres veces. El MAXM no tiene muestreador automático y cada espécimen debe ser manipulado separadamente, por lo que el procesamiento resulta más lento. Durante este estudio se utilizó la versión del software 7B(5).
Tanto el Coulter STKS como el MAXM, son autoanalizadores que están instalados en el Laboratorio Principal del Hospital Clínico Universitario de Caracas, utilizados en la rutina y emergencia de este laboratorio. Ambos instrumentos fueron revisados, calibrados y puestos a punto para realizar este trabajo, según las especificaciones de los fabricantes; además, durante los tres meses que duró el trabajo, se contó con el apoyo técnico de la casa comercial. Fue calibrado con el calibrador S-Cal, y el control de calidad diario fue ejecutado usando niveles bajo, normal y alto de las células control Plus 5C y con el Control Latrón Coulter. Las muestras fueron analizadas por el sistema de tubo cerrado al vacío dentro de las 4 horas de recolectadas las muestras.
Estadística
Las herramientas estadísticas empleadas para la comparación del Coulter STKS Y MAXM contra el diferencial manual de referencia fueron: La envoltura binomial, con limites del 95% de confianza(1). Para analizar la exactitud de los datos que caen fuera de estos límites se empleó el error estándar de proporción, empleando para el método de referencia n = 400 células y para el método automatizado n = 8.000 células(1). La diferencia de las medias(7-10) y el coeficiente de correlación (r)(7-12).
Para establecer los valores de referencia para los autoanalizadores hematológicos y para el diferencial manual, se calculó la media + 3DS de la población en estudio; eliminándose los datos que caían fuera de estos limites. Con los valores remanentes, se recalculó la media + 2DS para establecer el rango normal del diferencial leucocitario. Esto incluye el 95% de los sujetos normales de la escuela de Bioanálisis(1,13,14).
RESULTADOS
Método de referencia
Calificación del proceso: En las figuras 1-a a la 1-e se representan gráficamente los resultados obtenidos por el coordinador del proceso de calificación para los dos observadores que ejecutarían el método de referencia, tal como lo establece el protocolo H20-A, encontrándose resultados individuales de los observadores dentro de los límites del 99% de confianza.
Comparación entre los observadores calificados: Quisimos establecer una comparación entre los observadores para darle mayor validez al método de referencia, para lo cual se siguieron las pautas señaladas en la "calificación del proceso", pero en este caso se utilizaron todas las muestras en estudio. Los gráficos se muestran en las figuras 2-a a la 2-b. El eje de las "x" representa el promedio de los resultados entre ambos observadores y el eje de las "y" la media de los resultados individuales de cada observador.
Comparación del STKS con el método manual de referencia: Los gráficos de dispersión con la envoltura binomial, para cada una de las subpoblaciones celulares, se muestran en las figuras 3-a a la 3-e. En el eje de las abcisas se representan los resultados del método manual de referencia y en el eje de las ordenadas los del STKS. Los resultados están expresados en porcentaje y las líneas continuas representan la envoltura binomial para los intervalos de confianza del 95%.
El coeficiente de correlación entre el diferencial manual y el STKS (figuras 3-a a la 3-e) fue excelente para neutrófilos, linfocitos y eosinófilos, pero pobre para monocitos (0,34) y todavía menor (0,12) para basófilos. En las figuras 4-a a la 4-e se representan los gráficos de las diferencias de las medias entre el método manual y el STKS. En la tabla I se resume las diferencias de las medias para cada subtipo celular.
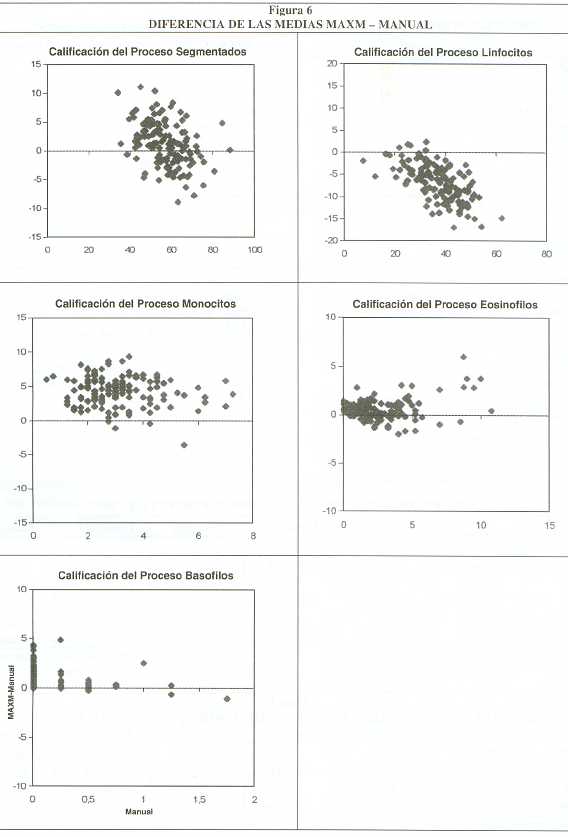
Comparación del MAXM con el método manual de referencia: En las figuras 5-a a la 5-e se muestran los gráficos de dispersión para los límites del 95% de confianza correspondientes a neutrófilos, linfocitos, monocitos, eosinófilos y basófilos, representando en el eje de las abcisas los valores porcentuales del método manual, y en las ordenadas los del MAXM.
Los resultados de los coeficientes de correlación se representan en los gráficos anteriores (figuras 5-a a la 5-e) obteniéndose una buena correlación para neutrófilos, linfocitos, y eosinófilos, no así para monocitos. Las diferencias de las medias se muestran en las figuras 6-a a la 6-e. En la tabla 1 se resume las diferencias de las medias para cada subtipo celular.
Valores de referencia
Los valores de referencia de la población estudiada, para el STKS y MAXM, en valores relativos y valores absolutos, se muestran en las tablas 2 y 3 respectivamente. Estos valores se obtuvieron de la misma población empleada para el estudio de comparación. Para la metodología manual sólo se obtuvieron valores de referencia relativos (Tabla 2).
Tabla 1: Comparación de los resultados empleando las diferencias de las medias
| Manual* | STKS | MAXM | |
| Neutrófilos % | |||
| Media | 56,9 | 56,3 | 58,1 |
| Dif. Media | -0,59 | 1,13 | |
| DE Dif. Media | 3,95 | 3,83 | |
| Linfocitos % | |||
| Media | 37,2 | 31,6 | 30,3 |
| Dif. Media | -5,66 | -6,92 | |
| DE Dif. Media | 4,12 | 4,13 | |
| Monocitos % | |||
| Media | 3,1 | 7,1 | 7,4 |
| Dif. Media | 4,01 | 4,22 | |
| DE Dif. Media | 2,06 | 2,13 | |
| Eosinófilos % | |||
| Media | 2,6 | 3,2 | 3,1 |
| Dif. Media | 0,62 | 0,56 | |
| DE Dif. Media | 1,01 | 1,1 | |
| Basófilos % | |||
| Media | 0,1 | 1,7 | 1,3 |
| Dif. Media | 1,64 | 1,03 | |
| DE Dif. Media | 1,6 |
Dif. media: diferencia de las medias.
DE: Desviación estándar.
*Manual de referencia sobre 400 células.
Tabla 2: Valores de referencia expresados en porcentaje (%)
| Neutrófilos | Linfocitos | Monocitos | Eosinófilos | Basófilos | ||
| Método | Media | 56,9 ,1 | 37,2 | 3,1 | 2,6 | 0,1 |
| Manual | Rango | 36,7 - 77 | 18,7 - 55,8 | 0,5 - 5,7 | 0 - 7,1 | 0 - 0,6 |
| Coulter | Media | 56,7 | 31,7 | 7,0 | 3,0 | 1,7 |
| STKS | Rango | 39,4 - 74 | 16,4– 46,9 | 3,3 – 10,7 | 0 – 7,4 | 0-4,8 |
| Coulter | Media | 57,9 | 30,7 | 7,5 | 2,9 | 1,1 |
| MAXM | Rango | 41,0 - 74,7 | 16,8-44,5 | 3,0 – 12,0 | 0 – 7,5 | 0 – 2,6 |
Tabla 3: Valores de referencia absolutos para cada uno de los autoanalizadores
| Neutrófilos | Linfocitos | Monocitos | Eosinófilos | Basófilos | ||
| Coulter | Media | 4,1 | 2,3 | 0,5 | 0,2 | 0,1 |
| STKS | Rango | 2,1 – 6,2 | 0,8 – 3,8 | 0,2 – 0,8 | 0,0 – 0,6 | 0,0 – 0,4 |
| Coulter | Media | 4,6 | 2,4 | 0,6 | 0,2 | 0,1 |
| MAXM | Rango | 1,9 – 7,4 | 1,1 – 3,7 | 0,2 – 0,9 | 0,0 – 0,7 | 0,0 – 0,3 |
Los valores están expresados en células por 10 9/L
DISCUSIÓN
Siguiendo lo establecido en el protocolo H20A del NCCLS, el método manual de referencia tendrá validez, siempre y cuando los observadores aprueben el proceso de calificación. Al observar los gráficos (Figuras 1-a a la 1-e) que el coordinador elaboró para cada subtipo celular, nos damos cuenta que no sobrepasan el límite de confianza del 99%. Estos resultados, conjuntamente con los observados en la comparación entre observadores para toda la población en estudio (Figuras 2-a a la 2-e) donde se cumplen las normas establecidas, le dan validez al método manual para emplearlo como referencia para el estudio comparativo con el Coulter STKS y MAXM.
Cuando comparamos los valores del diferencial leucocitario del STKS contra el método de referencia, empleando la envoltura binomial, notamos visualmente que un pequeño porcentaje de datos cae fuera de los límites del 95%. Analizando estos datos para exactitud, siguiendo los lineamientos del protocolo H20-A, encontramos que el 12% de los neutrófilos cae fuera de los límites del 95% de confianza. Los valores de neutrófilos se dispersan equitativamente alrededor de la línea media (Gráfico 4-a), obteniendo una diferencia entre el STKS y el manual de - 0,59 (Tabla 1). El coeficiente de correlación fue de 0,92. Analizando en conjunto estas tres herramientas estadísticas, podríamos deducir que entre el STKS y el método manual de referencia hay un acuerdo para este subtipo leucocitario, lo que coincide con lo reportado por la mayoría de los autores que han realizado este tipo de comparaciones(2,4,15-18) especialmente los que utilizan el coeficiente de correlación y la diferencia de las medias como tratamiento estadístico.
Con relación a los linfocitos, un gran porcentaje de datos sobrepasa los límites del 5% permitido por la envoltura binomial. Luego del análisis de los datos se determinó que un 47% sobrepasaba los límites de la envoltura. Si observamos detalladamente los gráficos (Figura 3-b) y las diferencias de las medias (Tabla 1 y Figura 4-b), notamos que los puntos que se salen son todos por debajo del límite inferior del 95% de confianza, dando una diferencia de las medias de – 5,56.
Si analizamos el coeficiente de correlación de 0,9 podríamos deducir, al igual que la mayoría de los investigadores(2,4,15,16,18), que hay una buena correlación entre ambas metodologías, pero los dos primeros análisis estadísticos no llevan a la misma conclusión. Con la envoltura binomial y la diferencia de las medias, lo único que podemos concluir es que hay una clara subestimación de los linfocitos, hecho que al parecer no se refleja en otros trabajos publicados(2,4,18).
Para monocitos nos encontramos con algo parecido a lo que ocurre con los linfocitos. Un porcentaje de datos aún mayor que el de linfocitos, específicamente el 74%, cae fuera de la envoltura y todos ellos por encima del límite superior del 95% de confianza, con una diferencia de las medias de + 4,01, lo que claramente nos hace pensar que hay sobrestimación de monocitos por parte del STKS. La correlación fue pobre con una r = 0,34. Analizando los resultados obtenidos para linfocitos y monocitos, una subestimación de los primeros y sobrestimación de los segundos, podría interpretarse que el STKS cuenta y clasifica los linfocitos grandes como monocitos(19). La sobrestimación de monocitos concuerda con lo reportado en la literatura, pero en estos trabajos no se explica a expensas de qué otras células se realiza la misma(4,18). El análisis de los eosinófilos, empleando la envoltura binomial (Figura 3-d), demuestra que sólo el 5% se sale de los límites de confianza. El coeficiente de correlación fue bueno, r = 0,92; y la diferencia de las medias muy pequeña, con un valor de + 0,62. Estos datos reflejan que existe una buena concordancia al clasificar estas células por ambas metodologías, independientemente de las herramientas estadísticas que se empleen.
En cuanto a los basófilos, por cualquier análisis se demuestra que existe un claro desacuerdo entre la metodología manual y la del STKS. Con la envoltura binomial un 45,8% de basófilos sobrepasa los límites del 95% de confianza (Figura 3-e). No hay correlación, y la diferencia de las medias es de 1,64. Estos resultados coinciden ampliamente con otros trabajos publicados y podrían explicarse, por un lado por los errores inherentes a la baja proporción de basófilos en una muestra, por lo que en estos casos la aplicación de métodos estadísticos no tienen validez, pero además pareciera que las metodologías que se emplean para clasificar este tipo de células no son las más apropiadas(2-4,15,16,18,20).
Al realizar el análisis comparativo de los resultados del MAXM y el método manual de referencia, encontramos que son muy similares a los obtenidos para el STKS, lo cual era de esperarse conociendo que ambos instrumentos emplean la misma metodología para realizar el diferencial de 5 subpoblaciones.
En vista de que el análisis estadístico para algunos subtipos celulares resultó ser significativo para el instrumento en estudio, seguimos las recomendaciones de Westgard(9,10) para juzgar la aceptabilidad del método evaluado, calculando el error sistemático. Este error sistemático se calcula tomando en consideración la ecuación de regresión para cada uno de los subtipos celulares en cada instrumento (Figuras 3 y 5); como concentración crítica, escogimos el límite superior de los valores de referencia para todas las células y en el caso de neutrófilos y linfocitos, también se calculó el error sistemático tomando en consideración el límite inferior. La interpretación del error sistemático se realizó por comparación con el error permitido; estableciendo como error permitido una cuarta parte del rango de referencia del método manual(9,10). El objetivo de emplear este tratamiento estadístico es concluir si el error sistemático que se obtiene por el método en estudio comparado con el de referencia, es tan grande como para afectar el nivel de decisión médica.
Como se puede observar en las tablas 4 y 5, los errores sistemáticos para neutrófilos, linfocitos y eosinófilos resultaron ser menores que los errores permitidos, lo que se traduce en que, aún cuando existan diferencias estadísticamente significativas como ocurre en el caso de los linfocitos, este error es pequeño y no tendría porqué afectar el nivel de decisión médica; es decir, al momento de clasificar los linfocitos, el Coulter STKS los subestiman en una cantidad que se considera no afecta la interpretación clínica. En el caso de los monocitos los valores del error sistemático resultaron ser superiores al error permitido, interpretándose que la sobrestimación del instrumento al clasificar monocitos, es significativa tanto desde el punto de vista estadístico como de interpretación clínica.
Se calcularon valores de referencia para cada uno de los subtipos celulares en estudio en términos absolutos (109/L) y relativos (%). Para el diferencial manual se calcularon solo los valores relativos, debido a la imprecisión que representa esta metodología al llevarlo a valores absolutos. Como es de esperarse, los valores de monocitos por el método manual resultaron ser inferiores a los obtenidos en cada uno de los autoanalizadores (Tablas 2 y 3). El valor inferior y el valor superior de este rango de referencia son los que deben introducirse en el autoanalizador, de manera que las muestras que traspasen los límites establecidos muestren una señal de alarma. Además, estos valores deberían aparecer impresos en la hoja de reporte para la debida interpretación por parte del clínico.
CONCLUSIONES
Los autoanalizadores STKS y MAXM y el método manual son comparables, cuando clasifican neutrófilos, linfocitos y eosinófilos. En el caso de los monocitos, los valores del STKS y MAXM no son comparables con la metodología manual. En cuanto a los basófilos, no encontramos concordancia alguna entre la metodología manual y la automatizada, lo cual confirma lo descrito por otros autores.
En vista de las diferencias observadas en cada uno de los instrumentos, es de especial relevancia que todo laboratorio, dentro de su protocolo de trabajo, establezca sus valores de referencia para la población que atiende.
AGRADECIMIENTO
Este trabajo fue subvencionado por el CDCH, y por el aporte económico de las casas comerciales COULTER ELECTRONICS Y ROCHE DIAGNOSTICS SYSTEM.
Tabla 4: Error sistemático calculado para un porcentaje de 36,7 de neutrófilos y 18% de linfocitos
| EP | STKS | MAXM | |
| Neutrófilos | 10,1 | 3,2 | 6,4 |
| Linfocitos | 9,3 | -0,9 | -1,8 |
EP= error permitido para cada subtipo celular.
Tabla 5: Error sistemático calculado para un porcentaje de 77,1 de neutrófilos, 55,8 de linfocitos, 5,7 de monocitos y 7,1 de eosinófilos
| EP | STKS | MAXM | |
| Neutrófilos | 10.1 | 3,7 | -1,4 |
| Linfocitos | 9,3 | -10,4 | -12 |
| Monocitos | 1,3 | 2,8 | 3,5 |
| Eosinófilos | 1,7 | 1,7 | 1,2 |
EP= error permitido para cada subtipo celular.
REFERENCIAS BIBLIOGRÁFICAS
1. National Committee for Clinical Laboratory Standards. Reference Leukocyte Differential Count Proportional) and evaluation of Instrumental Methods. NCCLS. Document H20-A. 1992; 1: 12. [ Links ]
2. Buttarello M, Gadotti M, Lorenz C, et al. Evaluation of Four Automated Hematology Analysers. A Comparative Study of Differential Counts. Am J Clin Pathol. 1992; 97: 345-52. [ Links ]
3. Fernández De Castro M, Viloria B, Ezquieta B. Valoración del Autoanalizador Hematológico Coulter STKS. Sangre. 1992; 37(2): 93-100. [ Links ]
4. Warner BA, Reardon DMA. Field Evaluation of the Coulter STKS. Am J Clin Pathol. 1991; 95: 207-17. [ Links ]
5. Billett HH, Simson E, Main P. The MAXM Hematology Autoanalyzer. An Alternative?. Am J Clin Pathol. 1994; 102: 36-44. [ Links ]
6. Coulter. Evaluation of the Coulter MAXM at four Clinical sites. Technical Monograph. Coulter Corporation. Hialeah, Florida. [ Links ]
7. Westgard JO, De Vos DJ, Hunt MR. Concepts and Practices in the Evaluation of Clinical Chemistry Methods. I Background and Approach. Am J of Med Tech. 19. 1978 44(4): 290-300. [ Links ]
8. Westgard JO, et al. Concepts and Practices in the Evaluation of Clinical Chemistry Methods. II Experimental Procedures. Am J Med Tech 19. 1978; 44(5): 420-30. [ Links ]
9. Westgard JO, et al. Concepts and Practices in the Evaluation of Clinical Chemistry Methods. III Statistics. Am J Med Tech 19. 1978; 44(6): 552-71. [ Links ]
10. Westgard JO, et al. Concepts and Practices in the Evaluation of Clinical Chemistry Methods. IV. Decisions of Acceptability. Am J Med Tech 19. 1978; 44(7): 727-42. [ Links ]
11. Martin Bland J, Altman DG. Statistical Methods for assessing Agreement Between two Methods of Clinical Measurement. The Lancet. 1986; 307-10. [ Links ]
12. Dawson-Saunders B, Trapp R. Correlación y Regresión. En: Bioestadística Médica. Ed. Manual Moderno, Mexico 1993; 187-213. [ Links ]
13. Redondo AF. Fuentes de variación. Rangos de referencia. En: La lógica en la interpretación de las pruebas diagnósticas. Ed. Garsi, Madrid. 1989; 44-7. [ Links ]
14. Evatt BL, Gibbs WN, et al. In: Fundamental Diagnostic Hematology. Anemia. US Department o Health and Human Services and World Health Organization. 2° ed. 1992; 35-7. [ Links ]
15. Bentley SA, Johnson A, Bishop CA. Parallele Evaluation of Four Automated Hematology Analysers. Am.J.Clin.Pathol. 1993; 100: 626-32. [ Links ]
16. Cornbleet PJ, Myrick D, Levy R. Evaluation of the Coulter STKS Five-Part Differential. Am. J. Clin. Pathol. 1993; 99: 72-81. [ Links ]
17. Kessler C, SheridanB, CharlesC, KraemerK, Pierre RV, Machin SJ, Grant D. Performance of the Coulter Gen.S System’s White cell fifferential on an abnormal specimen data set. Lab.Hematol. 1997; 1(3): 41-7. [ Links ]
18. Warner BA, Reardon DM, Marshall DP. Automated Haematology Analysers: a four-way comparison. Med. Lab.Sciences. 1990; 47: 285-96. [ Links ]
19. Hübl W, Hauptlorenz S, Tutlos L, Jilch R, Fisher M, Bayer PM. Precision and Accuracy of Monocyte Counting. Am.Clin.Pathol. 1995; 103: 167-70. [ Links ]
20. Llompart I, Vila M, Quetglas P, et al. Evaluación del autoanalizador hematológico Coulter MAXM. Sangre. 1995; 40(2): 121-28. [ Links ]