Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Medicina
versión impresa ISSN 0798-0469
RFM v.29 n.1 Caracas jun. 2006
CARACTERIZACIÓN HISTOPATOLÓGICA DE LA ESTENOSIS SUBVALVULAR AÓRTICA: ESTUDIO DE 24 BIOPSIAS.
(Caracterización histopatológica del material quirúrgico de membranectomía o miomectomía septal subaórtica).
Leticia Hamana1, Claudia Blandenier de Suárez2
1
Profesor instructor por concurso. Adjunto de la Sección de Patología Cardiovascular. Instituto Anatomopatológico. UCV.2
Profesor titular. Jefe de la Sección de Patología Cardiovascular. Instituto Anatomopatológico. UCV.Autor responsable: Dra. Claudia Blandenier de Suárez. claudia1937@cantv.net Sección de Patología Cardiovascular. Instituto Anatomopatológico "Dr. José Antonio ODaly". UCV. Tlf. 6053492.
RESUMEN
La estenosis subaórtica, es la obstrucción del tracto de salida del ventrículo izquierdo, causada por un exceso de tejido o por anomalías congénitas de cualquiera de las estructuras ubicadas por debajo de la válvula aórtica.
Con el objetivo de clasificar un grupo de biopsias de estenosis subaórtica se describen las características macroscópicas e histopatológicas de 24 biopsias provenientes del Hospital Universitario de Caracas, las cuales fueron analizadas con coloraciones de rutinas, coloraciones especiales e inmunohistoquímica, encontrando que la mayoría de los especimenes fueron de aspecto membranoso o fibroso, algunos mostraban tejido muscular. La fibrosis fue el hallazgo histopatológico más constante (100%), degeneración mixoide, músculo liso, fibras elásticas, neoformación vascular y células inflamatorias. Igualmente se observó músculo cardíaco correspondiente al lecho quirúrgico.
Concluimos señalando la importancia de un trabajo en conjunto del patólogo con el clínico para clasificar estas lesiones, igualmente, mientras más se conozca de su estructura anatómica, macroscópica e histopatológica, más posibilidades habrá de conseguir evidencias en cuanto a su etiopatogenia.
Palabras clave: Membrana subaórtica, Estenosis subvalvular aórtica.
ABSTRACT
The subaortic stenosis is the left ventricular outflow tract obstruction caused by an excess of weaving or by congenital anomalies of any of the structures located under the valve aortica. With the objective to classify a group of biopsies, the macroscopic characteristics of subaortic stenosis are described and histopathologic of 24 biopsies proceeding from the University Hospital of Caracas, which they were analyzed with of routines and special histopathologics colorations and inmunohistochemistry. Finding that the majority of the cases they were of membranous or fibrous aspect, some they showed muscular fibers. The fibrosis was the hsitopathologic find more constant (100%), mixoide degeneration, smooth muscle, elastic fibers, neoformation vascular and inflammatory cells. Likewise corresponding heart muscle was observed a surgical bed. We conclude indicating the importance of a work as a group of the pathologist with the clinical one to classify these wounds, likewise, while more be known of its macroscopic, anatomical structure and histopathologic, more possibilities there will be of obtain evidences as for its etiopatogenia.
Key words: Subaortic stenosis
Recibido: 13-01-06. Aceptado: 27-03-06.
INTRODUCCIÓN
La estenosis subaórtica, es la obstrucción del tracto de salida del ventrículo izquierdo por debajo de la válvula aórtica causada por un exceso de tejido o por anomalías congénitas propias de cualquiera de las estructuras que conforman el tracto de salida de dicho ventrículo(1).
Una característica importante de la estenosis subaórtica, es la diversidad de lesiones cardíacas con las que se relaciona y la inconsistencia de los términos usados para su clasificación, debido a que se utiliza la misma terminología para definir condiciones patológicas distintas y a su vez, se emplea una variedad de nombres para designar lesiones idénticas. De igual manera, algunos términos empleados son indistintamente descriptivos, histológicos o anatómicos.
Algunos autores, entre ellos Edwards y col., sugieren clasificar la estenosis aórtica subvalvular en tres tipos: Tipo membranoso o discreta, Collar fibromuscular y túnel fibromuscular(2). Reis y col. dividen a la estenosis subaórtica en tipo discreto y tipo túnel, consistiendo la tipo discreto en un anillo fibroso aislado o con una base muscular(3). Choi y Sullivan por su parte, sugirieron una clasificación de la estenosis subaórtica, basada en características morfológicas y ecocardiográficas(4,5). Tabla 1.
Clasificación de la estenosis subaórtica
| ° Obstrucción suaórtica de segmento corto (longitud <1/3 de diámetro de la válvula aórtica). |
| ° Obstrucción suaórtica de segmento corto (longitud >1/3 de diámetro de la válvula aórtica). |
| ° Estenosis subaórtica debida a mal alineamiento de estructura septales en presencia de DVS. |
| ° Mal alineamiento posterior, con DVS por encima de la obstrucción. |
| ° Mal alineamiento anterior, con obstrucción por debajo del DVS. |
| ° Estenosis subaórtica debida a tejido valvular aurículo ventricular en el TSVI: |
| ° Tejido valvular mitral accesorio |
| ° Unión anómala de las cuerdas de la válvula mitral |
| ° Tejido valvular tricúspide que prolapsa a través de un DVS |
| ° Válvula aurículo ventricular izquierda anormal en DSAV |
DSAV: defectos septal aurículo ventricular; TSVI: tracto de salida del ventrículo izquierdo; DSV: defecto septal ventricular. Br Heart J. 1991;65:280-286.
La estenosis subaórtica tipo membranoso o discreta, se caracteriza por la presencia de un diafragma o cresta de tejido fibroso o fibromuscular endocárdico delgado, que rodea total o parcialmente el tracto de salida del ventrículo izquierdo a lo largo de la pared anteroseptal y que envuelve a menudo la valva antero-medial de la mitral y el cual se localiza desde pocos milímetros hasta 2 a 3 cm por debajo del plano valvular aórtico(6,7). La estenosis subaórtica fibromuscular, compromete el miocardio del septum interventricular, siendo la forma más común, la observada en la miocardiopatía hipertrófica(8). En la estenosis subaórtica fibromuscular en forma de "túnel", el tracto de salida del ventrículo izquierdo completo es estrechado por una banda endocárdica fibrosa o fibromuscular, irregular y gruesa que puede involucrar la válvula aórtica y a su vez producir regurgitación mitral al interferir en el movimiento de la valva anteromedial(9).
El diagnóstico de estenosis subaórtica es establecido por la clínica, los hallazgos ecocardiográficos, el cateterismo cardíaco y la angiocardiografía(10), siendo el mejor método, el ecocardiograma transesofágico(11). Estos estudios proporcionan elementos de diagnóstico diferencial entre la estenosis subaórtica de la miocardiopatía hipertrófica, la presencia de un músculo papilar aberrante o sobre crecimiento del tejido valvular mitral, herniación tricúspidea a través de un defecto septal ventricular o defecto septal atrio-ventricular en "cuello de ganso"(12,13)
El tratamiento correctivo de esta entidad patológica es quirúrgico y solo la progresión de la estenosis subvalvular constituye la indicación de la extirpación o resección de la lesión anatómica (membranectomía con o sin miomectomía septal)(14) . La presencia de un gradiente de presión de 40 mmHg con estenosis subaórtica discreta aislada es un criterio razonable para la resección quirúrgica dado que su progresión a gradientes mayores es altamente probable, siendo requerida la resolución inmediata en caso de que exista asociación con otros defectos cardíacos congénitos(15).
La membrana estenótica subaórtica es un material de estudio anatomopatológico poco frecuente, y en nuestra sección especializada en patología cardiovascular hemos tenido la oportunidad de analizar un número considerable de casos en la última década, gracias a que se ha incrementado notablemente la cirugía cardiovascular en el Hospital Universitario de Caracas(16).
La clasificación de las lesiones que caracterizan la estenosis subaórtica es importante, porque no sólo determina el tipo de conducta quirúrgica sino que permite al patólogo extender su análisis con fines a profundizar sobre la etiopatogenia de esta entidad.
Con el objetivo de clasificar un grupo de biopsias de estenosis subaórtica se realiza la descripción de las características macroscópicas e histopatológicas de un grupo de casos operados y estudiados en nuestro centro.
MÉTODOS
Para el siguiente estudio, se seleccionaron 24 biopsias referidas como "membranas sub-valvulares aórticas", provenientes del Servicio de Cirugía Cardiovascular del Hospital Universitario de Caracas desde el año 1993 hasta el 2005. El material fue analizado en la sección de Patología Cardiovascular del Instituto Anatomopatológico "Dr. José A. ODaly", UCV. Se recopiló de las boletas de solicitud, la información clínica pertinente.
Las biopsias fueron recibidas fijadas en formalina al 10 %, siendo examinadas y descritas macroscópicamente. Los fragmentos más representativos de la lesión fueron procesados e incluidos en parafina y consecutivamente cortados y coloreados con hematoxilina-eosina. En algunos casos seleccionados, realizamos coloraciones especiales de Verhoeff para fibras elásticas, tricrómico de Gomori para tejido colágeno y muscular y PAS azul Alciano para corroborar la presencia de mucopoli-sacáridos.
Estudio macroscópico
Las muestras recibidas fueron observadas y descritas, señalando las características más significativas tales como forma, tamaño, presencia de tejido fibroso y tejido muscular y otros aspectos morfológicos. Los datos fueron tabulados según su frecuencia e importancia.
Estudio histológico con microscopio óptico
En cada caso, se realizó el estudio histológico, evaluando la presencia, grado y distribución de la fibrosis y elastosis del endomiocardio, la presencia de degeneración mixoide, de vasos sanguíneos, músculo liso, músculo cardíaco y células inflamatorias. La fibrosis se dividió de manera subjetiva en leve, moderada y severa, dependiendo de su distribución en 30%, 60% o 90% del tejido respectivamente. Los elementos fueron consignados de acuerdo a un protocolo de estudio previamente determinado.
Estudio inmunohistoquímico
Mediante la técnica del polímero marcado con peroxidasa conjugado al anticuerpo secundario se realizaron inmunoreacciones para desmina en 8 casos, actina músculo liso específico en 9 casos, vimentina en 3 casos y CD34 en 1 caso, en la Sección de Inmuno-histoquímica del Instituto Anatomopatológico.
Clasificación del material
Para la clasificación del material, nos basamos en los hallazgos morfológicos e histopatológicos, tal y como lo proponen algunos autores como Edwards, Reis y col., en membranosa o discreta, y fibromuscular.
RESULTADOS
En nuestro estudio, se evaluaron un total de 24 casos con membrana subvalvular aórtica, de los cuales 11 correspondieron al género masculino y 13 al femenino con edades comprendidas entre 1 y 38 años. En el Tabla 2, está consignada la distribución de los casos según los grupos etarios y el género.
Distribución de los casos de membrana subvalcular aórtica según edad y género N=24
| Edad (años) | Masculio | % | Femenino | % | Total | % |
| 1-10 | 3 | 12,5 | 1 | 4,1 | 4 | 16,6 |
| 11-20 | 6 | 25,0 | 6 | 25,0 | 12 | 50.0 |
| 21-30 | 1 | 4,1 | 4 | 16,6 | 5 | 20.8 |
| >30 | 0 | 0 | 2 | 8,3 | 2 | 8,3 |
| No especificado | 1 | 4,1 | 0 | 0 | 1 | 4.1 |
| Total | 11 | 45,8 | 13 | 54,1 | 24 | 100,0 |
Hallazgos macroscópicos
La mayoría de los especimenes se recibieron como fragmentos irregulares constituidos por tejido membranoso de aspecto fibroso, color blanquecino y de consistencia renitente, algunos de los cuales mostraron áreas de aspecto gelatinoso. Otros especimenes, mostraron una forma semilunar o anular, siendo igualmente de aspecto fibroso y de color blanco nacarado. En un caso, se apreció tejido de aspecto muscular adherido a uno de los fragmentos de membrana, y en tres casos se recibió aparte un fragmento de tejido muscular, de color pardo claro. Figura 1.
Aspecto macroscópico de la membrana subaórtica: A: Membrana subaórtica recibida fragmentada. B: Membrana subaórtica de aspecto fibromuscular. C: Membrana subaórtica de aspecto fibroso. D: Membrana subaórtica fibrosa, blanco nacarado, con aspecto gelatinoso o mixoide.

Cuatro de los casos estudiados, venían acompañados del espécimen de resección de las válvulas sigmoideas aórticas, las cuales fueron resecadas en dos de ellos por insuficiencia valvular, encontrándose al estudio histopatológico lesiones secundarias a chorro; los dos casos restantes fueron resecados por estenosis valvular, siendo uno de ellos una estenosis aórtica bivalva y el otro una trivalva secuela de una endocarditis infecciosa.
Hallazgos histológicos. Tablas 3 y 4
Características microscópicas de la membrana subvalvular aórtica en orden de frecuencia N=24
| Características | SI | % | NO | % |
| Fibrosis | 24 | 100,0 | 0 | 0 |
| Degeneración mexoide | 20 | 83,3 | 4 | 16,6 |
| Músculo liso | 20 | 83,3 | 4 | 16,6 |
| Inflamación | 10 | 41,6 | 14 | 58,3 |
| Músculo cardíaco | 7 | 29,1 | 17 | 70,8 |
| Vasos | 7 | 29,1 | 17 | 70,8 |
Características microscópicas de la membrana subvalvular aórtica según su distribución N=24
| Características | Nº de Casos | Distribución | |
| Focal (%) | Difuso (%) | ||
| Degeneración mixoide | 19 | 18 (94,7) | 1 (5,3) |
| Músculo liso | 19 | 13 (68,4) | 6 (31,6) |
| Músculo cardíaco | 6 | 4 (66,6) | 2 (33,3) |
| Vasos sanguíneos | 6 | 5 (83,3) | 1 (16,7) |
| inflamación | 10 | 9 (90,0) | 1 (10,0) |
Dentro de los hallazgos histológicos, la fibrosis fue el más importante y constante (100%), la cual fue moderada (58,3%) o marcada (41,6%).
La presencia de degeneración mixoide, se puso de manifiesto en 20 casos (83,3%), mostrando en su mayoría distribución focal (95,0%).
Con la coloración de hematoxilina-eosina se evidenció la presencia de músculo liso en 19 casos (83,3%), con distribución focal en 13 (68,4%) y difusa en 6 (31,6%) de ellos. Figura 2.
Características microscópicas de la membrana subaórtica. A: Membrana subaórtica formada predominantemente por tejido colágeno denso (H-E). B: Inmunomarcaje positivo para vimentina en los fibroblastos. C: Abundantes fibras musculares lisas formando parte de la membrana subaórtica (H-E). D: Inmunomarcaje positivo para actina músculo liso en las fibras musculares. E: Músculo cardíaco (lecho quirúrgico) y membrana subaórtica adyacente (Tricrómico de Van Gieson). F: Membrana subaórtica con elastosis y banda endocárdica de tejido elástico (Verhoeff).

En 14 de los casos se realizaron coloraciones especiales para fibras elásticas, de los cuales, 12 (85,7%) mostraron elastosis. Figura 2-F.
Se observó igualmente músculo cardíaco en 6 (29,1%) de los casos, en su mayoría de distribución focal (66,7%). En estos pacientes no fue posible establecer una relación clínico patológica con miocardiopatía hipertrófica. Figura 2-E.
Se observaron vasos sanguíneos neoformados (29,1%), en su totalidad capilares, el 83,3% de distribución focal, no encontrándose una diferenciación vascular en arteriolas, vénulas o linfáticos. Figura 3.
Características microscópicas de la membrana subvalvular aórtica. A: Membrana subaórtica con múltiples calcificaciones (H-E). B: Válvula sigmoidea aórtica con estenosis calcificada posendocarditis como complicación de una membrana subvalvular aórtica (H-E). C y D: Neovascularización e infiltrado inflamatorio de linfocitos en una membrana subaórtica fibrosa (H-E).
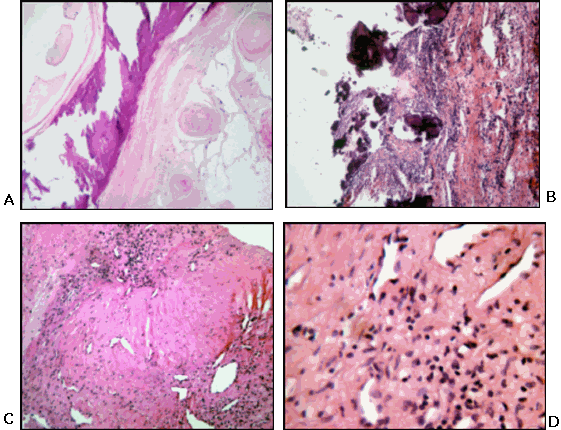
La presencia de células inflamatorias se puso en evidencia en 41,6% de los casos, todas de tipo linfocítico, en su mayoría leve y focal, sin la presencia de macrófagos o polimorfonucleares neutrófilos. Figura 3.
Hallazgos inmunohistoquímicos
Con la técnica de inmunohistoquímica, en los casos seleccionados, se corroboró la presencia de fibrosis (inmunomarcaje intra citoplasmático positivo para vimentina, en los fibroblastos), fibras musculares lisas (inmunomarcaje positivo para actina músculo liso específico en el citoplasma de las células musculares lisas que formaban parte de la membrana) y cardíacas (inmunopositividad para desmina en los miocardiocitos del lecho quirúrgico).
El CD34 realizado en uno de los casos, fue positivo en las paredes de los vasos y negativo en las células componentes de la membrana.
DISCUSIÓN
La estenosis subaórtica es una lesión cardíaca infrecuente, en la cual el tracto de salida del ventrículo izquierdo está estrechado por la presencia de un anillo fibroso o fibromuscular(17). Constituye el 8%-20% de todas las formas de obstrucción al tracto de salida del ventrículo izquierdo(18,19).
Se han planteado una serie de hipótesis acerca de su etiopatogenia, entre ellas la teoría genética, tomando en cuenta la incidencia familiar, la cual sugiere una pre-disposición genética para la formación de tejido fibroso o fibromuscular en esta zona específica del ventrículo izquierdo. Por otra parte, se ha sugerido su naturaleza adquirida, basándose en evidencias clínicas, ecocardiográficas y angiocardiográficas que revelan el desarrollo y progresión de la lesión en pacientes sin obstrucción previa del tracto de salida del ventrículo izquierdo. Apoya lo antes expuesto, la documentación de su característica progresiva durante la infancia y adolescencia, siendo rara su aparición en el período neonatal e infancia temprana, encontrándose además, su recurrencia después de una resección quirúrgica adecuada. Sin embargo, Sabine y col., publicaron el caso de un recién nacido con evidencias de estenosis subaórtica discreta, demostrando que la misma puede desarrollarse in útero(20). A su vez, la estenosis subaórtica puede coexistir con otras anomalías congénitas hasta en 50% de los casos, lo cual sugiere que el factor congénito está involucrado en su patogénesis(21,22). Algunos autores como Rosenquist y col., apoyan la Teoría geométrica, porque encontraron un aumento de la distancia mitral-aórtica en 23 especimenes cardíacos con estenosis subaórtica, sugiriendo cambios en la dinámica del flujo sanguíneo en un período crítico de la vida fetal, con el consecuente desarrollo del tejido que causa la estenosis subaórtica. Ellos formularon que alteraciones hemodinámicas pueden causar acumulación de células embrionarias cerca de la cresta del septum ventricular, las cuales pueden diferenciarse dando como resultado una cresta fibrosa o fibromuscular(23). Por su parte, Gewilling y col., han sugerido que el patrón de flujo anormal puede deberse a la presencia de un anillo septal, mal alineamiento del septum interventricular, tracto de salida pequeño o elongado, o una banda muscular apical(24,25).
Otros autores apoyan la Teoría de la turbulencia y el estrés mecánico, sugiriendo que la turbulencia generada, independientemente del mecanismo, puede dañar el endotelio con depósito de fibrina y desarrollo de una banda fibromuscular típica(26).
En conclusión, aunque el mecanismo no está claro, la secuencia de eventos que explican la aparición de estenosis subaórtica, comienza con una anomalía morfológica subyacente, asociado a predisposición genética, con la consecuente proliferación celular.
La anormalidad hemodinámica primaria de la estenosis es la presencia de un gradiente de presión sistólica entre la cavidad ventricular y la aorta. Algunos estudios han revelado gradientes de más de 50 mmHg en 88 % de los casos, siendo éste responsable de la hipertrofia concéntrica ventricular entre otras cosas(9).
En nuestro estudio, no pudimos utilizar la clasificación más reciente de Choi y Sullivan, debido a que la misma es más anatómica, y nosotros analizamos especimenes de resección quirúrgica los cuales en su mayoría se recibieron fragmentados y sin la información clínica necesaria con respecto a los hallazgos intraoperatorios o ecocardiográficos. Igualmente, a pesar de contar con las características histopatológicas, no pudimos hablar de estenosis subaórtica membranosa o fibromuscular, pues conceptualmente, esta última compromete el miocardio del septum interventricular, tal y como ocurre en la miocardiopatía hipertrófica, siendo imposible relacionar los casos con esta entidad, de acuerdo a la información clínica, por lo cual la presencia de músculo cardíaco en algunos de los casos fue interpretada como consecuencia de la profundización del lecho quirúrgico en el miocardio subyacente. De la misma manera, no fue posible señalar los casos tipo Túnel o collar por las limitaciones anteriormente expuestas.
La estenosis subaórtica, ocurre en personas jóvenes, usualmente asintomáticas, siendo descubierta durante exámenes de rutina por la presencia de un soplo. El rango de edad oscila entre 18 días y 14 años, con una edad promedio de 3 a 5 años(27). Otros han reportado una edad promedio de 15 años. En nuestro estudio, comprobamos la presencia de la entidad en un grupo de mayor edad, porque sólo el 16,6 % resultaron menores de 11 años, encontrándose con mayor frecuencia en el grupo entre 11-20 años (50 %), con tan solo dos casos mayores de 30 años (37 y 38 años). Esto coincide con algunos reportes que sugieren su relativa frecuencia en adultos(28). En un estudio realizado en el Hospital de niños Memorial en Chicago, se encontró que la estenosis subaórtica discreta es más frecuente en hombres que en mujeres en una relación 2,5:1. Por otro lado, en cinco centros cardiológicos pediátricos en Canadá, la relación fue de 1,6:1(29). A diferencia de estos autores, Van Son y col. encontraron un mayor porcentaje de casos (51,5 %) en mujeres, lo cual coincide con lo encontrado por nosotros, con una incidencia mayor en mujeres (54,1 %) que en hombres (45,8 %)(30).
En cuatro de nuestros casos, se recibió conjuntamente las válvulas sigmoideas aórticas, en dos de ellos, con lesiones de chorro y cónsonas con reflujo sanguíneo. Esto se explica por el daño causado por el choque sistólico producido por la obstrucción subvalvular, capaz de generar insuficiencia aórtica hasta en el 50 % de los casos(31).
Dos de los casos de estenosis subaórtica de nuestro estudio, se asociaron a estenosis aórtica bivalva congénita, en solo uno de ellos se resecó conjuntamente la válvula aórtica debido a estenosis severa. Esta asociación es muy poco frecuente. Kelly y col., encontraron tan solo 1 de 20 casos de membrana subaórtica asociado con estenosis bivalva(32). Rohlicek y col. reportaron la asociación con válvula aórtica bicúspide en 13 de 92 pacientes(29).
Una de las complicaciones de la estenosis subvalvular aórtica es la endocarditis en la válvula aórtica, secundaria a las lesiones de chorro y que puede generar estenosis aórtica trivalvular como se vio en uno de nuestros casos.
En cuanto a los hallazgos histológicos, la mayoría de los autores, al igual que nosotros, reportan la presencia de fibrosis, fibras elásticas y fibras musculares lisas, sin un componente de miocardiocitos. Nosotros reportamos músculo cardíaco en siete casos, lo cual como mencionamos anteriormente, se interpretó como la profundización del lecho quirúrgico, y no como miocardiocitos formando parte de una banda fibromuscular.
Igualmente, en un estudio realizado, el examen histológico de un tejido subaórtico resecado en un recién nacido, reportó abundante matriz intersticial mixomatosa y células mesenquimáticas, predominantemente fibro-blastos sin presencia de colágeno denso o miocitos, siendo estas características similares al tejido endocárdico embrionario(20). Nosotros en cambio, encontramos degeneración mixoide en la mayoría de los casos, pero leve y focal, siendo la característica más relevante y constante la presencia más bien de colágeno denso.
La estenosis subvalvular aórtica, es una condición dinámica y progresiva, por lo cual se sigue sugiriendo en casos leves, el seguimiento de los pacientes de manera cercana, a fin de detectar la progresión de la enfermedad o la aparición de complicaciones, lo cual sería indicación de la resolución quirúrgica inmediata. Igualmente, los casos con obstrucción importante del tracto de salida del ventrículo izquierdo, experimentan una progresión rápida de la enfermedad, por lo cual se benefician desde el principio con la cirugía.
La cirugía para la resolución de la estenosis subaórtica acarrea un bajo riesgo de mortalidad, aunque algunos reportes han descrito complicaciones posoperatorias tales como bloqueo cardíaco y daño valvular mitral así como una tasa de recurrencia de 7%-27% y de reintervención de 20% o más(22). La mortalidad es significativamente mayor en pacientes con estenosis tipo túnel comparado con los casos de obstrucción discreta, particularmente en aquellos asociados con otras anomalías cardíacas(30).
Es importante concluir señalando la relevancia de una información clínica adecuada y de un trabajo en conjunto del patólogo con el clínico a fin de poder clasificar estas lesiones, tomando en cuenta la importancia que esto tiene desde el punto de vista pronóstico y en la toma de decisiones para su resolución. Igualmente mientras más se conozca de su estructura anatómica, macroscópica e histopatológica, más posibilidades habrá de conseguir evidencias en cuanto a su etiopatogenia.
Referencias
1. Mack G, Silberbach M. Aortic and pulmonary stenosis. Pediatrics in Review. 2000;21:1-5. [ Links ]
2. Edwars JE. Pathology of left ventricular outflow tract obstrucction. Circulation. 1965;31:586-599. [ Links ]
3. Reis RL, Peterson LM, Mason DT1, Simón AG. Congenital fixed subvalvular aortic stenosis. An anatomical classification and correlations with operative results. Circulation. 1971;43:I11-18. [ Links ]
4. Choi J, Sullivan I. Fixed subaortic stenosis: Anatomical spectrum and nature of progression. Br Heart J. 1991;65:280-286. [ Links ]
5. Kitchiner D. Subaortic stenosis: Still more questions than answers. Heart. 1999;82:647-648. [ Links ]
6. Paul J, Tani L, Williams R, Lambert L, Hawkins J, Minich L. Relation of the discrete subaortic stenosis position to mitral valve function. Am J Cardiol. 2002;90:1414-1416. [ Links ]
7. Suárez C, Alvarez A, Salazar S, Suárez L. Cardiomiopatía hipertrófica infantil y juvenil: Estudio post-mortem. Bol Hosp Univers Caracas. 1993;23:107-119. [ Links ]
8. Puigbó J, Cambellas I, Giordano H, Acquatella H, Gómez J, Casal H, et al. Estudio sobre la miocardiopatía hipertrófica: aspectos clínicos, ecocardiográficos, hemodinámicos y angiocardiográficos en una serie de treinta pacientes. Gac Méd Caracas. 2001;109:488-496. [ Links ]
9. Schoen F, Edwards W. Valvular heart disease: General principles and stenosis. En: Silver, Gotlieb, Schoen, editores. Cardiovascular Pathology. 3ª edición. Filadelfia, Pennsilvania: Churchill Livingstone; 2001: 402-39. [ Links ]
10. Blieden L, Allen H, Lucas R, Moller J. Discrete membranous subaortic stenosis: ECG and vectocardiographic findings. Am Heart J. 1984;107:1293-1296. [ Links ]
11. Bogdan A, Popescu M, Ghiorghiu L, Apetrei E, Gimghina C. Subaortic stenosis produced by an accessory mitral valve: The role of echocardiography. Echocardiography. 2005;22:39. [ Links ]
12. Hauser M. Fixed subaortic stenosis. Orphanet encyclopedia 2003. http://WWW.orpha.net/data/patho/GB/uk-FSS. [ Links ]
13. Aguilar C, Santo de Ssoto J, Descalzo A, Lillo T, Grueso J, Gil Fournier M. Estenosis subaórtica progresiva causada por tejido mitral accesorio. Rev Esp Cardiol. 1999;52:438-440. [ Links ]
14. Tansel O, Yagdi T, Atay Y, Engin C, Levent E, Buket S, Alayunt E. Discrete subaortic stenosis. Surgical outcomes and follow-up results. Tex Heart Inst J. 2003;30:286-292. [ Links ]
15. Newfeld E, Muster A, Milton P, Idriss F, Riker W. Discrete subvalvular aortic stenosis in childhood. Am J Cardiol. 1976;38:53-61. [ Links ]
16. Suárez C, Milano M, Fernandez H, Valderrama E. Evaluación de las biopsias procedentes del Hospital Universitario de Caracas (1981-2000). Avan Cardiol. 2002;22:1-9. [ Links ]
17. Schneeweiss A, Motro M, Shem-Tov A, Blieden L, Neufeld H. Discrete subaortic stenosis associated with congenital valvular aortic stenosis- A diagnostic challenge. Am Heart J. 1983;106:55-57. [ Links ]
18. Shem-Tov A, Schneeweiss A, Motro M, Neufeld H. Clinical presentation and natural history of mild discrete subaortic stenosis. Circulation. 1982;66:509-512. [ Links ]
19. Ercan H, Semra A, Sadi T, Halil G, Ayten I. Echocardiographic, morfologic, and geometric variations of the left ventricular outflow tract: Possible role in the pathogenesis of discrete subaortic stenosis. Angiology. 2000;51:2132-21. [ Links ]
20. Kleinert S, Ott D, Geva T. Critical discrete subaortic stenosis in the newborn period. Am Heart J. 1993;125:1187-1191. [ Links ]
21. Vogel M, Freedom R, Brand A, Trusler G, Williams W, Rowe R. Ventricular septal defect and subaortic stenosis: An analysis of 41 patients. Am J Cardiol. 1983;52:1258-1263. [ Links ]
22. Gersony W. Natural history of discrete subvalvular aortic stenosis: Management implications. JACC. 2001;38:843-845. [ Links ]
23. Rosenquist G, Clark E, McAllister H, Bharati S, Edwards J. Increased mitral-aortic separation in discrete subaortic stenosis. Circulation. 1979;60:70-74. [ Links ]
24. Gewilling M, Daenen W, DuMoulin M, Van der Hauwaert L. Fheologic genesis of discrete subvalvular aortic stenosis: A Doppler echocardiographic stufy. J Am Coll Cardiol. 1992;19:818-824. [ Links ]
25. Hegesh J, Marx G, Allen H. Development of a subaortic membrane after surgical closure of a membranous ventricular septal defect in an infant. Am Heart J. 1987;114:899-902. [ Links ]
26. Cilliers A, Gewilling M. Rheology of discrete subaortic stenosis. Heart. 2002;88:335-336. [ Links ]
27. Onbasili AO, Tekten T, Ceyhan C. Subaortic stenosis caused by flail discrete membrane in an older patient. Heart. 2004;90:399. [ Links ]
28. Oliver JM, González A, Gallego P, Sánchez A, Benito F, Mesa JM. Discrete subaortic stenosis in adults: Increased prevalence and slow rate of progression of the obstruction and aortic regurgitation. J Am Coll Cardiol. 2001;38:835-842. [ Links ]
29. Roholicek C, Del Pino F, Coté J, Finley J. Natural history and surgical outcomes for isolated discrete subaortic stenosis in children. Heart. 1999;82:708-713. [ Links ]
30. Son J, Schaff H, Danielson G, Hagler D, Puga F. Surgical treatment of discrete and tunnel subaortic stenosis. Circulation. 1993;88:159-169. [ Links ]
31. Attia M, Mostafá M, Ibrahim F. Association of subaortic membrane in patients presenting with severe aortic regurge. J. Of Egypt. Society of Cardiothorac. Surg. 2002;10:349-352. [ Links ]
32. Kelly D, Wulfsberg E, Rowe R. Discrete subaortic stenosis. Circulation. 1972;46:309. [ Links ]













