Revista del Instituto Nacional de Higiene Rafael Rangel
versión impresa ISSN 0798-0477
INHRR vol.43 no.1 Caracas jun. 2012
Obtención de Antraquinona contenida en el exudado de Aloe Vera (L.) Burm. f. (Zábila)
OSWALDO SAAVEDRA1, CARLOS RONDóN1, MÁxIMO GALLIGNANI1, CARLOS AYALA1, MARGARELLI NICOLA2
1 Laboratorio de Espectroscopia Molecular. Departamento de Química. Facultad de Ciencias. Universidad de Los Andes e-mail: saavedra@ula.ve / oswaldo_phd@hotmail.com
2 Departamento de Química. Instituto Universitario de Tecnología Alonso Gamero.
RESUMEN
La investigación tuvo como propósito obtener la antraquinona contenida en el exudado de Aloe vera (L.) Burm.f. (zábila) mediante el método de cristalización y su identificación mediante la técnica de espectrofotometría de radiación infrarroja. La muestra la conformaron 18 plantas de zábila, recolectadas al oeste de la ciudad Santa Ana de Coro, estado Falcón. Se utilizaron tres métodos para la obtención de antraquinona a partir del exudado de zábila. En el método A, la antraquinona se obtuvo por descenso de la temperatura; en el método B, las muestras fueron liofilizadas y luego se disminuyó la temperatura; y en el método C, la antraquinona se obtuvo mediante un modificador de matriz. Con el método A se obtuvo un rendimiento de antraquinona de 7,65 ± 4,62% p/p; con el método B 5,74 ± 3,25 % p/p y con el método C 25,93 ± 1,49% p/p. El mayor rendimiento de antraquinona se obtuvo con el método de precipitación mediante modificador de matriz.
Palabras clave: Antraquinona, Aloe vera, zábila, Aloína.
Anthraquinone obtention from Aloe Vera (L.) Burm. f. Exudate
ABSTRACT:
The purpose of this wok was obtain the anthraquinone from Aloe vera exudate applying method by crystallization and identifies it through spectrophotometric infrared and ultraviolet- visible techniques. The sample were 18 plants of Aloe vera, recollected at west of Coro city, Falcón state. It was used 3 methods to obtain anthraquinone from Aloe vera exudate. In the method A, anthraquinone was obtained by temperature descend; in the method B, the samples were lyophilized and temperature descends; and in the method C, anthraquinone was obtained by matrix modifier. With the method A it was obtained 7,65 ± 4,62% w/w of anthraquinone; with method B 5,74 ± 3,25 % w/w and with the method C 25,93 ± 1,49% w/w. The method with the best efficiency to obtain anthraquinone was the method C.
Keywords: Aloin, Aloe vera, Aloe vera exudate, Aloin.
INTRODUCCIÓN
La investigación se centra en la obtención de antraquinona contenida en el exudado de Aloe vera. Las antraquinonas, entre ellas la aloína, es una sustancia de uso medicinal y farmacológico y, de hecho, se utiliza en variadas especialidades farmacéuticas, dirigidas a solucionar problemas de salud, entre algunos: para purgar, tratar heridas, infecciones bucales, laxante natural indicado en estreñimiento de cualquier origen o causa, coadyuvante en el tratamiento de los procesos inflamatorios del tracto gastrointestinal, en enfermedades gastrointestinales crónicas como úlceras, gastritis y en hemorroides; en enfermedades respiratorias, tales como asma bronquial, bronquitis crónica y coadyuvante en la fluidificación de las secreciones bronquiales(1).
Pero la aloína también ha sido objeto de interés comercial, la misma se cotiza a buen precio en el mercado internacional, siendo su mayor valor como aloína purificada.
Pero debido al escaso conocimiento que se tiene sobre la obtención y purificación de este compuesto, la mayoría de los países exportan la pasta de zábila, materia prima sobre la cual se obtiene, principalmente, la aloína, mas de un menor valor comercial(2,3,4,5).
El Aloe vera, es una planta conocida con diversos nombres, tales como zábila, sábila, Aloe de Çurazao y con los nombres científicos Aloe vera (L.) Burm.f. y Aloe barbadensis Miller. Es una fuente natural de antraquinonas, que posee un alto contenido de aloína. Aunque la planta posee diversos compuestos, la atención se ha fijado por años en la aloína.
El exudado de zábila, además conocido como zumo o látex, se obtiene al cortar las hojas de la roseta de la planta en su base y permitiendo que escurra, recolectándose en un recipiente. El exudado obtenido se somete a evaporación y, cuando alcanza la consistencia adecuada, se deja endurecer, conformándose la denominada pasta de zábila o acíbar, también conocido como áloe o áloes(6).
Este exudado es un líquido amarillo y de sabor amargo. Dependiendo de la especie y las condiciones de cultivo, puede contener entre un 5 a 30% p/p de barba - loína (aloína); componente principal de interés comercial, medicinal y farmacológico.
La especie que se cultiva en Venezuela es la conocida como áloe de Curaçao, también llamada Aloe barbadensisMiller y como Aloe vera (L). Burm. f.(7). Esta especie rinde el mayor porcentaje de aloína y es la aloína más común, desde un punto de vista comercial.
Características físico-químicas de la aloína La aloína es un polvo microcristalino de color amarillo limón a amarillo oscuro, con olor a áloe y sabor amargo. Es un catártico perteneciente al grupo de las antraquinonas(6). Tiene una masa molecular de 418,39 g/mol y su fórmula molecular es C21H22O9.
La presente investigación esta orientada hacia la obtención de las antraquinonas del exudado de zábila mediante su precipitación, tratando de mantener la muestra lo más cercana posible a sus condiciones naturales, a los fines de que sea apta para consumo humano. Por otra parte, se propone su identificación por técnicas espectrofotométricas, como es la espectrofotometría de radiación infrarroja (IR) y espectrofotometría ultravioleta visible, pues en ellas la cantidad de muestra que se utiliza es del orden de los microgramos, y las antraquinonas se encuentra en el exudado de Aloe vera en la cantidad suficiente para realizar los ensayos requeridos con estas técnicas(8). Objetivo de la investigación Obtener antraquinona contenida en el exudado de Aloe vera, de manera que la muestra sea apta para el consumo humano. Objetivos específicos – Precipitar la antraquinona contenida en el exudado de zábila, empleando el método de cristalización. – Determinar la cantidad de antraquinona obtenida. – Establecer el método de precipitación por cristalización de antraquinona con el mayor rendimiento. – Caracterizar la antraquinona precipitada por medio de métodos instrumentales de análisis como la espectrofotometría infrarroja y ultravioleta-visible.
MATERIALES Y MÉTODOS
Seguidamente se señalan los materiales, reactivos, equipos, recolección y tratamiento de la muestra utilizados en la presente investigación, con la finalidad de obtener, cuantificar e identificar la aloína contenida en el exudado de penca de zábila.
Materiales
Vasos de precipitados, vidrio reloj, matraces erlenmeyer, desecador, embudo para filtración por gravedad, porta embudo, soporte universal, termómetro, porta para pastilla de KBr.
Reactivos
Cloruro de sodio (NaCl) al 99,8% de pureza, de la casa J.T. Baker Chemical. Aloína estándar (C21H22O9) al 70% de pureza (Aloína A), de la casa Figura 1. Fórmula estructural de la aloína. Sigma Chemical.
Bromuro de potasio (KBr), al 99,5% de pureza, de la casa Analar, grado espectroscópico.
Equipos
Espectrofotómetro infrarrojo, marca Perkin Elmer, modelo FT-IR Spectrometro Spectrum 2000, acoplado a un computador personal con software Spectrum v 2.00, detector DTGS (sultato de triglicina adulterado), rango de cobertura 380 – 10.000 cm-1. Prensa hidráulica, marca In ternacional Cristal Laboratory (ICL), de 0 a 12 toneladas. Espectrofotómetro ultravioleta-visible, marca Perkin Elmer, modelo Lambda 20, acoplado a un computador personal con un software UVWinlab, cobertura espectral 900 a 290 nm. Liofilizador, marca LyovaC GT 2. Leybold –Heraus. Balanza electrónica, marca ER-180A. AND. Estufa, marca Beckman, modelo 1270. Sistema de agua ultrapura, marca Barnsted, Nano Pure Infinity. Ne ve ra, marca Electroluz, modelo Premium.
Muestras
Las muestras de exudado de zábila se recolectaron al oeste de la ciudad de Santa Ana de Coro, estado Falcón, en plantas de cinco años de edad, en época de inflorescencia. En total, se obtuvo exudado de 18 plantas, las cuales fueron procesadas por distintos procedimientos para obtener antraquinona precipitada.
Tratamiento de las muestras
Las muestras recolectadas se clasificaron en tres grupos, de seis muestras cada uno. Cada grupo se sometió a un procedimiento distinto con el objeto de precipitar las antraquinonas, y establecer con cuál método se obtendría el mayor rendimiento de antraquinona precipitada.
El primer grupo de muestras se colocaron en una nevera a 3 °C por 24 horas, con la finalidad de precipitar las antraquinonas, luego de filtradas las muestras fueron colocadas en un desecador, finalmente fueron pesadas y determinado su rendimiento (método A).
El segundo grupo de muestras se colocaron en un liofilizador por 24 horas, luego fueron colocadas en una nevera por 24 horas a 3 °C, para completar la precipitación de antraquinonas; posteriormente, se filtraron y el precipitado se colocó en el desecador, por último, se pesaron y se determinó su rendimiento (método B).
En el tercer grupo de muestras, la antraquinona se precipitó mediante un modificador de matriz, en este caso se empleó cloruro de sodio al 25% p/p, siguiendo los lineamientos de investigaciones previas(5), ya que a esta concentración de NaCl se obtiene el mayor porcentaje de antraquinona precipitada, estando las muestras a una temperatura ambiente de 25 °C; debe acotarse que la solubilidad máxima del cloruro de sodio a esa temperatura es 31,1% p/p. Luego de precipitada la antraquinona, se filtró, y el precipitado obtenido fue colocado en una estufa a 70 °C por 24 horas, para su total secado; después, el precipitado se colocó en un desecador para su enfriamiento, luego se pesó y determinó su rendimiento (método C).
Todas las muestras antes de someterlas a los procedimientos respectivos, se les agregó sorbato de potasio (C6H7O2K) al 0,075 %p/p y benzoato de sodio (C6H5COONa) al 0,035% p/p, previa pesada del exudado de zábila, con el fin de retardar la fermentación y oxidación de las muestras. Asimismo, se midió el pH y se calculó la densidad de estas muestras.
RESULTADOS
A continuación se presentan y discuten los resultados obtenidos de la aplicación de las metodologías propuestas para la precipitación de la antraquinona contenida en el exudado de Aloe vera. Una vez obtenidos los precipitados de antraquinona, se procede a su identificación mediante técnicas espectroscópicas, específicamente, la espectrometría de ab sorción de radiación infrarroja y ultravioleta-visible; comparándose el espectro obtenido de la muestras de antraquinona precipitada con el espectro de un patrón de aloína, una antraquinona contenida en el exudado de penca de zábila.
Precipitación de antraquinona en el exudado de zábila
Se inicia con los resultados obtenidos del método de obtención de antraquinona mediante descenso de la temperatura. Prosigue el método de obtención de antraquinona por liofilización y descenso de la temperatura. Finalmente, se tiene el resultado proveniente de la obtención de la antraquinona por una sustancia modificadora de matriz, que en este caso fue cloruro de sodio. Se observa en la tabla 1 que, tomando en cuenta los valores promedio, el peso de exudado de las hojas de zá bila obtenido fue de 13,00 ± 1,96 g, ocupando un volumen de 11,7 ± 1,9 mL, arrojando una densidad de 1,11 ±
0,04 g/mL, siendo el pH de 4,65 ± 0,04. Luego de colocar las muestras en la nevera a 3 ºC por 24 horas, y posterior filtración y secado, se obtuvo una masa de antraquinona precipitada de 1,048 ± 0,76 g, que representa un porcentaje de 7,65 ± 4,62% p/p de rendimiento. Se deduce de este resultado, que funcionó el descenso de la temperatura como mecanismo para lograr la precipitación de la antraquinona contenida en el exudado de zábila; dado que la solubilidad de una sustancia es proporcional a la temperatura, al disminuir la temperatura se disminuye la solubilidad, por ende, precipita la antraquinona que ahora, por la concentración en que se encuentra, no puede ser solubilizada en el medio.
A objeto de descartar posibles valores anómalos en el cálculo del promedio obtenido de antraquinona, se pro cedió a aplicar a los resultados del peso de antraquinona obtenida el estadígrafo Q de Dixon(9). Para ello, se ordenaron los datos de menor a mayor.

Se observa en la tabla 2, que los valores obtenidos no son anómalos, ya que, para todos los casos, la Q de Di xon calculada fue menor que la Q de Dixon crítica, para N = 6, al nivel de confianza del 95%, no evidenciándose diferencia estadística significativa. Por lo tanto, todos los valores del peso de antraquinona obtenida se aceptan.
En la tabla 3 se observa que, considerando valores promedios para todas las variables, se obtuvo un peso de exudado de zábila de 12,88 ± 2,24 g, el volumen fue de 11,4 ± 2,0 mL, correspondiendo a una densidad de 1,13 ± 0,03 g/mL, ubicándose el pH en 4,62 ± 0,08. Después de liofilizar las muestras y colocarlas en una nevera por 24 horas a 3 ºC, una vez filtradas y secadas, la cantidad de antraquinona obtenida fue de 1,15 ± 1,12 g, rindiendo un 8,53 ± 7,41 % p/p.
Para determinar si los valores del peso de antraquinona obtenida con este método son anómalos o no, se procedió a aplicar el estadígrafo Q de Dixon.
Se puede apreciar en la tabla 4, que el valor de 3,32 g de antraquinona obtenida fue el único valor que resultó anómalo, ya que la Q de Dixon calculada es mayor que la Q de Dixon crítica, siendo estadísticamente significativa al nivel de confianza del 95%, por lo tanto este valor no se acepta, de allí que no se debe emplear en el cálculo del promedio del peso de antraquinona. En consecuencia, el promedio y desviación estándar del peso de antraquinona obtenida mediante el método de liofilización y descenso de temperatura son 0,71±0,38, para un rendimiento de 5,74 ± 3,25% p/p.





El porcentaje de humedad, en promedio, luego de lio filizar las muestras durante 6 horas, fue de 16,45 ± 4,27% p/p. No se mantuvo un tiempo mayor las muestras en el liofilizador para evitar la pérdida de mucho agua o que la muestra se secara.
Por otra parte, se recolectó un volumen total de 138,8 mL de exudado de zábila, provenientes de 72 pencas, lo que significa 1,9 mL por hoja o penca de zábila En la tabla 4 se puede apreciar que, en general, la densidad experimentó un descenso en todas las muestras, tanto en las muestras tratadas por descenso de la temperatura como en las tratadas por liofilización y descenso de temperatura, luego de la precipitación de la antraquinona. Encontrándose una diferencia estadísticamente significativa entre los valores iniciales y finales de la densidad, al nivel de 95% de confianza (F = 57,65, p = 1,38E-7, N = 12), a favor de la densidad final; lo que pone en evidencia que se retiró una cantidad significativa de antraquinona del exudado de zábila.
Asimismo, no se encontró diferencia estadísticamente significativa, al nivel de confianza del 95%, entre el porcentaje obtenido de antraquinona precipitada del exudado en las muestras procesadas por descenso de la temperatura y las muestras procesadas por liofilización y descenso de temperatura (F = 0,06, p = 0,811, N = 6). Aún descartando los valores extremos en ambas grupos de muestras, en la no liofilizada la muestra 1, con 15,23% p/p, y en la liofilizada la muestra 5, con 22,44% p/p, no existe diferencia estadísticamente significativa entre las varianzas de las muestras, a nivel del 95% de confianza (F = 0,04, p = 0,85, N = 5.
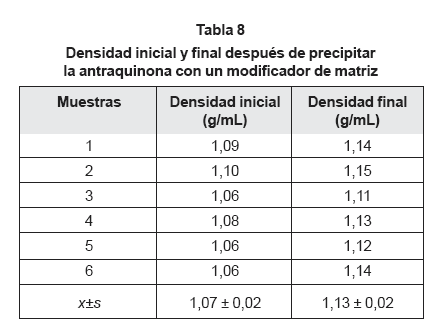
En la tabla 5, se presentan los resultados obtenidos con el empleo de un modificador de matriz para precipitar antraquinona en el exudado de zábila. Observando los valores promedio obtenidos para todas las variables medidas en el experimento, se tiene que el peso de exudado recolectado fue de 16,7830 ± 0,5685 g, ocupando un volumen de 15,6 ± 0,4 mL, reportándose una densidad de 1,07 ± 0,02 g/mL, siendo el pH medido de 4,91 ± 0,02. Además, el volumen de exudado recolectado fue de 93,7 mL, proveniente de 55 pencas de zábila, obteniéndose un promedio de 1,70 mL por penca.
Después de agregado el modificador de matriz a las muestras, que en el caso que nos ocupa se trató de cloruro de sodio (NaCl) al 25% p/p, estando las muestras a 25 ºC, luego de dejar las muestras en un lugar oscuro y fresco por 24 horas, se filtró, y se dejó el precipitado en una estufa a 70 ºC por 24 horas, posteriormente se colocó en un desecador para su enfriamiento. La cantidad, en promedio, de antraquinona precipitada fue de 4,35 ± 0,17 g, produciendo un rendimiento de 25,93 ± 1,49% p/p.
Este mecanismo para precipitación de la antraquinona fue efectivo, lo que significa que el cloruro de sodio desplazó a la antraquinona asociada con el agua en el exudado de zábila, en consecuencia, la antraquinona precipita y el cloruro de sodio permanece disuelto en el sobrenadante.
Se observa en la tabla 6, un aumento en la densidad de todas las muestras después de agregar el modificador de matriz. Siendo estadísticamente significativa la diferencia entre la densidad inicial y la final, al nivel de 95% de confianza (F = 31,89, p = 2,13E-4, N = 6). La diferencia observada es a favor de la densidad final, lo que pone en evidencia que el modificador de matriz (NaCl) se disolvió en el exudado de zábila, quedando en solución en el líquido sobrenadante.
Por otra parte, al comparar estadísticamente los valores obtenidos en el porcentaje de antraquinona precipitada con los tres métodos de obtención empleados, se encuentran diferencias estadísticamente significativas, al nivel de confianza de 95%, entre los porcentajes de antraquinona precipitada en las muestras procesadas por descenso de la temperatura y liofilización y enfriamiento con respectos a los valores obtenidos en las muestras en las que se empleó modificador de matriz, a favor de la precipitación de antraquinona con modificador de matriz (F = 84,93, p = 3,34E-6, N = 6 y F = 31,79, p = 2,16E-4, N = 6, respectivamente).

Este resultado pone en evidencia que el método más efectivo para precipitar antraquinona contenida en el exu dado de Aloe vera, es empleando modificador de ma triz; ya que con este método se obtuvo el mayor rendimiento de antraquinona precipitada, siendo estadísticamente significativa la diferencia observada en el rendimiento, con respectos a los otros dos métodos empleados.
De acuerdo con los resultados obtenidos de la precipitación de antraquinona a partir del exudado de zábila, se puede decir, que la cantidad de antraquinona obtenida con los tres métodos aplicados se encuentra dentro de los valores reportados en investigaciones documentales, esto es, entre 5 y 30% p/p(6).
El valor de porcentaje de antraquinona precipitada obtenido en la presente investigación empleando modificador de matriz, guarda relación con el obtenido en otra investigación(5), en la cual se obtuvo un porcentaje de antraquinona precipitada en el orden de 28,99 ± 2,49% p/p, a 25 ºC, por 24 horas, pero a un pH de 3, y se reporta una densidad de 1,05 g/mL.
En este orden de ideas, en una investigación realizada en cultivos de zábila del estado Falcón(10), se reporta para el exudado de zábila un pH de 4,66 ± 0,32 y una densidad de 1,06 ± 0,01 g/mL, valores que guardan cierta coincidencia con los encontrados en esta investigación (pH = 4,72 ± 0,05 y densidad 1,11 ± 0,03 g/mL; valores promedio de todas las muestras). Además, señalan haber obtenido 30,5 ± 5,85 mL de exudado por penca y un porcentaje de aloína en la pasta de zábila de 27,69 ± 11,12% p/p.
El valor de aloína obtenida difiere, de manera apreciable, con los reportados en la presente investigación con relación a la cantidad de antraquinona obtenida con los métodos de disminución de la temperatura (7,65 ± 4,62% p/p), y el de liofilización y enfriamiento (5,74 ± 3,25% p/p); pero cercano a lo obtenido con el mé todo de precipitación de aloína por modificador de matriz (25,93 ± 1,49% p/p).
Al realizar una prueba F(9) a los datos obtenidos con el método de obtención de antraquinona precipitada con modificador de matriz y los valores reportados para el método de obtención de aloína a partir de pasta de zábila, no se encontraron diferencias estadísticamente significativas, al nivel de 95% de confianza (F = 0,145 ; p = 0,71).
Por otra parte, existe una correlación negativa y significativa entre las variables densidad y porcentaje de aloína; esto fue evidenciado al realizar un análisis de correlación de Pearson a estas variables(9). La correlación negativa indica que existe una relación inversa entre estas variables, es decir, a menor densidad mayor cantidad de aloína.
A manera de síntesis, aunque la aloína que contiene la zábila se puede obtener de la pasta, del gel y del exudado, generalmente, ésta se obtiene de la pasta, la cual arroja un buen rendimiento(2,10). La aloína obtenida a par tir de esta materia prima se utiliza con fines de comercialización y en algunas fórmulas farmacéuticas(11,12).
La aloína obtenida del gel tiene el menor rendimiento, llegándose a reportar 0,25% p/p de aloína(13); de manera que, prácticamente, no se utiliza como materia prima para la obtención de aloína. Se utiliza, principalmente, en la industria cosmética y farmacéutica en productos para el cuidado de la piel y agente suavizante(14). Mientras que la obtención de aloína a partir del exudado de zábila, con el método de antraquinona preci pitada a través de un modificador de matriz da un buen rendimiento, próximo al que se obtiene a partir de la pasta de zábila, y requiere menos tratamiento.
Identificación de la antraquinona
A continuación se presentan los espectros de la antraquinona precipitada, obtenidos por espectrometría de absorción de radiación infrarroja y ultravioleta visible.
El espectro infrarrojo fue realizado sobre el patrón de antraquinona y sobre una muestra de aloína, ambos mez clados con bromuro de potasio (KBr) para elaborar una pastilla.

Los espectros de la figura 2, representan el color ne - gro el espectro de la pastilla de KBr, el espectro de color azul la pastilla del patrón de aloína con KBr y el espectro color rojo la pastilla de la muestra de antraquinona precipitada y KBr.
Se puede inferir de estos espectros, que sus bandas se superponen, siendo esto una evidencia que los es - pec tros corresponden a una misma sustancia, que para el caso en estudio es la aloína.
Los espectros de la figura 3 representan, el color ne - gro el espectro del patrón de aloína con KBr, los espectros color verde y rojo la pastilla de muestras de antraquinona precipitada y KBr. Estos espectros muestran las bandas de absorción de radiación infrarroja entre 2535,3 a 222,9 cm-1, incluyendo la región de la huella dactilar (1200-600 cm-1), zona en la que se identifica un compuesto, por la peculiaridad de su espectro.
Los espectros tanto de la muestras como el del pa - trón se superponen entre sí, lo que es una evidencia de la similitud existente entre ellos, lo que permite concluir que se trata de la misma sustancia, aloína, en este caso. De acuerdo con lo señalado en la teoría(8), la zo na de la huella dactilar que se encuentra entre 1200 y 600 cm-1 permite la identificación de compuesto, ya que pe queñas diferencias en la estructura y la constitución de una molécula ocasionan cambios significativos en el es pectro y la distribución de los picos en la región. Por es ta razón, coincidencias entre los espectros de dos com puestos en esta región espectral es una evidencia de su identidad.
Seguidamente se presentan los espectros electrónicos de la antraquinona precipitada, estos espectros se realizaron en solución diluida, utilizando como solvente agua. El espectro ultravioleta-visible fue realizado sobre el patrón de aloína y sobre una muestra de antraquinona.
En la figura 4 se observan el espectro ultravioletavisible del agua en color rojo, del patrón de aloína en co - lor azul y de la muestra de antraquinona precipitada en color verde. Se deduce de los espectros, que la banda a 210 nm que aparece en el patrón de aloína no se percibe en el espectro de muestra de aloína precipitada, la banda a 252,1 nm en el patrón aparece a 253 en la muestra, la ban da que se encuentra a 299,1 en el patrón se observa a 297,07 en la muestra y por último la banda a 383,5 en el patrón aparece también en la misma longitud de onda en la muestra.

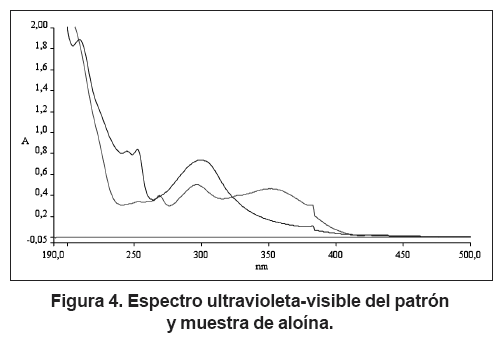
En consecuencia, se puede expresar que debido a la similitud encontrada en ambos espectros, se trata de la misma sustancia; en este caso, de la aloína. Se observan ligeras diferencias en la longitud de onda en que aparecen algunas bandas en los espectros del patrón y la muestra, que se pueden explicar por el entorno mo - lecular que rodea las moléculas de aloína en el patrón y en la muestra.
Este resultado concuerda con investigación realizada en el estado Falcón sobre antraquinonas en Aloe vera barbadensis de zonas semiáridas, en la cual se reporta la elucidación del compuesto 1,8 dihidroxiantraquinona, sugiriendo que los compuesto químicos presentes en el exudado de la planta tienen el esqueleto antraquinónico. Los espectros infrarrojos indican la presencia de grupos OH alcohólicos, fenólicos, ácidos, y grupos carboxílicos característicos de aldehídos, cetonas o ácidos; hallazgos que también son coincidentes con los espectros infrarrojos presentados en este artículo(14).
Por otra parte, los ensayos realizados para cuantificar la aloína por ultravioleta –visible muestran evidencia que no se ajustan a la linealidad requerida por la ley Beer(8).
Finalmente, se debe mencionar que además de la aloína, las otras antraquinonas que se puede encontrar en el exudado de penca de zábila es la aloe-emodina y los aloinosidos A y B. La aloe-emodina es un producto de degradación de la aloína, por lo que su presencia depende de la técnica empleada en la preparación y en las condiciones de conservación del exudado. Mientras que los aloinosidos se encuentran en pequeñas cantidades, e incluso no se reportaron en Aloe barbadensisMiller, de acuerdo a una caracterización de exudado realizada por cromatografía de fase reversa(15). Esto pone en evidencia que el precipitado obtenido del exudado de Aloe vera, es fundamentalmente aloína.
CONCLUSIONES
De los resultados obtenidos y los objetivos propuestos en la investigación, se concluye lo siguiente. La separación de la aloína del exudado de Aloe vera mediante su precipitación, fue satisfactoria; por cuanto se logró por el método de cristalización, despojar el exudado de zábila de su contenido de antraquinona. La cantidad de antraquinona obtenida fue la siguiente: por el método de descenso de la temperatura 7,65 ± 4,62% p/p; por el método de liofilización y enfriamiento 5,74 ± 3,25% p/p y por el método de precipitación de antraquinona por modificador de matriz 25,93 ± 1,49% p/p. El mayor rendimiento de antraquinona se obtuvo con el método de precipitación mediante modificador de matriz.
El análisis estadístico de estos valores reveló que no existe diferencia significativa, al 95% de confianza, entre el rendimiento obtenido de antraquinona por el método de descenso de la temperatura con respecto al rendimiento de antraquinona obtenido por el método de liofilización y enfriamiento. Pero si existe diferencia significativa entre estos métodos y el método de precipitación de antraquinona mediante modificador de matriz; estando la diferencia a favor de éste último método.
Los métodos instrumentales de análisis como la espectrofotometría infrarroja y ultravioleta-visible permitieron caracterizar la antraquinona obtenida; corroborándose, a través de los espectros, que el precipitado obtenido mediante el método de gravimetría de precipitación es, efectivamente, aloína.
Por último, se presenta un método sencillo con el cual se puede obtener antraquinona, de una forma natural, a partir del exudado de zábila.
REFERENCIAS
(1) Reynolds T. The compounds in Aloe leaf exudates: a review. Botanical Journal of the Linnean Society. 1985. 90, pp. 157-177.
(2) Madrid J. Separación de aloína en pasta de zábila. Trabajo de ascenso no publicado. Instituto Universitario de Tecnología Alonso Gamero. Coro, estado Falcón; 1996. [ Links ]
(3) Zambrano HP. Perfil preliminar del mercado de la zábila (aloe vera) en el estado Falcón, Venezuela. Bioagro. 2005, 17, 2. [ Links ]
(4) Sigma/Aldrich (2005).Manual de reactivos. Recuperado el 17 de marzo de 2008, disponible: http://www.Sigmaaldrich.com . [ Links ]
(5) Margarelli NY, Landa K. Desarrollo de un proceso químico para la obtención de una fase insoluble rica en aloína por modificación de matriz. Caso acíbar Aloe (L.) Burm. f. Tesis de grado no publicada. Instituto Universitario de Tecnología Alonso Gamero, Coro. Venezuela; 2006. [ Links ]
(6) Claus EP y Tyler VE. Farmacognosia. Buenos Aires, Argentina: Ateneo; 1977.
(7) Grindlay D y Reynolds T. The Aloe vera phenomenon: A review of the properties and modern uses of the leaf parenchyma gel. Journal of Ethnopharmacology. 1986: 1986; 16: 117-151.
(8) Skoog DA, Holler FJ y Nieman TA. Principios de análisis instrumental. 5ta. Edición. Madrid, España: McGraw-Hill; 2001.
(9) Miller JC y Miller JN. Statistics for analytical chemistry. 3ra edición. Londres, Inglaterra: Ellis Horwood PTR Pren tice Hall; 1993.
(10)Maldonado C. Análisis parcial del control de calidad en acíbar y pasta de zábila (Aloe Barbadensis Miller). Croa zatia. 2000, (1), 1, 57-65.
(11) Intercon. Vademécum Farmacológico Venezolano. 10ª edición. Caracas, Venezuela, Ediciones Médicas Hispánicas; 2003. (12) Lehr de Spilva A, Muktans SY y Navarrete MR. Guía Spilva de las especialidades farmacéuticas. XXXa edición. Caracas: Global ediciones, S.A; 2008.
(13)Arias M y Rivas P. Aloe vera: Obtención y estabilización de principios activos para su utilización en preparaciones farmacéuticas. Tesis no publicada. Universidad de los Andes, Facultad de Farmacia, Mérida Venezuela; 1992.
(14)Prato M, Ávila R, Donquis C, Medina E y Reyes R. Antraquinonas en Aloe vera barbadensis de zonas semiáridas de Falcón, Venezuela, como inhibidores de la corrosión. Re vista Multiciencias. 2008; 8, 2: 148-154.
(15)Saccú D, Bogoni P y Procida G. Aloe exudate: Characterization by Reversal Phase HPLC and Headspcae GC-MS. J Agric, Food Chem. 2001; 49: 4526-4530.












 uBio
uBio 
