Revista del Instituto Nacional de Higiene Rafael Rangel
versión impresa ISSN 0798-0477
INHRR vol.46 no.1-2 Caracas dic. 2015
Evaluación de la expresión de marcadores celulares p16 INK4a, PCNA y Cadherina E, mediante técnicas inmunohistoquimicas en lesiones de cuello uterino causadas por virus del papiloma humano.
Evaluation of the expression of cellular markers p16 INK4a, PCNA and E-cadherin by immunohistochemical techniques in cervical lesions caused by human papilloma virus.
Marwan Said Aguilar Mejia1,2, Miguel Antonio Rojas Mendoza3, Pedro Jose Michelli Gago1, Joseba Celaya1
1: Laboratorio de Patología Molecular, Cátedra de Anatomía Patológica, Escuela de Medicina Luis Razetti, Facultad de Medicina, Universidad Central de Venezuela (UCV)
2: Departamento de Virología, Gerencia Sectorial de Diagnóstico y Vigilancia Epidemiológica, Instituto Nacional de Higiene Rafael Rangel
3: Instituto de Biomedicina, Universidad Central de Venezuela (UCV)
Autor responsable de la correspondencia: Marwan Aguilar
Ubicación: Dpto. de Virología, Gerencia Sectorial de Diagnóstico y Vigilancia Epidemiológica, Instituto Nacional de Higiene Rafael Rangel (INHRR) Ciudad Universitaria, Caracas.
Correo electrónico: marwaguilar@yahoo.com, marwan.aguilar@inhrr.gov.ve
Número de teléfono: 04265164712
RESUMEN
Las infecciones por virus de papiloma humano (VPH) influyen en la expresión de proteínas del ciclo celular y producen alteraciones en el epitelio cervical que promueven el desarrollo de la neoplasia intraepitelial cervical (NIC); los genotipos de VPH se agrupan en VPH de bajo o de alto riesgo oncogénico. Las oncoproteínas virales E6 y E7 de los VPH de alto riesgo (16 y 18), se unen a varios reguladores del ciclo celular, por lo tanto están relacionadas con lesiones de alto grado y cáncer de cuello uterino. El objetivo de este trabajo fue evaluar 36 biopsias de cuello uterino mediante inmunohistoquímica y medir la expresión de los marcadores celulares siguientes: Antígeno Nuclear de Proliferación Celular (PCNA), la proteína de adhesión celular Cadherina E que se inactiva en los momentos iniciales de invasión y metástasis, la expresión de la proteína p16-INK4 que es un inhibidor de las ciclinas que participa en el punto de control G1 del ciclo celular en lesiones de cuello uterino. Los resultados obtenidos indicaron que en todas las muestras evaluadas se obtuvo un incremento en la expresión de P16INK4a (95,86%) y de PCNA (92,27%) en zonas con lesión comparado con zonas sin lesión y una disminución en la expresión de cadherina E (18,94%) en zonas con lesión. En conclusión, el marcador celular p16INK4a (P<0,0033) mostró un mejor comportamiento predictivo de la evolución de las lesiones que PCNA y Cadherina E.
Palabras Clave: Virus del Papiloma Humano, Lesiones del Cuello Uterino, Inmunohistoquímica, Infecciones de Transmisión Sexual
SUMMARY
Infections human papillomavirus (HPV) influence the expression of cell cycle proteins and produce changes in the cervical epithelium that promote the development of cervical intraepithelial neoplasia (CIN); HPV genotypes are grouped into HPV low risk or highoncogenic. Viral oncoproteins E6 and E7 of high-risk HPV (16 and 18), bind to various cell cycle regulators, therefore they are related to high-grade lesions and cervical cancer. The aim of this study was to evaluate 36 cervical biopsies by immunohistochemistry and measuring the expression of the following cellular markers: Nuclear Antigen Cell Proliferation (PCNA), the cell adhesion protein E-cadherin is inactivated in the initial moments of invasion and metastasis, p16 expression-INK4 protein is a cyclin inhibitor involved in the G1 checkpoint in the cell cycle cervical lesions. The results showed that in all samples tested increased the expression of p16INK4a (95.86%) and PCNA (92.27%) in lesion areas compared to areas without injury and a decrease in expression was obtained Ecadherin (18.94%) in areas with injury. In conclusion, the p16INK4a cell marker (P <0.0033) showed a better predictive performance of the evolution of lesions PCNA and Ecadherin.
Key words: Human Papilloma Virus, Cervical lesions, Immunohistochemistry, sexually transmitted infections.
Recibido: 29 de marzo de 2016 Aprobado: 10 de junio de 2016
INTRODUCCIÓN
El Ciclo de vida del VPH sigue el programa de diferenciación de la célula hospedadora, el queratinocito. Los tipos de VPH de bajo riesgo como el 6 y 11 forman viriones y tienden por lo general a desaparecer espontáneamente, mientras que los de alto riesgo como el 16 y 18 son persistentes se integran al genoma celular y transformar la célula (1). La transmisión de los virus papiloma humanos es facilitada por superficies epiteliales escoriadas o ablandadas. Las infecciones anogenitales son trasmitida principalmente por contacto sexual (1,2).
Las infecciones por el virus de papiloma humano (VPH) afectan la expresión de proteínas del ciclo celular, produciendo alteraciones en el epitelio cervical que promueven el desarrollo de la neoplasia intraepitelial cervical (NIC I cuando son lesiones de bajo grado y NIC II y NIC III cuando son de alto grado), ya que las oncoproteínas propias del VPH interactúan con las proteínas que controlan la función del ciclo celular, entre las cuales están, la p53, p16 INK4a, PCNA (antígeno nuclear de proliferación celular) y Cadherina E (3).
Un evento importante en la transformación de la célula, es la integración del ADN viral en el ADN del hospedador ocasiona NIC de alto grado y carcinoma. Esta integración viral en el genoma del hospedador se asocia con la rotura del código de lectura abierta y pérdida de función de E2, que fisiológicamente regula E6 y E7, lo que desencadena una proliferación celular sin control, ya que la proteína E6 acelera la degradación de p53, mientras que E7 interfiere la vía de p16 INK4a/CDk4/ciclinaD1/pRb (4).
La unión específica de la proteína p16 INK4a con las quinasas dependientes de ciclina CDK4 y CDK6, inhibe la actividad de fosforilación de los complejos CDK-ciclina D1 a través del complejo de proteína nuclear Rb/E2F. La vía de la ciclina D/CDK4,6/p16 INK4a/Rb/E2F desempeña una función fundamental en el control del crecimiento celular a través de la integración con múltiples estímulos mitogénicos y no mitogénicos (5,6).
El diagnóstico de NIC depende de la identificación de características morfológicas bien descritas en la biopsia cervical. Sin embargo, constantemente se ha demostrado que el diagnóstico histológico de NIC es afectado por proporciones significativas de decisiones entre los patólogos. En años recientes se ha demostrado exitosamente que p16INK4a es un marcador sensible especifico de carcinomas y lesiones NIC asociadas a VPH, por lo tanto se ha sugerido que la tinción para este biomarcador pudiera ayudar a identificar más precisamente lesiones NIC en secciones de tejido y por consiguiente reducir variaciones en la interpretación de lesiones cervicales (7, 8).
El antígeno nuclear de proliferación celular PCNA es una proteína multifuncional de 36 kDa, que se relaciona con la proliferación celular, resaltando específicamente las células con una activa replicación del ADN y es usado universalmente para evaluar la proliferación celular mediante inmunohistoquímica, sin embargo no distingue entre células displásicas o malignas en proliferación de las células normales que están proliferando (9). Desde hace varios años se ha examinado la actividad proliferativa de la displasia y del carcinoma in situ (CIS) en el cuello uterino mediante inmunotinción de PCNA y tinción de la región organizadora nucleolar argirofilica de unión a plata (AgNOR) y se demostró una diferencia significativa en el índice de marcaje de la inmunotinción de PCNA obtenida de las células displásicas en cada categoría histopatológica entre la displasia severa y CIS. No obstante, el índice de PCNA parecía ser un medio útil de evaluar actividad proliferativa en displasia y CIS y especialmente en distinguir CIS de displasia severa. Adicionalmente, el índice de presencia del PCNA sugiere una considerable alteración del comportamiento biológico que involucra cambios genéticos que ocurren durante la progresión de la carcinogénesis que va desde de una displasia severa a CIS (10).
Las cadherinas son glicoproteínas transmembranas que facilitan la adhesión intercelular por mecanismos dependientes de calcio. La cadherina E es la más abundante y su dominio citoplasmático se conecta al citoesqueleto por medio de las cateninas (4). Las moléculas adyacentes de cadherina E mantienen las células juntas; además la cadherina E puede transmitir señales anti crecimiento por secuestro de catenina-β. La cadherina E tiene un peso molecular de 120 kDa; es la cadherina más importante en los epitelios y hay evidencias de que la inactivación del complejo de adhesión cadherina-catenina desempeña una función en los pasos iniciales de invasión y metástasis (11).
En este trabajo se evaluó mediante la técnica de inmunohistoquímica la expresión de los marcadores moleculares de proliferación celular (PCNA), de adhesión celular (Cadherina E) y de supresión celular (p16 INK4a). De manera de establecer el mejor marcador predictivo en la progresión a cáncer, en pacientes con lesiones malignas y pre-malignas producidas por la infección con el VPH, en biopsias de cuello uterino. Ademas se analizó la probable relación existente entre la infección por los distintos tipos de VPH, el grado de lesión y los niveles de expresión de las 3 proteínas.
MATERIALES Y MÉTODOS
Recolección de las muestras.
Se estudiaron 36 muestras obtenidas de lesiones de cuello uterino de pacientes con bajo y alto grado histológico uterino con edades comprendidas entre los 18 años y los 62 años de esdad, se tomaron dos muestras: una de raspado de células epiteliales cervicales para el diagnóstico molecular y tipificación mediante la técnica de reacción en cadena de la polimerasa (PCR) y una biopsia de tejido para realizar las coloraciones con hematoxilina/eosina y hacer su clasificación histológica correspondiente. Estas muestras procedían de los siguientes hospitales Venezolanos: Hospital Dr. Domingo Luciani (El Llanito, Petare), Hospital Dr. Miguel Pérez Carreño (El Pescozón, Caracas) y Hospital Oncológico padre Machado (El Cementerio, Caracas). Todas las pacientes cuyas biopsias fueron incluidas en este estudio, previamente habían firmado un consentimiento informado en el cual se especificaba la utilización de dichas muestras con fines de investigación.
Clasificación de las muestras según el grado histológico de la lesión.
La clasificación del grado de la lesión histológica en Neoplasia Intraepitelial Cervical (NIC) se realizó en base a las alteraciones del patrón celular observado en el epitelio cervical mediante la coloración con hematoxilina/eosina (H/E). Según el autor Richart, (12) esta va de lesiones NIC primarias (NIC I o leve) de bajo grado, a alteraciones graves que definen las lesiones NIC II y NIC III ( displasia moderada y severa ) o de alto grado y carcinoma microinvasivo (CMI) (13). Se trabajó con cortes de 0,4 μm en las muestras de biopsias fijadas en formol al 10% embebidas en parafina y coloreado con hematoxilina/eosina. Como controles negativos (es decir, de tejidos sanos o normales) se consideraron las porciones sin lesión en los cortes de tejido epitelial cervicouterino. Como controles positivos se incluyeron en los ensayos cortes de biopsias con lesión de alto grado con fuerte reactividad positiva.
Detección molecular y Tipificación del VPH.
Para extraer el ADN viral del VPH se utilizó las muestra de raspados cervicales usando el mini estuche en columna de QIAamp DNA Kits (QIAGEN, Hilden, Alemania) según las instrucciones del fabricante. Una vez obtenido el ADN se procedió a realizar la primera reacción en cadena de la polimerasa (PCR) para detectar el VPH. Para ello se utilizó los cebadores consenso My09/My11 de la región L1 del virus y como control interno un gen constitutivo la beta-globina con los cebadores HMBB01, PC04 y GH20 (4). La PCR fue realizada a un volumen final 50 μl que contenía una mezcla de 50 mM, KCl, 10 mM Tris- HCl (pH 8.5), 6 mM de MgCl2, 200 μM de cada desoxinucleotido trifosfato (dNTP), 5 U de AmpliTaq Gold DNA polimerasa (PE Applied Biosystems, Weiterstadt, Germany) y 50 pmol de cada cebador. La amplificación se realizó en un termociclador Perkin Elmer 9400 con las siguientes condiciones 94ºC por 10 minutos seguido de 40 ciclos de 1 minito desnaturalización a 94ºC, 1 minuto de alineación a 55ªC, 1 minuto de extensión a 72ºC y una extensión final de 7 minuto a 72ºC.
La tipificación del VPH consistió en una PCR multiplex anidada de 2 rondas programada en un termociclador convencional TC-3000X, en la primera se amplifica la región E6/E7 lo que facilitará y mejorará los resultados de la segunda ronda, en ésta ronda son utilizados varios sets de Cebadores los cuales permiten la tipificación de 19 genotipos, esta metodología no solo logra determinar el genotipo de VPH presente también se puede conocer si el paciente posee infección por múltiples VPH (coinfección) (14, 15, 16, 17). Los productos de las reacciones de todas las PCRs fueron identificados por su tamaño mediante electroforesis en geles de agarosa al 2% teñido con Bromuro de etidio. Como controles positivos se usaron plásmidos con el ADN viral, muestras clínicas que contenían VPH-16, 33, 35, 68 y como controles negativos las mismas reacciones de PCR pero sin ADN.
Técnica inmunohistoquímica para evaluar expresión de p16INK4a, PCNA y cadherina E.
Los marcadores celulares se ensayaron para cada biopsia de paciente con los cortes de 0,4 micras colocados en láminas portaobjeto sensibilizadas con polilisina L. Los cortes se incubaron en una estufa a 60 °C por 45 minutos a 37°C. Luego para desparafinar e hidratar el tejido, fueron sumergidas en xilol y 4 con alcohol isopropilico (grado técnico, 70%, 50% y 30%), dejándose lavar en agua corriente por 10 minutos. La recuperación antígenica se llevó a cabo en una vaporera (Oster®) a una temperatura de aproximadamente 100 °C durante 30 minutos. Se dejó enfriar y se lavaron las láminas sumergiéndolas en agua destilada por 5 minutos. Para el bloqueo de las peroxidasas endógenas se cubrieron los cortes con solución al 3% de peróxido de hidrógeno y se incubaron por 30 minutos. Luego se lavaron los cortes con buffer TBST (Tris Base, cloruro de Sodio y Tween 20). Se cubrieron los cortes con 200 μl del anticuerpo monoclonal primario de ratón anti proteína humana, marcador celular (Dako Cytomation, Denmark), se preparó según especificaciones del fabricante, usándose el diluente recomendado (antibody diluente DAKO, S3022). Se emplearon las siguientes diluciones: PCNA, 1/200 (Dako Cytomation, Denmark); cadherina E, 1/50 (Dako Cytomation, Denmark) y p16 INK4a, 1/200 (Dako Cytomation, Denmark). Se íncubo durante 16 horas. Para el anticuerpo secundario: se utilizó el sistema EnVision de DAKO (Dual Link System peroxidase, ref K4061). Se incubaron las láminas 2 horas en cámara húmeda y protegido de la luz. Se lavaron los cortes tres veces con buffer TBST. El cromógeno se preparó según las instrucciones del fabricante, se usó el sistema UltraVision Plus Detection System Thermo Scientific TA-060-HDX, 20 μl de Diaminobencidina (DAB) más 1 ml del substrato. Se colocó 30 μl y se dejó incubar por 10 minutos. Luego se colocó el cubreobjetos con medio permanente (Merckoglas; flüssiges Deckglas für die Mikroskopie); y por ultimo estas laminas fueron observadas al microscopio óptico. Para cada marcador fueron utilizadas 3 cortes de cada biopsia por lo consiguiente 3 láminas por paciente. Se usaron como controles negativos, cortes sometidos al mismo procedimiento pero en lugar del anticuerpo monoclonal antimarcador a evaluar, se usó un anticuerpo monoclonal primario anti – neurofisina relacionada a la oxitocina de rata.
Patrones de tinción característicos.
Para la evaluación de la expresión de los marcadores celulares ensayados, se tomaron en consideración las siguientes características. Para PCNA; tinción nuclear nítida de color marrón. La cadherina E; tinción dorada, nítida e intensa en la membrana celular y para p16 INK4a; color marrón castaño en el núcleo y en el citoplasma. La interpretación de los resultados se hizo mediante evaluación semicuantitativa según el método descrito por Mirhashemi (18) que mide la intensidad de la tinción, estimando una evaluación semicuantitativa, del porcentaje (%) de células positivas. Para ello se realizó el contaje a una resolución de 400X de las células dianas en 4 campos escogidos al azar. La intensidad de la reacción se evaluó considerando el patrón de tinción para cada marcador mediante cruces como se indica a continuación: +, reacción débil; ++, reacción moderada y +++, reacción intensa (evaluación cualitativa). Se evaluó la expresión de los marcadores celulares en zonas de tejido con lesión y en zonas de tejido sin lesión.
Análisis estadístico
Se realizó el análisis estadístico de los datos mediante el conteo y los porcentajes obtenidos para cada marcador celular, calculando la media y la varianza para cada grupo NIC según el grado histológico de la lesión, tanto para zonas de tejido con lesión como para zonas de tejido sin lesión. Además, se estimó si había o no había asociación entre los marcadores celulares evaluados para lo cual se aplicó el método estadístico de correlación, en el cual se calculó un coeficiente de correlación r que representa una medida del grado de asociación de dos variables; en este estudio su valor nos indicara si existe o no existe una estrecha relación entre dos marcadores celulares.
RESULTADOS Y DISCUSIÓN
La clasificación de las lesiones de NIC en el epitelio de cuello uterino de las pacientes incluidas en este estudio se realizó en base a las alteraciones observadas en el epitelio cervical, reveladas mediante la coloración con hematoxilina – eosina de cortes de biopsias tomadas con microscopio Olympus I X 50 a un aumento total de 100X y 200X (Figura 1). Se observa un halo claro perinuclear de núcleos hipercromáticos agrandados y aumento del número de células en los diferentes tejidos esto concuerda con la descripción de Richard (12) de las lesiones de alto grado (NIC II y NIC III) quien reportó que a medida que el grado de apiñamiento nuclear incrementa, se encuentra una disminución concomitante en el número de células binucleadas y gigantes, con un incremento uniforme a medida que las células monomórficas de las zonas epiteliales más profundas comienzan a aparecer en la superficie (13).
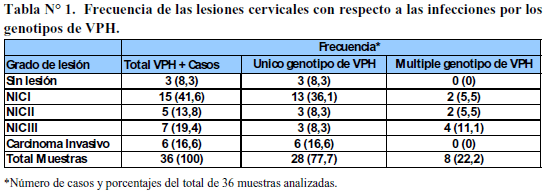
En lo concerniente a la infección por VPH, de estas pacientes (Tabla N° 1), se encontró que en aquellas con lesiones de cérvix de bajo grado (NIC I) se detectó la presencia de los genotipos de VPH de bajo riesgo oncogénico 43 como infección única (IU) y como infección múltiple (IM) los genotipos 6/11 y 6/11/44 respectivamente; también en NIC I se detectó la presencia de los genotipos de VPH de alto riesgo oncogénico 68, 18, 16 como infección única (IU) y como infección múltiple (IM), 6/11/35/66, es decir, mezclados con 6/11 que son de bajo riesgo. Esto coincide con los resultados de Graterol (19), quienes encontraron que en lesiones de bajo grado los genotipos 6/11 conjuntamente con VPH 16; García (20), también detecto en NIC I los genotipos 11, 30, 6 y 43, y los genotipos 16 y 18 que son de alto riesgo. Mendoza (21), detecto los genotipos 58/42 en lesiones de bajo grado. Como infección múltiple (IM), en otras dos pacientes se detectaron los genotipos 51/59 y 58/68 de alto riesgo oncogénico. Al respecto, es oportuno señalar que Graterol (19), también detecto en lesiones de alto grado el genotipo 6 de VPH acompañado de VPH 16. Por otra parte, García (22) detecto en lesiones NIC II, los genotipos 16, 18, 31, 45, 51, y 52 que son de alto riesgo oncogénico. Mendoza (21) detecto el genotipo 31 de VPH en lesiones de alto grado; López (23), también lo detecto en lesiones cervicales de alto grado los genotipos de VPH 16, 51 y 58 entre otros de alto riesgo oncogénico. En las siete pacientes con lesiones cervicales severas (NIC III) se detectaron genotipos de VPH de alto riesgo oncogénico, bien sea como infección única (IU) o combinados (IM), incluyéndose genotipos de alto riesgo con genotipos de bajo riesgo oncogénico. Como infección única se detectó en una paciente el genotipo 52. Los otros genotipos de VPH de alto riesgo detectados fueron 16/66/68, 35/66, 51/58 y 16/68/6/11 (6 y 11 de bajo riesgo). García (20) reportaron presencia en lesiones cervicales NIC III de los genotipos de VPH (separados o combinados) 16, 18 ,31, 45, 51 y 52. López (23) reportaron como infección múltiple (IM) en lesiones de alto grado, presencia de los genotipos de VPH 18/51, 16/31, 45/35 y 11/58. Se observa la coincidencia con este trabajo de la presencia de los genotipos 16, 35, 51 y 58.
Con respecto a las pacientes con carcinoma invasor, en este estudio se encontró en una paciente, como infección única (IU), el genotipo 59 de VPH, y en otras cuatro pacientes se detectó el genotipo de VPH 16 que son genotipos de alto riesgo oncogénico. Entre los hallazgos de esta investigación, destaca la presencia del genotipo de VPH 16 detectado como el tipo más frecuente en lesiones de alto grado, lo cual coincide con los reportes de otros investigadores, entre los cuales se pueden citar los trabajos de Graterol (19), García (20), Mendoza (21) y López (23).
Estas observaciones corroboran las evidencias aportadas por distintos investigadores respecto a la contribución de las infecciones por genotipos de VPH de alto riesgo al desarrollo del cáncer cervicouterino como consecuencia de su capacidad para integrarse en el genoma de las células hospedadoras y de poder así interferir con los mecanismos de control del ciclo celular.
Respecto a los resultados de la evaluación de los marcadores celulares en epitelio de cuello uterino (Tabla N° 2), esta se realizó mediante el contaje celular (media de cuatro campos en porcentaje) para la expresión de los marcadores celulares PCNA, cadherina E y p16INK4a, se hizo un análisis estadístico de los datos de porcentaje obtenidos para cada marcador celular, calculando la media y la varianza para cada grupo NIC según el grado histológico de la lesión, tanto para zonas de tejido con lesión como para zonas de tejido sin lesión. Luego se hizo la comparación de medias de distribución t de Student al nivel de significación aceptable de 0,05 con una probabilidad p de error al rechazar la hipótesis nula < 0,05 (dócima unilateral) o p < 0,025 (dócima bilateral) para lo cual fue necesario calcular los grados de libertad.
Para cada grupo histológico con lesión se comparó su media con la media del grado histológico inmediato inferior (o superior) para inferir si había o no diferencia estadísticamente significativa entre las medias de esos grados histológicos de la lesión en base a la probabilidad p del error al rechazar la hipótesis nula, obtenida de tablas mediante un valor t observado (calculado) y un valor t crítico tabulado dependiendo de los grados de libertad para las variables consideradas.
Además, se estimó si había o no había asociación entre los marcadores celulares evaluados para lo cual se aplicó el método de correlación, en el cual se calcula un coeficiente R2 de correlación que representa una medida del grado de asociación de dos variables; en este estudio su valor nos indicaría si existe o no existe una estrecha relación entre dos marcadores celulares.
Se observó que en todas estas pacientes había un incremento en la expresión de PCNA y de p16INK4a en zonas con lesión comparado con zonas sin lesión. En la figura 2 A-H se observa las imágenes de inmunotinción para PCNA en los diferentes grados de lesiones donde hay un incremento progresivo de la tinción a medida que la lesiones es de mayor grado. Algunos trabajos han reportado que el porcentaje PCNA positivo de células básales epiteliales cervicales, era igual o menor al 16 % en todos los casos de epitelio escamoso normal, atrófico o metaplásico e igual o mayor al 18 % en todos los casos con displasia moderada o severa, y que la evaluación del porcentaje de células con tinción para PCNA podía distinguir todos los casos de displasia severa y moderada, y la mayoría de casos con condiloma de epitelio escamoso normales, atróficos o metaplásicos (24). Por otra parte, también se ha reportado expresión PCNA negativo en cérvix normal o con inflamación y una expresión de PCNA incrementada en 63,2 % de lesiones NIC y en 100 % de cáncer de células escamosas (p < 0,01, y p < 0,05 respectivamente) (25). Actualmente se sabe que la proteína E7 de VPH puede unirse a la proteína del retinoblastoma (Rb) alterando su función y a las de ciclinas activándolas; ya que PCNA es una ciclina, el incremento en las lesiones de la expresión de PCNA sugiere un efecto promotor de lesión y de progresión hacia el cáncer cervical (26). Los resultados de la evaluación de cadherina E en las lesiones del cuello uterino (Tabla N° 2), indicaron que su expresión disminuía en las lesiones respecto a zonas sin lesiones. En la figura 2 I-P se observa las imágenes de la inmunohistoquimica con cadhrerina E en los distintos grados de lesión y a diferencia del otro marcador el PCNA este disminuye su tinción a medida que la lesión aumenta su grado. Como ya se ha descrito, la disminución de cadherina E es marcada en lesiones NIC III y su expresión es mínima en el epitelio de cuello uterino con carcinoma invasor, debido, en principio, a que la función de la cadherina E se pierde en todos los cánceres epiteliales por inactivación mutacional de los genes de cadherina E, por activación de los genes de catenina β o por expresión incontrolada de algunos factores de transcripción de los oncogenes SNAIL y TWIST, que codifican unos factores de transcripción cuya función principal es favorecer un proceso denominado transición epitelio – mesenquima. En esta transición, las células carcinomatosas o alteradas en el epitelio cervical, suprimen la expresión de cadherina E (26).
Los resultados obtenidos para cadherina E en este trabajo concuerdan con los hallazgos de otros investigadores (11) quienes reportaron un descenso en la expresión de cadherina E (menor o igual a 50 % de células positivas) en cáncer de células escamosas cervicales.
Los resultados de la evaluación de la inmunotinción para p16 INK4a (Tabla N°2) indicaron que su expresión en zonas con lesión aumentó progresivamente según el grado de la lesión. En lesiones leves o NIC I (figura 2 Q-R,), se observó escaso marcaje nuclear en zonas con lesión (confinada al estrato basal). En lesiones NIC II y NIC III se ve un aumento marcadamente progresivo y constante de la tinción en la diferentes capas del epitelio hasta llegar a carcinoma donde la inmunotinción se difundió en toda la lesión (Figura 2 S-X). Estos resultados concuerdan con los hallazgos de otros investigadores (27), quienes reportaron ausencia de inmunotinción para p16INK4a en epitelio cervical normal o en lesiones benignas, inmuno reactividad focal en lesiones NIC I e inmunotinción para p16 INK4a uniformemente distribuida en núcleo y en citoplasma en lesiones NIC II, NIC III así como también en carcinoma invasor de células escamosas en cuello uterino. Los resultados obtenidos en este trabajo para la sobreexpresión de p16 INK4a en lesiones de cuello uterino también apoyan los datos de otros trabajos, los cuales señalan la existencia de una estrecha asociación entre la expresión del marcador p16 INK4a y la progresión de la neoplasia intraepitelial cervical (18, 24, 27). Adicionalmente, también se ha encontrado correlación entre el grado de expresión de p16 INK4a y el grado de neoplasia intraepitelial cervical (p < 0,001) y entre el grado de expresión de p16 INK4a y los genotipos de VPH de alto riesgo (p < 0,001) (28).
Se ha determinado que p16 INK4a es un supresor tumoral y la unión de la proteína E7 de VPH de alto riesgo a p16 INK4a inactiva su acción inhibidora sobre las quinasas CDK 4 y 6, las cuales pueden entonces hiperfosforilar la proteína retinoblastoma (Rb) ocasionando la liberación de factores transcripcionales E2F de oncogenes (6, 26).
En vista de que los resultados de los ensayos realizados que fueron observados con las muestras de biopsias de este grupo de pacientes mostraban una tendencia hacia el incremento de la inmunotinción para PCNA y p16INK4a en las lesiones con respecto a las zonas de epitelio sin lesión y una pérdida de la inmunoreactividad para cadherina E en las lesiones alto grado, con los datos obtenidos para estas proteínas se aplicó el método estadístico de correlación para determinar si había alguna asociación significativa entre la expresión de estos marcadores celulares en las lesiones, para lo cual se calculó el coeficiente de correlación r. Los resultados de la correlación (Tabla N°3) indicaron ausencia de asociación entre los marcadores celulares PCNA y cadherina E (r = 0,08); ausencia de asociación entre p16 INK4a y cadherina E ( r = - 0,12 ) y un cierto grado de asociación entre los biomarcadores PCNA y p16 INK4a ( r = 0,51 ). Esta asociación podría explicarse en base a las funciones de ambas proteínas, ya que PCNA es una ciclina y p16 INK4a es un inhibidor de las quinasas dependientes de ciclinas CDK 4 y 6 como se mencionó anteriormente.
CONCLUSIONES
La evaluación mediante las técnicas inmunohistoquímicas de la expresión de los marcadores celulares estudiados en este trabajo (PCNA, cadherina E y p16 INK4a) en los distintos grados de lesión de cuello uterino en estas pacientes, los resultados apuntan a que el seguimiento de la evolución de la lesión intraepitelial cervical de estas pacientes infectadas por VPH, la evaluación de la expresión del marcador de supresión celular p16 INK4a, sería la más adecuada que la evaluación de la expresión de PCNA o de cadherina E, aunque la evaluación de la expresión de cadherina E sería útil en la determinación aproximada del grado de avance de la lesión hacia un estado de malignidad o de cáncer invasor.
AGRADECIMIENTOS:
Al Fondo Nacional de Ciencia, Tecnología e Innovación (FONACIT) bajo el marco de MISION CIENCIA LUZ PROYECTO LAB 2007001088 SUB-4 y a la Coordinación de investigación de la Facultad de Medicina de la Universidad Central de Venezuela (UCV).
REFERENCIAS:
1.-Zur Hausen H. Papillomavirus infections a major cause of human cancers. Bioph Acta. 1996; 1288: F55–F78. [ Links ]
2.-Araujo E, Barroso S, Cendón A, Muñoz M, Ortunio M, Cardozo R, Guevara H. Infección por virus de papiloma humano en mujeres: Hallazgos paraclínicos. Rev Obst Ginecol Venez. 2010; 70(2): 82–89. [ Links ]
3.-Van de Putte G, Kristensen GB, Lie AK, Baekelandt M, Holm R. Cyclins and proliferation markers in early squamous cervical carcinoma. Gynecol Oncol. 2004; 92: 40–46. [ Links ]
4.-Lerma E. Factores que intervienen en la diseminación del cáncer de cuello uterino. Rev Española Patol. 2005; 38 (4): 1–10. [ Links ]
5.-Queiroz C, Correia Silva T, Alves VAF, Villa LL, Costa MC, Travassos AG, Araujo Filho JB. Comparative study of the expression of cellular cycle proteins in cervical intraepithelial lesions. Pathol Res Pract. 2006; 202: 731–737. [ Links ]
6.-Sano T, Oyama T, Kashiwabara K, Fukuda T, Nakajima T. Immunohistochemical over expression of p16 protein associated with intact retinoblastoma protein expression in cervical cancer and cervical intraepithelial neoplasia. Pathol Int. 1998; 48: 580–585. [ Links ]
7.-Ordi J, García S, del Pino M, Landolfi S, Alonso I, Quintó Ll, Torné A. p 16 INK4a Immunostaining Identifies Occult CIN Lesions in HPV–Positive Women. Int J Gynecol Pathol. 2009; 28(1): 90–97. [ Links ]
8.-Toro de Méndez M, Fernández Izquierdo A. Detección de virus papiloma humano (VPH) a partir de muestras celulares de cuello uterino en base líquida. Correlación con la inmunorreactividad de la proteína p 16 INK4a. Invest Clin. 2009; 52 (1): 3–14. [ Links ]
9.-Wang JL, Zheng BY, Li XD, Ängström T, Lindström MS, Wallin KL. Predictive Significance of The Alterations of p 16 INK4a, p14 ARF, p 53, and Proliferating Cell Nuclear Antigen Expression in the Progression of Cervical Cancer. Clin Cancer Res. 2004; 10: 2407–2414. [ Links ]
10.-Kobayashi I, Matsuo K, Ishibashi Y, Bpharmsci Kanda S, Sakai H. The Proliferative Activity in Dysplasia and Carcinoma In Situ of the Uterine Cervix Analyzed by Proliferating Cell Nuclear Antigen Immunostaining and Silver-Binding Argyrophilic Nucleolar Organizer Region Staining. Human Pathol. 1994; 25 (2): 198-202. [ Links ]
11.-Van de Putte G, Kristensen GB, Baekelandt M, Lie AK, Holm RB. E -cadherin and catenins in early squamous cervical carcinoma. Gynecol Oncol. 2004; 94: 521–527. [ Links ]
12.-Richart RM. A modified terminology for cervical intraepithelial neoplasia. Obst Gynec. 1990; 75(1):131–132. [ Links ]
13.-Richart RM. Colpomicroscopic Studies of Cervical Intraepithelial Neoplasia. Cancer. 1966; 19 (3): 395–405. [ Links ]
14.-de-Roda HA, Walboomers JM, Van-den BA, Meijer CJ, Snijders PJ. The use of general primers GP5 and GP6 elongated at their 3′ ends with adjacent highly conserved sequences improves human papillomavirus detection by PCR. J Gen Virol. 1995; 76: 1057-1062. [ Links ]
15.-Hildesheim A, Schiffman MH, Gravitt PE, Glass AG, Greer CE, Zhang T, Scott DR, Rush BB, Lawler P, Sherman ME, et al. Persistence of type-specific human papillomavirus infection among cytologically normal women. J Infect Dis. 1994; 169: 235-240. [ Links ]
16.-Gravitt PE, Peyton CL, Apple RJ, Wheeler CM. Genotyping of 27 human papillomavirus types by using L1 consensus PCR products by a single-hybridization, reverse line blot detection method. J. Clin. Microbiol. 1998; 36:3020-3027. [ Links ]
17.-Sotlar K, Diemer D, Dethleffs A, Hack Y, Stubner A, Vollmer N, Menton S, et al. Detection and Typing of Human Papillomavirus by E6 Nested Multiplex PCR. J. Clin. Microbiol. 2004; 42 (7): 3176–3184. [ Links ]
18.-Mirhashemi R, Ganjei–Azar P, Nadji M, Lambrou N, Atamdede F, Averette HE. Papillary squamous cell carcinoma of the uterine cervix: An immunophenotypic appraisal of 12 cases. Gynecol. Oncol. 2003; 90: 657–661. [ Links ]
19.-Graterol IJ, Finol HJ, Correnti M. Virus del papiloma humano en lesiones intraepiteliales escamosas (LIE) de cuello uterino. Tipificación y ultraestructura. Rev. Soc. Ven. Microbiol. 2006; 26(2): 89–94. [ Links ]
20.-García Tamayo J, Molina J, Blasco Olaetxea E. Importancia de los estudios de inmunohistoquímica en el diagnóstico y la evaluación pronóstica de la neoplasia intraepitelial y el cáncer cervical. Revisión. Invest. Clin. 2009; 50 (2):1-12. [ Links ]
21.-Mendoza LP, Arbiza J, Paez M, Kasamatsu E, Castro A, Giménez G, Basiletti J. Distribution of Human Papillomavirus Genotypes in Paraguayan Women According to the Severity of the Cervical Lesion. J. Med. Virol. 2011; 83: 1351–1357. [ Links ]
22.-García DA, Cid Arregui A, Schmitt M, Castillo M, Briceño I, Aristizábal FA. Highly Sensitive Detection and Genotyping of HPV by PCR Multiplex and Luminex Technology in a Cohort of Colombian Women with Abnormal Cytology. Open Virol. J. 2011; 5: 70–79. [ Links ]
23.-López J, Ili CG, Brebi P, García P, Capurro I, Guzmán P, Suárez E, et al. Detección y tipificación de virus papiloma humano en lesiones preneoplásicas de cuello uterino. Rev. Med. Chile. 2010; 138:1343 – 1350. [ Links ]
24.-Mittal KR, Demopoulos RI, Goswami S. Proliferating Cell Nuclear Antigen (Cyclin). Expression in Normal and Abnormal Cervical Squamous Epithelia. Am. J. Surg. Pathol. 1993; 17(2): 117–122. [ Links ]
25.-Wang JL, Zheng BY, Li XD, Ängström T, Lindström MS, Wallin KL. Predictive Significance of The Alterations of p 16INK4a, p14 ARF, p 53, and Proliferating Cell Nuclear Antigen Expression in the Progression of Cervical Cancer. Clin. Cancer Res. 2004; 10: 2407–2414. [ Links ]
26.-Kumar V, Abbas AK, Fausto N, Mitchell RN, Robbins SL. Patología humana. 8 ed. Barcelona, España: Elsevier; 2008. [ Links ]
27.-Missaoui N, Trabelsi A, Hmissa S, Fontanière B, Yacoubi MT, Mokni M, Korbi S. p 16 INK4a over expression in precancerous and cancerous lesions of the uterine cervix in Tunisian women. Pathol. Res Pract. 2010; 206: 550–555. [ Links ]
28.-Agoff SN, Lin P, Morihara J, Mao C, Kiviat NB, Koutsky LA. p16 INK4a Expression Correlates with Degree of Cervical Neoplasia: A comparison with Ki-67 Expression and Detection of High – Risk HPV Types. Mod. Pathol. 2003; 16 (7): 665–673. [ Links ]












 uBio
uBio