Revista del Instituto Nacional de Higiene Rafael Rangel
versión impresa ISSN 0798-0477
INHRR vol.46 no.1-2 Caracas dic. 2015
Anemia Infecciosa Equina. Una Revisión
Equine Infectious Anemia. A Review
Abelardo Morales Briceño1, Aniceto Méndez Sánchez1, María Morales Briceño2.
1 Departamento de Anatomía y Anatomía Patológica Comparadas, Edificio de Sanidad Animal, Campus de Rabanales Ctra. de Madrid km 396, 14071, Córdoba Universidad de Córdoba. España. 2 Ejercicio Privado.
Teléfono: 0034619307223. Email: aamorales13@gmail.com
RESUMEN
La Anemia Infecciosa Equina (en ingles Equine Infectious Anemia EIA), es una enfermedad viral que afecta a los équidos a nivel mundial. El agente causal, pertenece al género Lentivirus, de la familia Retroviridae, subfamilia Orthoretrovirinae. La enfermedad se caracteriza por episodios febriles recurrentes, trombocitopenia, anemia, pérdida de peso y edema de las partes bajas del cuerpo; si no se produce la muerte en el curso de los ataques clínicos agudos, se produce una fase crónica y la enfermedad tiende a convertirse en latente. La AIE debe notificarse ante la OIE: Organización Mundial de Sanidad Animal. En 2015 la OIE mediante Código Sanitario para los Animales Terrestres se estableció a la Anemia Infecciosa Equina en la lista única de enfermedades e infecciones de los équidos. Los veterinarios que detecten un caso de anemia infecciosa equina deben seguir las pautas nacionales y/o locales para la notificación y las pruebas de diagnóstico correspondientes. Este artículo describe los aspectos más relevantes de la Anemia Infecciosa Equina.
PALABRAS CLAVES: Anemia Infecciosa Equina, AIE, EIA, equinos.
ABSTRACT
Equine Infectious Anemia (EIA) is a viral disease that affects horses worldwide. The causative agent belongs to the genus Lentivirus, the family Retroviridae, subfamily Orthoretrovirinae. The disease is characterized by recurrent episodes of fever, thrombocytopenia, anemia, weight loss and edema of the lower parts of the body; if death does not occur in the course of the acute clinical attacks, a chronic stage occurs and the disease tends to become dormant. The IEA must be reported to the OIE: World Organization for Animal Health. In 2015 by Health Code OIE Terrestrial Animal it was established Equine Infectious Anemia in the single list of diseases and infections of horses. Veterinarians detected a case of equine infectious anemia should follow national and / or local to the notification and guidelines appropriate diagnostic tests. This article describes the most relevant aspects of the Equine Infectious Anemia.
KEYWORDS: Anemia Infectious Equine, Anemia, AIE, EIA, equine
Recibido: 05 de mayo de 2015 Aprobado: 21 de agosto de 2015
Introducción
En una era de creciente globalización, nunca ha sido mayor el riesgo de propagación de enfermedades infecciosas en humanos y animales, incluidos los équidos (1). La Anemia Infecciosa Equina (AIE, en ingles Equine Infectious Anemia EIA), es una enfermedad viral que afecta a los équidos a nivel mundial. El término "fiebre de los pantanos" fue utilizado por primera vez por Torrance en 1903 en Canadá (2). El agente causal, pertenece al género Lentivirus, de la familia Retroviridae, subfamilia Orthoretrovirinae (3). Este virus posee un genoma de ARN de doble cadena de 8.2 kb aproximadamente (4). Además de las proteínas estructurales codificadas por gag, pol y env, el genoma contiene tres marcos de lectura abierta que codifican las proteínas Tat y Rev generalmente presentes en los lentivirus y la Proteína S2 (5). Los productos de los genes gag y pol se traducen del RNA mensajero viral de larga duración. El montaje del precursor Gag proteínas en la membrana plasmática es esencial para el virus de florecimiento de las células huésped (5). El virus de la Anemia Infecciosa Equina es el único, entre los retrovirus estudiados hasta la fecha, que su dominio L es un motivo YPDL situado en el C-terminal región de P9 (5). Este virus requiere componentes de la proteína vacuolar clasificación celular (VPS) maquinaria para la liberación eficaz. Las Proteínas Clase E VPS están involucradas en la biosíntesis del cuerpo multi-vesicular (MVB). Las proteínas AIP1/ALIX, clase E VPS Bro1, juegan un papel clave mediante la vinculación de MVB complejos que actúan en las etapas tempranas y tardías de infección (5).
Recuento histórico epidemiológico
El virus de la Anemia Infecciosa Equina fue identificado por primera vez en Francia en 1843, y en un principio fue diagnosticado en los Estados Unidos en 1888 (6). Su prevalencia en USA comenzó a subir en el 1930 y alcanzó su pico destructiva en los Estados Unidos entre los años '60 y '70 (7). En 1975, se detectaron 10.371 casos de infección por EIA en los Estados Unidos (7). En Canadá fue descrita en 1882 (2). La amplitud que fue adquiriendo en 1966 en algunos centros europeos de caballos de competición condujo a la OIE a incluirla en las labores de la Comisión del Código y de la Comisión de Normas (8). En Venezuela fue descrito en 1939, el porcentaje de positividad fue de 12,4%. En Colombia la Anemia Infecciosa Equina fue reportada en1948 (4). La AIE fue descrita en Mongolia e 1952 y en 2011 presento una prevalencia de 24.5% (9). En Brasil ha sido descrita por primera vez en Rio de Janeiro en 1968 (10). En Chile fue diagnosticada por primera vez en 1980 y declarada erradicada en 1981(11). En Australia, la única área donde pueda ser considerada como endémica es a lo largo de los sistemas fluviales del interior del centro y oeste de Queensland (12). En Baja California México, la AIE fue descrita por primera vez en 1999. El virus tiene una distribución mundial dado que se informa regularmente en las Américas, África, Asia, Europa y Australia (2). En Europa, en los últimos años los focos de Anemia Infecciosa Equina se han dado principalmente en Rumanía (13). La Anemia Infecciosa Equina es un enfermedad endémica en Rumania, de hecho, en junio del 2010 adoptó una Decisión Europea para establecer medidas especiales de protección para el movimiento de équidos provenientes de este país (13). El último foco descrito en España fue en 1983. Esta enfermedad parece estar ausente solo en pocos países, tales como Islandia y Japón (14). Sin embargo recientemente en 2014 fue descrita en Japón. La AIE debe notificarse ante la Organización Mundial de Sanidad Animal (OIE, por sus siglas en francés) (3). En 2015 la OIE mediante Código Sanitario para los Animales Terrestres se estableció a la Anemia Infecciosa Equina en la lista única de enfermedades e infecciones de los équidos (3). Los veterinarios que detecten un caso de anemia infecciosa equina deben seguir las pautas nacionales y/o locales para la notificación y las pruebas de diagnóstico correspondientes (2014). En Venezuela el establecimiento de un Plan Sanitario para garantizar la Salud Agrícola Integral, está basado en un marco legal, en primera instancia la Constitución de la República Bolivariana de Venezuela, articulo 156, numeral 32, artículos 305, 306 y 307. Decreto 6.129 por Ley Habilitante. La Ley de Salud Agrícola Integral establece en sus artículos de carácter obligatorio 21, 23 y 36 garantizar la Salud Agrícola Animal. El Reglamento Nacional de Carreras de Caballos vigente establece Titulo IX Capitulo I Articulo 305: establece que los Servicios Veterinarios tiene por objeto el control sanitario animal en el Instituto Nacional de Hipódromos. Artículo 13: Los propietarios o propietarias, ocupantes, administradores, o administradoras o responsables, de las unidades de producción animal o vegetal, están obligados a cumplir todas las medidas de prevención, control y erradicación que determine el Ejecutivo Nacional, a través de sus órganos y entes competentes, con la finalidad de impedir la penetración y diseminación de enfermedades y plagas. Artículo 17: Es deber de los profesionales en materias afines a la salud agrícola integral denunciar al Ejecutivo Nacional, a través de sus órganos y entes competentes, la ocurrencia o sospecha de enfermedades o plagas que afectan los animales o vegetales y a las personas. Dentro de los términos previstos, para que se adopten las medidas preventivas y profilácticas que impidan la introducción y diseminación de enfermedades y plagas a los animales, vegetales y a las personas. Artículo 31: El Ejecutivo Nacional, a través de sus órganos y entes competentes podrá dictar la medida sanitaria de cuarentena interna a los animales y vegetales, productos, subproductos y materias primas de ambos orígenes, los organismos benéficos, las personas y los medios relacionados con ellos, en caso de enfermedades y plagas que puedan desencadenar un brote epidémico en el lugar donde se encuentren o en el de procedencia, y en caso de que éstas ya hubiesen penetrado, su localización, control y erradicación de enfermedades y plagas cuarentenarias con el objetivo de salvaguardar el territorio nacional no afectado, así como evitar su traslado a otros países; sin perjuicio de la aplicación de cualquier otra medida sanitaria que se estime pertinente. En estos casos, informará de inmediato a las personas interesadas el régimen de cuarentena establecido y el estado de alerta epidemiológico o de emergencia sanitaria. Artículo 32: Los animales y vegetales, importados antes de ingresar al territorio nacional deberán cumplir un período de cuarentena en el país de origen, de acuerdo al Protocolo de Importación suscrito con dicho país, bajo la supervisión del Ejecutivo Nacional, a través de sus órganos y entes competentes, y un período de cuarentena en el territorio de la República Bolivariana Venezuela, en el que serán sometidos a observaciones clínicas, epidemiológicas y diagnóstico de laboratorio por un tiempo mínimo de treinta (30) días, con las excepciones correspondientes. Por razones epidemiológicas o sanitarias los períodos de cuarentena podrán ser más prolongados. Artículo 72: El Instituto Nacional de Salud Agrícola Integral (INSAI) realizará las actividades de inspección, prevención, vigilancia y control del cumplimiento del presente Decreto con Rango, Valor y Fuerza de Ley, sus reglamentos y normas técnicas, a través de inspectores o inspectoras de salud agrícola integral debidamente acreditados. Ley de Salud Agrícola Integral: Artículo 21: El Ejecutivo Nacional, a través de sus órganos y entes competentes en materia de Control Zoosanitario y Protección Fitosanitaria, tiene como objetivos la elaboración, coordinación, ejecución, supervisión y evaluación de los planes, proyectos y programas de vigilancia, prevención, control y erradicación de enfermedades y plagas endémicas, emergentes, re-emergentes y transfronterizas de ocurrencia en todas las especies animales y vegetales, de acuerdo a las exigencias zoosanitarias y fitosanitarias nacionales e internacionales; y Articulo 36 de la Ley de Salud Agrícola Integral: El Ejecutivo Nacional, a través de sus órganos y entes competentes, regulará y emitirá las autorizaciones sanitarias para la movilización de animales y vegetales, productos y subproductos de ambos orígenes. Artículo 23: Ley de Salud Agrícola Integral: En los puestos y las estaciones de cuarentena, los animales se mantendrán bajo observación clínica, epidemiológica y de diagnóstico de laboratorio de conformidad con lo establecido en el presente Decreto con Rango, Valor y Fuerza de Ley, sus reglamentos y normas técnicas de salud agrícola integral. Según el Reglamento Nacional de Carreras de Caballos Vigente 1995: El Servicio Veterinario tiene por objeto el control de todo lo relacionado con el aspecto sanitario animal, dentro del recinto de los hipódromos nacionales adscritos al Instituto Nacional de Hipódromos. Artículo 306: Las funciones del Servicio Veterinario serán las siguientes: a) Llevar el control sanitario de los ejemplares alojados en las caballerizas de los Hipódromos Nacionales, adscritos al Instituto Nacional de Hipódromos. Artículo 307: En caso de presentarse una epizootía dentro de las caballerizas de los Hipódromos Nacionales adscritos al Instituto Nacional de Hipódromos, de los Haras o de los Centros de Doma y Entrenamiento, el Servicio Veterinario podrá prohibir la entrada o la salida de ejemplares, durante el tiempo que se considere necesario. Artículo 308: El Servicio Veterinario indicará los requisitos necesarios que deben cumplirse para la entrada o salida de ejemplares a las caballerizas del Hipódromo respectivo. A pesar de las normativas oficiales en cada país e internacionales para su control y el esfuerzo colectivo realizado por todos los sectores involucrados productores, industria hípica y veterinarios, la Anemia Infecciosa Equina dada su idiosincrasia y evolución clínica, constituye un enigma y una gran limitante por las importantes pérdidas económicas y las limitaciones en las exportaciones dada la globalización en el comercio de caballos a nivel mundial así como los cambios climáticos influyen notablemente en la epidemiologia, transmisión y prevalencia de esta enfermedad.
ASPECTOS CLINICOS
La enfermedad se caracteriza por episodios febriles recurrentes, trombocitopenia, anemia, pérdida de peso y edema de las partes bajas del cuerpo; si no se produce la muerte en el curso de los ataques clínicos agudos, se produce una fase crónica y la enfermedad tiende a convertirse en latente (3).Un equino infectado con el virus de la AIE puede presentar uno de los siguientes cuatro cuadros clínicos: Sobreagudo: presentación poco frecuente en la cual el animal muere súbitamente antes de presentar signos clínicos. Aguda: el estadio agudo de la enfermedad se asocia con la alta viremia inicial dentro de la 1ª y 4ª semana post infección, caracterizado por fiebre alta (41ºC.) intermitente, depresión, inapetencia, anemia, mucosas de tonalidad entre roja oscura a ictéricas. Si el animal sufre una severa trombocitopenia pueden desarrollarse petequias en las mucosas y epistaxis pudiendo finalizar con la muerte del animal (15). Crónico: la mayoría de los caballos que sobreviven al estadío agudo y sobreviene un largo período de recuperación de 5 a 30 días, caracterizado por ciclos de viremia intermitentes y recurrentes acompañados de fiebre, depresión, pérdida de peso y de la condición corporal, ictericia, hemorragias, edema ventral y anemia. Cada ciclo febril se asocia con la emergencia de una nueva variante antigénica del virus y su replicación en altos títulos (15). En caballos con infección crónica, se han informado casos de lesiones oftálmicas, caracterizadas por despigmentación con vasos coroidales prominentes (14). Subclínico o inaparente: el cuadro clínico crónico evoluciona a la forma inaparente que representa otra manera de presentación muy frecuente de la enfermedad (15). No se observan signos clínicos, es totalmente asintomático. En la mayoría de los casos el diagnostico es accidental y controversial para clínicos, propietarios y autoridades sanitarias oficiales dada la condición asintomática de estos caballos infectados.
Mortalidad
El índice de morbilidad y la gravedad de los signos clínicos están influenciados por la cepa y la dosis del virus, y por la salud del animal (14). La morbilidad y mortalidad de la AIE es variable, dependiendo de la virulencia particular del serotipo viral, susceptibilidad propia de los animales expuestos y del manejo de los mismos (15). Se han informado epizootias con altos índices de morbilidad y mortalidad aunque, los casos de muerte no son frecuentes en los caballos infectados naturalmente (15). La inoculación experimental con una dosis viral alta puede producir índices de mortalidad de hasta el 80% (14).
Lesiones post-mortem
Se evidencia linfadenomegalia de ganglios linfáticos, esplenomegalia y hepatomegalia. Mucosas pálidas y hemorragia petequial en algunos casos. En los casos crónicos, también se puede observar emaciación, lo cual representa un signo clínico característico. Con frecuencia se puede observar edema en los miembros y a lo largo de la pared abdominal ventral. Se pueden observar petequias en los órganos internos tales como el bazo y el riñón (14). También se han informado casos de hemorragias en las mucosas y las vísceras y trombosis en los vasos sanguíneos. Los caballos con infección crónica que mueren entre episodios clínicos, generalmente no presentan lesiones macroscópicas importantes, pero algunos animales pueden presentar glomerulonefritis proliferativa o lesiones oculares (14).
Histopatología
Histológicamente estos órganos linfoides (nódulos linfáticos, bazo e hígado), están infiltrados con poblaciones de leucocitos inmaduros y de células plasmáticas (3). Las células de Kupffer, del hígado, generalmente contienen hemosiderina o eritrocitos (3). El bazo presenta hemosiderosis marcada, amiloidosis reactiva, e hiperplasia de células endoteliales. A nivel renal se evidencia glomerulonefritis membranosa y glomerulonefritis membrano-proliferativa.
Microscopia Electrónica
Estudios ultra-estructurales sugieren a nivel muscular atrofia y trazo irregular de la línea Z, en el sistema sarcotubular edema de las cisternas terminales (16). Las mitocondrias exhibieron una matriz con diferentes densidades electrónicas y la presencia de gránulos electrón densos, diferentes grados de hipercontracción, pérdida total de la organización de los sistemas contráctil y sarcotubular, degeneración de las mitocondrias, ruptura del sarcolema y necrosis segmental (16). Los capilares intramusculares exhibieron alteraciones como el engrosamiento y reduplicación de la membrana basal, prolongaciones del citoplasma endotelial hacia la luz y pérdida de la continuidad de la pared endotelial y pericitos, unos aparentemente normales, otros con alteraciones El infiltrado celular consistió en macrófagos y neutrófilos (16).
Transmisión y Epidemiologia
El virus de la Anemia Infecciosa Equina se transmite mecánicamente desde las piezas bucales de insectos picadores (14), incluidas las moscas de los establos (Stomoxys calcitrans), los vectores más efectivos son las moscas picadoras de la familia Tabanidae, especialmente las moscas de los caballos (Tabanus spp. y Hybomitra spp.) y las moscas de los ciervos (Chrysops spp.). En los caballos, este virus permanece en los leucocitos sanguíneos durante toda la vida, y también está presente en el plasma durante los episodios febriles (14). Los caballos sintomáticos son más propensos a transmitir la enfermedad que aquellos con infección inaparente. El virus también puede transmitirse de manera iatrogénica: por transfusiones de sangre o mediante agujas, instrumentos quirúrgicos, y flotadores dentales contaminados. El VAIE también puede transmitirse de una yegua a su potrillo in útero. Los caballos pueden infectarse mediante la inoculación de secreciones corporales (semen, sudor, orina, entre otras), en forma cutánea o subcutánea. A partir de un brote epidémico en el 2006 en Irlanda, se planteó la posibilidad de transmisión por aerosoles provenientes de material infeccioso, durante el contacto cercano (2014).
Diagnostico
Clínico
El diagnostico clínico se realiza en caballos con pérdida de peso, edema y fiebre intermitente, anemia, edema y debilidad progresiva (intolerancia al ejercicio).
Hematológico
Los hallazgos hematológicos de laboratorio, no son patognomónicos de la AIE (15), linfopenia, trombocitopenia y anemia normocitica y normocromica.
Aislamiento Viral
Se puede aislar el virus en caballos sospechosos en cultivos de leucocitos preparados a partir de caballos no infectados y requiere confirmación por medio de un ELISA (17) y/o por la prueba de la inmunofluorescencia (18).
Reacción en cadena de la polimerasa
Se ha descrito la reacción en cadena de la polimerasa anidada (PCR) para detectar el ADN provírico de la AIE en la sangre periférica de los caballos (19). El método de la PCR anidada está basado en las secuencias de cebadores en la región correspondiente al gen gag del genoma provírico (3). También se ha descrito la PCR con transcriptasa inversa en tiempo real (20). Pruebas precisas nos permiten identificar y eliminar los reactores positivos de rebaños y efectivamente bloquear la propagación de la EIA en las poblaciones analizadas.
Pruebas Serológicas
Prueba de inmunodifusión en Gel de Agar: Test de Coggins (prueba prescrita para el comercio internacional).
La Anemia infecciosa Equina era difícil de identificar y diagnosticar hasta 1970, cuando se desarrollo la prueba de inmunodifusión en agar gel, comúnmente conocida como la "Prueba de Coggins,". Esta prueba fue desarrollada por Leroy Coggins en 1972, y hasta el presente la Organización Internacional de Epizootias (OIE) la recomienda como método diagnóstico de elección (15). Los anticuerpos precipitantes se producen rápidamente como resultado de la infección por la AIE y se pueden detectar mediante la prueba AGID (3). Las reacciones específicas se indican por las líneas de precipitina entre el antígeno de la AIE y el suero problema, y se confirman por ser idénticas a la reacción que se da entre el antígeno y el suero estándar positivo (3).
Enzimoinmunoanálisis
Más recientemente, ensayos de inmunoabsorción ligado a enzimas (prueba ELISA) redujeron el tiempo para un resultado de laboratorio a partir de al menos 24 horas a menos de una hora. Existen cuatro tipos de ELISA que han sido aprobados por el Departamento de Agricultura de los Estados Unidos para el diagnóstico de la anemia infecciosa equina y que están disponibles internacionalmente: un ELISA de competición y tres ELISA no de competición. El ELISA de competición y dos de los ELISA no de competición detectan los anticuerpos producidos contra el antígeno proteico del núcleo p26 (3). El tercer ELISA no de competición incorpora la proteína del núcleo p26 y los antígenos gp45 (proteína transmembrana vírica) (3). Un resultado positivo obtenido mediante el ELISA debe comprobarse de nuevo utilizando la prueba AGID. También se puede confirmar el resultado por la técnica de inmunoelectrotransferencia (21).
MÉTODOS DE CONTROL Y PREVENCIÓN
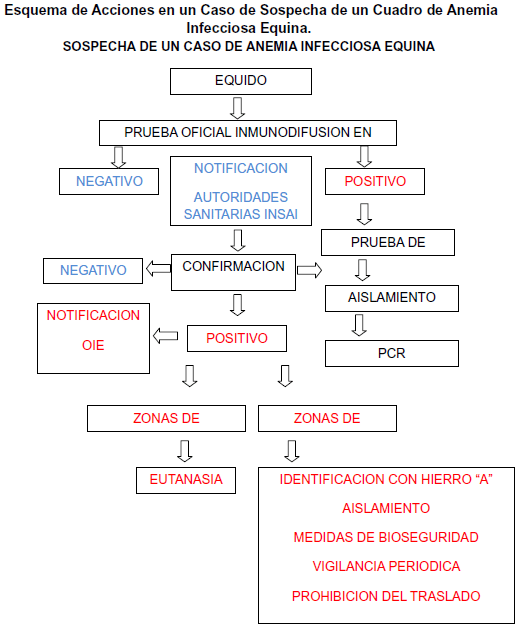
La AIE constituye una enfermedad latente y un desafío constante para los veterinarios dedicados a la actividad hípica (15). Pruebas precisas nos permiten identificar y eliminar los reactores positivos de rebaños y efectivamente bloquear la propagación de la AIE en las poblaciones analizadas. La AIE debe notificarse ante la Organización Mundial de Sanidad Animal (OIE), cumpliendo con los requisitos para la notificación de la enfermedad a las naciones miembro de la OIE, así como los veterinarios deben seguir las pautas nacionales y/o locales para la notificación y las pruebas de diagnóstico correspondientes. Muchos países tienen programas de control que requieren que los equinos sean evaluados para la AIE (14). El movimiento internacional de équidos y el comercio de esperma son los factores más importantes responsables de la difusión de diversos patógenos equinos (1). Esta patología, adquiere importancia no solo en relación con las grandes pérdidas económicas que les ocasiona a los productores, ya que deben eliminar a los animales positivos, sino también por las limitaciones a las exportaciones, el comercio caballar y las actividades ecuestres (15). Las competencias ecuestres nacionales e internacionales son potencialmente áreas de riesgo para la transmisión e infección de la AIE, es por ello que se deben extremar las medidas de control en la cual todos los équidos participantes deben obligatoriamente ser negativos al virus de la Anemia Infecciosa Equina mediante la prueba de Inmunidifusión en Agar Gel y confirmado por ELISA. Otros factores que pueden hacer o tener el potencial de influir en la distribución mundial de las enfermedades infecciosas equinas incluyen: acuerdos comerciales multinacionales, enfermedades emergentes, la mutación de los agentes patógenos, los fenómenos relacionados con el clima, la migración de amplificar/reservorios o vectores, la disponibilidad de nuevos vectores, vacuna contaminación y agroterrorismo (1). La variabilidad antigénica del Virus de la AIE es un serio problema que limita el control de la AIE. No existe vacuna disponible para la AIE. Sin embargo se han probado vacunas contra el VAIE inactivadas y de subunidad en distintos laboratorios, que han mostrado capacidad de protección solo contra infecciones de cepas prototipo homólogas (3). Entre 1975 y 1990, en China, se utilizó mucho una vacuna viva atenuada que se había desarrollado a principios de los años 1970, y resultó eficaz para el control de la prevalencia de la AIE, con prevalencia baja desde 1990, la estrategia de control de la AIE ha pasado de la vacunación a la cuarentena, para evitar que los anticuerpos contra la vacuna interfieran con las pruebas de diagnóstico (3). En Venezuela, el resultado del Test de Coggins es la certificación Oficial de AIE, se debe realizar cada 3 meses (90 días) que junto al certificado anual de vacunación son requisitos indispensables para poder procesar el aval sanitario y la guía para la movilización del ejemplar. La legislación actual establece Zonas de Erradicación en donde todo animal positivo debe ser aislado reconfirmado y sacrificado por las autoridades sanitarias (INSAI), y Zonas de Control donde los procedimientos ante animales positivos es el aislamiento, reconfirmación e identificado con hierro caliente en la región masetérica izquierda (cachete) utilizando la marca de una A de anemia y se recomienda la eutanasia solo si el propietario lo autoriza, así como la prohibición de la circulación en territorio nacional. En la actualidad no existen estudios que describan el impacto de estos programas de control y erradicación de la Anemia Infecciosa Equina en Venezuela. Dado que los equinos infectados se convierten en portadores de por vida, deben permanecer aislados de otros animales susceptibles o ser sacrificados (CFSPH, 2009). En muchos países, un reactor (animal positivo), debe ser marcado a fuego, con frío o tatuado en el labio y se le prohíbe el traslado de un lugar a otro, solo si son llevados a su establecimiento de origen, a un matadero o a un establecimiento de diagnóstico o investigación, y deben ser trasladados bajo condiciones de cuarentena. El riesgo de infección congénita es mayor, si la yegua tiene signos clínicos antes de parir y los potros nacidos de yeguas infectadas, deben ser aislados de otros équidos hasta que se determine que están libres de infección (14). Durante un brote epidémico, la fumigación para controlar los insectos vectores, el uso de repelentes de insectos y de establos protegidos de insectos, puede facilitar la interrupción de la transmisión (14). La ubicación, de los animales en grupos pequeños, separados por al menos 183m, puede ser beneficiosa cuando el virus puede transmitirse dentro de un establecimiento (14). Se debe tener cuidado y estricto control, para evitar la transmisión iatrogénica que representa en muchos lugares la vía de trasmisión. En los países donde la AIE no está presente, se contienen los brotes mediante cuarentenas y controles de movimiento, seguimiento de los casos y vigilancia periódica. En poblaciones de équidos salvajes, donde persiste la infección de AIE, es necesario el control de periódico. La desinfección se debe realizar de las instalaciones y material empleado en animales sospechoso. Los virus envueltos como el virus de la Anemia Infecciosa Equina son destruidos rápidamente por los desinfectantes más comunes. El virus no persiste en los insectos, que son vectores mecánicos. En los establos las medidas físicas de protección de insectos, limitan el acceso a vectores y disminuyen el potencial riesgo de infección. En el año 2006 posterior al primer caso de AIE en Irlanda, se establecieron medidas de control (22), las cuales se mencionan a continuación:
- Prueba (Test de Coggins) en todos los ingresos hospitalarios.
- Mantener mayor separación del personal y pacientes por el tiempo y espacio para reducir la transmisión intra-hospitalaria.
- Siempre que sea posible: diseñar y mantener estrictas instalaciones de aislamiento para casos sospechosos.
- Aislamiento a una milla de distancia, para albergar cualquier caballo con signos iníciales sugerentes de una enfermedad de declaración obligatoria.
- Registros de ingresos detallados, tratamientos, personal, ubicación y movimientos (aunque esta medida resulto invaluable).
- Adopción de las precauciones estándar para los caballos con guantes, derrames de sangre deben desinfectarse.
- Exigir una revisión de seguridad y eficacia de los productos como el plasma equino, procedente de productores.
- Continuar con las pruebas de control para la AIE y alentar el potencial riesgo.
Otras medidas que se adoptan en el Reino Unido (2): en un caso de Anemia Infecciosa Equina en un país afectado, las investigaciones epidemiológicas adecuadas deben llevarse a cabo para determinar si la introducción y propagación ulterior de la enfermedad es probable que se asocie con la importación de caballos infectados o ha sido consecuencia de las actividades humanas. Proporcionar la información de las autoridades veterinarias de un país de la UE afectado, el rastreo adecuado que se ha llevado a cabo, y que todos expuestos o en contacto con caballos AIE conocidos positivos se han sometido a restricciones apropiadas (cuarentena) en los locales para prevenir contactos o movimientos incontrolados y están supervisadas mediante visitas periódicas y análisis de sangre repetidos. En Australia, Queensland Horse Council recomienda en áreas endémicas, que el riesgo de infección puede reducirse mediante la protección de los caballos contra los insectos vectores, cuando sea posible. Por ejemplo: Mantener caballos lejos de zonas bajas, extracción de criaderos de insectos, uso de insecticidas, estabulación a prueba de insectos (12). Campañas de concientización y educación de la Anemia Infecciosa Equina, son fundamentales para garantizar el éxito en el control de la Anemia Infecciosa Equina. Los cambios climáticos asociados al calentamiento global pueden influir sobre la aparición y reemergencia de enfermedades infecciosas (23). Las enfermedades transmitidas por vectores tanto infecciosas como parasitarias se incrementan por los cambios climáticos en humanos y animales de manera paulatina a los cambios de clima, humedad y precipitaciones. Los datos que se disponen indican que la variabilidad interanual e interdecenal del clima tiene una influencia directa sobre la epidemiología de las enfermedades transmitidas por vectores (24). En los climas más cálidos, las hembras de mosquito digieren la sangre más rápido y se alimentan con mayor frecuencia (24). Así como también a mayor temperatura lo parásitos y los virus completan la incubación extrínseca en el interior del mosquito hembra en menor tiempo. Aumentando de esta manera la proporción de vectores potencialmente infecciosos. La modificación del régimen de precipitaciones puede tener también un efecto a corto y largo plazo sobre el hábitat de los vectores, así como de su proporción. El aumento de las precipitaciones puede incrementar el número de y calidad de criaderos de vectores tales como: mosquitos, garrapatas y caracoles, así como la densidad de vegetación, influyendo en la existencia de lugares donde posarse (24). Los estudios realizados han puesto de manifiesto que unas condiciones desusadamente secas (por ejemplo las provocadas por el tiempo relacionado con el fenómeno El Niño/Oscilación Austral en la zona norte del continente), van acompañadas o seguidas de un aumento de la incidencia de enfermedades transmitidas por vectores (24). Esto parece indicar un importante impacto sobre la prevalencia de la Anemia infecciosa Equina. Es por ello que la conciencia y la integración de un sistema vigilancia epidemiológica de la Anemia Infecciosa Equina es fundamental para afrontar los retos del calentamiento global a nivel mundial.
AVANCES EN INVESTIGACIÓN
Los primeros estudios del virus de la Anemia Infecciosa Equina, fueron publicados en 1950 (25), los experimentos de infección en animales de experimentación (26), así como experimentos de transmisión e infección en caballos (27). En 1960, se iniciaron los primeros estudios para el diagnostico mediante la precipitación en agar gel de difusión (28) y el test de fijación del complemento (29), acompañado de estudios citológicos mediante aspirado de medula ósea (30), así como paulatinamente se fueron realizando aportes (31), hasta que se desarrollo el diagnostico de la Anemia Infecciosa Equina por el Test de Inmunodifusion en Agar Gel (32). A partir de la creación de el test de Inmunodifusion en Agar Gel, se realizo el diagnostico del virus de la Anemia Infecciosa Equina en muchas poblaciones de caballos, así como fueron confirmados muchos casos clínicos sospechosos y muchos casos asintomáticos fueron detectados como positivos. La prevalencia se incremento en 1930, con su pico destructivo en los Estados Unidos entre 1960-1970. La amplitud que fue adquiriendo en 1966 en algunos centros europeos de caballos de competición condujo a la OIE a incluirla en las labores de la Comisión del Código y de la Comisión de Normas. La prueba de Coggins que corresponde a este objetivo fue introducida en el Código después de la 3a Reunión sobre enfermedades caballares, celebrada en Lyon en 1977, que había propiciado el encuentro de los expertos y de la OIE, por lo cual la prueba de Coggins se declara con un valor irrefutable en el marco de los intercambios, en el Anexo 4.4.3.1.del Código figura el método normalizado. En 1977 se realizaron estudios de microscopia electrónica (33). A principios de 1980 se iniciaron los primeros estudios a nivel molecular (34). Así como ensayos por enzimoinmunoanálisis (ELISA) (35). Además fueron detectados anticuerpos por inmunofluorescencia (33). En 1984 se describieron las principales alteraciones genómicas asociadas a la infección persistente por el virus de Anemia Infecciosa Equina (36). Se describió la organizacion genómica del Lentivirus y la secuencia completa de la región del gen env de la Anemia Infecciosa Equina (37) y fue reportada la variación antigénica del virus (38). Se demostró el ADN viral en caballos infectados con el virus (39). Entre 1990-2010, se realizaron avances de inmunología, inmunopatología y patología molecular, también en prevalencia en poblaciones, mecanismos de trasmisión, los vectores en el control y erradicación en muchos lugares dada la globalización en las competencias y eventos ecuestres a nivel mundial. Se ha descrito la reacción en cadena de la polimerasa anidada (PCR) para detectar el ADN provírico de la AIE (19). También se ha descrito la PCR con transcriptasa inversa en tiempo real (20). Los últimos avances en investigación están enfocados en la atenuación del virus de la Anemia Infecciosa Equina mediante macrófagos derivados de monocitos, (40), restricción de la replicación del virus, con viperin de equinos, mediante la inhibición de la producción y/o liberación del Gag viral, Env y el receptor a través de la distorsión del retículo endoplasmico (Tang, et al., 2014). Estudios de la replicación e infectividad sugieren la implicación del ARN de doble cadena especifica de Adenosina Deaminasa 1 (ADAR 1) (41).
REFERENCIAS
1. Timoney PJ. Factors influencing the international spread of equine diseases. Vet Clin North Am Equine Pract. 2000 Dec;16(3):537-51. [ Links ]
2. A code of practice for equine infectious anaemia. DARD 4 August 2006. En http://www.dardni.gov.uk/code-of-practice-for-equine-infectious-anaemia.pdf. (revisada 19/08/2015). [ Links ]
3. Manual de la O.I.E. sobre animales terrestres. Anemia Infecciosa Equina: Capítulo 2.5.6; 2013. p.1-6. [ Links ]
4. Ruiz-Saenz J, Cruz A, Reyes E, Lopez-Herrera A, Gongora A. Asociación serológica de la Rinoneumonitis viral equina y la Anemia infecciosa equina. Rev.MVZ Córdoba. 2008; 13(1): 1128-1137. [ Links ]
5. Leroux C, Cadore J, Montelaro R. Equine Infectious Anemia Virus (EIAV): what has HIVs country cousin got to tell us? Vet. Res. 2004; 35: 485–512. [ Links ]
6. Brockhoff T. Equine Infectious Anemia in Horses. The Horse Aug 1; 1998. [ Links ]
7. Cordes T, Issel C. Equine Infectious Anemia - Jun 27th, 11. AAEP Forum article courtesy of The Horse magazine, an AAEP Media Partner. [ Links ]
8. Blajan L. Contribución de la O.I.E. en la lucha contra las enfermedades caballares. Rev.sci.tech.Off.Int.Epiz. 1986; 5 (1): 197-205. [ Links ]
9. Pagamjav O, Kobayashi K, Murakam H, Tabata Y, Miura Y, Boldbaatar B, Sentsui H. Serological survey of equine viral diseases in Mongolia. Microbiol Immunol. 2011; 55: 289–292. [ Links ]
10. Cavalheiro J, Lina Da Silva R, Ribeiro de Almeida M, Silveira S, Freitas J. Incidencia de Anemia Infecciosa Equine No Estado do Goias. Anais de A.I.E. 1978; 8. 1: 157-170. [ Links ]
11. Berrios P. Antecedentes en Chile de enfermedades virales de los animales domésticos: Enfermedades erradicadas y bajo control. Avances en Ciencias Veterinarias. 2001; 16 p.3-14. [ Links ]
12. Queensland Horse Council Inc. May 2010. Revisada 19/08/2015. [ Links ]
13. Informe Comisión Europea RASVE: Alertas y Notificaciones. 1er cuatrimestre; 2012. [ Links ]
14. CFSPH. Anemia Infecciosa Equina; 2009. p1-5. [ Links ]
15. González Del Pino F. Anemia Infecciosa Equina (AIE): Presentación de uncuadro clínico. REDVET. 2011; 12 (10): 4-12. [ Links ]
16. Acevedo L, Finol H, Sucre L. Patología ultraestructural del músculo gluteus medius de caballos criollos en los llanos venezolanos infectados naturalmente por el virus de la anemia infecciosa equina. Revista Científica, FCV-LUZ. 2009; XIX (3): 268 - 276. [ Links ]
17. Shane BS, Issel CJ, Montelaro RC. Enzyme-linked immunosorbent assay for detection of equine infectious anemia virus p26 antigen and antibody. J. Clin. Microbiol. 1984; 19: 351–355. [ Links ]
18. Weiland F, Matheka HD, Bohm HO. Equine infectious anaemia: Detection of antibodies using an immunofluorescence test. Res. Vet. Sci. 1982; 33: 347– 350. [ Links ]
19. Nagarajan MM, Simard C. Detection of horses infected naturally with equine infectious anemia virus by nested polymerase chain reaction. J. Virol. Methods. 2001; 94: 97–109. [ Links ]
20. Cook RF, Cook S, Li FL, Montelaro RC, Issel CJ. Development of a multiplex real-time reverse transcriptase-polymerase chain reaction for equine infectious anemia virus (EIAV). Virol Methods. 2002; 105: 171–179. [ Links ]
21. Animal and Plant Health Inspection Service, USDA: United States Department Of Agriculture (USDA) (2002). Equine Infectious Anemia Uniform Methods and Rules. Disponible en http://www.aphis.usda.gov/animal_health/animal_diseases/eia/ (Revisada 19/08/2015). [ Links ]
22. Issel C, Sadlier M. Reducing the risks of infection in veterinary practices: Recent lessons learned with Equine Infectious Anemia (EIA). Hagyard Bluegrass Equine Symposium 2007 Proceedings: 89-102. [ Links ]
23. Currie B.J. Environmental change, global warming and infectious diseases in Northern Australia. Environmental Health. 2005. (1): 42. [ Links ]
24. Githeko A., Lindsay S, Confalonieri U, Patz J. El cambio climático y las enfermedades transmitidas por vectores: Un análisis regional. Bulletin of the World Health Organization. 2000; 78 (9):1136-1147. [ Links ]
25. Reagan Rl, Lillie Mg, Hickman Jw, Brueckner Al. Studies of the virus of equine infectious anemia. Am J Vet Res. 1950 Apr;11 (39):157-8. [ Links ]
26. Todd Wm, Randall Cc. Studies on the infectivity of the virus of equine infectious anemia for small laboratory animals. Cornell Vet. 1956. [ Links ]
27. Yaoi H, Nagata A, Goto N, Saito K. Experimental studies on equine infectious anemia (swamp fever). I. Re-transmission of Arakawa's virus to horse. Arch Gesamte Virusforsch. 1959; 8(5):621-31. [ Links ]
28. Saxer E. Further studies on the possibility of the use of precipitation by agar gel diffusion in equine infectious anemia. Pathol Microbiol (Basel) 1960; 23:722-6. [ Links ]
29. Arakawa S, Kaneko T, Muto S, Tsurumin, Murakami K, Seki T. Experimental studies on equine infectious anemia (EIA). V. Complement fixation test and precipitation test of horse-serum with mouse-fixed EIA virus antigen. Jpn J Microbiol. 1960 Jul; 4: 249-63. [ Links ]
30. Yamamoto H. Pathological studies on bone marrow in equine infectious anemia. 3. Cytlogical findings of bone marrow aspirates. Natl Inst Anim Health Q (Tokyo) 1968 Winter; 8(4):217-26. [ Links ]
31. Coggins L, Kemen MF Jr, Noronha F, Richard CG, Nusbaum SR, Rickard CG. Equine infectious anemia: Report of progress in research. J Am Vet Med Assoc. 1969 Jul 15; 155 (2):344-5. [ Links ]
32. Coggins L, Norcross NL, Nusbaum SR. Diagnosis of equine infectious anemia by immunodiffusion test. Am J Vet Res. 1972 Jan; 33(1):11-8. [ Links ]
33. Weiland F, Matheka HD, Coggins L, Hatner D. Electron microscopic studies on equine infectious anemia virus (EIAV). Brief report. Arch Virol. 1977; 55(4):335-40. [ Links ]
34. Cheevers WP, Watson SG, Klevjer-Anderson P. Persistent infection by equine infectious anemia virus: Asymmetry of nucleotide sequence reiteration in the integrated provirus of persistently infected cells. Virology. 1982. Apr 15; 118 (1):246-53. [ Links ]
35. Suzuki T, Ueda S, Samejina T. Enzyme-linked immunosorbent assay for diagnosis of equine infectious anaemia. Vet. Microbiol. 1982; 7: 307–316. [ Links ]
36. Payne S, Parekh B, Montelaro RC, Issel CJ. Genomic alterations associated with persistent infections by equine infectious anaemia virus, a retrovirus. J Gen Virol. 1984 Aug;65 (Pt 8):1395-9. [ Links ]
37. Rushlow K, Olsen K, Stiegler G, Payne SL, Montelaro RC, Issel CJ. Lentivirus genomic organization: The complete nucleotide sequence of the env gene region of equine infectious anemia virus. Virology. 1986 Dec;155 (2):309-21. [ Links ]
38. Kono Y. Antigenic variation of equine infectious anemia virus as detected by virus neutralization. Brief report. Arch Virol. 1988; 98(1-2):91-7. [ Links ]
39. Rice NR, Lequarre AS, Casey JW, Lahn S, Stephens RM, Edwards J. Viral DNA in horses infected with equine infectious anemia virus. J Virol. 1989 Dec;63 (12):5194-200. [ Links ]
40. Ma J, Wang SS, Lin YZ, Liu HF, Liu Q, Wei HM, Wang XF, Wang YH, Du C, Kong XG, Zhou JH, Wang X. Infection of equine monocyte-derived macrophages with an attenuated equine infectious anemia virus (EIAV) strain induces a strong resistance to the infection by a virulent EIAV strain. Vet Res 2014 Aug 9;45:82. [ Links ]
41. Tang YD, Na L, Zhu CH, Shen N, Yang F, Fu XQ, Wang YH, Fu LH, Wang JY, Lin YZ, Wang XF, Wang X, Zhou JH, Li CY. Equine viperin restricts equine infectious anemia virus replication by inhibiting the production and/or release of viral Gag, Env, and receptor via distortion of the endoplasmic reticulum. J Virol 2014 Nov;88 (21):12296-310. [ Links ]












 uBio
uBio 
