Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Venezolana de Oncología
versión impresa ISSN 0798-0582
Rev. venez. oncol. v.17 n.1 Caracas ene. 2005
Mapeo linfático intraoperatorio e identificación: Del ganglio centinela en pacientes con estadios tempranos de carcinoma de cuello uterino
Carmen María Suárez1, Josefa María Briceño1, Francisco Medina1, Félix Anzola1, Marco Rezic1, Franco Calderaro1, Loretta Di Giampietro1, Alirio Mijares1, David Parada2, Argimiro Rodríguez1, Josepmilly Peña1, Antonieta Rennola3, Sara Maissi3
1Servicio de ginecología oncológica, Hospital Oncológico Padre Machado.
2Servicio de anatomía Patológica, Hospital Oncológico Padre Machado,
3Servicio de anatomía patológica, Hospital Oncológico Padre Machado Caracas, Venezuela
Correspondencia: Dra. Carmen María Suárez. Servicio de Ginecología Oncológica, Hospital Onco lógico Padre Machado, Av. Alejandro Calvo Lairet, El Cementerio, Caracas, 1070, Venezuela. Tel.: (0414) 331.2678
Resumen
OBJETIVOS: Estudiar la exactitud diagnóstica, factibilidad de la detección de ganglio centinela en pacientes con carcinoma de cuello uterino precoz. MÉTODOS: Entre diciembre de 2001 y abril 2004 se realizaron 28 histerectomías radicales abdominales con linfadenectomía pélvica. De estas, 22 pacientes con diagnóstico de carcinoma de cuello uterino fueron elegibles para este estudio. El día antes de la cirugía se inyectó isótopo radioactivo (4,5 mCi de Tc99 en suspensión de sulfato coloidal) en cuatro cuadrantes del cerviz y se realizó linfoscintigrafía estática. La inyección del colorante vital (azul patente) se realizó posterior a la inducción anestésica. Intraoperatoriamente se identificó el ganglio centinela mediante visión directa y detección con gammacámara. Se realizó posteriormente la histerectomía radical modificada tipo Meigs con linfadenectomía pélvica bilateral. Se hizo el estudio histopatológico de la pieza quirúrgica y los ganglios centinela por separado. Los ganglios centinelas negativos por tinción hematoxilina-eosina fueron sometidos a estudios inmunohistoquímicos para descartar micrometástasis. RESULTADOS: Se identificó el ganglio centinela en 19 pacientes, con un 86,4 % de identificación. Intraoperatoriamente se detectaron 30 ganglios centinelas. El estudio anatomopatológico reveló 40 ganglios centinelas, todos negativos para metástasis, tanto con hematoxilina-eosina como mediante inmunohistoquímica. 63,33 % eran iliacos externos. No se evidenció metástasis a ganglios pélvicos en ningún caso. CONCLUSIÓN: La identificación del ganglio centinela en pacientes con carcinoma de cuello uterino es un procedimiento factible. Esta serie demuestra que debe utilizarse el método combinado para la ubicación del mismo.
PALABRAS CLAVE: Cáncer, cuello uterino, diagnóstico, ganglio centinela, linfadenectomía
Summary
OBJECTIVES: Study the feasibility and diagnostic accuracy of sentinel lymph node detection in patients with early cervical cancer. METHODS: Between December 2001 and April 2004, 28 patients with preoperative diagnosis of early cervical carcinoma underwent radical abdominal hysterectomy with bilateral pelvic dissection. Twenty two patients were eligible for this study. On the day prior to surgery 4.5 mCi of filtered technicium-99 radiocolloid was injected into the cervix around the tumor in four quadrants. Static lymphoscintigraphy was performed. On the day of surgery blue dye was injected in the cervix after induction of general anesthesia. Intraoperatively the sentinel lymph node was searched under direct vision and with the aid of a gammaprobe. Radical abdominal hysterectomy and bilateral pelvic lymphadenectomy were performed in the usual manner. The sentinel lymph nodes were sent to frozen section and the surgical specimen was sent separately for histopathogical analysis. Negative sentinel lymph nodes on routine hematoxilin-eosin staining were submitted to immunohistochemical studies. RESULTS: The sentinel lymph node or nodes were identified in 19 patients, with an identification rate of 86.4 %. A total of 40 sentinel nodes were evaluated; routine hematoxilin-eosin staining and immunohistochemical studies were negative for metastases. 63.33 % of these sentinel nodes had an external iliac location. No metastases were found in non-sentinel lymph nodes. CONCLUSION: Sentinel lymph node identification in cervical carcinoma is feasible. The combined method must be used in order to achieve the best results with the procedure.
KEY WORDS: Cancer, uterine cervix, diagnoses, sentinel lymph node, lynphadenectomy.
Premio dr. Alejandro calvo lairet. 2004.
Recibido: 10/07/2004 Revisado: 15/08/2004 Aceptado para Publicación: 01/10/2004
Introducción
El carcinoma de cuello uterino es la segunda neoplasia maligna más frecuente a nivel mundial, registrándose aproximadamente 437 000 casos anuales. En Venezuela constituye el cáncer más frecuente en la mujer, registrándose para 1998 un total de 3 288 casos, con una tasa cruda, por 100 000 habitantes, de 28,48 y una tasa estandarizada por 100 000 habitantes, según la población mundial, de 32,96. Corresponde al 25,68 % de la totalidad de casos de cáncer en el país. La mortalidad por cáncer de cuello uterino fue de 1 348 casos en dicho año. En 1999 se registró una elevación de esta cifra a 2 149 casos. Ya para el primer trimestre de 2000 se habían registrado 432 decesos por esta causa (1). Es un problema de salud pública que se observa en pacientes jóvenes, con buena expectativa de vida posterior al tratamiento, si el diagnóstico se realiza en estadios tempranos. En nuestro centro hemos observado una marcada tendencia al aumento del diagnóstico de pacientes jóvenes en estadios precoces, de allí la importancia de ahondar en la investigación de esta patología y su ideal forma de tratamiento. El diagnóstico se basa en una exhaustiva historia clínica y examen físico, la citología de exo/endocérvix, la colposcopia y la biopsia de cuello uterino, bien sea en sacabocados o mediante conización. El 90 % de las neoplasias de cuello uterino corresponde al carcinoma epidermoide, seguido del adenocarcinoma De acuerdo a los lineamientos de la FIGO la estadificación del carcinoma de cerviz se hace en base a la evaluación clínica (3). Son considerados exámenes clínicos la palpación (tacto bimanual y bidigital), la inspección y colposcopia, la biopsia (punch, cono, legrado endocervical), la cistoscopia, la rectoscopia, la urografía de eliminación y la radiografía del tórax. Se consideran pruebas opcionales, no necesarias para la estadificación clínica, el ultrasonido abdominal, la tomografía abdominopélvica y la resonancia magnética nuclear de pelvis. Sin embargo son estudios útiles para planificar el tratamiento de la paciente y se utilizan con relativa frecuencia en nuestro medio. Es de hacer notar que el estado ganglionar de la paciente no es tomado en cuenta al realizar la estadiaje clínico según FIGO, a pesar de ser éste un factor de alto impacto en la sobrevida.
Existe una amplia gama de estrategias terapéuticas empleadas en el manejo de esta patología, que incluye la utilización de cirugía, radioterapia externa, braquiterapia y quimioterapia. En los estadios precoces de cáncer de cuello uterino los procedimientos quirúrgicos tienen un rol protagónico, siendo el estándar de oro la histerectomía radical abdominal con linfadenectomía pélvica en este grupo de pacientes (4), generalmente jóvenes, sin condiciones comórbidas en quienes se persigue la conservación de la vagina y el funcionalismo ovárico. Se entiende por estadios tempranos o precoces de cáncer de cerviz, aquellas lesiones confinadas al cuello o al tercio superior de la vagina, sin afección parametrial, invasión a órganos vecinos o metástasis a distancia, correspondiendo entonces a los estadios I y IIa según la FIGO (5).
Se ha determinado que el estado ganglionar es el factor pronóstico más importante en estos tumores. Plentl y Friedman (6), describieron un patrón predecible de drenaje del cerviz, que se establece de manera escalonada desde el estroma cervical y linfáticos de la serosa uterina hacia los grupos ganglionares en los parametrios, linfáticos pélvicos, linfáticos pararrectales y linfáticos paraaórticos. Múltiples patrones de drenaje linfático han sido descritos extensamente, pero los datos disponibles han sido sesgados en su mayoría (7). La descripción tradicional se ha basado en la presencia de tres vías linfáticas principales, una anterior que pasa a través del ligamento vesico-uterino hasta los ganglios interilíacos, una lateral que corre a través del parametrio lateral y que es la principal ruta de drenaje, y una posterior, menor, que pasa a través del ligamento sacro-uterino y a lo largo del uréter, hasta los ganglios presacros y preaórticos (8).
Uno de los estudios más exhaustivos de diseminación linfática del carcinoma de cuello uterino ha sido realizado por el grupo italiano de Benedetti-Panici y col. (7). Al evaluar cuidadosamente los especímenes quirúrgicos de 225 histerectomías radicales con linfadenectomía pélvica y paraaórtica sistemática, obtuvieron un promedio de 70 ganglios linfáticos por paciente (48 pélvicos, 22 paraaórticos). Establecen una clasificación anatómica de los grupos ganglionares por regiones, clasificándolos en aórticos (para, pre y retrocava, intercavo-aórticos, pre, para y retroaórticos) y pélvicos (ilíacos comunes superficiales y profundos, ilíacos externos, presacros, obturatrices superficiales y profundos, ilíacos internos y parametriales). Los grupos ganglionares que son asiento de metástasis aisladas y aquellos más frecuentemente involucrados están localizados sobre el nervio obturador, entre la bifurcación de las arterias iliacas, alrededor de la arteria y vena iliaca externa y sobre los vasos iliacos comunes, correspondiendo a los grupos obturatrices superficiales, iliacos externos e iliacos comunes superficiales. Estos ganglios pueden ser considerados como los que drenan principalmente al cerviz (7). Es de hacer notar que a pesar de encontrar ganglios parametriales distribuidos de manera irregular a lo largo de todo el parametrio en 59 % de los especímenes quirúrgicos, no se observaron metástasis nodales aisladas en este grupo, sino acompañadas de enfermedad nodal pélvica o paraaórtica. Estos hallazgos se han corroborado en otras series (9,10). En estudio reciente de los mismos autores, el porcentaje de ganglios linfáticos hallados en el parametrio fue de 93 %, con un 18 % de afección ganglionar parametrial en los estadíos IB1 de cáncer de cuello uterino, pero raramente aislada, sino en presencia de positividad de ganglios pélvicos, que fueron positivos en un 24 % de estos casos (10).
En pacientes con carcinoma de cuello uterino estadio I y II según la FIGO, el porcentaje de metástasis linfáticas pélvicas se encuentra entre 0 % - 16 % y 24 % - 31 %, respectivamente. En estos mismos grupos, el porcentaje de pacientes con afección de ganglios paraaórticos va desde 0 % - 22 % y 11 % - 19 %, respectivamente (11).
Clark (12), fue el primero en aplicar el concepto halstediano de cirugía radical al manejo del cáncer de cuello uterino. Posteriormente, con los estudios de Taussig (13) y Meigs (14), la disección ganglionar pélvica se ha convertido en una parte integral del tratamiento quirúrgico del cáncer de cuello uterino en estadios precoces, estableciéndose el concepto de linfadenectomía sistemática. La morbilidad asociada a la linfadenectomía ocurre en un porcentaje no despreciable de casos, siendo las complicaciones tempranas la lesión vascular en un 10 %, la hemorragia severa en un 2 % y la lesión del nervio obturador en un 0,3 %. Las complicaciones tardías más frecuentes son las infecciones secundarias (19 %) y la formación de linfoquistes (18 %) seguido de la trombosis venosa profunda en un 5 % (15). El primero en poner en duda la necesidad de la linfadenectomía sistemática fue Cabañas en sus estudios de investigación en cáncer de pene (16), cuando define al ganglio centinela como el primer ganglio dentro del área de drenaje que recibe el flujo linfático de la lesión y que por tanto debe ser el primer sitio de enfermedad metastásica; demostrando que la linfadenectomía sistemática no era necesaria si el ganglio centinela no estaba afecto. El concepto de ganglio centinela y la técnica de detección del mismo, ha sido desarrollado exhaustivamente y validado en melanoma (17) y cáncer de mama (18).
En la última década, los procedimientos de mapeo linfático han sido aplicados de manera cada vez mayor al tratamiento de una variedad de neoplasias sólidas. Esta técnica comprende la inyección de un colorante vital o suspensión de radioisótopo al tejido adyacente al tumor primario. El material es captado por los linfáticos regionales que drenan a uno o más ganglios centinelas, lo que permite al cirujano su identificación, bien sea mediante visión directa o mediante el uso de gammacámara. En las áreas de drenaje linfático donde el concepto de ganglio centinela sea válido, el estado patológico de estos ganglios específicos debería reflejar el estado global de la zona de drenaje (19). A pesar de la complejidad del drenaje linfático del cuello uterino, el cual no es predecible sino que es descrito por algunos autores como al azar (20), sumado a la localización profunda y poco accesible de los grupos ganglionares involucrados, el carcinoma de cuello uterino es un buen candidato para el mapeo linfático ya que de acuerdo a la baja incidencia de afectación nodal en estadios precoces, más del 80 % de las pacientes que son sometidas a linfadenectomía no obtienen beneficio alguno del procedimiento y sin embargo deben estar expuestas a la morbilidad asociada a esta cirugía (21). Por otra parte, una determinación exacta del estado ganglionar en esta población permitiría seleccionar aquellas pacientes con ganglios linfáticos afectos para quimiorradiación sin la necesidad de emplear cirugía pélvica radical (21).
En años recientes, a medida que aumenta la sobrevida global de las pacientes con cáncer de cuello uterino en estadios precoces, se está prestando más atención a la preservación de la fertilidad, la cosmesis y los procedimientos mínimamente invasivos. En este contexto, la aplicación de técnicas de identificación del ganglio centinela por vía laparoscópica en conjunto con la traquelectomía radical o histerectomía radical por este abordaje constituye un avance significativo en el manejo de esta enfermedad, siendo múltiples las series donde se presenta el procedimiento realizado por vía laparoscópica (22-24).
Métodos
El presente estudio prospectivo y descriptivo fue realizado en el Hospital Oncológico Padre Machado, en el Servicio de Ginecología Oncológica desde diciembre de 2001 hasta abril de 2004 se incluyeron en esta serie a todas las pacientes con diagnóstico de carcinoma de cuello uterino en estadios tempranos según la clasificación de la FIGO, planificadas para exploración quirúrgica con el intento de realizar histerectomía radical y linfadenectomía pélvica. Los criterios de exclusión fueron los antecedentes de quimioterapia o radioterapia primaria, antecedentes de cirugía retroperitoneal o ganglios macroscópicamente tomados en el momento de la cirugía.
Procedimiento: En un tiempo aproximado de 16 horas previo a la cirugía se inyectaron 4,5 mCi de Tc99 en suspensión de sulfato coloidal de renio (NanoVIS; CIS, Biointernational, France) para un total de 2 mL en cuatro cuadrantes del cerviz en hora 12, 3, 6 y 9. Se inyectaron 0,5 mL por cuadrante con aguja 21- gauge (Figura 1). Se realizó linfoscintigrafía estática 30 minutos posterior a este procedimiento, registrándose el número y localización de los ganglios centinelas identificados (Figura 2). Al día siguiente, después de la inducción anestésica se colocó a las pacientes en posición de litotomía y posterior a un tacto bimanual y bidigital se inyectó 1 mL de azul patente (Bleu Patente V 2,5 %, Guerbet, France) en el cuello uterino en hora 12, 3, 6 y 9 a razón de 0,25 mL por cuadrante con aguja 21 gauge. Inmediatamente después de la inyección de colorante vital se realizó la laparotomía y las incisiones en el peritoneo pélvico para exponer el retroperitoneo. Se procedió a una inspección visual cuidadosa de la pelvis y retroperitoneo, sondeándose de manera exhaustiva con una gammacámara (Navigator Gamma Guidance System; United States Surgical Corporation, USA).


Se registró el contaje radioactivo en el cuello uterino y en la pelvis y región paraórtica. En un intervalo de tiempo no mayor de 20 minutos desde la inyección del azul patente se identificaron los ganglios teñidos de azul y los ganglios radioactivos (Figura 3). Se consideraron ganglios centinelas aquellos teñidos de azul o aquellos que tenían un contaje radioactivo al menos 10 veces mayor que los niveles de fondo en la pelvis. Se realizó comprobación de su radioactividad ex vivo y se realizó nuevamente sondaje de la cavidad pélvica con la gammacámara con el fin de detectar otros ganglios radioactivos. Los contajes radioactivos de los ganglios centinelas y su localización fueron registrados, al igual que el número y ubicación de los ganglios centinelas azules. Dichos ganglios fueron enviados a biopsia extemporánea (corte congelado). Posteriormente se continuó la linfadenectomía pélvica e histerectomía abdominal radical a discreción del cirujano del caso. Se realizó estudio histológico habitual de la pieza de linfadenectomía y de los ganglios centinelas por separado.

Estudio histológico del ganglio centinela: los ganglios centinelas se seccionaron a intervalos de 2 mm - 3 mm. Posteriormente fueron embebidos en parafina, fijándose los bloques en formalina. Se realizaron cortes de 4 micras de espesor y se colorearon con hematoxilina-eosina. En caso de no encontrarse metástasis, se realizaron estudios inmunohistoquímicos con el fin de identificar posibles micrometástasis (Figura 4 y 5).


Técnica de inmunohistoquímica del ganglio centinela: previo a desparafinar e hidratar los cortes histológicos, se procedió a practicar la recuperación de antígenos utilizando para ello una vaporera (Black & Decker), colocando las láminas durante 20 minutos a una temperatura de 95ºC en solución Dako® (S1700) para dicha recuperación. Posteriormente se lavaron en tres oportunidades con agua destilada por 5 minutos. Se continuó con la inhibición de la peroxidasa endógena incubándose el material a temperatura ambiente por 30 minutos en una solución de peróxido de hidrógeno-metanol al 3 %, (peróxido de hidrógeno al 30 %, Macrosearch®), lavándose inmediatamente tres veces con solución de buffer fosfato a pH 7.2 (PBS) por 5 minutos cada lavado. Se incubaron cada uno de los casos con el anticuerpo primario monoclonal Queratina AE1/AE3 (Queratina prediluido, Dako®) durante 30 minutos a temperatura ambiente. Las incubaciones con el anticuerpo secundario universal biotinilado unido al complejo enzimático (Dako® - EnVision®) fueron realizadas a temperatura ambiente durante 10 minutos en cada caso, posteriormente se hicieron 3 lavados con PBS.
Finalmente los cortes de inmunohistoquímica fueron revelados con diaminobencidina, contrastados con hematoxilina de Meyer, deshidratados con alcoholes a concentraciones crecientes y aclarados con xilol, para finalmente ser examinados en un microscopio de luz, con aumentos directos que oscilaron entre 3,5 X y 40 X. Cada uno de los casos problema fueron corridos con controles positivos (correspondiente a secciones de piel) y controles negativos (en los cuales se añadió PBS en vez de del anticuerpo primario). Se tomó como caso positivo cuando se evidenció expresión para el anticuerpo primario, sin importar la intensidad de reactividad para dicho anticuerpo.
Métodos estadísticos: se calculó la media y la desviación estándar de las variables continuas; en el caso de las variables nominales, su frecuencia y porcentaje. El análisis de este estudio fue de tipo exploratorio, pues estuvo restringido sólo a la elaboración de elementos de representación estadística (histogramas y gráficos de sectores). Todos los datos fueron procesados con SPSS 10.0 para Windows®.
Resultados
En el período comprendido entre diciembre de 2001 y abril de 2004 se realizaron 28 histerectomías radicales abdominales tipo Meigs con linfadenectomía pélvica en pacientes con diagnóstico de carcinoma de cuello uterino en estadios precoces. Seis pacientes no se incluyeron en el protocolo de detección de ganglio centinela por problemas técnicos como la no disponibilidad de isótopo radioactivo o colorante vital, o fallas en el funcionamiento del equipo. Las 22 pacientes restantes constituyen la población evaluada en esta serie (Cuadro 1).

La edad de las pacientes osciló entre 27 y 57 años, con una media de 38,59 años y una desviación estándar de 9,04 años. La mayoría tenían diagnóstico de carcinoma epidermoide de cuello uterino (81,77 %) y, el 95,45 % eran estadio IB1. La biopsia dirigida por colposcopia (punch) fue el método empleado para el diagnóstico en 72,7 % de los casos. En 13,6 % se realizó conización mediante asa diatérmica y, en el 13,6 % restante, conización con bisturí frío. Las lesiones del cuello uterino sólo fueron visibles mediante colposcopia en 31,81 % de las pacientes. El tamaño osciló entre 0 cm y 4 cm, con una media de 1,33 cm y una desviación estándar de 1,23 cm.
La utilización del método combinado (utilización de isótopo radioactivo y colorante vital) se realizó en 18 casos, correspondiendo al 81,81 % de la muestra. En tres casos (13,63 %) se utilizó únicamente linfoscintigrafía e isótopo radioactivo por no contar con el colorante vital; en un caso sólo se utilizó colorante vital debido a falta de disponibilidad de radioisótopo.
En los 21 casos en que se utilizó la linfoscintigrafía, se realizó la inyección del isótopo radioactivo 16 horas previo a la intervención quirúrgica. La linfoscintigrafía evidenció la presencia de ganglios centinelas en 19 pacientes (90,47 %). El número de ganglios detectados por este método varió entre 0 y 4 por paciente, con una media de 1,57 y una desviación estándar de 0,98. En 6 pacientes (28,6 %), se identificaron ganglios centinelas bilaterales. En todas las pacientes los ganglios se ubicaron en la pelvis. En una paciente (4,75 %) se identificó un ganglio paraaórtico adicional (Figura 6).
Durante el acto quirúrgico, en los 19 casos en que se utilizó colorante vital, se identificó el ganglio centinela a los 20 minutos posterior a su inyección cuando el procedimiento fue exitoso.

De manera global, intraoperatoriamente se detectó el o los ganglios centinelas en 19 de 22 mujeres, con un porcentaje de identificación del 86,4 %. Cuando se analiza el porcentaje de identificación de acuerdo al método utilizado, encontramos un porcentaje de identificación de 94,44 % para el método combinado (colorante vital y radioisótopo), 33,33 % cuando se utiliza únicamente radioisótopo y, 100 % cuando se utilizó únicamente el colorante vital.
El mapeo linfático intraoperatorio identificó 30 ganglios centinelas. En cuatro pacientes se encontraron ganglios centinelas pélvicos bilaterales. En cuanto a la ubicación, en 63,33 % de los ganglios eran iliacos externos. 30 % de los ganglios se ubicaron en la fosa obturatriz. En una paciente se identificó un ganglio centinela paraórtico y en otra paciente uno parametrial (3,33 % respectivamente).
Hubo tres procedimientos fallidos (13,6 %) donde no se identificó el ganglio centinela. Cuando se utilizó el método combinado, sólo falló en un caso. Llama la atención que en esta paciente la linfoscintigrafía detectó un drenaje bilateral pélvico (2 ganglios pélvicos derechos y 2 izquierdos) aunque intraoperatoriamente no se detectaron ganglios centinelas posterior a un sondaje exhaustivo del retroperitoneo con la gammacámara. La inspección visual tampoco detectó la presencia de ganglios azules. Esta paciente tenía como antecedente la realización de una conización con asa diatérmica en otro centro hospitalario, no presentando lesión en el cuello uterino ni a visión directa ni mediante evaluación colposcópica. Las otras dos fallas del método se evidenciaron en pacientes en las que no se utilizó el método combinado sino únicamente el radioisótopo, no teniendo la ayuda visual del colorante vital para la búsqueda del ganglio centinela intraoperatoriamente.
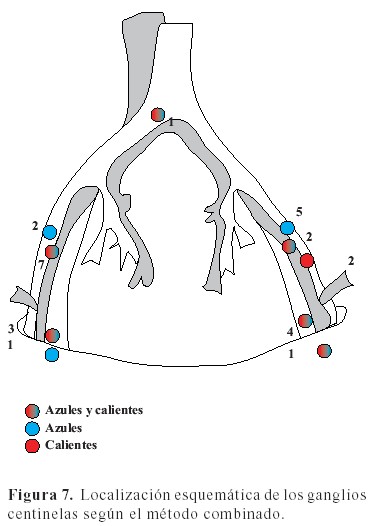
Al analizar los ganglios centinelas identificados con el método combinado, observamos que se identificaron 28 ganglios. Dieciocho fueron azules y calientes (64,2 %). Hubo ocho ganglios que no fueron detectados por la gammacámara estando únicamente azules. Se obtuvo un rango de 1 a 4 ganglios azules y calientes. El método de detección de los ganglios centinelas de acuerdo a su ubicación se encuentra resumido en el Cuadro 2 y esquematizado en la Figura 7.
El número total de ganglios centinelas identificados por los anatomopatólogos fue de 40, con un rango de 0 a 6 ganglios por paciente, un promedio de 1,82 ganglios y una desviación estándar de 1,62. Todos los ganglios centinela fueron negativos tanto en el corte congelado como en la evaluación histopatológica definitiva con tinción hematocilina y eosina. Los estudios de inmunohistoquímica de estos ganglios centinelas negativos no evidenciaron la presencia de micrometástasis en ningún caso. Se realizó histerectomía abdominal radical abdominal tipo Meigs con linfadenectomía pélvica bilateral en la totalidad de las pacientes. En el estudio anatomopatológico de la pieza quirúrgica se encontró un total de 304 ganglios, evidenciando un rango entre 7 y 19 ganglios por paciente y un promedio de 13,8 ganglios disecados. Todos los ganglios resultaron negativos para metástasis empleando coloración hematoxilina y eosina de rutina. El porcentaje de falsos negativos en nuestra serie fue del 0 %, entendiéndose por falsos negativos aquellos casos en que el ganglio centinela es negativo en presencia de ganglios no centinelas positivos. En la pieza definitiva no se evidenció afectación parametrial en ningún caso.
No se registraron complicaciones inherentes al procedimiento. Una minoría de las pacientes reportó dolor moderado con la inyección del isótopo radioactivo. No evidenciamos reacciones anafilácticas al colorante vital ni desaturación en el transoperatorio. El tiempo quirúrgico promedio fue de 3 horas y media (un rango de 3 a 4 horas). Las pacientes permanecieron ingresadas 48 horas posteriores a la intervención quirúrgica, egresando en excelentes condiciones.

Discusión
Existen actualmente en la literatura internacional numerosas series de mapeo linfático intraoperatorio y detección de ganglio centinela en pacientes con carcinoma de cuello uterino. Uno de los reportes iniciales fue de Echt y col. (25). Ellos describieron un porcentaje de éxito en la identificación del ganglio centinela de 15,4 % mediante la utilización de lymphazurin (2 mL) en el cerviz. Atribuyeron la baja tasa de detección del ganglio a la poca cantidad de colorante utilizado, sugiriendo estudios posteriores con mayores dosis del mismo. Kamprath (26), es el primero que emplea radiosótopo como método de detección del ganglio centinela, realizando el mapeo linfático mediante abordaje mínimamente invasivo utilizando Tc99 y una gamma-cámara introducida a través del trócar de laparoscopia. Reportan un porcentaje de identificación del ganglio centinela de 100 % sin falsos negativos. Verheijen y col. (27), son los primeros que utilizaron un método combinado y describen sus hallazgos utilizando linfoscintigrafía, gamma-cámara y colorante vital (0,2 mL) obteniendo un 80 % de identificación del ganglio centinela. Concluyen que se obtienen mejores resultados con el isótopo radioactivo que con el colorante vital pero que ambas modalidades son complementarias. OBoyle y col. (19), identificaron ganglios centinela en 60 % de sus pacientes. El aporte principal de esta serie es determinar la influencia del tamaño tumoral en la detección; en tumores menores de 4 cm el porcentaje de identificación del ganglio centinela fue de 73 %, descendiendo a 20 % cuando las lesiones medían más de 4 cm. Hacen énfasis además en que el tiempo entre la inyección del contraste y la apertura del retroperitoneo no debe ser mayor de 20 minutos y sugieren que la conización previa no influye en el éxito del procedimiento. DArgent y col. (28), describen una técnica laparoscópica de identificación del ganglio centinela mediante la utilización de azul patente. Este grupo completa la linfadenectomía por vía laparoscópica y en caso de estar negativos los ganglios, procede a una histerectomía vaginal radical tipo Schauta- Amreich o una traquelectomía radical. Llama la atención que, en los primeros casos de su serie no se obtuvieron buenos resultados con la inyección de 2 mL de colorante vital, empleando 4 mL en los casos subsiguientes con excelentes resultados. Malur y col. (29), reportaron la poca efectividad del procedimiento cuando se realiza la inyección del colorante vital en los fondos de saco laterales de la vagina, sugiriendo se emplee la técnica de inyección en cuatro cuadrantes del cerviz, método empleado en la mayoría de las series mencionadas. La mayor serie publicada hasta la fecha es la de Levenback y col. (21), grupo que utiliza una técnica consistente con criterios uniformes de selección a nivel multiinstitucional. Utilizan un procedimiento combinado, empleando linfoscintigrafía preoperatoria y mapeo linfático intraoperatorio con colorante vital e isótopo radioactivo mediante gamma-cámara, con un porcentaje de identificación del ganglio centinela de 100 %, una sensibilidad de 87,5 % y un valor predictivo negativo de 97 %.
En nuestra serie obtuvimos un porcentaje de identificación global del ganglio centinela de 86,4 %. Este es similar al de otras series publicadas en la literatura (Cuadro 3). El método de inyección intracervical de radioisótopo y de colorante vital en cuatro cuadrantes ya detallado en publicación previa (30), arrojó excelentes resultados. Sin embargo, a pesar de utilizar en los primeros casos 2 mL de colorante vital, disminuimos esta cantidad a 1 mL en los casos subsecuentes obteniendo resultados igualmente satisfactorios. La linfoscintigrafía preoperatoria, si bien cuestionada por otros autores (21), resultó muy útil para el cirujano al momento de sondear el retroperitoneo, encontrando una buena correlación entre ésta y los hallazgos intraoperatorios. En los 18 casos en que se utilizó el método combinado, el porcentaje de identificación del ganglio centinela fue de 94,44 %. El 64,28 % de los ganglios centinelas fueron detectados tanto por gammacámara como por visión directa (ganglios azules y calientes), el 28,57 % únicamente se detectó con el colorante vital y el 7,14 % únicamente con gammacámara, a diferencia de otras series (21,29) donde se reporta un porcentaje mucho menor de identificación de ganglios azules. Esto puede deberse a que en nuestro estudio inyectamos volúmenes de radioisótopo y azul patente empleando técnicas idénticas de inyección. La mayoría de los ganglios centinelas fueron catalogados como iliacos externos y obturatrices. Esto coincide con múltiples reportes en la literatura donde se establece que estos grupos ganglionares son los que drenan principalmente el cuello uterino (7,10,21). Sin embargo, en una paciente se determinó una vía de drenaje directamente hacia los ganglios paraórticos, lo cual está también reportado en la literatura (21). En un caso el drenaje fue parametrial, lo cual tampoco es usual. Al analizar los resultados obtenidos en las cuatro pacientes en que no se utilizó el método combinado, al utilizar únicamente radioisótopo se obtuvo un 33,33 % de identificación. Al usar únicamente colorante vital este porcentaje se eleva a 100 %, sin embargo, este resultado aparentemente mejor que el obtenido con el método combinado no es comparable, en vista de sólo tratarse de un caso. Sin embargo, impresiona que el método combinado sea el más eficaz para la realización exitosa del mapeo linfático intraoperatorio. En cuatro casos el mapeo linfático intraoperatorio detectó ganglios centinelas bilaterales, hallazgo también reportado en series previas (21).
No se identificó el ganglio centinela en 3 pacientes (13,6 %). Al utilizar el método combinado, éste falló únicamente en un caso, siendo las otras dos fallas en pacientes en que se utilizó solamente radioisótopo sin la ayuda del colorante vital, lo cual, demuestra nuevamente la mayor eficacia de este último método. En vista que 27,2 % de las pacientes tuvieron como antecedente la realización de una conización previa, bien sea con asa diatérmica o con bisturí frío, no parece haber una relación entre ésta y el porcentaje de identificación del ganglio centinela. Es de hacer notar, sin embargo, que en la única paciente en que el procedimiento con método combinado fue fallido había un antecedente de conización con asa. Sin embargo, el mapeo linfático intraoperatorio debe realizarse independientemente de este antecedente.

No evidenciamos relación alguna entre el tamaño tumoral y el éxito del procedimiento.
No se registraron lesiones mayores de 3 cm de diámetro.
En la gran mayoría de las pacientes se identificó más de un ganglio centinela, con un promedio de 2 ganglios por paciente. No se ha dilucidado actualmente si todos los ganglios que se detectan durante el mapeo son considerados centinela o si los ubicados más lejos del tumor pudieran ser considerados como una segunda estación linfática de drenaje. En vista de esto es importante tomar como centinela a todos los ganglios que se detecten intraoperatoriamente independientemente de su localización.
En nuestra serie no se evidenciaron ganglios centinelas positivos ni por técnicas de coloración habitual de hematoxilina-eosina ni mediante estudios inmunohistoquímicos de detección de citoqueratina. Tampoco se evidenciaron ganglios positivos en las linfadenectomías pélvicas realizadas. Esto puede deberse a la selección de los casos ya que solamente incluimos a pacientes con estadios IB1 para este procedimiento. Las demás pacientes estadios IB2 y IIA son manejadas con protocolos de terapia combinada que consisten en radioterapia y quimioterapia concurrente seguidos de cirugía radical. Hubo un 100 % de correlación entre el estado ganglionar de la pelvis y el ganglio centinela, no habiendo falsos negativos. Actualmente se están estudiando técnicas más sensibles de detección de micrometástasis empleando técnicas de transcriptasa reversa para la detección de la expresión de la citoqueratina M en ganglios linfáticos de pacientes con carcinoma de cuello uterino en estadios tempranos (31). Este método, sumado a la inmunohistoquímica, pudiera aplicarse a futuro al estudio de los ganglios centinela, para aumentar la exactitud del procedimiento. Su aplicabilidad clínica, al igual que la detección de las micrometástasis por inmunohistoquímica, está aun por determinarse.
Esta serie describe la experiencia obtenida a través de una técnica quirúrgica abierta, sin embargo, en la literatura actual hay varias series que demuestran la aplicabilidad laparoscópica de este método (32,33).
Nosotros podemos concluir en: la identificación del ganglio centinela en pacientes con carcinoma de cuello uterino es un procedimiento factible. La técnica combinada (isótopo radioactivo y colorante vital) da excelentes resultados y es la que recomendamos para efectuar el procedimiento. La inyección del isótopo radioactivo y el colorante debe ser realizados en forma intracervical, en cuatro cuadrantes, ya que este método ha demostrado ser eficaz. La utilización de menor cantidad de colorante vital (1 mL) es recomendada por nosotros en vista de obtener mejores resultados que con cantidades mayores. En este estudio comprobamos que el procedimiento es eficaz en pacientes con estadios IB1 y IA2 ya que en estas pacientes existe una correlación entre el estado ganglionar y el del ganglio centinela, ahorrando la linfadenectomía pélvica a una gran cantidad de pacientes. Consideramos que el antecedente de conización previa, bien sea con asa o con bisturí frío, no contraindica el procedimiento, ya que en ellas se realizó el mapeo linfático intraoperatorio de manera eficaz. Es necesaria la incorporación paulatina en los servicios de ginecología oncológica del uso de laparoscopia en los procedimientos oncológicos ya que estas nuevas técnicas de mapeo linfático intraoperatorio y linfadenectomía selectiva son perfectamente realizables por esta vía. El carcinoma de cuello uterino es un problema de salud pública en Venezuela que afecta a mujeres jóvenes en edad reproductiva. Es en esta población donde se deben hacer los máximos esfuerzos para diagnosticar a las pacientes en estadios precoces e investigar nuevas modalidades de tratamiento que ofrezcan una menor morbilidad y mayor preservación de la función reproductiva y sexual.
Referencias
1. División de Sistemas Estadísticos M.S.D.S. División de Oncología. Registro Central de Cáncer. [ Links ]
2. González-Merlo J, González Bosquet E, Biete Solá A, Casanova Doménech L, Mestres J. Cáncer de cerviz. En: González-Merlo J, González-Bosquet J, editores.Ginecología Oncológica. 2ª edición. Barcelona: Masson; 2000.p.41-71. [ Links ]
3. Ngan H, Benedet JL, Jones III HW, Bender HG, Pecorelli S. Cancer of the cervix. En: Benedet JL, Pecorelli S, editores. Staging classifications and clinical practice guidelines of gynecologic cancers by the FIGO Committee on Gynecologic Oncology. Elsevier; 2000.p.27- 40. [ Links ]
4. National Cancer Institute. Cervical carcinoma. NCI PDQ Statements. Jan. 2002. [ Links ]
5. Shepherd JH. Cervical and vulva cancer: Changes in FIGO definitions of staging. Br J Obstet Gynaecol. 1996;103(5):405-406. [ Links ]
6. Plentl A, Friedman EA. Lymphatic system of the female genitalia. En: Lymphatics of the cervix uteri. Filadelfia: WB Saunders; 1971;2:75-84. [ Links ]
7. Benedetti-Panici P, Maneschi F, Scambia G, Greggi S, Cutillo G, DAndrea G, et al. Lymphatic spread of cervical cancer: An anatomical and pathological study based on 225 radical hysterectomies with systematic pelvic and aortic lymphadenectomy. Gynecol Oncol. 1996;62(1):19-24. [ Links ]
8. Reiffenstul G. The lymphatics of the female genital organs. Filadelfia: J.B. Lippincott Co.; 1964. [ Links ]
9. Michel G, Morice P, Castaigne D, Leblanc M, Rey A, Duvillard P. Lymphatic spread in stage Ib and II cervical carcinoma: Anatomy and surgical implications. Obstet Gynecol. 1998;91(3):360-363. [ Links ]
10. Benedetti-Panici P, Maneschi F, DAndrea G, Cutillo G, Rabiti C, Congiu M, et al. Early cervical carcinoma. The natural history of lymph node involvement redefined on the basis of thorough parametrectomy and giant section study. Cancer. 2000;88(10):2267-2274. [ Links ]
11. Ramirez P, Levenback C. Sentinel nodes in gynecologic malignancies. Curr Opin Oncol. 2001;13(5):403- 407. [ Links ]
12. Clark JG. A more radical method of performing hysterectomy for cancer of the uterus. Bull Johns Hopk Hosp. 1896;6. [ Links ]
13. Taussig FJ. Iliac lymphadenectomy with irradiation in Rev Venez Oncol [ Links ]
15 Mapeo linfático intraoperatorio - Carmen Suárez y col. WS, Fiorica JV. Detection of sentinel lymph nodes with lymphazurin in cervical, uterine and vulvar malignancies. South Med J. 1999;92(2):204-208. the treatment of cancer of the cervix. Am J Obstet Gynecol. 1934;98:650-667.
14. Meigs JV. Carcinoma of the cervix-the Wertheim operation. Surg Gynecol Obstet. 1944;78:195-199. [ Links ]
15. Benedetti-Panici P, Maneschi F, Cutillo G. Pelvic and aortic lymphadenectomy. Surg Clin North Am. 2001;81(4):841-858. [ Links ]
16. Cabanas RM. Anatomy and biopsy of sentinel lymph nodes. Urol Clin North Am. 1992;19(2):267-276. [ Links ]
17. Morton DL, Wen DR, Wong JH, Economou JS, Cagle LA, Storm FK, et al. T Technical details of intraoperative lymphatic mapping for early stage melanoma. Arch Surg. 1992;127(4):392-399. [ Links ]
18. Giuliano AE, Kirgan DM, Guenther JM, Morton DL. Lymphatic mapping and sentinel lymphadenectomy for breast cancer. Ann Surg. 1994;220(3):391-401. [ Links ]
19. OBoyle J, Coleman R, Bernstein S, Lifshitz S, Muller C, Miller D. Intraoperative lymphatic mapping in cervix cancer patients undergoing radical hysterectomy: A pilot study. Gynecol Oncol. 2000;79(2):238- 243. [ Links ]
20. Metcalf KS, Johnson N, Calvert S, Peel KR. Site specific lymph node metastasis in carcinoma of the cervix: Is there a sentinel node? Int J Gynecol Cancer. 2000;10(5):411-416. [ Links ]
21. Levenback C, Coleman R, Burke T, Lin W, Erdman W, Deavers M, et al. Lymphatic mapping and sentinel node identification in patiens with cervix cancer undergoing radical hysterectomy and pelvic lymphadenectomy. J Clin Oncol. 2002;20(3):688-693. [ Links ]
22. Plante M, Renaud MC, Tetu B, Harel F, Roy M. Laparoscopic sentinel node mapping in early-stage cervical cancer. Gynecol Oncol. 2003;91(3):494-503. [ Links ]
23. Buist MR, Pijpers RJ, van Lingen A, van Diest PJ, Dijkstra J, Kenemans P, et al. Laparoscopic detection of sentinel lymph nodes followed by lymph node dissection in patients with early stage cervical cancer. Gynecol Oncol. 2003;90(2):290-296. [ Links ]
24. Barranger E, Grahek D, Cortez A, Talbot JN, Uzan S, Darai E. Laparoscopic sentinel lymph node procedure using a combination of patent blue and radioisotope in women with cervical carcinoma. Cancer. 2003;97(12):3003-3009. [ Links ]
25. Echt ML, Finan MA, Hoffman MS, Kline RC, Roberts
26. Kamprath S, Possover M, Schneider A. Laparoscopic sentinel lymph node detection in patiens with cervical cancer. Am J Obstet Gynecol. 2000;182(6):1648. [ Links ]
27. Verheijen RH, Pijpers R, van Diest PJ, Burger CW, Buist MR, Kenemans P. Sentinel node detection in cervical cancer. Obstet Gynecol. 2000;96(1):135-138. [ Links ]
28. DArgent D, Martin X, Mathevet P. Laparoscopic assessment of the sentinel lymph node in early stage cervical cancer. Gynecol Oncol. 2000;79(3):411-415. [ Links ]
29. Malur S, Krause N, Kohler C, Schneider A. Sentinel lymph node detection in patients with cervical cancer. Gynecol Oncol. 2001;80(2):254-257. [ Links ]
30. Briceño JM, Suarez CM, Medina F, Anzola F, Calderaro F, Di Giampietro L, et al. Mapeo linfático intraoperatorio e identificación del ganglio centinela en pacientes con carcinoma de cuello uterino. Reporte preliminar: Protocolo del Hospital Oncológico Padre Machado. Rev Venez Oncol. 2002;14(2):100-104. [ Links ]
31. Van Trappen P, Gyselman V, Lowe D, Ryan A, Oram D, Bosze P, et al. Molecular quantification and mapping of lymph-node micrometastasis in cervical cancer. Lancet. 2001;357(9249):15-20. [ Links ]
32. Hauspy J, Verkinderen L, De Pooter C, Dirix LY, van Dam PA. Sentinel node metastasis in the groin detected by technetium-labeled nannocolloid in a patient with cervical cancer. Gynecol Oncol. 2002;86(3):358-360. [ Links ]
33. van Dam PA, Hauspy J, Vanderheyden T, Sonnemans H, Spaepen A, Eggenstein G, et al. Intraoperative sentinel node identification with Technetium-99m-labeled nanocolloid in patients with cancer of the uterine cervix: A feasibility study. Int J Gynecol Cancer. 2003;13(2):182-186. [ Links ]
34. Medl M, Peters-Engl C, Schutz P, Vesely M, Sevelda P. First report of lymphatic mapping with isosulfan blue dye and sentinel node biopsy in cervical cancer. Anticancer Res. 2000; 20(2B):1133-1134. [ Links ]
35. Lantzsch T, Wolters M, Grimm J, Mende T, Buchmann J, Sliutz G, Koebl H. Sentinel node procedure in Ib cervical cancer: A preliminary series. Br J Cancer. 2001;85(6):791-794. [ Links ]
36. Barranger E, Grahek D, Cortez A, Uzan S, Darai E. Laparoscopic sentinel lymph node procedure in patients with cervical cancer (letter). J Clin Oncol. 2002;20(10):2602-2606. [ Links ]
37. Verheijen R, Buist M, Dijkstra J, Pijpers R, Van Lingen A, Kenemans P. Laparoscopic sentinel node detection in patients with cervical cancer (abstract). Int J Gynecol Cancer. 2002. [ Links ]













