Revista Científica
versión impresa ISSN 0798-2259
Rev. Cient. (Maracaibo) v.16 n.3 Maracaibo mayo 2006
Valores Hematológicos de la Tortuga Verde (Chelonia mydas) presente en la Alta Guajira
Alfredo José Montilla Fuenmayor 1, Jim Lenrry Hernández Rangel 1 y Mary Cruz Alvarado Árraga2
1Laboratorio de Investigaciones Piscícolas, Facultad Experimental de Ciencias. Teléfono: 0261 7597762. Fax: 0261 7598109. E-mail: alfredojmf@cantv.net
2Laboratorio de Diagnóstico Clínico, Policlínica Veterinaria, Facultad de Ciencias Veterinarias. Universidad del Zulia. Maracaibo, Venezuela.
RESUMEN
La tortuga verde (Chelonia mydas) es probablemente la tortuga marina más conocida debido a su histórico valor alimenticio y la cantidad de investigaciones que han sido conducidas para su conservación, esta tortuga está declarada nacional e internacionalmente como Especie en Peligro de Extinción. Con la finalidad de obtener valores hematológicos de referencia de Ch. mydas, fueron capturadas un total de treinta tortugas colocando redes en la línea de costa del Golfo de Venezuela, alta Guajira. Se obtuvo sangre de los animales realizando punción de los senos cervicales dorsales; en las muestras extraídas se determinaron los parámetros: Recuento de Glóbulos Rojos (RGR), Recuento de Glóbulos Blancos (RGB), Hematocrito (Hcto), Volumen Globular Medio (VGM) y Recuento Diferencial de Leucocitos. Fueron medidos el largo curvo del caparazón (LCC) y ancho curvo de caparazón (ACC) con el fin de estimar el grupo etáreo de los animales. Los valores promedios de los parámetros hematológicos fueron RGR (0,42 × 106µL), RGB (6,16 × 103µL), Hcto (29,40%), VGM (730,17 fL). El recuento diferencial de leucocitos fue: Heterófilos (82,9%-5,1023 × 103/µL), Linfocitos (14,7%-0,9081 × 103/µL), Eosinófilos (0,47%-0,0236 × 103/µL), Monocitos (1,97%-0,1259 × 103/µL). Estos resultados coinciden con los intervalos de referencia documentados para la especie. La variabilidad en algunos de los parámetros evaluados podría ser atribuida a factores como edad, sexo, estado reproductivo, estrés, temperatura, técnicas de captura y métodos de análisis.
Palabras clave: Chelonia mydas, valores hematológicos, alta Guajira.
Hematological Values of the Green Turtle (Chelonia mydas) Present in the High Guajira
ABSTRACT
The green turtle (Chelonia mydas) is probably the more well-known sea turtle due to its historical food value and significant amount of research that has been for its conservation,is declared national and internationally as an endangered species of Extinction. In order to determine reference hematological values for Ch. mydas a total of thirty turtles were captured placing nets in the line of coast from Gulf of Venezuela, high Guajira. Blood samples were taken from the dorsal cervical sinuses in all the animals. Red Blood Cell (RBC), White Blood Cell (WBC), Packed Cell Volume (PCV), Mean Corpuscular Volume (MCV), differential count of leukocytes were measured. The curved carapace length (CCL) and curved carapace width (CCW) were measured in order to estimate the turtles´age. The values averages of the hematological parameters were RBC (0.42 × 106µL), WBC (6.16 × 103µL), PCV (29.40%), MCV (730.17 fL), Heterophils (82.9%-5.1023 × 103/µL), Lymphocytes (14.7%-0.9081 × 103/µL), Eosinophils (0.47%-0.0236 × 103/µL), Monocytes (1.97%-0.1259 × 103/µL). These results coincide with the reference intervals documented for the species. The variability in some of the parameters evaluated could be attributed to factors as age, sex, reproductive state, stress, temperature, capture technique and analysis methods.
Key words: Chelonia mydas, hematological values, high Guajira.
Recibido: 12 / 07 / 2005. Aceptado: 20 / 02 / 2006.
INTRODUCCIÓN
Las tortugas marinas constituyen uno de los grupos de reptiles actuales más primitivos, surgiendo a finales del Triásico hace más de 200 millones de años. No obstante, en el último siglo, debido a múltiples factores antrópicos, sus poblaciones se han visto reducidas drásticamente [8].
En Venezuela se encuentran cinco de las 8 especies presentes a nivel mundial: la tortuga carey (Eretmochelys imbricata), la tortuga verde o blanca (Chelonia mydas), la tortuga cabezona o caguama (Caretta caretta), la tortuga guaraguá o maní (Lepidochelys olivacea) y la tortuga cardón (Dermochelys coriacea). A excepción de la especie Lepidochelys olivacea, todas anidan en las costas venezolanas, cuya extensión es de más de 2.000 km de longitud, comprendida desde la Península de la Guajira (estado Zulia) hasta Punta Barima (estado Sucre), incluyendo el sector insular hasta Isla de Aves, ofreciendo así diversos hábitats importantes para el desarrollo, alimentación, reproducción y migración [6, 12].
Internacionalmente la Unión Mundial para la Naturaleza (UICN) al igual que el Libro Rojo de la Fauna Venezolana, cataloga a la tortuga verde o blanca (Chelonia mydas) como Especie en Peligro de Extinción [13, 18].
Recientemente se ha dado importancia a la realización de estudios a campo que permitan recolectar información sobre el estado de salud de poblaciones silvestres con énfasis en aquellas especies en peligro de extinción.
La evaluación hematológica es un método sencillo a través del cual se pueden obtener excelentes indicadores de muchos aspectos del estado de salud de un individuo y su estado reproductivo [7, 10].
El campo de la hematología de reptiles es hasta cierto punto nuevo y poco conocido, este ha evolucionado ganando habilidad y experiencia con más y nuevas técnicas [7, 20].
La descripción de las características morfológicas de células sanguíneas en quelonios marinos es limitada. La clasificación de las células sanguíneas, específicamente los leucocitos de reptiles ha sido inconsistente, debido a los variables criterios y técnicas utilizadas para categorizarlas [21].
Muchos factores, como la edad, sexo, estación, estrés, dieta, circulación hormonal, temperatura, presión del oxígeno e hidratación corporal, afectan los valores en la sangre [2, 5].
La escasa información publicada sobre valores hematológicos de tortugas marinas ha sido reportada por Frair, 1977a, 1977b (Florida); Wood y Ebanks, 1984 (Caribe); Grumbles y col., 1990 (México); Norton y col., 1990 (Florida) (citados por Aguirre y col., [2]); Bolten y Bjorndal [3] (Bahamas); Work y col. [21] (Hawaii).
En Venezuela no existen registros de trabajos publicados o investigaciones relacionadas sobre hematología en tortugas marinas. Siendo el Golfo de Venezuela un área importante de alimentación para poblaciones foráneas de las especies Chelonia mydas, Eretmochelys imbricata, Caretta caretta, Dermochelys coriacea y con menor frecuencia Lepidochelys olivacea [12, 17] se planteó como objetivo de este estudio, determinar los valores hematológicos de la tortuga verde (Chelonia mydas) en la alta Guajira.
Los valores obtenidos servirán de referencia para evaluar el estado de salud de otras poblaciones de tortugas de la misma especie presentes en Venezuela, así como para establecer comparaciones con los valores reportados por otros investigadores.
MATERIALES Y MÉTODOS
Área de estudio
La Guajira venezolana se encuentra ubicada en la región más septentrional del estado Zulia y está adjudicada al municipio Páez; posee una superficie aproximada de 2.632 km2, con una línea costera de 153 km2 hacia el Golfo de Venezuela (FIG. 1). El Golfo se encuentra ubicado en el norte del Sistema Lago de Maracaibo entre los municipios Páez y Almirante Padilla de la costa Occidental; municipio Miranda de la costa Oriental y el estado Falcón [17].
FIGURA 1. UBICACIÓN DE LA ALTA GUAJIRA/ GEOGRAPHIC UBICATION OF HIGH GUAJIRA
Muestreo
Se realizaron 12 salidas de campo comprendidas entre los meses de abril y agosto de 2004. La captura de las tortugas se realizó en la línea de costa de la Península de la Guajira comprendida desde la población de Neima hasta Castilletes. Se realizaron recorridos entre uno y dos kilómetros paralelos a la costa, en una embarcación de madera provista con un motor fuera de borda de 40 HP. Se realizó una captura pasiva colocando redes fijas de 60 metros de longitud, evitando su contacto con el lecho marino, a una profundidad que dependió del área de captura en el mar. La abertura, entre nudos, de las redes fue de 30 cm2 y 50 cm2. Las tortugas permanecieron de 6 a 12 horas en la red durante la noche hasta el momento de la toma de muestra sanguínea en horas de la mañana, momento en la cual eran revisadas las redes.
Morfometría
Se registraron los datos morfométricos, Largo Curvo del Caparazón (LCC) y Ancho Curvo del Caparazón (ACC) de 30 tortugas, utilizando una cinta métrica flexible.
Extracción de muestras sanguíneas
Para la extracción de sangre en las 30 tortugas verdes (Chelonia mydas) se empleó la técnica de punción de los senos cervicales dorsales [10]. Se introdujo en ángulo perpendicular al cuello, una aguja calibre 21 por 1,5 pulgadas, conectada a un sistema BD VacutainerMR de toma múltiple [1, 2]. Los tubos Vacutainer esterilizados estaban provistos de heparina con litio. Después de la extracción de sangre se presionó la zona tratada evitando la formación de hematomas [1, 2, 9] y al cabo de unos minutos, la tortuga era liberada.
Debido a las condiciones de trabajo de la zona de estudio, las muestras sanguíneas se mantuvieron refrigeradas en una cava con hielo entre 3 a 5 horas, tiempo transcurrido entre la toma de muestra y el procesamiento de la misma.
El Recuento de Glóbulos Rojos (RGR) y Recuento de Glóbulos Blancos (RGB) se realizó utilizando la solución Natt & Herricks [4]. Adicionalmente se determinó el volumen globular medio (VGM). Su determinación se hizo mediante un cálculo matemático que relaciona el valor del hematocrito y el número de hematíes.
El recuento leucocitario se obtuvo contando la cantidad total de leucocitos presentes en los 9 milímetros cúbicos del hemocitómetro. La cantidad de leucocitos totales fue determinada usando la siguiente fórmula:
Total GB contados + 10% de los GB x 200 = GB por microlitro [4].
Posteriormente se determinó el valor del volumen globular por la técnica del microhematocrito, utilizando una plantilla de porcentajes provista por la microcentrífuga Autocrit Vitra 3, Clay Adams modelo Nº 0575, EUA.
Para el recuento diferencial de leucocitos o leucograma se realizaron dos frotis por cada muestra obtenida y se tiñeron con colorante Dip Quick Stain, con los valores obtenidos se calcularon los valores absolutos.
Para el análisis estadístico se utilizó el paquete comercial Microsoft Office Excel 2003, realizando una estadística descriptiva. Los datos fueron expresados como una media, desviación estándar, valor mínimo y máximo de cada variable hematológica.
RESULTADOS Y DISCUSIÓN
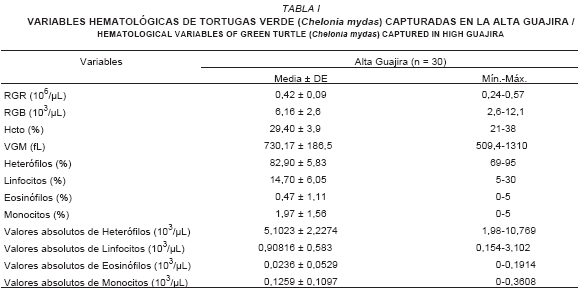
Los parámetros hematológicos de las 30 tortugas objeto de este estudio están resumidos en la TABLA I.
Sólo uno de los 30 ejemplares estudiados mostró fibropapilomas en poca cantidad; sus valores hematológicos se encontraron dentro de los valores presentados en las restantes 29 tortugas verdes, por lo cual se incluyó para el análisis. Posiblemente la muestra de este ejemplar no presentó diferencias en las otras variables, debido a que presentaba una lesión incipiente.
Los resultados obtenidos en la presente investigación fueron comparados con investigaciones anteriores [2], realizadas en la Bahía Kaneohe, isla de Oahu, Hawai con 5 tortugas verdes juveniles saludables a las cuales se les colectó sangre a cero (0) horas de captura, una (1) hora, tres y cuatro(3-4) horas y veinticuatro (24) horas postcaptura.
El valor de RGR para el presente estudio fue de 0,42 × 106/µL ± 0,09 (TABLA I), al realizar una comparación con valores reportados en el estudio antes mencionado [2], se observó que el valor que más se aproxima es 0,40 × 106/µL ± 0,12 (0,28 × 106/µL-0,59 × 106/µL), correspondiente a la muestra colectada de 3 a 4 horas postcaptura; con esto se puede inferir que las tortugas eran mayormente capturadas en horas no muy lejanas al momento de la toma sanguínea, partiendo de que las variables hematológicas varían según las horas que permanecen los ejemplares atrapados en la red bajo estrés.
El RGB promedio en el presente estudio, fue de 6,16 × 103/µL ± 2,63 (2,6 × 103/µL-12,1 × 103/µL). Estos resultados difieren de los reportados por otros investigadores [2, 21]. En este estudio se observaron valores menores a los señalados para muestras sanguíneas tomadas a 0 horas de captura, (9,34 × 103/µL ± 4,44), pero valores muy cercanos, para muestras sanguíneas tomadas a 24 horas postcaptura (7,08 × 103/µL ± 1,58) lo cual puede indicar, que los ejemplares capturados mantienen un estrés considerable durante el tiempo que permanecen en la red.
La media de hematocrito (TABLA I), fue de 29,4% ± 3,9 (21%-38%), estos resultados fueron muy cercanos a los reportados en investigaciones anteriores [21], con valores de hematocrito de 29% ± 4 (17%-35%) de 26 tortugas verdes de Puako y la Bahía de Kaneohe (Hawaii), también con otros estudios realizados en la Bahía Kaneohe, Hawaii [2] con valores de 29,5% ± 4,5 (24%-40%).
Estudios hematológicos llevados a cabo en grupos de tortugas con fibropapilomas [2], reportaron valores muy bajos de hematocrito 20,2% ± 6,0 (6%-27%), en el presente estudio el único ejemplar con fibropapilomas presentó valores hematológicos dentro de los intervalos normales.
El índice eritrocitario, Volumen Globular Medio (VGM) fue determinado obteniéndose 730,17 ± 186,5 (509,4-1310,3) fentolitros. El valor encontrado concuerda con lo citado por Aguirre y col. [2].
En el conteo diferencial de leucocitos se observaron heterófilos, linfocitos, eosinófilos y monocitos. Los basófilos no fueron observados en las muestras estudiadas, esto podría deberse al escaso número en circulación de este tipo celular en animales normales [21]. Los valores relativos de leucocitos se obtuvieron por identificación de 100 células en el frotis expresándose en porcentaje. También fueron calculados los valores absolutos expresados en la TABLA I.
Trabajos realizados, tanto con tortugas sanas como con fibropapilomas, encontraron diferencias en los valores absolutos y relativos de heterófilos, basófilos, neutrófilos y linfocitos entre las tortugas saludables y aquellas con fibropapilomas [2]. La linfopenia severa y neutrofilia observada en tortugas con fibropapilomas sugieren una supresión o inhibición del sistema inmune en estos animales [2]. En este estudio el único individuo con fibropapilomas presentó un recuento diferencial de leucocitos entre los valores normales.
Durante la realización del recuento diferencial de leucocitos, se observaron varios ejemplares con eritrocitos redondos y policromáticos, éstos son llamados eritrocitos inmaduros, la presencia de estas células en bajas cantidades (menos de 10 eritrocitos policromatofílicos por campo) se considera normal [4]. Cuando un animal anémico presenta un alto porcentaje de este tipo de células se puede inferir que la tortuga padece de anemia responsiva o regenerativa, sin embargo para confirmar este tipo de anemia es necesario calcular el índice de reticulocitos. Las causas más frecuentes de este tipo de anemia son hemorragias o infección por ectoparásitos. La anemia no regenerativa se presenta con menor frecuencia y puede deberse a malnutrición o efecto represivo en la médula ósea por enfermedades crónicas [19]. En este estudio el número de eritrocitos policromatofílicos por campo fue bajo (menor de 10) y el hematocrito se encontró dentro de los valores normales.
El porcentaje de heterófilos comprendió el 82,9 % (5,1023 × 103/µL) del conteo diferencial de los leucocitos. Se observaron como células redondas u ovaladas con un borde citoplasmático liso y un núcleo ubicado excéntricamente en la mayoría de las células, de forma lenticular, ovalado y raramente bilobulado, con cromatina teñida desde un rojo azulado a púrpura. Los gránulos citoplasmáticos se observaron de forma variable pero mayormente de forma bacilar, de color naranja a morado claro (FIG. 2).
Los linfocitos representaron un 14,7% (0,9081 × 103/µL) del conteo diferencial de leucocitos, se observaron redondos, ovalados y en muchas ocasiones de forma irregular, moldeándose a la forma de las células cercanas, cromatina finamente distribuida de coloración violeta pálido y ocasionalmente fuerte. El citoplasma generalmente escaso se observó de color azul claro a violeta (FIG. 3). En muy pocos linfocitos se observaron gránulos azurófilos muy finos en el citoplasma de la célula.
Los eosinófilos comprendieron el 0,47% (0,0236 × 103/µL) del conteo diferencial de leucocitos y se observaron como células redondas u ocasionalmente ovaladas, con borde citoplasmático liso, con gránulos redondos grandes y escasos de coloración rojiza a violeta. El núcleo presentó forma lenticular u oval de color púrpura y ubicación excéntrica (FIG. 4). En Hawaii, diversos autores reportan eosinófilos y basófilos, tanto en tortugas juveniles saludables como enfermas con fibropapilomas [2]. Otros reportaron eosinofília relacionada con infecciones parasitarias [21]. En este estudio los valores absolutos y relativos de eosinófilos se encontraron dentro de los valores normales citados en la literatura [2, 21].
Los monocitos representaron el 1,97% (0,1259 × 103/µL) del conteo diferencial de leucocitos. Las células fueron observadas redondas con bordes celulares externos lisos, presentaron abundante citoplasma teñido de azul a violeta. Se observó un núcleo generalmente excéntrico de forma oval con una concavidad en el centro de coloración púrpura clara y cromatina finamente distribuida (FIG. 5). Las monocitosis sugieren un proceso infeccioso crónico o de estimulación inmunogénica [2]. En este estudio los valores absolutos y relativos de monocitos se encontraron dentro de los valores normales citados en la literatura [21].
Los resultados en el conteo diferencial muestran algunas diferencias en la literatura, debido en parte a que no existe un criterio definido que describa con exactitud los diferentes tipos de leucocitos.
Investigaciones realizadas por varios autores, describen en frotis de tortugas verde la presencia de eritrocitos, eosinófilos, basófilos, azurófilos, neutrófilos, linfocitos, monocitos y trombocitos utilizando microscopio de luz (citados por Work y col. [21]). Aguirre y col. [2], empleando la misma metodología clasifica a los leucocitos como: heterófilos, neutrófilos, linfocitos, eosinófilos y basófilos. La discrepancia en la clasificación de leucocitos, se debe a que en estos estudios no se ha realizado la diferenciación de las células mediante caracterización citoquímica y/o estudio ultraestructural con el uso de microscopía electrónica, que corroboren sus resultados. Estas investigaciones describen como leucocitos: linfocitos, monocitos, heterófilos, eosinófilos y basófilos [21]. En mamíferos son comúnmente observados neutrófilos. Algunos autores describen la presencia de neutrófilos en reptiles, mientras que otros los reportan como heterófilos, los cuales funcionalmente corresponden a los neutrófilos de mamíferos [2, 19, 21].
La literatura denomina heterófilos a los polimorfonucleares que con mayor frecuencia se presentan en la sangre de reptiles y aves [4, 15, 21] y bajo esta denominación han sido descritos en esta investigación.
En el presente estudio se reportó heterofília y linfopenia como hallazgo común en las muestras evaluadas. Resultados similares fueron reportados en trabajos anteriores [2], en muestras sanguíneas de tortugas tomadas 24 horas postcaptura. La heterofília en reptiles generalmente está asociada a procesos inflamatorios, enfermedades bacterianas, parasitarias, micóticas y también puede presentarse en casos de neoplasias y leucemias mieloides. Ante la aparición de enfermedades infecciosas, la heterofília puede estar acompañada de cambios en la morfología celular con la observación de heterófilos tóxicos [15]. En este estudio se presentó heterofília sin cambios en la morfología celular de los heterófilos. Algunos autores reportan heterofília madura en animales saludables asociada a estrés y cambios estacionales [15]. Leucograma de estrés ha sido reportado en otras especies, debido en gran parte al manejo realizado durante el proceso de captura [5, 21].
Las variaciones obtenidas en este estudio pueden deberse al método de captura empleado. Generalmente otros investigadores emplean la técnica de captura manual por medio de buceo con apnea o equipo con tanques lo cual permite causar menos estrés a los animales y obtener ejemplares menos estresados.
El método de captura con redes provoca estrés en las tortugas debido a que los ejemplares generalmente quedan atrapados en la noche y permanecen de 6 a 12 horas hasta el momento de tomar la muestra sanguínea. También existen factores como las diferencias en tallas, sexo, temperatura, hidratación corporal entre otros, que igualmente aportan algunas variaciones en sus valores normales [5].
La influencia de las variaciones climáticas o ambientales sobre los valores hematológicos de reptiles es muy controversial [14]. La realización del presente estudio ocurrió durante la misma temporada del año y en un período corto de tiempo comprendido entre el mes de abril hasta agosto, por lo que se presume que estas variables no afectaron los resultados.
Para establecer si existían diferencias en los valores hematológicos de tortugas de distintos grupos clases por tamaños, primero se clasificaron los ejemplares según su talla. Luego se realizó una comparación y adaptación entre las diferentes clasificaciones de clases por tamaños propuestas por varios autores [1, 11, 16] en diferentes áreas geográficas (Mar Caribe Colombiano, Hawaii y Golfo de Venezuela) resultando las clases propuestas en la TABLA II.
Al aplicar estas clasificaciones a la población en estudio, se obtuvieron 2 ejemplares juveniles (6%) (Clase II), 16 subadultos (53 %) (Clase III) y 12 adultos (40%) (Clase IV). Se realizó la comparación de los parámetros hematológicos entre la clase III y IV. Una vez obtenida la clasificación de la población, se aplicó un Análisis de Componentes Principales (PCA, por sus siglas en inglés) a las variables hematológicas, el cual no arrojó diferencia alguna.
Los resultados obtenidos, presentados en la tabla III, con estadística descriptiva, no mostraron variabilidad entre las clases de tamaños y los parámetros hematológicos, a excepción del VGM que presentó un leve incremento para la clase III. Probablemente estas dos clases de tamaños no sean determinantes para obtener diferencias. Algunos autores [3], reportan correlación significativa del tamaño del cuerpo para 13 de 26 analitos bioquímicos de la sangre medidos en una población silvestre de tortuga verde (Chelonia mydas) en el sur de las Bahamas.
Uno de los factores por los cuales no se obtuvieron diferencias en los resultados, podría estar relacionado con la talla mínima de madurez sexual. Se conoce por medio de estudios de anidación, que las tortugas hembras del Atlántico que anidan por primera vez son más grandes que las del Pacífico [11, 12]. La Longitud Estándar del Caparazón (LEC) de tortugas de Isla Galápagos (Océano Pacífico) sexualmente maduras fue de 81,4 cm, mientras que para el Atlántico, en Tortugueros (Costa Rica) se registran promedios de 100,3 cm y en Isla de Aves (Venezuela) de 107,7 cm, razón por la cual es probable que algunas de las tortugas ubicadas en la Clase IV (adultos) no hayan alcanzado la madurez sexual y por ello presenten valores similares a los registrados en la Clase III (subadultos).
Algunos autores coinciden en señalar que no existen diferencias significativas en los valores hematológicos entre hembras y machos en algunas especies de reptiles [14]. En el presente estudio no fue posible la determinación del sexo debido a que se obtuvieron sólo 4 tortugas lo suficientemente grandes para ser identificados como ejemplares machos debido a la diferenciación del tamaño de la cola y desarrollo de las uñas anteriores.
CONCLUSIONES
En líneas generales, las tortugas verdes capturadas en el Golfo de Venezuela se presentaron clínicamente saludables, sólo una tortuga presentó leves fibropapilomas en las extremidades anteriores y cuello.
Los resultados de los parámetros hematológicos de RGR 0,42 × 106/µL, RGB 6,16 × 103/µL, Hcto 29,40% y VGM 730,17 fL, han sido señaladas por otros autores como valores comunes para tortugas que reflejan cierto grado de estrés.
Cuatro tipos de leucocitos fueron observados mediante el conteo diferencial en frotis: Heterófilos con 82,9% (5,1023 × 103/µL), Linfocitos con 14,7% (0,9081 × 103/µL), Eosinófilos con 0,47% (0,0236 × 103/µL) y Monocitos con 1,97% (0,1259 × 103/µL).
Los valores hematológicos para las clases de tamaños III y IV no presentaron diferencias entre ellos.
AGRADECIMIENTO
Los autores desean expresar su agradecimiento a la División de Investigación de la Facultad Experimental de Ciencias por el financiamiento parcial del proyecto FDI Nº 13-2004. Igualmente a los propietarios de la Clínica Veterinaria Servedinca, ubicada en la ciudad de Guanare, estado Portuguesa.
REFERENCIAS BIBLIOGRÁFICAS
1. Aguirre, A.A.; Balazs, G.H. Blood Biochemistry Values of Green Turtles, Chelonia mydas, with and without Fibropapillomatosis. Comp Haematol Inter 10: 132-137. 2000. [ Links ]
2. Aguirre, A.A.; Balazs, G.H.; SPEAKER, T.R.; GROSS, T.S. Adrenal and hematological responses to stress in juvenile green turtles (Chelonia mydas) with and without fibropapilomas. Physiol Zool 68: 831-854. 1995. [ Links ]
3. Bolten, A.; Bjorndal, K. Blood profiles for a wild population of green turtles (Chelonia mydas) in the southern Bahamas: size-specific and sex-specific relationships. J Wild Dis. 28(3): 407-413. 1992. [ Links ]
4. Campbell, T. Avian Hematology .Chapter 1. In : Campbell T. Avian Hematology and Citology:. 2nd Ed. Iowa State Press. 3-156 pp. 1995. [ Links ]
5. Dessauer, H. Blood Chemistry of Reptiles: Physiological and evolutionary aspects. GANS (Ed). Biology of the Reptilia, Vol. 3 Morphology, Academic. Press, New Cork. 1-72 pp. 1970. [ Links ]
6. Guada, H.; Solé, G. Plan de Acción para la Recuperación de las Tortugas Marinas de Venezuela.WIDECAS (Red para la conservación de las Tortugas Marinas en el grazn Caribe) Informe técnico del P.A.C Nº 39 (Programa ambiental del Caribe). 112 pp. 2000. [ Links ]
7. Lowell A. The biology, husbandry and health care of reptiles. Vol III. T.F.H. Publications, INC. United States of America. Chapter: Diagnostics procedures: hematology 703-713 pp. 1998. [ Links ]
8. Lutz, P.L.; Musick, J. A. The Biology of Sea Turtles. CRC Press, Inc. Boca Raton, Florida. 6-19 pp. 1997. [ Links ]
9. Morán, L. Obtención de muestras sanguíneas de calidad analítica. Editorial Panamericana. México. 161 pp. 2001. [ Links ]
10. Owens, D.; Ruiz, G. New methods of obtaining blood and cerebrospinal fluid from marine turtles. Herpetol. 36: 17-20. 1980. [ Links ]
11. Parra, L. Diagnóstico de la situación actual de las poblaciones de tortugas marinas en la Costa Occidental del Golfo de Venezuela, Estado Zulia. La Universidad del Zulia. Licenciatura en Biología. (Tesis de Grado) 154 pp. 2002. [ Links ]
12. Pritchard, P.C.H.; Trebbau, P. The turtles of Venezuela. Society for the study of amphibians and reptiles. 403 pp. 1984. [ Links ]
13. Rodríguez, J.P.; Rojas-Suárez, F. Libro Rojo de la Fauna Venezolana. 2nd Ed. PROVITA (Fundación Polar) Caracas, Venezuela. 472 pp. 1999. [ Links ]
14. Rossini, M. Determinación de los parámetros hematológicos de la Baba (Caiman crocodylus) en hábitat silvestre. Universidad Central de Venezuela. Cátedra de Patología (Trabajo de ascenso). 73 pp. 2002. [ Links ]
15. Rosskopf, W. Disorders of Reptilian Leukocytes and Erithrocytes. Chapter 22. In : Funge A. Laboratory Medicine. Avian and Exotic Pets. W.B. Saunders Company. 198-204 pp. 2000. [ Links ]
16. Rueda, J.; Ulloa, G.; Medrano, S. Estudio sobre la Biología Reproductiva, la Ecología y el Manejo de la Tortuga Canal (Dermochelys coriacea) en el Golfo de Urabá. Contribución al conocimiento de las tortugas marinas de Colombia. Biblioteca Andrés Posada Arango. Serie de Publicaciones Especiales del INDERENA. Colombia. 1-131 pp. 1992. [ Links ]
17. Sideregts, L.; Guerrero, M.; Acuña, A.; Molero, H.; Pirela, D.; González, L; Rincón, J. Informe Preliminar sobre la Situación Actual de las Tortugas Marinas en el Golfo de Venezuela, Estado Zulia. Museo de Biología. Departamento de Biología. Universidad del Zulia. 14 pp. 1987. [ Links ]
18. UNIÓN MUNDIAL PARA LA NATURALEZA (UICM). Estrategia Mundial para la Conservación de las Tortugas Marinas. Comisión de Sobrevivencia de Espacies/Grupo de Especialistas en Tortugas Marinas (Español). Arlington, Virginia. 24 pp. 1995. [ Links ]
19. Watson, J. Diagnostic Procedure: Hematology. In : The biology, husbandry and health care of reptiles. Vol. III, L.Asckerman (Ed.). 703-713 pp. 1999. [ Links ]
20. Wilmoth, K.A. Laboratory manual of reptilian hematology. 2nd Ed. Houston Zoological Gardens. USA. 14 pp. 1994. [ Links ]
21. Work, T.; Raskin, R.; Balazs, G.; Whittaker, S. Morphologic and cytochemical characteristics of blood cells from Hawaiian green turtles. AJVR. 59 (10): 1252-1257. 1998. [ Links ]












 uBio
uBio