Revista Científica
versión impresa ISSN 0798-2259
Rev. Cient. (Maracaibo) v.16 n.3 Maracaibo mayo 2006
Obtención y Caracterización de dos Concentrados Proteicos a partir de Biomasa de Kluyveromyces marxianus var. marxianus cultivada en suero lácteo Desproteinizado
Marta Elena Cori de Mendoza1, Nilo Rivas2, Blas Dorta3, Emperatriz Pacheco de Delahaye4 y Antonio Bertsch5
1,2,4,5Instituto de Química y Tecnología, Facultad de Agronomía, Universidad Central de Venezuela, Apdo. 4579. Maracay, 2101, Venezuela. E-mail: martacori@cantv.net . Telf: (0243)-2465360,5507304.
3Instituto de Biología Experimental, Facultad de Ciencias, UCV.
RESUMEN
El presente trabajo se realizó con el propósito de obtener un concentrado proteico con un bajo contenido de ácidos nucleicos a partir de biomasa microbiana. Para ello se cultivó la levadura Kluyveromyces marxianus var. marxianus en lactosuero desproteinizado y suplementado con fuentes de nitrógeno y vitaminas a pH 4,5; 32 a 35°C y una tasa de aireación de 1,22 volúmenes de aire por volumen de medio por minuto (VVM). Se obtuvo un rendimiento promedio de: biomasa de 0,30 g/g lactosa, un consumo de lactosa del 93, 21% y concentración celular 4,15 g/L al final de la fermentación. A partir de la biomasa obtenida se elaboraron dos concentrados proteicos: uno por extracción alcalina y precipitación isoeléctrica (C1) y otro por extracción alcalina, fosforilación y precipitación isoeléctrica (C2). El análisis de los concentrados mostró diferencias significativas (P < 0,05) en los contenidos de cenizas, grasa, proteína cruda, nitrógeno no proteico, ARN y carbohidratos. Se evidenció una disminución significativa (P < 0,05) del contenido de ARN de 4,59% (C1) a 2,71% (C2) hecho importante para el uso de este concentrado proteico para el consumo humano. La fosforilación de la proteína (C2) incrementó la capacidad de absorción de agua (4,21 a 4,64 g agua/g proteína), la solubilidad (32,43 a 41,74 g proteína solubilizada/g proteína total), y la capacidad emulsionante (903,38 a 971,91 g aceite/g proteína), y disminuyó la capacidad de absorción de grasa (1,79 a 1,65 g grasa/g proteína), características éstas que deben ser consideradas para la incorporación de los concentrados proteicos como ingredientes de productos cárnicos y de panadería.
Palabras clave: Lactosuero, Kluyveromyces marxianus, concentrado proteico, ARN.
Attainment and Characterization of Two Protein Concentrates from Biomass of Kluyveromyces marxianus var. marxianus Grown in Deproteinized Whey
ABSTRACT
This work was carried out with the purpose of attain a protein concentrate from microbial biomass with low content of nucleic acids. The yeast Kluyveromyces marxianus var. marxianus was grown on deproteinized and supplemented whey with nitrogen and vitamins sources at pH 4.5; 32 to 35°C and an aeration rate of 1.22 volumes of air fed for volume of broth per minute (VVM). The average biomass yield obtained was 0.30 g/g lactose, a lactose consumption of 93.21% and a cellular concentration of 4.15 g/L at the end of the fermentation. Two protein concentrates were obtained: the first one by alkaline extraction and isoelectric precipitation (C1) and the second one by alkaline extraction, phosphorylation and isoelectric precipitation (C2). Chemical analysis of both concentrates shown significant differences (P < 0.05) in the content of ash, fat, crude protein, non protein nitrogen, RNA and carbohydrates. There was significant (P < 0.05) the decrease in the RNA content from 4.59% (C1) to 2.71% (C2), important fact for the use of this protein concentrates for human consumption. Phosphorylation of the protein (C2) produced an increase in the water holding capacity (4.21 to 4.64 g water/g protein), solubility (32.43 to 41.74 g solubilized protein/g total protein) and emulsifying capacity (903.38 to 971.91 g oil/g protein), as well as a decrease in the oil absorption capacity (1.79 to 1.65 g oil/g protein). These characteristics are important when considering the use of such protein concentrates as ingredients in bakery or meat products.
Key words: Whey, Kluyveromyces marxianus, protein concentrate, RNA.
Recibido: 16 / 03 / 2005. Aceptado: 24 / 03 / 2006.
INTRODUCCIÓN
El lactosuero o suero lácteo puede ser definido como la porción acuosa de la leche que es separada de la cuajada durante la manufactura convencional del queso [14]. El proceso más antiguo para la utilización del suero es el calentamiento para recuperar la proteína del mismo como un concentrado proteico insoluble, dando como resultado un suero parcialmente desproteinizado. La proteína láctea obtenida tiene muy variadas aplicaciones, entre las cuales se citan la fabricación de sopas, condimentos para ensaladas, pasta enriquecida con proteína, helados, productos especiales dietéticos y productos cárnicos. Además de este método tradicional se puede obtener lactosuero desproteinizado a partir de leche y empleando el sistema de ultrafiltración, obteniendo así un suero lácteo que se conoce con el nombre del permeado [16]. Los sólidos totales del suero lácteo están formados principalmente por lactosa, la cual representa un 4,8%p/v, además de 0,9%p/v de proteína, 0,8%p/v de minerales y menos de 0,05%p/v de grasa [16]; es por esto que el problema de la utilización del lactosuero es en esencia el del uso de la lactosa, lo cual es también cierto para el suero desproteinizado [6]. En el caso de Venezuela, se ha estimado la producción de suero para el año 2004 en 713.258 toneladas [12].
Con el fin de satisfacer la escasez en la producción de proteínas para alimentación humana y animal en los países en desarrollo, se han establecido en las últimas décadas varios procesos para la producción de microorganismos o biomasa microbiana [9]. Se han estudiado numerosos sustratos para la producción de biomasa unicelular, siendo el suero lácteo uno de los que se ha considerado más importante debido a su bajo precio y su disponibilidad [13], aparte de que suele ser un contaminante importante en aguas de desecho, lo que causa serios problemas en el funcionamiento de las plantas de depuración [1]. Aunque algunas investigaciones al respecto han utilizado el suero entero, la importancia que han adquirido los concentrados proteicos ha hecho que la producción de biomasa se haya desarrollado hacia el uso de suero desproteinizado para incrementar el atractivo económico del proceso [13]. Es así que se ha propuesto su empleo como sustrato de fermentación para microorganismos capaces de asimilar la lactosa, tales como la levadura Kluyveromyces marxianus var. marxianus, con el propósito de obtener biomasa microbiana, también conocida como proteína unicelular [3, 5, 37]. Esta tiene un contenido proteico que oscila entre 40 y 80% en base seca y su calidad la asemeja más a la proteína animal que a la vegetal [1]. Sin embargo, el uso de proteína unicelular para consumo humano presenta importantes limitaciones: la presencia de las paredes celulares, pues éstas reducen la biodisponibilidad de las proteínas, además contienen factores antigénicos y alergénicos; el alto contenido de ácidos nucleicos (básicamente ARN) los cuales pueden ocasionar trastornos renales y gota, y por último las reducidas propiedades funcionales que exhibe la biomasa celular deshidratada [32]. Estas limitaciones pueden superarse mediante la elaboración de concentrados proteicos, tal y como ha sido descrito para Candida tropicalis [7] y para Kluyveromyces marxianus var. marxianus [35] utilizando la extracción alcalina y precipitación isoeléctrica; sin embargo, esto no es suficiente, dado que los niveles de ácidos nucleicos deben ser reducidos, bien sea por métodos químicos o métodos enzimáticos. Entre los métodos químicos, uno de los más aceptados es la fosforilación con oxicloruro de fósforo [15] o alternativamente con trimetafostato de sodio [30], donde se han obtenido concentrados proteicos a partir de Saccharomyces cerevisiae, los cuales han sido luego deshidratados a través de métodos sofisticados, como la liofilización o el secado por aspersión, respectivamente. La suplementación de productos cárnicos y de panadería con concentrados proteicos bajos en ácidos nucleicos, mejora las propiedades funcionales de dichos alimentos. Se ha ensayado la incorporación de harinas y autolizados obtenidos de Candida utilis y Saccharomyces cerevisiae en la elaboración de los mencionados productos con excelentes resultados [17, 18].
El objeto del presente estudio fue caracterizar la producción de biomasa de Kluyveromyces marxianus var. marxianus en suero lácteo desproteinizado, así como la elaboración de dos concentrados proteicos: uno por extracción alcalina y precipitación isoeléctrica, y otro con una fosforilación adicional con el fin de reducir el contenido de ácidos nucleicos, caracterizando los productos obtenidos en cuanto a su composición química y a algunas propiedades funcionales.
MATERIALES Y MÉTODOS
Microorganismo
Se utilizó un aislado de Kluyveromyces marxianus var. marxianus, ATCC 28244, el cual era mantenido, mediante subcultivo periódico, en agar lactosado [3] y almacenado a 5°C en el agar inclinado.
Medio de cultivo
El medio de cultivo se preparó mediante la suspensión de suero dulce en polvo (Compañía Láctea de Mayenne, BBA Lactalis, Francia) a razón de 60 g/L en agua destilada (con el fin de que las concentraciones de las diversas fracciones fueran las correspondientes a lactosuero en su estado líquido natural) y posterior desproteinización por precipitación siguiendo el método empleado por Zambrano [37]. Se ajustó el pH a 4,5 con ácido acético concentrado, seguido del tratamiento térmico (96°C/15 min). La preparación se mantuvo en reposo durante 18 h, a temperatura ambiente y se filtró a través de papel Whatman Nº 1. El filtrado se diluyó en agua destilada [3], para ajustar la concentración de lactosa al 1,5% p/v y se suplementó con sulfato de amonio y extracto de levadura a las concentraciones de 0,2 y 0,1% p/v, respectivamente. El pH se reajustó a 4,5 y luego se esterilizó en un autoclave (121°C/15 min) [37].
Análisis químico del medio de cultivo
Se siguió la metodología de Official Methods of Analysis A.O.A.C. International para las determinaciones de humedad [22], proteína cruda [27] y cenizas [24]. El contenido de lactosa se determinó mediante el método semi-micro de Somogyi [21] y el pH, con la ayuda de un analizador Radiometer Copenhagen, PHM62 (fabricado en Dinamarca).
Preparación del inóculo
El inóculo se preparó a través de dos ciclos sucesivos de crecimiento de la levadura a 35°C, utilizando el medio de cultivo descrito. En el primer ciclo la levadura se sembró con asa de platino en matraces erlenmeyer de 250 mL con volúmenes de trabajo de 40 mL y se incubaron durante 20 horas utilizando un agitador reciprocante. Alícuotas de 20 mL de estos cultivos (Inóculo 1) eran transferidas a matraces erlenmeyer de 1 litro con volúmenes de trabajo de 180 mL. Éstas a su vez eran incubadas a 35°C durante 20 horas, obteniéndose el inóculo requerido (Inóculo 2) para iniciar la fermentación.
Fermentación
Los cultivos se prepararon en matraces Erlenmeyer de 6 L, operados con volúmenes de trabajo de 3 L, en un agitador reciprocante a 140 oscilaciones por minuto, dentro de un cuarto climatizado a temperaturas entre 32 y 37°C. Los procesos se iniciaron con un volumen de inóculo equivalente al 10% del volumen de trabajo y con la adición de antiespumante Sigma A-5633 estéril a una concentración de 0,33 mL/L. Durante el proceso se burbujeaba aire estéril en forma contínua a razón de 1,22 volúmenes de aire por volumen de medio por minuto (VVM).
Determinación de biomasa y consumo de lactosa
Se tomaron alícuotas (10 mL) por duplicado del cultivo microbiano en crecimiento, las cuales se centrifugaron (12.000 g /10 min). Los sedimentos se lavaron 2 veces con agua destilada, posteriormente se secaron a 105°C hasta obtener peso constante. Los respectivos sobrenadantes fueron procesados mediante el método semi-micro de Somogyi [21] para la determinación del consumo de lactosa, mediante la diferencia entre la concentración inicial y la remanente.
Se determinó el valor de la velocidad máxima de crecimiento específico (µmax) al considerar la gráfica del logaritmo neperiano de la concentración celular con respecto al tiempo, y determinar la pendiente de la línea recta correspondiente a la fase exponencial [3].
Recuperación de la biomasa
Alcanzada la fase estacionaria de crecimiento, todo el caldo de cultivo fue centrifugado (12.000 g/15 min). El sedimento se lavó dos veces con agua destilada y deshidrató (55°C/18 h) en una estufa marca Memmert (fabricada en Alemania). El residuo seco se depositó en frascos cerrados herméticamente y se almacenó a 4°C.
Determinación del pH isoeléctrico
El pH isoeléctrico de la proteína de la levadura se determinó mediante el método utilizado por Cunningham y col. [7] con algunas modificaciones. Se elaboró una suspensión de biomasa seca en agua destilada al 5% (p/v), utilizando una licuadora Osterizer (modelo 438, Oster de Venezuela, S.A.), operada a la máxima velocidad durante 5 minutos. La suspensión fue dividida en dos lotes, uno de los cuales fue suplementado con trimetafosfato de sodio al 3% p/v. Cada lote fue distribuido en tubos de ensayo, a razón de 10 mL/tubo. Al contenido de cada tubo se le ajustó el pH a un valor determinado en el intervalo de 1 a 9 con HCl 0,1 N o con NaOH 0,1 N, según fuese el caso. Las preparaciones se agitaron durante 30 minutos a temperatura ambiente y el pH se ajustó nuevamente a los valores predeterminados. Posteriormente las muestras se centrifugaron (12.000 g × 10 minutos) y el líquido sobrenadante se recuperó, determinándose al mismo el contenido de proteína cruda [22] por triplicado.
Obtención de los concentrados proteicos
Se prepararon dos tipos de concentrados proteicos: C1) mediante extracción alcalina y subsiguiente precipitación isoeléctrica [7, 8, 35]; C2) por extracción alcalina, fosforilación con trimetafosfato de sodio y precipitación isoeléctrica [8, 30].
En la FIG. 1 se presenta el esquema seguido para la obtención de dichos concentrados.
Análisis químico de la biomasa y de los concentrados proteicos
Se siguió la metodología de Official Methods of Analysis A.O.A.C. International para las determinaciones de humedad [25], proteína cruda [26] y cenizas [23]; el nitrógeno no proteico se determinó según el método de Bynum y Barbano [2]; la proteína verdadera mediante la diferencia entre el nitrógeno total y el nitrógeno no proteico, multiplicada por el factor 6,25 [10]; la grasa por el método de Weibull-Soxhlet [31]; carbohidratos por diferencia [13] y los ácidos nucleicos según el método empleado por Otero y col. [28].
Determinación de las propiedades funcionales de los concentrados proteicos
Capacidad de absorción de agua. La suspensión acuosa del concentrado proteico seco (10% p/v), se agitó durante 30 seg en un agitador Vortex y luego 30 min en un agitador reciprocante a 25°C. La preparación se centrifugó (12.000g/20 min) descartándose el sobrenadante. La diferencia entre el peso húmedo del sedimento y el peso seco inicial proporcionó la cantidad de agua absorbida, expresándose los resultados como g agua/g proteína [29].
Capacidad de absorción de grasa. Se mezclaron 4 mL de aceite de maíz con 0,5 g del concentrado proteico seco en un tubo de centrífuga. La mezcla se dejó reposar durante 30 min a 25°C y seguidamente se centrifugó (12.000 g/25 min) descartándose el sobrenadante. La diferencia entre el peso del sedimento obtenido y el peso seco inicial proporcionó la cantidad de aceite retenido, expresándose los resultados como g aceite/g proteína. [28].
Capacidad de absorción de grasa. Se mezclaron 4 mL de aceite de maíz con 0,5 g del concentrado proteico seco en un tubo de centrífuga. La mezcla se dejó reposar durante 30 min a 25°C y seguidamente se centrifugó (12.000 g/25 min) descartándose el sobrenadante. La diferencia entre el peso del sedimento obtenido y el peso seco inicial proporcionó la cantidad de aceite retenido, expresándose los resultados como g aceite/g proteína. [28].
Capacidad emulsionante. Se mezclaron 2 mL de una solución acuosa de la proteína en estudio (30 mg/mL) y 98 mL de buffer fosfato 0,01 M empleando una licuadora de alta velocidad, equipada con dos electrodos para la medición de la conductividad eléctrica. El vaso con los ingredientes de la mezcla se pesó e inmediatamente se adicionó aceite de maíz (Mazeite®) a razón de 80 mL/min bajo agitación constante hasta que el valor de la conductividad se hizo cero (punto de inversión). El vaso con la preparación se pesó nuevamente y por diferencia se determinó la cantidad de aceite incorporado, expresándose la capacidad de emulsión como g aceite/g proteína [28].
Solubilidad a pH 7. A la suspensión acuosa del concentrado proteico al (10% p/v) se le ajustó el pH a 7 con NaOH 1 N y seguidamente se diluyó la preparación mediante la adición de agua hasta reducir la concentración proteica hasta 5% p/v. Se agitó en forma continua durante 30 minutos a 30°C y luego se centrifugó (12.000 g/10 min). Al sobrenadante le fue analizado el contenido de proteína cruda mediante la metodología descrita en Official Methods of Analysis A.O.A.C. International [27], expresándose como g proteína solubilizada/g proteína total [29].
Análisis estadístico
A los fines de llevar a cabo la investigación propuesta, una vez obtenida la biomasa necesaria se tomaron de la misma 3 porciones para elaborar el concentrado correspondiente al tratamiento 1 y 3 porciones para elaborar el concentrado correspondiente al tratamiento 2, obteniendo así 2 tratamientos con 3 repeticiones cada uno. A cada unidad experimental resultante se le realizó un análisis químico y la evaluación de algunas propiedades funcionales, por triplicado. Las propiedades funcionales le fueron evaluadas también a una muestra de un aislado proteico comercial de soya, con el objeto de establecer las comparaciones pertinentes con la metodología aplicada. Lo anteriormente expuesto se adapta a un diseño completamente aleatorizado con 3 repeticiones y 3 muestras dentro de la unidad experimental. Para comparar los 2 tratamientos se aplicó la prueba de Mann-Whitney (P < 0,05) ya que no se encontró normalidad en el comportamiento de los datos [33]. Para el estudio de las variables cuando se incluyó el aislado proteico comercial de soya, se aplicó la prueba de Kruskal-Wallis (P < 0,05) y las comparaciones múltiples no paramétricas [33], empleando para todo esto el paquete estadístico Statistix 3,0.
RESULTADOS Y DISCUSIÓN
Crecimiento de Kluyveromyces marxianus en lactosuero
El medio de cultivo preparado presentó un contenido de lactosa 1,57% p/v, proteína cruda de 0,11% p/v, cenizas de 0,35% p/v, y un pH 4,5. Estos valores coinciden con los reportados por otros autores [3, 5].
El crecimiento de Kluyveromyces marxianus en dicho medio estuvo caracterizado por una fase exponencial con una duración de 6 a 7 horas aproximadamente (FIG. 2). El valor de la velocidad máxima de crecimiento específico (µmax) fue de 0,42 h–1 (promedio de 5 procesos fermentativos independientes) lo que corresponde a un tiempo de generación de 1,65 h. La concentración de biomasa alcanzada al final del crecimiento osciló entre 3,67 y 4,65 g/L, consumiéndose casi la totalidad de la lactosa, con un valor promedio de 93,21%, correspondiente a 14,6 g/L. Estos datos permitieron calcular el rendimiento en biomasa referido a lactosa consumida, el cual osciló entre 0,28 y 0,33 g/g. Es importante destacar que los valores de los distintos parámetros de cultivo determinados en el presente estudio guardan cierta similitud con los reportados por otros autores a pesar de que en algunos casos las condiciones de operación fueron marcadamente diferentes. Así, Vananuvat y Kinsella [36], utilizando tanques agitados reportan valores de µmax en el rango de 0,35 h–1 y 0,44 h–1 para velocidades de agitación de 300 rpm y 700 rpm respectivamente; Castillo y Sánchez [3], empleando fiolas agitadas obtienen valores de µmax de 0,41 h–1 a 35°C, y Chinappi y Sánchez [5] hicieron determinaciones de µmax entre 0,34 y 0,62 h–1, al emplear diversos tipos de biorreactores operados a altas tasas de aireación y agitación.
Composición química de la biomasa y determinación del pH isoeléctrico de la proteína. El análisis de la composición química de la biomasa producida (deshidratada), expresada en términos porcentuales (p/p en base húmeda) proporcionó un contenido de humedad de 5,77; cenizas 8,62; grasa 9,25, proteína cruda 53,71; Nitrógeno no Proteico 1,52; proteína verdadera 44,19 y ARN 8,14. El contenido de proteína cruda coincidió con los valores reportados por otros autores, de 52 [3] y 54 [9], pero superó el valor de 49,5 [10]; mientras que el contenido de ARN, si bien es cercano a los de otros trabajos con esta misma levadura: 8,8 [3], 8,68 [35] y 9,46 [20], supera al valor de 4,9 reportado por Delaney y col. [10]. Se determinó la solubilidad de la proteína de la biomasa, con y sin la adición de la sal fosfatada durante el proceso de extracción. Las curvas de solubilidad para cada caso muestran la misma tendencia (FIG. 3); sin embargo, a valores extremos de pH se observó una mayor solubilidad en la proteína sin fosforilar. Si bien el pH isoeléctrico de la misma es alrededor de 4, lo cual coincide con los valores reportados por Damodaran y Kinsella [8] para K. marxianus, es evidente que bajo tratamiento con trimetafosfato de sodio, la mínima solubilidad de la proteína se obtiene a inferiores valores de pH (intervalo 1 a 3), en concordancia con lo observado por Pacheco y Sgarbieri [30]. No obstante, se debe tener presente que los valores de pH isoeléctrico de los ácidos nucleicos están incluidos en dicho intervalo [8].
El fenómeno relacionado con el desplazamiento del punto isoeléctrico pudiera atribuirse a que con la adición del trimetafosfato de sodio, tanto los cationes como los aniones de la sal reaccionan con los grupos ionizables de la proteína, evitando así que ésta se asocie por atracciones electrostáticas con otras moléculas de su misma especie. Es probable que el anión de la sal tenga mayor influencia que el catión, debido a que este último esté fuertemente hidratado, tal y como lo señalan Liu y Hung [19] trabajando con cloruro de sodio, por lo que aún en el pH que representa el punto isoeléctrico de la proteína no fosforilada, se tendría una carga neta diferente a cero (negativa) desplazándose ligeramente el punto isoeléctrico hacia un pH más ácido.
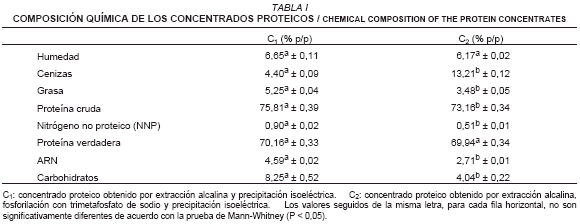
Preparación y caracterización de los concentrados proteicos. Para evitar la coprecipitación de ácidos nucleicos a bajos valores de pH [8] y debido a que no se observaron grandes diferencias en los valores de pH de mínima solubilidad de las proteínas, los concentrados proteicos para ambos tratamientos fueron preparados mediante precipitación a pH 4. La composición química de los mismos se muestra en la TABLA I.
Todos los parámetros, a excepción de la humedad y la proteína verdadera mostraron diferencias significativas entre los tratamientos estudiados (C1 y C2). El contenido de cenizas en C2 resultó estadísticamente mayor que en C1, como era de esperarse ya que parte de la sal utilizada en la fosforilación proteica durante la elaboración del concentrado C2 queda remanente formando parte del producto final. En cuanto al contenido de grasa, éste resultó significativamente mayor en C1 que en C2. Los valores obtenidos para ambos concentrados se aproximan a 3,47% y 4,1% (Shetty y Kinsella [32] y Otero y col. [28], respectivamente) en el caso de levadura cervecera. El tratamiento con trimetafosfato de sodio induce la disociación de los complejos de nucleoproteína, quedando los ácidos nucleicos en solución mientras las proteínas son precipitadas [8]. El contenido de ARN se redujo significativamente (P < 0,05) en C2 con respecto a C1, lo que explica la mayor proporción de NNP en C1, debido a que el nitrógeno correspondiente a los nucleótidos representa una parte importante del nitrógeno no proteico [29]. El contenido de proteína verdadera no difiere estadísticamente (P > 0,05) en los concentrados proteicos preparados (C1 y C2) y aunque la proporción de ARN de C1 no es tan alta como la referida por Pacheco y Sgarbieri [30], de 15,25%, es disminuida considerablemente a través de la fosforilación aplicada, con las consecuencias favorables que ello tiene, si dicho producto fuese destinado al consumo humano. Pacheco y Sgarbieri [30] obtuvieron un concentrado proteico fosforilado con Trimetafosfato de sodio a partir de levadura cervecera con un contenido de ARN del 3,7%; en otros estudios, elaborando concentrados proteicos fosforilados con oxicloruro de fósforo, el contenido de ARN en los mismos fue de 2,7% a partir de levadura de panadería [15] y 4% a partir de Saccharomyces carlbergensis [8]. Con base en lo anterior, se observa que los concentrados proteicos fosforilados obtenidos en este trabajo presentaron un contenido de ARN inferior a la mayoría de los datos reportados en otras investigaciones.
Propiedades funcionales
Estas propiedades les fueron evaluadas a los 2 concentrados (C1 y C2) obtenidos y comparados con los valores de un aislado proteico comercial de soya. Dicho aislado posee (según el informe del fabricante) la siguiente composición química: 92% de proteína cruda, 4% de humedad, 0,3% de fibra cruda, 0,1% de grasa cruda y 4,0% de minerales. Los resultados correspondientes a estas evaluaciones se aprecian en la TABLA II.
Los concentrados proteicos mostraron diferencias significativas (P < 0,05) para todas las propiedades funcionales. La capacidad de absorción de agua de C2 fue mayor a la de C1, y menor a la del aislado de soya. En estudios previos, empleando Saccharomyces cerevisiae se encontró esta misma tendencia al obtener (a pH 5, ambos) 3,71 g agua/g proteína para el concentrado sin fosforilar y 5,11 g agua/g proteína para el concentrado fosforilado [30].
Sung y col. [34] obtuvieron 7,1 g agua/g proteína para el aislado de soya sin fosforilación y 11,7 g agua/g proteína para el aislado de soya fosforilado. En otro estudio se señalan valores de 1,85 hasta 6,3 mL agua/g proteína para aislados proteicos de soya de varias marcas comerciales [11].
Para el aislado proteico a partir de Saccharomyces cerevisiae se reportan 4,24 g agua/g proteína [28].
El aumento en la capacidad de absorción de agua puede ser debido a la introducción de grupos fosfato a las cadenas polipeptídicas, lo que posiblemente causa cambios conformacionales y estructurales debido a un aumento en las fuerzas de repulsión [30]. Los valores obtenidos en este trabajo por los concentrados proteicos son bastante aproximados a los de otros trabajos donde se emplearon métodos de deshidratación como la liofilización u otros donde la proteína no se ve sometida a temperaturas que puedan modificar significativamente su estructura, y por lo tanto sus propiedades físicas y químicas, quedando así en evidencia que a través de un método de deshidratación convencional y poco costoso, propiedades como la capacidad de absorción de agua no se ven aparentemente afectadas.
Los resultados indican que la capacidad de absorción de grasa de C1 es significativamente mayor a la del C2, y ésta a su vez a la del aislado de soya. Los valores obtenidos para ambos concentrados son mayores que el reportado por Otero y col. [28] (0,92 g aceite/g proteína) para un aislado proteico de Saccharomyces cerevisiae. En otro estudio empleando aislados de soya, se señalan valores de 1,00 hasta 1,95 mL de aceite/g proteína para aislados de diferentes marcas comerciales [11].
Con el aumento de las cargas negativas, como consecuencia de la fosforilación, es probable que los grupos no polares del aceite incorporado establezcan menos interacciones con las cadenas proteicas, explicándose así la diferencia observada.
En relación a la capacidad emulsificante se observa que C2 es significativamente mayor a C1, pero a su vez es estadísticamente menor al aislado comercial de soya; esto significa que con la fosforilación aumentó la capacidad emulsificante de la proteína, pero no al nivel de la del aislado de soya.
En estudios conducidos por Otero y col. [28] los investigadores obtuvieron por precipitación isoeléctrica un concentrado proteico de levadura cervecera cuya capacidad emulsificante fue de 144 g aceite/g proteína, utilizando el método de la resistencia eléctrica. Por otra parte, Sung y col. [34] trabajando con proteína de soya obtuvieron una capacidad emulsificante de 169 mL aceite/g proteína para el aislado sin fosforilar con trimetafosfato de sodio y 265 mL aceite/g proteína. Los resultados de este trabajo muestran la misma tendencia reportada por Sung y col. [34], ya que la capacidad emulsificante se vio incrementada con la fosforilación de la proteína. Según estos autores el enlace covalente de los grupos fosfato (aniones) a las cadenas polipeptídicas, y el incremento en la carga negativa altera las características fisicoquímicas de la proteína por lo que aumenta la capacidad emulsificante.
Por otro lado se observa que bajo las condiciones de experimentación, los valores obtenidos superan lo encontrado por Otero y col. [28] con el concentrado proteico de levadura cervecera. Las características de una emulsión pueden ser influenciadas por múltiples factores, tales como: tipo y geometría del equipo utilizado, intensidad de la energía empleada, velocidad de adición del aceite, temperatura, pH, fuerza iónica, presencia de azúcares y agentes de superficie de bajo peso molecular, exposición al oxígeno, tipo de grasa (punto de fusión) y concentración de las proteínas solubles [4]. Es por esto que si no se procede en condiciones estandarizadas, una misma emulsión da resultados diferentes al ser estudiada por distintos investigadores, explicándose por qué difieren tanto los datos publicados por distintos grupos sobre el comportamiento de una proteína como emulsificador.
Se observaron diferencias estadísticas (P < 0,05) para la solubilidad a pH neutro en los diferentes concentrados. Pacheco y Sgarbieri [30] reportaron resultados similares a los del presente estudio, donde para un concentrado de levadura cervecera mostraron una solubilidad a pH 7 de aproximadamente 50%, mientras que para el concentrado fosforilado fue de 62%.
En otro estudio [35] se determinó una solubilidad del 63% (proteína cruda) en el aislado proteico obtenido a partir de Kluyveromyces marxianus por extracción alcalina y precipitación isoeléctrica. Además, Cunnhingham y col. [7] reportaron una solubilidad proteica de aproximadamente 30% a pH 7, trabajando con un aislado proteico de Candida utilis obtenido por extracción alcalina y precipitación isoeléctrica.
Los resultados de solubilidad entre los trabajos suelen ser muy diferentes debido, entre otras razones, a la levadura empleada y al método seguido para la obtención del concentrado proteico.
CONCLUSIONES
Los resultados del presente estudio demuestran que se puede obtener un concentrado proteico a partir de biomasa microbiana Kluyveromyces marxianus var. marxianus cultivada en suero lácteo desproteinizado. Los valores de rendimiento y la concentración celular obtenidos fueron satisfactorios para este microorganismo, a pesar de que el biorreactor usado no es similar al empleado normalmente en este tipo de investigaciones.
Se evidenció una disminución significativa (P < 0,05) del contenido de ARN de 4,59% (C1) a 2,71% (C2), hecho importante para el uso de este concentrado proteico para el consumo humano.
El tratamiento con trimetafosfato de sodio mejoró las propiedades funcionales de la proteína de la levadura, haciendo más factible su uso como ingrediente en ciertos alimentos. La gran cantidad de lactosuero generada en el país pudiera ser utilizado para producir concentrados proteicos a partir de levaduras de uso industrial con lo que se proporcionaría un doble beneficio: por un lado la disminución de la contaminación del medio ambiente por los vertidos de este subproducto, y por otro lado la generación de una proteína de buena calidad para su uso en la alimentación.
AGRADECIMIENTO
Los autores agradecen el apoyo económico del CDCH-UCV por el financiamiento del proyecto 01-37-4332-1999.
REFERENCIAS BIBLIOGRÁFICAS
1. BEN-HASSAN, R.; GHALY, A. Continuous production of single cell protein from cheese whey lactose using Kluyveromyces fragilis. Trans. of the Am. Soc. of Agric. Eng. (ASAE). 38 (4): 1121-1127. 1995. [ Links ]
2. BYNUM, D.; BARBANO, D. Whole milk reverse osmosis retentates for cheddar cheese manufacture. Chemical changes during aging. J. of Dairy Sci. 68:1-10. 1985. [ Links ]
3. CASTILLO, F.; B. de SANCHEZ, S. Studies on the growth of Kluyveromyces fragilis in whey for the production of yeast protein. Acta Cientif. Venezol. 29 (2): 113-118. 1978. [ Links ]
4. CHEFTEL, J.; CUQ, J. Aminoácidos péptidos y proteínas. Cap 5. En: Fennema, O. (Ed.) Química de los alimentos. Editorial Acribia, S.A.España. 275-410 pp.1993 [ Links ]
5. CHINAPPI, I.; SÁNCHEZ, J. Producción de biomasa de Kluyveromyces fragilis en suero de leche desproteinizado. Acta Cientif. Venezol. 51:223-230. 2000. [ Links ]
6. COTON, S. Whey resources and utilization. J. of the Society of Dairy Tech. 38(4): 97-100. 1985 [ Links ]
7. CUNNINGHAM, S.; CATER C.; MATTIL K. Rupture and protein extraction of petroleum-grown yeast. J. of Food Sci. 40: 732-735. 1975. [ Links ]
8. DAMODARAN, S.; KINSELLA, J. Dissociation of yeast nucleoprotein complexes by chemical phosphorilation. J. Agric. Food Chem. 32(5): 1030-1032. 1984 [ Links ]
9. DE LA TORRE, M.; FLORES, L. Proteínas unicelulares. Cap 11. En: García, M.; Quintero, R.; López, A. (Ed.). Biotecnología Alimentaria. Limusa Noriega Editores, México, 383-396 pp. 1993 [ Links ]
10. DELANEY, R.; KENNEDY, R.; WALLEY, B. Composition of Saccharomyces fragilis biomass grown on lactose permeate. J. of the Sci. of Food and Agric. 26 (8): 1177-1186. 1975. [ Links ]
11. ELIZALDE, B.; BARTHOLOMAI, G.; PILOSOF, A. The effect of pH on the relationship between hidrophilic/lipophilic characteristics and emulsification properties of soy proteins. Lebensm-Wiss u-techrd. 29: 334-339. 1996. [ Links ]
12. FOOD AND AGRICULTURE ORGANIZATION OF THE UNITED NATIONS. (FAO). DATOS AGRICOLAS DE FAOSTAT. Producción de Queso de Todo Tipo en la República Bolivariana de Venezuela para el año 2004. http://faostat.fao.org/faostat/form?collection=Production. Livestock.Derived&Domain=Production&servlet=1&hasbulk=&version=ext&language=ES 20/02/06 [ Links ]
13. GÁLVEZ, A.; RAMÍREZ, M.; GARCÍA-GARIBAY, M. Chemical composition of a mixture of single-cell protein obtained from Kluyveromyces fragilis and whey proteins. Arch. Latinoam. de Nutr. XL( 22): 252-262. 1990. [ Links ]
14. GIARDINA, G. Utilización de suero para el enriquecimiento de pastas alimenticias. Facultad de Agronomía. UCV. (Tesis de Grado). 102 pp. 1995. [ Links ]
15. HUANG, Y.; KINSELLA, J.Effects of phosphorylation on emulsilying and foaming properties and digestibility of yeast protein. J. of Food Sci. 52(6):1684-1688. 1987. [ Links ]
16. JELEN, P. Reprocessing of whey and other dairy wastes for use as food ingredients. Food Tech. 37 (2): 81-84. 1983. [ Links ]
17. KINSELLA, J.Functional proteins from yeast nucleoprotein for food uses:methods for isolation. Chapter 14. In: Knorr, D. Food Biotechnology. Marcel Dekker, Inc., New York and Basel U.S.A. 363-391 pp. 1987. [ Links ]
18. LITCHFIELD, J. Food Supplements from microbial proteins. Chapter 4. In: Goldberg, I.; Williams R. In: Biotechnology and Food Ingredients. Van Nostrand Reinhold. New York. 65-123 pp. 1991. [ Links ]
19. LIU, L.; HUNG, T. Functional properties of acetylated chickpea proteins. J. of Food Sci. 63(2): 331-337. [ Links ]
20. MORESI, M.; ORBAN, E.; QUAGLIA, G.; CASINI, I. Effect of some physicochemical treatments on the kinetics of autolysed-yeast extract production from whey. J. Sci. Food Agric. 67: 347-357. 1995. [ Links ]
21. NELSON, N. Nelson-Somogyi modification colorimetric method for determination reducing sugar. J. Biol. Chem. 153: 375-380. 1944. [ Links ]
22. OFFICIAL METHODS OF ANALYSIS 16th Ed. 3rd Revision, A.O.A.C. INTERNATIONAL, Gaithersburg, MD. Method 925.23. 1997. [ Links ]
23. OFFICIAL METHODS OF ANALYSIS 16th Ed. 3rd Revision, A.O.A.C. INTERNATIONAL, Gaithersburg, MD. Method 942.05. 1997. [ Links ]
24. OFFICIAL METHODS OF ANALYSIS 16th Ed. 3rd Revision, A.O.A.C. INTERNATIONAL, Gaithersburg, MD. Method 945.46. 1997. [ Links ]
25. OFFICIAL METHODS OF ANALYSIS 16th Ed. 3rd Revision, A.O.A.C. INTERNATIONAL, Gaithersburg, MD. Method 960.18. 1997. [ Links ]
26. OFFICIAL METHODS OF ANALYSIS 16th Ed. 3rd Revision, A.O.A.C. INTERNATIONAL, Gaithersburg, MD. Method 962.10. 1997. [ Links ]
27. OFFICIAL METHODS OF ANALYSIS 16th Ed. 3rd Revision, A.O.A.C. INTERNATIONAL, Gaithersburg, MD. Method 991.20. 1997. [ Links ]
28. OTERO, M.; CABELLO, A.; VASALLO M.; GARCÍA, L.; LÓPEZ, J. Tecnología para la utilización integral de la levadura de cerveza en la industria alimenticia. Arch. Latinoam. de Nutr. 50(4):361-365. 2000. [ Links ]
29. PACHECO, E.; RIVAS, N. Efecto de la hidrólisis con tripsina y pepsina sobre las propiedades funcionales de la harina de ajonjolí. Rev. Fac. Agron. UCV 18: 107-117. 1992. [ Links ]
30. PACHECO, M.; SGARBIERI, V. Hidrophilic and rheological properties of brewers yeast protein concentrates. J. of Food Sci. 63(2): 238-243. 1998. [ Links ]
31. RODRÍGUEZ, B.; MARTÍN, E. Cap II. Análisis de alimentos. Tomo I. UCV-OBE. 35-112 pp. 1980 [ Links ]
32. SHETTY, K.J.; KINSELLA, J.E. Preparation of yeast protein isolate with low nucleic acid by succinylation. J. of Food Sci. 44: 633-638. 1979. [ Links ]
33. SIEGEL, S.; CASTELLAN, N. Estadística no paramétrica. Cap 5 y 6. 4ª Ed. Editorial Trillas. 129-259 pp. 1995. [ Links ]
34. SUNG, H.; CHEN, H.; LIU, T.; SU, J. Improvement of the functionalities of soy protein isolate through chemical phosphorylation. J. of Food Sci. 48: 716-721.1983. [ Links ]
35. VANANUVAT, P.; KINSELLA, J. Extraction of protein, low in nucleic acid, from Saccharomyces fragilis grown continuosly on crude lactose. J. Agr. Food Chem. 23(2): 216-221. 1975a. [ Links ]
36. VANANUVAT, P.; KINSELLA, J. Production of yeast protein from crude lactose by Saccharomyces fragilis. Batch culture studies. J. of Food Sci. 40: 336-341. 1975b. [ Links ]
37. ZAMBRANO, P. Producción de proteína unicelular a partir de suero desproteinizado. Facultad de Agronomía. UCV. (Tesis de Grado) 88 pp. 1997. [ Links ]












 uBio
uBio