Revista Científica
versión impresa ISSN 0798-2259
Rev. Cient. (Maracaibo) v.18 n.2 Maracaibo abr. 2008
Utilización de microorganismos marcadores para la evaluación de las condiciones higiénico-sanitarias en la producción primaria de leche.
Marcelo Lisandro Signorini 1, Gabriel Jorge Sequeira 1, Julio César Bonazza 1, Rodolfo Dalla Santina 1, Luis Enrique Martí 1, Laureano Sebastián Frizzo 1,2 y Marcelo Raúl Rosmini 1*
1 Departamento de Salud Pública Veterinaria, Facultad de Ciencias Veterinarias, Universidad Nacional del Litoral, Kreder 2805 (3080) Esperanza (Argentina). * E-mail: mrosmini@unl.edu.ar
2 Becario del Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET, Argentina).
RESUMEN
Los microorganismos marcadores presentes en los alimentos advierten sobre la manipulación inadecuada de la materia prima o el alimento, la presencia de un peligro para el consumidor o una deficiencia de los procesos destinados a su saneamiento. Estos marcadores son herramientas importantes para poder desarrollar registros microbiológicos históricos, a partir de los cuales se pueden establecer valores propios de referencia alcanzables con la metodología de trabajo desarrollada en cada empresa. Dichos valores permitirán, además, implementar los sistemas que garantizan la inocuidad de los alimentos, como es el caso del Análisis de Peligros y Control de Puntos Críticos (HACCP, por su sigla en inglés). El objetivo del trabajo fue estudiar los principales microorganismos marcadores de higiene en leche cruda como herramienta para evaluar las condiciones higiénico-sanitarias en la producción primaria, de tal forma que permitan elaborar un diagnóstico de la situación inicial como paso previo a la implementación de un sistema HACCP. Para el estudio, y a manera de experiencia piloto, se utilizó leche cruda proveniente de un establecimiento productor de la provincia de Santa Fe (Argentina). Las muestras se recolectaron directamente de la ubre, luego del prefrío (intercambiador a placas con agua a temperatura ambiente), tanque de enfriamiento, manos del ordeñador, pezoneras y agua empleada en el establecimiento. Se realizó 1 muestreo por semana hasta completar 44 muestreos distribuidos a lo largo del año. Los marcadores estudiados fueron: recuento total de microorganismos psicrotrofos, mesófilos, termodúricos, mohos y levaduras, enterobacterias y Staphylococcus aureus. Se determinó, además, la presencia de clostridios sulfito reductores y Salmonella spp. El análisis de correlación entre los microorganismos marcadores no permitió establecer predicciones sobre el comportamiento de un grupo microbiano con base en el proceder de otro. No obstante, la información de cada uno de los marcadores individualmente resultó adecuada para evaluar las condiciones higiénico-sanitarias en la producción primaria de leche y generar registros que serán de utilidad para implementar el sistema HACCP.
Palabras clave: Leche cruda, microorganismos marcadores, seguridad alimentaria, HACCP.
Use of Indicator Microorganisms for the Hygienic-Sanitary Conditions Evaluation in the Milk Primary Production.
ABSTRACT
The indicator microorganisms present in the food notify on the inadequate manipulation of the commodity or the food, the presence of a hazard for the consumer or a processes deficiency. These indicator microorganisms are important tools to develop historic microbiologic records, from which own values of compassable reference with the methodology of work developed in each business can be established. These values will permit, besides, to implement the systems that guarantee the food safety, as is the case of the Hazard Analysis of Critical Control Points (HACCP). The objective of this work was to study the main hygiene indicator microorganisms in raw milk as tool to evaluate the sanitary conditions in the primary production, in such a way that they permit to devise a diagnosis of the initial situation like prior step to the implementation of a HACCP system. For the study, and to way of pilot experience, raw milk originating from a producing establishment of the Santa Fe Province, Argentina, was utilized. The samples were collected directly from the udder, after the first cooling, bulk tank, milker hands, teat cup and water employed in the dairy farm. One sampling was carried out for week until completing 44 samplings distributed along the year. The indicator microorganisms studied were: psychrotrophic count, mesophilic count, thermoduric, molds and yeasts, coliforms and Staphylococcus aureus. It was determined, besides, the presence of sulphite-reducting clostridia and Salmonella spp. The correlation analysis among the indicator microorganisms did not permit to establish predictions on the behavior of a microbe group based on the behavior of another. Nevertheless, the information that each one of the indicator microorganisms turned out to be adequate to evaluate the sanitary conditions in the milk primary production and to generate records that will be useful for the HACCP system implementation.
Key words: Raw milk, indicator microorganisms, food safety, HACCP.
Recibido: 06 / 07 / 2006. Aceptado: 09 / 07 / 2007.
INTRODUCCIÓN
Las industrias lácteas que procesan la leche producida en la cuenca lechera santafecina han alcanzado, en términos generales, un alto nivel tecnológico y de seguridad alimentaria [49]. Por otro lado, los establecimientos productores de leche (tambos), que les proporcionan la materia prima, no presentan un nivel de desarrollo homogéneo y satisfactorio como para asegurar un alto nivel de calidad y, en especial, de inocuidad de la leche producida [52].
En los últimos años, favorecido por la apertura comercial vivida en Argentina, se ha manifestado un creciente interés internacional por los alimentos en general y los productos lácteos en particular. Esta demanda no ha podido ser atendida completamente debido, en gran medida, a las conocidas dificultades sanitarias del rodeo vacuno y las consecuentes deficiencias en la calidad de la materia prima (inhibidores, contaminantes, etc.) [38, 40, 52].
Con el objetivo de garantizar la seguridad de los alimentos se han diseñado diversos sistemas de trabajo basados, en general, en la aplicación de medidas que evitan que los contaminantes, vehiculizados por los alimentos, lleguen hasta el consumidor. El que más desarrollo ha tenido es el Sistema de Análisis de Peligros y Control de Puntos Críticos (HACCP, por sus siglas en inglés) [33], sustentado por un adecuado control de proveedores y la aplicación de prerrequisitos básicos: Buenas Prácticas de Fabricación (BPF) y Procedimientos Operativos Estandarizados de Saneamiento (POES) [6, 7, 8, 27, 30, 48].
Una vez que se han puesto en práctica las BPF y los POES, y antes de adoptar un sistema destinado al control de un peligro específico (HACCP), la empresa debe realizar un estudio prospectivo mediante la utilización de microorganismos marcadores para establecer los valores propios de referencia, que son alcanzables con la metodología de trabajo implementada. Al cabo del tiempo, este estudio debe generar una base de datos histórica que permita, por comparación con los valores exigidos por la normativa vigente o por los mercados internacionales, definir si dicha metodología de trabajo es la adecuada o debe ser mejorada.
Los microorganismos marcadores son aquellos cuya presencia en los alimentos advierte sobre una inadecuada manipulación de la materia prima o el alimento, la existencia de un peligro para la salud del consumidor (microorganismos, toxinas, etc.), o una falla en los procesos destinados a su saneamiento. Entre los marcadores se pueden diferenciar dos grupos: a) microorganismos índices, aquellos cuya presencia o detección a ciertos niveles supone la presencia potencial de microorganismos patógenos con estrecha relación taxonómica, fisiológica y ecológica; b) microorganismos indicadores, aquellos cuya detección o presencia en números predeterminados sugiere un fallo en un proceso destinado a sanear, higienizar, descontaminar o mejorar la seguridad del alimento [39].
En el caso particular de la leche cruda los microorganismos indicadores son útiles para juzgar el funcionamiento del establecimiento productor, pues señalan la existencia de defectos durante la manipulación, el incumplimiento de las pautas de higiene y permiten inferir la vida útil y la inocuidad del alimento [39]. Entre los grupos o microorganismos índices, las enterobacterias y Escherichia coli sugieren el origen fecal de la contaminación, mientras que Staphylococcus aureus se relaciona con la ubre infectada (mastitis), la piel, las mucosas y el tracto respiratorio de los animales y el hombre [17, 25].
Por otra parte, la presencia de microorganismos patógenos, como Salmonella, implica falta de inocuidad del alimento y como consecuencia un severo riesgo para el consumidor.
La aplicación del sistema HACCP en establecimientos de producción de leche cruda, como parte integral de un sistema de calidad sistemático y racional de previsión, permitirá asegurar la inocuidad del producto final, contribuirá a mejorar la calidad del mismo y facilitará los procesos industriales posteriores [20]. El estudio de los microorganismos marcadores de higiene de la leche cruda permitirá conocer las condiciones higiénicas iniciales en las diferentes etapas del proceso, y determinar las condiciones sanitarias del producto, para tomar decisiones oportunas que reviertan las desviaciones que pudieran presentarse en el sistema.
El objetivo de este trabajo fue estudiar los principales microorganismos marcadores de higiene en leche cruda como herramienta para evaluar las condiciones higiénico-sanitarias en la producción primaria de leche, de tal forma que permita elaborar un diagnóstico de la situación inicial como paso previo a la implementación de un sistema HACCP.
MATERIALES Y MÉTODOS
Toma de muestras
El presente trabajo se realizó en un establecimiento situado en la localidad de Iriondo, provincia de Santa Fe, Argentina, dedicado a la producción primaria de leche.
Se realizó un muestreo por semana, con un intervalo aproximado de 7 días, hasta completar 44 muestreos distribuidos a lo largo del año. Las muestras de leche se recolectaron en las siguientes etapas del proceso de obtención y almacenamiento de leche cruda: a la salida de la ubre, luego del preenfriamiento (intercambiador a placas con agua a temperatura ambiente) y del tanque de enfriamiento [45]. La leche presente en el tanque de enfriamiento al momento del muestreo, estaba constituida por leche obtenida en el ordeño anterior y almacenada por 12 horas a temperatura de refrigeración (< 8ºC) más el agregado de leche ordeñada simultáneamente en el momento del muestreo. En todos los casos las muestras estuvieron constituidas por tres subunidades extraídas al azar del conjunto total. En el caso de la leche a la salida de la ubre, cada subunidad de muestreo estaba formada por leche proveniente de 10 animales seleccionados al azar. Esta extracción se realizó posteriormente al lavado de los pezones con agua de pozo (sin secado) y la eliminación de los primeros chorros de leche.
También se obtuvieron muestras de ambas manos del ordeñador, las cuales quedaron integradas como una única subunidad. El muestreo se realizó mediante enjuague directo de las mismas en caldo lactosado al 10% inmediatamente antes de comenzar el ordeñe.
Asimismo, se muestrearon las pezoneras realizándose al inicio del ordeño por enjuague de su parte interna con caldo lactosado al 10%, estando constituida la única subunidad por el enjuague de las cuatro partes que componen el sistema. Trimestralmente se obtuvo una muestra de agua utilizada en las instalaciones de ordeño.
Las muestras se almacenaron en condiciones de refrigeración y se transportaron al laboratorio de Análisis de Alimentos de la Facultad de Ciencias Veterinarias de Esperanza, Argentina, para su análisis inmediato.
Análisis microbiológicos y fisicoquímicos
Microorganismos marcadores: Para establecer un diagnóstico de la situación higiénico-sanitaria inicial y al mismo tiempo construir la base del registro histórico del establecimiento, para los diferentes puntos de muestreo se analizaron los siguientes microorganismos marcadores:
a) Leche (a la salida de la ubre, luego del prefrío y del tanque de enfriamiento): recuento total de microorganismos psicrotrofos, mesófilos, termodúricos, mohos y levaduras, enterobacterias y Staphylococcus aureus. Adicionalmente, la leche obtenida del tanque de enfriamiento, fue analizada para verificar la presencia de clostridios sulfito reductores y Salmonella spp. Además se determinaron la temperatura y el pH de la leche.
b) Agua: recuento del coliformes totales, fecales (número más probable, NMP) y Escherichia coli.
c) Manos del ordeñador: recuento total de microorganismos psicrotrofos, mesófilos, termodúricos, mohos y levaduras, enterobacterias y Staphylococcus aureus.
d) Pezoneras: recuento total de microorganismos psicrotrofos, mesófilos, termodúricos, mohos y levaduras y enterobacterias.
Técnicas analíticas:
a) Para el recuento de microorganismos psicrotrofos, mesófilos y termodúricos se utilizó el Agar para Recuento en Placa (Biokar, Beauvais, Francia). La temperatura y tiempo de incubación para el recuento de psicrotrofos fue de 7°C durante 10 d, mientras que para los dos grupos restantes fue de 37°C durante 48 h. Para la determinación de microorganismos termodúricos, las muestras se sometieron a un calentamiento de 63°C durante 30 min, previo a la siembra [24].
b) El recuento de mohos y levaduras se determinó en agar YGC (Biokar, Beauvais, Francia) incubando a 30°C durante 48 h. Para el recuento de enterobacterias se utilizó agar Violeta Rojo Bilis Glucosa (Biokar, Beauvais, Francia), incubando a 37°C durante 24 h [24].
c) La determinación de Staphylococcus aureus comenzó con la siembra en superficie en agar Baird-Parker (Merck, Darmstad, Alemania), con el agregado de yema de huevo y telurito de potasio. Transcurridas 48 h de incubación a 37°C, las colonias presuntivas se resembraron en caldo BHI (Merck, Darmstad, Alemania) durante 24 h a 37°C y, a partir de este cultivo fresco, se realizaron las pruebas de termonucleasa y coagulasa. Para la primera determinación se empleó agar para la determinación de DNAsa (Merck, Darmstad, Alemania), mientras que la prueba de la coagulasa se realizó exponiendo el cultivo fresco con plasma de conejo de acuerdo con la recomendación de la Comisión Internacional de Estándares Microbiológicos para Alimentos (ICMSF) [24].
d) La determinación de clostridios sulfito reductores se realizó inoculando 1 mL de leche sin diluir en el fondo de un tubo conteniendo 10 mL de agar SPS (Merck, Darmstad, Alemania) fundido y templado. Posteriormente se puso el tubo en un baño termostático a 75°C durante 15 min para eliminar células vegetativas. Luego se colocó el agar inoculado en un baño de agua fría para, una vez solidificado el agar, colocar 5 mL de parafina fundida, con el objetivo de crear un ambiente anaeróbico. Se lo dejó incubar a 37°C durante 24 h. La formación de gas (evidenciado por un resquebrajamiento y elevación del agar) y la reducción del sulfito (detectada por un ennegrecimiento del medio de cultivo) fueron los aspectos tenidos en cuenta para considerar a la muestra como positiva [5].
e) Para la determinación de Salmonella spp. se siguió la metodología de la Federación Internacional de Lechería [28].
f) Para el recuento de coliformes totales y fecales en agua se empleó el método del NMP en Caldo McConkey [3]. Para la determinación de E. coli, se tomó una alícuota a partir de los tubos positivos a la prueba de coliformes fecales, para ser sembrado en agar McConkey (Merck, Darmstad, Alemania). Las placas fueron incubadas durante 24 h a 37°C. Las colonias típicas fueron confirmadas en base al patrón IMViC [2].
g) Las determinaciones de pH se realizaron con un termo-phMetro Altronix, modelo TPX (Argentina), y un electrodo de vidrio.
Análisis estadísticos
Para analizar el efecto de cada punto de muestreo (ubre, prefrío y tanque de enfriamiento) sobre los microorganismos marcadores se utilizó el análisis de la varianza. Cuando las diferencias resultaron significativas se aplicó la técnica de Duncan de comparaciones múltiples de medias [50]. Se realizaron análisis de correlación entre los diferentes microorganismos marcadores a nivel del tanque de refrigeración, eliminando del análisis las observaciones con valores perdidos en alguna de las variables que estaban interviniendo en la correlación. Además, se realizó una correlación parcial con el objetivo de controlar estadísticamente el posible efecto atribuible de la estación climática y la temperatura de la leche. Los análisis estadísticos fueron realizados empleando el paquete estadístico SPSS ver. 8,0 para Windows [50].
RESULTADOS Y DISCUSIÓN
Microorganismos marcadores
Los resultados obtenidos de los recuentos de microorganismos marcadores de higiene en los diferentes puntos de muestreo se exponen en la TABLA I. Una alta carga de bacterias contaminantes en la leche disminuye la vida útil de los productos elaborados, desmejora la calidad organoléptica y nutricional, e interviene en los procesos de fermentación ácido láctica y en la coagulación enzimática promoviendo el deterioro o proteólisis de las caseínas [47].
Microorganismos mesófilos
Los microorganismos mesófilos presentaron un mayor recuento (P<0,05) en el tanque de enfriamiento con relación a los niveles encontrados en los dos puntos de muestreo restantes. No obstante, las concentraciones de mesófilos totales en el tanque de enfriamiento sólo fueron, en promedio, 0,2 logUFC/mL de leche superiores a los hallados en la leche obtenida directamente de la ubre y luego del preenfriamiento. Un recuento elevado de los microorganismos mesófilos en la leche cruda indica la existencia de deficiencias en todo el sistema de obtención del producto, es decir, evidencia una insuficiente higiene en el establecimiento [10,11]. No obstante, el número total de estos microorganismos no aporta información suficiente para identificar la fuente de contaminación ni suministra datos sobre la capacidad de conservación de un producto ni sobre los potenciales riesgos para la salud que representa su consumo [21]. A pesar de ello, en los productos que no han sido sometidos a ningún tratamiento térmico, por ejemplo la leche cruda, el recuento de colonias mesófilas se considera el mejor microorganismo marcador para valorar la higiene de la producción [36]. Entre las posibles razones de los altos recuentos, de este grupo marcador, se pueden mencionar las infecciones de la ubre, la falta de higiene en los equipos y en los procedimientos de ordeño, inadecuada calidad microbiológica del agua y las deficientes condiciones de almacenamiento de la leche en el tambo [14], en resumen, a la falta de aplicación de Buenas Prácticas de Fabricación [41].
Los recuentos de microorganismos mesófilos totales evidenciaron que la leche producida en el establecimiento tenía una buena calidad microbiológica. El promedio de dichos microorganismos fue inferior al valor exigido por la Comunidad Europea para la leche cruda de vaca (Directiva 92/46/CEE, < 5 logUFC/mL). Estos resultados indican que el nivel de higiene general del establecimiento era adecuado y el sistema de obtención de la leche permitía, desde el punto de vista higiénico, recolectar un producto en condiciones de ser exportado. Por otra parte, estos valores concuerdan con los encontrados en el 58% de los establecimientos productores de la región [52, 53] y se encuentran por debajo del valor promedio determinado en el noroeste de la provincia de Santa Fe y sur de Santiago del Estero (5,08 logUFC/mL) en un estudio que abarcó diez años [43]. Los valores obtenidos también resultaron inferiores a los informados en un estudio realizado en Malasia (promedio nacional = 7,08 logUFC/mL, mejor región del país = 6,9 logUFC/mL) [14] y estuvieron muy próximos a los encontrados en Dinamarca (promedio años 2000-2002 = 3,9 logUFC/mL) [22], en la región de Camembert (3,89 logUFC/mL) [16] y en los Alpes Franceses (de 3,07 a 4,14 logUFC/mL) [35]. El escaso incremento del número de microorganismos mesófilos totales encontrados, entre las muestras obtenidas directamente de la ubre y las extraídas del tanque de frío, evidencia que el proceso de extracción de leche utilizado era eficiente para controlar la contaminación. El incremento observado puede estar en relación con la carga microbiana de la leche almacenada previamente en el tanque de enfriamiento y a la temperatura de almacenamiento en el mismo.
Microorganismos psicrotrofos
Por el contrario, los microorganismos psicrotrofos no mostraron diferencias (P>0,05) entre los recuentos en los distintos puntos de muestreo. Estos microorganismos son capaces de crecer a temperaturas de 7°C o inferiores, aunque su temperatura óptima de multiplicación sea superior. La enumeración de bacterias psicrotrofas en alimentos que deben ser almacenados en refrigeración (0 a 7°C), es importante porque su presencia (particularmente en un gran número) indica una probabilidad elevada de deterioro durante un almacenamiento prolongado. Los alimentos crudos mantenidos bajo refrigeración, previo a su procesamiento, están sujetos a la pérdida de calidad y posible deterioro por las bacterias psicrotrofas. Cuando estos gérmenes se desarrollan en gran número antes del tratamiento de la leche, alcanzando recuentos superiores a 107 UFC/mL, secretan enzimas termorresistentes (proteasas y lipasas) que originan defectos de sabor-olor (flavour) (sabores amargos, enranciamiento, etc.) o problemas de estabilidad física durante el almacenamiento de los productos pasteurizados, aunque los microorganismos hayan sido destruidos durante el tratamiento térmico [31, 36].
Dentro de este grupo microbiano, el género Pseudomonas es el más frecuentemente reportado en leche cruda [12, 15] aunque también se encuentran Flavobacterium spp. y Alcaligenes spp. [36]. La óptima actividad de las proteasas y lipasas generadas se encuentra a una temperatura de 20-30°C, pero una considerable síntesis también se observa a bajas temperaturas. Un alto recuento de estos microorganismos en la leche cruda puede ser considerado como indicador de una vida útil limitada de la leche pasteurizada, en especial si están presentes los psicrotrofos termodúricos [19]. Bajo condiciones de higiene, menos del 10% de los microorganismos totales son psicrotrofos, comparado con el 75% de participación en la carga microbiana total de la leche cuando no se contemplan medidas higiénicas [12, 23, 37]. En el presente estudio, el valor promedio de los recuentos de microorganismos psicrotrofos en el tanque de enfriamiento fue inferior al 10% del valor correspondiente al recuento de microorganismos mesófilos totales, esto refuerza lo expresado anteriormente sobre el buen nivel de higiene durante el ordeño. Por otra parte, los valores obtenidos fueron inferiores a los encontrados en Malasia (promedio nacional = 3,88 logUFC/mL) [14] y estuvieron muy próximos a los valores máximos encontrados en los Alpes Franceses (de 1,41 a 3,16 logUFC/mL) [35].
Microorganismos termodúricos
Los mayores valores (P<0,05) de microorganismos termodúricos se encontraron en la leche extraída directamente de la ubre (2,61 logUFC/mL de leche), mientras que en los demás puntos de muestreo los valores estuvieron por debajo de los 2,3 logUFC/mL de leche. Los microorganismos termodúricos provienen del medio ambiente de la vaca (agua de lavado, barro, etc.) y normalmente se desarrollan en el equipo de ordeño. En la industria láctea se definen como microorganismos termodúricos aquellos que sobreviven a la pasteurización y en el laboratorio se consideran como tales los que resisten 30 min a 63,5°C. La mayor parte son Gram + y su termorresistencia supone que cuando se encuentren en la leche cruda podrán también estar presentes en el producto final [36]. Los recuentos elevados indican que las prácticas de higiene durante la extracción de la leche son deficientes o bien, el equipo de ordeño no ha sido adecuadamente higienizado, por períodos prolongados de tiempo, dando lugar a la formación de costras (piedra de leche) en las cuales se acumulan y desarrollan los microorganismos [1, 26]. Recuentos con valores de 2,3-2,5 logUFC/mL de leche se consideran aceptables [10, 11], mientras que valores inferiores a 1 logUFC/mL de leche son indicativos de excelentes prácticas de higiene en los equipos de ordeño [46]. En este trabajo los valores en el tanque de enfriamiento se encontraban dentro de los niveles mencionados como aceptables, lo cual confirma que las prácticas desarrolladas durante la obtención de la leche eran adecuadas. Por otra parte, dichos valores fueron inferiores a los encontrados en Malasia (promedio nacional = 3,96 logUFC/mL) [14], estuvieron próximos a los valores máximos encontrados en los Alpes Franceses (2,52 logUFC/mL) [35] y fueron superiores a los reportados en New York, EUA (2,11 logUFC/mL) [9] y en Pensilvania, EUA (2,09 logUFC/mL) [29].
Enterobacterias
En el recuento de enterobacterias de la leche resultaron significativas (P<0,05) las diferencias entre los 3 puntos de muestreo estudiados. Las muestras obtenidas directamente del tanque de enfriamiento presentaron los valores más elevados (P<0,05), seguidas por las obtenidas en el prefrío y las extraídas directamente de la ubre. Los microorganismos que integran la familia Enterobactereaceae se encuentran ampliamente distribuidos en el ambiente y son habitantes normales del intestino de los animales de sangre caliente. Pueden constituir entre el 10 y 30% de la flora presente en leche cruda refrigerada [51]. Su hallazgo en muestras de leche cruda y agua destinada a la limpieza está relacionado con la contaminación de origen fecal y, por lo tanto, es un indicio de la presencia de microorganismos patógenos de dicho origen. Los valores máximos encontrados en este trabajo correspondieron al tanque de enfriamiento (2,88 logUFC/mL), mientras que los valores mínimos estuvieron relacionados con la leche obtenida directamente de la ubre (1,71 logUFC/mL). La ubre está señalada como una fuente de microorganismos de origen fecal, no obstante, los mayores valores encontrados en la leche presente en el tanque de enfriado estarían señalando la existencia de otros factores que le dan origen a las enterobacterias. Una posible explicación a este hecho podría estar relacionada con la mezcla de la leche fría del ordeño anterior y la leche parcialmente refrigerada por el intercambiador de placas; esto produciría una elevación de la temperatura y favorecería la multiplicación de los microorganismos. Debe tenerse en cuenta que aproximadamente el 50% de las enterobacterias presentes en leche cruda son psicrotrofas y tienen capacidad para desarrollarse con tiempos de generación bajos (5 horas) aún a temperaturas de 5-7°C. A esta observación se debe sumar el hecho que uno de los mejores coeficientes de correlación se encontró entre las enterobacterias y los psicrotrofos. Por último, los resultados de los recuentos realizados en la leche del tanque de enfriamiento en este trabajo están próximos a los valores máximos encontrados en los Alpes Franceses (2,60 logUFC/mL) [35].
Mohos y levaduras
La leche obtenida del tanque de enfriamiento presentó los mayores recuentos de mohos y levaduras (P<0,05) respecto de los niveles observados en la leche obtenida directamente de la ubre y luego de atravesar el intercambiador a placas. Los valores obtenidos entre estos dos últimos puntos de muestreo no difirieron significativamente entre si (P>0,05). Los mohos y las levaduras están ampliamente distribuidos en el ambiente y pueden ser encontrados como parte de la flora normal de un producto alimenticio, sobre los equipos inadecuadamente sanitizados, o como contaminantes del ambiente [2]. Su presencia en la leche cruda es un indicio de la contaminación ambiental. Los valores encontrados en este estudio fueron inferiores a los informados en Dinamarca (3,71 logUFC/mL) [22] y estuvieron muy próximos a los reportados en la región de Camembert (1,89 logUFC/mL) [16], aunque en ambos solo contaron levaduras. Por otra parte, se ubicaron en el rango de los valores reportados en los Alpes Franceses (de 1,08 a 3,03 logUFC/mL) [35].
Staphylococcus aureus
Los mayores valores de S. aureus fueron encontrados en la leche obtenida directamente de la ubre con respecto a los valores determinados en la leche del tanque de enfriamiento (P<0,05), las cuales no resultaron estadísticamente significativas (P>0,05) las diferencias entre la leche obtenida luego del prefrío y los otros dos puntos de muestreo. El S. aureus es reconocido como el principal responsable de la mastitis clínica y subclínica en el ganado lechero [14] y ha sido definido como el principal patógeno causante de mastitis bovina en estudios realizados en la zona norte de la provincia de Santa Fe, Argentina, habiendo sido detectado en el 43% de los aislamientos [42]. No obstante, la no detección en la leche cruda no es indicativa de su ausencia en el rodeo [10, 11]. Aunque este microorganismo se destruye durante el tratamiento térmico, S. aureus produce una toxina termorresistente que no se inactiva en la pasteurización y origina intoxicaciones alimentarias. Por lo tanto, la ausencia del microorganismo en una muestra no garantiza que el producto sea seguro para la salud [36]. Los valores encontrados en los recuentos de S. aureus (de 0,37 a 0,8 logUFC/mL de leche) están muy por debajo del necesario para producir cantidad suficiente de enterotoxina (>6 logUFC/mL de leche) como para provocar síntomas de intoxicación en el humano [25]. También estuvieron muy por debajo de los niveles exigidos por la Comunidad Europea para leche cruda de vaca destinada a la elaboración de productos a base de leche cruda cuyo proceso de elaboración no incluye ningún tratamiento térmico (Directiva 92/46/CEE, 2,7 logUFC/mL). Por otra parte, estos valores se ubicaron por debajo de los informados en la región de Camembert (2,54 y 2,65 logUFC/mL para el verano e invierno respectivamente) [16], de los encontrados en Dinamarca (3,76 logUFC/mL) [22] y de los reportados en Malasia (4,08 logUFC/mL) [14]. Los mayores valores encontrados a nivel de la ubre estarían confirmando que esta región anatómica es una fuente natural de estos microorganismos marcadores y, al mismo tiempo, es el único sitio de contacto indirecto entre la leche y las manos de los operarios, las cuales podrían constituir otra fuente potencial.
Correlación entre los microorganismos marcadores
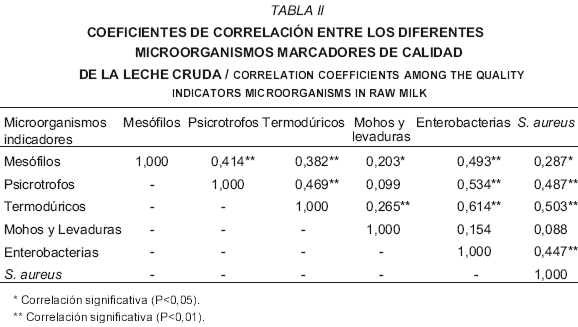
La TABLA II muestra los resultados del análisis de correlación efectuado entre los grupos de microorganismos marcadores contemplados en este estudio en la leche cruda a nivel del tanque de refrigeración. No se obtuvieron coeficientes de correlación de Pearson superiores a 0,8. Los coeficientes más importantes fueron aquellos hallados entre microorganismos termodúricos y enterobacterias (0,614), psicrotrofos y enterobacterias (0,534) y termodúricos y S. aureus (0,503). Las demás comparaciones mostraron coeficientes menores a 0,5. Cuando se realizó una correlación parcial con el objetivo de controlar estadísticamente el posible efecto atribuible de la estación climática y la temperatura de la leche, los coeficientes de correlación no variaron significativamente, lo que nos permite afirmar que las correlaciones halladas en el presente estudio no se ven sustancialmente alteradas al considerar dichas variables. El análisis de correlación entre los microorganismos marcadores presentes en la leche cruda pretende encontrar las relaciones existentes entre los valores hallados con miras a poder simplificar los estudios rutinarios acotando la variedad de grupos evaluados. A pesar de esto, el análisis de los resultados obtenidos sugiere la existencia de una correlación poco clara entre los principales microorganismos marcadores en la leche cruda refrigerada, en especial al considerar que los altos niveles de significación estadística encontrados están asociados a bajos coeficientes de correlación. Este hecho demuestra un escaso valor predictivo entre los diferentes microorganismos estudiados y, por lo tanto, dificulta la reducción del número de marcadores utilizados para definir la calidad higiénica de la leche cruda. No obstante, estos coeficientes de correlación son comparables a los obtenidos por otros autores al analizar la calidad microbiológica y química de la leche cruda en el Estado de Nueva York [9], aunque en dicho estudio las correlaciones con mayores coeficientes se obtuvieron entre psicrotrofos y mesófilos (0,7685) y entre psicrotrofos y enterobacterias (0,467). En otro estudio, Jayarao y col. [29], buscando establecer lineamientos para el monitoreo microbiológico de tanques de refrigeración de leche cruda, encontraron las principales correlaciones entre mesófilos y psicrotrofos (0,619), entre mesófilos y S. aureus (0,517) y entre mesófilos y termodúricos (0,51).
Clostridios sulfito reductores
Los clostridios sulfito reductores se encontraron en el 40% de las muestras analizadas a lo largo del estudio. Estos agentes bacterianos alteran los quesos de pasta dura y corteza sólida, produciendo fermentación ácida-butírica, lo que se traduce en una hinchazón tardía (debido a la producción de anhídrido carbónico e hidrógeno) y en cambios en el aroma por la presencia de ácido butírico. La fuente de esporas está constituida por el forraje usado en la alimentación de las vacas, del ambiente que rodea la sala de ordeñe y de las condiciones de higiene durante el mismo [1, 26]. En un estudio realizado por Gaggiotti y col. [18], al muestrear cisternas de leche cruda proveniente de la cuenca lechera central argentina, se determinó que el 49% de las mismas poseía una concentración de clostridios sulfito reductores superiores a 1000 esporas/mL de leche, siendo clasificadas como de mala calidad para la elaboración de quesos y sólo el 21% de las cisternas estaban libres de esporas.
Salmonella spp.
No se detectaron muestras positivas a Salmonella spp. en la leche obtenida del tanque de enfriamiento a lo largo del año. La baja proporción de muestras positivas a clostridios sulfito reductor encontrados en el presente estudio, conjuntamente con la ausencia de Salmonella, demuestran la existencia de una leche cruda de buena calidad tanto para su industrialización como para su destino a leche fluida.
Análisis de temperatura y pH en la leche
La TABLA III presenta los valores de pH y temperatura de la leche obtenida en los diferentes puntos de muestreo estudiados. En esa tabla se puede observar que la temperatura de la leche obtenida directamente de la ubre se redujo significativamente (P<0,05) por efecto del sistema de prefrío (reducción aproximada a 5°C) y experimentó una nueva disminución significativa (P<0,05), respecto de este último valor (reducción aproximada a 14°C), por efecto del sistema de enfriamiento (tanque de almacenamiento). Es importante que la leche obtenida en el ordeño sea enfriada rápidamente y que permanezca el menor tiempo posible en almacenamiento [14]. La leche recién ordeñada está aproximadamente a una temperatura de 38°C. Para reducir el desarrollo de las bacterias contaminantes y la velocidad de alteración, la leche debe enfriarse rápidamente a 4°C y en condiciones ideales, a 2°C en los treinta minutos siguientes al ordeño [36]. Si bien desde el punto de vista estadístico resultaron significativas (P<0,05) las diferencias de temperatura entre los tres puntos de muestreo, en la práctica, el valor observado en el tanque de enfriamiento durante las operaciones de ordeñe y primeras horas post-ordeñe era adecuado para la supervivencia y reproducción de la totalidad de los microorganismos marcadores estudiados. La disminución de la temperatura que produjo el sistema de preenfriamianto no resultó suficiente como para representar un choque térmico para los microorganismos y, por otra parte, podría estar explicando, al menos parcialmente, el elevado valor de la temperatura de la leche en el tanque de enfriamiento.
En el caso del pH de la leche, el valor encontrado en las muestras obtenidas del tanque de enfriamiento fue superior (P<0,05), en aproximadamente 0,2 unidades, a los otros dos puntos de muestreo, los cuales resultaron similares entre sí (P>0,05). Al ser el grupo microbiano enterobacterias el que presentó niveles elevados y constantes de multiplicación en el tanque de enfriamiento a lo largo del estudio, podría explicar en parte el llamativo valor del pH hallado en la leche almacenada bajo refrigeración. Se han encontrado especies de enterobacterias con capacidad para hidrolizar la β y a caseínas (Enterobacter), β caseína (Escherichia coli) y k caseína (Aeromonas spp y Serratia spp) [49]. Estos grupos microbianos mediante desaminaciones (oxidativa, hidrolítica, reductora, etc.) son capaces de producir grupos químicos alcalinizantes (NH3), posibles responsables de la elevación del pH en el tanque de enfriamiento [17, 25, 32]. La actividad proteolítica puede ser detectada aún cuando la población de microorganismos psicrotrofos es inferior a 4 logUFC/mL de leche, dependiendo de los niveles de producción enzimática ocurrida durante la fase logarítmica de crecimiento. Las poblaciones necesarias para causar cambios detectables en leche varían según el género y especie y también dentro de un mismo género; la cantidad suficiente es muy variable y se ha reportado que puede estar entre 2 a 8 logUFC/mL [32, 51]. Para confirmar la hipótesis expuesta se requiere de estudios tendientes a caracterizar la microflora de enterobacterias presentes bajo estas condiciones, demostrar y cuantificar la actividad proteolítica de dichas especies tanto in vitro como en el sustrato de interés.
Análisis microbiológicos en agua
En lo referente a los análisis microbiológicos realizados al agua empleada en el establecimiento, se observó que solamente durante el otoño e invierno se hallaron niveles cuantificables de coliformes totales (23 NMP/mL de agua), mientras que para las dos estaciones restantes no se identificó este grupo microbiano. En lo que respecta a los coliformes fecales y E. coli, no fueron hallados a lo largo del período de estudio. En un estudio realizado por Charlón y col. [13] con el objetivo de caracterizar el agua disponible (análisis fisico-químico y bacteriológico) en las instalaciones de ordeño ubicadas en la cuenca lechera central de Argentina, se observó un promedio de 104 NMP/mL, de coliformes totales, siendo el 48% de las muestras analizadas no aptas para el consumo humano según las especificaciones del Código Alimentario Argentino (CAA) (<3NMP/mL). Los autores concluyeron que el agua disponible en los tambos no era apta para la limpieza de la maquinaria empleada durante el ordeño. En el presente estudio, solo en otoño-invierno los niveles de coliformes totales detectados superaron el límite de aptitud establecido por el CAA. Si bien los recuentos de coliformes totales no son elevados, el agua de pozo debería ser considerada como una fuente potencial de contaminación microbiana. Estos recuentos están en concordancia con los hallados por Robinson [44] y Frazier y Westhoff [17], quienes coinciden en afirmar que si bien el número de microorganismos introducidos por el agua es bajo, la multiplicación en residuos dentro de la maquinaria, puede resultar en una seria contaminación para la leche cruda.
Análisis microbiológicos en manos de operarios y pezoneras
S. aureus sólo fue detectado en las manos de los operarios (0,68 logUFC/cm2) durante la estación otoño. Los microorganismos mesófilos fueron los que evidenciaron los mayores recuentos a lo largo del estudio (< 2,5 logUFC/cm2), seguidos por los psicrotrofos (1,44 logUFC/cm2) y los termodúricos (1,02 logUFC/cm2) como grupos bacterianos más importantes. Las enterobacterias (0,40 logUFC/cm2) y mohos y levaduras (0,50 logUFC/cm2) fueron los grupos microbianos con menor importancia. La contribución de las manos de los operarios como fuente de S. aureus a la leche cruda sólo fue posible durante el otoño y, tal como se mencionó anteriormente, el único sitio de acceso posible en las condiciones de producción estudiadas (línea cerrada) era el contacto de las manos con la ubre. Esta situación está resaltando el papel de la glándula mamaria como fuente de este microorganismo marcador.
Los mesófilos fueron los microorganismos marcadores que mostraron recuentos más elevados en las pezoneras a lo largo del estudio (3,03 logUFC/cm2), seguidos por los psicrotrofos (2,31 logUFC/cm2) y los termodúricos (1,41 logUFC/cm2) como grupos bacterianos más importantes. Las enterobacterias (0,94 logUFC/cm2) y mohos y levaduras (0,97 logUFC/cm2) fueron los grupos microbianos con menor importancia. Las máquinas de ordeñe están consideradas como fuentes importantes de microorganismos psicrotrofos, termodúricos y enterobacterias [17, 44]. No obstante esto, son escasos los antecedentes con que se cuenta acerca de la presencia y cuantificación de microorganismos marcadores en pezoneras. Amiot [4] y McKinnon y col. [34] concluyen que la máquina de ordeñe en su conjunto aporta entre 3-5 logUFC/mL a la leche cruda. Por su parte Robinson [44] halló que el 66,7% de las máquinas ordeñadoras muestreadas en una cuenca lechera de Gran Bretaña poseían recuentos superiores a los 3 logUFC/cm2. Estos valores coinciden con los hallados en las pezoneras en el presente estudio.
CONCLUSIONES
El análisis de correlación entre los microorganismos marcadores no permitió establecer predicciones sobre el comportamiento de un grupo microbiano en base al proceder de otro. No obstante, la información que cada uno de los microorganismos marcadores brindó en forma individual resultó interesante para evaluar las condiciones higiénico-sanitarias en la producción primaria de la leche. Los valores obtenidos en los recuentos de microorganismos mesófilos, psicrotrofos y termodúricos indicaron que las prácticas de saneamiento desarrolladas eran adecuadas para asegurar la higiene del producto. Los microorganismos patógenos estudiados estuvieron ausentes o lo hicieron en valores por debajo de las exigencias internacionales, esto evidencia que no representan un peligro para la salud del consumidor o la calidad de la leche cruda. En base a los valores de los microorganismos marcadores estudiados se puede afirmar que la calidad de la leche analizada cumplía con los criterios de higiene establecidos para la exportación a la Unión Europea y estaba en condiciones de ser destinada a la elaboración de productos lácteos o leche fluida de alta calidad.
AGRADECIMIENTO
Los autores agradecen el apoyo brindado por el personal del Establecimiento La Negra, por su colaboración inestimable para la realización del presente trabajo.
REFERENCIAS BIBLIOGRÁFICAS
1. ADAMS, M.R.; MOSS, M.O. Microbiología de los alimentos principales. En: Microbiología de los alimentos. Zaragoza, Ed. Acribia, 129-169pp.1997. [ Links ]
2. AMERICAN PUBLIC HEALTH ASSOCIATION (APHA) Compendium of methods for the microbiological examination of foods. 3 Ed. Washington, D.C. 1992. [ Links ]
3. AMERICAN PUBLIC HEALTH ASSOCIATION (APHA) Standard methods for the examination of water and wastewater. 15ª Ed. Washington, 277 pp. 1980. [ Links ]
4. AMIOT, J. Ciencia y tecnología de la leche: principios y aplicaciones. Zaragoza, Acribia. 547 pp. 1991. [ Links ]
5. ANGELOTTI, R.; HALL, H.E.; FOTER, M.J.; LEWIS, K.H. Quantitation of Clostridium perfringens in foods. Appl. Microbiol. 10:193-199. 1962. [ Links ]
6. BRYAN, F.L. Procedures for local health agencies to institute a Hazard Analysis Critical Control Points Program for food safety assurance in food service operations. J. Envirom. Health. 47: 241-245. 1985. [ Links ]
7. BRYAN, F.L. Bases y principios para la implementación del sistema HACCP en la elaboración de alimentos. Curso Internacional de Especialización en HACCP. Buenos Aires, 12-16 agosto, UADE/Food Control, 68 pp. 1991. [ Links ]
8. BRYAN, F.L. Evaluaciones por análisis de peligros en puntos críticos de control. Guía para identificar peligros y evaluar riesgos relacionados con la preparación y la conservación de alimentos. Ginebra: OMS. 86 pp. 1992. [ Links ]
9. BOOR, K.J.; BROWN, D.P.; MURPHY, S.C.; KOZLOWSKI, S.M.; BANDLER, D.K. Microbiological and chemical quality of raw milk in New York Sate. J. Dairy Sci. 81: 1743-1748. 1998. [ Links ]
10. CALVINHO, L.F.; CANAVESIO, V.R.; AGUIRRE, N. Análisis de leche del tanque de frío: Una herramienta para detectar problemas y proponer soluciones. Publicación Miscelánea del Instituto de Tecnología Agropecuaria (INTA) Nº 89, 73-74pp. 1998. [ Links ]
11. CALVINHO, L.F.; CANAVESIO, V.R.; AGUIRRE, N. Análisis de leche de tanque de frío. Chacra 843: 70. 2001. [ Links ]
12. CHAMPAGNE, C.P.; LAING, R.R.; ROY, D.; MAFU, A.A. Psychrotrophs in dairy products: Their effects and their control. Crit. Rev. Food Sci. 34(1): 1-30. 1994. [ Links ]
13. CHARLÓN, V.; TAVERNA, M.; CUATRIN, A.; NEGRI, L. Características del agua disponible en las instalaciones de ordeño de tambos ubicados en la cuenca lechera central de la Argentina. Rev. Arg. de Prod. Anim. 21(1): 228. 2001. [ Links ]
14. CHYE, F.Y.; ABDULLAH, A.; AYOB, M.K. Bacteriological quality and safety of raw milk in Malaysia. Food Microbiol. 21: 535-541. 2004. [ Links ]
15. COUSIN, M.A. Presence and activity of psychrotrophic microorganisms in milk and dairy products: a review. J. Food Prot. 45: 172-207. 1982. [ Links ]
16. DESMESURES, N.; BAZIN, F.; GUÉGUEN, M. Microbiological composition of raw milk from selected faros in the Camembert region of Normandy. J. Appl. Microbiol. 83: 53-58. 1997. [ Links ]
17. FRAZIER, W.C.; WESTHOFF, D.C. Contaminación, conservación y alteración de la leche y sus productos. En Microbiología de los Alimentos. Zaragoza, Acribia, 313-342 pp., 1993. [ Links ]
18. GAGGIOTTI, MC; ROMERO, L.A.; COMERÓN, E.A.; WANZENRIED, R.A. Influencia del tipo de forraje y de la higiene preordeño sobre la presencia de clostridios gasógenos en el alimento y en la leche. Rev. Arg. de Prod. Anim. 22(1): 397-398. 2002. [ Links ]
19. GARCÍA-ARMESTO, M.; SUTHERLAND, A.D. Temperature characterization of psychrotrophic and mesophilic Bacillus species from milk. J. Dairy Res. 64: 261-270. 1997. [ Links ]
20. GARDNER, L.A. Testing to Fulfill HACCP (Hazard Analysis Critical Control Points) Requirements: Principles and Examples. J. Dairy Sci. 80: 3453-3457. 1997. [ Links ]
21. HAYES, M.C.; RALYEA, R.D.; MURPHY, S.C.; CAREY, N.R.; SCARLETT, J.M.; BOOR, K.J. Identification and characterization of elevated microbial counts in bulk tank raw milk. J. Dairy Sci. 84: 292-298. 2001. [ Links ]
22. HOLM, C.; JEPSEN, L.; LARSEN, M.; JESPERSEN, L. Predominant microflora of downgraded danish bulk tank milk. J. Dairy Sci. 87: 1151-1157. 2004. [ Links ]
23. HUMBERT, G.; GUNGAMP, M.C.; LINDEN, G. Method for the measurement of lipase activity in milk. J. Dairy Res. 64: 465-469. 1997. [ Links ]
24. INTERNATIONAL COMMISSION ON MICROBIOLOGICAL SPECIFICATIONS FOR FOODS (ICMSF). Microorganismos indicadores. En: Microorganismos de los alimentos. Vol.1 Técnicas de análisis microbiológico. 2da Ed. Acribia, Zaragoza. 3-15 pp. 2000. [ Links ]
25. INTERNATIONAL COMMISSION ON MICROBIOLOGICAL SPECIFICATIONS FOR FOODS (ICMSF). Temperatura. En: Ecología microbiana de los alimentos. Vol. 1: Factores que afectan a la supervivencia de los microorganismos en los alimentos. Acribia, Zaragoza, 15 pp. 1984. [ Links ]
26. INTERNATIONAL COMMISSION ON MICROBIOLOGICAL SPECIFICATIONS FOR FOODS (ICMSF). Leche y productos lácteos. En: Ecología microbiana de los alimentos, Vol. 2: Productos alimenticios. Acribia. Zaragoza, 472-525 pp., 1985. [ Links ]
27. INTERNATIONAL COMMISSION ON MICROBIOLOGICAL SPECIFICATIONS FOR FOODS (ICMSF). El sistema de análisis de riesgos y puntos críticos de control. Acribia, Zaragoza. 335 pp. 1991. [ Links ]
28. INTERNATIONAL DAIRY FEDERATION (FIL-IDF) Milk and milk products. Detection of Salmonella. International Dairy Federation, IDF. Brussels, Belgium Standard 93B:1005. 1995. [ Links ]
29. JAYARAO, B.M.; PILLAI, S.R.; SAWANT, A.A.; WOLFGANG, D.R.; HEGDE, N.V. Guidelines for monitoring bula tank milk somatic cell and bacterial count. J. Dairy Sci. 87: 3561-3573. 2004. [ Links ]
30. JOUVE J.L. Incorporating HACCP into quality systems (ISO 9000) Ecole Nationale V Vétérinaire France. Proc. 11th Inter Symp WAVFH, París, 24-29 oct., 63-67 pp., 1993. [ Links ]
31. LARPENT, J.P. Leche y productos lácteos no fermentados. En: Microbiología alimentaria, Volumen I. Aspectos microbiológicos de la seguridad y calidad alimentaria, por C.M. Burgerois, J.F. Mescle, y J. Zucca (Eds). Zaragoza, Acribia, 209-220 pp. 1994. [ Links ]
32. LAW, B.A. Reviews of the progress of dairy science: Enzymes of psychotrophic bacteria and their effects on milk and milk products. J. Dairy Res. 46: 573-588. 1979. [ Links ]
33. MALDONADO S., E.; MARTÍNEZ H., P.A.; HENSON, S.J.; CASWELL, J.A.; CADENA M., J.A.; COPADO B., F. Costos y beneficios asociados a la implementación de los controles de inocuidad y calidad alimentaria: HACCP e ISO 9000 en los mataderos mexicanos. Rev. Científ. FCV-LUZ XV (4): 353-360. 2005. [ Links ]
34. McKINNON, C.H.; BRAMLEY, A.J.; MORANT, S. An in-line sampling technique to measure the bacterial contamination of milk during milking. J. Dairy Res. 55:33-40. 1988. [ Links ]
35. MICHEL, V.; HAUWUY, A.; CHAMBA, J.F. La flore microbienne de laits crus de vache: diversité et influence des conditions de production. Lait. 81: 575-592. 2001. [ Links ]
36. NEAVES, P.; LANGRIDGE, E.W. Controles analíticos en la elaboración de productos lácteos. En: Tecnología de los productos lácteos de Early, R. (Ed). Zaragoza, Acribia. 335 pp. 2000. [ Links ]
37. NIELSEN, S.S. Plasmin system and microbial protease in milk: Characteristics, roles and relationship. J. Agric. Food Chem. 50: 6628-6634. 2002. [ Links ]
38. MINISTERIO DE ECONOMÍA Y OBRAS Y SERVICIOS PÚBLICOS. SECRETARÍA DE AGRICULTURA, PESCA Y ALIMENTACIÓN. Informe Estadístico de Leche y Productos Lácteos. 92 pp. 1995. [ Links ]
39. MOSSEL, D.A.A.; MORENO, B.; STRUIJK, C.B. Vigilancia o comprobación microbiológica de los alimentos. En: Microbiología de los alimentos. Zaragoza, Acribia, 375 pp. 2003. [ Links ]
40. ORGANIZACIÓN MUNDIAL DE LA SALUD (OMS). Evaluación de ciertos Residuos de Fármacos de uso veterinarios en los Alimentos. 38° Informe del Comité Mixto FAO/OMS de Expertos en Aditivos Alimentarios. Serie de Informes Técnicos N° 815. OMS, Ginebra. 67 pp. 1991. [ Links ]
41. PESSOT, H.; ROSMINI, M.R.; SEQUEIRA, G.J.; MARTÍ, L.E.; FRIZZO, L.; BONAZZA, J.; DALLA S., R. Buenas Prácticas de Manipulación en la producción primaria de leche. Parte 2. Tecnol. Láct. Latinoam. 33: 27-30. 2004. [ Links ]
42. REVELLI, G.R.; RODRÍGUEZ, C.G. Prevalencia de agentes etiológicos causales de mastitis bovina en la zona noroeste de Santa Fe y sur de Santiago del Estero. Respuesta a la sensibilidad antimicrobiana. Tecnol Láct Latinoam. 23: 48-53. 2001. [ Links ]
43. REVELLI, G.R.; SBODIO, O.A.; TERCERO, E.J. Recuento de bacterias totales en leche cruda de tambos que caracterizan la zona nor-oeste de Santa Fe y sur de Santiago del Estero. Rev. Arg. de Microbiol. 36: 145-149. 2004. [ Links ]
44. ROBINSON, R. Dairy Microbiology. The microbiology of milk. Vol. 1 Ed. Elsevier Applied Sci. 301 pp. 1990. [ Links ]
45. ROSMINI, M.R.; SIGNORINI, M.L.; SCHNEIDER, R.; BONAZZA, J.C. Evaluation of two alternative techniques for counting mesophilic aerobic bacteria in raw milk. Food Contr. 15:39-44. 2004. [ Links ]
46. RUEGG, P.L.; REINEMANN, D.J. Milk quality and mastitis test. Bovine Prac. 36: 41-54. 2002. [ Links ]
47. SBODIO, O.A.; MINETTI, M.L.; TERCERO, E.J. Proteólisis en leche destinada a la elaboración de quesos. Rev. Intern. del Centro de Inform. Tecnol. (CIT). Chile, 10: 109-117. 1999. [ Links ]
48. SERVICIO NACIONAL DE SANIDAD ANIMAL. Manual de procedimientos aplicación del sistema HACCP análisis de riesgo y puntos críticos de control. Buenos Aires, 62 pp. 1996. [ Links ]
49. SIGNORINI, M.L.; SEQUEIRA, G.J.; BONAZZA, J.C.; DALLA S., R.; OTERO, J.L.; ROSMINI, M.R. Variación estacional en los principales indicadores de higiene en leche cruda de un tambo de la cuenca central. Rev. FAVE-Cien. Vet. 2:97-110. 2003. [ Links ]
50. STEEL, R.G.; TORRIE, J. H. Bioestadística, Principios y Procedimientos. 2da Ed. Editorial Mc Graw Hill / Interamericana de México S.A. 662 pp. 1998. [ Links ]
51. SUHREN, G. Producer microorganisms. In: Enzymes of psychrotrophs in raw foods. R.C. McKELLAR (Ed), CRC Press, Inc. 3 pp. 1989. [ Links ]
52. TAVERNA, M; CALVINHO, L. Calidad de leche. Dónde estamos parados? Infortam. 127: 74-78. 1999. [ Links ]
53. TAVERNA, M.; CALVINHO, L.F.; CANAVESIO, V.R.; NEGRI, L.; PÁEZ, R.; CARLÓN, V.; CUATRIN, A. Caracterización de la calidad higiénico sanitaria de la leche producida en la cuenca lechera central de la Argentina. Rev. Arg. de Prod. Anim. 21(1): 270. 2001. [ Links ]












 uBio
uBio