Revista Científica
versión impresa ISSN 0798-2259
Rev. cient. (Maracaibo) v.20 n.5 Maracaibo ene. 2010
CONCENTRACIONES PLASMÁTICAS DE LAS HORMONAS ESTEROIDES Y DE LH EN RESPUESTA A LA ADMINISTRACIÓN DE PROSTAGLANDINAS EN OVEJAS BERGAMACIA
Plasmatics Concentrations of Steroidals Hormones and LH in Response to the Administration of Prostaglandins in Bergamacia Sheep
Luis Fernando Uribe-Velásquez 1*, Miryam Vélez-Marín 2 y Adriana Correa-Orozco 2
1 Departamento de Salud Animal, Universidad de Caldas. AA 275, Manizales, Caldas, Colombia
2 Programa de Maestría en Ciencias Veterinarias, Facultad de Ciencias Agropecuarias, Universidad de Caldas, Manizales, Caldas, Colombia. *(6) 8781516, E-mail: lfuribe@ucaldas.edu.co
RESUMEN
Las concentraciones de progesterona (P4), estradiol (E2) y hormona luteinizante (LH) fueron evaluadas durante el estro sincronizado con prostaglandina-PGF2 (PG) en ovejas Bergamacia. Las ovejas fueron distribuidas en dos grupos (n=7/grupo): grupo 1, sincronizado con dos inyecciones de PG a intervalo de 7 días, y grupo 2, las hembras presentando estro natural. Las muestras de sangre fueron colectadas antes de la PG y durante todo el experimento para determinar esteroides. Para LH, fueron colectadas muestras de sangre en los días uno, seis y 12 del ciclo estral, durante 8 horas a intervalos de 30 minutos para definir su amplitud y frecuencia. Las concentraciones hormonales fueron determinadas por radioinmunoanálisis. Hubo diferencia significativa en las concentraciones plasmáticas de P4 entre los grupos (P<0,001), entre los días (P<0,0001) y en la interacción grupo versus día (P<0,05). Las concentraciones circulantes de P4 alcanzaron su valor máximo en el día 11 (3,01 ± 0,48 ng/mL) para T1 y en el día octavo (4,49 ± 0,45 ng/mL) para T2. Las concentraciones plasmáticas basales de LH en el día 12 fueron diferentes (P<0,05) en T1 (2,45 ± 0,70 ng/mL) cuando comparado con T2 (0,95 ± 0,17 ng/mL). La amplitud de los pulsos de LH presentó una diferencia significativa entre grupos en el sexto día (P<0,01), siendo de 2,29 ± 0,33 ng/mL para T1 y de 1,49 ± 0,34 ng/mL para T2. La frecuencia de los pulsos de LH fue diferente (P<0,05) entre los dos grupos en el sexto día. Se concluye que el uso de PGF2 puede modificar las concentraciones plasmáticas de P4, las cuales pueden tener un efecto sobre la frecuencia pulsátil de LH.
Palabras clave: Ciclo estral, estradiol, LH, oveja, progesterona, RIA, sincronización.
ABSTRACT
Progesterone (P4), estradiol (E2) and luteinizing hormone (LH) concentrations during synchronized estrous cycle using prostaglandin (PGF2 ) in sheep were studied. Ewes were randomly divided in two groups (n=7/group): T1 synchronized with two injections of PG, given 7 days apart, and T2, female showing natural estrous. Blood samples were collected from one day before PG and during experiment for steroidal determination. For profile of luteinizing hormone (LH) pulses, blood samples were collected at 30-min intervals for a period of 8h on days one, six and 12. Hormonal concentrations were determined by radioimmunoassay. Mean concentrations of P4 (P<0.001) were different between groups, days (P<0.0001) and interaction treatment x day. In T1 and T2, the animals showed increases in P4 plasma concentrations on day 11 (3.01 ± 0.48 ng/mL) and day eight (4.49 ± 0.45 ng/mL), respectively. Mean plasma LH concentration was different on day 12 (P<0.05) among T1 (2.45 ± 0.70 ng/mL) and T2 (0.95 ± 0.17 ng/mL). The LH pulse amplitude on day six (P<0.01) differed between the two groups, for T1 was 2.29 ± 0.33 ng/mL and T2 was 1.49 ± 0.34. Differences in LH pulse frequency on day six (P<0.05) were observed. These data suggest that use of PGF2 alters plasma concentrations of P4 and it could reduce LH pulse frequency.
Key words: Estrous cycle, estradiol, LH, sheep, progesterone, RIA, synchronization.
Recibido: 10 / 09 / 2009. Aceptado: 16 / 04 / 2010.
INTRODUCCIÓN
La glándula hipófisis anterior secreta los pulsos de la hormona luteinizante (LH) en respuesta a la hormona liberadora de gonadotrofinas (GnRH) la cual es liberada al flujo porta-hipofisiario por el hipotálamo [14]. Los mecanismos nerviosos que modulan la liberación pulsátil de la secreción de GnRH, que a su vez, inducen los pulsos secretorios de LH, presentan un papel importante en el mantenimiento de la ciclicidad. La frecuencia de los pulsos de GnRH/LH es más elevada en la fase folicular que durante la fase luteal, aumento que contribuye para el desarrollo folicular ovárico [35]. Los cambios en frecuencia y amplitud de los pulsos son, principalmente, un reflejo de la intensa acción de los esteroides sexuales [14]. Han sido mostradas evidencias en la oveja (Ovis aries) referentes al efecto de los esteroides en el control de LH, siendo que, la progesterona (P4) tiene su principal acción en el hipotálamo disminuyendo la frecuencia, a la vez que aumenta la amplitud de los pulsos de LH; el estradiol (E2) actúa en la hipófisis, disminuyendo la amplitud de los pulsos sin afectar su frecuencia [15].
Las hembras ovinas exhiben dos modelos de secreción de LH: un modelo tónico continuo a través del ciclo estral que controla las actividades folicular y luteal; y un segundo modelo, con el pico de LH pre-ovulatorio induciendo ovulación y luteinización [23]. Asimismo, estudios desarrollados por Karsch y col. [19] en animales ovariectomizados, reportaron que la P4 parece ejercer una potente inhibición de la secreción tónica de LH en ovejas.
Los tratamientos hormonales para el control del estro y de la ovulación permiten inducir y sincronizar el momento de la aparición del estro en las hembras cíclicas [2]. Una alternativa para la sincronización del estro es el uso de la prostaglandina F2 (PGF2 ), factor luteolítico que provoca la regresión del cuerpo lúteo e interrupción de la fase progestacional del ciclo estral [3, 16], iniciando un nuevo ciclo en muchas especies, incluidas la bovina (Bos taurus-indicus), caprina (capra hircus) y ovina [11]. Gonzales-Bulnes y col. [13] proponen que la inducción de la luteólisis durante el ciclo estral natural puede ser usada como método para la sincronización del estro en técnicas de asistencia reproductiva en ovejas. El objetivo principal del presente trabajo fue determinar el efecto de la sincronización con prostaglandina F2 sobre las hormonas esteroides y LH en hembras ovinas Bergamacia, comparadas con animales presentando estro natural.
MATERIALES y MÉTODOS
El trabajo experimental fue desarrollado en el Departamento de Reproducción Animal y Radiología Veterinaria de la Facultad de Medicina Veterinaria y Zootecnia/UNESP-Botucatu, São Paulo, Brasil. El municipio de Botucatu se localiza a 22° 31 latitud Sur y 48° 15 longitud Oeste, en altitud de 804 m [8]. El clima es clasificado como tropical de altitud [28], con temperatura media de 20,7°C y precipitación pluviométrica anual de 1.358, 6 mm [8]. Fueron utilizadas 14 hembras ovinas adultas pertenecientes a la raza Bergamacia, durante la estación reproductiva, con peso corporal de 60,42 ± 8,16 kg; las ovejas con edades comprendidas entre los dos a cinco años, habían sido previamente examinadas en cuanto al estado clínico general, sanitario y reproductivo. Los animales permanecieron en boxes de 3x3 m, con luminosidad natural; mantenidas con un macho vasectomizado, para observación del estro, dos veces por día durante dos horas. Las hembras ovinas fueron sometidas a un período pre-experimental de cuatro meses, para adaptación a la alimentación, y a la estabulación. Después de ese lapso fueron pesadas y distribuidas en dos grupos experimentales.
La alimentación consistió de una ración concentrada (13,28% de proteína bruta y 8,99% de fibra bruta) y heno de Cynodon dactylon (L.) Pers. cv Coast Cross (4,98% de proteína bruta y 35,88% de fibra bruta, en la materia seca). Los animales recibieron 1 kg/cabeza/día de ración concentrada y 2 kg/cabeza/día de heno, con disponibilidad ad libitum de mezcla mineral y agua.
Los animales fueron distribuidos al azar en dos grupos: grupo 1 (n=7), sincronizado con dos dosis de un análogo de prostaglandina (125 µg; Ciosin®, Mallinckrodt Veterinary, São Paulo, Brasil) con intervalo de 7 días, durante la mitad de la fase luteal; grupo 2 control (n=7), presentando estro natural. Desde el día anterior a la aplicación de la PGF2 hasta la siguiente ovulación (período interovulatorio), las ovejas se monitorearon por medio de un ecógrafo (SSD-500; Aloka Co. Ltda, Japón) con un transductor lineal prostático humano de 7,5 Mhz (Modelo UST-660-7,5; Aloka Co. Ltda, Japón). El día de la ovulación fue definido como el momento de desaparición del mayor folículo ( 5 mm) [5]. En todas las ovejas, por la mañana (8h), se colectaron muestras de sangre por venopunción yugular, antes de la aplicación de la prostaglandina y durante todo el período experimental para la determinación de las hormonas esteroides.
Para la LH fueron colectadas muestras en los días uno, seis y 12 del ciclo estral (inicio, mitad y final de la fase luteal), durante 8 horas a intervalos de 30 minutos, para definir la amplitud y la frecuencia de esta hormona [22]. Las muestras de sangre se colectaron en tubos heparinizados; inmediatamente después fueron centrifugadas a 1.000 x g durante 15 minutos (Centrifuga de Bancada Baby®I Modelo 206 BL, Fanem®, Brasil), y el plasma almacenado a -20°C (Freezer Vertical - modelo 349 FV, Fanem®, Brasil), para posterior determinación de las hormonas esteroides (P4y E2) y de LH utilizando la técnica de radioinmunoanálisis (RIA). La determinación de la concentración de P4 fue realizada con la técnica definida por Lafrance & Goff [20] modificada en la extracción que fue intercambiada por danazol [24] y en la separación del doble anticuerpo que fue sustituida por charcol. La sensibilidad del ensayo fue de 0,01 ng/mL. Los coeficientes de variación intra e inter-ensayo, fueron, respectivamente, de 9 y 12%.
Para establecer las concentraciones de E2 fueron utilizados kits comerciales Coat-A-Count (Diagnostic Products Corporation, Los Angeles, CA, EUA) en fase sólida, en contador gama Cobra. La sensibilidad del ensayo fue de 8 pg/mL. Los coeficientes de variación intra e inter-ensayo para el E2 fueron de 19 y 22%, respectivamente. La concentración de LH fue determinada mediante el uso del doble anticuerpo, siguiendo la metodología de Price y col. [26]. La sensibilidad del ensayo fue de 0,2 ng/mL, y los coeficientes de variación intra-ensayo para valores bajos y altos de LH fue de 4 y 14%, respectivamente. La significancia de los efectos de los grupos en las concentraciones plasmáticas de P4 y E2 fueron determinados por el análisis de medidas repetidas utilizando el programa Statistical Analysis System [30]. Para las concentraciones basales y amplitud de LH se utilizaron las medidas repetidas. Para la variable pulsos de LH (8 horas), los datos se transformaron y se utilizaron las pruebas no paramétricas [30]. Para los efectos fijos (grupo, día, grupo x día) se utilizó el test F [30], y para las comparaciones múltiples de las medias el test de Tukey-Kramer [21].
RESULTADOS Y DISCUSIÓN
Una oveja del grupo sincronizado fue excluida del trabajo por presentar cuerpo lúteo (CL) de vida corta. En todas las hembras ovinas sincronizadas fue observado mediante ecografía al menos un cuerpo lúteo en la mitad de la fase luteal, que sufrió regresión en respuesta a la dosis luteolítica del análogo de prostaglandina (cloprostenol), lo cual fue constatado por las bajas concentraciones plasmáticas de P4. El día de la ovulación fue definido como el día cero.
Las concentraciones plasmáticas de P4 (media ± DE) en los grupos experimentales se muestran en la FIG 1. Se observó diferencias significativas (P<0,001) en las concentraciones plasmáticas de P4 entre los grupos. También se evidenciaron diferencias significativas en los días (P<0,0001) y en la interacción grupo vs día (P<0,05). Los valores de las concentraciones plasmáticas de P4 antes de la ovulación en el presente experimento, estuvieron de acuerdo con reportados por Scaramuzzi y col. [31] y Amiridis y col. [3], quienes observaron valores menores de 1 ng/mL durante la fase folicular.

Las hembras ovinas que presentaron ciclo estral natural mostraron concentraciones circulantes de P4 bajas en el día de la ovulación (0,27 ± 0,45 ng/mL), aumentando progresivamente hasta el octavo día (4,49 ± 0,45 ng/mL). Después fueron observadas algunas oscilaciones hasta alcanzar su más bajo nivel en el día 16 (0,75 ± 0,45 ng/mL).
En el grupo sincronizado con la PGF2 , los animales presentaron concentraciones más bajas de P4 cuando fueron comparados con el grupo del ciclo natural. Así, las concentraciones se mantuvieron bajas desde el día de la ovulación (día cero) hasta el tercer día (0,73 ± 0,48 ng/mL). Después fueron observados aumentos significativos en los días cuatro (2,55 ± 0,48 ng/mL) y 11 (3,01 ± 0,48 ng/mL) similar a lo reportado por Uribe-Velásquez y col. [36]. En este grupo experimental, el uso de PGF2 (cloprostenol) puede haber modificado las concentraciones plasmáticas de P4. Al respecto, Cárdenas y col. [7] reportaron que en ovejas la formación del cuerpo lúteo es más lenta en animales sincronizados con la PGF2 en comparación con animales cíclicos naturales. Posiblemente, el corto intervalo desde el inicio de la luteólisis hasta la manifestación del estro en animales tratados con la PGF2 , puede comprometer la dinámica de los folículos en crecimiento y su respuesta al incremento de las gonadotrofinas y al grado de maduración folicular.
Según Colazo y col. [9], las prostaglandinas provocan la regresión luteal por actuar a través de los receptores de las células luteales grandes y de las células endoteliales del cuerpo lúteo. Por tanto, la administración de PGF2 resulta primero en una disminución del tamaño de las células luteales grandes y luego en una disminución en el número de las células pequeñas, las cuales presentan receptores para LH, con la consecuente disminución en la producción de P4. Juengel y col. [18], demostraron que dosis relativamente bajas de PGF2 pueden provocar la apoptosis de las células capilares luteales, reduciendo las concentraciones de mRNAs y de P4 circulante nueve horas después de su administración.
Los perfiles de las concentraciones de E2 plasmático (media ± DE) en los grupos experimentales son presentados en la FIG 2. Las concentraciones de E2 en el plasma no fueron diferentes entre los grupos del ciclo sincronizado y del ciclo natural antes de la ovulación, presentando un pico en el día –2 de 15,02 ± 1,19 y 13,74 ± 1,11 pg/mL, disminuyendo luego en el día –1 a valores de 10,25 ± 1,19 y 9,92 ± 1,11 pg/mL, respectivamente. Aumentos en las concentraciones plasmáticas de E2 antes de la ovulación fueron encontrados también por Ravindra y col. [27]. Por el contrario, en ovejas de la raza Manchega tratadas con dos dosis de cloprostenol con 10 días de intervalo, los niveles de estradiol durante la fase folicular aumentaron de 1,4 ± 0,4 pg/mL en el día -2,5 a 2,5 ± 0,3 pg/mL en el día de la detección del estro (día cero) [13].
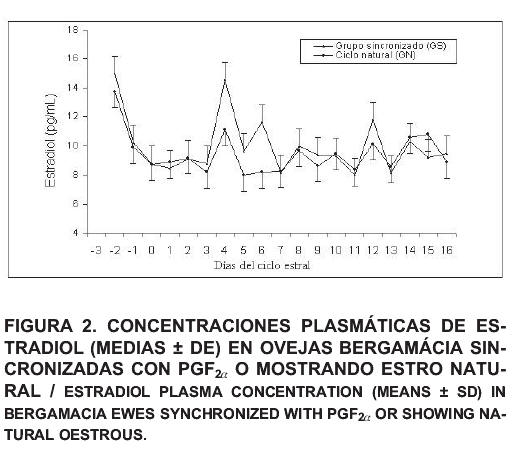
Las hembras ovinas del ciclo natural mostraron un patrón de secreción promedio de 8,75 ± 1,11 pg/mL en el día de la ovulación, con dos aumentos en los días cuatro (11,12 ± 1,11 pg/mL) y 15 (10,80 ± 1,11 pg/mL) del ciclo estral (dia cero = ovulación); indicando una diferencia estadística (P<0,0001) entre los días, durante la fase luteal del ciclo estudiado, lo que refleja posiblemente un incremento en la actividad folicular. En el grupo sincronizado con la PGF2, fueron verificados dos aumentos significativos en los días cuatro y 12, con valores de 14,56 ± 1,19 y 11,78 ± 1,19 pg/mL, respectivamente.
Las concentraciones de E2 aumentaron después de la regresión luteal en asociación con el crecimiento del folículo dominante. También fue reportado por Schrick y col. [32], una primera elevación de la concentración de E2 plasmático en los días tres al ocho; al igual que Baird y col. [4] que describieron aumentos significativos en los días seis al nueve del ciclo estral, los cuales estarían ligados estrechamente al desarrollo de las ondas de crecimiento folicular. Por otro lado, Schrick y col. [32] demostraron otros dos elevaciones significativos en los días seis al nueve, y 11 al 15, sugiriendo que pueden ser constatados tres aumentos significativos en las concentraciones plasmáticas de E2 durante la fase luteal del ciclo estral ovino. Este mecanismo también fue observado por Campbell y col. [6], los cuales indicaron que el incremento de E2 en la sangre después de la luteólisis puede ser atribuido en parte, a los efectos directos de LH en su secreción durante la fase luteal, sumado la emergencia de folículos grandes estrogénicos en las 10 horas siguientes a la inducción de la luteólisis.
Las concentraciones sanguíneas de E2 luego de la liberación espontánea de prostaglandinas o de su administración pueden afectar la luteólisis. Según Colazo y col. [9], las concentraciones circulantes de E2, que están relacionadas con el desarrollo folicular, pueden no solo afectar la disminución en las concentraciones plasmáticas de P4, sino también las respuestas del cuerpo lúteo a la administración de las diferentes dosis de PGF2 . Los estudios de Hixon y col. [17] habían señalado que las concentraciones de E2 pueden afectar la luteólisis, lo que fue evidenciado cuando los folículos ováricos en hembras ovinas fueron eliminados por irradiación directa.
La fase de crecimiento folicular está directamente interrelacionada con las concentraciones de las hormonas esteroides, lo que fue resaltado por Evans y col. [10] en novillas. Estos autores observaron que las hembras con un folículo grande presente (13-16 mm) en el momento del tratamiento con cloprostenol, presentaron una leve declinación en las concentraciones de P4 en las 24 horas siguientes del tratamiento, sugiriendo que el folículo dominante de estas hembras fue menos estrógeno-activo. Novillas mostrando un número elevado de folículos pequeños (5-8 mm) o medios (9-12 mm) en el momento de la administración del cloprostenol, es posible que secreten una mayor cantidad de E2, lo que resulta en una disminución significativa de las concentraciones de P4, en el mismo período de tratamiento.
Según Sangha y col. [29], la PGF2 posiblemente reduce la habilidad potencial del CL para producir P4, ya sea actuando directamente en las células luteales o indirectamente por sus efectos en la irrigación vascular ovárica. Los patrones de comportamiento de las concentraciones plasmáticas de E2 observados en la presente investigación, están estrechamente ligados a los cambios de la población folicular durante el ciclo estral, lo que también pudiera estar relacionado con la variación de los niveles de la estimulación gonadotrófica.
Las medias ± desviación estándar de las concentraciones basales (ng/mL), la amplitud de los pulsos (ng/mL) y la frecuencia de los pulsos (pulsos/8 horas) de LH son presentadas en la TABLA I. Las concentraciones plasmáticas basales de LH en el primer día del ciclo estral (día cero = ovulación) no fueron diferentes entre los grupos control y sincronizado, siendo respectivamente, de 1,42 ± 0,35 y 2,21 ± 0,59 ng/mL. Igualmente, no se verificaron diferencias en el sexto día del ciclo estral entre los grupos estudiados, con valores de 2,96 ± 0,91 y 2,29 ± 0,50 ng/mL, para el ciclo natural y sincronizado, respectivamente. En el día 12 del ciclo estral fueron observadas diferencias significativas (P<0,05) entre el grupo control (0,95 ± 0,17 ng/mL) y el grupo sincronizado (2,45 ± 0,70 ng/mL).

Las concentraciones plasmáticas de LH se mantuvieron bajas después de la ovulación y durante la fase luteal del ciclo estral, concordando con los valores descritos por Smith y col. [33] y muy aproximados a los obtenidos por Martin y col. [23].
En la literatura consultada se encontraron evidencias del control de LH en la oveja, mostrando que la P4 tiene su principal acción sobre el hipotálamo, disminuyendo la secreción tónica y la frecuencia de los pulsos de LH. En ese sentido, la diferencia significativa observada en la descarga de LH en el día 12 del ciclo y entre los días en los animales del ciclo estral natural (control), puede ser explicada por las mayores concentraciones de P4 observadas en ese grupo.
La secreción tónica de LH representa un papel importante en el control reproductivo en las hembras ovinas. Durante el anestro, los patrones de desarrollo folicular son semejantes a los encontrados durante la estación reproductiva, por lo cual la principal causa de anovulación durante el anestro puede ser atribuida a deficiencias en la secreción tónica de LH y a una menor respuesta ovárica [1].
La amplitud de los pulsos de LH (ng/mL) no fue diferente entre los grupos natural y sincronizado en el primer día del ciclo estral, siendo respectivamente, 1,16 ± 0,33 y 1,06 ± 0,34 ng/mL. De la misma forma, en el día 12 del ciclo estral la amplitud de los pulsos no difirió entre el grupo control (1,30 ± 0,33 ng/mL) y el grupo sincronizado con la PGF2 (1,73 ± 0,34 ng/mL). Sin embargo, los grupos presentaron una diferencia (P<0,01) en el sexto día del ciclo estral que varió entre 1,49 ± 0,34 ng/mL para el grupo control y 2,29 ± 0,33 ng/mL para el grupo sincronizado.
Los cambios observados en la amplitud de los pulsos son, principalmente, un reflejo de la intensidad de los esteroides sexuales [14]. En el presente trabajo se observó la disminución de la amplitud de los pulsos en el sexto día del ciclo estral en animales en estro natural, efecto que puede ser el resultado del sinergismo existente entre la P4 y el E2, provocando cambios significativos en la amplitud de la hormona. La amplitud de la secreción de los pulsos de LH depende también de la estación, ya que los efectos inhibitorios de una dosis de prostaglandina son más bajos durante la estación reproductiva que en la época anestral. Esa respuesta del E2 durante la estación reproductiva es restaurada en ovejas ovariectomizadas cuando fueron tratadas con P4, explicando así, la acción sinérgica de estas dos hormonas esteroidales.
Entre los factores que afectan la frecuencia de los pulsos, además del feedback positivo y negativo de los esteroides gonadales, podemos citar la fase del ciclo reproductivo y el ambiente, la nutrición, los feromonas y el fotoperiodo [34]. En este trabajo, la frecuencia de los pulsos de LH (pulsos/8 horas) fue estadísticamente diferente (P<0,05) entre los dos grupos de animales en el sexto día del ciclo estral, siendo para el control de 0,14 ± 0,14 pulsos/8 horas y para el sincronizado de 0,71 ± 0,18 pulsos/8 horas. Esta variación pudiera estar relacionada con las concentraciones plasmáticas de P4 en la frecuencia pulsátil de LH y asociada también a las concentraciones plasmáticas de E2. Según Girmus y Wise [12] las hormonas esteroides ováricas pueden suprimir la secreción de LH, ya sea por la disminución de la secreción de GnRH del hipotálamo o indirectamente al reducir a respuesta de las gonadotrofinas al GnRH. En ese sentido, existe una clara evidencia en los rumiantes, en donde la P4 inhibe la frecuencia de los pulsos de LH y el E2 actúa principalmente inhibiendo la amplitud de los pulsos de LH, a pesar de que pueda ocurrir una cierta sinergia entre esas dos hormonas [25].
CONCLUSIONES
Los datos obtenidos en este estudio sugieren que la sincronización con PGF2 puede modificar las concentraciones plasmáticas de P4, las cuales pueden tener un efecto sobre la frecuencia pulsátil de LH.
REFERENCIAS BIBLIOGRÁFICAS
1. ABDENNEBI, L.; LESPORT, A.S.; REMY, J.J.; GREBERT, D.; PISSELET, C.; MONNIAUX, D.; SALESSE, R. Differences in splicing of mRNA encoding LH receptor in theca cells according to breeding season in ewes. Reprod. 123:819-826. 2002. [ Links ]
2. AISEN, E.G. Reproducción ovina y caprina. En: Figuerêdo, V., Rubianes, E. (Eds). Preparación de las hembras. Detección y control del estro y la ovulación, 1ª Ed. Inter-Médica S.A.I.C.I., Buenos Aires, Pp. 87-98. 2004.
3. AMIRIDIS, G.S.; VALASI, I.; MENEGATOS, I. Luteal stage dependence of pituitary response to gonadonotrophin-releasing hormone in cyclic dairy ewes subjected to synchronization of ovulation. Reprod. Fert. Develop. 17:769-774. 2005. [ Links ]
4. BAIRD, D.T.; LAND, R.B.; SCARAMUZZI, R.J.; WHEELER, A.G. Endocrine changes associated with luteal regression in the ewe: the secretion of ovarian oestradiol, progesterone and androstenedione and uterine prostaglandin F2 through the oestrus cycle. J. Endocrinol. 69:275-286. 1976. [ Links ]
5. BARRETT, D.M.W.; BARTLEWSKI, P.M.; BATISTAARTEAGA, M.; SYMINGTON, A.; RAWLINGS, N.C. Ultrasound and endocrine evaluation of the ovarian response to a single dose of 500 IU of eCG following a 12-day treatment with progestogen-releasing intravaginal sponges in the breeding an nonbreeding seasons in ewes. Theriogenol. 61:311-327. 2004. [ Links ]
6. CAMPBELL, B.K.; MANN, G.E.; McNEILLY, A.S.; BAIRD, D.T. Pulsatile secretion of inhibin, oestradiol and androstenedione by the ovary of the sheep during the oestrus cycle. J. Endocrinol. 126:385-393. 1990. [ Links ]
7. CÁRDENAS, H.; McCLURE, K.E.; POPE, W.F. Luteal function and blatocyst development in ewes following treatment with PGF2 and GnRH. Theriogenol. 40: 856-872. 1993. [ Links ]
8. CEPAGRI - Centro de Pesquisas Meteorológicas e Climáticas Aplicadas à Agricultura. Clima dos Municípios Paulistas. 2010. En línea: http://www.cpa.unicamp.br/outras-informacoes/clima_muni_086.html . 15-03-10. [ Links ]
9. COLAZO, M.G.; MARTÍNEZ, M.F.; KASTELIC, J.P.; MAPLETOFT, R.J. Effects of dose and route of administration of cloprostenol on luteolysis, estrus and ovulation in beef heifers. Anim. Reprod. Sci. 72:47-62. 2002. [ Links ]
10. EVANS, A.C.O.; KOMAR, C.M.; WANDJI, S.A.; FORTUNE. J.E. Changes in androgen secretion and luteinizing hormone pulse amplitude are associated with the recruitment and growth of ovarian follicle during the luteal phase of the bovine estrous cycle. Biol. Reprod. 57:394-401. 1997. [ Links ]
11. GINTHER, O.J.; ARAUJO, R.R.; PALHÃO, M.P.; RODRIGUES, B.L.; BEG, M.A. Necessity of sequential pulses of prostaglandin F2alpha for complete physiologic luteolysis in cattle. Biol. Reprod. 80:641-648. 2009. [ Links ]
12. GIRMUS, R.L.; WISE, M.E. Progesterone directly inhibits pituitary luteinizing hormone secretion in an estradioldependent manner. Biol. Reprod. 46:710-714. 1992. [ Links ]
13. GONZÁLEZ-BULNES, A.; VEIGA-LÓPEZ, A.; GARCÍA, P.; GARCÍA-GARCÍA, R.M.; ARIZNAVARRETA, C.; SÁNCHEZ, M.A.; TRESGUERRES, J.A.F.; COCERO, M.J.; FLORES, J.M. Effects of progestagens and prostaglandin analogues on ovarian function and embryo viability in sheep. Theriogenol. 63:2523-2534. 2005. [ Links ]
14. GOODMAN, R.L.; KARSCH, F.J. Pulsatile secretion of luteinizing hormone: Differential suppression by ovarian steroids. Endocrinol. 107:1286-1290. 1980. [ Links ]
15. GOODMAN, R.L.; BITTMAN, E.L.; FOSTER, D.L.; KARSCH, F.J. Alterations in the control of luteinizing hormone pulse frequency underlie the seasonal variation in estradiol negative feedback in the ewe. Biol. Reprod. 27:580-589. 1982. [ Links ]
16. HERRERA, H.L.; FELDMAN, S.D.; ZARCO, Q.L. Evaluación del efecto luteolítico de la prostaglandina F2 alfa en diferentes días del ciclo estral de la borrega. Vet. Mex. 21:143-147. 1990. [ Links ]
17. HIXON, J.E.; GENGENBACH, D.R.; HANSEL, D.R. Failure of prostaglandin F2 to cause luteal regression in ewes after destruction of ovarian follicles by X-irradiation. Biol. Reprod. 13:126-135. 1975. [ Links ]
18. JUENGUEL, J.L.; HAWORTH, J.D.; ROLLYSON, M.K.; SILVA, P.J.; NISWENDER, G.D. Effect of dose of protaglandin F2 on steroidogenic components and oligonucleosomes in ovine luteal tissue. Biol. Reprod. 62:1047-1051. 2000. [ Links ]
19. KARSCH, F.J.; LEGAN, S.J.; HAUGER, R.L.; FOSTER, D.L. Negative feedback action of progesterone on tonic luteinizing hormone secretion in the ewe: Dependence on the ovaries. Endocrinol. 101:800-806. 1977. [ Links ]
20. LAFRANCE, M.; GOFF, A.K. Effect of pregnancy on oxytocin-induced release of prostaglandin F2a in heifers. Biol. Reprod. 3:1113-1119. 1985. [ Links ]
21. LATOUR, D.; LITTELL, R. Advanced general linear models with an emphasis on mixed models. Version 6.12 Cary: Statistical Analysis System Institute. 268 pp. 1996. [ Links ]
22. LEYVA, V.; BUCKRELL, B.C.; WALTON, J.S. Regulation of follicular activity and ovulation in ewes by exogenous progestagen. Theriogenol. 50:395-416. 1998. [ Links ]
23. MARTIN, G.B.; THOMAS, G.B.; TERQUI, M.; WARNER, P. Pulsatile LH secretion during the preovulatory surge in the ewe: experimental observations and theoretical considerations. Reprod. Nutr. Develop. 27:1023-1040. 1987. [ Links ]
24. McGINLEY, R.; CASEY, J.H. Analysis of progesterone in unextrated serum; a method using danazol (17 a-preg- 4-en-20-yno (2,3) isoxasol-17-ol) a bloker of steroid binding to proteins. Steroids. 33:127-138. 1979. [ Links ]
25. PRICE, C.A. Secreçao pulsátil de LH alterada durante a superovulação em bovinos. Arq. Fac. Vet. 27:35-53. 1999. [ Links ]
26. PRICE, C.A.; MORRIS, B.A.; WEBB, R. Reproductive and endocrine effects of active immunization against a testosterone conjugate in the heifer. J. Reprod. Fert. 81:149-160. 1987. [ Links ]
27. RAVINDRA, J.P.; RAWLINGS, N.C.; EVANS, A.C.O. Ultrasonographic study of ovarian follicular dynamics in ewes during the estrous cycle. J. Reprod. Fertil. 101:501-509. 1994. [ Links ]
28. ROSS, J.L.S. Geografia do Brasil. Capitulo 2. En: Conti, J.B., Furlan, S.A. (Eds) Geoecologia: O Clima, os Solos e a Biota, 5ª Ed. Editora da Universidade de São Paulo, São Paulo, Pp. 100-108. 2005. [ Links ]
29. SANGHA, G.K.; SHARMA, R.K.; GURAYA, S.S. Biology of corpus luteum in small ruminants. Small Rum. Res. 43:53-64. 2002. [ Links ]
30. STATISTICAL ANALYSIS SYSTEM INSTITUTE (SAS). Users Guide: Statistics version 5. Cary, NC, USA. 1985. [ Links ]
31. SCARAMUZZI, R.J.; ADAMS, N.R.; BAIRD, D.T.; CAMPBELL, B.K.; DOWNING, J.A.; FINDLAY, J.K.; HENDERSON, K.M.; MARTIN, G.B.; McNATTY, K.P.; McNEILLY, A.S.; TSONIS, C.G. A model for follicle selection and the determination of ovulation rate in the ewe. Reprod. Fert. Dev. 5:459-478. 1993. [ Links ]
32. SCHRICK, F.N.; SURFACE, R.A.; PRITCHARD, J.Y.; DAILEY, R.A.; TOWNSEND, E.C.; INSKEEP, E.K. Ovarian structures during the estrous cycle and early pregnancy in ewes. Biol. Reprod. 9:1133-1140. 1993. [ Links ]
33. SMITH, J.F.; BRIGGS, R. M.; PARR, J.; JOHNSON, D. L.; DUGANZICH, D. M. Seasonal changes in LH profiles of ewes selected for and against an early lambing date. 1995. New Zealand Society of Animal Production. On Líne: http://www.nzsap.org.nz/proc/1995/ab95072.html . 19-03-2010. [ Links ]
34. THIÉRY, C.; MARTIN, G.B. Neurophysiological control of the secretion of gonadotrophin-releasing hormone and luteinizing hormone in sheep - A review. Reprod. Fert. Dev. 3:137-173. 1991. [ Links ]
35. TSUKAMURA, H. Neuroedocrine mechanism regulating luteinizing hormone secretion during periovulatory period: Negative and positive feedback actions of estrogen in the brain. J. Reprod. Dev. 44:80-90. 1998. [ Links ]
36. URIBE-VELÁSQUEZ, L.F.; OBA, E.; SOUZA, M.I.L. Población folicular y concentraciones plasmáticas de progesterona (P4) en ovejas sometidas a diferentes protocolos de sincronización. Arch. Med. Vet. 40:83-88. 2008. [ Links ]












 uBio
uBio 
