Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Zootecnia Tropical
versión impresa ISSN 0798-7269
Zootecnia Trop. v.24 n.1 Maracay mar. 2006
Cambios físicos-químicos y microbiológicos observados durante el proceso tecnológico de la conserva de atún
Yunilde del Valle Márquez Figueroa1, Ana Mercedes Cabello2*, Luz Bettina Villalobos1, Gracia Guevara3, Bertha Elena Figuera García1 y Osmicar Manuel Vallenilla González2
1- Universidad de Oriente. Postgrado de Biología Aplicada. Núcleo Sucre. Cumana, estado Sucre. Venezuela
2- Instituto Nacional de Investigaciones Agrícolas. Centro de Investigaciones del estado Sucre/ Nueva Esparta. Cumana, estado Sucre, Venezuela. *Correo electrónico: acabello@inia.gob.ve
3- AVEICASA. Cumana, estado Sucre. Venezuela.
RESUMEN
Este trabajo tuvo como objetivo determinar los cambios físicos-químicos y microbiológicos que ocurren en el músculo de atún durante el proceso tecnológico de la conserva. Las muestras de carne fueron tomadas en tres etapas: el desembarco del atún fresco; después del precocido y del producto esterilizado en una empresa conservera de atún en Cumana, estado Sucre, Venezuela. Los métodos utilizados fueron los recomendados por las normas Covenin para la cuantificación de los parámetros pH, nitrógeno básico volátil total (NBVT), trimetilamina (TMA), histamina y sal. Los resultados expresados en promedios para atún fresco, precocido y esterilizado son los siguientes: pH 5,83 5,83 y 5,84; NBVT 52,96 70,23 y 55,85 mg/100g; TMA 0,44 1,14 y 0,42 mg/100g; histamina 0,47 0,69 y 0,71 mg/100g; sal 1,28 0,70 y 1,90%; proteína 26,26 29,99 y 26,01%; humedad 70,47 66,29 y 69,61%; ceniza 1,97 1,54 y 1,44% y grasa 1,05 1,57 y 3,84% para el atún fresco, precocido y esterilizado, respectivamente. Los cambios observados indicaron que en la etapa de precocido es donde los valores de pH, TMA, NBVT e histamina presentaron un significativo incremento por el retardo en su entrada a los hornos de precocción. Sin embargo, los resultados para el producto esterilizado están dentro de los recomendados por Covenin para el atún en conserva.
Palabras clave: Atún, conserva, análisis
Physic-chemical and microbiological changes observed during the technological process of tuna canning
Summary
This work objective was to study the physic-chemical and microbiological changes that take place in tuna muscle during the landing of the capture and the technological process of canning. Samples of tuna meet were obtained at the moment of the vessels were landing, during the pre-cooking, and sterilization processes from a canning industry located in Cumaná, Sucre state, Venezuela. Methodology follows the recommendations by Covenin norms for measuring pH, total basic volatile nitrogen (TBVN), trimetilamine (TMA), histamine, and salt. The pH values were 5.83 5.83 and 5.84, TBVN 52.96 70.23 and 55.85 mg/100g, TMA 0.44 1.14 and 0.42 mg/100g, histamine 0.47 0.69 and 0.71 mg/100g, salt 1.80 0.70 and 1.90%, protein 26.26 29.99 and 26.01%, humidity 70.47 66.29 and 69.61%, ash 1.97 1.54 and 1.44 % and fat 1.05 1.57 and 3.84%, for fresh, precooked and sterilized tuna, respectively. The observed changes showed that during the precooking stage pH, TMA, TBVN, and histamine values increased significantly due to the delay in entrance to the precooking ovens. The physic-chemical and microbiological results for the sterilized product were within the ranges recommended by the Comisión Venezolana de Normas Industriales for canned tuna.
Keywords: Tuna, canning, analysis.
Recibido: 03/10/05 Aceptado: 17/11/05
INTRODUCCIÓN
Desde la captura del atún hasta que el producto Atún en conserva llegue al consumidor, la materia prima se somete a diversos tratamientos tecnológicos industriales como: congelación, descongelación, pre-cocción y esterilización. La cocción se aplica con el fin de reducir el exceso de humedad e inactivar las enzimas endógenas y la esterilización en condiciones anaeróbicas alarga la vida útil y elimina microorganismos. Posteriormente a la esterilización el producto se almacena, adecuadamente, para garantizar una buena palatabilidad del producto (Aubourg, 2001).
Los cambios químicos producidos en el pescado desde su captura y durante su almacenamiento y procesamiento, originan una serie de compuestos de gran importancia en el sabor, olor y la textura del músculo del pescado. La mayoría de estos compuestos son volátiles y su determinación se realiza en función de su contenido de nitrógeno básico volátil total (NBVT), trimetilamina (TMA) e histamina (Huidobro y Tejada, 1990). Los cambios microbiológicos dependen significativamente de los factores que afectan la concentración de sustratos y metabolitos en los tejidos de los peces, como la actividad de las enzimas endógenas, la contaminación microbiana y las condiciones de captura (Sickorkis, 1994).
Este trabajo planteó revisar el comportamiento de pH, NBVT, TMA, sal e histamina en el proceso industrial de la conserva de atún en una planta conservera, ubicada en Cumaná, estado Sucre, Venezuela, que cuenta con tecnologías modernas y buenas instalaciones. Uno de los parámetros más importantes es la histamina, producida a partir de la descarboxilación de la histidina por acción de la enzima histidina descarboxilasa. Esta amina biógena se ha asociado con intoxicaciones alimentarias (Taylor y Sumner, 1987) y su formación es común en pelágicos, como los túnidos y sardina porque forman cardúmenes de grandes volúmenes y en una sola faena se suelen capturar varias toneladas, lo que provoca el aumento de la temperatura corporal en 2 ó 3ºC (Goulding, 2001). Esto hace necesario aplicar frío para almacenarlos a bordo de las embarcaciones y transportarlos a los puertos manteniéndolos almacenados bajo congelación. Si este manejo no es adecuado, rápidamente se inician reacciones que contribuyen a la formación de estos componentes y otros que deterioran el pescado, como el NBVT y la TMA.
MATERIALES Y MÉTODOS
Los músculos de atún fueron tomados en una empresa situada en Cumaná, estado Sucre. Las muestras se obtuvieron siguiendo el orden del esquema tecnológico de la producción de la conserva de atún al natural, el cual es: fresco, precocido y esterilizado (Figura 1). El material fue trasladado en condiciones refrigeradas al Laboratorio de Tecnología de los Alimentos del INIA Sucre/ Nueva Esparta en Cumaná, donde se sometieron a los análisis sensorial, físico-químicos y microbiológicos. Se realizaron ocho muestreos con un total de cinco submuestras por fase.
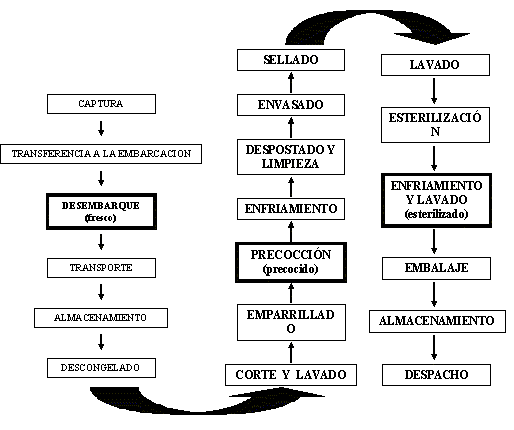
Figura 1. Flujograma del proceso industrial de la conserva de atún
Los análisis se iniciaron con la evaluación sensorial del pescado entero, según la tabla de apreciación de la frescura (Huss, 1999). Los atributos revisados fueron: olor, branquias, piel y apariencia general del pescado, con escala hedónica de 3 a 0, donde 3 es un pescado de excelente frescura y 0 esta en estado de descomposición. Las muestras se homogeneizaron, por separado y se realizaron los análisis por duplicado. El pH se determinó mediante un homogeneizado de la muestra en agua destilada en proporción de 1:9 y se procedió a medir con un potenciómetro digital marca ICM, modelo 41150, según Covenin (1979). Para el nitrógeno básico volátil total (NBVT) se pesaron 10 g de muestra y se colocaron en un matraz de 1.000 ml con 300 ml de agua destilada. Se adicionó 1 g de piedra pómez, 10 ml de etanol y 2 g de magnesia calcinada, el destilado se recogió en un matraz de 500 ml con 10 ml de solución de ácido sulfúrico 0,1 N, 30 ml de agua destilada y 5 gotas de rojo de metilo al 0,5% y se tituló con solución de hidróxido de sodio 0,1 N, de acuerdo a Covenin (1982). La histamina se determino homogenizando la muestra con metanol y se extrajo con una resina de intercambio iónico y se determinó con un espectrofotómetro, según Covenin (1995b). La trimetilamina (TMA), tomando un extracto de la muestra (2 ml) con ácido tricloroácetico, se extrajo con tolueno. Una alícuota seca de este tolueno se hizo reaccionar con ácido pícrico y la intensidad del color se estimó colorimetricamente. Para los análisis de los componentes como: proteína, humedad, ceniza y grasa se utilizó la metodología recomendada por la AOAC (1990). Proteína por el método de Kjeldahl, utilizando un digestor marca Tecator y la humedad con una balanza de humedad automática (Ohaus Scala corp. de apreciación 0,01g), hasta peso constante. Cenizas por calcinación en mufla eléctrica a 550°C por 4 horas y la grasa por Blight y Dyer (1959).
Se aplicaron análisis microbiológicos, como índice de coliformes totales y mesófilos, utilizando los métodos de APHA (1992). Para coliforme se empleo la técnica del número más probable (NMP) y la población aerobia mesófila mediante conteo en placa por el método de siembra por inclusión. Al producto esterilizado se le realizó la prueba de esterilidad comercial, según Covenin (1985), para detectar la efectividad del proceso de esterilización sobre la flora bacteriana presente.
RESULTADOS Y DISCUSIÓN
La evaluación organoléptica del pescado antes del inicio del proceso denominado como fresco, reveló que estaban en buenas condiciones, ya que el 100% presentó una puntuación de 2, escala hedónica, que significa bueno (Huss, 1999). El pescado fresco es aquel que se encuentra en pre rigor o está justamente en estado de rigor mortis. La duración de esta fase va a depender de: la condición fisiológica del animal, el esfuerzo de pesca, composición química y la manipulación después de su captura. Este análisis evidenció que el pescado que llega de barcos atuneros a la empresa, congelado, está apto para el procesamiento de la conserva. Sería importante revisar la manipulación abordo, el efecto del tiempo y condiciones de almacenamiento abordo sobre el pescado.
El conocimiento sobre la composición química del pescado y los cambios de parámetros asociados con alteraciones de este han sido discutidos por varios autores (Connell, 1978; Kodaira, 1991; Huss, 1999). Este trabajo trata sobre los cambios de los componentes del músculo del atún y la variación de parámetros indicadores de deterioro que ocurren durante el proceso de fabricación de la conserva y la detección de microorganismos contaminantes o indicadores de la calidad higiénico-sanitaria en la manipulación del atún durante este proceso, cambios que pueden afectar la calidad nutricional del producto final y alertar sobre su inocuidad.
La composición química de la carne de pescado depende de muchas variables entre las que se destacan la especie, edad, estado fisiológico, época y región de captura. El pescado de más edad es generalmente más rico en grasa y, por lo tanto contiene una menor proporción de agua. En determinadas épocas del año, los peces están más delgados y la carne tiene un contenido mayor de agua con menos proporción de proteínas y grasa. Generalmente este estado aparece después del desove. Una vez que los animales se alimentan de nuevo, recuperan sus características habituales. Ordóñez et al. (1998) señalan que de acuerdo con las estaciones, se observan cambios cíclicos en la composición de todas las especies de pescado. Estos cambios son más acusados en algunas especies pelágicas que tienen un alto contenido de grasa, como por ejemplo el arenque, la caballa y el atún.
La composición próximal (proteínas, humedad, grasa y cenizas) obtenidas durante las tres etapas de muestreo que se reportan en el Cuadro 1. Se observa que el cambio más notorio fue en el contenido de proteínas, con un aumento en la fase del precocido, durante el cual, el calor coagula las proteínas y reduce el contenido de humedad. En el producto esterilizado hay una ligera disminución de 3,98% en la fracción porque las proteínas solubles o salcoplasmáticas pasan al líquido de cobertura que es una ligera salmuera y también por procesos de tratamiento térmico no muy controlados, por lo que pueden sufrir desnaturalización. La aplicación de altas temperaturas provoca deshidratación del músculo concentrando la fracción proteica, por ello el incremento observado entre 26,26 a 29,99% en la etapa de precocción.
| Cuadro 1. Resultados porcentuales promedios de la composición proximal del atún en las fases de fresco, precocido y esterilizado de la conserva de atún. | |||
| Análisis (%) | Fresco | Precocido | Esterilizado |
| Proteínas | 26,26 ± 1,761 | 29,99 ± 1,999 | 26,01 ± 2,258 |
| Humedad | 70,47 ± 2,876 | 66,29 ± 3,731 | 69,61 ± 5,451 |
| Grasa | 1,05 ± 0,186 | 0,57 ± 1,907 | 3,84 ± 2,042 |
| Ceniza | 1,97 ± 0,241 | 1,54 ± 0,978 | 1,44 ± 1,732 |
La humedad en el tejido se reduce a 4,18% y en la etapa de esterilizado se observa que nuevamente gana 3,32%, debido a que en la etapa de envasado se agrega agua para la esterilización que entra en contacto con el músculo y el tejido absorbe nuevamente el agua por equilibrio osmótico.
Al concentrar tejido por efecto de la esterilización a 116ºC se observó un incremento de la fracción de grasa de 0,57% (precocción) a 3.84%.
Al realizar el análisis de varianza, se demostró que solo la fracción proteica presento diferencias significativas (P<0,05). Un análisis a posteriori de Duncan, nos indicó que existen 2 grupos, uno conformado por fresco-esterilizado y el precocido.
La proporción de ceniza es relativamente baja y está relacionada al contenido de sal. El atún es sometido a bordo de las embarcaciones a una salmuera fría para bajar su temperatura corporal antes de ser congelados, por lo que en esa fase absorbe la sal. En este caso se observa una disminución de fresco a precocido y a esterilizado, como consecuencia de la concentración de proteínas y la deshidratación provocada por la aplicación de altas temperaturas, con el agua sale parte de la sal y otros minerales.
Los valores de: pH, NBTV, TMA e histamina tuvieron un significativo incremento y esto se debe a que el pescado sufre un retardo para su entrada en los hornos de precocción de aproximadamente 10 horas (descongelado, corte y emparrillado) y después es dejado enfriar con ayuda de ventilación forzada por 1 hora. En este tiempo se dan estos cambios favorecidos por las altas temperaturas de la planta procesadora (entre 23 a 28 ºC). Se recomienda acortar los tiempos de espera del pescado fresco para ser precocido y bajar las temperaturas de las áreas de trabajo por debajo de 21°C.
Los resultados de los cambios en los parámetros pH, NBVT y TMA que ocurren en las diferentes fases del proceso se reportan en el Cuadro 2. Los valores de pH obtenidos se corresponden con un pescado fresco congelado, en cuyo proceso de enfriamiento se ha empleado sal. El manejo a bordo para preservar el atún durante largas campañas emplea un sistema de enfriamiento rápido después de la captura y utiliza agua de mar con altas concentraciones de sal para lograr un descenso de la temperatura corporal del pescado, luego pasa a las cubas donde generalmente son congelados a granel, utilizando congelación por contacto sólido-gas a –9ºC. Los resultados obtenidos muestran cambios, tanto en el atún fresco, precocido y esterilizado. Estos cambios son normales ante la aplicación de tecnologías de conservación por cocción y esterilización. El resultado de los valores de pH indican una buena calidad, lo que denota que el pescado recibe una aceptable manipulación a bordo. El pH está relacionado directamente con frescura del pescado (Huss, 1999).
| Cuadro 2. Resultados promedios de los parámetros físico-químicos en las fases de: fresco, precocido y esterilizado de la conserva de atún | |||
| Análisis | Fresco | Precocido | Esterilizado |
| pH | 5,83 ± 0,091 | 5,83 ± 0,205 | 5,84 ± 0,093 |
| NBVT (mg/100g) | 24,47 ± 2,104 | 28,38 ± 2,403 | 31,19 ± 2,111 |
| TMA (mg/100g) | 0,44 ± 0,342 | 1,14 ± 0,531 | 0,42 ± 0,405 |
| Histamina (mg/100g) | 0,47 ± 0,482 | 0,69 ± 0,792 | 0,71 ± 0,780 |
| Sal (%) | 1,13 ± 0,352 | 1,29 ± 0,351 | 1,09 ± 0,133 |
Los principales cambios en los compuestos nitrogenados no proteicos son el NBVT, la reducción del oxido de trimetilamina (OTMA) a trimetilamina (TMA), la descarboxilación de histidina dando histamina y la descomposición de urea con liberación de amoníaco (Ordóñez et al., 1998).
El NBVT expresa cuantitativamente el contenido de bases volátiles de baja masa molecular y aminas procedentes de la descarboxilación microbiana de los aminoácidos y se ha considerado representativo del grado de alteración del pescado y de los productos pesqueros. El nivel máximo tolerable y que coincide con alteraciones organolépticas es de 30 – 35 mg NBVT/100 g. para pescados grasos, como el arenque, el atún y la caballa. Los valores promedios de NBVT para el atún fresco, precocido y esterilizado fueron de 24,47; 28,38 y 31,19 mg/100 g, respectivamente, los cuales se incrementaron ligeramente en las tres fases de proceso muestreadas. Sin embargo, estos cambios sufridos durante el proceso están entre los valores permitidos.
El oxido de trimetilamina y sus derivados comprenden un conjunto de componentes nitrogenado no proteicos relativamente abundante en las especies de pescado de origen marino. La trimetilamina (TMA) es una determinación muy útil, la cual está relacionada con la alteración microbiana en algunas especies de pescado, pero no siempre es exacto pues otros factores pueden afectar su tasa. En el caso del pescado se consideran como valores límites aceptables los comprendidos entre 10 – 15 mg N-TMA/100 g de pescado. Los resultados obtenidos en esta investigación están muy por debajo de los valores establecidos (Cuadro 2), lo que indica que no se dieron grandes cambios en relación a este parámetro químico durante el proceso de la conserva de atún.
Valls (2002) indicó que las especies pelágicas en su mayoría tienen un alto contenido de histidina, la cual está presente como constituyente de las proteínas, enzimas y péptidos o también en forma libre en los tejidos. Así, algunas especies de atún pueden tener hasta 2.000 mg de histidina libre y este factor intrínseco puede ocasionar un riesgo potencial de intoxicación. Las especies o túnidos empleadas para la elaboración de las conservas de atún son clasificadas como grandes pelágicos y por ello la necesidad de controlar la presencia de histamina.
La más interesantes de estás aminas es la histamina que procede de la descarboxilación de la histidina. Su determinación cuantitativa constituye un índice de calidad muy importante desde el punto de vista sanitario, siendo útil su determinación en las reservas de pescado ya que se ha demostrado que es termoestable incluso a tratamientos de 116°C durante 90 minutos.
Al realizar el análisis de varianza, se demostró que el NBVT y el TMA presentaron efectos significativas (P<0,05). Un análisis a posteriori de Duncan para NBVT indicó que se mantienen tres grupos diferenciados, mientras que en TMA se formaron dos grupos, uno conformado por fresco- esterilizado y el precocido. A pesar de estas condiciones los resultados para el producto esterilizado o producto final están dentro de lo recomendado por la Comisión Venezolana de Normas Industriales para el atún en conserva (Covenin, 1995a), por lo que la conserva de atún procesada, fabricada en esa empresa, se considera apta para ser comercializada y consumida.
La condición microbiológica indica la calidad higiénico-sanitaria y por eso se incluye en la evaluación de las alteraciones que pueden afectar el pescado. Los mesófilos y coliformes son considerados indicadores de la contaminación microbiológica y se asocian con posible deterioro. Los resultados de las evaluaciones microbiológicas se reportan en la Figura 2 para las tres etapas evaluadas del proceso de la conserva de atún. Para la carne de atún fresca se encontraron recuentos promedios de 2,2 x 103 UFC/g y 3,8 x 102 NMP/g para mesófilos y coniformes, respectivamente. Sin embargo, para el producto precocido se obtuvieron promedios de 1,21 x 103 UFC/g y 0,3 x 10 NMP/g, indicando que probablemente las condiciones higiénicas de las superficies de cubierta y cubas de almacenamiento de los barcos no están muy limpias, por lo que el pescado se contamina con estos microorganismos. Se observa en la misma figura el efecto de las temperaturas de precocción y esterilización que reducen la población microbiana. Esta carga se reduce durante la precocción y desaparece en el proceso de esterilización.

Figura 2. Población microbiológica del atún en las tres etapas muestreadas
El producto esterilizado resultó comercialmente estéril, cumpliendo con las normas establecidas por Covenin (1985), lo que demuestra la eficiencia de los procesos térmicos aplicados en la eliminación de la microflora presente. Doyle et al. (2000) indicaron que la microflora de la carne de atún está influenciada por el ambiente de la zona de captura, la época del año, las condiciones de pesca, la manipulación y el procesado. La presencia de mesófilos en atún fresco es producto de la manipulación a bordo o durante el almacenamiento y traslado a la planta, el cual se realiza generalmente a granel en camiones. Se recomienda estudiar las condiciones de manejo a bordo de los barcos y de los almacenes o cubas de congelación.
Al relacionar la presencia de estos microorganismos con el incremento de histamina reportado en el Cuadro 2, se puede señalar que está asociada a la presencia de estos y que dentro de estos microorganismos se encuentran descarboxiladores de la histidina, como son algunas bacterias Gram Negativas (Escherichia coli, Aeromonas sp, Enterobacter sp), que han sido asociadas a la formación de histamina. Grau et al. (2003) indicaron que el crecimiento de esta flora bacteriana es favorecido por la inadecuada manipulación a bordo que en algunos casos incluye retardo en el enfriamiento del pescado. A pesar del aumento observado, los valores de histamina no representan riesgo para la salud y están dentro de los límites permitidos para la comercialización indicada por Covenin (1995a) de 20 mg/100 g. Sin embargo, se recomienda un trabajo coordinado entre las flotas de captura y las empresas manufactureras para la aplicación de las buenas prácticas de manufactura a bordo (Huss, 1999), que eviten la contaminación microbiológica del pescado y su exposición de calor reduzcan los retardos en el proceso de congelación.
La efectividad de la aplicación de altas temperaturas en la reducción de microorganismos, la inactivación enzimática y la reducción de reacciones químicas y bioquímicas es evidente en el proceso de elaboración de conserva, sin embargo, se puede recomendar estudios de tratamientos térmicos para reducir la pérdida nutricional especialmente en el contenido de proteínas.
CONCLUSIONES
Se evidenció que el músculo sufre cambios importantes en los valores de pH, nitrógeno básico volátil total y humedad entre la fase de fresco a precocido, por lo que se recomienda la aplicación de buenas prácticas de manufacturas (BPM) para evitar o retardar estos cambios.
En el atún fresco se detectó la presencia de mesófilos, lo que demostró que las condiciones de manejo abordo no cumplían las BPM. Se recomienda bajar las temperaturas de almacenamiento y aplicar aseo de cubierta, cubas, operadores y almacenes.
Las fases de precocido y esterilización, fueron efectivas para reducir la carga microbiana del producto fresco.
Esta evaluación determinó variabilidad en los parámetros físico-químicos evaluados por lo que se recomienda su control periódico durante el procesamiento para la obtención de un buen producto.
BIBLIOGRAFÍA
1. AOAC (Association of Official Analytical Chemists). 1990. Official Methods of Analysis. 20º ed. Washington. D.C. 1298 pp. [ Links ]
2. APHA (American Public Health Association). 1992. Compendium of Methods for Microbiological Examination of Food. 3ra ed. Washington, D.C. 1115 pp. [ Links ]
3. Aubourg S. 2001. Loss of quality during the manufacture of canned fish products. Food Sci. Tech. Inst., 7(3): 199-215. [ Links ]
4. Blight G. y W. Dyer. 1959. A rapid method of total lipid extraction and purification. Can. J. Bioch. Phys., 37(8):9 11-917. [ Links ]
5. Covenin (Comisión Venezolana de Normas Industriales). 1979. Alimentos. Determinación de pH (Acidez iónica). Norma 1315-79. Caracas, Venezuela. 3 pp. [ Links ]
6. Covenin (Comisión Venezolana de Normas Industriales). 1982. Alimentos. Determinación del nitrógeno básico volátil total (NBVT) en pescados y productos marinos. Norma 1948-82. Caracas, Venezuela. 4 pp. [ Links ]
7. Covenin (Comisión Venezolana de Normas Industriales). 1985. Alimentos comercialmente estériles. Evaluación de la esterilidad comercial. Norma 2278-85. Caracas, Venezuela. 22 pp. [ Links ]
8. Covenin (Comisión Venezolana de Normas Industriales). 1995a. Atún en Conserva. 3ra Revisión. Norma 1766-95. Caracas, Venezuela. 6 pp. [ Links ]
9. Covenin (Comisión Venezolana de Normas Industriales). 1995b. Productos del mar. Determinación de histamina. Norma 3186-95. Caracas, Venezuela. 30 pp. [ Links ]
10. Connell J. 1978. Control de la Calidad del Pescado. Acribia. Zaragoza, España. 236 pp. [ Links ]
11. Doyle M., L. Beuchat y T. Montville. 2000. Microbiología de los Alimentos. Fundamentos y Fronteras. Acribia. Zaragoza, España. [ Links ]
12. Goulding I. 2001. Transporte de atún congelado. Infopesca Int.. 9: 27-33. [ Links ]
13. Grau C., D. Sánchez, A. Zerpa, O. Vallenilla y O. Berti. 2003. Estudio de la microflora asociada a la formación de histamina en sardina (Sardinella aurita). Rev. Fac. Cien. Vet. LUZ, 13(3):199-204. [ Links ]
14. Huidobro A. y M. Tejada. 1990. Determinación analítica de los compuestos nitrogenados no proteicos en el músculo de pescado. Aplicación al control de calidad. Rev. Agroquím. Tecnol. Aliment, 30(3):293-300. [ Links ]
15. Huss H. 1999. Aseguramiento de la calidad de los productos pesqueros. FAO. Documento Técnico de Pesca. No. 334. Roma, Italia. 174p. [ Links ]
16. Kodaira M. 1991. Composición química y cambios post-morten en pescado, crustáceos y moluscos. Curso-Taller Avances en biotecnología de organismos marinos de importancia comercial Universidad Central de Venezuela. Universidad de Oriente. Isla de Margarita. 31 pp. [ Links ]
17. Ordóñez J., M, Cambero, L. Fernández, M. García, G. de Fernando, L. de la Hoz y M. Selgas. 1998. Tecnología de los Alimentos. Alimentos de origen animal. Volumen II. Editorial Sintesis. Madrid, España. 365p. [ Links ]
18. Sikorski Z. 1994, Tecnología de los Productos del Mar: Recursos, Composición Nutritiva y Conservación. Acribia. Zaragoza, España [ Links ]
19. Taylor S. y S. Sumner, 1987. Determination of histamine, putrescine and cadaverine. En Kramer D.E y J. Liston (Eds) Seafood Quality Determination. Elsevier. pp. 235-245. [ Links ]
20. Valls J. 2002. Histamina en atún y otros grandes pelágicos métodos para su cuantificación. Taller Aprovechamiento e industrialización de atún y otros grandes pelágicos. ICTA-UCV. IUT-Cumaná. 10 pp. [ Links ]













