Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Zootecnia Tropical
versión impresa ISSN 0798-7269
Zootecnia Trop. vol.29 no.4 Maracay dic. 2011
Comparación entre dos modelos diferentes de cámaras de McMaster empleadas para el conteo coproscópico en el diagnóstico de infecciones por nematodos gastroentéricos en rumiantes
Espartaco Sandoval 1*, Gustavo Morales 2, Nideysy Ybarra 3, Mariana Barrios 1, Jorge Borges 1.
1 Instituto Nacional de Investigaciones Agrícolas (INIA), Centro de Investigaciones Agrícolas. Yaracuy, Venezuela. *Correo electrónico: esandoval@inia.gob.ve.
2 Instituto Nacional de Investigaciones Agrícolas (INIA), Centro Nacional de Investigaciones Agrocopecuarias (CENIAP), Aragua, Venezuela.
3 Instituto Universitario Tecnológico del estado Yaracuy, Venezuela.
RESUMEN
El parasitismo gastrointestinal en rumiantes, representa una importante limitante del crecimiento, reproducción y supervivencia en animales susceptibles. Para su control debe disponerse de técnicas diagnósticas capaces de determinar la presencia del parásito, los niveles de infección y permitir inferir en base a estos resultados, el estado de alteraciones fisiológicas y el grado de afección sobre factores de importancia en la producción que estas generan. El objetivo de este trabajo consistió en comparar la eficacia de dos cámaras diseñadas para el conteo coproscópico de huevos de estróngilos digestivos. Para el estudio se emplearon 40 becerros mestizos de ambos sexos, de los cuales se recolectaron 40 muestras de heces directamente del recto de cada animal para su posterior procesamiento por las técnicas de McMaster clásica modifi cada (TCC) que consta de dos compartimientos y requiere de una muestra de 3 g de heces, y la técnica de McMaster modificada empleando la cámara INTA (TCI), que posee 4 compartimientos y requiere de una muestra de 5 g de heces. Para la comparación entre los recuentos de huevos de estróngilos digestivos por gramo de heces (HPG) se empleó la prueba de Wilcoxon y la correlación mediante el coefi ciente de rangos de Spearman. La comparación de las discrepancias se hizo con la prueba de McNemar y la concordancia con el Índice de Kappa. Se concluye que ambas cámaras poseen características de confi abilidad, rapidez, sencillez y bajo costo, sin embargo, la TCI ofrece ventajas en cuanto detección de huevos (animales positivos) e identifi cación de animales acumuladores.
Palabras clave: coprología, parasitismo, diagnóstico, cámara, estróngilos.
Comparison between two McMaster egg counting slide used for the diagnostic of gastrointestinal nematode infection in ruminants
ABSTRACT
Gastrointestinal parasitism in ruminants, represents a major constraint to growth, reproduction and survival in susceptible animals. The control of parasitic infections need of techniques able to determine the presence of the parasite and the infestation levels within the herd in order to establish the possible relationship among the physiologic alterations, the level of parasitic infection and the affection on the production. The aims of this work, was to compare the classical coproscopical technique of McMaster (TCC) against the McMaster INTA (TCI) technique, both are eggs counting slide used for the parasitological diagnosis. For the study 40 crossbreed calves of both sexes were used. A total of 40 samples of faeces were gathered directly of the rectum of each animal and examined for both techniques. The comparison between the eggs per gram of faeces counts (HPG) was realized by mean of Wilcoxon test and the correlation through the coeffi cient of ranks of Spearman. The comparison of the discrepancies was made with the McNemar test and the agreement was evaluated with the Kappa Index. We conclude that both cameras have features of reliability, speed, simplicity and low cost, but the TCI offers advantages in detection of eggs (positive animals) and accumulators animal identifi cation.
Keysword: coprology, parasitism, diagnostic, McMaster slide, gastrointestinal nematodes.
Recibido: 11/01/11 Aceptado: 08/11/11
INTRODUCCIÓN
Las infecciones con nematodos gastrointestinales en rumiantes domésticos representan una importante causa de pérdida de la productividad en sistemas pastoriles de las regiones tropicales y subtropicales, centrándose su fi siopatología en aspectos como la depresión del apetito, cambios en las funciones gastrointestinales y alteraciones en el metabolismo proteico (Fox, 1997).
Una característica importante de los endoparásitos, es que no son directamente apreciables, por lo que generalmente requieren de pruebas de laboratorio para demostrar y cuantifi car su presencia (Benavides y Romero, 2008). En términos generales los miembros del orden Strongylida, en su fase adulta, se alojan en el tubo digestivo desde donde producen huevos que salen al exterior junto a la materia fecal (Agyei, 1991), característica que puede ser utilizada para evidenciar dichas formas de diseminación, mediante el examen de una pequeña cantidad de heces, constituyendo lo que se conoce como coprología microscópica (Morales y Pino, 2009).
El control del parasitismo debe tener, principalmente, el objetivo de reducir las pérdidas económicas generadas al limitar el desempeño productivo de los rebaños y este debe estar fundamentado en el empleo de técnicas coprológicas capaces, no solo de determinar la presencia del parásito, sino también de cuantifi car sus niveles y permitir asociar esos resultados al grado de compromiso con factores productivos y el estado de alteraciones orgánicas (Morales et al., 2010; Sandoval et al., 2009; Morales et al., 2008; Sandoval et al., 2007).
Los conteos de huevos por gramos de heces, han sido ampliamente utilizados en estudios clínicos y evaluación de la efi cacia de los tratamientos antihelmínticos. Se reconoce que no existe una relación lineal entre la población de parásitos adultos y el conteo de huevos por gramos de heces, sin embargo, han sido demostradas correlaciones positivas entre ambas variables (Morales et al., 1995). Esta correlación se pierde con la edad y el grado de inmunidad de los animales, además otros factores como la prevalencia y fecundidad de los parásitos, condiciones climáticas locales y de pastoreo también pueden infl uenciar los resultados de estas técnicas, sin embargo, en la actualidad éstas siguen siendo irremplazables en términos prácticos bajo condiciones de campo (Githigia, et al., 2001; Waller, 1997).
La sobre dispersión parasitaria es un hallazgo comprobado en el seno de la población hospedadora, por lo que nuevos enfoques preconizan la importancia de la coproscopía cuantitativa como criterio de selección para identifi car dentro del rebaño el grupo de animales a ser tratados, en función de su susceptibilidad individual a las infecciones parasitarias (Morales et al., 2008), para la selección de animales resistentes para su uso como reproductores (Morales et al, 2001), así como la evaluación de métodos alternativos de control sostenible, tales como la manipulación de la nutrición del hospedador, que puede favorecer una condición de resistencia o resilencia en el mismo (Hoste et al., 2005).
Estas propuestas contribuyen a reducir costos, retardar la aparición de cepas resistentes, disminuir el impacto ambiental de los quimioterápicos, así como la presencia de residuos químicos en el producto fi nal. Por consiguiente, se requiere contar con técnicas diagnósticas que ofrezcan confi abilidad, rapidez, sencillez y bajo costo.
En nuestro país, diversos autores han realizado trabajos de investigación, en base a estas técnicas con la intención de establecer patrones y cuantifi car la emisión de huevos de estróngilos digestivos por gramo de heces en el curso del día (Sandoval et al.,2002), por épocas (Sandoval et al., 2004-2005; Fuentes et al., 1990) o durante el crecimiento (Moreno, L. 1988; Moreno et al., 1984; Cortes., 1972) para ser empleados en el diseño de estrategias de control.
Dentro de las alternativas diagnósticas, desarrolladas para la estimación de las cargas parasitarias, la que ofrece mayor aceptación y ventajas es el recuento de huevos por gramos de heces (HPG), destacándose por su sencillez y rapidez, la realizada empleando la cámara de conteo de Mc Master (TCC) (Hansen y Perry, 1994).
En virtud de que los investigadores del Instituto Nacional de Tecnología Agropecuaria (INTA) de la Argentina, han adaptado una nueva cámara de conteo conocida como la cámara INTA (TCI Fiel et al., 1998), el objetivo de este trabajo consistió en comparar la efi cacia de estas dos cámaras para el conteo coproscópico de los huevos de estróngilos digestivos y evaluar su capacidad para la identifi cación de los animales acumuladores de parásitos.
MATERIALES Y MÉTODOS
Toma de muestras
Para el presente estudio se seleccionaron 40 becerros mestizos de ambos sexos, con peso promedio de 85 kg y una edad promedio de 6 meses. Se recolectaron 40 muestras directamente del recto de cada animal empleando una bolsa plástica y conservadas en refrigeración a 4°C, previa identifi cación, hasta su procesamiento por las TCC (Morales y Pino, 1977) y la TCI (Fiel et al., 1998). Los niveles de infección fueron establecidos en base a los recuentos de HPG siguientes:
Niveles de infección de acuerdo a la técnica coproscópica

Técnica cuantitativa de McMaster clásica
Esta técnica se fundamenta en el principio de fl otación donde los huevos livianos presentes en una determinada muestra de heces, expuestas a una solución sobresaturada como líquido de fl otación, se separan de la masa fecal ubicándose en la superfi cie de dicho líquido. Brevemente: Se disuelven 3 g de heces, con solución sobresaturada de NaCl hasta completar un volumen de 45 ml (dilución 1:15), se tamiza utilizando un colador de malla fi na, se homogeniza la solución y posteriormente con un gotero se extrae la mezcla para proceder al llenado de la cámara (2 celdillas) y se deja en reposo durante 5 min. Luego se lee al microscopio a aumento de 100 x, contando todos los huevos que están dentro o sobre las líneas de las rejillas. El número de HPG es calculado sumando el resultado del recuento de ambas celdillas el cual se multiplica por 50 (Morales y Pino, 2009)
Técnica cuantitativa de McMaster INTA
Esta técnica tiene el mismo fundamento que la anterior. Brevemente: Se disuelven 5 g de heces, hasta completar un volumen de 100 ml (dilución 1:20), se tamiza utilizando un colador de malla fi na, se homogeniza la solución y posteriormente con un gotero se extrae la mezcla para proceder al llenado de la cámara (4 celdillas) y se deja en reposo durante 5 min. Luego se lee al microscopio a aumento de 100 x, contando todos los huevos que están dentro o sobre las líneas de las rejillas. El número de HPG es calculado sumando el resultado del recuento de las cuatro celdillas, el cual se multiplica por 10 (Fiel et al., 1998)
Características de ambas cámaras

Análisis estadístico
Para la comparación entre los recuentos de HPG obtenidos por ambas técnicas se empleó la prueba de Wilcoxon. Los estudios de correlación se realizaron mediante el coeficiente de correlación de rangos de Spearman. Para la comparación de las discrepancias entre ambas técnicas en el diagnóstico de positivos y negativos, así como de animales con altas cargas parasitarias o acumuladores de parásitos se empleó la prueba de McNemar (Morales y Pino, 2009 a,b). Con el fin de establecer la concordancia o acuerdo para ambas tecnicas, se utilizo el Indice de Kappa (Cohen, 1960) para el caso de tablas de contingencia de 2x2, mientras que para el caso de tablas de NxK (clasificacion de los animales en relacion al nivel de infestacion) se recurrio a la generalizacion de dicha prueba desarrollada por Fleiss (1971). La interpretacion del Indice de Kappa se realizo de acuerdo a la escala siguiente:
< 0 Sin Acuerdo
0-0,20 Insignificante
0,20-0,40 Bajo
0,40-0,60 Moderado
0,60-0,80 Bueno
0,80-1 Muy bueno
Para el caso de las pruebas de correlacion de rangos de Spearman, Wilcoxon y McNemar se establecio un nivel a= 5% como nivel de signifi cacion. Por ultimo se calcularon la especifi cidad y la sensibilidad de ambas tecnicas considerando la TCC como "tecnica de oro", (Malaga, 1990).
Los analisis estadisticos fueron realizados empleando el paquete estadistico INFOSTAT (2004) y para el calculo del Indice de Kappa se recurrio al software MINITAB (2000).
RESULTADOS Y DISCUSION
En el Cuadro 1, se observa que tanto la media como la mediana de los recuentos de HPG obtenidos con TCC resultaron superiores a los obtenidos con la propuesta del INTA. La comparacion indica la existencia de diferencias estadisticamente signifi cativas entre dichas tecnicas coproscopicas. Por otra parte, cuando los recuentos en una de las tecnicas son elevados tambien lo son en la otra (Correlacion de Spearman rho = 0,88; P<0,05)
Cuadro 1. Estadisticas descriptivas de los recuentos de HPG obtenidos por las camaras de Mc Master clasica y Mc Master INTA.

Letras diferentes en la misma fi la indican diferencias estadísticas. Prueba de Wilcoxon: P<0,05.
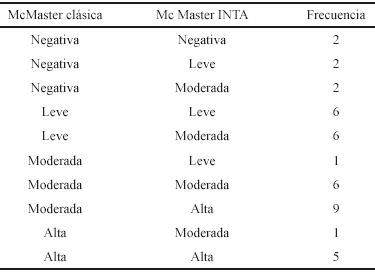
En el Cuadro 2, se observa que solo en dos casos los niveles de infeccion fueron superiores con la TCC, representando el 5% de las muestras, mientras que en 19 casos (47,5% de las muestras) los niveles de infeccion fueron superiores con la TCI. En este sentido la TCI resulta de mayor ventaja para la identifi cacion de animales infectados, ya que mientras la TCC reporta 4 casos negativos la TCI los reporta como leves (2) y moderados (2). En otras 15 ocasiones, la TCC reporta infestaciones leves (6) o moderadas (9), mientras que la TCI los reporta como moderadas y altas, respectivamente. Estos resultados pueden explicarse por la mayor cantidad de heces y de volumen total de carga empleados con la camara del INTA. En el resto de los casos (19/40) que representan el 47,5%, hubo coincidencia en los niveles de infeccion con ambas camaras. Se puede observar, que la concordancia entre ambas tecnicas para discriminar los niveles de infeccion es discreta (Indice de Kappa: 0,27) y por consiguiente una tecnica no debe sustituir a la otra para estos fines.
Cuadro 2. Concordancia entre los niveles de infección utilizando las cámaras de McMaster clásica y McMaster INTA.
Tal como aparece en el cuadro 3, los resultados de la prueba de McNemar evidenciaron una fuerte discrepancia entre ambas tecnicas para la deteccion de los acumuladores de parasitos, lo cual fue ratifi cado por el bajo indice de concordancia de Kappa observado, indicando para este criterio baja concordancia entre ambas tecnicas diagnosticas.
Cuadro 3. Concordancia y discrepancia en la determinación de individuos acumuladores de parásitos o con altos niveles de infección establecidos por el recuento de HPG.

Letras diferentes en la misma fi la indican diferencias estadísticas. Prueba McNemar P<0,05. Índice de Kappa: 0,36.
Estos resultados indican una mayor capacidad de la TCI para detectar animales acumuladores.
La Sensibilidad y la especifi cidad resulto ser de 89,5% y de 100% para la TCC y de 100% y 33% para la técnica de TCI. La baja especifi cidad obtenida para la TCI, se explica ya que al utilizar a la TCC como técnica de oro, esta en dos casos identifi ca las muestras como negativas, las cuales vendrían a ser consideradas como verdaderos negativos, mientras que la TCI las reconoce como positivas, siendo a su vez califi cados como falsos positivos, resultados que al contario de las pruebas serológicas resultan imposible de obtener. Es de resaltar, que estos aspectos (sensibilidad y especifi cidad) no son de gran relevancia en coproscopía, ya que dichos conceptos se refi eren a la detección de verdaderos positivos y verdaderos negativos, que en este tipo de diagnóstico están relacionados con la distribución de los huevos en la materia fecal y con la cantidad de huevos por gramo de heces examinado, lo cual indica que cuando las cargas son bajas la detección de verdaderos positivos requiere del examen de mayor cantidad de heces, lo que le da la ventaja a la TCI.
Cabe destacar, que ambas cámaras poseen características de confi abilidad, rapidez, sencillez y bajo costo, sin embargo, la TCI ofrece ventajas en cuanto detección de huevos (animales positivos) e identifi cación de animales acumuladores.
CONCLUSIONES
La técnica de TCI se presenta como una valiosa alternativa para el diagnóstico cuantitativo de parásitos gastrointestinales en rumiantes, ya que tiene una mayor capacidad para detectar animales acumuladores dado su mayor grado de sensibilidad La técnica de TCC mantiene su pertinencia por ser de uso clásico a nivel internacional.
LITERATURA CITADA
1. Agyei, A. 1991. Epidemiological observations on helminth infections of calves in Southerm Ghana. Tropical Animal Health and Production. 23:134-140. [ Links ]
2. Benavides, E. y A. Romero. 2008. Control de los parásitos internos del ganado en sistemas de pastoreo en el trópico colombiano. Carta Federan No 71:88-111. [ Links ]
3. Cortes, P. 1972. Fluctuación de las parasitosis gastrointestinales del ganado bovino, desde su nacimiento hasta el destete en las zonas de bosque y llano. Universidad de Oriente. 60 p. [ Links ]
4. Cohen, J. 1960. A coeffi cient of agreement for nominal scales. Educational and. Psychological Measurements. 20:37- 46. [ Links ]
5. Fiel, C., P. Steffan y D. Ferreira. 1998. Manual para el diagnostico de nematodes en bovinos. Técnicas de frecuente utilización en la práctica veterinaria: su interpretación. División de Sanidad Animal de Bayer, Argentina. 57 p. [ Links ]
6. Fleiss, J.L. 1971. Measuring nominal scale agreement among many raters. Psychological Bulletin. 76(5):378 – 382. [ Links ]
7. Fox, M. 1997. Pathophysiology of infection with gastrointestinal nematodos in domestic ruminants: recent developments. Veterinary Parasitology. 72(3-4):285-308. [ Links ]
8. Fuentes, E., R. Acosta, L. Moreno, R. López, N. Pérez y N. Rivero. 1990. Aspectos epidemiológicos de las helmintiasis gastrointestinales en becerras de un rebaño del distrito Muñoz, estado Apure. Veterinaria Tropical. 15(1):99-108. [ Links ]
9. Githigia, S., S. Thamsborg and M. Larsen. 2001. Effectiveness of grazing management in controlling gastrointestinal nematodes in weaner lambs on pasture in Denmark. Veterinary Parasitology. 99(1):15-27. [ Links ]
10. Hansen, J. and B. Perry. 1994. The epidemiology, diagnosis and control of helminth parasites of ruminants .International Laboratory for Research on Animal Diseases, Nairobi, Kenya; 171 p. [ Links ]
11. Hoste, H., J. Torres, V. Paolini, A. Aguilar, E. Etter, Y. Lefrileux., C. Chartier. 2005. Interactions between nutrition and gastrointestinal infections with parasitic nematodes in goats. Small Ruminant Research. 60:141-151. [ Links ]
12. INFOSTAT. InfoStat versión 2004. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. 2004. [ Links ]
13. Malaga, H. 1990. Epidemiología veterinaria. Ed. Universidad del Zulia, Maracaibo, Venezuela. 143p. [ Links ]
14. MINITAB (2000). Statistical software.Release 13 for Windows. MINITAB Inc. ,U.S.A [ Links ]
15. Morales, G., L. A. Pino, E. Sandoval y D. Jiménez. 2010. Relación entre la condición corporal y el nivel de infestación parasitaria en bovinos a pastoreo como criterio para el tratamiento antihelmíntico selectivo. (en Taller de Artes Gráfi cas del INIA para impresión). [ Links ]
16. Morales, G. y L. A Pino. 2009a Nematodos parásitos de los rumiantes domésticos en Venezuela diagnóstico y control. Ed. Laboratorio de Diagnóstico Veterinario ALIANI. Barinas, Venezuela. 143 p. [ Links ]
17. Morales, G. y L. A. Pino, 2009 b. Estadística no paramétrica aplicadas a las ciencias de la salud. Ed. Universidad Católica Andrés Bello. Caracas, Venezuela. 102 p. [ Links ]
18. Morales, G., E. Sandoval y L. A. Pino y Z. Rondón, Z. 2008. Evaluación de dos criterios de utilidad en un programa de control de la infección por nematodos gastrointestinales en ovinos mediante tratamiento selectivo. Zootecnia Tropical. 26(2):141-150. [ Links ]
19. Morales, G., L. A. Pino, E. Sandoval, L. de Moreno, D. Jiménez y C. Balestrini. 2001. Dinámica de los niveles de infección por estróngilos digestivos en bovinos a pastoreo. Parasitología al Día. 25:115-120. [ Links ]
20. Morales G., Moreno L., Pino L.A., Surumay Q., Moreno J. 1995. Relationship between adult Word burden and faecal count in naturally infetecd cattle. Research and Reviews in Parasitolgy. 55(3): 181-183. [ Links ]
21. Moreno, L. 1988. Relación entre la edad y la parasitosis gastrointestinal en bovinos. FONAIAP Divulga. 6(27):12-13. [ Links ]
22. Moreno, L., S. Flores, A. Patiño, E. Garrido. 1984. Evolución natural de las helmintosis gastrointestinales en becerros de la Estación Experimental de Calabozo, estado Guárico. Revista Veterinaria Venezolana. 48(27):3-7. [ Links ]
23. Sandoval, E., G Morales, L.A. Pino, D. Jiménez y O. Márquez. 2007. Evaluación del comportamiento leucocitario en ovejas a pastoreo como un criterio para determinar la susceptibilidad a la infección con estróngilos digestivos. REDVET. Revista electrónica de veterinaria. 8(9). Disponible en: http://www.veterinaria.org/revistas/redvet. [Octubre 05, 2010]. [ Links ]
24. Sandoval, E., G. Morales, D. Jiménez, L. A. Pino y O. Márquez. 2009. Evaluación de un programa de control selectivo en becerros doble propósito infectados con estróngilos digestivos. Zootecnia Tropical. 27(2):215-219. [ Links ]
25. Sandoval, E., G. Morales, D. Jiménez, L. A. Pino y O. Márquez. 2002. Dinámica del recuento de huevos por gramos de heces de estróngilos digestivos a diferentes horas del día en becerros naturalmente infectados. Veterinaria Tropical. 27(1):51-62. [ Links ]
26. Sandoval, E., G. Morales, L.A. Pino, D. Jiménez, O. Marquez y C. Araque. 2004-2005. Efecto del tratamiento con iverectina en relación con la época, localidad y manejo sobre la carga parasitaria y ganancia de peso en becerros. Veterinaria Tropical. 29-30(1-2):23-45. [ Links ]
27. Waller, P. 1997. Sustainable helminth control of ruminants in developing countries. Veterinary Parasitology71:195-207. [ Links ]













