Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Paradígma
versión impresa ISSN 1011-2251
Paradìgma v.9 n.2 Maracay dic. 2008
Introducción a la cinética química: efecto de un extracto vegetal sobre el mecanismo de oxidación del fe (ii)
Petra Beatriz Navas; Armando Carrasquero-Durán
Profesora de
Profesor de
RESUMEN
Se propone el estudio de la cinética de la oxidación del complejo hierro (II) ofenantrolina como una experiencia didáctica para un curso de Cinética Química a nivel universitario, en la cual se incluyen tres momentos didácticos: Primero, una revisión de los conceptos químicos relacionados con el comportamiento de las sustancias involucradas en la reacción, seguido del diseño de mapas de conceptos y de los experimentos. Posteriormente se obtienen los resultados experimentales que se emplean en la validación de los mecanismos de reacción propuestos. La transformación del ion ferroso en su forma férrica fue monitoreada por medio de los cambios en la absorbancia del complejo de color rojo que se forma con la fenantrolina, observándose una reacción de pseudo primer orden con una constante de velocidad de 0,050 ± 0,002 s-1. Las velocidades de oxidación fueron menores cuando se incorporó al medio un extracto de albedos de naranja, lo cual se asoció a la presencia de flavonoides. El efecto inhibidor presentó un orden de reacción igual a -1 con respecto a la concentración del extracto, manteniendo el primer orden en el catión divalente. Para el estudio de la cinética fueron muy valiosos el Método de los Estados Estacionarios, las ecuaciones integradas y la ecuación de Van´t Hoff . Esta experiencia puede ser muy útil para introducir a los estudiantes en los conceptos y modelos más importantes de la cinética química a nivel universitario.
Palabras clave: Cinética, mecanismos, oxidación, inhibidor, albedo, ion ferroso
Introduction to the chemicals kinetics: effect of a vegetabl extract on the oxidation mechanism of fe(ii)
The kinetics study of iron(II)ophenantroline oxidation induced by HNO3 is proposed as a didactic experience for the course of chemical kinetics. Three didactic moments are included: First, review of related chemical concepts and design of the concept maps and the experiments. Experimental results are obtained and used to prove validity of proposed reaction mechanisms. Transformation of ferrous ion to ferric ion was followed by changes in absorbance of red colored ophenantroline complex. It was observed a pseudo first order kinetics with a velocity constant of 0,050 ± 0,002s-1. Oxidation rates were lower when an orange albedo extract was added to reaction mixture, which was associated with the presence of flavonoids in the natural extract. This inhibitory effect was associated with a reaction rate of
Keywords: Kinetics, mechanism, oxidation, inhibitor, albedo, ferrousion.
Recibido: 15 05 2008 Aceptado: 18 09 2008
Introducción:
La mayoría de los cursos de fisicoquímica a nivel superior introducen a los estudiantes en los principios de la termodinámica a fin de predecir la espontaneidad de las reacciones. Sin embargo, la termodinámica se ve limitada al no poder establecer la rapidez con la cual ocurre una reacción espontánea, como en el caso de la reacción entre el hidrógeno y el oxígeno para producir agua.
Por esta razón, los cursos de físicoquímica suelen complementarse con el tema de cinética química, que se refiere al estudio de la velocidad con la cual ocurren las reacciones (Le Vent, 2003), por lo que su enseñanza debería basarse en un enfoque experimental, donde los alumnos realicen mediciones precisas de la variación que experimentan en el tiempo las concentraciones de las sustancias reaccionantes. La interpretación de los resultados experimentales, tomando en cuenta variables como temperatura, catalizadores, inhibidores, etc. debe conducir a una mayor compresión por parte del alumno de los mecanismos por medio de los cuales ocurren las transformaciones, tal como lo señalan Merino y Herrero (2007), para quienes las actividades de laboratorio deben coadyuvar al reforzamiento de los aspectos teóricos.
Para esto, Hodson (1994), propone un tratamiento integral de los trabajos de laboratorio como una investigación dirigida haciendo hincapié en la solución de problemas, mientras que White (1995), afirma que la participación de los estudiantes en investigaciones reales que contribuyan a desarrollar las habilidades intelectuales, debe ser un componente esencial en la enseñanza de las ciencias.
Por lo tanto, hay que considerar que las actividades de laboratorio deben ser diseñadas de tal forma que el alumno, además de adquirir las habilidades necesarias para obtener mediciones de precisión y exactitud conveniente, pueda integrar la teoría y la práctica al permitirle interpretar los resultados bajo la forma de posibles mecanismos de reacción. Para ello, deben incluirse contenidos relacionados tanto con los modelos matemáticos para la determinación del orden de reacción como también con el método de los estados estacionarios y las propiedades químicas de las sustancias, a fin de obtener posibles mecanismos de reacción que puedan ser validados con los resultados experimentales. Ejemplos de este enfoque pueden ser examinados en los trabajos de Vitz (2007) donde se estudia el efecto de la vitamina C para inhibir la oxidación del ión ioduro en la presencia de peróxido de hidrógeno, o en el de Williams y col. (2005), quienes orientan a sus alumnos en el estudio de la cinética de descomposición del Aspartame, para lograr aprendizajes significativos no sólo de los conceptos fundamentales de la cinética química, sino del comportamiento químico de este edulcorante artificial, muy utilizado en la actualidad por la industria de los alimentos.
En este trabajo se propone a los alumnos un trabajo de investigación en el cual deben determinar el potencial inhibidor de un extracto alcohólico de albedo de naranjas en la oxidación del ión ferroso por el ácido nítrico diluido.
Método
En esta experiencia se incluyen tres momentos didácticos:
a) Identificación de los principios químicos involucrados en el trabajo y propuesta de mecanismos de reacción:
Esta es una etapa muy importante en el proceso de aprendizaje ya que aquí se produce la construcción del conocimiento (Bailey & Garratt, 2002). De una amplia variedad de fuentes de información que abarquen textos, revistas científicas, Internet etc. los estudiantes deben aprender los conceptos, modelos y métodos experimentales de
b) Diseño de los experimentos:
En este momento, los estudiantes deben haber construido en sus mentes un esquema sobre el problema a investigar y las relaciones existentes entre los diferentes principios químicos involucrados. Esto debe reflejarse en el diseño de los procedimientos experimentales por los propios estudiantes y de esta forma los facilitadores pueden evaluar el grado de comprensión alcanzado por los alumnos e introducir las actividades pertinentes para mejorar el proceso. El elemento esencial de los experimentos se relaciona con la medición precisa de los cambios en la concentración del Fe2+ lo que determina la velocidad de la reacción en presencia o no del extracto natural.
c) Interpretación de los resultados experimentales:
Una vez ejecutados los experimentos, los alumnos deben realizar los cálculos de las velocidades iniciales, órdenes de reacción y contrastar las leyes de velocidad experimentales con las derivadas de los mecanismos propuestos. Esta fase constituye el segundo momento de evaluación del aprendizaje de los alumnos ya que ellos deben explicar a los profesores los cálculos realizados a fin de demostrar la validez o no de los mecanismos propuestos.
Resultados y Discusión
Desarrollo de la experiencia:
a) Identificación de los principios químicos involucrados en el trabajo y propuesta de mecanismos de reacción
La velocidad de una reacción viene determinada por los cambios en el tiempo en las concentraciones de las especies que reaccionan, pudiendo ser expresada como una ecuación matemática conocida como Ley de Velocidad. Por ejemplo, en la oxidación del ión ferroso por acción del ácido nítrico, una posible ley de velocidad es:

Donde m y n son los órdenes de reacción con respecto al ácido nítrico y al hierro (II) respectivamente. Si se utiliza una concentración del ácido muy grande en relación a la del ión metálico, la ley de velocidad se simplifica de la siguiente manera:

La constante de velocidad K se denomina ahora como constante aparente (KAparente) ya que incluye el termino asociado a la concentración del HNO3. El paso siguiente consiste en determinar el valor de n para lo cual se puede hacer uso de las ecuaciones de velocidad integradas (Frost & Pearson, 1961), las cuales permiten predecir por métodos gráficos el orden de una reacción. Por ejemplo, para comprobar si la oxidación obedece a una cinética de primer orden se hace la siguiente deducción:

Por otro lado, utilizando el método de Van´t Hoff (Swinbourne, 1985) también se puede determinar matemáticamente el orden de una reacción química en la cual están involucrados dos reactivos; sin embargo, este método requiere del cálculo previo de las velocidades iniciales, lo cual puede ser hecho por métodos gráficos o computarizados a partir de los datos experimentales.
Por ejemplo,

![]()
Propuesta del mecanismo de reacción para la oxidación del ión ferroso promovida por el ácido nítrico:
El HNO3 es un agente oxidante fuerte y los productos de su reducción dependen de la concentración del ácido, por ejemplo a bajas concentraciones los principales productos son NO con alguna cantidad de NO2 (Jolly, 1964). La reducción del HNO3 aporta el oxígeno necesario para formar el complejo dioxígenodihierro, que ha sido identificado como un intermediario inestable en la autooxidación de los complejos ferrosos (Katakis & Allenm, 1964) e involucra un puente peroxo entre dos iones de hierro (II).
A partir de esta información se propone el siguiente mecanismo:

De acuerdo a la ecuación 4, la oxidación sigue una cinética de primer orden con respecto a la concentración de iones ferrosos, lo cual es consistente con la cinética de primer orden establecida experimentalmente por Agrawall y Mushram (1971) para la autooxidación del ión hexacianoferrato (II) inducida por la cloramina-T. Asimismo, Woods (1966) indica que los hydroperóxidos reaccionan con el ión ferroso para producir iones férricos y peróxido de hidrógeno en una cinética de orden 1 con respecto al hierro divalente.
Propuesta del mecanismo de reacción para la oxidación del ión ferroso promovida por el ácido nítrico en presencia de un inhibidor:
La adición de compuestos orgánicos sintéticos o naturales puede inhibir la oxidación del ión ferroso ya sea por quelación de los iones, impidiendo la reacción con el oxígeno o por neutralización directa de moléculas activas de oxígeno, a través de la formación de radicales libres orgánicos altamente estables (Kita et al. 1992). La estabilidad que adquieren los radicales libres orgánicos por la deslocalización electrónica, llamada energía de resonancia, explica las propiedades antioxidantes de muchas moléculas de origen natural como los gingeroles y el ácido carnósico entre otros (Kakatani y Kikuzaki, 1987).
Con base en lo anterior se plantea el siguiente mecanismo:


Inhibidores naturales
Muchos flavonoides son antioxidantes promisorios debido a que sus estructuras moleculares favorecen la estabilización de los radicales fenólicos. Por ejemplo, en el epicarpio de la naranja, Braverman (1949) determinó hasta un 3,6 % de la flavanona hesperidina, cuya estructura molecular contiene grupos hidroxilicos que al reaccionar con el oxígeno pueden formar radicales libres, que se estabilizan por resonancia en los anillos bencénicos. Nijveldt et al. (2001) y Makris et al. (2007) señalan que los flavonoides y otros biofenoles exhiben elevadas capacidades antioxidantes, ya que estos compuestos inactivan radicales libres del tipo hidroperóxido, oxígenos singletes, iones superóxidos etc. Los mismo autores señalan que el consumo de estos antioxidantes naturales puede tener grandes beneficios para la salud, ya que contribuyen a reducir el riesgo de enfermedades cancerosas y, al mismo tiempo, retardan el envejecimiento celular.
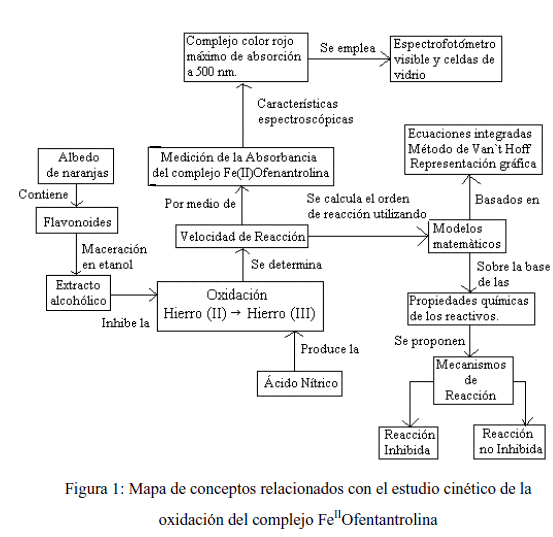
Sobre la base de la información anterior, los alumnos pueden elaborar mapas de conceptos que les faciliten estructurar un cuerpo coherente de conocimiento, un ejemplo de estos mapas es representado en la figura 1.
Hipótesis de trabajo
La presencia de flavonoides en el albedo de naranja sugiere que un extracto alcohólico de este material vegetal puede inhibir la autooxidación del ión ferroso por el mecanismo de reacción planteado.
b) Diseño de los experimentos:
Experimento 1: Oxidación del ión ferroso.
Una solución acuosa 3.10-
Cuadro 1: Soluciones de trabajo para la oxidación del Fe(II)-Ofenantrolina.
| Solución de trabajo | Alícuota de la solución madre de Fe(II)-Ofenantrolina | Volumen final (mL) | Concentración final (mol.L-1.10-5) |
| 1 | 12 | 250 | 14,4 |
| 2 | 10 | 250 | 12,0 |
| 3 | 6 | 250 | 7,2 |
Naranjas dulces se adquirieron en el mercado local. Luego de lavarlas con agua corriente, el albedo se retiró de la pulpa a mano, utilizando un cuchillo y se dejó secar en estufa a 45° C por tres días. Una masa de
Se formaron dos grupos de tres vasos de precipitados de 50 mL y se agregaron 25 mL de las soluciones de trabajo. Al primer grupo se agregaron 0,1 mL del extracto de albedos y al segundo se agregaron 0,2 mL. Ambos grupos fueron identificados como A y B. A todas las soluciones se agregaron 0,5 mL de HNO3
Experimento 1: Oxidación del ión ferroso.
El cuadro 2 muestra la variación de la concentración del complejo de hierro (II) con el tiempo para las soluciones de trabajo 1 y
| Tiempo (min) | [FeII-ofenantrolina].10-6 mol.L-1 | |
| | Solución 1 | Solución 2 |
| 0 | 14,4 | 12,0 |
| 5 | 11,1 | 9,8 |
| 10 | 9,2 | 6,9 |
| 15 | 6,8 | 5,0 |
| 20 | 5,3 | 4,5 |
Cuadro 3: Ecuaciones de regresión para la cinética de primer orden.
| Experimento | Ecuación | R2 | KAparente |
| 1 | y = -0,0217x - 4,8381 | 0,996 | 0,050 |
| 2 | y = -0,0229x - 4,9186 | 0,977 | 0,053 |
Experimento 2: Oxidación del ión ferroso en presencia del extracto de albedos de naranja.
El efecto inhibidor del extracto de albedos de naranjas en la oxidación del ión ferroso se observa en los datos mostrados en el cuadro 4, siendo mayor el efecto cuando se empleó la dosis de 0,2 mL. Para determinar de la velocidad inicial se aplicó en cada caso un modelo matemático polinomial de 3er grado utilizando el paquete Curve expert® (Hyams, 1993) (cuadro 5), obteniéndose ecuaciones con coeficientes de regresión significativos. Las velocidades iniciales se calcularon por medio del valor de la primera derivada de las funciones para valores de tiempo de reacción cercanos a cero; es decir, lo más próximos posibles al inicio de cada reacción. Posteriormente se aplicó el método de Van´t Hoff obteniéndose la gráfica de la figura 3.
Cuadro 4: Concentraciones del complejo Hierro(II)Ofenantrolina en función al tiempo de reacción.
| | 0,1 mL extracto | 0,2 mL extracto |
| Tiempo (min) | [Fe2+].10- | [Fe2+].10- |
| 0 | 14,30 | 14,30 |
| 5 | 13,52 | 14,17 |
| 10 | 12,24 | 13,52 |
| 15 | 10,37 | 12,24 |
| 20 | 6,86 | 7,72 |
| 30 | 5,19 | 6,86 |
| 40 | 4,92 | 6,86 |
| 50 | 4,65 | 6,58 |
| Tiempo (min) | [Fe2+].10- | [Fe2+].10- |
| 0 | 11,92 | 11,92 |
| 5 | 11,20 | 11,61 |
| 10 | 10,40 | 10,99 |
| 15 | 9,18 | 9,77 |
| 20 | 6,30 | 6,86 |
| 30 | 5,40 | 6,58 |
| 40 | 5,40 | 6,30 |
| 50 | 5,40 | 5,74 |
| Tiempo (min) | [Fe2+].10- | [Fe2+].10- |
| 0 | 9,77 | 9,77 |
| 5 | 9,18 | 9,47 |
| 10 | 8,30 | 8,88 |
| 15 | 6,86 | 7,14 |
| 20 | 5,19 | 6,30 |
| 30 | 3,57 | 5,46 |
| 40 | 3,57 | 5,19 |
| 50 | 3,57 | 4,65 |
Cuadro 5: Ecuaciones de regresión para las cinéticas de oxidación del complejo en presencia del extracto alcohólico.
| Soluc. | Modelo matemático | R2 | Velocidad Inicial L.mol-1.min-1 |
| 1-A | Y =1,48.10-5-2,84.10-7X – 4,83.10-9X2 + 1,32.10-10X3 | 0,984 | 2,84.10-7 |
| 1-B | Y =1,49.10-5-1,46.10-7X – 8,95.10-9X2 + 1,74.10-11X3 | 0,958 | 2,02.10-7 |
| 2-A | Y =1,22.10-5-2,16.10-7X – 3,04.10-9X2 + 1,32.10-10X3 | 0,977 | 2,16.10-7 |
| 2-B | Y =1,19.10-5-1,06.10-7X – 1,10.10-9X2 + 9,20.10-10X3 | 0,999 | 1,06.10-7 |
| 3-A | Y =1,00.10-6-1,88.10-7X – 3,33.10-9X2 + 9,14.10-10X3 | 0,991 | 1,88.10-7 |
| 3-B | Y =9,92.10--7-8,83.10-8X–7,73.10-9X2 + 1,66..10-11X3 | 0,988 | 8,83.10-8 |

El orden de reacción negativo evidencia el efecto inhibidor del extracto natural y es consistente con el mecanismo propuesto.

es semejante a la deducida del mecanismo propuesto.
Conclusión
Estos resultados muestran que la presencia de algunos de los componentes en el extracto crudo de albedos de naranja son capaces de reducir la velocidad de oxidación del ión ferroso, actuando de esta manera como un inhibidor.
La ejecución de esta práctica de laboratorio, que requiere de dos sesiones de 2 horas cada uno, proporciona al estudiante un conjunto de datos numéricos a partir de los cuales puede realizar cálculos, proponer ecuaciones, modelos y construir gráficos, con lo cual el aprendizaje es más significativo. Asimismo, esta actividad didáctica puede complementarse con la propuesta por parte de los alumnos de aquellas posibles sustancias antioxidantes presentes en el extracto, la manera de separarlas e identificarlas, etc. La actividad debe culminar con la presentación pública de los resultados, ya sea bajo la forma de una exposición oral o de una presentación en póster, que permita a los alumnos dar a conocer su trabajo a los demás compañeros y, al mismo tiempo, fomentar la importancia que tiene la divulgación de los resultados de una actividad científica.
Referencias
2. Bailey, P.D. & Garratt, J. (2002). Chemical education: Theory and practice. U Chem Ed, (6), 39-57. [ Links ]
3. Braverman, L. (1949). Citrus products. New York, Interscience Publisher. 958 p. [ Links ]
4. Hodson, D. (1994). Hacia un enfoque más crítico del Trabajo de Laboratorio. Enseñanza de las Ciencias, 12 (3), 299-313. [ Links ]
5. Hyams, D. (1993). Curve Expert Ver. 1.37 Microsoft USA. [ Links ]
6. Jolly, W. (1964) The inorganic chemistry of nitrogen. W.A.
7. Kakatani, N. & Kikizaki, H. (1987). A new antioxidative glycoside isolated from oregano. Agriculture and biological chemistry, 51 (10), 2727-2732. [ Links ]
8. Katakis, D. & Allenm, A.O. (1964). Mechanism of radiolitic oxidation of ferrous ion. The Journal of Physical Chemistry, 68 (3), 657-660. [ Links ]
9. Le Vent, S. (2003). Rate of Reaction and Rate Equations. Journal of Chemical Education. 80(1): 89-91. [ Links ]
10. Makris, D., Boskou, G & Andrikopoulos, N. K. (2007). Polyphenolic content and in vitro antioxidant characteristics of wine industry and other agri-food solid waste extracts. Journal of Food Composition and Analysis, 20, 125-132. [ Links ]
11. Merino, J.M. y Herrero, F. (2007) Resolución de problemas experimentales de Química: Una alternativa a las prácticas tradicionales. Revista Electrónica de Enseñanza de las Ciencias, 6(3): 630-648
12. Nijveldt, R.J., Van-Nood, E., Van-Hoorn, D.E.C., Boelens, P.G., Van-Norren, K. y Van-Leeuwen, P.A.M. (2001). Flavonoids: a review of probable mechanism of action and potential applications. American Journal of Clinical Nutrition, 74, 418-425. [ Links ]
13. Ruebush, L. y North, S. W. (2008). The Teaching of Consecutive First-Order Reaction Kinetics: A Chemical Education Research Study of the Impact of Hands-On Demonstrations. The Chemical Educator, 13(3), 131-135
14. Swimbourne, W. (1985). Analysis of kinetic data.
15. White, R.T. (1996). The link between the laboratory and learning. International Journal of Science Education, 18 (7), 761-774. [ Links ]
16. Williams, K., Adhyaru, B., Timofeev, J. y Blankenship, M. (2005). Decomposition of Aspartame: A Kinetics Experiment for Upper-Level Chemistry Laboratories. Journal of chemical education, 82(6), 924-925
17. Woods, R. (1966). Intermediates in oxidation of FeSO4 in arsenic acids. The Journal of Physical Chemistry, 70 (5), 1446-1452. [ Links ]
18. Vitz, E. (2007). A Student Laboratory Experiment Based on the Vitamin C Clock Reaction. Journal of Chemical Education, 84 (7), 1156-1157. [ Links ]