Saber
versión impresa ISSN 1315-0162
Saber vol.25 no.4 Cumaná dic. 2013
Estudio dft de las reacciones de formación de 2-propenal y 1-hidroxipropan-2-ona a partir de glicerol
Dft study of formation reactions of 2-propenal and 1-hydroxypropan- 2-one from glycerol
Edgar Márquez1, Máryury Flores2
1 Universidad de Oriente, Núcleo de Sucre, Escuela de Ciencias, Departamento de Química, Laboratorio de Fisicoquímica Orgánica, Cumaná, Venezuela
2 Universidad Politécnica Territorial del Oeste de Sucre Clodosbaldo Russian, Departamento de Higiene y Seguridad Laboral, Cumaná, Venezuela E-mail: eamarquez@udo.edu.ve
RESUMEN
Las reacciones de formación de 2-propenal y 1-hidroxipropan-2-ona a partir de glicerol, vía deshidratación molecular en fase gaseosa, fueron examinadas teóricamente usando diferentes métodos de la teoría funcional de la densidad (B3LYP, B3PW91, MW1PW91 y PBEPBE), con dos bases, 6-31G(d,p) y 6-31++G(d,p), empleando el paquete computacional G09W. La formación de 2-propenal fue estudiada a través de una reacción de tres pasos; el primer paso involucra la eliminación de agua a partir del grupo hidroxilo secundario, seguido por una reacción de tautomerización y, finalmente, otra deshidratación. La formación de 1-hidroxipropan-2-ona fue estudiada a través de una reacción que involucra una primera deshidratación y, posteriormente, una tautomerización ceto-enol. Los resultados obtenidos demuestran que la primera deshidratación es el paso limitante en ambas reacciones. El paso determinante en la etapa limitante es la polarización del enlace C-OH, la cual es asistida por un átomo de hidrógeno en posición b. Los parámetros cinéticos y termodinámicos de activación, el análisis NBO y la distribución de cargas en los átomos involucrados en el estado de transición, demuestran que todos los grupos OH presentes en el glicerol son cinéticamente equivalentes; por lo tanto, la selectividad de la descomposición molecular de glicerol depende de la rapidez con que se alcanza el equilibrio ceto-enol en la segunda etapa de ambas reacciones.
Palabras clave: Deshidratación, estado de transición, NBO.
ABSTRACT
The gas-phase dehydration reactions of glycerol to 2-propenal and 1-hydroxypropan-2-one, were examined by meaning of several methods: B3LYP, B3PW91, MW1PW91 y PBEPBE, combined with two basis-set: 6-31G(d,p) and 6-31++G(d,p) using density functional theory (DFT) and the package G09W. The formation of 2-propenal was studied via three stepway reaction: the first step involves a dehydration of secondary hydroxyl group, followed by keto-enol equilibrium reaction, and, finally, a second dehydration. Formation of 1-hidroxypropan-2-one was studied through a stepway reaction that involves a first dehydration of primary hydroxyl group and, finally, a keto-enol equilibrium reaction. Theoretical results suggest the first dehydration is the limiting-step in the two studied reactions. The important step in the limiting stage was the polarization of C-OH bond, which is assisted for b-Hydrogen atom. Thermodynamics and kinetics parameters, NBO calculations and charge distribution along the transition state, suggest that all hydroxyl groups occurring in the glycerol molecules are kinetically equivalent; thus, selectivity of molecular glycerol decomposition is depending of equilibrium keto-enol rate in the second step of both reactions.
Key words: Dehydration, transition state, NBO.
Recibido: abril 2013. Aprobado: agosto 2013. Versión final: octubre 2013.
INTRODUCCIÓN
La producción de compuestos químicos renovables ha tenido mucha atención con el paso de los años. Entre las fuentes naturales, a través de las cuales se pueden generar combustibles, destacan los azúcares, celulosas y hemicelulosas. Estas moléculas, altamente funcionales, necesitan ser transformadas con el propósito de ser utilizadas en las industrias químicas. Sin embargo, el cambio de los derivados del petróleo a las fuentes químicas bio-renovables, requiere de un extraordinario esfuerzo, debido a la diferencia natural entre las materias primas, además, la catálisis desarrollada durante los últimos 100 años no es directamente aplicable a las reacciones de la biomasa (Shanks 2010).
Idealmente, se podría tomar ventaja de grupos funcionales ya presentes en diferentes clases de biomasas, como ejemplo, el uso de ácidos grasos en detergentes, del nitrógeno presente en aminoácidos así como de los grupos OH presentes en los alcoholes. Este último, podría ser clave en el desarrollo de nuevos compuestos con alto potencial como intermediarios y/o materias primas en la industria química (Shanks 2010).
El glicerol es el poliol más pequeño disponible como biomasa y está presente en el esqueleto de los triglicéridos, los cuales constituyen, aproximadamente, el 10% de la biomasa. Adicionalmente, el glicerol es liberado en la producción del biodiesel, representando el 1% de la biomasa total; no obstante, constituye un material de partida para la producción de derivados químicos industriales (Behr 2008).
Actualmente, debido al incremento en la producción de biodiesel vía transesterificación de aceites y grasas con metanol o etanol, la disponibilidad de glicerol ha aumentado exponencialmente, lo cual genera la disminución de los precios. Como consecuencia de esto, la exigencia de transformar el glicerol en un producto de mayor valor agregado, se ha hecho imperativa. Esto implica la necesidad de desarrollar nuevas tecnologías que permitan la transformación de glicerol a compuestos de mayor interés comercial (Bozell 2010).
Una opción importante para usar glicerol es la conversión catalítica a 2-propanal (acroleína, acrilaldehido) vía doble deshidratación (Fig. 1). La acroleína (acrilaldehido) es una sustancia clave en la síntesis de otros compuestos químicos y su producción mundial es de, aproximadamente, 106 millones de toneladas al año. A nivel industrial, la acroleína es usada para la elaboración de varios productos, incluyendo ácido acrílico, éster acrílico, polímeros absorbentes y detergentes (Kraus 2008).
Otro producto importante que pudiese derivarse del glicerol es el compuesto 1-hidroxipropan-2-ona (acetol), el cual es un intermediario clave en la producción de propilenglicol. El propilenglicol, es un componente comercial con una producción anual que sobrepasa los 450 millones de toneladas al año en el mundo y se comercializa entre 1,50 y 2,20 $ por kg de compuesto, con un crecimiento anual de producción de 4% (Wang et al. 2010).
Desde el punto de vista químico, es posible obtener los productos antes mencionados (acroleína, acetol) a partir de reacciones moleculares tal como se muestra en la Figura 1. La selectividad de los grupos OH, podría dar la formación de acroleína vía reacción 1 y acetol, vía reacción 2. A pesar del uso comercial de estos productos, no existen suficientes datos cinéticos al respecto. El conocimiento detallado del mecanismo de reacción molecular por el cual se llevan a cabo estas reacciones, podría dar claridad en cuanto al potencial uso de estas transformaciones como posibles derivados del glicerol. Debido a la ausencia de datos cinéticos y termodinámicos de estas reacciones, la química computacional juega un rol fundamental en el conocimiento y entendimiento de estos procesos (Coll 2011).
El propósito de este trabajo fue realizar un estudio computacional de la cinética y el mecanismo de la reacción de deshidratación en fase gaseosa de glicerol para la formación de 2-propanal (acrilaldehido) y 1-hidroxipropan-2-ona (acetol) por dos vías diferentes, utilizando distintos métodos de correlación electrónica, de la teoría DFT, así como determinar los posibles estados de transición (TS), el paso determinante y la formación de cargas parciales presentes en cada uno de los TS.
MATERIALES Y MÉTODOS
Métodos computacionales y modelaje molecular
El cálculo de la estructura electrónica de reactivos, estados de transición y productos de reacción fue llevado a cabo utilizando la teoría del funcional de la densidad (DFT), empleando varias combinaciones de funcionales de correlación/intercambio. Entre éstos destacan la formulación de tres parámetros de Becke en combinación con el funcional de Lee, Yang y Parr [B3LYP/6-31G(d,p), B3LYP/6-31++G(d,p)], el funcional de correlación de Perdew-Wang (1991) [MPW1PW91/6-31G(d,p), MPW1PW91/6-31++G(d,p)], y los de Perdew, Burke y Ernserhof [PBE/6-31G(d,p), PBE /6-31++G(d,p)], todos pertenecientes al paquete computacional Gaussian 09 para Windows (Foresman 1986).
El criterio de convergencia utilizado en la matriz densidad fue de 10-9 unidades atómicas, el valor para el desplazamiento máximo fue de 0,0018 Å, y para la fuerza máxima de 0,00045 Hartree/Bohr.
Los puntos estacionarios, los mínimos de energía y los correspondientes al estado de transición fueron verificados usando cálculos de frecuencia. Para obtener el estado de transición, (TS) se usó el protocolo TSQ (tránsito sincrónico cuadrático). Dicha estructura fue identificada a través del análisis normal de los modos vibracionales, caracterizado por una frecuencia negativa, y confirmada por los cálculos IRC (Fukui 1970).
Las magnitudes termodinámicas como la energías de punto cero (ZPVE) y entropías absolutas, S(T), fueron obtenidas a partir de cálculos de frecuencias haciendo uso de la mecánica cuántica y la mecánica estadística para obtener las funciones de partición de las especies involucradas y así obtener el coeficiente de velocidad (McQuarrie 1996).
El coeficiente de velocidad se obtuvo usando la teoría del estado de transición (TET), asumiendo que el coeficiente de transmisión es igual a 1. Los parámetros cinéticos y termodinámicos de activación, tales como ΔDG, ΔDH and ΔDS fueron obtenidos usando las la teoría del estado de transición canónica (TST) (McQuarrie 1996).
Análisis de orden de enlace
Los cálculos NBO (orbitales naturales de enlace) fueron usados para estudiar el progreso de la reacción a lo largo de la superficie de energía potencial. Para esto, se calcularon los índices de enlaces de Wiberg usando Gaussian 09W. A través de estos índices se estimaron los órdenes de enlaces a partir del análisis poblacional electrónico. El proceso de formación y rompimiento de enlaces en el mecanismo de la reacción fue seguido utilizando el concepto de sincronicidad, (Sy) (Moyano et al. 1989), definido por la siguiente expresión:

Donde n es el número de enlaces directamente involucrados en la reacción; δBi es la variación relativa del índice de enlace y está definido por:

Los superíndices R, TS, P representan al reactante, estado de transición y productos, respectivamente.
La evolución del enlace fue calculado por la siguiente expresión:

El valor promedio de evolución, SBave, fue calculado por:

El parámetro de sincronicidad es usado para explicar si una reacción concertada procede de forma sincrónica, (Sy = 1), o si la reacción es completamente asincrónica, (Sy = 0).
RESULTADOS Y DISCUSIÓN
Parámetros cinéticos y termodinámicos
Inicialmente, dos de los grupos OH presentes en la molécula del glicerol pueden ser eliminados para formar agua; sin embargo, la formación de 2-propanal y/o 1-hidroxipropan-2-ona va a depender de la selectividad de ambos grupos hidroxilos.
Para la formación de 2-propenal se propuso la eliminación del grupo hidroxilo central (secundario) vía un estado de transición de cuatro miembros, para formar el compuesto 1,3-dihidroxipropeno, el cual tautomeriza a 3-hidroxipropanal vía TS de cuatro miembros; finalmente, se planteó una segunda deshidratación para formar el compuesto 2-propenal, también a través de un estado de transición de cuatro miembros (Fig. 2). Análogamente, para la reacción de formación de 1-hidroxipropan- 2-ona a partir de glicerol, se simuló una primera deshidratación vía un estado de transición de cuatro miembros, seguida de una reacción de tautomerización para formar el intermediario 1,2-dihidroxi-1-propeno, el cual tautomeriza a 3-hidroxipropanona, vía un estado de transición de cuatro miembros (Fig. 3).
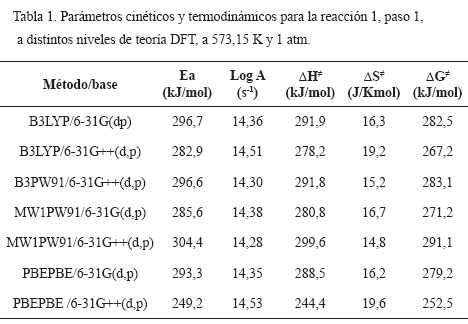
La Tabla 1 muestra los parámetros cinéticos y termodinámicos de activación obtenidos para la primera reacción de deshidratación de glicerol (vía 1) a distintos niveles de teoría. Se observa que los valores de Ea están entre [249 < x < 297], lo cual está acorde con reacciones de primer orden, de naturaleza molecular. Los valores de DG demuestran que ambas reacciones son endergónicas. Los valores de entropía (> 0) sugieren estados de transición cíclicos con polaridad considerable. Para la reacción 1, la energía de activación de la etapa 1 (TS1) es considerablemente mayor que las etapas subsiguientes, demostrando que la descomposición de glicerol a 2-propenal tiene como etapa determinante la primera deshidratación.
La Tabla 2 muestra los parámetros cinéticos y termodinámicos obtenidos a distintos niveles de teoría para la reacción 2. Estos valores están acordes con una reacción unimolecular con TS de cuatro miembros de naturaleza polar. La etapa 1 es considerablemente mayor que la etapa 2, por lo tanto, esta podría considerarse como la fase límite para convertir glicerol a 1-hidroxipropan-2- ona. El método B3PW91/6-31G++(d,p) fue seleccionado para comparar las etapas de ambas vías, ya que la literatura demuestra que este método produce resultados acordes con los valores experimentales en reacciones unimoleculares con estados de transición de cuatro miembros (Márquez et al. 2009).
La Tabla 3 muestra que la primera etapa en ambas vías es la más energética, por lo tanto, es la etapa límite en ambas reacciones. Este resultado sugiere que los grupos hidróxidos presentes en el glicerol son cinéticamente equivalentes, es decir, la conversión molecular de glicerol, vía deshidrataciones consecutivas, no es una reacción específica. Sin embargo, la etapa 2 de la vía 2 es menos energética que la etapa 2 de la vía 1 en, aproximadamente, 30 kJ/mol.
Estados de transición y mecanismos Las estructuras optimizadas para reactivos R, TS y P fueron obtenidas a distintos niveles de teoría; sin embargo, estas no varían significativamente con el método utilizado. En este sentido, las estructuras correspondientes a reactivos, TS y productos, de la etapa determinante de ambas vías de reacción, se muestran las figuras 4 y 5, respectivamente.
Los parámetros geométricos como longitud de enlace, ángulos dihedrales y frecuencia imaginaria fueron estudiados en las primeras etapas de ambas vías, por ser éstas el paso determinante en todos los casos estudiados (Tabla 4). La numeración de los átomos fue seguida según la Figura 6, donde A representa la primera etapa de la vía 1 y B la primera etapa de la vía 2, respectivamente.
Como se puede observar en la Tabla 4, los TS involucrados en las primeras etapas de ambas vías presentan los mismos parámetros geométricos, confirmando la equivalencia cinética de todos los grupos hidróxidos presentes en la molécula de glicerol. Asimismo, el valor de los ángulos dihedrales demuestra que los TS son cercanos a la planaridad.
Distribución de cargas
Para describir los cambios en la distribución de cargas a cargas NBO para los átomos involucrados en las etapas limitantes; en este caso, los átomos O1, C2, C3 y H4 (Fig. 6), los cuales intervienen en la formación del estado de transición (Tabla 5).
La Tabla 5 muestra valores similares para los átomos O1 y H4 en ambas vías, demostrándose una vez más la equivalencia de los grupos OH presentes en la molécula de glicerol.
Análisis del orden de enlace Los índices de enlace de Wiberg, Bi, fueron calculados para todos los enlaces que cambian durante el transcurso de la primera etapa de ambas reacciones, y se identificaron de acuerdo a la Figura 6, nombrados como O1-C2, C2-C3, C3-H4 y H4-O1. Para el resto de los enlaces se considera que el cambio es insignificante. Los resultados obtenidos se muestran en las tablas 6 y 7, correspondientes a la formación del 2-propenal y 1-hidroxipropan-2-ona, respectivamente.
Para ambas reacciones, los enlaces que más evolucionan son O1-C2 y C3-H4, respectivamente, demostrándose que el paso lento en cada caso es la polarización del enlace O1-C2, seguido de la abstracción de un hidrógeno b por el grupo hidroxilo polarizado. Este resultado es fundamental para estudios posteriores, ya que demuestra que la reacción puede ser específica si se usa un catalizador capaz de modificar la coordenada de reacción O1-C2.
CONCLUSIONES
Las reacciones de deshidratación unimolecular y homogéneas de glicerol, en fase gaseosa, podrían llevarse a cabo vía estados de transición cíclicos de cuatro miembros, polar en naturaleza, donde el paso lento, para ambas vías de reacción, es la polarización del enlace C-OH. Asimismo, la selectividad molecular hacia la formación de uno de los dos productos (acetol o acrilaldehido) depende de la rapidez con que se establece el equilibrio ceto-enol de la segunda etapa de reacción.
REFERENCIAS BIBLIOGRÁFICAS
1. Behr A, Eilting J, Irawadi K, Leschinski J, Lindner F. 2008. Selective hydrogenolysis of glycerol to 1,2-propanediol: Comparison of batch and continuous process operations. Green Chem. 10:13-17. [ Links ]
2. Bozell J, Petersen G. 2010. Technology development for the production of biodiesel products from biorefinery carbohydrates - US Department of Energys Top 10 revisited. Green Chem. 12:539-549. [ Links ]
3. Coll D, Delbecq F, Aray Y. 2011. Stability of intermediates in the glycerol hydrogenolysis on transition metal catalysts from first principles. Phys. Chem. Chem. Phys. 13:1448-1456. [ Links ]
4. Foresman B, Frish E. 1986. Exploring Chemistry with Electronic Methods, 2nd Edition, Gaussian, Inc, Pittsburg, PA, pp. 302.
5. Fukui K. 1970. Formulation of the reaction coordinate. J. Phys. Chem. 74:4161-4163. [ Links ]
6. Kraus G. 2008. Synthetic methods for the preparation of 1,3-propanediol. Clean. 36:648-656. [ Links ]
7. Márquez E, Mora J, Córdova T, Chuchani G. 2009. DFT calculations of triethyl and trimethyl orthoacetate elimination kinetics in the gas phase. J. Phys. Chem. A. 113(11):2600-2606. [ Links ]
8. Mcquarrie D. 1986. Statistical Mechanics, Harper & Row, New York, pp. 586.
9. Moyano A, Pericás M, Valenti E. 1989. A theoretical study on the mechanism of the thermal and the acid-catalyzed decarboxylation of 2-oxetanones (b-lactones). J. Org. Chem. 54:573-582.
10. Shanks B. 2010. Conversion of biorenewable feedstocks: New challenges in heterogeneous catalysis. Ind. Eng. Chem. Res. 49(21):10212-10217.
11. Wang S, Wang A, Zhang Y, Liu C. 2010. Selective hydrogenolysis of glicerol to propylene glicol on Cu-ZnO composite catalysts: structural requirements and reaction mechanism. Chem. Asian J. 5(5):1100-1111.












 uBio
uBio