Saber
versión On-line ISSN 2343-6468
Saber vol.27 no.4 Cumaná dic. 2015
HEMOGLOBINA GLICOSILADA O HEMOGLOBINA GLICADA,
¿CUÁL DE LAS DOS?
GLYCOSILATED HEMOGLOBIN OR GLYCATED HEMOGLOBIN, WHICH OF THE TWO?
Mariela Bracho-Nava 1, Victoria StepeNka-Alvarez 2,4, MariBel Sindas-VillaSMil 3,4, Yoleida RivaS de CASAL4, María Bozo de GoNzález 1, ANYelo Duran-Mojica 1
Universidad del Zulia, Facultad de Medicina, Escuela de Bioanálisis, 1 Cátedra de Bioquímica General,
2 Postgrado de Medicina Interna, 3 Cátedra de Práctica Profesional de Bioquímica, 4 Hospital General del Sur,
Instituto Zuliano de Diabetes Dr. Roberto Gutiérrez Urdaneta (INZUDIABETES), Maracaibo, Venezuela
E-mail: mariela.bracho@gmail.com
RESUMEN
La hemoglobina A1c (HbA1c) constituye un fiel indicador para evaluar los pacientes diabéticos y gracias a la estandarización alcanzada en la prueba, es el primer criterio de diagnóstico de diabetes en individuos asintomáticos o con sospecha clínica de esta enfermedad, de acuerdo con la American Diabetes Association (ADA). Se define a la HbA1c, según la International Federation of Clinical Chemistry (IFCC), como un término genérico referido a un grupo de sustancias que se forman a partir de reacciones bioquímicas entre la hemoglobina A (HbA) y algunos azúcares reductores presentes en la circulación sanguínea, siendo la glucosa el más abundante de ellos. Esta reacción es conocida con el nombre de reacción de Maillard, la cual se basa en una glicosilación no enzimática o más correctamente denominada, una glicación. La costumbre, desconocimiento o confusión entre ambos procesos químicos ha llevado a que se siga haciendo uso del término de hemoglobina glicosilada en vez de hemoglobina glicada. En el presente artículo se ofrece una revisión del proceso de formación de la hemoglobina A1c, definiendo la reacción de glicosilación y glicación de una proteína, las especies químicas que favorecen la glicación, las características del proceso de glicación de la hemoglobina, las etapas en las cuales se da y los efectos relacionados con la glicación de proteínas en los seres humanos, para finalmente concluir con un pasaje de las denominaciones que ha recibido la HbA1c hasta el presente; todo con el objetivo de esclarecer y dar propiedad al empleo de la denominación de hemoglobina glicada.
Palabras clave: HbA1c, glicación, glicosilación, hemoglobina glicada.
ABSTRACT
Hemolobin A1c (HbA1c) has become a faithful indicator to monitor diabetic patients and thanks to the standardization achieved in the test, is the first step for diagnosis of diabetes in asymptomatic individuals or with clinical suspicion of the disease, according to the American Diabetes Association (ADA). HbA1c is defined, according to the International Federation of Clinical Chemistry (IFCC), as a generic term referring to a group of substances that are formed from biochemical reactions between hemoglobin A (HbA) and some reducing sugars present in the bloodstream, glucose being the most abundant of them. This reaction is known as the Maillard reaction, which is based on a non-enzimatic glycosylation, or more correctly called, in a glycation. Custom, ignorance or confusion among both chemical processes has led to use the term glycosylated hemoglobin instead of glycated hemoglobin. This article provides a review of the process of formation of hemoglobin A1c, defining the reaction of glycosylation and the protein glycation, the chemical species that favor the glycation, the characteristics of the process of glycation of hemoglobin, stages in which it occurs and the effects related to the glycation of proteins in human beings, to finally conclude with a passage of designations which has received the HbA1c to the present; all with the aim of clarifying and giving property to the use of the term glycated hemoglobin.
Key words: HbA1c, glycation, glycosylation, glycated hemoglobin.
INTRODUCCIÓN
La hemoglobina (Hb) de los seres humanos adultos normales, está compuesta por tres fracciones llamadas: hemoglobina A, hemoglobina A2 y hemoglobina F. La hemoglobina A (HbA), es la más abundante de todas, representando aproximadamente el 97%. A través de reacciones bioquímicas, parte de esta HbA se puede combinar con azúcares, convirtiéndose en glucohemoglobina o glicohemoglobina (HbA1). Dependiendo del azúcar que incorpore, se obtienen las diferentes subfracciones conocidas como hemoglobinas menores o rápidas (HbA1a, HbA1b y HbA1c), por ser las que primero eluden en los procesos de cromatografía usados para identificarlas (Tabla 1) (Schroter 1980, Jenkins y Ratnaike 2003, Campuzano-Maya y Latorre- Sierra 2010).
La HbA1c es la más abundante de los componentes menores de la hemoglobina en los eritrocitos humanos (aproximadamente el 80% de la HbA1). Así pues, se puede definir como la condensación de la glucosa en la porción N-terminal (grupo valinaterminal) de la cadena beta de la hemoglobina A, siendo por tanto su denominación química N-1-desoxifructosil-beta-Hb; de tal forma que el organismo se encuentra expuesto a la modificación de su hemoglobina por la adición de residuos de glucosa: a mayor glicemia, mayor adición de glucosa a la hemoglobina (Bunn et al. 1976, Pérez Páez et al. 2009). Esta reacción, conocida desde hace muchos años, recibe el nombre de reacción de Maillard, glicosilación no enzimática o más recientemente, glicación (González Flecha et al. 2000, Escribano Serrano y Michán Doña
2013).
La combinación de azúcares con biomoléculas fue estudiada a principios del siglo XX por Louis Camille Maillard, químico francés que en 1912 estudiaba la pérdida de lisina (aminoácido esencial) en los alimentos conservados, ricos en proteínas y carbohidratos; este científico enunció las bases moleculares de estas reacciones que luego tomaron su nombre. La importancia de su contribución fue el postulado de que también estos procesos se producen a nivel biológico, es decir, no ocurren sólo en la cocina sino que se llevan a cabo espontáneamente en el organismo (Maillard 1912, Rossi 2007).
Por más de 50 años, el avance en la comprensión química de esta reacción estuvo directamente vinculado con la ciencia y la tecnología alimentaria. Su relevancia fisiológica se puso de manifiesto a partir del descubrimiento de moléculas de glucohemoglobina en la sangre de individuos sanos y del aumento en su proporción en personas que padecen diabetes (Koenig et. al. 1976). Sin embargo, cabe destacar que la glicación no es una reacción exclusiva de la hemoglobina, presentándose en la mayoría de las proteínas y en general, de las biomoléculas del organismo (Campuzano-Maya y Latorre-Sierra 2010, Caldés Melis 2012).
DEFINIENDO LA REACCIÓN DE GLICOSILACIÓN Y DE GLICACIÓN
La glucosilación o glicosilación, es una reacción química enzimática post-traduccional, que tiene como fin la formación de una proteína conjugada (glicoproteína). Es un proceso intracelular, ocurre tanto en el retículo endoplasmático rugoso como en el aparato de Golgi, con múltiples funciones en la vida humana y un control genético estricto. En este tipo de reacción hay la participación de enzimas (glicosiltransferasas) que transfieren oligosacáridos sobre una determinada proteína (Jiménez et al. 2002, Escribano Serrano y Michán Doña 2013).
Los tipos más comunes de glicoproteínas encontrados en células eucariotas son definidos de acuerdo a la naturaleza de las regiones de unión con la proteína, siendo las más frecuentes las de enlace -N y -O. Las N-glucoproteínas son una cadena de oligosacáridos unidos en forma covalente a un grupo amino de la cadena lateral de un residuo de asparagina de una cadena polipeptídica, generalmente vía N-acetilglucosamina (Glc-NAc), dentro de una secuencia consenso: Asn-X- Ser/Thr. Las O-glucoproteínas, suelen unirse mediante un enlace glucosídico-O entre la N-acetilgalactosamina (GalNAc) y el grupo hidroxilo de un residuo de serina o treonina (Mathews y van Holde 1998, Varki et al. 1999).
Las glicoproteínas, una vez sintetizadas pueden encontrarse en la superficie celular o como moléculas de secreción, por lo que pueden modular o mediar una gran variedad de eventos durante las interacciones celulares y de células con la matriz extracelular, cruciales para el desarrollo y funciones de organismos multicelulares complejos (Jiménez et al. 2002).
En contraposición al concepto anterior, la glicación o glucación, describe la modificación post-traduccional de los grupos amino de las proteínas por la acción de azúcares reductores, sin participación enzimática (Sacks
2003). Dicho de otra manera, desde el punto de vista químico, consiste en la unión de grupos amino primarios de aminoácidos, péptidos y proteínas con el grupo carbonilo de los azúcares reductores (generalmente monosacáridos), de los cuales la glucosa es el más abundante en el organismo (Cohen 2011).
Inicialmente, se identificaron los residuos proteicos como dianas de la glicación (Reynolds 1965, Takahashi 1977), siendo los aminoácidos lisina y arginina los centros de reacción más destacados (Shapiro et al. 1980.
Ahmed y Thornalley 2005). Posteriormente, se comprobó que las bases nitrogenadas del ADN (Bucala et al. 1984), principalmente la 2-desoxiguanosina (Knerr et al. 1994), también sufren procesos de glicación. Actualmente, se sabe que la fosfatidiletanolamina y la fosfatidilserina, dos componentes lipídicos esenciales de las membranas celulares de los mamíferos, también reaccionan con este tipo de compuestos glicantes (Bucala et al. 1993, Caldés Melis 2012).
La reacción entre grupos amina de biomoléculas y carbonilo de azúcares tiene lugar en condiciones fisiológicas y sin control enzimático, causando modificaciones estructurales y funcionales en las proteínas, lípidos y ácidos nucleicos (Caldés Melis 2012). Estas reacciones implicadas en los procesos de glicación de las biomoléculas son de enorme interés ya que se han relacionado con las complicaciones patológicas de la diabetes (algunas nefropatías, retinopatías y enfermedades cardiovasculares) (Schalkwijk y Miyata 2012), con varias enfermedades neurodegenerativas como el Alzheimer o el Parkinson (Münch et al. 2012) y con otras enfermedades asociadas al envejecimiento (Ansari y Moinuddin 2011, Caldés Melis 2012).
COMPUESTOS RESPONSABLES DE LA GLICACIÓN (ESPECIES GLICANTES)
La glucosa es el azúcar reductor más abundante en el organismo. Su concentración en la sangre está sometida a un cuidadoso mecanismo de regulación en individuos sanos y en personas que padecen diabetes, aumenta sustancialmente. Esto lleva a que éste sea el azúcar reductor generalmente considerado en las reacciones de glicación de interés biológico. Sin embargo, cualquier azúcar que posea un grupo carbonilo libre puede reaccionar con los grupos amino primarios de las proteínas. La reactividad de los distintos azúcares está dada por la disponibilidad de su grupo carbonilo (González Flecha et al. 2000).
Los aminoácidos, unidad estructural de todas las proteínas, son especies químicas que poseen un grupo amino primario, un grupo carboxilo y una cadena lateral característica de cada aminoácido. Al constituirse una proteína se produce la reacción entre el grupo carboxilo del primer aminoácido y el grupo amino del siguiente formándose el denominado enlace peptídico. En consecuencia, una vez formada la cadena polipeptídica, sólo quedará como tal el grupo amino primario del primer aminoácido, constituyendo el denominado grupo amino terminal. Además, algunos aminoácidos poseen en su cadena lateral grupos capaces de reaccionar con los azúcares reductores (el amino de la lisina y el guanidinio de la arginina). En la glicación de las proteínas, el grupo amino terminal es el más reactivo, seguido por los grupos amino primarios de la cadena lateral de los residuos de lisina y, con mucha menor reactividad, los grupo guanidino de los residuos de arginina (Okitani et al. 1984, González Flecha et al. 2000).
CARACTERÍSTICAS DE LA GLICACIÓN DE LA HEMOGLOBINA
La glicación de la Hb es un proceso que se produce en el interior del hematíe, al ser la pared de éste, entera y libremente permeable a las moléculas de monosacáridos (Escribano Serrano y Michán Doña 2013). Esta reacción posee unas características muy singulares (González Flecha et al. 2000, Jiménez et al. 2002, Mato 2009, Escribano Serrano y Michán Doña 2013):
a. Es un proceso continuo, ya que existe un incesante nacimiento y destrucción de los glóbulos rojos. Todos los días se producen alrededor de un 1% de nuevos hematíes (reticulocitos) y se destruyen en una cantidad similar.
b. Es un proceso no enzimático, por lo que se ha mal llamado glicosilación no enzimática para diferenciarla de la glicosilación.
c. Es un proceso lento. Al no ser catalizado por enzimas, requiere que se suceda en una serie de etapas para poder completarse.
d. Las etapas iniciales de la glicación son reversibles y se completan en tiempos relativamente cortos, mientras que las posteriores transcurren más lentamente y son irreversibles, por lo que la desaparición de los compuestos resultantes sólo ocurre cuando el hematíe es destruido.
ETAPAS DE LA REACCIÓN DE GLICACIÓN
A lo largo del proceso de glicación entre la cadena β de la hemoglobina A y la glucosa, se pueden distinguir tres etapas:
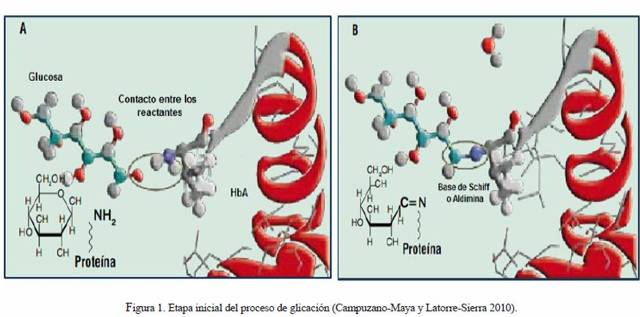
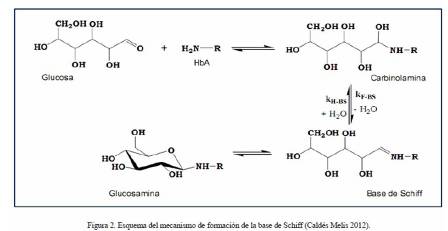
1. Etapa inicial, con una tasa de reacción rápida (período de horas), donde se produce la condensación de la proteína con el azúcar (Fig. 1A). En esta unión covalente, el extremo Nterminal (amino terminal) y más reactivo de la cadena beta de la globina, se enlaza por adición nucleofílica con el carbono carbonílico (o carbono anomérico en la estructura cerrada o proyección de Haworth), por ser el más reactivo de la glucosa, dando lugar de forma reversible a un compuesto denominado Base de Schiff, Aldimina o HbA1c lábil (Fig. 1B). La base de Schiff es sólo estable por un corto tiempo, luego del cual se inicia un proceso de reordenamiento de los enlaces químicos (Brownlee et al. 1984, Okitani et al. 1984, González Flecha et al. 2000, Aponte et al. 2009, Mato 2009, Campuzano-Maya y Latorre-Sierra 2010, Escribano Serrano y Michán Doña 2013). En la Figura 2 se indica el esquema del mecanismo de formación de la base de Schiff, representándose la unión de grupo amino terminal de la HbA con la glucosa, para formar un intermediario carbinolamina que se deshidrata espontáneamente para formar la base (Cho et al. 2007).
2. Etapa de reordenamiento de la estructura de la base de Schiff. A continuación esta aldimina sufre una reestructuración del doble enlace del tipo Amadori (Fig. 3A), en honor al químico que describió por primera vez este tipo de reajuste, formándose de manera irreversible, un Producto de Amadori, Cetoamina o HbA1c estable (Fig. 3B). Este complejo estable es el que se determina habitualmente a nivel de laboratorio. En esta etapa la tasa de reacción es mucho más lenta, sucede en un período de días (Brownlee et al. 1984, Okitani et al. 1984, González Flecha et al. 2000, Aponte et al. 2009, Mato 2009, Campuzano-Maya y Latorre-Sierra 2010, Escribano Serrano y Michán Doña 2013). En la Figura 4 se muestra el esquema del mecanismo de reordenamiento de la base de Schiff hasta formar el producto de Amadori. Este mecanismo se inicia mediante la protonación del nitrógeno imínico de la base de Schiff, lo que provoca un descenso en la densidad electrónica del Cα y el debilitamiento de su enlace C–H. La eliminación de dicho protón mediante catálisis ácido-base general, genera una 1,2-enolamina que tautomeriza hacia la formación del producto de Amadori (Isbell y Frush 1958).
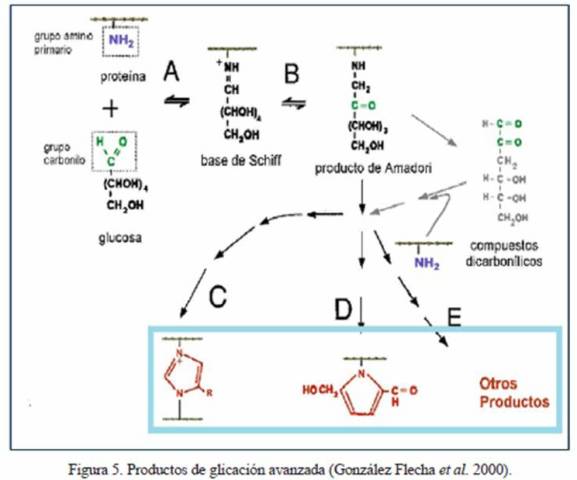
3. Etapa de transformaciones complejas del producto de Amadori. Los productos de Amadori poseen un grupo carbonilo que puede seguir reaccionando con otros grupos amino. El mecanismo de estas reacciones no se conoce con detalle, aunque se sabe que es un proceso que involucra complejos reordenamientos intramoleculares y en algunos casos la asociación entre varios de estos compuestos. Los producto de Amadori pueden seguir dos vías: una es la deshidratación y reordenamiento del producto de Amadori, tanto en condiciones oxidativas como en no oxidativas. La segunda vía es por reacción de compuestos carbonílicos o dicarbonílicos altamente reactivos con grupos funcionales amino, tiol y guanidino. Ambas vías conducen, de manera irreversible y más lenta, a la formación de un conjunto complejo y heterogéneo de compuestos estables llamados Productos Finales de Glicación Avanzada (PGA ó AGEs, por sus siglas en inglés: Advanced Glycation End-products), estructuras generalmente coloreadas (presentan color pardo amarillento) y/o fluorescentes (Fig. 5) que resultan del entrecruzamiento con otras proteínas o con otras zonas de la misma proteína (Ikeda et al. 1996, González Flecha et al. 2000, Aponte et al. 2009, Mato 2009, Campuzano- Maya y Latorre-Sierra 2010, Cohen 2011, Caldés Melis 2012, Escribano Serrano y Michán Doña 2013).
En condiciones fisiológicas la aparición de estos compuestos (PGA) está determinada por (González Flecha et al. 2000):
a. La concentración (cantidad) de azúcares reductores, principalmente glucosa.
b. El tiempo durante el cual se mantiene esa cantidad de glucosa.
c. El tiempo de exposición a la glucosa de la proteína, es decir, su vida media (tiempo que tarda en destruirse).
En proteínas de recambio rápido, el proceso de glicación no supera, en general, las etapas iniciales (formación de la base de Schiff y eventualmente del producto de Amadori), mientras que las de vida media larga llegan a formar los PGA (González Flecha et al.
2000).
EFECTOS DE LOS PGA
La glicación de biomoléculas es un factor clave en muchas patologías asociadas a la diabetes (nefropatía, retinopatía, enfermedades cardiovasculares, entre otras.), así como en el envejecimiento y otras enfermedades neurodegenerativas (Thorpe y Baynes 1996, Brownlee 2001). En individuos diabéticos no controlados, la falta o los niveles bajos de insulina aumentan considerablemente los niveles de glucosa en sangre, lo que afecta irreversiblemente a la integridad de las proteínas de larga vida (Fan et al. 2009, Maillard-Lefebvre et al. 2009, Zhang et al. 2011). Las enfermedades neurodegenerativas, tales como el Alzheimer (Mimna et al. 2007) o el Parkinson (Xu et al. 2011), se relacionan con el plegamiento erróneo de proteínas y con los procesos de agregación y deposición de fibrillas de tipo amiloide, lo que podría ser consecuencia de la glicación de las proteínas implicadas (Caldés Melis 2012).
Los PGA están implicados en el desarrollo de estas diversas patologías a través de tres mecanismos generales (Brownlee 1995):
1. La modificación de proteínas estructurales que se encuentran fuera de la célula.
2. El desencadenamiento de procesos intracelulares a través de la unión a receptores extracelulares.
3. La alteración de proteínas intracelulares.
Los PGA se acumulan en el interior de las células insulino-dependientes y fuera de ellas, sobre todo en las proteínas de las membranas basales, en las proteínas circulantes y en las proteínas estructurales como el colágeno. A medida que pasa el tiempo, la acumulación de PGA a nivel tisular aumenta, contribuyendo a la senescencia de muchos órganos corporales incluida la piel (Cohen 2011).
HbA1c: DE LAS PRIMERAS DENOMINACIONES A LA ACTUAL
Inicialmente fue usado el nombre de hemoglobinas rápidas para hacer referencia a las glicohemoglobinas. Posteriormente, de acuerdo a sus propiedades cromatográficas se usaron los nombres triviales de hemoglobina A1a, hemoglobina A1b y hemoglobina A1c, refiriéndose a su orden de elución en una columna de intercambio iónico (Weykamp et al. 2009).
Por muchos años el carácter no-enzimático de la reacción de glicación no estuvo claramente demostrado, es por ello que a finales de la década de los 70, los términos de hemoglobina glicosilada o glucosilada fueron introducidos (Gillery 2013).
La definición química de la HbA1c, N-1- desoxifructosil-beta-Hb, abreviada a DOF-Hb, también fue propuesta para nombrarla, sin que este término haya tenido muchos partidarios (Escribano Serrano y Michán Doña 2013).
En 1983, la Unión Internacional de Química Pura Aplicada, la Unión Internacional de Bioquímica y Biología Molecular junto con la Comisión en Nomenclatura Bioquímica sugirió el término de hemoglobina glicada, pero finalmente en 1986, recomendaron glicohemoglobina (Weykamp et al.2009).
La declaración de consenso de la Federación Internacional de Química Clínica (IFCC por sus siglas en inglés), la Asociación Europea para el Estudio de la Diábetes (EASD), la Federación Internacional de Diábetes (IDF) en 2007 y la Asociación Americana de Diábetes (ADA) declararon que el nombre debe ser HbA1c (Weykamp et al. 2009).
Las denominaciones Test A1c o A1c son las actualmente recomendadas por la ADA para facilitar la comunicación con los pacientes. La denominación más extendida en el mundo anglosajón, quizás por su brevedad, es A1c (Escribano Serrano y Michán Doña 2013).
Finalmente, se descarta el uso habitual del término glicosilada, ya que este vocablo corresponde al tipo de reacción química enzimática, asumiéndose correctamente el término de hemoglobina glucada o su anglicismo glicada, para referirse al efecto de la reacción de glicación sobre la hemoglobina (Escribano Serrano y Michán Doña 2013).
REFERENCIAS BIBLIOGRÁFICAS
1. Ahmed N, Thornalley P. 2005. Peptide mapping of human serum albumin modified minimally by methylglyoxal in vitro and in vivo. Ann NY Acad Sci 1043 ( 1): 260-266. [ Links ]
2. Ansari N, Moinuddin R, Ali R. 2011. Glycated lysine residues: a marker for non-enzimatic protein glycation in age-related diseases. Dis Markers 30 ( 6): 317-324. [ Links ]
3. Aponte R, Ramírez Z, Hernández G, Sommontes Z. 2009. Los procesos de glicosilación no enzimática. Archivo Médico de Camagûey. 13 ( 6): 1-15. [ Links ] Disponible en línea en: http://www.redalyc. org/articulo.oa?id=211116129020 (Acceso 26.03.2014).
4. Brownlee M. 1995. Advanced protein glycosylation in diabetes and aging. Annu Rev Med 46: 223-234. [ Links ]
5. Brownlee M. 2001. Biochemistry and molecular cell biology of diabetic complications. Nature 414 ( 6865): 813-820. [ Links ]
6. Brownlee M, Vlassara H, Cerami A. 1984. Nonenzimatic glycosylation and the pathogenesis of diabetic complications. Anm Intern Med 101 ( 4): 527-537. [ Links ]
7. Bucala R, Model P, Cerami A. 1984. Modification of DNA by reducing sugars: a possible mechanism for nucleic acid aging and age-related dysfunction in gene expression. Proc Natl Acad Sci USA 81 ( 1): 105-109. [ Links ]
8. Bucala R, Makita A, KoschinskyT, Cerami A, Vlassara H. 1993. Lipid advanced glycosylation: pathway for lipid oxidation in vivo. Proc Natl Acad Sci USA 90 ( 14): 6434-6438. [ Links ]
9. Bunn HF, Haney DN, Kamin S, Gabbay KH, Gallop PM. 1976. The biosynthesis of human hemoglobin A1c Slow glycosylation of hemoglobin in vivo.. J Clin Invest 57 ( 6): 1652-1659. [ Links ]
10. Caldés Melis C. 2012. Formación de bases de Schiff de aminofosfolípidos con compuestos alicantes y efecto competitivo de Vitámeros B6. Palma de Mallorca: Universidad de las Islas Baleares, Programa de Doctorado de Ciencia y Tecnología Química [Disertación Grado Doctor en Ciencia y Tecnología Química], pp. 192.
11. Campuzano-Maya G, Latorre-Sierra G. 2010. La HbA1c en el diagnóstico y en el manejo de la diabetes. Medicina & Laboratorio. 16(5-6): 211-241. Disponible en línea en: http://www.medigraphic. com/pdfs/medlab/myl-2010/myl105-6.pdf (Acceso 26.03.2014). [ Links ]
12. Cho SJ, Roman G, Yeboah F, Konishi Y. 2007. The road to advanced glycation end products: a mechanistic perspective. Curr Med Chem 14 ( 15): 1653-1671. [ Links ]
13. Cohen E. 2011. La glicosilación no enzimática: una vía común en la diabetes y el envejecimiento. Med Cutan Iber Lat Am 39 ( 6): 243-246. [ Links ]
14. Escribano Serrano J, MichánDoña A. 2013. Glucohemoglobina A1c, del 7 al 53. Diabetes Práctica. 04 ( 04): 150-155. Disponible en línea en: http://www.diabetespractica.com/docs/publi caciones/1390568783Articulo_revision_4-4.pdf (Acceso 26.03.2014). [ Links ]
15. Fan X, Zhang J, ThevesM, Strauch C, Nemet I, Liu S, Qian J, Giblin FJ, Monnier VM. 2009. Protein synthesis, post-translational modification, and degradation. J Biol Chem 284 ( 50): 34618- 34627. [ Links ]
16. Gillery P. 2013. A history of HbA1c through clinical chemistry and laboratory medicine. Review. Clin Chem Lab Med 51 ( 1): 65-74. [ Links ]
17. González Flecha FL, Castello PR, Gagliardino JJ, Rossi JPFC. 2000. La glucosilación no enzimática de proteínas. Mecanismo y papel de la reacción en la diabetes y el envejecimiento. Ciencia al Día Internacional 3 ( 2): 1-17. [ Links ] Disponible en línea en: http://www.ciencia.cl/CienciaAlDia/volumen3/ numero2/articulos/articulo2.html (Acceso 24.04.2015).
18. Ikeda K, Higashi T, Sano H, Jinnouchi Y, Yoshida M, Araki T, Ueda S, Horiuchi S. 1996. Nε- (Carboxymethyl)lysine protein adduct is a major immunological epitope in proteins modified with advanced glycation end products of the Maillard reaction. Biochemistry 35 ( 24): 8075-8083. [ Links ]
19. Isbell HS, Frush HL. 1958. Mutarotation, hydrolysis, and rearrangement reactions of glycosylamines. J Org Chem 23 ( 9): 1309-1319. [ Links ]
20. Jenkins M, Ratnaike S. 2003. Capillary electrophoresis of hemoglobin. Clin Chem Lab Med 41 ( 6): 747- 754. [ Links ]
21. Jiménez MM, Trejo MH, Romero IJ, Chávez R, Lascurain R, Zenteno E. 2002. Alteraciones de la glicosilación en enfermedades humanas. Rev Inst Nal Enf Resp Mex 15 ( 1): 39-47. [ Links ] Disponible en línea en: http://www.medigraphic.com/pdfs/iner/ in-2002/in021g.pdf (Acceso 07.05.2015).
22. Knerr T, Ochs S, Severin T. 1994. Reaction of guanosine, 2-deoxyguanosine and guanosine- 5-monophosphate with glucose. Carbohydr Res 256 ( 1): 177-183. [ Links ]
23. Koenig RJ, Peterson CM, Jones RL, Saudek C, Lehrman M, Cerami A. 1976. Correlation of glucose regulation and hemoglobin AIc in diabetes mellitus. N Engl J Med 295 ( 8): 417-420. [ Links ]
24. Maillard LC. 1912. Condensation des acides aminés sur les sucres; formation de melanoidines par voie méthodique. CR Acad Sci Paris 154::66- 68. [ Links ]
25. Maillard-Lefebvre H, Boulanger E, Daroux M, Gaxatte C, Hudson Bi, Lambert M. 2009. Soluble receptor for advanced glycation end-products: a new biomarker in diagnosis and prognosis of chronic inflammatory diseases. Rheumatology 48 ( 10): 1190-1196. [ Links ]
26. Mathews C, VanHolde K. 1998. Bioquímica. 2a ed. McGraw-Hill-Interamericana, Madrid, España, pp. 341. [ Links ]
27. Mato FE. 2009. Glicosilación de las Proteínas Sanguíneas, Revisión Bibliográfica. SIRIVS Sistema de Revisiones en Investigación Veterinaria de San Marcos. Universidad Nacional Mayor de San Marcos, Facultad de Medicina Veterinaria, Maestría en Salud Animal, Curso Investigación II. Disponible en línea en: http:// veterinaria.unmsm.edu.pe/files/diabetesEM.pdf (Acceso 26.03.2014). [ Links ]
28. Mimna R, Camus MS, Schmid A, Tuchscherer G, Lashuel Ha, Mutter M. 2007. Disruption of amyloid-derived peptide assemblies through the controlled induction of a β-sheet to α-helix transformation: application of the switch concept. Angew Chem Int Ed 46 ( 15): 2681-2684. [ Links ]
29. Münch G, Westcott B, Menini T, Gugliucci A. 2012. Advanced glycation endproducts and their pathogenic roles in neurological disorders. Amino Acids 42 ( 4): 1221-1236. [ Links ]
30. Okitani A, Cho RK, Kato H. 1984. Polymerization of lysozyme and impairment of its aminoacid residues caused by reaction with glucose. Agric Biol Chem 48 ( 7): 1801-1808. [ Links ]
31. Pérez Páez I, Rodríguez Weber FL, Díaz Greene EJ, Cabrera Jardines R. 2009. Mitos y realidad de la hemoglobina glucosilada. Med Int Mex 25 ( 3): 202-209. [ Links ]
32. Reynolds TM. 1965. Chemistry of nonenzymatic browning II Adv. Food Res 14: 167-283. [ Links ]
33. Rossi JPFC. 2007. La combinación de los azucares con las biomoléculas desde la cocina hasta el organismo. Medicina (Buenos Aires) 67 ( 2): 167-176. [ Links ]
34. Sacks DB. 2003. Hemoglobin variants and hemoglobin A1c analysis: problem solved? Clin Chem 49(8):1245-47. [ Links ]
35. Schalkwijk CG, Miyata T. 2012. Early-and advanced non-enzymatic glycation in diabetic vascular complications: the search for therapeutics. Amino Acids 42 ( 4): 1193-1204. [ Links ]
36. Schroter W. 1980. Glycosylated hemoglobins and diabetes mellitus. Eur J Pediatr 134 ( 2): 95-98. [ Links ]
37. Shapiro R, Macmanus MJ, Zalut C, Bunn HF. 1980. Sites of nonenzymatic glycosylation of human haemoglobin A. J Biol Chem 255 ( 7): 3120- 3127. [ Links ]
38. Takahashi K. 1977. Further studies on the reaction of phenylglyoxal and related reagents with proteins. Biochem. J 81 ( 2): 403-414. [ Links ]
39. Thorpe SR, Baynes JW. 1996. Role of the Maillard reaction in diabetes mellitus and diseases of aging. Drugs Aging 9 ( 2): 69-77. [ Links ]
40. Varki A, Cummings R, Esko J, Freeze H, Hart G, Marth J. 1999. Essentials of glycobiology. Protein-Glycan interactions. Cold Spring Harbor Laboratory Press. 41-59. [ Links ]
41. Weykamp C, John WG, Path FRC, Mosca A. 2009. A Review of the Challenge in Measuring Hemoglobin A1c. J Diabetes Sci Technol 3 ( 3): 439-445. [ Links ]
42. Xu Q, Park Y, Huang X, Hollenbeck A, Blair A, Schatzkin A, Chen H. 2011. Diabetes and risk of Parkinsons disease. Diabetes Care 34 ( 4): 910- 915. [ Links ]
43. Zhang Q, Monroe ME, Schepmoes AA, Clauss TRW, Gritsenko MA, Meng D, Petyuk VA, Smith RD, Metz TO. 2011. Comprehensive identification of glycated peptides and their glycation motifs in plasma and erythrocytes of control diabetic subjects. J Proteome Res 10 ( 7): 3076-3088. [ Links ]












 uBio
uBio