Saber
versión impresa ISSN 1315-0162
Saber vol.28 no.4 Cumaná dic. 2016
SISTEMA FIBRINOLÍTICO: MÉTODOS DE ESTUDIO Y HALLAZGOS EN VENENOS DE SERPIENTES DE LOS GENEROS Bothrops, Crotalus, Micrurus EN VENEZUELA
ALEXIS RODRÍGUEZ-ACOSTA1,2, ANA MARÍA SALAZAR1, EMELYN SALAZAR1, ELDA ELIZA SANCHEZ3, MARÍA EUGENIA GIRON2, IRMA AGUILAR1, JEILYN VIVAS1,BELSY GUERRERO1
1 Instituto Venezolano de Investigaciones Científicas, Centro de Medicina Experimental, Laboratorio Fisiopatología, Sección Coagulación, Caracas, Venezuela,
2 Universidad Central de Venezuela, Facultad de Medicina, Instituto Anatómico,Laboratorio de Inmunoquímica y Ultraestructura, Caracas, Venezuela,
3 Texas A&M University-Kingsville, National Natural Toxins Research Center, Kingsville, USA. E-mail: belsyguerrero@yahoo.es / bguerrer@ivic.gob.ve
RESUMEN
En la presente revisión se muestran resultados relevantes de actividades hemostáticas, con especial énfasis a las relacionadas con la fibrinólisis, presentes en venenos de serpientes venezolanas de los géneros Bothrops, Crotalus y Micrurus, que existen en diversas localidades geográficas. Con esta descripción, se presenta además una revisión de diversos ensayos que se utilizan en investigación para estos estudios. Se han evidenciado importantes diferencias inter e intra-especies, e incluso entre ejemplares de distintos espacios geográficos, lo que debe influir en los mecanismos de acción de sus venenos y la sintomatología clínica. Estas diferencias en composición y concentración de componentes activos, deben estar asociadas a variaciones estacionales o geográficas, dieta, sexo, hábitat, edad, e inclusive variabilidades genéticas. Ello podría explicar las discrepancias en los cuadros clínicos de las víctimas y también ayudar a determinar mecanismos de acción que faciliten una mejor orientación a los médicos tratantes. Estas variables ayudarían al seguimiento y tratamiento de los pacientes, orientando a los especialistas en antivenenos, en la escogencia del inóculo, con una mezcla amplia de venenos de diferentes especies, géneros, edad, sexo y procedencia, así como con toxinas de relevancia, para la preparación y obtención de estos antivenenos con valores de gran eficacia y amplio espectro. Los componentes bioactivos aislados, como las colombienasas y la tenerplasminina-1, por sus características biológicas, representan asimismo moléculas con un uso potencial como trombolíticos y antifibrinolíticos, respectivamente.
PALABRAS CLAVE: Serpentes, Viperidae, Elapidae, fibrinólisis, toxinas.
FIBRINOLYTIC SYSTEM: METHODS OF STUDY AND FINDINGS IN Bothrops, Crotalus, Micrurus SNAKE VENOMS IN VENEZUELA
ABSTRACT
In the current review, relevant results are shown on hemostatic activities, with special emphasis on those related to fibrinolysis, from venoms present in Venezuelan serpents of the genera Bothrops, Crotalus and Micrurus, captured in different geographical locations. A review is made of various research methods used for these studies. Significant differences were evidenced inter and intra-species and even between different geographic locations, which should influence the mechanisms of action and clinical symptomatology. The differences in the composition and the concentration of active components must be associated with seasonal or geographical variations, diet, sex, habitat, age, and even genetic variability, which may explain the discrepancies in the clinical pictures of victims and also help to determine mechanisms of action that provide better guidance to treating physicians. These variables could help in the monitoring and treatment of patients, and guide antivenom specialist in choosing the inoculum, from a range of different venoms of different species, gender, age, sex and origin, as well as isolated toxins relevant to the preparation of antivenoms with great efficiency and broad spectrum. The isolated bioactive compounds, such as colombienasas and tenerplasminina-1, with their biological characteristics, also represent molecules with potential use as thrombolytic agents and antifibrinolytic, respectively.
KEY WORDS: Serpentes, Viperidae, Elapidae, fibrinólisis, toxinas.
Recibido: septiembre 2016. Aprobado: septiembre 2016. Versión final: octubre 2016.
INTRODUCCIÓN
Los accidentes ofídicos, por su incidencia, severidad, así como por las secuelas y potencial mortalidad, representan un grave problema médico, social y económico en muchas partes de Asia, África y América (De Sousa et al. 2013). Según algunos estudios epidemiológicos, la Organización Mundial de la Salud para el 2010 estimó que en el mundo, anualmente pueden ocurrir un mínimo de 421.000 envenenamientos por accidentes ofídicos y alrededor de 20.000 muertes, con un valor máximo de hasta 2.500.000 envenenamientos y alrededor de 100.000 muertes (Chippaux 1998, 2008, Kasturiratne et al. 2008, WHO 2010). En Suramérica el estudio de venenos de serpientes reviste gran importancia, entre ellos los del género Bothrops responsables de más del 80% de los accidentes ofídicos, con el mayor número de muertes, seguidos por Crotalus responsables de alrededor del 15% de los accidentes; Lachesis, Porthidium y Micrurus responsables de un 5% (Rengifo y Rodríguez-Acosta 2004). Kasturiratne et al. (2008) estimaron que el número de muertes anuales por mordeduras de serpiente en América Latina oscila entre 540 y 2.298. En el año 2011, Gutiérrez reportó para Latinoamérica y el Caribe alrededor de 70.000 envenenamientos por año, cifra que está en el límite inferior del estimado por Kasturiratne et al. (2008). Las tasas de mortalidad por 100.000 habitantes por año descritas para algunos países Latinoamericanos son las siguientes: Costa Rica 0,02 - 0,15; Panamá 0,5; Venezuela 0,1 - 0,2; Brasil 0,05; Ecuador 0,05 (Gutiérrez 2011).
En Venezuela existe un alto número de accidentes por mordeduras de serpientes (alrededor de 7.000 casos), siendo la familia Viperidae causante de la mayoría de los accidentes, debido a su agresividad, grado de eficiencia en el momento de atacar y alta frecuencia en las zonas rurales y urbanas (Rengifo y Rodríguez-Acosta 2005, Navarrete et al. 2009, De Sousa et al. 2013). Esta familia, en el país comprende 6 géneros: Crotalus, Bothrops, Bothriopsis, Bothriechis, Porthidium y Lachesis (Fuentes y Rodríguez-Acosta 1997).
La presente revisión resume los resultados obtenidos por nuestro grupo de trabajo, con venenos de serpientes de los géneros Bothrops, Crotalus y Micrurus, capturadas en diversas regiones de Venezuela, además, incluyendo estudios como objetos de comparación, de venenos de Micrurus de los Estados Unidos de América, con énfasis en los efectos sobre el sistema fibrinolítico y su abordaje metodológico para evaluar estos efectos.
La importancia de estos trabajos está basada en la necesidad de establecer metodologías para estudiar actividades tóxicas relevantes, con énfasis en la fibrinólisis, que permitan determinar diferencias entre venenos, además por género y especie, por localidad geográfica, para facilitar la interpretación de los cuadros clínicos, seguimiento de los pacientes, preparación de anti-venenos más efectivos, así como orientar en la búsqueda de agentes trombolíticos y anti-fibrinolíticos naturales, con potencial aplicación terapéutica en patologías asociadas a aterotrombosis y desórdenes hemorrágicos, así como la caracterización bioquímica y biológica y la evaluación de sus actividades en modelos experimentales.
HEMOSTASIA
La hemostasia permite controlar la pérdida de la sangre como consecuencia de una lesión vascular o daño tisular por agentes externos, mediante la activación local y casi secuencial de los diferentes procesos que conforman este sistema: a) reacciones vasculares que producen modificaciones del tono vascular, así como la expresión, liberación y/o modulación de diversos componentes de la hemostasia; b) respuestas plaquetarias que desencadenan fenómenos de adhesión y agregación para formar un tapón de plaquetas y cumplir así con una primera etapa de este proceso, la llamada hemostasia primaria; c) activación de la coagulación, lo que consolida el coágulo primario y lo transforma en un tapón hemostático definitivo, proceso conocido como la hemostasia secundaria; y d) activación de la fibrinólisis para permitir la disolución del coágulo y la recanalización del vaso lesionado una vez cumplida su función, e iniciado el proceso de cicatrización y regeneración tisular (Quintana-González 2002, Colman et al. 2006a, Clemetson 2012, Vivas 2013).
Entre las múltiples sustancias exógenas que pueden activar la hemostasia se encuentran secreciones y venenos de diversos animales (serpientes, orugas, escorpiones, ciempiés, arañas, y parásitos), así como bacterias, hongos y virus, entre otros (Markland 1998, Arocha-Piñango et al. 1999, Matsui et al. 2000, Francischetti 2010, Sajevic et al. 2011, Kini 2011, Mebius et al. 2013, Serrano 2013, Chuansumrit y Chaiyaratana 2014, Maggi y Faulhaber 2015).
El fibrinógeno y la fibrina son algunos de los sustratos de la hemostasia donde actúan los componentes tóxicos de venenos. El fibrinógeno es una glicoproteína plasmática sintetizada en el hígado como una molécula de 340 kDa, conformada por un par de dímeros, que contienen tres pares de cadenas polipeptídicas, Aα, Bβ y . El proceso de conversión de fibrinógeno en fibrina, ocurre durante la activación de la coagulación, por acción de la principal enzima de este sistema, la trombina. La fibrina junto con los elementos formes de la sangre y el tapón plaquetario, originado durante la activación de la hemostasia primaria, forman el coágulo que impide la pérdida de sangre e inicia el proceso de cicatrización vascular; además, la fibrina juega un papel importante en diversas situaciones fisiopatológicas y se halla implicada en procesos como trombosis, inflamación, angiogénesis y metástasis tumoral (Colman et al. 2006b, Vivas 2013, Heissig et al. 2016).
En condiciones fisiológicas una vez cumplida su función hemostática e iniciado el proceso de regeneración del vaso lesionado, la fibrina es degradada por acción de la plasmina, enzima generada por activación del sistema fibrinolítico (Castellino y Ploplis 2005, Rijken y Lijnen 2009, Colman et al. 2006b, Hoover-Plow 2010).
Sistema Fibrinolítico
Es el principal mecanismo de defensa que evita la deposición de fibrina en el sistema vascular, integrado por la fibrina (sustrato y cofactor), el plasminógeno (zimógeno), los activadores del plasminógeno (tipo tisular-tPA y tipo uroquinasa-uPA) que transforman el zimógeno en plasmina (principal enzima de este sistema), los inhibidores de las activadores del plasminógeno conocidos como PAIs (PAI-1 principalmente a nivel vascular, PAI-2 y PAI-3 así como la proteasa nexina), los inhibidores de plasmina (α2-antiplasmina, su principal inhibidor y la α2-macroglobulina como inhibidor de amplio espectro) y los moduladores (como la porción proteica de la lipoproteína A, el inhibidor de la fibrinólisis activable por trombina, conocido como TAFI y la anexina 2). Este sistema se activa con la formación de la fibrina, a la cual se une el plasminógeno y el t-PA, para formar el complejo fibrina/t-PA/plasminógeno, que asegura una eficiente y controlada generación de plasmina en el sitio de la lesión (Lijnen 2001, Colman et al. 2006b, Rijken y Lijnen 2009, Hoover-Plow 2010, Leebeek y Rijken 2015, Longstaff y Kolev 2015) (Fig. 1).
Figura 1. Componentes del sistema fibrinolítico a nivel vascular. Zimógeno: Plasminógeno; Enzima principal: Plasmina; Inhibidor del Activador del Plasminógeno tipo 1 (PAI-1); Activadores del Plasminógeno: Tipo tisular (t-PA), Uroquinasa (UK), factor XII (FXII), Precalicreína (Pk) y Calicreína (Kk); Moduladores: Inhibidor de la Fibrinólisis Activable por Trombina (TAFI) e Inhibidor de Plasmina: α2-antiplasmina.
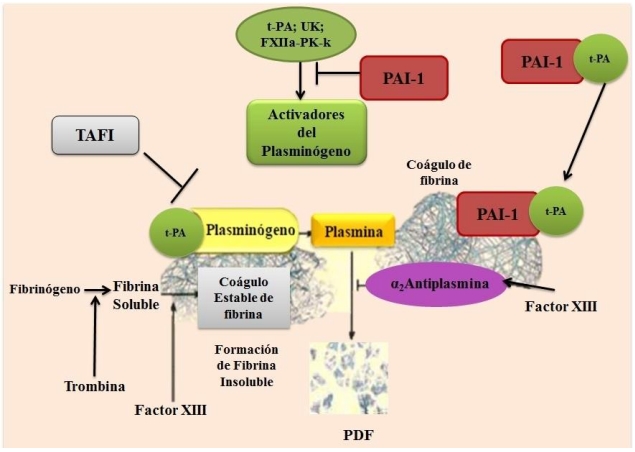
A nivel celular, el sistema fibrinolítico involucra receptores para plasminógeno, t-PA y sobre todo para u-PA (u-PAR), así como proteínas adhesivas, anexinas, integrinas y matrices, entre estas la fibrina, componentes que regulan la activación y función de este sistema en procesos celulares (Anglés-Cano et al. 2001, Castellino y Ploplis 2005, Rijken y Lijnen 2009, Heissig et al. 2016).
La plasmina además de degradar fibrina, puede actuar sobre otras proteínas como fibrinógeno, factores V y VIII de la coagulación y componentes extracelulares, facilitando procesos de remodelación tisular, invasión de células tumorales, inflamación y embriogénesis, entre otros. Esta enzima también actúa en procesos inflamatorios, al activar vías de señalización que incrementan la liberación de mediadores proinflamatorios como IL-1 y metaloproteasas de matriz (MMPs), lo que amplifica la reacción inflamatoria (Okajima 2001, Rijken y Lijnen 2009, Hoover-Plow 2010, Longstaff y Kolev 2015, Heissig et al. 2016).
La activación del sistema fibrinolítico es esencial para eliminar controladamente los depósitos intravasculares de fibrina. Diversos procesos patológicos como hiperfibrinólisis, cardiopatías, cáncer, diabetes, infecciones, inflamación y contacto con virus, bacterias y secreciones de animales, entre estos sanguijuelas, orugas, escorpiones y serpientes, pueden alterar el equilibrio de este sistema, lo que puede inducir a severas complicaciones hemostáticas, incluyendo trombosis y hemorragias (Chudzinski-Tavassi et al. 1998, Arocha Piñango et al. 1999, Colman et al. 2006b, Longstaff y Kolev 2015).
VENENOS DE SERPIENTES Y FIBRINÓLISIS
Los venenos de serpientes son mezclas de componentes inorgánicos (poliaminas, alcaloides), orgánicos (péptidos, proteínas, carbohidratos en forma de glicoproteínas, lípidos principalmente fosfolípidos, aminas, nucleótidos) y restos insolubles de tejidos. Según el efecto patológico, estos venenos se han clasificado en neuro-/miotóxicos y hemorrágicos/citotóxicos. En el primer grupo se encuentran los de la familia Elapidae, ricos en neurotoxinas y fosfolipasas tipo A2, con efectos principalmente neurotóxicos, miotóxicos y cardiotóxicos. En el segundo grupo están los de la familia Viperidae, que contienen numerosas enzimas, capaces de degradar proteínas circulantes en sangre, así como de la matriz extracelular e inducir alteraciones en los sistemas inflamatorio y hemostático de las víctimas (Kamiguti y Cardoso 1989, Kamiguti et al. 1991, Russel et al. 1997, Markland 1998, Arocha-Piñango et al. 1999, Braud et al. 2000, Calvete et al. 2009, Teixeira et al. 2009, Selistre-de-Araujo et al. 2010, Sajevic et al. 2011, Moura-da-Silva y Baldo 2012, Serrano 2013, Pinyachat 2016).
Los venenos de serpientes, principalmente de la familia Viperidae y algunos de la familia Elapidae, entre estos los del género Micrurus (Salazar et al. 2011), contienen una variedad de proteínas y péptidos que afectan el sistema hemostático, clasificadas según su acción en cuatro grupos: a) Hemorraginas, enzimas que degradan proteínas adhesivas y de la matriz extracelular, involucradas en la estructura vascular, lo que promueve desórdenes de la permeabilidad capilar; b) Proteínas que alteran plaquetas, al activar o inhibir sus funciones, entre estas fosfolipasas tipo A2, serinoproteasas, metaloproteasas, L-amino-ácido oxidasas, fosfodiesterasas, desintegrinas, lectinas tipo C y dendropeptinas; c) Proteínas que interfieren con la coagulación, que comprenden proteasas procoagulantes (activadoras de protrombina, factor X y factor V y enzimas trombino-similares) y proteínas con acción anticoagulante, entre estas inhibidores de factores IXa, Xa, trombina y proteasas que degradan fibrinógeno, activadores de la proteína C (principal regulador negativo de la coagulación) y fosfolipasas A2 que actúan como anticoagulantes, al degradar fosfolípidos de membranas plaquetarias (importantes para el ensamblaje de complejos enzimáticos del sistema de la coagulación); d) Proteasas que interfieren con la fibrinólisis, bien sea enzimas con acción directa sobre la fibrina/fibrinógeno, enzimas con actividad activadora del plasminógeno, enzimas con acción sobre el endotelio (inducen síntesis y liberación de activadores del plasminógeno y/o inhibidores), o inhibidores del sistema fibrinolítico, entre estos los de tipo serpinas que actúan como inhibidores de plasmina (Guerrero y Arocha-Piñango 1992, Alape-Girón et al. 1996, Kamiguti et al. 1996, Guerrero et al. 1997a,b, Markland 1998, Arocha-Piñango et al. 1999, Guerrero et al. 1999, Braud et al. 2000, Matsui et al. 2000, Laing y Moura-da-Silva 2005, Swenson y Markland 2005, Sánchez y Swenson 2007, Salazar et al. 2007, Girón et al. 2008, Larréché et al. 2008, Salazar et al. 2008, Da Silva et al. 2009, Fox y Serrano 2009, Salazar et al. 2009, Sánchez et al. 2009, Salazar et al. 2011, Sánchez et al. 2010, Bos y Camire 2010, Clemetson 2010, Guerrero et al. 2011, Sajevic et al. 2011, Girón et al. 2013a,b, Berling e Isbister 2015, Lucena et al. 2016).
Enzimas con acción sobre Fibrina/Fibrinógeno
Según la cadena del fibrinógeno sobre la cual actúen más rápidamente, estas enzimas se han clasificado como α, β y fibrinogenasas, las cuales no presentan una especificidad absoluta, ya que pueden actuar sobre las diferentes cadenas al incrementar el tiempo de incubación o la dosis. No se han reportado enzimas de venenos de serpientes que degraden específica y exclusivamente la cadena del fibrinógeno, sin embargo, existen reportes con acción sobre estas cadenas (Markland 1998, Lu et al. 2005, Swenson y Markland, 2005, Rodríguez-Acosta et al. 2010, Girón et al. 2013a, b).
En los últimos años, se han identificado, aislado y caracterizado, de venenos bothrópicos venezolanos, de diferentes especies, un gran número de enzimas fibrino(geno)líticas (Salazar et al. 2007, 2009, Girón et al. 2008, 2013a,b). Estas enzimas al actuar sobre el fibrinógeno/fibrina pueden desencadenar un síndrome hemorrágico local o sistémico asociado a hipo o afibrinogenemias y/o coagulopatías, lo que complica la evolución clínica de las víctimas de accidentes bothrópicos (Sánchez y Swenson 2007).
Entre los componentes tóxicos de venenos de animales que actúan sobre el fibrinógeno/fibrina se encuentran:
a) Las metaloproteasas de venenos de serpientes (MPVS): enzimas que abundan en venenos de la familia Viperidae y en menor cantidad en la familia Elapidae y Colubridae (Moura-da-Silva et al. 2007, Markland y Swenson 2013). Las MPVS son toxinas que contienen múltiples dominios, que se han clasificado en tres clases. Las MPVS de clase PI (20-30 kDa) contienen el dominio catalítico típico de metaloproteasas; las de clase PII (30-60 kDa) contienen además un dominio desintegrina C-terminal; las de clase PIII representan aquellas que contienen un dominio C-terminal rico en cisteínas (60-90 kDa) que tienden a ser las más hemorrágicas; y las que presentan un dominio lectina tipo C (60 -100 kDa), unido mediante enlaces disulfuro entre sí y al dominio rico en cisteínas, relativamente raras que requieren de cisteínas libres no conservadas en las MPVS PIII. Las MPVS aisladas de venenos bothrópicos se les han atribuido diversas acciones sobre el sistema hemostático. Las de clase P-I se han asociado a actividad fibrinolítica, por su parte las de clase PIII con actividad hemorrágica, fibrinolítica y procoagulante (activadores de protrombina y factor X) (Bjarnason y Fox 1994, Jia et al. 1996, Kini 2005, Fox y Serrano 2009, Markland y Swenson 2013, Bernardoni et al. 2014).
La mayoría de las MPVS con actividad fibrino(geno)lítica son α-fibrinogenasas, capaces de hidrolizar preferencialmente las cadenas Aα del fibrinógeno, aunque con tiempos de incubación más prolongados pueden actuar sobre las cadenas Bβ (Swenson y Markland 2005, Guo et al. 2007, Sánchez et al. 2010, Leonardi et al. 2007, Jia et al. 2009). Estas enzimas, por su capacidad al degradar coágulos de fibrina sin estimular la fibrinólisis endógena (no activar plasminógeno) y al no ser inactivadas por los inhibidores fisiológicos de la hemostasia (SERPINAS), presentan un gran potencial terapéutico en enfermedades tromboembólicas (Markland y Swenson 2010). Entre estas enzimas se encuentran las colombienasas aisladas de Bothrops colombiensis (Girón et al. 2013a,b).
b) Las serinoproteasas de venenos de serpientes (SVSP): son enzimas que abundan en venenos de la familia Viperidae y en menor proporción en la familia Elapidae y Colubridae, que poseen al menos un dominio catalítico estructuralmente similar a la tripsina, y que a nivel de la hemostasia actúan sobre los sistemas vascular, calicreína/quinina, coagulación y fibrinolítico (Serrano y Maroun 2005, Serrano 2013). Sobre el sistema fibrinolítico actúan principalmente como activadores del plasminógeno, cuya actividad fue descrita por primera vez en el veneno de Trimeresurus stejnegeri, donde identificaron un compuesto denominado TSV-PA, asociado a una serinoproteasa de 33 kDa con acción sobre el enlace Arg561-Val562 del Pg, de la misma forma que los activadores fisiológicos del plasminógeno, t-PA y u-PA (Zhang et al. 1995, Sánchez y Swenson 2007). Del veneno de Lachesis muta muta, también ha sido aislado un activador de plasminógeno, una glicoproteína de 33 kDa asociada a una serinoproteasa (Sánchez et al. 2000, Hermogenes et al. 2006). Del veneno de Agkistrodon halys brevicaudus se aisló la haly-PA (Park et al. 1998). Adicionalmente las SVPSs también pueden presentar actividad fibrinogenolítica, asociadas a β-fibrinogenasas, las cuales actúan principalmente sobre las cadenas Bβ del fibrinógeno (Swenson y Markland 2005). Entre éstas se encuentran la harobin aislada de Lapemis hardwickii (He et al. 2007); la BpSP-I de Bothrops pauloensis (Costa et al. 2009).
Adicionalmente, en componentes activos de venenos de serpientes se ha detectado una actividad estimuladora de células endoteliales con liberación de activadores del plasminógeno, entre estas la metaloproteasa batroxobina aislada de Bothrops atrox; así como actividad potenciadora de la fibrinólisis asociada al t-PA, al disociar complejos t-PA/PAI-1, como la jararagina, una metaloproteasa aislada de Bothrops jararaca (Klöcking et al. 1987, Sugiki et al. 1995, Kamiguti et al. 1996, Laing y Moura-da-Silva 2005).
c) Los antifibrinolíticos: por lo general son inhibidores de serinoproteasas que pueden actuar sobre plasmina, enzima que juega un papel importante en la modulación de trombosis, fibrinólisis, inflamación y apoptosis. Estos inhibidores pueden tener una aplicación clínica en cuadros hemorrágicos asociados a hiperfibrinólisis (Masci et al. 2000, Cheng et al. 2005, Flight et al. 2005, 2009, Qiu et al. 2013, Wan et al. 2013, Kolev y Longstaff 2016). Los estímulos fisiológicos, como estrés y ejercicio exhaustivo o condiciones patológicas como dengue
hemorrágico, cáncer, leucemia promielocítica aguda, hipotensión, trauma quirúrgico, cirrosis, deficiencias de inhibidores o moduladores negativos del sistema fibrinolítico, deficiencias de factores de la coagulación como el VIII o IX asociados a una baja generación de trombina, pueden inducir una hiperfibrinólisis primaria con manifestaciones clínicas de sangrado (Rodeghiero et al. 1994, Grünewald et al. 2002, Kolev y Longstaff 2016).
Dos categorías de agentes terapéuticos se han empleado como agentes antifibrinolíticos, para reducir situaciones clínicas asociadas con desregulación de la fibrinólisis: la aprotinina, un inhibidor de serinoproteasas; y análogos de la lisina, tales como el ácido ε-aminocaproico (EACA) y el ácido tranexámico (Ortmann et al. 2013, Kolev y Longstaff 2016). Recientemente, del veneno de Micrurus tener tener fue identificado,
aislado y caracterizado un antifibrinolítico que actúa como un inhibidor de plasmina, denominado tenerplasminina-1, con una masa molecular de 6.542 Da (Salazar et al. 2011, Vivas 2013, Vivas et al. 2016), el cual presenta una acción similar a otros inhibidores de plasmina aislados de venenos de diversos animales (Masci et al. 2000, Brazón et al. 2009, Choo et al. 2012, Cheng y Tsai 2013, Qiu et al. 2013, Wan et al. 2013).
Para caracterizar compuestos con actividades relacionadas con el sistema fibrinolítico, en nuestro grupo se estudiaron mezclas de venenos de serpientes por especie y localidad geográfica, de los géneros Bothrops, Crotalus y Micrurus, evaluando también otras actividades relacionadas con la hemostasia que permitan a futuro estudiar en modelos animales, su potencial aplicabilidad terapéutica.
MÉTODOS PARA EVALUAR EL EFECTO DE VENENOS DE SERPIENTES O SUS FRACCIONES SOBRE EL SISTEMA FIBRINOLÍTICO
Venenos
Los venenos en estudio, se recolectaron como mínimo de 6 serpientes adultas por especie y de diversas regiones geográficas. Entre éstos los de B. atrox (Parguasa, estado Bolívar; Puerto Ayacucho 1, Serranía del Cuao y Puerto Ayacucho 2, estado Amazonas), B. colombiensis (El Guapo y Caucagua, estado Miranda), Bothrops isabelae (estado Trujillo), Crotalus durissus cumanensis (Lagunetica, Carrizales,Guarenas, Santa Teresa, estado Miranda; estado Aragua; estado Anzoátegui y Margarita, estado Nueva Esparta), Micrurus isozonus (Calabozo, estado Guárico; Caracas, Distrito Capital; La Boyera, estado Miranda; Maracay, estado Aragua), M. t. tener y Micrurus fulvius fulvius (Texas y Florida, USA). Las serpientes capturadas en Venezuela fueron mantenidas en cautiverio en el Serpentario del Instituto de Medicina Tropical de la Facultad de Medicina de la Universidad Central de Venezuela. Para la obtención del veneno de los diferentes ejemplares se realizaron ordeños cada 30 días, mediante procedimiento manual. Los venenos fueron centrifugados a 2000 g por 10 min a 4°C, liofilizados y almacenados a -80°C. Los venenos de M. t. tener y M. f. fulvius fueron adquiridos en el Centro Nacional de Investigación de Toxinas Naturales (NNTRC, Texas A&M University-Kingsville, Texas, USA).
Concentración de proteínas
Para las fracciones, la concentración se determinó por espectrometría, según la ley de Beer (Simonian y Smith 2006), asumiendo que una unidad de absorbancia es equivalente a 1 mg/mL de proteína, cuando un haz de luz a 280 nm incide sobre una muestra contenida en una celda de 1 cm de longitud. Para venenos completos se empleó el método de Lowry et al. (1951).
Células en cultivo
Línea de células endoteliales, de sinusoide hepático (LSEC), fue cultivada en medio específico HAM-F12 suplementado, conteniendo 10% de Suero Fetal de Bovino (SFB), y mantenida a 37°C con 5% de CO2 en atmósfera húmeda. Para obtener las células requeridas para los ensayos, en estado subconfluente, se agregó tripsina/EDTA al 0,01% en PBS a 37°C, luego de 2-3 min las células despegadas se recolectaron y centrifugaron a 1.800 g por 10 min. El paquete celular se resuspendió en medio específico suplementado, conteniendo 10% de SFB.
Para los experimentos, la solución de células fue ajustada a 150.000/pozo, para ello se agregó azul de Tripan al 0,4% y en cámara de Neubauer se contaron bajo microscopio, y se incubaron por 4 h a 37°C, con 5% de CO2 en atmósfera húmeda. Finalmente los cultivos fueron estimulados a diferentes tiempos (4, 24 y 48 h) con las dosis de veneno, usando como control positivo trombina. Para realizar los ensayos hemostáticos, el sobrenadante y las células se recolectaron después de los tiempos establecidos, y de inmediato se realizaron las determinaciones.
Animales de experimentación
Ratones machos de las cepas BALB/c y C57BL/6 entre 8 y 10 semanas (18 y 20 g), fueron suministrados por el Bioterio Central del Instituto Venezolano de Investigaciones Científicas (IVIC). Durante un período previo a las pruebas (8 días), los ratones fueron mantenidos en el Bioterio del Centro de Medicina Experimental-IVIC, a temperatura entre 22 y 24°C, con ciclos de luz /oscuridad de 12 h cada uno, con agua y comida ad libitum. El protocolo para el uso de animales fue aprobado previamente por la Comisión de Bioética para Investigación en Animales del IVIC y bajo las normas del uso de animales de experimentación del Instituto Anatómico de la Universidad Central de Venezuela. Así mismo, la manipulación de los animales siguió los principios de cuidado y manejo previamente establecidos por el National Institute of Health y el sub-comité de manejo de animales (NIH 1985, Giles 1987).
ACTIVIDADES BIOLÓGICAS
Letal
Se expresó como Dosis Letal Cincuenta (DL50), y se definió como la cantidad de veneno o fracción que por vía intravenosa (i.v.) causó lamuerte del cincuenta por ciento de los animales en 24 h. Para el ensayo, dosis seriadas de veneno o fracción disueltas en 0,2 mL de NaCl al 0,85% se inyectaron a grupos de 5 ratones/dosis; luego de 24 h se registró el número de animales muertos y se determinó la letalidad aplicando el método de Spearman-Kärber (1978), propuesto por la Organización Mundial de la Salud (WHO 2010). Los animales controles se trataron con solución salina isotónica.
Hemorrágica
Se usó el modelo en piel, usando el método de Omori-Satoh (1972) y se expresó como la Dosis Hemorrágica Mínima (DHM, cantidad de veneno capaz de producir una lesión hemorrágica con un diámetro de 10 mm, en 2 h). Para el ensayo, se inyectaron por vía intradérmica (i.d.) en región abdominal, dosis seriadas sub-letales del veneno disuelto en 0,1 mL de solución salina isotónica, usando como mínimo 4 ratones/dosis. Los animales controles se trataron con solución salina isotónica. Los animales se sacrificaron con CO2, se les disecó la piel y se determinó el diámetro de la lesión hemorrágica, la cual se expresó en mm2.
Edematizante
Por el método de Yamakawa et al. (1976), modificado por Scannone, con base en el Manual del Instituto Clodomiro Picado (Dr. Héctor Scannone, comunicación personal). En la almohadilla plantar del miembro posterior derecho de ratones (en caso de venenos se recomiendan ratones C57BL/6 machos de 18 a 22 g por ser cepas sensibles (Barrios et al. 2012), se inyectaron 30 µL de solución de veneno a evaluar, a diferentes dosis (1-10 µg). Como control, en el miembro posterior izquierdo se inyectaron 30 µL de solución fisiológica. Después de diferentes tiempos (30, 60, 120, 240 y 480 min), los ratones se anestesiaron con CO2 y sacrificaron para extraer los miembros posteriores que se pesaron en balanza analítica. Los resultados se expresaron en porcentaje de edema del miembro (aumento de peso) con respecto al control.
Hialuronidasa
Por una modificación del método de Queiroz et al. (2008). En placas de 96 pozos se agregaron 20 µL del veneno (1-10 µg), 60 µL de ácido hialurónico (0,5 mg/mL) y 20 µL de tampón 50 mM acetato de sodio, pH 6,0 conteniendo 0,15 M NaCl. Se incubó por 30 min a 37°C y luego se agregaron 200 µL de 2,5% bromuro de cetiltrimetilamonio en 2% NaOH y se determinó la absorbancia a 405 nm. Los resultados se expresaron como unidades de reducción de turbidez (URT)/µg de veneno, tomando como 100% de actividad la absorbancia del ácido hialurónico en presencia de PBS estéril.
Fosfolipasa tipo A2
Por el método de Gutiérrez et al. (1985). Se disolvieron 3 g de agar en 300 mL de tampón PBS, pH 7,2; se calentó hasta disolver y luego de enfriar a 55°C se agregaron 20 µL 0,01 M CaCl2, 3 g de azida de sodio, 6 mL de suspensión de yema de huevo fresco y 3,6 mL de eritrocitos de carnero, se mezcló suavemente y sobre placas de Petri de 10 cm se vertieron 25 mL de la solución. Sobre el gel formado se perforaron pozos de 3 mm de diámetro, donde se colocaron 15 μL de veneno o fracción a diferentes concentraciones (1-50 μg), se incubó en cámara húmeda a 37°C y luego de 18 h se midió el área de hemólisis. Como control negativo se empleó PBS estéril. Los resultados se expresaron en mm2.
Gelatinolítica
Por el método de Guerrero et al. (2010) que emplea geles de acrilamida donde se copolimeriza gelatina (1 mg/mL). Para el ensayo, en un gel de acrilamida al 7,5% que contiene 1 mg/mL de gelatina, se corrieron entre 5 y 10 µg de veneno o fracción en tampón 50 mM Tris-HCl, pH 7,3, en condiciones no reducidas. Después de electroforesis, para remover el SDS, el gel se lavó dos veces por 30 min con Tritón X-100 al 2,5%, luego con agua destilada por 5 min, con agitación suave y continua por tres veces. El gel se incubó toda la noche a 37°C en tampón 50 mM Tris-HCl, pH 7,3 conteniendo 200 mM NaCl, 1mM CaCl2 y 1mM MgCl2. Finalmente se coloreó con 0,5% azul de Coomassie por 2 h, luego se decoloró con etanol:ácido acético:agua (30:7:63). Las zonas claras del sustrato lisado que contrastan con el fondo oscuro, revelan la presencia de enzimas gelatinolíticas. En el gel se corrieron también marcadores de masa molecular precoloreados, para establecer la masa relativa de las proteínas activas.
Proteolítica sobre proteínas de matriz extracelular (MEC)
Por el método de Lucena et al. (2006). Se evaluaron diferentes relaciones de proteína: veneno y tiempos de incubación, a 37°C para laminina y fibronectina y a 25°C para colágeno tipo IV. La reacción se detuvo agregando 2 µL de 20% azul de bromofenol en glicerol y 3 µL de 2% DTT- 2% SDS, en un baño de hielo. Las muestras se llevaron a ebullición por 3 min y los cambios en las moléculas se visualizaron por electroforesis en geles SDS-PAGE al 7,5% (Laemmli 1970), empleando coloración con azul de Coomassie o inmunodetección. Como controles se evaluaron proteínas pre-incubadas con tampón.
ACTIVIDADES RELACIONADAS CON LA FIBRINOLISIS
Amidolítica
Siguiendo el método de Guerrero y Arocha-Piñango (1992) que emplea sustratos cromogénicos (Chromogenix AB-Mölndal Sweden) específicos para enzimas con actividad fibrinolítica semejante a plasmina (S-2251, 0,80 mM), t-PA (S-2288, 1,20 mM), calicreína (S-2302, 0,44 mM) y uroquinasa (S-2444, 0,30 mM). Como controles positivos se usaron enzimas patrón. Para el ensayo, en microplacas de poliestireno de 96 pozos se agregaron 70 µL de tampón (recomendado para cada sustrato en particular), 20 µL de muestra (1-10 µg) y 10 µL del sustrato a la concentración final indicada. Se incubó a 37°C y se determinó la absorbancia a 405 nm cada 5 min, hasta un máximo de 30 min. La actividad amidolítica se expresó en mUA 405 nm/min/µg.
Activadora del plasminógeno
Por modificación del método de Mussoni et al. (1979). Como sustrato se empleó plasma humano citratado o plasminógeno (Plg) purificado (Chromogenix AB-Mölndal Sweden) y como activador de plasminógeno se empleó estreptoquinasa (Sk), que forma un complejo Plg-Sk, en el cual el Plg adquiere una conformación de pseudo-enzima capaz de generar plasmina, que fue evaluada con el sustrato cromogénico S-2251. En placas de poliestireno de 96 pozos se colocaron 20 L de plasminógeno (2 µM) o de plasma, 20 L de veneno o fracción, evaluando diversas relaciones plasminógeno: veneno / fracción (entre 10:1 y 50:1, tomando en cuenta que en plasma la concentración de este sustrato es de alrededor de 2 mM) y 20 L de tampón recomendado para el sustrato. Después de incubar a 37°C por 10 min, se colocaron 20 L del sustrato cromogénico S-2251 (0,80 mM, concentración final), se incubó a 37 C y a los 5, 15 y 30 min se determinó la absorbancia a 405 nm. La actividad activadora de Plg se expresó en UI/similares a Sk/g de veneno, para lo cual se empleó una curva de referencia preparada con diferentes dosis de Sk (0,01 - 10 UI /mL).
Fibrinolítica en placas de fibrina
Siguiendo el método de Marsh y Arocha-Piñango (1972). Las placas de fibrina se prepararon a partir de fibrinógeno en presencia ( 10 %) o ausencia de plasminógeno. En placas de Petri de 35 mm se agregaron 1,5 mL de solución de fibrinógeno (0,3%, en tampón 50 mM imidazol - 0,15 M NaCl, pH 7,4) y 75 µL de 10 UI/mL trombina bovina (disuelta en 0,025 M CaCl2), se mezcló e incubó a temperatura ambiente por 30 min. Luego se aplicaron 10 µL de la muestra (1-10 µg) y después de 24 h a 37°C se determinó el área de lisis (mm²). La actividad se expresó como el área de lisis por µg de proteína (mm²/µg). Como controles positivos se emplearon plasmina (actividad directa) y sct-PA o tcu-PA (actividad activadora de plasminógeno).
Fibrinolítica en microplacas de fibrina
Por modificación del método de placas de fibrina de Marsh y Arocha-Piñango (1972). En microplacas de 96 pozos de fondo plano se prepararon coágulos de fibrina mezclando 200 µL de solución de fibrinógeno (0,3%, en tampón 50 mM imidazol - 0,15 M NaCl, pH 7,4) y 12 µL de 10 UI/mL trombina bovina (disuelta en 0,025 M CaCl2), luego de 30 min se determinó la absorbancia a 405 nm. La actividad fibrinolítica de venenos o fracciones, se evaluó adicionando sobre el gel de fibrina 10 µL de muestra (1-10 µg), luego se incubó en cámara húmeda a 37°C por 18 h y se determinó la absorbancia a 405 nm. La absorbancia de la fibrina en presencia de tampón imidazol se tomó como el 100%, la cual disminuyó al ocurrir la lisis. La actividad fibrinolítica se expresó como el porcentaje de disminución de la absorbancia de la fibrina en presencia del veneno. La actividad se comparó con plasmina (actividad directa) y con t-PA o u-PA (actividad activadora de plasminógeno).
Lisis del coágulo
La actividad fibrinolítica evaluada por el método de lisis del coágulo, se basa en el registro de cambios de absorbancia en función del tiempo,de un coágulo formado por trombina en presencia de t-PA. Para el ensayo, en microplacas de fondo plano de 96 pozos, se mezclaron 155 µL de tampón 50 mM Tris-HCL-0,15 M NaCL, pH 7,4,20 µL de plasma citratado, 20 µL de trombina/calcio (1,5 UI/mL en 0,2 M CaCl2) y 5 µL t-PA (1,7 nM). Luego dentro de un lector de microplacas a temperatura ambiente (Sunrise-Tekan, USA), se determinó la absorbancia a 340 nm cada 2 min, durante 90 min. Para evaluar la actividad fibrinolítica inducida por venenos o fracciones activas, se sustituyó el t-PA por solución de veneno o fracción, a diferentes dosis (1-10 µg). A partir de la curva que se graficó con los cambios de absorbancia en función del tiempo se determinaron los siguientes parámetros. Tiempo de Lisis (TL): Es el tiempo que transcurrió desde el inicio de la polimerización, hasta la completa disolución del coágulo y se expresó en segundos. Tiempo de Lisis 50 (TL50): Es el tiempo que transcurrió desde el inicio de la polimerización hasta la disolución del 50% del coágulo y se expresó en segundos. Velocidad de Lisis (VL): Se determinó por el valor de la pendiente de la curva, en la parte lineal descendente que corresponde a la zona de lisis, y se expresó en unidades de absorbancia en función del tiempo, en valor absoluto.
Zimografía de fibrina
La zimografía sobre fibrina se determinó por el método de Carvajal y Arocha-Piñango (1991). Inicialmente sobre un gel de poliacrilamida-SDS, en condiciones no reducidas, se realizó la separación electroforética de las proteínas del veneno o fracción (la cantidad que produjo un área de lisis en placas de fibrina de aproximadamente 600 mm²). Finalizada la corrida, para eliminar el SDS el gel se lavó dos veces con 0,2% Tritón X-100 y tres veces con agua destilada, con agitación constantemente durante 1 h a temperatura ambiente. Luego el gel se colocó sobre una placa de fibrina-agarosa, que se preparó mezclando 8,5 mL de 1,2% fibrinógeno (tampón imidazol-salino pH 7,4, en presencia o ausencia de plasminógeno, según se evalúe actividad activadora de plasminógeno o acción directa sobre la fibrina), con 8,5 mL de 2,5% (p/p) agarosa de bajo punto de fusión y 2 mL de 1 UI/mL de trombina (en 0,025 M CaCl2). La mezcla se vertió sobre una lámina de GelBond (8 x10 cm) y el gel formado se dejó estabilizar durante 30 min a temperatura ambiente. Esta placa de fibrina-agarosa-gel se incubó en cámara húmeda a 37°C y luego de 18 h se retiró el gel y la lámina de GelBond se coloreó con “Amido Black” [0,1%, en una mezcla de metanol/ácido acético/agua (70:10:20)] por 5 min;seguidamente se lavó con metanol puro hasta que el fondo permitió visualizar las áreas de lisis como zonas más claras sobre la lámina coloreada, luego se secó en estufa a 37°C. Como control positivo se empleó plasmina (actividad directa) y t-PA o scu-PA (actividad activadora de Pg). Las masas moleculares relativas de las bandas activas se determinaron por medio de patrones pre-coloreados que se corrieron en el mismo gel.
Degradación de fibrina
La actividad fibrinolítica se evaluó también por medio del patrón de degradación de fibrina, siguiendo el método de Lucena at al. (2006). Para el ensayo, se mezclaron 0,3% fibrinógeno (en tampón 0,05 M Tris pH 7,4 conteniendo 0,15 M NaCl y 0,02 M CaCl2), 2 UI/mL factor XIII (purificado siguiendo el método de Guerrero et al. (1999), 2 UI/mL trombina bovina (preparada en KCl 0,15 M/0,25M CaCl2). A los coágulos formados, luego de 3 h a 37°C se les agregó veneno o fracción (1 - 50 µg/mL), se incubó a 37°C y después de 0, 30 y 90 min, 3 y 24 h, la reacción se detuvo agregando un volumen igual de mezcla reductora (2% SDS - 2% ditiotreitol (DTT), 0,025% azul de bromofenol y 50% glicerol), sobre un baño de hielo. Después las muestras se llevaron a ebullición por 3 min, se centrifugaron por 5 min a 10.000g y se sometieron a electroforesis en geles al 7%, por el sistema Tris-Tricina (Schägger y von Jagow 1987), visualizando las bandas con 0,5% azul de Coomassie. Como control positivo se empleó 0,15 UI/mL plasmina.
Degradación de fibrinógeno
La actividad fibrinogenolítica se evaluó por medio del patrón electroforético de la molécula o cadenas del fibrinógeno, siguiendo el método de Salazar et al. (2007) y por la actividad coagulante remanente. El Fg disuelto en tampón 0,05 M Tris-HCl, pH 7,4, se incubó a 37°C por 4 h con veneno o fracción, inicialmente a distintas relaciones (Fg: veneno). Luego a una relación adecuada donde se observó una degradación intermedia, se evaluaron distintos tiempos de incubación. La electroforesis se realizó en geles de poliacrilamida al 7%, en condiciones no reducidas (molécula) y al 10%, en condiciones reducidas (cadenas), utilizando el sistema Tris-Tricina. Las bandas se visualizaron con la coloración con 0,5% azul de Coomassie.
La actividad coagulante remanente de Fg tratado se determinó por el método de Austen y Rhymes (1975). Para el ensayo, se mezclaron 100 µL de Fg (en tampón 0,05 M Tris - 0,15 M NaCL, pH 7,4, tampón de coagulación) con 100 µL de 2,5 UI/mL trombina bovina (en 0,025 M CaCl2), inmediatamente con movimientos suaves dentro de un baño de María a 37°C, se determinó el tiempo requerido para formar coágulo. Como control se empleó Fg incubado en tampón de coagulación.
Antifibrinolítica
La actividad inhibitoria de la fibrinólisis fue estudiada por medio de la plasmina. La actividad remanente de la plasmina pretratada con veneno o fracciones cromatográficas fue evaluada por el método amidolítico descrito previamente, para lo cual se mezcló una cantidad determinada de plasmina (1 μM) con veneno (entre 0,5 y 5 μg/μL) o fracción (0,5 - 4 μM), luego se incubó a 37°C por 30 min y se determinó la actividad residual de la enzima.
Alternativamente se evaluó la actividad de la plasmina en placas de fibrina, para lo cual 10 μL de la mezcla anterior se aplicaron sobre un gel de fibrina y después de 24 h a 37°C de determinó el área de lisis. El efecto del veneno o fracciones se expresó en % de aumento o disminución, según los resultados obtenidos de la enzima pretratada con una solución tampón imidazol - salino, pH 7,4 que representó el 100% de actividad. Como control de inhibición de plasmina se usó aprotinina (100 UI/mL).
Actividades evaluadas en modelos celular y animal
Para evaluar el efecto de venenos o fracciones sobre actividad fibrinolítica en células múridas implicadas en la respuesta hemostática (células endoteliales y macrófagos), inicialmente se determinó la citotoxicidad y luego se determinó el efecto sobre el sistema fibrinolítico con dosis no citotóxicas de veneno o fracción.
Para medir el efecto citotóxico del veneno sobre las células se utilizó el ensayo de sulforrodamina B (Vichai y Kirtikara 2006). Para el ensayo, las células fueron sembradas en placas de fondo plano de 96 pozos (Corning, USA) a razón de 20 x 103/100 L pozo (células endoteliales) y 150 x 103/100 L pozo (macrófagos peritoneales), en medio específico, luego se incubaron por 24 h a 37 C, se descartó asépticamente el medio y se agregaron los tratamientos (venenos o fracciones, a diferentes dosis entre 0 y 100 g/mL, como mínimo ocho dosis crecientes) en el medio de cultivo específico para cada línea celular en 100 L/pozo.
Para evaluar el efecto sobre el sistema fibrinolítico, en placas de 96 pozos se cultivaron 150 x 104 macrófagos/pozo o 20 x 104 células endoteliales/ pozo. Luego de 2 h se agregaron los tratamientos (venenos o fracciones) o la trombina (1 y 5 UI/mL) como control positivo. Los cultivos se incubaron a 37°C por 4, 24 y 48 h; luego se recolectaron los sobrenadantes que se almacenaron -70°C hasta su uso. Lisis de euglobulinas
Es un ensayo utilizado para determinar la actividad fibrinolítica en plasma, en el cual se evalúan proteínas hemostáticas incluyendo fibrinógeno, plasminógeno y sus activadores, en ausencia de inhibidores (entre estos 2-antiplasmina y PAIs), emplea un fraccionamiento de las euglobulinas del plasma a bajo pH y fuerza iónica (Kowalski at al. 1959, Booth 1991, Smith at al. 2003). Este ensayo fue utilizado en estos trabajos para evaluar la actividad fibrinolítica en los sobrenadantes celulares, siguiendo el método de Barrios et al. (2009, 2012).
Para el ensayo, sobre un baño de hielo, en un tubo plástico se mezclaron 0,9 mL de 0,01% ácido acético y 0,05 mL de los sobrenadantes de las células tratadas, se incubó a 4°C por 30 min y se centrifugó por 10 min a 1400 g. El precipitado se resuspendió en 0,05 mL de tampón 0,05 M Tris, pH 7,4; luego se determinó la actividad fibrinolítica por el micrométodo de placas de fibrina o por la actividad amidolítica sobre los sustratos cromogénicos S-2444 y S-2288, miden actividad similar a u-PA y t-PA, respectivamente, siguiendo los ensayos antes descritos.
Para evaluar el efecto in vivo de venenos o fracciones sobre la actividad fibrinolítica, se emplearon ratones C57BL/6, inyectados por vía intraperitoneal (i.p.) con veneno o fracción, a dosis subletales, en 200 µL de solución salina estéril. Luego de 24, 48 o 72 h los animales fueron colocados en una cámara con éter sin llegar a la muerte, con una inyectadora estéril de 1 mL se les realizó una punción limpia a nivel del corazón, y se les extrajo aproximadamente 1 mL de sangre. Finalmente, los animales fueron eutanizados en cámara de C02.
Para los ensayos de hemostasia, una porción de sangre se mezcló con citrato de sodio al 3,8%, a una relación 9:1, luego para obtener el Plasma Pobre en Plaquetas (PPP) se centrifugó a 2.000 g por 15 min a 4°C. La actividad fibrinolítica se evaluó por medio del método de lisis de fibrina por euglobulinas, descrito previamente.
OTRAS ACTIVIDADES HEMOSTÁTICAS
Agregación plaquetaria
Por el método de Da Silva et al. (2009), con un agregómetro (Chrono-Log, modelo 560, C.A, USA). Para el ensayo, de donantes sanos que no consumieron
aspirina o anti-agregantes plaquetarios en los nueve días previos al ensayo, se extrajo sangre por punción venosa, la cual fue anticoagulada con citrato de sodio al 3,8% a una relación 9:1. Luego para obtener PRP se centrifugó a 250 x g por 15 min a temperatura ambiente. Para obtener Plasma Pobre en Plaquetas (PPP) el paquete globular se volvió a centrifugar a 1.000 x g por 15 min.
Para el ensayo de agregación, en una cubeta del agregómetro se colocaron 500 μL de PRP (ajustado a 300.000 plaquetas/mm3 con el PPP), se preincubó a 37°C durante 4 min, luego se agregaron concentraciones variadas del veneno o fracción (entre 1 - 20 μg), y se indujo la agregación con la adición de 5 μL de adenosin difosfato (ADP, 10 μM), colágeno (2 μg/mL), trombina (0,6 UI/mL) o ristocetina (1,25 mg/mL), concentración final; luego se registraron los cambios de tramitancia durante 8 min. Los resultados se compararon con los obtenidos con plaquetas tratadas con tampón 0,05 M Tris - 0,15 M NaCl, pH 7,4.
Procoagulante
Por el método amidolítico antes descrito y por el método coagulante de Salazar et al. (2007) que emplea como sustrato, fibrinógeno bovino o plasma citratado fresco congelado, según se evalúe actividad semejante a trombina o procoagulante. Para el ensayo, se preincubaron por 3 min a 37°C, 100 µL de plasma citratado o de solución de fibrinógeno (0,3% en tampón de coagulación), luego se agregaron 100 µL de tampón de coagulación y 100 µL de solución de trombina (entre 0,5 y 15 UI/mL) o 100 µL de veneno/fracción (1-50 µg), se mezcló y en un baño de María a 37°C con movimientos suaves se determinó el tiempo de coagulación. La actividad semejante a trombina fue reportada en UI/mL, referida a la curva del estándar.
Inhibitoria de enzimas de la hemostasia
Las enzimas de la hemostasia en su mayoría son serinoproteasas, excepto el factor XIII que es una transglutaminasa. Para evaluar la actividad amidolítica de estas enzimas, como herramienta diagnóstico se emplean sustratos cromogénicos, que son péptidos sintéticos de tres a cinco aminoácidos unidos en el extremo N-terminal a un cromóforo, la p-nitroanilina (p-NA), con una secuencia que simula al sustrato natural de la enzima en estudio, la cual hidroliza el enlace amida y libera la p-NA que absorbe a 405 nm (http://www.chromogenix.com).
El efecto de venenos o fracciones sobre la actividad amidolítica de trombina, factor Xa o tPA, se evaluó siguiendo el método de Guerrero y Arocha-Piñango (1992). Para el ensayo, en placas de 96 pozos se mezclaron 10 μL del veneno o fracción (entre 1-20 μg) con 20 μL de la enzima (a una dosis que presente una actividad en el punto medio de la curva). La mezcla se incubó a 37°C por 30 min, luego se agregaron 60 μL del tampón recomendado para cada sustrato y 10 μL del sustrato cromogénico correspondiente, a la concentración recomendada (6 mM S-2238, 8 mM S-2222, o 1,20 mM S-2288). Después de 10 min a 37°C se determinó la actividad enzimática residual. El efecto fue expresado en %, tomando como referencia la actividad de la enzima en presencia de tampón de coagulación. Como controles de inhibición se emplearon hirudina (para trombina a una relación 1:1); aprotinina (para plasmina a 100 UI/mL), inhibidor de tripsina obtenido de soya (SBTI, para factor Xa a 50 µg/mL).
UNA VISIÓN GLOBAL DE LOS VENENOS Y SUS EFECTOS SOBRE EL SISTEMA FIBRINOLÍTICO
Los venenos de serpientes inducen efectos locales y sistémicos en las víctimas, los cuales son complejos y muy variables, debido a los diversos componentes activos que pueden actuar solos o acoplados con otras moléculas del veneno y del hospedador, contribuyendo a la propagación de las toxinas (Calvete et al. 2009). La variabilidad en las manifestaciones clínicas por accidentes ofídicos puede estar relacionada con la composición y la concentración de los componentes tóxicos lo cual se puede relacionar con diferencias geográficas, sexo, genética, edad, alimentación, especie, entre otras (Daltry et al. 1996, Pifano y Rodríguez-Acosta 1996, Sasa y Vázquez 2003, Menezes et al. 2006, Aguilar et al. 2007, Salazar et al. 2007, 2008, 2009, 2011).
Las principales manifestaciones del envenenamiento bothrópico están representadas por alteraciones en la hemostasia. En el caso de envenenamientos crotálicos predominan las manifestaciones neurotóxicas y miotóxicas, acompañadas de leves alteraciones en la hemostasia. En los envenenamientos micrúricos la principal manifestación es la neurotoxicidad y el bloqueo neuromuscular progresivo, en casos severos la muerte resulta por un paro respiratorio (Rodríguez-Acosta et al. 1995). En el caso de Micrurus, se han descrito cuadros clínicos donde el componente neurotóxico no aparece en las primeras horas siguientes a la mordida, donde se aprecian otras manifestaciones relevantes como dolor y edema en el sitio de la mordida, además de manifestaciones respiratorias, anemia, hemoglobinuria, leucocitosis, trombocitopenia y coagulopatías que conllevan a hemorragias (Manock et al. 2008, Pérez et al. 2012, de Roodt et al. 2013).
Los estudios de venenos de serpientes por especies y localidades geográficas, permiten determinar múltiples mecanismos que pueden desencadenar los accidentes ofídicos, lo que puede orientar a una mejor interpretación de cuadros clínicos, seguimiento de los pacientes y preparación de antivenenos. Adicionalmente, identificar compuestos bioactivos en venenos de serpientes reviste gran importancia para estudiar mecanismos de acción que ayuden a guiar la producción de antivenenos más efectivos, sobre todo en el caso de moléculas con poca inmunogenicidad, bien sea por una baja concentración en el veneno o por sus determinantes antigénicos. Además el aislamiento y caracterización de compuestos con potencial terapéutico en patologías asociadas a la hemostasia, fortalece la investigación aplicada.
En este trabajo se presenta un resumen de resultados obtenidos en diferentes trabajos de nuestro grupo, relacionados con la evaluación de actividades referidas con el sistema fibrinolítico, acompañadas de otras actividades de relevancia que pueden inducir complicaciones en los modelos in vivo donde se evalúe el potencial uso de los compuestos aislados de venenos de serpientes. En la búsqueda de un veneno con actividad fibrinolítica y/o antifibrinolítica, a los fines de aislar compuestos bioactivos con potencial aplicación en terapia trombolítica o en síndromes hemorrágicos asociados a hiperfibrinólisis, se evaluaron diversos venenos de serpientes de los géneros Bothrops (Salazar et al. 2007, Girón et al. 2008, Rodríguez-Acosta et al. 2010), Crotalus (Aguilar et al. 2007, Salazar et al. 2008) y Micrurus (Salazar et al. 2011, Vivas 2013), separados por especie y localidad. Los resultados publicados en los diversos trabajos, se resumen en las Tablas 1, 2 y 3, en los cuales se evidencia que venenos de estas serpientes presentan variaciones individuales en la composición y concentración de los componentes activos, relacionados con el género, especie y sobre toda la distribución geográfica. Los hallazgos logrados con los venenos del género Micrurus son de gran importancia para la comunidad científica, ya que se evalúan características y mecanismos de acción de toxinas que pueden permitir un mejor abordaje de los accidentes ofídicos por corales, ya que en la literatura son escasos los reportes comparativos de estos venenos por lo difícil de mantener estas serpientes en cautiverio, su manipulación y la cantidad de veneno que producen.
Tabla 1. Actividades biológicas en venenos de Bothrops, Crotalus y Micrurus.

Tabla 2. Actividades procoagulante y agregación plaquetaria en venenos de Bothrops, Crotalus y Micrurus.

Tabla 3. Actividades fibrino(geno)líticas en venenos de Bothrops, Crotalus y Micrurus.


Tabla 2. Actividades procoagulante y agregación plaquetaria en venenos de Bothrops, Crotalus y Micrurus.

Tabla 3. Actividades fibrino(geno)líticas en venenos de Bothrops, Crotalus y Micrurus.

ACTIVIDADES EVALUADAS
Letal
Entre las actividades que deben ser evaluadas en todo veneno esta la letalidad, algunas variables influyen en los resultados. Entre las vías de inyección del veneno más utilizadas están la intramuscular-IM, la intravenosa-IV, la intraperitoneal-IP, la subcutánea-SC y con menos frecuencia la intracerebroventricular-ICV. Los valores de DL50 más bajos han sido obtenidos con la vía ICV, mientras la SC da los valores más altos (Oukkache et al. 2014). Da Silva y Aird (2001) demostraron en un modelo múrido que el grado de toxicidad de los venenos de serpientes coral es ruta-dependiente, siendo más efectiva la vía intravenosa, seguida de la intraperitoneal y la menos letal la intramuscular. Otra variable a ser considerada es el modelo animal, debido a la susceptibilidad o resistencia a los componentes tóxicos reportada en diversos estudios, encontrándose que los venenos son más tóxicos sobre sus presas naturales (da Silva y Aird 2001). En un estudio que evaluó el efecto de la hemolinfa de la oruga Lonomia achelous sobre el sistema hemostático, se encontró que la cepa de ratones C57BL/6 fue más sensible a los componentes tóxicos, en comparación con las cepas BALB/C y C3H/He (Barrios et al. 2012), lo que en parte puede estar asociado a la variabilidad en las actividades hemostáticas encontradas en estas cepas (Barrios et al. 2009).
En otro trabajo del grupo (Salazar et al. 2011) se resalta la toxicidad de venenos micrúricos, de los cuales hay muy pocos reportes en la literatura, sobre todo de serpientes de Venezuela. En la búsqueda de un modelo animal para evaluar los efectos de venenos de coral sobre la hemostasia e inflamación, por la elevada toxicidad que estos presentan, la letalidad de los venenos de Micrurus se evaluó inicialmente en ratones BALB/C, los cuales han resultado ser más resistentes. Los venenos evaluados presentaron una DL50 entre 0,32 y 0,78 mg/kg, siendo el más letal M. f. fulvius (Florida, USA) (0,32 mg/kg), seguido de M. isozonus de Venezuela (0,52-0,81 mg/kg); el menos letal fue M. t. tener (0,78 mg/kg) (Salazar et al. 2011) (Tabla 1).
La elevada toxicidad de los venenos de Micrurus se ha relacionado con las neurotoxinas. Recientemente, en venenos de M. fulvius se han evidenciado que las PLA2, que constituyen cerca del 33,4% del veneno, son los principales componentes asociados a la neurotoxicidad en ratones (Barros et al. 1994, Peterson 2006, Chippaux 2007, Manock et al. 2008, Rey-Suárez et al. 2012, Vergara et al. 2014, Bucaretchi et al. 2016). Estos hallazgos se comparan a los reportados en otros venenos micrúricos de Latinoamérica (0,065-1,41 mg/kg) (Silva 1994, da Silva et al. 2001). Sin embargo difieren con relación a los datos obtenidos de los venenos de coral de M. tener de los Estados Unidos y México (0,779-1,19 mg/kg) y M. fulvius de los Estados Unidos (0,279-3,2 mg/kg) donde se evidencian diferencias según la especie, localidad, vía de inyección y cepa de ratones empleada para el ensayo (Arce et al. 2003, Sánchez et al. 2008, Tanaka et al. 2010, Bénard-Valle et al. 2014, Vergara et al. 2014).
Nuestros estudios constituyen el primer reporte de letalidad de venenos de coral de Venezuela, la cual se asemeja a la reportada en los venenos crotálicos venezolanos (0,18-0,86 mg/kg) (Aguilar et al. 2007), hallazgo que puede estar asociado a las neurotoxinas presentes en ambos venenos (Sampaio et al. 2010).
Los venenos bothrópicos fueron los menos letales, con una DL50 entre 4,0 y 11,6 mg/kg, resultados que están en concordancia con lo reportado en la literatura, cuya toxicidad se ha asociado a componentes activos con efectos sistémicos, sin efectos neurotóxicos predominantes (Salazar et al. 2007, Prezotto-Neto et al. 2016).
Hemorrágica
En las lesiones del subendotelio la actividad hemorrágica tiene implicación clínica importante en el envenenamiento, al facilitar la dispersión de toxinas entre diferentes órganos y sistemas, de allí que su estudio es de relevancia para la caracterización de venenos (Bjarnason y Fox 1994, Gutiérrez y Rucavado 2000, Gutierrez et al 2005, Kamiguti et al. 1996).
El análisis comparativo de la actividad hemorrágica en los venenos aquí evaluados (Tabla 1) (Aguilar et al. 2007, Salazar et al. 2007, Girón et al. 2008, Salazar et al. 2008, Rodríguez-Acosta et al. 2010, Salazar et al. 2011, Vivas 2013), demuestra que los venenos bothrópicos son los más hemorrágicos, entre estos B. atrox y B. colombiensis - El Guapo son los más activos, los cuales presentan valores de DHM entre 2,5 y 5,6 µg/ratón. Los venenos crotálicos presentan una actividad hemorrágica variable, siendo la mayoría inactivos; el más activo fue el C. durissus cumanensis de Lagunetica (estado Miranda) (4,1 µg/ratón), con una actividad similar a la encontrada en los venenos bothrópicos (Aguilar et al. 2007, Salazar et al. 2008). Diversos autores han asociado esta actividad principalmente a metaloproteasas (Kamiguti et al. 1996, Gutiérrez y Rucavado 2000, Herrera et al. 2015, Gutiérrez et al. 2016), de allí que las diferencias observadas, según la especie deben estar relacionadas con la proporción de estas enzimas, principalmente las de clase P-III, las cuales son abundantes en venenos bothrópicos (Swenson y Markland 2005, Fox y Serrano 2009, Girón et al. 2013a, Markland y Swenson, 2013).
En contraste, los venenos de Micrurus no presentaron actividad hemorrágica (Salazar et al. 2011, Vivas 2013), lo que coincide con los reportes de la literatura, excepto en Micrurus veryi donde por estudios histológicos demostraron una discreta actividad hemorrágica a una dosis de 100 µg/animal; así como en el veneno de la cobra Ophiophagus haunah de la familia Elapidae, donde aislaron una actividad hemorrágica especie específica (Ohsaka 1979, Weissenberg et al. 1987, Tan y Saifuddin 1990). Esta escasa actividad hemorrágica en venenos elapídicos puede estar relacionada con la baja proporción de metaloproteasas, en especial de la clase PIII, enzimas responsables en gran parte de esta actividad (Fernández et al. 2011, Rey-Suárez et al. 2011, Salazar et al. 2011, Vivas 2013).
Edematizante
El edema local es una de las manifestaciones clínicas de los accidentes ofídicos, que evidencia una respuesta inflamatoria, con liberación de mediadores derivados de la acción de PLA2s sobre el ácido araquidónico, como leucotrienos capaces de inducir aumento en la permeabilidad vascular y acumulación de líquido en el espacio intersticial.
Además, las PLA2s son capaces de inducir edema a través de la liberación de histamina y serotonina por la activación y degranulación de mastocitos (Teixeira et al. 2003, Farsky 2005, Clissa et al. 2006, Pardal et al. 2010, de Roodt et al. 2013). La activación de células del tejido residente también promueve quimiotaxis de células inflamatorias, mayormente neutrófilos y monocitos/macrófagos, induciendo a un infiltrado en la zona del tejido lesionado (León et al. 2011). Adicionalmente, el proceso inflamatorio y el edema son potenciados por metaloproteasas de los venenos que degradan componentes de la membrana basal y alteran la permeabilidad vascular, con la consiguiente extravasación de electrolitos y componentes sanguíneos (Teixeira et al. 2009, Zychar et al. 2010, Gutiérrez et al. 2016).
En esta revisión se presentan los resultados del efecto edematogénico inducido por los venenos de B. isabelae, C. d. cumanensis y M. t. tener, donde se evidencia que a la misma dosis, luego de 4 h de inyección, el veneno de Bothrops fue el más activo, seguido de Micrurus. Por su parte, el veneno de Crotalus produjo un menor edema (Fig. 2 A). Los venenos de Bothrops contienen toxinas que inducen una respuesta proinflamatoria asociada a la formación de edema (Teixeira et al. 2003, Clissa et al. 2006). El efecto edematogénico en Micrurus fue comparable a lo descrito para otros venenos de este género (Gutiérrez et al. 1980, Barros et al. 1994, Tambourgi et al. 1994) y puede estar vinculado a las PLA2s (Dokmetjian et al. 2009, Pardal et al. 2010, Casais-E-Silva et al. 2016). Esta respuesta edematogénica también puede relacionarse con la producción de anafilotoxinas por activación del sistema del complemento asociada a metaloproteasas, las cuales pueden unirse a receptores de basófilos y mastocitos, produciendo la liberación de histamina, que podría aumentar la permeabilidad vascular y generar vasodilatación (Tambourgi et al. 1994, Tanaka et al. 2012).
Por su parte, el veneno de Crotalus indujo el menor efecto edematogénico, lo que puede asociarse a que estos venenos producen en su mayoría efectos antiinflamatorios. La crotoxina, la principal toxina de los venenos de serpientes del género C. durissus, se le ha atribuido un efecto de inhibidor del edema crónico inducido por el bacilo Calmette-Guérin; al estimular la generación de mediadores de la vía las lipoxigenasas, las cuales inhiben dicho edema (Nunes et al. 2010, da Silva et al. 2013).
Figura 2.Actividades edematizante, hialuronidasa y Fosfolipasa A2 (PLA2) de venenos de Micrurus, Bothrops y Crotalus. A: Actividad edematizante. Ratones machos C57BL/6 inyectados por vía i.d. en la almohadilla plantar del miembro posterior derecho con diferentes venenos (8 - 20 μg) en 30 μL de solución salina estéril; y con 30 μL de solución salina estéril en el miembro posterior izquierdo. Después de 240 min, se determinó el % de edema con respecto al control. Los resultados representan tres experimentos independientes por triplicado (media ± DE). * p < 0,05 vs. Micrurus tener tener. B: Actividad PLA2. Los resultados representan la media ± DS y son expresados como el área de lisis en mm2/μg de proteína, n = 6. *p < 0,05: veneno de Micrurus vs los demás venenos. C: Actividad hialuronidasa. Los resultados representan la media ± DS y son expresados como Unidades de Reducción de Turbidimetría (URT) por mg de veneno, n = 6 * p < 0,001: Mtt vs demás Micrurus y Bothrops. ** p < 0,01: Cdc vs Mff, Mi y Bothrops. Mtt: M.t.tener, Mff:
M.f.fulvius, Mi: M.isozonus, Bi: B. isabelae, Bas: B. asper, Bcol: B.colombiensis, Batr: B. atrox, Cdc: C. d. cumanensis.

Fosfolipasa tipo A2 (PLA2)
Entre las enzimas de relevancia en venenos de serpientes se encuentran las PLA2, enzimas que alteran el metabolismo lipídico y la estructura de lípidos de membranas celulares, entre estas de plaquetas, muy importantes en el funcionamiento del sistema hemostático de las víctimas (Teixeira et al. 2003, Kini 2006, Rodrigues et al. 2007, Furtado et al. 2014, Bustillo et al. 2015). A la actividad PLA2 se le ha asociado efecto neurotóxico, al actuar como neurotoxinas presinápticas y bloquear la transmisión neuromuscular (Montecucco y Rossetto 2000, Belo et al. 2005, Oliveira et al. 2008, Gutiérrez y Lomonte 2013); además de efectos cardiotóxicos, hemolíticos y miotóxicos, entre otros, descritos previamente (Alape-Girón et al. 1996, Rosso et al. 1996, Moraes et al. 2003, Nawarak et al. 2003, Texeira et al. 2003, Cecchini et al. 2005, Kini 2006, Teixeira et al. 2009, Corrêa-Netto et al. 2011, Fernández et al. 2011, Rey-Suarez et al. 2011, de Roodt et al. 2012, Renjifo et al. 2012, Fernandes et al. 2014, Dutta et al. 2015, Terra et al. 2015, Almeida et al. 2016, Jiménez-Charris et al. 2016).
Entre los resultados presentados en la presente revisión, se evidencia que los venenos crotálicos y bothrópicos presentan una menor actividad PLA2, en comparación a los venenos de Micrurus (Vivas 2013) (Fig. 2 B). Tanaka et al. (2010) y Kopper et al. (2013), evidenciaron un amplio espectro de actividad PLA2 en venenos de diferentes géneros, la cual puede estar relacionada con efectos neurotóxicos, hemostáticos e inflamatorios, de relevancia en las manifestaciones clínicas de las víctimas.
Hialuronidasa
Las hialuronidasas son enzimas que degradan ácido hialurónico, uno de los principales componentes de la matriz extracelular de vertebrados, que conecta proteínas filamentosas, fibras de colágeno y células de tejido conectivo; algunas tienen la habilidad de degradar más lentamente glicosaminoglicanos. Son enzimas conocidas como “factores de difusión” de las toxinas desde el sitio de contacto hasta la circulación, su acción además de incrementar la potencia de las toxinas también está involucrada en el daño local (Duran-Reynals 1933, Frost et al. 1996, Kemparaju y Girish 2006, Girish et al. 2009).
La actividad hialuronidasa potencia la toxicidad de los venenos mediante la pérdida de la integridad de la matriz extracelular, lo que aumenta el influjo de toxinas a diversos sistemas del organismo de las víctimas (Matsushita y Okabe 2001, Pessini et al. 2001, Girish y Kemparaju 2006, Girish et al. 2009, Fox 2013, Bordon et al. 2015). Son enzimas encontradas en venenos de serpientes (Kudo y Tu 2001, Girish et al. 2004, Antunes et al. 2010, Bordon et al. 2012, Wiezel et al. 2015), avispas (Kemeny et al. 1984, Pinto et al. 2012), arañas (Barbaro et al. 2005, Ferrer et al. 2013, Biner et al. 2015, Bordon et al. 2015) y escorpiones (Feng et al. 2008, Horta et al. 2014, Bordon et al. 2015).
En nuestros estudios (Vivas 2013), se evidencia actividad hialuronidasa en todos los venenos evaluados (Fig. 2 C). En los venenos de Micrurus se observó una actividad entre 5,2 - 67,5 U/mg, lo cual coincide con reportes previos de la literatura (Tan y Ponnudurai 1991, 1992, da Silva y Aird 2001, Kudo y Tu 2001, Tanaka et al. 2010). En los venenos de Bothrops se encontró una actividad entre 3,3-19,2 U/mg, resultados que difieren de los descritos por Queiroz et al. (2008), quienes encontraron en venenos de Bothrops latinoamericanas una actividad hialuronidasa máselevada, entre 48-190 U/mg. El los venenos de C. d. cumanensis se observó una actividad entre 55,8- 60,4 U/mg, lo que se asemeja a lo reportado previamente en venenos de Crotalus (Tan y Ponnudurai 1991, Kudo y Tu 2001, Bordon et al. 2012). Esta actividad hialuronidasa es de gran relevancia ya que puede causar colapso sistémico en las victimas, al degradar el ácido hialurónico,un componente de matriz extracelular (MEC) relacionado con procesos como desarrollo embrionario, inflamación, fertilización, entre otros (Kreil 1995, Girish et al. 2004, Fox 2013).
Gelatinolítica
Uno de los mecanismos asociados a la actividad hemorrágica en piel, es el daño local por degradación de proteínas de matriz como fibronectina, laminina y colágeno (Lucena et al. 2007, 2011). La gelatina es un producto desnaturalizado del colágeno (componente mayoritario del tejido conectivo), de allí que se emplea como un sustrato para evaluar metaloproteasas y serinoproteasas de venenos de serpientes asociadas con proteólisis de componentes extracelulares (Serrano et al. 1993, Fox y Serrano 2009, Serrano 2013).
En venenos con elevada actividad neurotóxica, como los elapídicos se ha descrito degradación de componentes de matriz extracelular asociada a daño tisular y sangramientos localizados (Alam et al. 1996, Gutiérrez et al. 2016), con baja actividad gelatinolítica. Bee et al. (2001) con el empleo de un ELISA evidenciaron una elevada actividad gelatinolítica en venenos de viperidos, tal y como ha sido reportado con métodos como zimografia con gelatina, y una muy baja o ausente actividad en venenos elapídicos, tales como Micrurus nigrocinctus mosquitensis de Costa Rica y M. fulvius de USA.
En los venenos de las serpientes venezolanas del género Bothrops, tales como B. isabelae y B. colombiensis, se ha evidenciado actividad gelatinolítica asociada a metaloproteasas (Rodríguez-Acosta et al. 2010, Girón et al. 2013a,b). Menezes et al. (2006) reportaron actividad gelatinolítica en veneno de Bothrops jararaca, asociada a metaloproteasas de clase P-III (50 kDa) y la clase P-I de 25 kDa aquellas encontradas en ejemplares hembras. Terra et al. (2009) también evidenciaron actividad gelatinolítica asociada a metaloproteasas, en B. jararaca vinculada a la clase P-III, y en Bothrops lanceolatus a la clase P-I.
En el presente trabajo se presenta un zimograma con gelatina que evidencia actividad gelatinolítica en venenos micrúricos, la cual fue más evidente en M. t. tener, seguida de M. f. fulvius y M. isozonus-Calabozo (Fig. 3 A) El zimograma muestra áreas de lisis entre 24-255 kDa y 38-255 kDa, respectivamente (Vivas 2013). Es posible que los componentes con esta actividad, se asocien con metaloproteasas hemorrágicas clase P-III (Fox y Serrano 2009). Sin embargo, no se descarta la asociación con serinoproteasas (20-40 kDa) (Moura-da-Silva et al. 1990, Kini 2006).
Figura 3: Actividades gelatinolítica, fibrinotectinolítica y sobre la agregación plaquetaria. A: Actividad gelatinolítica de venenos de Micrurus. Zimografia en poliacrilamida-gelatina de 50 µg del veneno de serpientes Micrurus. Las áreas claras representan lisis (actividad gelatinolítica). Líneas: 1) Marcadores de masa molecular; 2) M.t.tener; 3) M.f.fulvius; 4) M.isozonus-Calabozo. B: Actividad fibronectinolítica de venenos de Micrurus. SDS-PAGE al 7,5% en condiciones reducidas, coloración con azul de Coomassie. Incubación de fibronectina (Fn) con veneno a 37°C, 24 h y a la relación 100:10 y 100:20. Líneas: 1) Marcador de masa molecular; 2) Fn control (15 µg); 3) Fn + M.t.tener 100:10; 4) Fn + M.t.tener 100:20; 5) Fn + M.f.fulvius 100:10; 6) Fn + M.f.fulvius 100:20; 7) Fn + M.isozonus-Calabozo 100:10; 8) Fn + M.isozonus-Calabozo 100:20. C: Efecto del veneno de M.t.tener sobre agregación plaquetaria. Inductores 10 µM adenosín difosfato (ADP), 2 mg/mL colágeno (COL) y 1,25 mg/mL ristocetina (RIS). % agregación en presencia de 10 μg de veneno o tampón (control).

Proteolítica sobre proteínas de matriz extracelular (MEC)
Componentes de la MEC como fibronectina, laminina y colágeno, están involucrados en procesos biológicos como cicatrización de tejidos y hemostasia (Lucena et al. 2006, 2007, 2011). Uno de los mecanismos de acción de las toxinas de venenos de serpientes está relacionado con daño local inducido por degradación de proteínas de MEC, efecto que puede estar asociado a metaloproteasas o serinoproteasas (Fernández et al. 2011, Rey-Suárez et al. 2011).
En los resultados de venenos de Bothrops y Crotalus (Aguilar I, comunicación personal, Salazar et al. 2007, 2008, Rodríguez-Acosta et al. 2010, Girón et al. 2013b), se muestra la presencia de actividad fibronectinolítica, la cual también se evidenció en los venenos micrúricos, siendo este el primer hallazgo reportado en la familia Elapidae (Vivas 2013) (Fig. 3 B). La fibronectina (glicoproteína adhesiva presente en forma soluble en el plasma y en forma insoluble en la MEC de muchos tejidos) puede unirse a colágeno, fibrinógeno, fibrina, factor XII y plaquetas, regulando procesos como adhesión y agregación plaquetaria, remodelación del tejido y fibrinólisis (Lucena et al. 2006, 2007, Sánchez et al. 2010). Esta actividad fibronectinolítica se ha asociado a metaloproteasas que pueden causar daño local, facilitar la difusión de los componentes tóxicos a diferentes órganos y sistemas y favorecer el síndrome hemorrágico observado en las víctimas (Lucena et al. 2007, Sánchez et al. 2010, Gutiérrez
et al. 2016).
Efecto sobre la agregación plaquetaria
El efecto de los venenos sobre la agregación plaquetaria inducida por ADP, colágeno y ristocetina, fue ampliamente estudiado en los venenos de Micrurus (Tabla 2). Los resultados evidenciaron un efecto inhibitorio de la agregación. Los venenos de M. isozonus de las diversas regiones de Venezuela inhibieron entre 51 y 68%, siendo el veneno de Calabozo el menos activo (51% de inhibición) con respecto a los demás venenos en estudio. El veneno de M. f. fulvius indujo 60% de inhibición; a su vez el veneno de M. t .tener fue el más activo, con 95% de inhibición (p < 0,05), con una CI50 de 12,79 mg/mL. La agregación plaquetaria inducida por colágeno y ristocetina fue inhibida por los venenos de M. t .tener (98 y 97 %) y M. f. fulvius (92 y 90%); el veneno de M. isozonus-Calabozo indujo una inhibición de 86 y 87% respectivamente. La Figura 3 C muestra las curvas de agregación plaquetaria inducidas por los tres agonistas, en presencia del veneno de M. t .tener.
Procoagulante
Los venenos de serpientes, especialmente de la familia Viperidae, contienen componentes que actúan sobre la coagulación, entre estos activadores de factores IX, X, V y protrombina y/o enzimas similares a trombina con acción directa obre el fibrinógeno (Markland 1998, Lu et al. 2005, Sajevic et al. 2011). En los trabajos aquí resumidos (Tabla 2) se evalúo la actividad coagulante por dos métodos: a) amidolítico, que emplea sustratos cromogénicos; y b) coagulante, que emplea como sustratos: plasma humano (enzimas procoagulantes) y fibrinógeno (enzimas similares
a trombina).
Los resultados evidenciaron que los venenos de Micrurus, a las condiciones evaluadas, no presentan actividad amidolítica; en contraste los venenos de Bothrops Crotalus mostraron actividad similar a trombina así como procoagulante similar a factor Xa. Con relación a los venenos bothrópicos, B. atrox-Parguasa, fue el más activo y B isabelae el menos activo. Los venenos crotálicos presentaron una actividad variable, siendo C. d. cumanensis-Aragua el más activo, y C. d. cumanensis-Carrizales fue inactivo.
Con relación a la actividad coagulante sobre plasma, fue más elevada en B. atrox, donde se observó una mayor actividad en comparación a los resultados con fibrinógeno como sustrato, lo que evidencia la presencia de enzimas procoagulantes. La actividad coagulante sobre fibrinógeno, por acción de enzimas similares a trombina, fue más elevada en B. atrox - Puerto Ayacucho 2, seguido de los venenos de B. colombiensis- El Guapo, B. isabelae y C. d. cumanensis - Guarenas, Santa Teresa y Aragua. Esta actividad pro-coagulante puede inducir en las víctimas cuadros de coagulación intravascular diseminada, los cuales incrementan los episodios hemorrágicos de las victimas (Kamiguti et al. 1986, Kamiguti y Cardoso 1989). En los venenos de Micrurus se observó que con fibrinógeno se forman coágulos a tiempos prolongados, lo cuales fueron muy frágiles, lo que puede estar asociado a enzimas similares a trombina que no inducen entrecruzamiento de la fibrina, al no activar al factor XIII, tal y como ha sido reportado en venenos de serpientes Viperidae (Pirkle y Marckland 1988). Esta actividad similar a trombina en venenos de Micrurus, puede desencadenar una lenta activación del sistema de la coagulación e inducir alteraciones en la hemostasia, que explicarían cuadros hemorrágicos tardíos, tal y como se ha reportado en algunas víctimas (Manock et al. 2008, de Roodt et al. 2013).
ACTIVIDADES RELACIONADAS CON LA FIBRINOLISIS
Fibrino(geno)lítica
Entre las actividades más estudiadas en venenos vipéridos, se encuentra la fibrino(geno)lítica, asociada a la degradación del fibrinógeno y/ó fibrina; en contraste existen pocos reportes de esta actividad en venenos elapídicos. Esta actividad se ha asociado a fibrinogenasas (Swenson y Markland 2005, Guo et al. 2007, Leonardi et al. 2007, Jia et al. 2009, Salazar et al. 2009, Sánchez et al. 2010, Girón et al. 2011, 2013a,b).
Con relación a la actividad proteolítica sobre el fibrinógeno (fibrinogenolítica), en los venenos de Bothrops y Crotalus evaluados en el presente estudio (Tabla 3), se observó una mayor actividad tipo -fibrinogenasa asociada a metaloproteasas, que a tiempos prolongados degrada las cadenas Bβ (Aguilar et al. 2007, Salazar et al. 2007, Girón et al. 2008, Salazar et al. 2008, 2009). El veneno de B. isabelae (Rodríguez-Acosta et al. 2010) a tiempos prolongados también actúa sobre las cadenas (Fig. 4 A), lo cual ha sido raramente reportado en enzimas aisladas de otros venenos, entre estos de Agkistrodon acutus, Bothrops moojeni y B. colombiensis (Serrano et al. 1993, Xiuxia et al. 2001, Liang et al. 2005, Giron et al. 2013a).
En los venenos micrúricos se evidenció una actividad fibrinogenolítica asociada a metalo- y cisteinoproteasas (Tabla 3) El veneno de M. f .fulvius hidrolizó rápidamente las cadenas Aα, sin efecto aparente sobre las otras cadenas. En contraste, el veneno de M. t. tener indujo una rápida degradación de cadenas Aα del fibrinógeno y lenta acción sobre las Bβ, sin efecto sobre las cadenas . Esta actividad fue abolida por inhibidores de metalo y cisteinoproteasas. El estudio de las fracciones de M. t. tener obtenidas por cromatografía de exclusión molecular evidenció esta actividad en las de elevada masa molecular, las cuales degradan rápidamente las cadenas A y a tiempos prolongados las cadenas Bβ; en las fracciones de masas moleculares intermedias se detectó actividad solo sobre las cadenas Aα (Salazar et al. 2011, Vivas 2013). Estos resultados están en concordancia con hallazgos descritos en metaloproteasas aisladas de venenos de Elapidae, como la F1 aislada de Naja nigricollis (Kini y Evans 1991) y la natrahagin de Naja atra, que hidrolizan rápidamente las cadenas Aα y lentamente las cadenas Bβ (Zhu y Wu 1999). La ohagin aislada de Ophiophagus hannah, hidroliza únicamente las cadenas Aα (Guo et al. 2007); la NN-PF3, aislada de Naja naja degrada las cadenas Aα (Kumar et al. 2010). Yunusova et al. (2013) aislaron de Naja oxiana, una metaloproteasa de 60 kDa que degrada preferencialmente las cadenas Aα del fibrinógeno. Recientemente del veneno de Naja kaouthia fue aislada una metaloproteasa de 66 kDa, denominada NKV 66, que degrada las cadenas Aα del fibrinógeno y la fibrina (Chanda et al. 2016).
Figura 4. Actividad fibrinogenolítica. A: Veneno de B. isabelae a una relación 100:10, a 37°C. SDS-PAGE (Tris/Tricina) SDS-PAGE al 9%, condiciones reducidas y coloración de azul de Coomassie. Lineas: 1: Fg control 0 min; 2: Fg control 24 h, 3-6: Fg+Veneno 5 min, 30 min, 1 y 24 h, respectivamente. B: Colombienasa -1 a una relación 100:0,1 y 30 min de incubación a 37°C, en presencia de inhibidores de proteasas y de iones metálicos. SDS-PAGE al 10%, condiciones reducidas, coloración de azul de Coomassie. Lineas: 1. Marcadores masa molecular; 2: Cadenas del Fg (25 µg); 3-10: Fg+colombienasa-1: 3) Sin inhibidores, 4) + EDTA 10mM; 5) +EDTA 10mM +2,5 mM Zn; 6) +EDTA 10mM +5 mM Zn; 7) +EDTA 10 m M+10 mM Zn; 8) +EDTA 10mM +2,5 mM Ca; 9) +EDTA 10mM +5 mM Ca; 10) 1+EDTA 10mM +10 mM Ca.

Con relación a la actividad proteolítica sobre la fibrina (fibrinolítica), en nuestros trabajos inicialmente fue estudiada por medio de la actividad amidolítica sobre sustratos, que evalúan enzimas asociadas a esta actividad. Los resultados evidenciaron en los venenos de Bothrops y Crotalus venezolanos una elevada actividad similar a calicreína, que fue más significativa en los bothrópicos (446 a 1126 mUA/min/mg), siendo más activo B. colombiensis (Tabla 3) (Aguilar et al. 2007, Salazar et al. 2007, Girón et al. 2008, Salazar et al. 2008, 2009). Esta actividad puede estar asociada al dolor local, aumento de la permeabilidad capilar, hipotensión sistémica y contracción del músculo liso (Weinberg et al. 2004). Adicionalmente, la calicreína puede inducir fibrinólisis, principalmente mediada por la activación de la pro-Uk y en menor grado por una activación directa del plasminógeno (Colman et al. 2006b). En los venenos evaluados también se observó una actividad intermedia similar a t-PA y una baja actividad similar a u-PA y a plasmina. En ninguno de los venenos de Micrurus en estudio se encontró actividad amidolítica similar a enzimas del sistema fibrinolítico, lo que debe estar asociado al bajo porcentaje de serinoproteasas reportado en estos venenos (Fernández et al. 2011, Rey-Suárez et al. 2011). En contraste con estos resultados, Zhang et al. (1994) aislaron del veneno
de la cobra Ophiophagus haunah una arginina/lisina amidasa con 43 kDa, la cual denominaron OhS1, que actúa sobre sustratos cromogénicos que presentan arginina o lisina en el residuo C-terminal y degradan el fibrinógeno a nivel de las cadenas A y B, cuya actividad fue inhibida por inhibidores de serinoproteasas como PMSF, DFP SBTI.
En nuestros trabajos, la actividad fibrinolítica también se evaluó sobre placas de fibrina (Tabla 3). Los resultados revelaron que el veneno de B. isabelae es el más activo, lo que puede estar relacionado con las metaloproteasas evidenciadas en el zimograma de fibrina, donde se observaron áreas de lisis en zonas con masas moleculares entre ~ 45 y 200 kDa. Los venenos C. d. cumanensis también mostraron actividad fibrinolítica en placa de fibrina, la cual ha sido escasamente reportada en este género de serpiente (Aguilar et al. 2007, Salazar et al. 2008, 2009, Rodríguez-Acosta et al. 2010). En un trabajo realizado por nuestro grupo fue demostrado que venenos de Crotalus oreganus helleri procedentes de serpientes capturadas en diferentes regiones del Sur de California (USA), una elevada actividad fibrino(geno)lítica, siendo el veneno identificado como San Bernardino 3 el más activo, del cual se aisló una metaloproteasa de 23 kDa, denominada hellerasa (Salazar et al. 2008).
Con relación a los venenos micrúricos, el de M. t. tener fue el único activo, el cual en microplacas de fibrina indujo un incremento de lisis inducida por plasmina, actividad que se observó en las fracciones con elevada e intermedia masa molecular, obtenidas del fraccionamiento de este veneno por cromatografía de exclusión molecular (Salazar et al. 2011, Vivas 2013).
La actividad fibrino(geno)lítica presente en los venenos en estudio, entre estos en los micrúricos donde no existen reportes de enzimas fibrinolíticas, puede inducir alteraciones en el balance hemostático de víctimas de envenenamiento por corales, donde existen raros reportes de complicaciones hemorrágicas, posiblemente relacionados a envenenamientos donde los componentes neurotóxicos de acción rápida que están en baja proporción o son poco activos, lo que retarda las complicaciones neurotóxicas, incluso la muerte rápida y permite visualizar las manifestaciones clínicas hemorrágicas.
La elevada actividad fibrinolítica observada en el veneno de B. colombiensis, acompañada de una baja actividad procoagulante y hemorrágica (Salazar et al. 2007, Girón et al. 2008), aunado a la disponibilidad de veneno, llevó a aislar y caracterizar bioquímica y biológicamente enzimas fibrino(geno)líticas con potencial aplicación como trombolíticas.
Las fibrinogenasas aisladas de B. colombiensis denominadas colombienasa-1 y colombienasa-2, presentan una masa molecular de 23.074 Da y 23.078 Da, con un pI de 6,0 y 6,2, respectivamente. Ambas enzimas degradan rápidamente las cadenas Aα del fibrinógeno y más lentamente las cadenas Bβ; adicionalmente la colombienasa-2, a altas dosis también degrada las cadenas γ. Esta actividad fibrinogenolítica es estable, a temperaturas entre 4 y 37°C con un máximo de actividad a 25°C, y en pHs entre 7 y 9. Además se demostró que no son capaces de activar plasminógeno, lo que evidencia que la actividad fibrinolítica es por acción directa (Girón et al. 2013a,b). Las colombienasas tienen un comportamiento similar a otras metaloproteasas clasificadas como α-fibrinogenasas (Mazzi et al. 2004, Bello et al. 2006, Marcussi et al. 2007).
Las actividades fibrinolítica/fibrinogenolítica de ambas colombienasas fueron inhibidas por EDTA, EGTA, 1-10 fenantrolina. Esta inhibición por quelantes de metales fue revertida solamente por Zn++ (10 mM) (Fig. 4 B), resultados que llevaron a clasificar a estas enzimas como -fibrinogenasas, del tipo metaloproteasas dependientes de zinc. Por sus masas moleculares alrededor de 23 kDa, y por sus características pueden ser clasificadas como metaloproteasas del tipo P-Ib (Girón et al. 2013a,b). Las metaloproteasas de la clase P-I presentan el dominio metaloproteasa caracterizado por una secuencia consenso HEXXHXXGXXH, responsable de la unión al zinc y carecen de los dominios tipo desintegrina y ricos en cisteína (Clissa et al. 2006).
La actividad fibrinolítica de las colombienasas también fue estudiada por la degradación de la fibrina entrecruzada, evaluada por el patrón electroforético en geles de poliacrilamida-SDS, el cual evidenció que la plasmina, empleada como control positivo y el veneno y sus fracciones, originan patrones de degradación diferentes (Fig. 5). La plasmina genera a las 24 h un patrón de degradación característico representado por dos prominentes bandas de 79,9 y 38,5 kDa, así como observó una actividad intermedia similar a t-PA y una baja actividad similar a u-PA y a plasmina. En ninguno de los venenos de Micrurus en estudio se encontró actividad amidolítica similar a enzimas del sistema fibrinolítico, lo que debe estar asociado al bajo porcentaje de serinoproteasas reportado en estos venenos (Fernández et al. 2011, Rey-Suárez et al. 2011). En contraste con estos resultados, Zhang et al. (1994) aislaron del veneno de la cobra Ophiophagus haunah una arginina/lisina amidasa con 43 kDa, la cual denominaron OhS1, que actúa sobre sustratos cromogénicos que presentan arginina o lisina en el residuo C-terminal y degradan el fibrinógeno a nivel de las cadenas A y B, cuya actividad fue inhibida por inhibidores de serinoproteasas como PMSF, DFP SBTI.
En nuestros trabajos, la actividad fibrinolítica también se evaluó sobre placas de fibrina (Tabla 3). Los resultados revelaron que el veneno de B. isabelae es el más activo, lo que puede estar relacionado con las metaloproteasas evidenciadas en el zimograma de fibrina, donde se observaron áreas de lisis en zonas con masas moleculares entre ~ 45 y 200 kDa. Los venenos C. d. cumanensis también mostraron actividad fibrinolítica en placa de fibrina, la cual ha sido escasamente reportada en este género de serpiente (Aguilar et al. 2007, Salazar et al. 2008, 2009, Rodríguez-Acosta et al. 2010). En un trabajo realizado por nuestro grupo fue demostrado que venenos de Crotalus oreganus helleri procedentes de serpientes capturadas en diferentes regiones del Sur de California (USA), una elevada actividad fibrino(geno)lítica, siendo el veneno identificado como San Bernardino 3 el más activo, del cual se aisló una metaloproteasa de 23 kDa, denominada hellerasa (Salazar et al. 2008).
Con relación a los venenos micrúricos, el de M. t. tener fue el único activo, el cual en microplacas de fibrina indujo un incremento de lisis inducida por plasmina, actividad que se observó en las fracciones con elevada e intermedia masa molecular, obtenidas del fraccionamiento de este veneno por cromatografía de exclusión molecular (Salazar et al. 2011, Vivas 2013).
La actividad fibrino(geno)lítica presente en los venenos en estudio, entre estos en los micrúricos donde no existen reportes de enzimas fibrinolíticas, puede inducir alteraciones en el balance hemostático de víctimas de envenenamiento por corales, donde existen raros reportes de complicaciones hemorrágicas, posiblemente relacionados a envenenamientos donde los componentes neurotóxicos de acción rápida que están en baja proporción o son poco activos, lo que retarda las complicaciones neurotóxicas, incluso la muerte rápida y permite visualizar las manifestaciones clínicas hemorrágicas.
La elevada actividad fibrinolítica observada en el veneno de B. colombiensis, acompañada de una baja actividad procoagulante y hemorrágica (Salazar et al. 2007, Girón et al. 2008), aunado a la disponibilidad de veneno, llevó a aislar y caracterizar bioquímica y biológicamente enzimas fibrino(geno)líticas con potencial aplicación como trombolíticas.
Las fibrinogenasas aisladas de B. colombiensis denominadas colombienasa-1 y colombienasa-2, presentan una masa molecular de 23.074 Da y 23.078 Da, con un pI de 6,0 y 6,2, respectivamente. Ambas enzimas degradan rápidamente las cadenas Aα del fibrinógeno y más lentamente las cadenas Bβ; adicionalmente la colombienasa-2, a altas dosis también degrada las cadenas γ. Esta actividad fibrinogenolítica es estable, a temperaturas entre 4 y 37°C con un máximo de actividad a 25°C, y en pHs entre 7 y 9. Además se demostró que no son capaces de activar plasminógeno, lo que evidencia que la actividad fibrinolítica es por acción directa (Girón et al. 2013a,b). Las colombienasas tienen un comportamiento similar a otras metaloproteasas clasificadas como α-fibrinogenasas (Mazzi et al. 2004, Bello et al. 2006, Marcussi et al. 2007).
Las actividades fibrinolítica/fibrinogenolítica de ambas colombienasas fueron inhibidas por EDTA, EGTA, 1-10 fenantrolina. Esta inhibición por quelantes de metales fue revertida solamente por Zn++ (10 mM) (Fig. 4 B), resultados que llevaron a clasificar a estas enzimas como -fibrinogenasas, del tipo metaloproteasas dependientes de zinc. Por sus masas moleculares alrededor de 23 kDa, y por sus características pueden ser clasificadas como metaloproteasas del tipo P-Ib (Girón et al. 2013a,b).Las metaloproteasas de la clase P-I presentan el dominio metaloproteasa caracterizado por una secuencia consenso HEXXHXXGXXH, responsable de la unión al zinc y carecen de los dominios tipo desintegrina y ricos en cisteína (Clissa et al. 2006).
La actividad fibrinolítica de las colombienasas también fue estudiada por la degradación de la fibrina entrecruzada, evaluada por el patrón electroforético en geles de poliacrilamida-SDS, el cual evidenció que la plasmina, empleada como control positivo y el veneno y sus fracciones, originan patrones de degradación diferentes (Fig. 5). La plasmina genera a las 24 h un patrón de degradación característico representado por dos prominentes bandas de 79,9 y 38,5 kDa, así como productos de muy baja masa molecular (6,3 kDa) (Marder y Francis 2006). En contraste, el veneno crudo y las colombienasas produjeron bandas correspondientes a productos de 34,4; 21,9 y 8,9 kDa.
Figura 5. Degradación de fibrina entrecruzada (XLX) por veneno de B. colombiensis y colombienasas 1 y 2. SDS-PAGE al 7% en condiciones reducidas, coloración con azul de Coomassie. 1. Marcadores masa molecular; 2. Cadenas del Fg-30 µg, 3. Fibrina XLX- 60 µg, 4-8. Fibrina XLX (60 µg) + Plasmina (2 µg) a 0, 30 y 90 min, 3 y 24 h de incubación, respectivamente; 9-11. Fibrina XLX (60 µg) + B. colombiensis (5 µg) a 30 min, 4 y 24 h de incubación, respectivamente; 12-14. Fibrina XLX (60 µg) + Colombienasa-1 (5 µg) a 30 min, 4 y 24 h de incubación, respectivamente, 15-17. Fibrina XLX (60 µg) + colombienasa-2 (5 µg) a 30 min, 4 y 24 h de incubación, respectivamente. 18. Veneno de B. colombiensis (5 µg).

Las colombienasas también degradan fibronectina, actividad que ha sido reportada en metaloproteasas aisladas de venenos de B. atrox (Sánchez et al. 2010), Bothrops leucurus (Bello et al. 2006), Bothrops neuwiedi (Rodrigues et al. 2000), B. colombiensis (Sánchez et al. 2009), Bothrops asper (Franceschi et al. 2000), así como en la hemolinfa de la oruga Lonomia achelous (Lucena et al. 2006, 2008) entre otras. La fibronectina juega un importante papel en procesos celulares de migración y adhesión asociados a la embriogénesis, malignidad, cicatrización y hemostasia. La acción proteolítica sobre esta importante proteína debe afectar procesos hemostáticos de relevancia, lo que podría explicar parte de las manifestaciones hemorrágicas locales y sistémicas observadas en los accidentes bothrópicos.
Las colombienasas carecen de actividades hemorrágica, miotóxica y edematogénica (Tabla 4) (Girón et al. 2013a,b); sin embargo por su alta actividad fibrino(geno)lítica podrían ser exploradas como agentes trombolíticos al disolver coágulos de fibrina e impedir su formación al degradar fibrinógeno, tal y como ha sido reportado para la fibrolasa, metaloproteasa fibrinolítica de 23 kDa aislada del veneno de Agkistrodon contortrix contortrix (Swenson y Markland 2005). Durante el envenenamiento estas enzimas pueden remover la fibrina que se forme, y degradar el fibrinógeno, lo que asegura un estado anticoagulante que facilita la propagación de otros componentes del veneno a través del sistema circulatorio de la presa (Swenson y Markland 2005).
Antifibrinolítica
Cuadros clínicos de hiperfibrinólisis aparecen en alrededor del 55% de las cirugías cardíacas, donde los antifibrinolíticos son el tratamiento más frecuentes, como compuestos que retarden o inhiban la activación de la fibrinólisis, o análogos de lisina que compiten por los residuos de lisina donde se forman los complejos t-PA/plasminógeno/fibrina, o por inhibidores directos de plasmina, la cual a nivel vascular tiene como principal función degradar la fibrina. A nivel celular, esta enzima generada por acción de la u-PA unida a su receptor, el u-PAR, cumple una función relevante al activar vías de señalización celular envueltas en diversos procesos como inflamación, cáncer y quimiotaxis, degradar la matriz extracelular que facilita la invasión y metástasis, cicatrización y remodelación tisular, ovulación e implantación del embrión, entre otros. La plasmina también contribuye con la degradación de matriz extracelular al activar metaloproteasas que degradan otros componentes de la matriz. De allí que inhibidores directos de plasmina puedan ser usados como coadyuvantes en la terapia para controlar el cáncer y en los procesos inflamatorios (Syrovets et al. 2012, Schuliga et al. 2013, Al-Horani y Desai 2014).
La actividad fibrinolítica presente en los venenos de serpientes, evaluada por el método de placas de fibrina, evidenció en B. atrox y M. t. tener una lisis de fibrina acompañada de una área sin lisis (Fig. 6 A) (Salazar et al. 2007, 2011), lo que sugirió la presencia de un inhibidor, bien sea de metaloproteasas, o enzimas similares a plasmina. Este hallazgo indujo a aislar del veneno de M. tener esta actividad, la cual fue denominada tenerplasminina-1, con una masa molecular de 6.542 Da, similar a inhibidores de proteasas tipo Kunitz. Por un inmunoblotting se evidenció que la tenerplasminina-1 forma un complejo con la plasmina (Fig. 6 B), el cual se demostró que disminuye la actividad amidolítica y fibrinolítica de la plasmina (Tabla 5), retarda la lisis de coágulos inducida por t-PA (Fig. 6 C) e inhibe la degradación del fibrinógeno por plasmina, tripsina y elastasa (Fig. 6 D). La tenerplasminina-1 no actúa sobre la actividad de trombina, factor Xa, o t-PA; a diferencia del veneno crudo de M. t. tener, que inhibe la agregación plaquetaria, este inhibidor no tiene efecto sobre esta función plaquetaria (Vivas 2013, Vivas et al. 2016).
Tabla 4. Propiedades de las α-fibrinogenasas aisladas del veneno de Bothrops colombiensis.


Figura 6. Actividad fibrinolítica y antifibrinolítica. A: Venenos de Micrurus en placas de fibrina (Pg+). 1) Plasmina 0,25 nKcat; 2) M.t.tener 25 μg; 3) M.t.tener 50 μg. B: Inmunobloting del complejo plasmina-tenerplasminina-1. SDS-PAGE 9%, condiciones nativas, transferidas a membrana de nitrocelulosa, incubada con anticuerpo antiplasmina de conejo (1:1000), seguido de un anticuerpo secundario antiIgG de conejo, en cabra, conjugado con peroxidasa (1:3.000). MW: Marcadores de masa molecular; Pl: Plasmina; Ap (aprotinina); TP1 (tenerplasminina-1). Pl + Ap (1:4), Pl + TP1 (1:2). C. Efecto de TP1 sobre lisis de fibrina inducida por t-PA. Plasma humano (50 µL, diluido 1:9) coagulado con trombina (1 IU/mL) y CaCl2 (10 mM) en presencia de tPA (0,5 µg/mL) y Tampón Tris-salino, o aprotinina (0,4 nM) o EACA (1 nM) o TP1 (0,2 nM), concentraciones finales. DO a 350 nm a 37°C. D. Efecto de TP1 sobre actividad fibrinogenolítica de tripsina (Try), quimotripsina (Qtry) y elastasa (Elas). SDS-PAGE 10%, condiciones reducidad, coloración azul de Coomassie. Try 0,5 nM, Qtry 0,05 nM), Elas 0,1 nM. Fibrinógeno (Fg, 25 μg) + enzima/ TP1 a una relación 1:4, 1:40 y 1:20 enzima: inhibidor, preincubado por 30 min y 37 °C). MW: Marcadores de masa molecular. Líneas: 1) Fg control; 2) Fg + Try; 3) Fg + (Try + TP1); 4) Fg + Qtry; 5) Fg + (Qtry + TP1); 6) Fg + Elas; 7) Fg + (Elas + TP1).

Con los resultados obtenidos de la caracterización de la tenerplasminina-1 se puede concluir que es un inhibidor que debe unirse al sitio activo de la plasmina, en la triada catalítica (His603, Asp646 y Ser741) (Wiman 1977), formando un complejo tenerplasminina-1/plasmina (Fig. 7), como ha sido reportado para aprotinina e inhibidores tipo Kunitz que actúan sobre esta enzima (Choo et al. 2012, Cheng y Tsai 2013, Wan et al. 2013).
Tabla 5. Efecto de tenerplasminina-1 sobre la actividad fibrinolítica de la plasmina.


Figura 7. Posible mecanismo de acción de tenerplasminina-1. Tenerplasminina-1 inhibe las actividades amidolítica, fibrinolítica y fibrinogenolítica de la plasmina, por posible unión en algún residuo que conforma la triada catalítica, formando un complejo tenerplasminina-1-plasmina que neutraliza su acción (Triada catalítica His603, Asp646 y Ser741).

La tenerplasminina-1 constituye el primer inhibidor de plasmina aislado de serpientes del género Micrurus, con potencial aplicación antifibrinolítica en patologías con una generación de plasmina aumentada, asociada a manifestaciones hemorrágicas, metástasis tumorales, infecciones parasitarias, virales y alteraciones de la hemostasia como la hemofilia (Vivas et al. 2016).
Estudios en modelos celular y animal
Con relación a la actividad fibrinolítica evaluada en modelos animales, específicamente con B. isabelae y M. t. tener (datos no publicados), así como con la hemolinfa de la oruga L. achelous (Barrios et al. 2012, Taylor et al. 2016), los resultados evidenciaron incremento de la lisis de fibrina inducida por la fracción euglobulina del plasma de los ratones experimentales, hallazgo que puede estar asociado a la actividad fibrinolítica propia del veneno, a una activación endógena de este sistema como consecuencia del envenenamiento del animal, o directamente a un efecto sobre las células implicadas en la fibrinólisis (células endoteliales, monocitos, macrófagos, entre otros), con aumento en la síntesis y secreción de enzimas tipo t-PA y u-PA (Heiden et al. 1996, Barrios et al. 2012, Taylor et al. 2016). Esta actividad fibrinolítica aumentada, tanto en el modelo animal como celular, se ha demostrado que en parte puede estar modulada por TNF-, citosina proinflamatoria involucrada en la respuesta celular a toxinas, entre estas a componentes activos de venenos de serpientes e invertebrados (Cruz et al. 2005, Clissa et al. 2006, Teixeira et al. 2009, Barrios et al. 2012, Furtado et al. 2014, Zoccal et al. 2014, Taylor et al. 2016). En este sentido, se ha evidenciado en ratones inyectados con hemolinfa de la oruga L. achelous, la liberación de esta citocina y a su vez como esta respuesta modula la actividad fibrinolítica, tanto en el modelo animal como el celular (Taylor et al. 2016). La interrelación entre el sistema hemostático y la inflamación, específicamente en la respuesta fibrinolítica y el TNF-, puede estar modulando las manifestaciones hemorrágicas observadas en las víctimas por envenenamiento con serpientes.
CONCLUSIONES
Los estudios bioquímicos y biológicos realizados con los venenos de serpientes del género Bothrops, Crotalus y Micrurus de diversas especies y localidades geográficas, muestran diferencias inter e intra-especies que pueden estar asociadas a dieta, sexo, edad, así como a variaciones estacionales o geográficas, las cuales pueden explicar las diferencias en los cuadros clínicos de las víctimas y ayudar a determinar mecanismos de acción que faciliten una mejor orientación a los médicos tratantes sobre el seguimiento y tratamiento, así como a los entes encargados de la preparación de los anti-venenos. Una muestra de venenos de diferentes especies, géneros e incluso de individuos, edades, sexos y procedencias, incluyendo componentes aislados con actividades biológicas relevantes, debe ser empleada para la preparación de inóculos que garanticen una más amplia respuesta inmune en los modelos empleados para la preparación de los anti-venenos con mayor capacidad neutralizante y de más amplio espectro. Los componentes bioactivos aislados, como las colombienasas y la tenerplasminina-1, por sus propiedades biológicas representan un potencial uso como trombolíticos y antifibrinolíticos, respectivamente.
REFERENCIAS BIBLIOGRÁFICAS
1.AGUILAR I, GUERRERO B, SALAZAR, A, GIRÓN M, PÉREZ J,SÁNCHEZ EE, RODRÍGUEZ-ACOSTA A. 2007. Individual venom variability in the South American rattlesnake Crotalus durissus cumanensis. Toxicon. 50(2):214-24. [ Links ]
2.ALAM JM, QASIM R, ALAM SM. 1996. Enzymatic activities of some snake venoms from families Elapidae and Viperidae. Pak. J. Pharm. Sci. 9(1):37-41.
3.ALAPE-GIRÓN A, STILES B, SCHMIDT J, GIRÓN-CORTES M, THELESTAM M, JÖRNVALL H, BERGMAN T. 1996. Characterization of multiple nicotinic acetylcholine receptor-binding proteins and phospholipases A2 from the venom of the coral snake Micrurus nigrocinctus. FEBS Lett. 380(1-2):29-32.
4.AL-HORANI RA, DESAI UR. 2014. Recent advances on plasmin inhibitors for the treatment of fibrinolysis-related disorders. Med. Res. Rev. 34(6):1168-1216.
5.ALMEIDA JR,RESENDE LM,SILVA AG, RIBEIRO RI, STÁBELI RG, SOARES AM, CALDERON LA, MARANGONI S,DA SILVA SL. 2016. Biochemical and functional studies of ColTx-I, a new myotoxic phospholipase A2 isolated from Crotalus oreganus lutosus (Great Basin rattlesnake) snake venom. Toxicon. 117:1-12.
6.ANGLÉS-CANOE, DE LA PEÑA DÍAZ A, LOYAU S. 2001. Inhibition of fibrinolysis by lipoprotein(a). Ann. N Y. Acad. Sci.936:261-75.
7.ANTUNES TC, YAMASHITA KM,BARBARO KC,SAIKI M, SANTORO ML. 2010. Comparative analysis of newborn and adult Bothrops jararaca snake venoms.
Toxicon. 56(8):1443-1458.
8.ARCE V, ROJAS E, OWNBY CL, ROJAS G, GUTIÉRREZ JM. 2003. Preclinical assessment of the ability of polyvalent (Crotalinae) and anticoral (Elapidae) antivenoms produced in Costa Rica to neutralize the venoms of North American snakes. Toxicon. 41(7):851-860.
9.AROCHA -PIÑANGO CL, MARCHI R, GUERRERO B. 1999. Inventory of exogenous hemostatic factors derived from arthropods. Thromb. Haemost. 81(4):647-656.
10.AUSTEN D, R HYMES I. 1975. A laboratory manual of blood coagulation.Osney Mead, Oxford, London: Blackwell Scientific Publications, pp 38.
11.BARBARO KC,KNYSAK I, MARTINS R, HOGAN C, WINKEL K. 2005. Enzymatic characterization, antigenic cross-reactivity and neutralization of dermonecrotic activity of five Loxosceles spider venoms of medical importance in the Americas. Toxicon. 45(4):489-499.
12.BARRIOS M,ODRÍGUEZ-ACOSTA A, GIL A, SALAZAR AM,TAYLOR P, SÁNCHEZ EE,AROCHA-PIÑANGO CL,GUERRERO B. 2009. Comparative hemostatic parameters in BALB/c, C57BL/6 and C3H/He mice. Thromb. Res. 124(3):338-343.
13.BARRIOS M, TAYLOR P, RODRÍGUEZ-ACOSTA A, SÁNCHEZ EE, AROCHA-PIÑANGO CL,GIL A, SALAZAR AM, CARVAJAL Z, ABAD MJ, GUERREROB. 2012. A mouse model to study the alterations in haemostatic and inflammatory parameters induced by Lonomia achelous caterpillar haemolymph. Toxicon. 59(5):547-554.
14.BARROS ACS,FERNANDES DP,FERREIRA LCL,SANTOS MC. 1994. Local effects induced by venoms from five species of genus Micrurus sp. (coral snakes). Toxicon. 32(4):445-452.
15.BEE A, THEAKSTON RD, HARRISON RA, CARTER SD. 2001. Novel in vitro assays for assessing the haemorrhagic activity of snake venoms and for demonstration of venom metalloproteinase inhibitors. Toxicon. 39(9):1429-1434.
16.BELO CA,LEITE GB, TOYAMA MH, MARANGONI S, CORRADO AP, FONTANA MD, SOUTHAN A, ROWAN EG, HYSLOP S, RODRIGUES-SIMIONI structural characterization of a novel phospholipase A2 from Micrurus dumerilii carinicauda venom. Toxicon. 46(7):736-750.
17.BELLO CA, HERMOGENES AL, MAGALHAES A, VEIGA SS, GREMSKI LH, RICHARDSON M, SÁNCHEZ EE. 2006. Isolation and biochemical characterization of a
fibrinolytic proteinase from Bothrops leucurus (white-tailed jararaca) snake venom. Biochimie. 88(2):189-200.
1B.ÉNARD-VALLE M, CARBAJAL-SAUCEDO A, DE ROODT A, LÓPEZ-VERA E, ALAGÓN A. 2014. Biochemical characterization of the venom of the coral snake Micrurus tener and comparative biological activities in the mouse and a reptile model. Toxicon. 77:6-15.
19.BERNARDONI JL, SOUSA LF, WERMELINGER LS, LOPES AS, PREZOTO BC,SERRANO SMT, ZINGALI RB, MOURA-DA-SILVA AM. 2014. Functional variability of snake venom metalloproteinases: adaptive advantages in targeting different prey and implications for human envenomation.
PLoS One. 9:e109651.
20.BERLING I, ISBISTER GK. 2015. Hematologic effects and complications of snake envenoming. Transfus. Med. Rev. 29(2):82-89.
21.BINER O, TRACHSEL C, MOSER A, KOPP L, LANGENEGGER N, KÄMPFER U, VON BALLMOOS C, NENTWIG W, SCHÜRCH S, SCHALLER J, KUHN-NENTWIG L. 2015.
Isolation, N-glycosylations and function of a hyaluronidase-like enzyme from the venom of the spider Cupiennius salei. PLoS One. 10:e0143963.
22.BJARNASON JB,FOX JW. 1994. Hemorrhagic metalloproteinases from snake venoms. Pharmacol. Ther. 62(3):325-372.
23.BOOTH N. 1991. The Laboratory Investigation of the fibrinolytic system. In: Thomson, J.M. (Ed.), Blood Coagulation and Haemostasis. 4th Edition. Churchill Livingstone Inc, New York, USA, pp. 113-149.
24.BORDON KC,PERINO MG, GIGLIO JR, ARANTES EC. 2012. Isolation, enzymatic characterization and antiedematogenic activity of the first reported rattlesnake hyaluronidase from Crotalus durissus terrificus venom. Biochimie. 94(12):2740-2748.
25.BORDON KC, WIEZEL GA, AMORIM FG, ARANTES EC. 2015. Arthropod venom hyaluronidases: biochemical properties and potential applications in medicine and biotechnology. J. Venom. Anim. Toxins incl. Trop. Dis. 22:21-43.
26.BOS MH, CAMIRE RM. 2010. Procoagulant adaptation of a blood coagulation prothrombinase-like enzyme complex in australian elapid venom. Toxins (Basel). 2(6):1554-1567.
27.BRAUD S, BON C, WISNER A. 2000. Snake venom proteins acting on hemostasis. Biochimie. 82(9):851-859.
28.BRAZÓN J, D'SUZE G, D'ERRICO ML, AROCHA-PIÑANGO CL, GUERRERO B. 2009. Discreplasminin, a plasmin inhibitor isolated from Tityus discrepans scorpion
venom. Arch. Toxicol. 83(7):669-678.
29.BUCARETCHI F, CAPITANI EM, VIEIRA RJ, RODRIGUES CK, ZANNIN M, DA SILVA NJ JR, CASAIS-E-SILVA LL, HYSLOP S. 2016. Coral snake bites (Micrurus spp.) in Brazil: a review of literature reports. Clin. Toxicol. (Phila). 54(3):222-234.
30.BUSTILLO S, GARCÍA-DENEGRI ME, GAY C, VAN DE VELDE AC, ACOSTA O, ANGULO Y, LOMONTE B, GUTIÉRREZ JM, LEIVA L. 2015. Phospholipase A(2) enhances the endothelial cell detachment effect of a snake venom metalloproteinase in the absence of catalysis. Chem. Biol. Interact. 240:30-36.
31.CALVETE JJ, SANZ L, ANGULO Y, LOMONTE B, GUTIÉRREZ JM. 2009. Venoms, venomics, antivenomics. FEBS. Lett. 583(11):1736-1743.
32.CARVAJAL Z, AROCHA-PIÑANGO CL. 1991. Estudio zimográfico de las fracciones purificadas del veneno de la Lonomia achelous. Rev. Iberoam. Trombos. Hemost. 4:182-184.
33.CASAIS-E-SILVA LL,TEIXEIRA CF, LEBRUN I, LOMONTE B, ALAPE-GIRÓN A, GUTIÉRREZ JM. 2016. Lemnitoxin, the major component of Micrurus lemniscatus coral snake venom, is a myotoxic and pro-inflammatory phospholipase A2. Toxicol. Lett. 257:60-71.
34.CASTELLINO FJ, PLOPLIS VA. 2005. Structure and function of the plasminogen/plasmin system. Thromb. Haemost. 93(4):647-654.
35.CECCHINI AL, MARCUSSI S, SILVEIRA LB, BORJA-OLIVEIRA CR, RODRIGUES-SIMIONI L, AMARA S, STÁBELI RG, GIGLIO JR, ARANTES EC, SOARES AM.
2005. Biological and enzymatic activities of Micrurus sp. (Coral) snake venoms. Comp. Biochem. Physiol. A Mol. Integr. Physiol. 140(1):125-134.
36.CHANDA C, SARKAR A, CHAKRABARTY D. 2016. Thrombolytic protein from cobra venom with anti-adhesive properties. Arch.
Biochem. Biophys. 590:20-26.
37.CHENG AC, TSAI IH. 2013. Functional characterization of a slow and tight-binding inhibitor of plasmin isolated from Russell's viper venom. Biochim. Biophys. Acta. 1840(1):153-159.
38.CHENG YC, YAN FJ, CHANG LS. 2005. Taiwan cobra chymotrypsin inhibitor: cloning, functional expression and gene organization. Biochim. Biophys. Acta.1747(2):213-220.
39.CHIPPAUX JP. 1998. Snake-bites: appraisal of the global situation. Bull. World Health Organ. 76(5):515-524.
40.CHIPPAUX JP. 2007. Venomous and poisonous animals. III. Elapidae snake envenomation. Med. Trop. (Mars). 67(1):9-12.
41.CHIPPAUX JP. 2008. Estimating the global burden of snakebite can to help to improve management. PloS Medicine. 5:e221.
42.CHOO YM, LEE KS, YOON HJ, QIU Y, WAN H, SOHN MR, SOHN HD, JIN BR. 2012. Antifibrinolytic role of a bee venom serine protease inhibitor that acts as a plasmin inhibitor. PLoS One. 7: e32269.
43.CHUANSUMRIT A, CHAIYARATANA W. 2014. Hemostatic derrangement in dengue hemorrhagic fever. Thromb. Res. 133(1):10-16.
44.CHUDZINSKI-TAVASSI AM, KELEN EM, DE PAULA ROSA AP, LOYAU S, SAMPAIO CA,BON C,ANGLÉS-CANO E. 1998. Fibrino(geno)lytic properties of purified hementerin, a metalloproteinase from the leech Haementeria depressa. Thromb. Haemost. 80(1):155-160.
45.CLEMETSON KJ. 2010. Snaclecs (snake C-type lectins) that inhibit or activate platelets by binding to receptors. Toxicon. 56(7):1236-1246.
46.CLEMETSON KJ. 2012. Platelets and primary haemostasis. Thromb. Res. 129(3):220-224.
47.CLISSA PB, LOPES-FERREIRA M, DELLA-CASA MS, FARSKY SH, MOURA-DA-SILVA AM. 2006. Importance of jararhagin disintegrin-like and cysteine-rich domains in the early events of local inflammatory response. Toxicon. 47(5):591-596.
48.COLMAN RW, CLOWES AW, GEORGE JN, GOLDHABER SZ, MARDER VJ. 2006a. Overview of Hemostasis. In: COLMAN RW, CLOWES AW, GOLDHABER SZ, M
ARDER VJ, GEORGE JN. (Ed.). Hemostasis and Thrombosis: Basic Principles and Clinical Practice. 5th Edition. Editorial Lippincott Williams & Wilkins, London, UK, Chap 1, pp. 3-16.
49.COLMAN RW, MARDER VJ, CLOWES AW, GEORGE JN, GOLDHABER SZ. 2006b. Hemostasis and thrombosis: basic principles and clinical practice. COLMAN
R (Ed.). 5th Edition. Editorial Lippincott Williams & Wilkins, London, UK, Chap 18, pp. 335-340.
50.COSTA FL, RODRIGUES RS, IZIDORO LF, MENALDO DL, HAMAGUCHI A, HOMSI-BRANDEBURGO MI, FULY AL, SOARES SG, SELISTRE-DE-ARAÚJO HS, BARRAVIERA B, SOARES AM, RODRIGUES VM. 2009. Biochemical and functional properties of a thrombin-like enzyme isolated from Bothrops pauloensis snake venom. Toxicon. 54(6):725-735.
51.CORRÊA-NETTO C, JUNQUEIRA-DE-AZEVEDO IDE L, SILVA DA, HO PL, LEITÃO-DE-ARAÚJO M, ALVES ML, SANZ L, FOGUEL D, ZINGALI RB, CALVETE JJ. 2011. Snake venomics and venom gland transcriptomic analysis of Brazilian coral snakes, Micrurus altirostris and M. corallinus. J.
Proteomics. 74(9):1795-1809.
52.CRUZ AH, MENDONÇA RZ, PETRICEVICH VL. 2005. Crotalus durissus terrificus venom interferes with morphological, functional, and biochemical changes in murine macrophage. Mediators Inflamm. 2005(6):349-359.
53.DA SILVA M, LUCENA S, AGUILAR I, RODRÍGUEZ-ACOSTA A, SALAZAR AM, SÁNCHEZ EE, GIRÓN ME, CARVAJAL Z, AROCHA-PIÑANGO CL, GUERRERO B. 2009. Anti-platelet effect of cumanastatin 1, a disintegrin isolated from venom of South American Crotalus rattlesnake. Thromb. Res. 123(5):731-739.
54.DA SILVA NG, SAMPAIO SC, GONÇALVES LR. 2013. Inhibitory effect of Crotalus durissus terrificus venom on chronic edema induced by injection of bacillus Calmette-Guérin into the footpad of mice. Toxicon. 63:98-103.
55.DA SILVA NJ JR, AIRD SD. 2001. Prey specificity, comparative lethality and compositional differences of coral snake venoms. Comp. Biochem. Physiol C. Toxicol. Pharmacol. 128(3):425-456.
56.DALTRY JC, WÜSTER W, THORPE RS. 1996. Diet and snake venom evolution. Nature. 379(6565):537-540.
57.DE ROODT RA, LAGO NR, STOCK RP. 2012. Myotoxicity and nephrotoxicity by Micrurus venoms in experimental envenomation. Toxicon. 59(2):356-364.
58.DE ROODT AR, DE TITTO E, DOLAB JA, CHIPPAUX JP. 2013. Envenoming by coral snakes (Micrurus) in Argentina during the period between 1979-2003. Rev. Inst. Med. Trop. São Paulo. 55(1):13-18.
59.DE SOUSA L, BASTOURI-CARRASCO J, MATOS M, BORGES A, BÓNOLI S, VÁSQUEZ-SUÁREZ A, GUERRERO B, RODRÍGUEZ-ACOSTA A. 2013. Epidemiology of ophidism in Venezuela (1996-2004). Invest. Clin. 54(2):123-137.
60.DOKMETJIAN J, DEL CANTO S, BISCOGLIO DE JIMÉNEZ M. 2009. Biochemical characterization of the Micrurus pyrrhocryptus venom. Toxicon. 53(3):375-382.
61.DURAN-REYNALS F. 1933. Studies on a certain spreading factor existing in bacteria and its significance for bacterial invasiveness. J. Exp. Med. 58(2):161-181.
62.DUTTA S, GOGOI D, MUKHERJEE AK. 2015. Anticoagulant mechanism and platelet deaggregation property of a non-cytotoxic, acidic phospholipase A2 purified from Indian cobra (Naja naja) venom: inhibition of anticoagulant activity by low molecular weight heparin. Biochimie. 110:93-106.
63.FARSKY SH, ANTUNES E, MELLO SB. 2005. Pro and antiinflammatory properties of toxins from animal venoms. Curr. Drug. Targets Inflamm. Allergy. 4(3):401-411.
64.FENG L, GAO R, GOPALAKRISHNAKONE P. 2008. Isolation and characterization of a hyaluronidase from the venom of Chinese red scorpion Buthus martensi. Comp. Biochem. Physiol C. Toxicol. Pharmacol. 148(3):250-257.
65.FERNANDES CA, BORGES RJ, LOMONTE B, FONTES MR. 2014. A structure-based proposal for a comprehensive myotoxic mechanism of phospholipase
A2-like proteins from viperid snake venoms. Biochim. Biophys. Acta. 1844(12):2265-2276.
66.FERNÁNDEZ J, ALAPE-GIRÓN A, ANGULO Y, SANZ L, GUTIÉRREZ JM, CALVETE JJ, LOMONTE B. 2011. Venomic and antivenomic analyses of the Central American coral snake, Micrurus nigrocinctus (Elapidae). J. Proteome. Res. 10(4):1816-1827.
67.FERRER VP, DE MARI TL, GREMSKI LH, TREVISAN SILVA D, DA SILVEIRA RB, GREMSKI W, CHAIM OM, SENFF-RIBEIRO A, NADER HB, VEIGA SS. 2013. A novel
hyaluronidase from brown spider (Loxosceles intermedia) venom (Dietrich's Hyaluronidase): from cloning to functional characterization. PLoS Negl. Trop. Dis. 7:e2206.
68.FLIGHT S,JOHNSON L,TRABI M,GAFFNEY P,LAVIN M,DE JERSEY J,MASCI P. 2005. Comparison of textilinin-1 with aprotinin as serine protease inhibitors
and as antifibrinolytic agents. Pathophysiol. Haemost. Thromb. 34(4-5):188-193.
69.FLIGHT SM,JOHNSON LA,DU QS,WARNER RL,TRABI M,GAFFNEY PJ,LAVIN MF,DE JERSEY J,MASCI PP. 2009. Textilinin-1, an alternative anti-bleeding agent to aprotinin: Importance of plasmin inhibition in controlling blood loss. Br. J. Haematol. 145(2):207-211.
70.FOX F,SERRANO S. 2009. Timeline of key events in snake venom metalloproteinase research. J. Proteomics. 72(2):200-209.
71.FOX JW. 2013. A brief review of the scientific history of several lesser-known snake venom proteins: L-amino acid oxidases, hyaluronidases and phosphodiesterases. Toxicon. 62:75-82.
72.FRANCESCHI A,RUCAVADO A, MORA N,GUTIÉRREZ JM. 2000. Purification and characterization of BaH4, a hemorrhagic metalloproteinase from the venom of the snake Bothrops asper. Toxicon. 38(1):63-77.
73.FRANCISCHETTI IM. 2010. Platelet aggregation inhibitors from hematophagous animals. Toxicon. 56(7):1130-1144.
74.FROST GI,CSOKA T,STERN R. 1996. The hyaluronidase: a chemical biological and clinical overview. Trends. Glycosc. Glycotechnol. 8(44):419-434.
75.FUENTES O,RODRIGUEZ -ACOSTA A. 1997. Sobre los géneros Bothriechis, Bothriopsis, Bothrops y Porthidium (Serpentes: Crotalidae) existentes en Venezuela. Claves para su identificacion de interes biomédico. Acta Biol. Venez. 17(3):31-38.
76.FURTADO JL,OLIVEIRA GA,PONTES AS,SETÚBAL SDA S,XAVIER CV,LACOUTH -SILVA F,LIMA BF,ZAQUEO KD, KAYANO AM, CALDERON LA,STÁBELI RG,SOARES
AM,ZULIANI JP. 2014. Activation of J77A.1 macrophages by three phospholipases A2 isolated from Bothrops atrox snake venom. Biomed. Res. Int. 2014:683123.
77.GILES A. 1987. Guidelines for the use of animals in biomedical research. Thromb. Haemost. 58(4):1078-1084.
78.GIRISH KS,KEMPARAJU K. 2006. Inhibition of Naja naja venom hyaluronidase: role in the management of poisonous bite. Life. Sci. 78(13):1433-1440.
79.GIRISH KS,SHASHIDHARAMURTHY R,NAGARAJU S, GOWDA TV,KEMPARAJU K. 2004. Isolation and characterization of hyaluronidase a "spreading factor" from Indian cobra (Naja naja) venom. Biochimie. 86(3):193-202.
80.GIRISH KS, KEMPARAJU K, NAGARAJU S, VISHWANATH BS. 2009. Hyaluronidase inhibitors: a biological and therapeutic perspective. Curr. Med.
Chem. 16(18):2261-2288.
81.GIRÓN ME,SALAZAR AM,AGUILAR I,PÉREZ JC,SANCHEZ EE, AROCHA-PIÑANGO CL, RODRÍGUEZ-ACOSTA A, GUERRERO B. 2008. Hemorrhagic, coagulant
and fibrino(geno)lytic activities of crude venom and fractions from mapanare (Bothrops colombiensis) snakes. Comp. Biochem. Physiol C. Toxicol. Pharmacol. 147(1):113-121.
82.GIRÓN ME, ESTRELLA A, SÁNCHEZ EE, GALÁN J, TAO WA, GUERRERO B, SALAZAR AM, RODRÍGUEZ-ACOSTA A. 2011. Purification and characterization of a metalloproteinase, Porthidin-1, from the venom of Lansberg's hog-nosed pitvipers (Porthidium lansbergii hutmanni). Toxicon. 57(4):608-618.
83.GIRÓN ME, RODRÍGUEZ-ACOSTA A, SALAZAR AM, SÁNCHEZ EE, GALÁN J, IBARRA C, GUERRERO B. 2013a. Isolation and characterization of two new non-hemorrhagic metalloproteinases with fibrinogenolytic activity from the mapanare (Bothrops colombiensis) venom. Arch. Toxicol. 87(1):197-208.
84.GIRÓN ME, GUERRERO B, SALAZAR AM, SÁNCHEZ EE, ALVAREZ M, RODRÍGUEZ-ACOSTA A. 2013b. Functional characterization of fibrinolytic metalloproteinases (colombienases) isolated from Bothrops colombiensis venom. Toxicon. 74:116-126.
85.GRÜNEWALD M, SIEGEMUND A, GRÜNEWALD A, KONEGAN A, KOKSCH M, GRIESSHAMMER M. 2002. Paradoxical hyperfibrinolysis is associated with a more intensely haemorrhagic phenotype in severe congenital haemophilia. Haemophilia. 8(6):768-775.
86.GUERRERO B, AROCHA-PIÑANGO CL. 1992. Activation of human prothrombin by the venom of Lonomia achelous (Cramer) caterpillars. Thromb. Res. 66(2-3):169-177.
87.GUERRERO B, GIL, A, AROCHA-PIÑANGO CL. 1997a. Lonomia achelous caterpillar venom (LACV) selectively inactivates blood coagulation factor FXIII. Thromb. Res. 87(1):83-93.
87.GUERRERO B, GIL A, AROCHA-PIÑANGO CL. 1997b. Degradation of factor XIII by Lonomin V, a purified fraction of Lonomia achelous caterpillar venom. Thromb. Res. 87(2):171-181.
88.GUERRERO B, PERALES J, GIL A, AROCHA-PIÑANGO CL. 1999. Effect on platelet FXIII and partial characterization of Lonomin V, a proteolytic enzyme from Lonomia achelous caterpillars. Thromb. Res. 93(5):243-252.
89.GUERRERO B, FINOL HJ, REYES-LUGO M, SALAZAR AM, SÁNCHEZ EE, ESTRELLA A, ROSCHMAN-GONZÁLEZ A, IBARRA C, SALVI I, RODRÍGUEZ-ACOSTA A. 2010. Activities against hemostatic proteins and adrenal gland ultrastructural changes caused by the brown widow spider Latrodectus geometricus (Araneae: Theridiidae) venom. Comp. Biochem. Physiol C. Toxicol. Pharmacol. 151(1):113-121.
90.GUERRERO B, AROCHA-PIÑANGO CL, SALAZAR AM, GIL A, SÁNCHEZ EE, RODRÍGUEZ-ACOSTA A, LUCENA S. 2011. The effects of Lonomin V, a toxin from the caterpillar (Lonomia achelous), on hemostasis parameters as measured by platelet function. Toxicon. 58(4): 293-303.
91.GUO XX, ZENG L, LEE WH, ZHANG Y, JIN Y. 2007. Isolation and cloning of a metalloproteinase from king cobra snake venom. Toxicon. 49(7):954-965.
92.GUTIÉRREZ JM. 2011. Envenenamiento por mordeduras de serpientes en América Latina y el Caribe: Una visión integral de carácter regional. Bol. Mal. Salud. Amb. 51(1):1-16.
93.GUTIÉRREZ JM, RUCAVADO A. 2000. Snake venom metalloproteinases: their role in the pathogenesis of local tissue damage. Biochimie. 82(9-10):841-850.
94.GUTIÉRREZ JM, LOMONTE B. 2013. Phospholipases A2: unveiling the secrets of a functionally versatile group of snake venom toxins. Toxicon. 62:27-39.
95.GUTIÉRREZ JM, CHAVES F, ROJAS E, BOLAÑOS R. 1980. Local effects induced by Micrurus nigrocinctus venom in white mice. Toxicon. 18(5-6):633-639.
96.GUTIÉRREZ JM, GENÉ JA, ROJAS G, CERDAS L. 1985. Neutralización of proteolytic and hemorrhagic activities of Costa Rican snake venoms by polyvalent antivenom. Toxicon. 23(6):887-893.
97.GUTIÉRREZ JM, RUCAVADO A, ESCALANTE T, DÍAZ C. 2005. Hemorrhage induced by snake venom metalloproteinases:biochemical and biophysical mechanisms involved in microvessel damage. Toxicon. 45(8):997-1011.
98.GUTIÉRREZ JM, ESCALANTE T, RUCAVADO A, HERRERA C. 2016. Hemorrhage caused by snake venom metalloproteinases: A journey of discovery and understanding. Toxins (Basel). 8(4):93.
99.HE J, CHEN S, GU J. 2007. Identification and characterization of harobin, a novel fibrino(geno)lytic serine protease from a sea snake (Lapemis hardwickii). FEBS. Lett. 581(16):2965-2973.
100.HEIDEN M, SEITZ R, EGBRING R. 1996. The role of inflammatory cells and their proteases in extravascular fibrinolysis. Semin. Thromb. Hemost. 22(6):497-501.
101.HEISSIG B, EIAMBOONSERT S, SALAMA Y, SHIMAZU H, DHAHRI D, MUNAKATA S, TASHIRO Y, HATTORI K. 2016. Cancer therapy targeting the fibrinolytic system. Adv. Drug. Deliv. Rev. 99(Pt B):172-179.
102.HERMOGENES AL, RICHARDSON M, MAGALHAES A, YARLEQUE A, RODRIGUEZ E, SANCHEZ EE. 2006. Interaction of a plasminogen activator proteinase, LV-PA with human α2-macroglobulin. Toxicon. 47(4):490-494.
103.HERRERA C, ESCALANTE T, VOISIN MB, RUCAVADO A, MORAZÁN D, MACÊDO JK, CALVETE JJ, SANZ L, NOURSHARGH S, GUTIÉRREZ JM, FOX JW. 2015. Tissue localization and extracellular matrix degradation by PI, PII and PIII snake venom metalloproteinases: clues on themechanisms of venom-induced hemorrhage. PLoS. Negl. Trop. Dis. 9:e0003731.
104.HOOVER-PLOW J. 2010. Does plasmin have anticoagulant activity? J. Vasc. Health Risk. Manag. 6:199-205.
105.HORTA CC, MAGALHÃES BDE F, OLIVEIRA-MENDES BB, DO CARMO AO, DUARTE CG, FELICORI LF, MACHADO-DE-ÁVILA RA, CHÁVEZ-OLÓRTEGUI C, KALAPOTHAKIS E. 2014. Molecular, immunological, and biological characterization of Tityus serrulatus venom hyaluronidase: new insights into its role in envenomation. PLoS. Negl. Trop. Dis. 8:e2693.
106.JIA LG, SHIMOKAWA K, BJARNASON JB, FOX JW. 1996. Snake venom metalloproteinases: structure, function and relationship to the ADAMs family of proteins. Toxicon. 34 (11-12):1269-1276.
107.JIA Y, LUCENA S, CANTU E, SÁNCHEZ EE, PÉREZ JC. 2009. cDNA cloning, expression and fibrin(ogen)olytic activity of two low-molecular weight
snake venom metalloproteinases. Toxicon. 54(3):233-243.
108.JIMÉNEZ-CHARRIS E, MONTEALEGRE-SÁNCHEZ L, SOLANO-REDONDO L, CASTRO-HERRERA F, FIERRO-PÉREZ L, LOMONTE B. 2016. Divergent functional profiles of acidic and basic phospholipases A2 in the venom of the snake Porthidium lansbergii lansbergii. Toxicon. 119:289-298.
109.KAMIGUTI AS, CARDOSO JL. 1989. Haemostatic changes caused by the venoms of South American snakes. Toxicon. 27(9):955-963.
110.KAMIGUTI AS, MATSUNAGA S, SPIR M, SANO-MARTINS IS, NAHAS L. 1986. Alterations of the blood coagulation system after accidental human inoculation by Bothrops jararaca venom. Braz. J. Med. Biol. Res. 19(2):199-204.
111.KAMIGUTI AS, CARDOSO JL, THEAKSTON RD, SANO-MARTINS IS, SANO-MARTINS IS, HUTTON RA, RUGMAN FP, WARRELL DA, HAY CR. 1991. Coagulopathy
and haemorrhage in human victims of Bothrops jararaca envenoming in Brazil. Toxicon. 29(8):961-972.
112.KAMIGUTI AS, HAY CR, THEAKSTON RD, ZUZEL M. 1996. Insights into the mechanism of haemorrhage caused by snake venom metalloproteinases. Toxicon. 34(6):627-642.
113.KASTURIRATNE A, WICKREMASINGHE A, DE SILVA N, GUNAWARDENA N, PATHMESWARAN A, PREMARATNA R, SAVIOLI L, LALLOO DG, DE SILVA HJ. 2008. The global burden of snakebite: A literature analysis and modelling based on a regional estimate of envenoming and deaths. PloS. Medicine. 5:e218.
114.KEMENY DM, DALTON N, LAWRENCE AJ, PEARCE FL, VERNON CA. 1984. The purification and characterisation of hyaluronidase from the venom of the honey bee, Apis mellifera. Eur. J. Biochem. 139(2):217-223.
115.KEMPARAJU K, GIRISH KS. 2006. Snake venom hyaluronidase: a therapeutic target. Cell. Biochem. Funct. 24(1):7-12.
116.KINI RM. 2005. The intriguing world of prothrombin activators from snake venom. Toxicon. 45(8):1133-1145.
117.KINI RM. 2006. Anticoagulant proteins from snake venoms: structure, function and mechanism. Biochem. J. 397(3):377-387.
118.KINI RM. 2011. Toxins in thrombosis and haemostasis: potential beyond imagination. J. Thromb. Haemost. 9(Suppl. 1):195-208.
119.KINI RM, EVANS HJ. 1991. Inhibition of platelet aggregation by a fibrinogenase from Naja nigricollis venom is independent of fibrinogen degradation. Biochim. Biophys. Acta. 1095(2):117-121.
120.KLÖCKING HP, HOFFMAN A, MARKWARDT F. 1987. Release of plasminógeno activator by batroxobin. Haemostasis. 17(4):235-237.
121.KOLEV K, LONGSTAFF C. 2016. Bleeding related to disturbed fibrinolysis. Br. J. Haematol. 175(1):12-23.
122.KOPPER RA, HARPER GR, ZIMMERMAN S, HOOK J. 2013. Comparison of total protein and phospholipase A2 levels in individual coral snake venoms. Toxicon. 76:59-62.
123.KOWALSKI E, KOPEC M, NIEWIAROWSKI S. 1959. An evaluation of the euglobulin method for the determination of fibrinolysis. J. Clin. Path. 12(3):215-218.
124.KREIL G. 1995. Hyaluronidases-a group of neglected enzymes. Protein. Sci. 4(9):1666-1669.
125.KUDO K, TU AT. 2001. Characterization of hyaluronidase isolated from Agkistrodon contortrix contortrix (Southern Copperhead) venom. Arch. Biochem.
Biophys. 386(2):154-62.
126.KUMAR MS, GIRISH KS, VISHWANATH BS, KEMPARAJU K. 2010. The metalloprotease, NN-PF3 from Naja naja venom inhibits platelet aggregation primarily by affecting α2β1 integrin. Ann. Hematol. 90(5):569-577.
127.LAEMMLI U. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T-4. Nature .227(5259):608-609.
128.LAING G, MOURA DA SILVA A. 2005. Jararhagin and its multiple effects on hemostasis. Toxicon. 45(8):987-996.
129.LARRÉCHÉ S, MION G, GOYFFON M. 2008. Haemostasis disorders caused by snake venoms. Ann. Fr. Anesth. Reanim. 27(4):302-339.
130.LEEBEEK FW, RIJKEN DC. 2015. The fibrinolytic status in liver diseases. Semin. Thromb. Hemost. 41(5):474-480.
131.LEÓN G, SÁNCHEZ L, HERNÁNDEZ A, VILLALTA M, HERRERA M, SEGURA A, ESRADA R, GUTIÉRREZ JM. 2011. Immune response towards snake venoms. Inflamm. Allergy Drug Targets. 10(5):381-398.
132.LEONARDI A, FOX JW, TRAMPUŠ-BAKIJA A, KRIŽAJ I. 2007. Ammodytase, a metalloprotease from Vipera ammodytes ammodytes venom, possesses
strong fibrinolytic activity. Toxicon. 49(6):833-842.
133.LIANG XX, ZHOU YN, CHEN JS, QIU PX, CHEN HZ, SUN HH, WU YP, YAN GM. 2005. Enzymological characterization of FII(a), a fibrinolytic enzyme from Agkistrodon acutus venom. Acta. Pharmacol .Sin.26(12):1474-1478.
134.LIJNEN HR. 2001. Elements of the fibrinolytic system. Ann. NY. Acad. Sci. 936:226-236.
135.LONGSTAFF C, KOLEV K. 2015. Basic mechanisms and regulation of fibrinolysis. J. Thromb. Haemost. 13(Suppl 1):S98-105.
136.LOWRY OH, ROSEMBROUGH NJ, FARR AL, RANDALL RJ. 1951. Protein measurement with the Folin phenol reagent. J. Biol. Chem. 193(1):265-275.
137.LU Q, CLEMETSON JM, CLEMETSON KJ. 2005. Snake venoms and hemostasis. J. Thromb. Haemost. 3(8):1791-1799.
138.LUCENA S, GUERRERO B, SALAZAR A, GIL A, AROCHA-PIÑANGO CL. 2006. Degradation of extracellular matrix proteins (fibronectin, vitronectin and laminin)
by serine-proteinases isolated from Lonomia achelous caterpillar hemolymph. Blood. Coagul. Fibrinolysis. 17(6):427-435.
139.LUCENA S, AROCHA PIÑANGO CL, GUERRERO B. 2007. Fibronectin. Structure and functions associated to hemostasis. Invest. Clin. 48(2):249-262.
140.LUCENA S, SALAZAR AM, GIL A, AROCHA-PIÑANGO CL, GUERRERO B. 2008. The action of Lonomin V (Lonomia achelous) on fibronectin functional properties. Thromb. Res. 121(5):653-661.
141.LUCENA S, SANCHEZ EE, PEREZ JC. 2011. Anti-metastatic activity of the recombinant disintegrin, r-mojastin 1, from the Mohave rattlesnake. Toxicon. 57(5):794-802.
142.LUCENA S, RODRÍGUEZ-ACOSTA A, GRILLI E, ALFONSO A, GOINS A, OGBATA I, WALLS R, SUNTRAVAT M, UZCÁTEGUI NL,GUERRERO B, SÁNCHEZ EE. 2016. The characterization of trans-pecos copperhead (Agkistrodon contortrix pictigaster) venom and isolation of two new dimeric disintegrins. Biologicals. 44(4):191-197.
143.MAGGI S, FAULHABER GA. 2015. Lonomia obliqua Walker (Lepidoptera: Saturniidae): hemostasis implications. Rev. Assoc. Med. Bras. 61(3):263-268.
144.MANOCK S, SUAREZ G, GRAHAM D, AVILA-AGUERO ML, WARRELL DA. 2008. Neurotoxic envenoming by South American coral snake (Micrurus lemniscatus helleri): case report from eastern Ecuador and review. Trans. R. Soc. Trop. Med. Hyg. 102(11):519-527.
145.MARCUSSI S, BERNARDES CP, SANTOS-FINHO NA, MAZZI MV, OLIVEIRA CZ, IZIDORO LM, FULY AL, MAGNO AJ, BRAZ ASK, FONTES MRM, GIGLIO JR, SOARES
AM. 2007. Molecular and functional characterization of a new non-hemorrhagic metalloprotease from Bothrops jararacussu snake venom with antiplatelet activity. Peptides. 28(12):2328-2339.
146.MARDER VJ, FRANCIS CW. 2006. Chapter 23: Physiologic Regulation of Fibrinolysis. In: COLMAN RW,CLOWES AW, GOLDHABER SZ, MARDER VJ, GEORGE JN. (Eds.). Hemostasis and Thrombosis: Basic Principles and Clinical Practice. Lippincott Williams & Wilkins, Philadelphia, USA, pp. 419-436.
147.MARKLAND FS. 1998. Snake venoms and the hemostatic system. Toxicon. 36(12):1749-1800.
148.MARKLAND FS, SWENSON S. 2010. Fibrolase: trials and tribulations. Toxins (Basel). 2(4):793-808.
149.MARKLAND FS JR, SWENSON S. 2013. Snake venom metalloproteinases. Toxicon. 62:3-18.
150.MARSH NA, AROCHA-PIÑANGO CL. 1972. Evaluation of the fibrin plate method for estimating plasminogen activator. Thromb. Diathes. Haemorrh. 28(1):75-88.
151.MASCI PP, WHITAKER AN, SPARROW LG,DE JERSEY J, WINZOR DJ, WATTERS DJ, LAVIN MF, GAFFNEY PJ. 2000. Textilinins from Pseudonaja textilis textilis. Characterization of two plasmin inhibitors that reduce bleeding in an animal model. Blood. Coagul. Fibrinolysis. 11(4):385-393.
152.MATSUI T, FUJIMURA Y, TITANI K. 2000. Snake venom proteases affecting hemostasis and thrombosis. Biochim. Biophys. Acta. 1477(1-2):146-156.
153.MATSUSHITA O, OKABE A. 2001. Clostridial hydrolytic enzymes degrading extracellular components. Toxicon. 39(11):1769-1780.
154.MAZZI MV, MARCUSSI S, CARLOS GB, STABELIC RG, FRANCO JJ,TICLI FK, CINTRA AC, FRANÇA SC, SOARES AM, SAMPAIO SV. 2004. A new hemorrhagic metalloprotease from Bothrops jararacussu snake venom: isolation and biochemical characterization. Toxicon. 44(2):215-223.
155.MEBIUS MM, VAN GENDEREN PJ, URBANUS RT, TIELENS AG, DE GROOT PG, VAN HELLEMOND JJ. 2013. Interference with the host haemostatic system by schistosomes. PLoS Pathog. 9:e1003781.
156.MENEZES MC, FURTADO MF, TRAVAGLIA -CARDOSO SR, CAMARGO AC, SERRANO SM. 2006. Sex-based individual variation of snake venom proteome among eighteen Bothrops jararaca siblings. Toxicon. 47(3):304-312.
157.MONTECUCCO C, ROSSETTO O. 2000. How do presynaptic PLA2 neurotoxins block nerve terminals? Trends. Biochem. Sci. 25(6):266-270.
158.MORAES FV, SOUSA-E-SILVA MC, BARBARO KC, LEITÃO MA, FURTADO MF. 2003. Biological and immunochemical characterization of Micrurus altirostris venom and serum neutralization of its toxic activities. Toxicon. 41(1):71-79.
159.MOURA-DA-SILVA AM, BALDO C. 2012. Jararhagin, a hemorrhagic snake venom metalloproteinase from Bothrops jararaca. Toxicon. 60(3):280-289.
160.MOURA-DA-SILVA AM, CARDOSO DF, TANIZAKI MM. 1990. Differences in distribution of myotoxic proteins in venoms from different Bothrops species. Toxicon. 28(11):1293-1301.
161.MOURA-DA-SILVA AM, BUTERA D, TANJONI I. 2007. Importance of snake venom metalloproteinases in cell biology: effects on platelets, inflammatory and endothelial cells. Curr. Pharm. Des. 13(28):2893-2905.
162.MUSSONI L, RACZKA E, CHMIELEWSKA J, DONATI MB, LATALLO ZS. 1979. Plasminogen assay in rabbit and mouse plasma using the chromogenic substrate S-2251. Thromb. Res. 15 (3-4):341-349.
163.NIH (NATIONAL INSTITUTE OF HEALTH). 1985. Principles of Laboratory Animal Care. National Institute of Health, USA, pp. 1-85.
164.NAVARRETE LF, LÓPEZ-JOHNSTON JC, BLANCO A. 2009. Guía de la Serpientes de Venezuela. Biología, venenos, conservación y listado de especies. Gráficas Lauki, Caracas, Venezuela, pp. 75.
165.NAWARAK J, SINCHAIKUL S, WU CY, LIAU MY, PHUTRAKUL S, CHEN ST. 2003. Proteomics of snake venoms from Elapidae and Viperidae families by multidimensional chromatographic methods. Electrophoresis. 24(16):2838-2854.
166.NUNES FP, ZYCHAR BC, DELLA-CASA MS, SAMPAIO SC, GONÇALVES LR, CIRILLO MC. 2010. Crotoxin is responsible for the long-lasting anti-inflammatory effect of Crotalus durissus terrificus snake venom: involvement of formyl peptide receptors. Toxicon. 55(6):1100-1106.
167.OKAJIMA K. 2001. Regulation of inflammatory responses by natural anticoagulants. Immunol. Rev. 184:258-274.
168.OLIVEIRA DA, HARASAWA C, SEIBERT CS, CASAIS E SILVA LL, PIMENTA DC, LEBRUN I, SANDOVAL MR. 2008. Phospholipases A2 isolated from Micrurus lemniscatus coral snake venom: behavioral, electroencephalographic, and neuropathological aspects. Brain Res. Bull. 75(5):629-639.
169.OMORI-SATOH T, SADAHIRO S, OHSAKA A, MURATA R. 1972. Purification and characterization of an antihemorrhagic factor in the serum of Trimeresurus flavoviridis, a crotalid. Biochim. Biophys. Acta. 285(2):414-426.
170.ORTMANN E, BESSER MW, KLEIN AA. 2013. Antifibrinolytic agents in current anaesthetic practice. Br. J. Anaesth. 111(4):549-563.
171.OUKKACHE N, EL JAOUDI R, GHALIM N, CHGOURY F, BOUHAOUALA B, MDAGHRI NE, SABATIER JM. 2014. Evaluation of the lethal potency of scorpion and snake venoms and comparison between intraperitoneal and intravenous injection routes. Toxins (Basel). 6(6):1873-1881.
172.PARDAL PPO, PARDAL JSO, GADELHA MAC, RODRIGUES LS, FEITOSA DT, PRUDENTE ALC, FAN HW. 2010. Envenomation by Micrurus coral snakes in the Brazilian amazon region: report of two cases. Rev. Inst. Med. Trop. São Paulo. 52(6):333-337.
173.PÉREZ ML, FOX K, SCHAER M. 2012. A retrospective evaluation of coral snake envenomation in dogs and cats: 20 cases (1996-2011). J. Vet. Emerg. Crit. Care (San Antonio). 22(6):682-689.
174.PARK D, KIM H, CHUNG K, KIM DS, YUN Y. 1998. Expression and characterization of a novel plasminogen activator from Agkistrodon halys venom. Toxicon. 36(12):1807-1819.
175.PESSINI AC, TAKAO TT, CAVALHEIRO EC, VICHNEWSKI W, SAMPAIO SV, GIGLIO JR, ARANTES EC. 2001. A hyaluronidase from Tityus serrulatus scorpion venom: isolation, characterization and inhibition by flavonoids. Toxicon. 39(10):1495-1504.
176.PETERSON ME. 2006. Snake bite: coral snakes. Clin. Tech. Small Anim. Pract. 21(4):183-186.
177.PIFANO F, RODRIGUEZ-ACOSTA A. 1996. Ecological Niche and redescription of Crotalus vegrandis (Serpentes: Crotalidae) in Venezuela. BRENESIA. 45-46:169-175.
178.PINTO JR, SANTOS LD, ARCURI HA, DIAS NB, PALMA MS. 2012. Proteomic characterization of the hyaluronidase (E.C. 3.2.1.35) from the venom of the social wasp Polybia paulista. Protein. Pept. Lett.19(6):625-635.
179.PINYACHAT A. 2016. Comparative studies of structural and functional properties of snake venom metalloproteinases. J. Med. Assoc. Thai. 99(Suppl. 1):S76-S88.
180.PIRKLE H, MARCKLAND JR FS. 1988. Hemostasis and Animal Venoms. Hematology, vol. 7. Marcel Dekker, New York, USA, pp. 658.
181.PREZOTTO-NETO JP, KIMURA LF, ALVES AF, GUTIÉRREZ JM, OTERO R, SUÁREZ AM, SANTORO ML, BARBARO KC. 2016. Biochemical and biological characterization of Bothriechis schlegelii snake venoms from Colombia and Costa Rica. Exp. Biol. Med. (Maywood). pii: 1535370216660214.
182.QIU Y, LEE KS, CHOO YM, KONG D, YOON HJ,JIN BR. 2013. Molecular cloning and antifibrinolytic activity of a serine protease inhibitor from bumblebee (Bombus terrestris) venom. Toxicon. 63:1-6.
183.QUEIROZ GP,PESSOA LA, PORTARO FC, FURTADO M DE F, TAMBOURGI DV. 2008. Interspecific variation in venom composition and toxicity of Brazilian snakes from Bothrops genus. Toxicon. 52(8):842-851.
184.QUINTANA -GONZÁLEZ S. 2002. Actualidades en hemostasia. Gac. Méd. Méx. 138(1):1-10.
185.RENGIFO C, RODRÍGUEZ-ACOSTA A. 2004. Serpientes, venenos y su tratamiento en Venezuela. Primera edición. Fondo de Publicaciones de la Facultad de Medicina, Universidad Central de Venezuela, Caracas, Venezuela, pp. 1-80.
186.RENJIFO C, SMITH EN, HODGSON WC, RENJIFO JM, SANCHEZ A, ACOSTA R, MALDONADO JH, RIVEROS A. 2012. Neuromuscular activity of the venoms of the Colombian coral snakes Micrurus dissoleucus and Micrurus mipartitus: an evolutionary perspective. Toxicon. 59(1):132-142.
187.REY-SUÁREZ P, NÚÑEZ V, GUTIÉRREZ JM, LOMONTE B. 2011. Proteomic and biological characterization of the venom of the redtail coral snake, Micrurus mipartitus (Elapidae), from Colombia and Costa Rica. J. Proteomics. 75(2):655-667.
188.REY-SUÁREZ P, FLORIANO RS,ROSTELATO-FERREIRA S, SALDARRIAGA-CÓRDOBA M, NÚÑEZ V, RODRIGUES-SIMIONI L, LOMONTE B. 2012. Mipartoxin-I, a novel three-finger toxin, is the major neurotoxic component in the venom of the redtail coral snake Micrurus mipartitus (Elapidae). Toxicon. 60(5):851-863.
189.RIJKEN DC, LIJNEN HR. 2009. New insights into the molecular mechanisms of the fibrinolytic system. J.Thromb. Haemost. 7(1):4-13.
190.RODEGHIERO F, CASTAMAN G. 1994. The pathophysiology and treatment of hemorrhagic syndrome of acute promyelocytic leukemia. Leukemia
.8(Suppl. 2):S20-S26.
191.RODRIGUES RS, IZIDORO LF, TEIXEIRA SS, SILVEIRA LB, HAMAGUCHI A, HOMSI-BRANDEBURGO MI, SELISTRE-DE-ARAÚJO HS, GIGLIO JR,FULY AL, SOARESM
AM, RODRIGUES VM. 2007. Isolation and functional characterization of a new myotoxic acidic phospholipase A2 from Bothrops pauloensis snake venom. Toxicon. 50(1):153-165.
192.RODRIGUES VM, SOARES AM, GUERRA-SÁ R, RODRIGUES V, FONTES MR, GIGLIO JR. 2000. Structural and functional characterization of neuwiedase, a
nonhemorrhagic fibrin(ogen)olytic metalloprotease from Bothrops neuwiedi snake venom. Arch. Biochem. Biophys. 381(2):213-224.
193.RODRÍGUEZ-ACOSTA A, MONDOLFI A, ORIHUELA R, AGUILAR A. 1995 ¿Qué hacer frente a un accidente ofídico? Venediciones, Caracas, Venezuela, pp. 46.
194.RODRÍGUEZ-ACOSTA A, SÁNCHEZ EE, MÁRQUEZ A, CARVAJAL Z, SALAZAR AM, GIRÓN ME, ESTRELLA A, GIL A, GUERRERO B. 2010. Hemostatic properties
of Venezuelan Bothrops snake venoms with special reference to Bothrops isabelae venom. Toxicon. 56(6):926-935.
195.ROSSO JP, VARGAS-ROSSO O, GUTIÉRREZ JM, ROCHAT H, BOUGIS PE. 1996. Characterization of alpha-neurotoxin and phospholipase A2 activities from Micrurus venoms. Determination of the amino acid sequence and receptor-binding ability of the major alpha-neurotoxin from Micrurus nigrocinctus nigrocinctus. Eur. J. Biochem. 238(1):231-239.
196.RUSSEL FE, WALTER FG, BEY TA, FERNÁNDEZ MC. 1997. Snakes and snakebite in Central America. Review article. Toxicon. 35(10):1462-1522.
197.SAJEVIC T, LEONARDI A, KRIŽAJ I. 2011. Haemostatically active proteins in snake venoms. Toxicon. 57(5):627-645.
198.SALAZAR AM, RODRÍGUEZ-ACOSTA A, GIRÓN ME, AGUILAR I, GUERRERO B. 2007. A comparative analysis of the clotting and fibrinolytic activities of the mapanare (Bothrops atrox) snake venom from different geographical areas in Venezuela. Thromb. Res. 120(1):95-104.
199.SALAZAR AM, AGUILAR I, GUERRERO B, GIRÓN ME, LUCENA S, SÁNCHEZ EE, RODRÍGUEZ-ACOSTA A. 2008. Intraspecies differences in hemostatic venom activities of the South American rattlesnakes, Crotalus durissus cumanensis, as revealed by a range of protease inhibitors. Blood.
Coagul. Fibrinolysis. 19(6):525-530.
200.SALAZAR AM, GUERRERO B, CANTU B, CANTU E, RODRÍGUEZ-ACOSTA A, PÉREZ JC, GALÁN JA, TAO A, SÁNCHEZ EE. 2009. Venom variation in hemostasis of the southern Pacific rattlesnake (Crotalus oreganus helleri): isolation of hellerase. Comp. Biochem. Physiol C. Toxicol. Pharmacol. 149(3):307-316.
201.SALAZAR AM, VIVAS J, SÁNCHEZ EE, RODRÍGUEZ-ACOSTA A, IBARRA C, GIL A, CARVAJAL Z, GIRÓN ME, ESTRELLA A, NAVARRETE LF, GUERRERO B. 2011.
Hemostatic and toxinological diversities in venom of Micrurus tener tener, Micrurus fulvius fulvius and Micrurus isozonus coral snakes. Toxicon. 58(1):35-45.
202.SAMPAIO SC, HYSLOP S, FONTES MR, PRADO-FRANCESCHI J, ZAMBELLI VO, MAGRO AJ, BRIGATTE P, GUTIERREZ VP, CURY Y. 2010. Crotoxin: novel activities for a classic beta-neurotoxin. Toxicon. 55(6):1045-1060.
203.SÁNCHEZ EE, LOPEZ-JOHNSTON JC, RODRÍGUEZ-ACOSTA A, PÉREZ JC. 2008. Neutralization of two North American coral snake venoms with United States
and Mexican antivenoms. Toxicon. 51(2):297-303.
204.SÁNCHEZ EE, RODRÍGUEZ-ACOSTA A, PALOMAR R, LUCENA SE, BASHIR S, SOTO JG, PÉREZ JC. 2009. Colombistatin: a disintegrin isolated from the venom of the South American snake (Bothrops colombiensis) that effectively inhibits platelet aggregation and SK-Mel-28 cell adhesion. Arch. Toxicol. 83(3):271-279.
205.SÁNCHEZ EE, LUCENA SE, REYES S, SOTO JG, CANTU E, LOPEZ-JOHNSTON JC, GUERRERO B, SALAZAR AM, RODRÍGUEZ-ACOSTA A, GALÁN JA, TAO WA, PÉREZ JC. 2010. Cloning, expression, and hemostatic activities of a disintegrin, r-mojastin 1, from the mohave rattlesnake (Crotalus scutulatus scutulatus). Thromb. Res. 126(3):e211-219.
206.SÁNCHEZ EF, SWENSON S. 2007. Proteases from South American Snake Venoms Affecting Fibrinolysis. Curr. Pharm. Anal. 3(2):147-157.
207.SÁNCHEZ EF, SANTOS CI, MAGALHAES A, DINIZ CR, FIGUEIREDO S, GILROY J, RICHARDSON M. 2000. Isolation of a proteinase with plasminogen-activating activity from Lachesis muta muta (bushmaster) snake venom. Arch. Biochem. Biophys. 378(1):131-141.
208.SÁNCHEZ EF, SCHNEIDER FS, YARLEQUE A, BORGES MH, RICHARDSON M, FIGUEIREDO SG, EVANGELISTA KS, EBLE JA. 2010. The novel metalloproteinase atroxlysin-I from peruvian Bothrops atrox (Jergón) snake venom acts both on blood vessel ECM and platelets. Arch. Biochem. Biophys. 496(1):9-20.
209.SASA M, VÁZQUEZ S. 2003. Snakebite envenomation in Costa Rica: a revision of incidence in the decade 1990-2000. Toxicon. 41(1):19-22.
210.SCHÄGGER H, VON JAGOW G. 1987. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Anal. Biochem. 166(2):368-379.
211.SELISTRE-DE-ARAUJO HS, PONTES CL, MONTENEGRO CF, MARTIN AC. 2010. Snake venom disintegrins and cell migration. Toxins (Basel). 2(11):2606-
2621.
212.SERRANO SM. 2013. The long road of research on snake venom serine proteinases. Toxicon. 62:19-26.
213.SERRANO SM, MAROUN RC. 2005. Snake venom serine proteinases: sequence homology vs. substrate specificity, a paradox to be solved. Toxicon. 45(8):1115-1132.
214.SERRANO SM, SAMPAIO CA, MANDELBAUM FR. 1993. Basic proteinases from Bothrops moojeni (caissaca) venom--II. Isolation of the metalloproteinase MPB. Comparison of the proteolytic activity on natural substrates by MPB, MSP 1 and MSP 2. Toxicon. 31(4):483-492.
215.SILVA JJ. 1994. Los Micrurus de la Amazonía Colombiana. Biología y toxicología experimental de sus venenos. Corporación Colombiana para la Amazonia Araracuara, COA. Colomb. Amazón. 7(1-2):41-138.
216.SCHULIGA M,WESTALL G,XIA Y,STEWART AG. 2013. The plasminogen activation system: New targets in lung inflammation and remodeling. Curr.
Opin. Pharmacol. 13(3):386-393.
217.SIMONIAN MH,SMITH JA. 2006. Spectrophotometric and colorimetric determination of protein concentration. Curr. Protoc. Mol. Biol. Chapter 10: Unit
10.1A.
218.SMITH A,JACOBSON L, MILLER B, HATHAWAY W, MANCO M. 2003. A new euglobulin lysis assay for global fibrinolysis. Thromb. Res. 112(5-6):329-337.
219.SPEARMAN-KÄRBER F. 1978. Alternative Methods of Analysis for Quantal Responses. In: Statistical Method in Biological Assay. Finney, D.J. Charles Griffin & Co. Ltd, London, UK, pp. 524-530.
220.SUGIKI M, MARUYAMA M, YOSHIDA E, MIHARA H, KAMIGUTI AS, THEAKSTON DG. 1995. Enhancement of plasma fibrinolysis in vitro by jararhagin, the main haemorrhagic metalloproteinase in Bothrops jararaca venom. Toxicon. 33(12):1605-1617.
221.SWENSON S, MARKLAND FS. 2005. Snake venom fibrin(ogen)olytic enzymes. Toxicon. 45(8):1021-1039.
222.SYROVETS T, LUNOV O, SIMMET T. 2012. Plasmin as a proinflammatory cell activator. J. Leukocyte. Biol. 92(3):509-519.
223.TAMBOURGI DV, DOS SANTOS MC, FURTADO MDF, DE FREITAS MCW, DA SILVA WD, KIPNIS TL. 1994. Pro-inflammatory activities in elapid snake venoms. Br. J. Pharmacol. 112(3):723-727.
224.TAN NH, SAIFUDDIN MN. 1990. Isolation and characterization of a hemorrhagin from the venom of Ophiophagus hannah (king cobra). Toxicon. 28(4):385-392.
225.TAN NH,PONNUDURAI G. 1991. A comparative study on the electrophoretic patterns of snake venoms. Comp. Biochem. Physiol. B. 102(1):103-109.
226.TAN NH, PONNUDURAI G. 1992. The biological properties of venoms of some American coral snakes (Genus Micrurus). Comp. Biochem. Physiol. B. 101(3):471-474.
227.TANAKA G, FURTADO M, PORTARO F, TAMBOURGI D. 2010. Diversity of Micrurus snake species related to their venom toxic effects and the prospective of antivenom neutralization. PLoS. Negl. Trop. Dis. 4:e622.
228.TANAKA G, QUEIROZ G, FURTADO MF, VAN DEN BERG C, TAMBOURGI D. 2012. Micrurus snake venoms activate human complement system and generate anaphylatoxins. BCM Immunology. 13:4. doi:10.1186/1471-2172-13-4.
229.TAYLOR P, SALAZAR E, BARRIOS M, SALAZAR AM, ABAD MJ, URDANIBIA I, SHEALY D, AROCHA-PIÑANGO CL, GUERRERO B. 2016. Role of the inflammatory response in the hemorrhagic síndrome induced by the hemolymph of the caterpillar Lonomia achelous. Toxicon. 121:77-85.
230.TEIXEIRA C, LANDUCCI E, ANTUNES E, CHACUR M, CURY Y. 2003. Inflammatory effects of snake venom myotoxic phospholipases A2. Toxicon.42(8):947-962.
231.TEIXEIRA C, CURY Y, MOREIRA V, PICOLO G, CHAVES F. 2009. Inflammation induced by Bothrops asper venom. Toxicon. 54(1):67-76.
232.TERRA AL, MOREIRA-DILL LS, SIMÕES-SILVA R, MONTEIRO JR, CAVALCANTE WL, GALLACCI M, BARROS NB, NICOLETE R, TELES CB, MEDEIROS PS, ZANCHI
FB, ZULIANI JP, CALDERON LL, STÁBELI RG, SOARES AM. 2015. Biological characterization of the Amazon coral
233.Micrurus spixii snake venom: Isolation of a new neurotoxic phospholipase A2. Toxicon. 103:1-11.
234.TERRA RM, PINTO AF, GUIMARÃES JA, FOX JW. 2009. Proteomic profiling of snake venom metalloproteinases (SVMPs): insights into venom induced
pathology. Toxicon. 54(6):836-844.
235.VERGARA I, PEDRAZA-ESCALONA M, PANIAGUA D, RESTANO-CASSULINI R, ZAMUDIO F, BATISTA CV, POSSANI LD, ALAGÓN A. 2014. Eastern coral snake Micrurus fulvius venom toxicity in mice is mainly determined by neurotoxic phospholipases A2. J. Proteomics. 105:295-306.
236.VICHAI V, KIRTIKARA K. 2006. Sulforhodamine B colorimetric assay for cytotoxicity screening. Nat. Protoc. 1(3):1112-1116.
237.VIVAS J. 2013. Efecto de venenos de serpientes del genero Micrurus sobre la hemostasia. Estudio de una actividad ant-hemostatica presente en el veneno de Micrurus tener tener. Caracas: Instituto Venezolano de Investigaciones Cientificas, Centro de Estudios Avanzados [Tesis Doctoral], pp. 187.
238.VIVAS J, IBARRA C, SALAZAR AM, NEVES-FERREIRA AG, SÁNCHEZ EE, PERALES J, RODRÍGUEZ-ACOSTA A, GUERRERO B. 2016. Purification and characterization of tenerplasminina-1, a serine peptidase inhibitor with antiplasmin activity from the coral snake (Micrurus tener tener) venom. Comp. Biochem. Physiol C. Toxicol. Pharmacol. 179:107-115.
239.WAN H, LEE KS, KIM BY, ZOU FM, YOON HJ, JE YH, LI J, JIN BR. 2013. A spider-derived Kunitz-type serine protease inhibitor that acts as a plasmin inhibitor and an elastase inhibitor. PLoS One. 8:e53343.
240. WEINBERG ML, FELICORI LF, BELLO CA, MAGALHÃES HP, ALMEIDA AP, MAGALHÃES A, SANCHEZ EF. 2004. Biochemical properties of a bushmaster snake venom serine proteinase (LV-Ka), and its kinin releasing activity evaluated in rat mesenteric arterial rings. J. Pharmacol. Sci. 96(3):333-342.
241.WEISSENBERG S, OVADIA M, KOCHVA E. 1987. Species specific sensitivity towards the hemorrhagin of Ophiophagus hannah (Elapidae). Toxicon. 25(5):475-481.
242.WHO (WORLD HEALTH ORGANIZATION ). 2010. Guidelines for the production Control and Regulation of snake antivenom immunoglobulins. Geneva, Switzerland, pp. 141.
243.WIEZEL GA, DOS SANTOS PK, CORDEIRO FA, BORDON KC, SELISTRE-DE-ARAÚJO HS, UEBERHEIDE B, ARANTES EC. 2015. Identification of hyaluronidase and
phospholipase B in Lachesis muta rhombeata venom. Toxicon. 107(Pt B):359-368.
244.XIUXIA L, JIASHU C, YINGNA Z, PENGXIN Q, GUANGMEI Y. 2001. Purification and biochemical characterization of F II(a), a fibrinolytic enzyme from Agkistrodon acutus venom. Toxicon. 39(8):1133-1139.
245.YAMAKAWA M, NOZAKI M, HOKAMA Z. 1976. Fractionation of Sakishima-habu (Trimeresurus elegans) venom and lethal, hemorrhagic and edema-forming activities of the fractions. In: OHSAKA A, HAYASHI K, SAWAI Y. (Eds). Animal, plant and microbial toxins. Plenum Press, New York, USA, pp. 97-110.
246.YUNUSOVA ES, SADYKOV ES, SHKINEV AV, SULTANALIEVA NM. 2013. Isolation and characteristics of α-fibrinogenase venom from Naja oxiana. Chem. Nat. Comp. 49(4):712-715.
247.ZHANG Y, LEE WH, XIONG YL, WANG WY, ZU SW. 1994. Characterization of OhS1, an arginine/lysine amidase from the venom of king cobra (Ophiophagus hannah). Toxicon. 32(5):615-623.
248.ZHANG Y, WISNER A, XIONG Y, BON C. 1995. A novel plasminogen activator from snake venom. Purification, characterization, and molecular cloning. J.
Biol. Chem. 270(17):10246-10255.
249.ZHU ZG, WU SG. 1999. Fibrinogenolytic properties of natrahagin (a proteinase from cobra venom) and its effect on human platelet aggregation. Zhongguo. Yao. Li. Xue. Bao. 20(10):944-947.
250.ZOCCAL KF, BITENCOURT C, PAULA-SILVA FW, SORGI CA, ARANTES EC, FACCIOLI LH. 2014. LR2, TLR4 and CD14 recognize venom associated molecular patterns from Tityus serrulatus to induce macrophage-derived inflammatory mediators. PLoS One. 9:e88174.
251.ZYCHAR BC, DALE CS, DEMARCHI DS, GONÇALVES LRB. 2010. Contribution of metalloproteases, serine proteases and phospholipases A2 to the inflammatory reaction induced by Bothrops jararaca crude venom in mice. Toxicon. 55(2-3):227-234.












 uBio
uBio 
