Saber
versión impresa ISSN 1315-0162
Saber vol.28 no.4 Cumaná dic. 2016
EN PACIENTES CON VULVOVAGINITIS DE COMUNIDADES RURALES DEL MUNICIPIO CARIPE, ESTADO MONAGAS, VENEZUELA, 2014
DRUVIC LEMUS-ESPINOZA, OSKARINA VILLARROEL JIMÉNEZ, MARÍA TERESA MANISCALCHI BADAOUI
Universidad de Oriente, Núcleo de Anzoátegui, Escuela de Ciencias de la Salud, Departamento de Microbiología y Parasitología, Grupo de Investigación de Microbiología Aplicada, Barcelona, Venezuela E-mail: lemusd@yahoo.com
RESUMEN
Este estudio evaluó mujeres sintomáticas con infección vaginal fúngica de cuatro comunidades rurales del municipio Caripe, estado Monagas, Venezuela, con el objetivo de identificar las especies involucradas y su sensibilidad a antimicóticos. Las especies de Candida se identificaron con el uso de CHROMagar Candida® y API AUX 20®. Adicionalmente se evaluó la susceptibilidad in vitro al fluconazol por el método de difusión en agar (CLSI, M44-A2). La prevalencia de vulvovaginitis micótica fue de 23/86 casos (26,7%) entre mujeres de 15a 60 años. Candida albicans fue la especie causal más común entre las pacientes (39,1%). Sin embargo, otros agentes aislados dentro del mismo género Candida dominaron (65,2%) y también fueron identificados: Complejo C. glabrata (4/23; 17,4 %), C. tropicalis (4/23; 17,4 %), Complejo C. parapsilosis (3/23; 13,1 %), C. guilliermondii (2/23; 8,7 %), C. krusei (1/23; 4,3%) y un caso de infección combinada de C. albicans con C. krusei (1/23). No se observó diferencia estadística entre los síntomas y las especies fúngicas; el eritema vulvovaginal se presentó en todas las mujeres infectadas. Más de la mitad de las levaduras aisladas (15/23) fueron sensibles a fluconazol. En esta muestra poblacional, los aislados Candida albicans y C. guilliermondii fueron 100% susceptibles a fluconazol, mientras que la cepa C. krusei aislada en la infección mixta fue resistente a fluconazol. Otras especies, como C. tropicalis (4/23), Complejo C. glabrata (2/23) y Complejo C. parapsilosis (1/23), presentaron susceptibilidad dosis dependiente al fluconazol. En las evaluaciones ginecológicas de pacientes de procedencia rural o urbana, con impresión clínica de vulvovaginitis micótica, debe implementarse la práctica del estudio microbiológico de la secreción vaginal.
PALABRAS CLAVE: Candida spp., Candida albicans, candidosis vaginal, fluconazol.
Candida spp. ISOLATED FROM PATIENTS WITH VULVOVAGINITIS OF RURAL COMMUNITIES FROM CARIPE MUNICIPALITY, MONAGAS STATE, VENEZUELA, 2014
ABSTRACT
This study evaluated patients with symptomatic vaginal fungal infection in a rural area of Caripe Municipality, Monagas state, Venezuela, aiming to identify the species involved and their sensibility to antimicotics. Identification of species of Candida yeast was made with the use of CHROMagar Candida® and API AUX 20®. Additionally, in vitro susceptibility to fluconazole was evaluated by the agar diffusion method (CLSI, M44-A2). The prevalence of vaginal candidiasis was 23/86 cases (26.7%) among women 15 to 60 years. Candida albicans was the most common species among patients (39.1%). However, other isolated agents within the same genus Candida dominated (65.2%) and were identified: Complex C. glabrata (4/23; 17.4%), C. tropicalis (4/23; 17.4%), Complex C. parapsilosis (3/23; 13.1%), C.guilliermondii (2/23; 8.7%), C. krusei (1/23; 4.3%) and one episode of mixed infection with C. albicans and C. krusei (1/23). No statistical difference was observed between symptoms; vulvovaginal erythema occurred in all infected women. More than half of the yeasts (15/23) were sensitive to fluconazole. In this population sample, isolates of C. albicans and C. guilliermondii were 100% sensitive to fluconazole, while the C. krusei strain (1/23) isolated from a mixed infection was resistant to this antimicotic. Other species, like C. tropicalis (4/23), C. glabrata (2/23) and Complex C. parapsilosis (1/23) showed dose-dependent susceptibility to fluconazole. In gynecological evaluations of patients from rural or urban communities, with clinical picture of micotic vulvovaginitis, a microbiological study of vaginal secretions should be implemented.
KEY WORDS: Candida spp, Candida albicans, vaginal candidosis, fluconazole.
Recibido: septiembre 2015. Aprobado: julio 2016 Versión final: septiembre 2016.
INTRODUCCIÓN
La vulvovaginitis fúngica en mujeres en edad reproductiva, sexualmente activas o no es una causa común de consulta médica, donde resulta difícil diferenciarla clínicamente de otras etiologías. Aproximadamente 15% de las mujeres están colonizadas por Candida albicans como parte de la microflora vaginal, pero generalmente no presentan síntomas (Solís-Árias et al. 2014). Existen estudios que revelan incremento en la incidencia de otras especies del mismo género relacionadas con la infección fúngica: C. tropicalis, C. kefyr, C. glabrata y C. parapsilosis (Azzam et al. 2002, Buscemi et al. 2004, Haleim et al. 2015). Cuando aparece la enfermedad infecciosa fúngica, se presentan también condiciones fisiológicas alteradas, desde disminución de la inmunidad local hasta la presencia de flujo vaginal anormal, por lo general blanco, grumoso acompañado de prurito, dolor urente, eritema y edema vaginal (Pimentel y Reynolds 2007). Las levaduras del género Candida evidencian un amplio espectro de susceptibilidad, con genotipos sensibles o resistentes a los tratamientos usuales, de estos, se ha observado particularmente el desarrollo de resistencia al fluconazol (Gamarra et al. 2014). La demostración del efecto anti Candida in vitro es una oportunidad pronóstica del resultado clínico de la infección por este hongo ante el fluconazol (Lemus-Espinoza et al. 2004), en ese sentido, el objetivo de este trabajo fue evaluar ginecológicamente pacientes de cuatro poblaciones rurales del norte del estado Monagas con vulvovaginitis micótica y tipificar fenotípicamente las especies aisladas de Candida, y su susceptibilidad al fluconazol.
MATERIALES Y MÉTODOS
Población y muestra
La naturaleza de este estudio fue de tipo descriptivo, se realizó durante los meses de febrero a septiembre de 2014, en Consultorios Médicos Integrales de Caripe (La Elvira, La Placeta, San Agustín y Teresen), estado Monagas. Las participantes fueron mujeres con sintomatología del tracto genital asociada a leucorrea. Se excluyeron pacientes embarazadas, o con sangrado menstrual, y que notificaron haber sido tratadas previamente con antifúngicos. Fue diseñado un cuestionario para obtener datos epidemiológicos y clínicos. Para la recolección de las muestras de secreción vaginal y cérvix, se usaron tubos con solución fisiológica estéril y dispositivos Copan (Pimentel y Reynolds 2007). A cada participante se solicitó consentimiento por escrito con base en las normas éticas concordantes con la Declaración de Helsinki de 1964, y el Código de Ética para la Vida del Ministerio del Poder Popular para la Ciencia, Tecnología e Industrias Intermedias de la República Bolivariana de Venezuela, 2011 (AMM 2008, MPPCT 2011). Todas las muestras fueron inmediatamente transportadas en cavas con hielo, hasta el laboratorio del Grupo de Investigaciones de Microbiología Aplicada, de la Escuela de Ciencias de la Salud, de la Universidad de Oriente, Núcleo de Anzoátegui, Barcelona.
Análisis de las muestras de flujo vaginal
El material obtenido fue examinado con microscopia óptica utilizando (a) solución fisiológica y (b) tinción de Gram, con la finalidad de verificar en la solución y en el frotis, probables elementos fúngicos tipo células de levadura y/o pseudohifas. El resto del material se uso para cultivos.
Las muestras fueron sembradas en agar Sabouraud con cloranfenicol (Himedia). Se empleó un medio secundario, CHROMagar Candida® (Oxoid), para la diferenciación de especies de levaduras. Las placas se incubaron a 35ºC en aerobiosis. Se revisaron diariamente. Se consideró infección por Candida cuando en la muestra ginecológica se observó en el examen microscópico blastosporas y pseudohifas, cultivo positivo para levaduras del género Candida y hallazgos clínicos en las pacientes. La interpretación como colonización por Candida se consideró, al haber ausencia de pseudohifas en la muestra (Fuenmayor-Boscan et al 2009). Adicionalmente se empleó el sistema API AUX20 (bioMeriux ®, France). Se evaluó la susceptibilidad in vitro a fluconazol (25 µg) por el método de difusión en agar (M44-A2) establecido por el Clinical Laboratory Standards Institute (CLSI 2004). Como control de calidad de la prueba, se utilizó la cepa ATCC Candida albicans 90028 de sensibilidad conocida.
Procesamiento de datos
Se realizó estadística descriptiva para determinar la frecuencia de aislamiento. Los resultados se expresaron como frecuencias relativas en porcentajes. Se determinó la significancia estadística mediante diferencia de proporciones (valor de Z), con índice de confiabilidad estadístico (p < 0,05). Se utilizó el programa SPSS versión 11.0 para Windows ®.
RESULTADOS
Se obtuvo cultivo positivo para Candida en 23/86 muestras (26,7%). El rango de edad en las mujeres con cultivo positivo fue de 15 a 60 años. El 100% de las pacientes con vulvovaginitis refirieron manifestaciones clínicas; las más frecuentes: eritema, disuria, prurito vulvovaginal y dispareunia. Destacó la presencia de flujo blanco amarillento en tres de las participantes con aislamiento de Complejo C. glabrata. En la figura 1 se muestran imágenes de cérvix con secreción y mucosa inflamada donde se aisló Candida spp.
El Complejo Candida albicans resultó aislada solo en mujeres mayores de 45 años y fue el germen más común entre las pacientes (39,1%). Otras Candida spp (60,9%), se identificaron: Complejo C. glabrata, C. tropicalis, Complejo C. parapsilosis, C. guilliermondii y C. krusei (Tabla 1). Excepcionalmente, se observó un caso de crecimiento mixto de C. albicans y C. krusei, cuyo aspecto bajo especuloscopía mostró cérvix con abundante secreción y grumos fuertemente adheridos al orificio cervical externo. En los estudios microscópicos de las muestras, que resultaron con cultivos positivos, se observaron blastosporas o la forma en pseudohifas indicativas del estado patógeno de las levaduras. Cuando se compararon las proporciones entre las Candida spp aisladas, se observó diferencia estadísticamente significativa entre Complejo C. albicans y Candida no albicans (p = 0,001) (Tabla 1). Se observó en el medio CHROMagar®, el desarrollo de colonias, con clara variabilidad de colores, en cada especie de levadura aislada. Candida albicans (verde esmeralda), C. glabrata (morado brillante), C. tropicalis (azul intenso), Complejo C. parapsilosis (morado claro), C. guilliermondii (rosa pálido) y C. krusei (rosa mate).
Figura 1. Especuloscopia de cérvix. A. Exocérvix eritematoso, presentando capa blanquecina en sección izquierda, pared vaginal y cuello por Candida albicans. B. Cérvix presentando grumos adherentes, y flujo en pared vaginal por Candida albicans y Candida krusei. C. Exocérvix con descarga de secreción blanco-amarillenta por Candida glabrata. D. Secreción homogénea blanca, de aspecto muy fluido causada por Candida tropicalis.

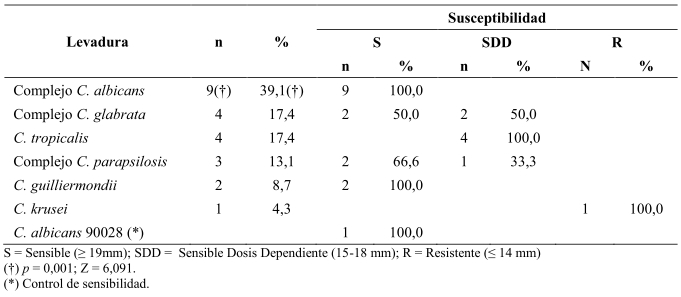
Fueron sensibles al fluconazol 15/23 aislados. Particularmente todos los aislados del Complejo C. albicans y C. guilliermondii. Resultó resistente C. krusei. Las otras especies: C. tropicalis, Complejo C. glabrata y Complejo C. parapsilosis presentaron susceptibilidad dosis dependiente al fluconazol (Tabla 2).
Tabla 1. Manifestaciones clínicas y características de las secreciones de pacientes con vulvovaginitis según especie de Candida aislada, municipio Caripe, estado Monagas.
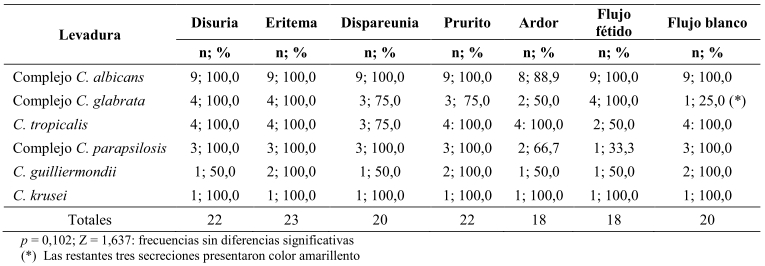
Tabla 2. Susceptibilidad al fluconazol de especies de Candida aisladas de muestras de pacientes con clínica vulvovaginal, municipio Caripe, estado Monagas.
DISCUSIÓN 
El único género identificado en los casos evaluados fue Candida (no se aislaron otros microrganismos asociados). Particularmente Candida albicans fue la levadura más frecuente (39,1%) en las pacientes con vulvovaginitis. Algunos autores han referido frecuencias de aislamientos de hasta 70% de los casos (Sachin y Santosh 2013, Gamarra et al. 2014). Sin embargo, existen otras especies involucradas, a saber, Candida glabrata y Candida guillermondii (Sachin y Santosh 2013, Gamarra et al. 2014). En este trabajo, la distribución Candida no albicans fue: Complejo C. glabrata y C. tropicalis (17,4 %), Complejo C. parapsilosis (13,1 %), C. guilliermondii (8,7 %) y C. krusei (4,3%), estos valores fueron similares a los resultados referidos por Buscemi et al. (2004), Sachin y Santosh (2013) y, más recientemente, por Haleim et al. (2015) en mujeres con vulvovaginitis micótica. El grupo de Candida spp. es considerado la segunda causa fúngica más común de vulvovaginitis por Dalben et al. 2008 y Hetticarachchi et al. 2010. La incidencia de estos casos de infección por Candida no albicans aún no está bien establecida (Esmaeilzadeh et al. 2009), quizás por ser una enfermedad infecciosa que no es de denuncia obligada, derive en sub-registro de la información epidemiológica de los casos. El porcentaje total de Candida no albicans en este trabajo representó el 60,9%. Existen reportes en años recientes de Egipto e India, en hospitales de zonas rurales que indican aumento en la incidencia de estas levaduras emergentes en infecciones vaginales, superando el 60% (Sachin y Santosh 2013, Haleim et al. 2015, Jithendra et al. 2015). En Venezuela Cherubini et al. (2003) evaluaron candidosis vaginal en mujeres habitantes de una zona rural del estado Falcón observando, que el 60% de los aislados fueron diferentes a Candida albicans. Estas especies parecen causar vulvovaginitis más severas que Candida albicans (Zeng et al 2011). Candida glabrata, C. tropicalis, C. guilliermondii y Complejo C. parapsilosis son cuatro taxones claramente mencionados como responsables de vulvovaginitis micótica (Buscemi et al. 2004, Dalben et al. 2008, Hetticarachchi et al. 2010, Jithendra et al. 2015), que poco a poco han ganado importancia clínica, originando razones de preocupación, por mostrar más resistencia a fármacos antifúngicos (Vermitsky et al. 2008, Jithendra et al. 2015). Esta es la importancia de asociar cada especie con su susceptibilidad in vitro a los antifúngicos.
Los estudios realizados por Azzam et al. (2002), Zeng et al (2011) y Schalkwyk (2015) demuestran que la secreción vaginal moderada, el prurito vulvar y el eritema de la mucosa vaginal en una paciente pudieran ser sugestivos de vulvovaginitis por Candida spp. Sin embargo; Grigoriou et al. (2006) reportaron que Candida no albicans causa con mayor frecuencia dolor y dispareunia que Candida albicans. Estas manifestaciones clínicas al parecer, no son suficientes para suponer cuál levadura estaría involucrada en la vulvovaginitis.
Se observó en esta población evaluada, el caso de infección mixta por C. albicans y C. krusei. El diagnóstico fue posible, por el empleo del medio cromógeno (Solís-Árias et al. 2014, Jithendra et al. 2015) que resultó útil para identificar, al mismo tiempo, las dos especies de levaduras presentes. En
otras investigaciones infecciosas ginecológicas, también de origen fúngico, se han reportado más de una levadura en una misma paciente, esta etiopatogenia es especialmente importante, porque los casos resultantes de más de una especie, son de difícil tratamiento (Rodríguez et al. 2013, Solís-Árias et al. 2014), como muestran estos resultados donde una de las levaduras fue susceptible y la otra no.
Muy pocos estudios informan la sensibilidad de las levaduras, basados en el documento CLSI 2004, M44-A2 el cual ofrece un método normalizado y valores de referencia para interpretar los resultados (Jithendra et al. 2015). En este trabajo claramente se observaron los aislados Complejo C. albicans y C. guilliermondii con 100% de sensibilidad a fluconazol. Sin embargo, hay información de resistencia para estas levaduras de hasta 15% en C. albicans (Dalben et al. 2008, Sachin y Santosh 2013, Jithendra et al. 2015). Es conocida la resistencia natural a fluconazol en C. krusei, y la baja respuesta de C. glabrata a este antifúngico. Ambas se asocian al empleo generalizado de fármacos triazólicos, pero particularmente, el uso de tratamiento previo con fluconazol ha sido identificado como principal factor de riesgo en el incremento de la resistencia farmacológica en casos de vulvovaginitis por C. glabrata (Sachin y Santosh 2013). Estudios documentados por otros autores en pacientes ginecológicas describen a Candida tropicalis, comúnmente aislada como sensibles dosis-dependiente a fluconazol hasta en 10%, y resistentes en más del 25% de los casos (Sachin y Santosh 2013, Jithendra et al. 2015), esos resultados coinciden con el presente estudio, donde las cuatro cepas de Candida tropicalis aisladas, presentaron susceptibilidad dosis-dependiente a fluconazol. Jithendra et al. (2015) afirmaron que la distribución geográfica de Candida es variable de un lugar a otro, debido al amplio margen de uso indistinto de un antimicótico u otro, la duración incompleta de su administración, aunado al mal diagnóstico del agente y a la falta de estudio de su sensibilidad.
CONCLUSIONES
El grupo de Candida no albicans fue dominante en las pacientes con vulvovaginitis de esta región rural del estado Monagas. En este trabajo tres de los seis taxones identificados presentaron sensibilidad dosis dependiente a fluconazol. Por la susceptibilidad de estos aislados, se recomienda dar un uso más adecuado y prudente al fluconazol.
REFERENCIAS BIBLIOGRÁFICAS
1.AMM(ASOCIACIÓN MÉDICA MUNDIAL). 2008. Declaración de Helsinki. Principios éticos para las investigaciones médicas en seres humanos. Modificación 59 Asamblea General. Seúl, Korea. Documento en línea: http://www.wma.net/es/30publications/10policies/b3/ (Acceso: 23.02.2014). [ Links ]
2.AZZAM M, CERMEÑO J, ORELLÁN-GARCÍA Y, PENNA S. 2002.Vulvovaginitis por Candida spp y Trichomonas vaginalis en mujeres sexualmente activas. Invest. Clin. 43(1):3-13.
3.BUSCEMIL, ARCHACALA A, NEGROMI R. 2004. Study of acute vulvovaginitis in sexually active adult women, with special reference of candidosis in patients of the Francisco J Muniz Infections Diseases Hospital. Rev. Iberoam. Micol. 21(4):177-181.
4.CHERUBINI B, SÁNCHEZ-MIRT A, GARCÍA L. 2003.Candidosis vaginal en mujeres sexualmente activas habitantes de una zona rural del estado Falcón, Venezuela. Rev. Soc. Ven. Microbiol. 23(1):138-145.
5.CLSI (CLINICAL LABORATORY STANDARDS INSTITUTE). 2004. Reference Method for Antifungal Disk Diffusion Susceptibility Testing of Yeasts. Approved Standard Second Edition. Document M44-A2. Wayne, Pennsylvania, USA.
6.DALBEN K, SUEMI D, PATUSSI E, LOPES M, ESTIVALET T. 2008. Susceptibilidad de levaduras vaginales a los antifúngicos más utilizados en Maringá, Paraná, Brasil. Acta Bioquím. Clín. Latinoam. 42(4):561-566.
7.ESMAEILZADEH S, OMRAN SM, RAHMANI Z. 2009. Frequency and etiology of vulvovaginal candidiasis in women referred to a gynecological center in Babol, Iran. Int. J. Fertil. Steril. 3(2):74-77.
8.FUENMAYOR-BOSCAN A, PAZ-MONTES A, ACOSTA N. 2009. Diagnóstico clínico presuntivo versus diagnóstico microbiológico en mujeres con leucorrea. Rev. Soc. Ven. Microbiol. 29(1):26-33.
9.GAMARRA S, MORANO S, DUDIUK C, MANCILLA E, NARDIN E, MENDEZ E, GARCIA-EFFRON G. 2014. Epidemiology and antifungal susceptibilities of yeasts
causing vulvovaginitis in a teaching hospital. Mycopathologia. 178(3-4):251-258.
10.GRIGORIOU O, BAKA S, MAKRAKIS E, HASSIAKOS D, KAPPAROS G, KOUSKOUNI E. 2006. Prevalence of clinical vaginal candidiasis in a university hospital and possible risk factors. Eur. J. Obstet. Gynecol. Reprod. Biol. 126(1):121- 125.
11.HALEIM M, EL-FEKY E, SAYED A, KADRY D, MAHMOUD A, RANA A. 2015.Prevalence of Candida non albicans species associated with vulvovaginal candidiasis in Egyptian women. Inter. J. Advances Health Sci. 2(3):304-313.
12.HETTICARACHCHI N, ASHBEE R, WILSON J. 2010. Prevalence and management of non-albicans vaginal candidiasis. Sex. Transm. Infect. 86(2):99-100.
13.JITHENDRA K, MADHAVULU B, RAMA P, MUNILAKSHMI P, AVINASH G. 2015. Candida Speciation from Vaginal Candidiasis and Its Antifungal Succeptability. Int. J. Curr. Med. App. Sci. 3(5):144-148.
14.LEMUS-ESPINOZA D, MANISCALCHI MT, LEDEZMA E, SÁNCHEZ J, VIVAS J, APITZ-CASTRO R. 2004. Susceptibilidad in vitro al ajoene de aislados de Candida albicans, C. parapsilosis y C. krusei obtenidos de pacientes con onicomicosis y su relación con el tratamiento tópico. Rev. Soc. Ven. Microbiol. 24(1-2):26-28.
15.MPPCT (MINISTERIO DEL PODER POPULAR PARA LA CIENCIA,TECNOLOGÍA E INDUSTRIAS INTERMEDIA Y FONDO NACIONAL DE CIENCIAS TECNOLOGÍA EN INNOVACIÓN). 2011. Código de bioética y bioseguridad. Tercera Edición. Caracas. Ediciones del Ministerio del Poder Popular para la Ciencia, Tecnología e Industrias Intermedias, Caracas, Venezuela.
16.PIMENTEL B, REYNOLDS E. 2007. Candidiasis vaginal. Rev. Paceña Med. Fam. 4(6):121-127.
17.RODRÍGUEZ M, GONÇALVES A, TOCANTINS M, CASTELLANO D, BARROSO J, DA SILVA L, GALUPPO D. 2013. Associação entre cultura de secreção vaginal, características sociodemográficas e manifestações clínicas de pacientes com diagnóstico de candidiase vulvovaginal. Rev. Bras. Ginecol. Obstet. 35(12):554-561.
18.SACHIN C, SANTOSH S. 2013.Vulvovaginal candidiasis due to non albicans Candida: its species distribution and antifungal susceptibility profile. Int. J. Curr. Microbiol. App. Sci. 2(12):323-328.
19.SCHALKWYK J. 2015. Vulvovaginitis: Screening for and Management of Trichomoniasis, Vulvovaginal Candidiasis, and Bacterial Vaginosis. J. Obstet. Gynaecol. Can. 37(3):266-274.
20.SOLÍS-ÁRIAS M, MORENO M, DÁVALOS R, FERNÁNDEZ O, ARENAS R. 2014.Colonización vaginal por Candida spp. Frecuencia y descripción de las especies aisladas en mujeres asintomáticas. Ginecol. Obstet. Mex. 82:1-8.
21.VERMITSKY J, SELF M, CHADWICK S, TRAMA J, ADELSON A, MORDECHAI E, GYGAX S. 2008. Survey of vaginal flora Candida species isolates from women of different age groups by use of species-specific PCR detection. J. Clin. Microbiol. 46(4):1501-1503.
22.ZENG J, ZONG L, MAO T, HUANG Y, XU Z. 2011. Distribution of Candida albican genotype and Candida species is associated with the severity of vulvovagianl candidiasis. Nan Fang Yi Ke Da Xue Xue Bao. 31(10):1649-1653.












 uBio
uBio 
