Revista de la Sociedad Venezolana de Microbiología
versión impresa ISSN 1315-2556
Rev. Soc. Ven. Microbiol. v.21 n.2 Caracas jul. 2001
Candida albicans y su efecto patógeno sobre las mucosas
Panizo, M. M. y Reviákina, V.
Departamento de Micología, Instituto Nacional de Higiene "Rafael Rangel", Caracas, Venezuela.
Resumen
Las infecciones micóticas producidas por las levaduras del género Candida, especialmente por Candida albicans, son complicaciones importantes en los pacientes inmunosuprimidos. Las tasas de morbilidad y mortalidad de estas infecciones se han incrementado considerablemente durante las últimas dos décadas. Frecuentemente, la candidosis de las mucosas (oral, gastrointestinal y vaginal), es el primer signo del deterioro de la función inmunológica. La severidad de las infecciones micóticas aumenta proporcionalmente con el aumento de la disfuncionalidad del sistema inmune; por lo tanto, los episodios de candidosis en las superficies mucosas son muy frecuentes y difíciles de tratar.
El desarrollo de nuevos procedimientos terapéuticos, asociados al deterioro de la respuesta inmune y a los factores de virulencia que posee Candida, como la propiedad de adherencia, la habilidad de competir con otros microorganismos por nutrientes y la capacidad de evadir las defensas del hospedero, interactúan entre sí, aumentando la frecuencia de la candidosis en el paciente inmunosuprimido. El propósito de esta revisión es presentar una panorámica de los aspectos más relevantes de la interacción entre Candida y la respuesta inmune del hospedero. La comprensión de estas complejas interacciones mejorará el conocimiento de los mecanismos de patogenicidad de este microorganismo y contribuirá al desarrollo de nuevas estrategias para la prevención y el manejo de estas infecciones.
Palabras-clave: Candidosis, mucosas, Candida albicans, patogénesis.
Candida albicans and its pathogenic effect on membranes
Abstract
Fungal infections produced by Candida species, specially by Candida albicans, are important complications among immunocompromised patients. Morbility and mortality rates of these infections have increased considerably during the past two decades. Frequently, mucosal candidiasis (oral, gastrointestinal, and vaginal) is the first sign of impaired immune function. The severity of fungal infections increases as the immune system becomes more dysfunctional, thus, mucosal candidiasis episodes are very frequent and difficult to treat.
The development of new therapeutic procedures, associated with the impaired of immune response and Candida virulence factors as adherence property, the ability to compete successfully with other microorganisms for nutrients, and the capacity to evade the host's immune defenses, interact between them and increase infection rates in the immunocompromised patient. The purpose of this review is to present an overview of the most relevant aspects of the interactions between Candida and the host immune response. The understanding of these complex interactions will improve the knowledge of Candida pathogenic mechanisms and will contribute to the development of new strategies for the prevention and management of these infections.
Introducción
Candida albicans es una levadura comensal que reside en las membranas mucosas de las cavidades oral y vaginal, así como en el tracto gastrointestinal de los humanos. Normalmente es inofensiva en el hospedero sano, pero su patogenicidad se dispara en el hospedero inmunocomprometido. Aunque la invasión inicial depende de los mecanismos inmunes del hospedero, C. albicans posee características intrínsecas que promueven su habilidad de causar enfermedad (1-3). Entre sus factores de virulencia se incluyen las adhesinas, la conversión morfogenética del microorganismo de la fase levaduriforme a la fase filamentosa, la secreción de enzimas como proteasas y fosfolipasas y la inmunomodulación de los mecanismos de defensa del hospedero (4-9).
El reconocimiento de receptores celulares en el hospedero por C. albicans es esencial para su supervivencia. La evolución de este microorganismo de comensal a patógeno es el resultado de su habilidad para colonizar células epiteliales en la mucosa y seleccionar adicionalmente otros atributos que promuevan su invasión.
Después del fenómeno de adherencia, se establecen interacciones entre el hongo y el hospedero que son críticas para el balance entre la enfermedad y la salud. C. albicans es capaz de adoptar diversas formas que indudablemente constituyen un mecanismo de adaptación a su ambiente y la forma micelial es considerada más virulenta que la fase levaduriforme. Se postula que la habilidad de C. albicans para formar tubos germinales es su mayor factor de virulencia pero no hay estudios que avalen este punto de vista (10, 11). Muestras obtenidas de tejidos animales y humanos enfermos casi siempre contienen hifas, pseudohifas y levaduras, sin embargo se piensa que el tubo germinal es más adherente a las superficies de las mucosas.
La patogenicidad depende de modificaciones de los mecanismos de defensa del hospedero, los cuales inician secundariamente transformaciones en el comportamiento fúngico.
Hoy en día se tiene un conocimiento razonablemente comprensible de los mecanismos dominantes de defensa y protección del hospedero contra la infección por C. albicans, tanto superficial como sistémica.
La inmunidad mediada por células es el mecanismo de defensa predominante en el hospedero durante la infección de la mucosa causada por C. albicans. Esto ha sido confirmado por estudios clínicos y experimentales que muestran el papel crítico de las células T en la protección contra la infección de la mucosa por C. albicans (por ejemplo, en candidosis mucocutánea crónica y candidosis gastrointestinal) (5)
Existen dos tipos de respuesta inmune y su papel en el desarrollo de la enfermedad es antagónico. Se conoce hoy en día como el paradigma Th1 y Th2.
La respuesta Th1 está asociada con la producción de Interferón gamma (IFN-g) e Interleuquina 2 (IL-2), se relaciona con resistencia a la infección controlando la respuesta inmune celular y se expresa al inicio de la enfermedad. La respuesta Th2 está relacionada con la producción de IL-4, IL-5, IL-6 e IL-10, se presenta en la fase progresiva de la enfermedad y tiene el control de la inmunidad humoral. La relación entre estas respuestas antagónicas determinará el curso de la enfermedad.
La activación de la respuesta Th1 depende en mayor proporción de las células presentadoras de antígenos y del Complejo Mayor de Histocompatibilidad clase II. Su inducción in vivo se correlaciona con la IL-12 y la extensión de la producción de IFN-g requiere la acción coordinada de algunas citoquinas incluyendo IL-6 y Factor de necrosis tumoral alfa (TNFá). La IL-12 es una citoquina fundamental, pues dirige la defensa tanto a nivel de las mucosas como a nivel sistémico.
En contraste, la respuesta Th2 no depende tanto de las células presentadoras de antígenos ni de las moléculas del Complejo Mayor de Histocompatibilidad clase II. Se asocia con la detección de Inmunoglobulina E (IgE) específica en suero, con la producción de IL-4 e IL-10 y regula las funciones efectoras antifúngicas de los macrófagos, incluyendo acción sobre el óxido nítrico que secretan cuando están activados. (12-15)
La candidosis mucocutánea ha sido observada en personas con deficiencias fisiológicas de inmunidad celular. La candidosis oral en el recién nacido o en la vejez puede estar relacionada con deficiencias del timo. La vulvovaginitis por Candida, asociada con el embarazo o el uso de anticonceptivos, puede estar ligada al papel de la progesterona sobre las células T y sobre la actividad anti-Candida de los leucocitos polimorfonuclares (LPMN). Además, la gonadotrofina coriónica y la hormona luteinizante inducen la transición de C. albicans de la fase levaduriforme a la fase filamentosa (16). La información clínica sugiere que la respuesta Th1 es sistemáticamente débil durante el embarazo.
El stress es frecuentemente una causa olvidada de inmunodeficiencia temporal. La regulación neuroendocrina y los efectos cronobiológicos pueden modular notablemente el sistema inmune y proveer la oportunidad de proliferación al hongo. La relevancia del stress en la candidosis, ha sido examinada sobre la base de que induce deterioro de la respuesta inmune. Datos proporcionados por estudios clínicos que usaron voluntarios sanos, han demostrado el efecto que provoca el stress físico y emocional, aumentando la colonización de las superficies mucosas por Candida (16, 17).
Además de las modificaciones fisiológicas, hay una larga lista de enfermedades que pueden facilitar el desarrollo de patógenos oportunistas. Deficiencias primarias o secundarias, que afectan las líneas mieloide o linfoide, muestran el papel fundamental de estas células en el control de la autodiscriminación y la homeostasis. La neutropenia y su duración es, obviamente, una de las principales causas de candidosis sistémica, mientras que la candidosis mucocutánea está directamente relacionada con deficiencias de las células T. La diabetes y otras endocrinopatías también son fuentes de candidosis mucocutánea (16, 18).
El incremento considerable de las infecciones por Candida en la década pasada, está ligado al desarrollo de nuevas técnicas y drogas, las cuales permiten al clínico penetrar profundamente en la intimidad tisular, celular y molecular de los pacientes, abriendo de este modo puertas para la invasión por Candida. Estos factores, denominados iatrogénicos, involucran nuevas sustancias químicas y técnicas terapéuticas, como son:
o Antibioticoterapia: particularmente la polimicrobiana, que causa modificaciones de la flora de la mucosa, favoreciendo la proliferación de Candida (19-21).
o Corticoterapia: directamente o a través de la modificación de la red de citoquinas, puede afectar a los LPMN, macrófagos y la actividad de las células T, favoreciendo el deterioro de su actividad antifúngica (22-25).
o Quimioterapia: favorece el agotamiento de los leucocitos, facilitando la infección fúngica. Además, la quimioterapia puede alterar la función de los LPMN y ulcerar la mucosa del tracto gastrointestinal, contribuyendo a la proliferación de Candida; estos fenómenos pueden ser potenciados por el tratamiento con antiácidos (26-28).
o Cirugía: principalmente la del tracto gastrointestinal (29).
o Cateterismo: puede provocar daño a los tegumentos y además proveer un sustrato, el cual, una vez dentro de la sangre, es cubierto rápidamente por fibronectina, fibrinógeno, plaquetas y otros componentes del plasma; esto constituye un soporte para la colonización y proliferación de microorganismos, los cuales, a este nivel, son más resistentes a los antibióticos y a los agentes antifúngicos (30, 31).
o Transplante: por sí mismo integra todos los factores iatrogénicos (32).
La mayoría de los factores iatrogénicos están relacionados con el deterioro de las defensas inmunes y de la integridad de superficie de las mucosas y la piel. Por otra parte, a nivel celular y molecular, Candida es un comensal que adopta comportamiento patógeno, pues cambia de su forma "tranquila" de vida a una más complicada, para superar las barreras naturales desarrolladas por el hospedero. Tiene que atravesar varias etapas para colonizar y proliferar a través de un hospedero usualmente bien protegido. La deficiencia en las defensas del hospedero no es suficiente para explicar la invasión, ya que el hongo necesita una estrategia particular para ser capaz de penetrar y crecer dentro de los tejidos del hospedero.
Para cambiar su comportamiento saprófito a patógeno, Candida tiene que desarrollar algunas características fenotípicas que le permitan penetrar al organismo del hospedero. La propensión de la célula fúngica a cambiar su comportamiento es muy grande y depende de su entorno. Se ha demostrado que el cambio fenotípico en las cepas de C. albicans está asociado con las infecciones sistémicas. Para ser considerado como un patógeno, Candida tiene que exhibir dos propiedades fundamentales: la adherencia a los receptores en el hospedero y la producción de enzimas líticas. Está bien establecido que estos dos procesos están asociados con variaciones morfológicas. Operando una transición dimórfica del estado levaduriforme al estado filamentoso, C. albicans incrementa sus propiedades adhesivas y la secreción de enzimas (16, 33).
Candidosis oral.
C. albicans coloniza la mucosa oral entre el 5-50% de los individuos sanos (34). El uso de corticosteroides predispone a padecer una candidosis oral y ésta es mucho más frecuente en pacientes que reciben quimioterapia por padecer linfoma y enfermedades hematológicas malignas, los que han recibido un transplante y los que tienen Síndrome de Inmunodeficiencia Adquirida (SIDA).
Clínicamente, los individuos con una reducida inmunidad mediada por células frente a Candida inevitablemente adquieren candidosis oral. Además, esta entidad se diagnostica frecuentemente bajo condiciones de inmunosupresión y específicamente cuando se encuentran disminuidos los recuentos de linfocitos T CD4(+) (35). Estos datos sugieren un papel importante de la inmunidad mediada por células durante esta enfermedad.
La experiencia clínica muestra que la candidosis oral es más común en pacientes con SIDA que en aquellos que tienen terapia inmunosupresora, un órgano transplantado o un linfoma. Una posible explicación es que las defensas locales del huésped están afectadas por el Virus de Inmunodeficiencia Humana (VIH). Un hallazgo interesante es que se ha observado un patrón de citoquinas Th2 en los individuos VIH(+) y este es más pronunciado en aquellos que tienen candidosis oral. El patrón de citoquinas Th2 (IL-4, IL-5, IL-6, IL-10) aparece como resultado de un descenso de las citoquinas Th1 (IL-2, IL-12 e IFN-g), más que por la elevación de las citoquinas tipo Th2. Alternativamente, esto puede estar influenciado por la virulencia de Candida.
El papel de la respuesta humoral en la candidosis oral ha sido estudiado exclusivamente en individuos VIH(+). Los anticuerpos específicos IgA contra Candida pueden estar normales o elevados en la saliva de los individuos VIH(+).
Estos anticuerpos específicos no parecen proteger a estos individuos de la candidosis oral.
La resistencia innata de la mucosa oral no ha sido estudiada con respecto a la función celular (por ejemplo, LPMN, macrófagos, células asesinas naturales). Las observaciones clínicas, sin embargo, muestran que la candidosis oral es extremadamente común en individuos neutropénicos. Por otra parte, existen datos en referencia a los efectos de los componentes antimicrobianos asociados a la saliva. Específicamente con respecto a Candida, se ha demostrado que en la saliva de individuos normales están presentes componentes anti-Candida y que estos se encuentran reducidos o ausentes en individuos VIH(+). Adicionalmente, las células epiteliales orales representan un mecanismo de defensa innato para el hospedero. Al presente, se desconoce si la actividad anti-Candida de estas células es modulada bajo condiciones de inmunosupresión (35).
Las defensas primarias a nivel de la mucosa oral incluyen la barrera física epitelial, el péptido antimicrobiano lingual (defensina con efecto antimicrobiano de amplio espectro), Ig A secretora, diferentes factores salivares (lisozima, histatinas y lactoferrina entre otros), junto con el propio flujo y arrastre efectuado por la saliva (36). La alteración más trivial parece ser suficiente para permitir que C. albicans produzca una infección localizada y limitada a la mucosa oral, que puede extenderse en casos severos a faringe, esófago e incluso producir una infección diseminada.
Como comensal de la cavidad oral, C. albicans puede adherirse a proteínas de la saliva y a bacterias de la cavidad oral para evitar su eliminación de esta zona. En estas interacciones intervienen múltiples mecanismos. Se ha observado aglutinación microscópica y macroscópica de aislados de C. albicans con cepas de Streptococcus sanguis, S. salivarius, S. mutans, S. mitis, Fusobacterium nucleatum, Actinomyces viscosus, Lactobacillus amylovorus y Bacteroides gingivalis (6). En general, la asociación con especies bacterianas distintas a los estreptococos fue sensible al tratamiento térmico de las bacterias y a la inhibición por un carbohidrato, por lo tanto, para estas especies, se sugiere la presencia de una interacción tipo lectina con los carbohidratos presentes en la superficie de Candida.
C. albicans también puede unirse a S. gordonii (6) y esta interacción parece ser una propiedad general para el hongo, ya que numerosas cepas poseen la habilidad de unirse a esta bacteria. La adhesina de unión que se ha propuesto para esta bacteria es un oligosacárido complejo. Esto se demostró por experimentos realizados utilizando anticuerpos contra el polisacárido de la pared de S. gordonii que inhibieron la adherencia y el mismo polisacárido por sí mismo también inhibe la adherencia. Este polisacárido contiene rhamnosa, glucosa, N-acetilgalactosamina y N-acetilglucosamina y la unión no fue inhibida por los azúcares encontrados en el polisacárido o por fucosa y manosa (6, 37). Por otra parte, es notorio que el polisacárido bacteriano contiene algunos de los azúcares que son reconocidos por la adhesina tipo lectina.
La saliva ofrece al hospedero protección contra la colonización. C. albicans se puede unir a varias proteínas de la saliva, aunque muy poco se conoce acerca de los componentes de la pared celular que intervienen en esta unión. Las investigaciones realizadas sobre éste tópico sugieren que las porciones de carbohidratos de las mananoproteínas pueden estar involucrados en la unión (6, 38). Proteínas de la saliva ricas en prolina promueven la unión y las mucinas presentes en la saliva procedentes de las glándulas submandibulares y sublinguales se unen tanto a la fase levaduriforme como a la fase filamentosa de C. albicans. Hoffman y Haidaris (53) estudiaron la unión del microorganismo en fase levaduriforme a las proteínas de la saliva humana y de rata. La unión fue específica para la mucina MG2 de la saliva humana y para una subfracción ácida de la mucina de la glándula submandibular de la rata, la RSMG.
La adherencia de C. albicans a las células epiteliales de la boca facilita la colonización y puede ser considerada como el primer paso en la patogénesis de la enfermedad. Varias categorías de adhesinas parecen estar involucradas en este proceso y de ellas, las interacciones tipo lectina, entre la porción proteica de la mananoproteína tipo lectina de Candida y un receptor con porciones de carbohidratos en la superficie de la célula del hospedero, parece ser el principal mecanismo de adherencia de Candida a las células epiteliales (9, 40-42)
No existen pruebas de la unión in vivo del microorganismo a los glicósidos específicos del hospedero, pero si existe correlación clínica acerca de que la candidosis oral es mucho más elevada en pacientes descritos como no secretores (individuos que presumiblemente no secretan receptores) en comparación con individuos que secretan receptores (43). La correlación es que la saliva de los secretores contiene receptores que bloquean la adherencia del microorganismo a la mucosa; de allí, la baja frecuencia de la enfermedad.
Adicionalmente, estudios realizados por Barret-Bee y col. (44) indican que existe una correlación entre la habilidad de C. albicans de adherirse a las células epiteliales y la producción de Fosfolipasa B, pero otras investigaciones sugieren que esta enzima no parece afectar directamente esta capacidad. Se necesitan estudios adicionales para confirmar estos resultados (figura Nº 1).

Candidosis gastrointestinal.
La mucosa gastrointestinal está dotada de un sistema de protección local, en el cual tiene lugar una respuesta inmune con características especiales llamada respuesta inmune asociada a las mucosas. Esta respuesta inmune se desarrolla a partir de tejido linfoide. Se encuentran asociaciones de tejido linfoide no encapsulado por tejido conectivo situado en la lámina propia y las áreas submucosas de los aparatos digestivo, respiratorio y genitourinario. Las células linfoides se hallan presentes, ya sea como cúmulos difusos u organizados en nódulos, solitarios o agrupados, que contienen centros germinales (folículos secundarios). En el ser humano, las amígdalas y las placas de Peyer en el íleon son particularmente prominentes. El epitelio intestinal que cubre dichas placas se halla especializado en el transporte de los antígenos hacia el tejido linfoide. Esta función particular es realizada por unas células epiteliales denominadas células M (micropliegues). Las células M son capaces de absorber y transportar los antígenos para que sean procesados y presentados a las células linfoides subepiteliales por las células presentadoras de antígenos.
Las respuestas inmunes humorales a nivel de la mucosa son de tipo IgA. La IgA secretora es un anticuerpo que puede atravesar las membranas mucosas y ayuda a impedir la entrada de los microorganismos patógenos. Además de la IgA, se encuentran un gran número de linfocitos en el tejido conjuntivo de la lámina propia y dentro de la capa epitelial de las mucosas. Los linfocitos de la lámina propia son predominantemente células T activadas, aunque también pueden detectarse numerosas céulas B activas y células plasmáticas. Estas células plasmáticas especiales secretan sobre todo IgA, que se transporta a través de las células epiteliales y se libera en el interior de la luz intestinal. Los linfocitos intraepiteliales son predominantemente células T que exhiben características fenotípicas de las que presentan los linfocitos de la lámina propia. Aunque el fenotipo de los linfocitos de la lámina propia es similar al de los linfocitos de sangre periférica (TCR alfa-beta), un porcentaje elevado de linfocitos intraepiteliales son células TCR gamma-delta, la mayoría de las cuales expresa CD8. La mayoría de los linfocitos intraepiteliales y de la lámina propia son células de memoria.
Las células linfoides asociadas a la mucosa recirculan principalmente dentro del sistema linfoide de las mucosas. Así, las células linfoides estimuladas en las placas de Peyer por un antígeno, viajan por la linfa hacia los ganglios linfáticos regionales y luego por el conducto torácico a la circulación, para ir de nuevo a asentarse en las mucosas, donde van a secretar IgA. La recirculación específica (tropismo por las mucosas) se basa en las moléculas de adhesión que éstas células expresan y la estimulación antigénica en un área de la mucosa provoca una respuesta tipo IgA en otras zonas cubiertas por mucosas (figura Nº 2).
Figura 2. Componentes del sistema inmunitario de las mucosas
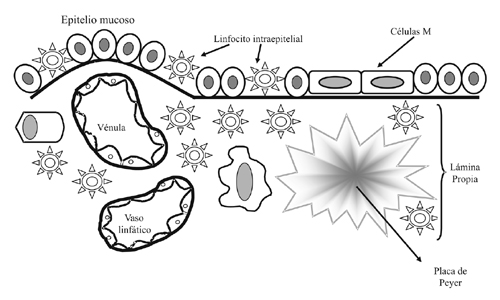
La migración y colonización de linfocitos B secretores de IgA y células T gamma-delta puede tener dos tipos de consecuencia, ya que un antígeno local puede producir una respuesta inmune local más una respuesta inmune sistémica (como por ejemplo la vacunación antipolio), o producir una respuesta inmune local más tolerancia sistémica (por ejemplo la tolerancia a los alimentos). Entre las características diferenciales de la respuesta inmune en las mucosas está la diferente distribución porcentual de las clases de inmunoglobulinas, predominando el tipo IgA (13-15).
La función primaria del sistema inmunitario de las mucosas es proporcionar defensa al individuo en la superficie de las mucosas y la función secundaria, pero de igual importancia, es evitar la entrada de antígenos por esta vía y proteger así al sistema inmunitario sistémico de la inadecuada exposición antigénica. Pero estas funciones operan conjuntamente con diversos factores protectores no inmunitarios.
Como el tracto gastrointestinal es frecuentemente colonizado por Candida, su proliferación está controlada por varios factores. Hay evidencia considerable de que la flora bacteriana normal, aeróbica y anaeróbica, inhibe la proliferación de Candida in vitro en el tracto gastrointestinal de modelos animales y en aislados de mucosa intestinal. Los mecanismos que se postulan son competencia nutricional y competencia por el nicho ecológico o por sitios de adherencia. La acidez gástrica normal y la producción de componentes tóxicos como ácidos grasos volátiles y/o ácidos biliares secundarios provocan alteraciones desfavorables en el microambiente para el crecimiento de patógenos. Adicionalmente, la peristalsis y la función ciliar mantienen el flujo de constituyentes de la mucosa y reduce la interacción de patógenos potenciales con las células epiteliales. La mucina forma una barrera entre estos patógenos y las células epiteliales; además, en ella se encuentran sustancias como la lactoferrina, lactoperoxidasa y lisozima que tienen efectos inhibitorios sobre uno u otro microorganismo específico (45).
La erradicación de la flora normal por el uso de antimicrobianos de amplio espectro, la administración de glucocorticosteroides y el tratamiento con drogas citotóxicas son factores de riesgo importantes para la infección por Candida. Los mecanismos incluyen inhibición de la inmunidad mediada por células, inducción de hiperglicemia, cambios cualitativos y cuantitativos en la secreción gástrica de mucina y producción de úlceras gástricas. Todo esto se debe a la combinación de cambios locales en la mucosa y al efecto inmunosupresor sistémico.
La mucina intestinal juega un papel importante en la lubricación de la superficie epitelial y en la defensa del hospedero. C. albicans se puede unir al residuo C-terminal de 118 kDa de la mucina a través de interacciones hidrofóbicas y la degradación de la mucina es facilitada por la secreción de aspartil-proteinasa 2 (38, 46). Esto implica que C. albicans se asocia con la mucina y la degrada; estas dos propiedades pueden modular la población de este hongo en el tracto gastrointestinal. El mecanismo por el cual esto se lleva a cabo es aún desconocido (figura Nº 3).
Figura 3. Candidosis gastrointestinal

Candidosis vaginal.
C. albicans coloniza la mucosa vaginal entre el 5-20% de las mujeres sanas (47). Se ha estimado que aproximadamente el 75% de todas las mujeres experimentan al menos un episodio de CVV en su vida (47) y de estas el 20% experimentan un episodio posterior (48). La Candidosis Vulvovaginal Recurrente (CVVR) definida como cuatro o más episodios anuales, se presenta en al menos el 5% de las mujeres que han experimentado un episodio de Candidosis Vulvovaginal Primaria Esporádica (CVVPE) (49-51).
Tanto los factores de virulencia del microorganismo como los factores predisponentes del hospedero han sido bien estudiados en la CVVPE, pero no se sabe mucho acerca de lo que ocurre en la CVVR. Aunque la curación clínica y micológica tras el tratamiento con azoles se alcanza en el 80-90% de los casos de CVV, aproximadamente el 20% de las pacientes sufren recaídas posteriores (48) y de éstas el 50% presentan episodios recurrentes dentro de varios días a tres meses después de que finalizan el tratamiento (51). Aún cuando se cree que los factores de riesgo ya mencionados para la CVVPE pueden jugar un papel en la CVVR, la mayoría de las mujeres que presentan esta entidad no muestran factores predisponentes reconocibles (47, 49).
Se manejan dos hipótesis para explicar el origen de la CVVR: la reinfección y la recaída. Estudios del cariotipo de C. albicans aisladas de episodios sucesivos de vaginitis en mujeres con CVVR (48) muestran que la misma cepa es aislada repetidamente y que esta permanece colonizando la mucosa vaginal en los períodos inter-episodios, lo que soporta el concepto de recaída, bien a expensas del reservorio vaginal o del gastrointestinal.
Poco se conoce acerca de los mecanismos de defensa de la mucosa vaginal contra cualquier patógeno, incluyendo C. albicans. Son muy pocos los trabajos realizados en mujeres con CVVR que tratan de establecer una relación entre la respuesta inmune y la aparición de la enfermedad y no se han realizado trabajos con mujeres inmunocompetentes e inmunosuprimidas con CVV.
Históricamente, las infecciones vaginales eran incluidas entre las infecciones de las mucosas afectadas por deficiencias de células T. Los datos basados en estudios experimentales de candidosis vaginal con un modelo murino estrógeno dependiente, para evaluar el papel de la inmunidad mediada por células, concluyeron que tanto la inmunidad adquirida como la inmunidad mediada por células o anticuerpos son responsables de proteger al ratón contra la candidosis vaginal y que la mucosa vaginal tiene cierto nivel de independencia inmunológica (52-58). Aunque la CVVR se presenta en ausencia de factores predisponentes conocidos, se ha postulado que es el resultado de alguna deficiencia o disfunción del sistema inmune, pero los resultados de las investigaciones indican que, de existir una deficiencia o disfunción inmune en las pacientes con CVVR, ésta se presenta a nivel local más que a nivel sistémico (59-62).
Estudios recientes sugieren que si las células T son importantes, es la respuesta local la que mejor protege contra la infección por C. albicans. Esta conclusión está basada en parte en estudios sobre un modelo murino con vaginitis inducida, así como en estudios clínicos en mujeres con CVVR (54, 55, 62, 63). Aunque las controversias abundan, estudios clínicos controlados apropiadamente sugieren que la vaginitis por Candida no es tan común en las mujeres infectadas por el virus de la inmunodeficiencia adquirida y no se correlaciona con el descenso de las células T CD4 (64-66). Estudios recientes sugieren que la resistencia innata puede ser crítica para la protección contra la infección por C. albicans. Aunque los anticuerpos son inducidos frente a la exposición a C. albicans, es incierto su papel protector contra las infecciones por este hongo. Varios autores han concluido que los anticuerpos anti-Candida no son protectores (58, 67), pero hay reportes que demuestran lo contrario en la infección experimental por C. albicans sistémica o vaginal (68, 69). La experiencia clínica, sin embargo, demuestra que individuos con deficiencias de inmunidad humoral no tienen un incremento en la susceptibilidad a la infección por este microorganismo (67).
Aunque la mucosa vaginal carece de áreas linfoides organizadas como las que tiene el tracto gastrointestinal, estudios en animales han demostrado que tiene todos los componentes necesarios para una respuesta inmune competente. Esto incluye expresión de inmunoglobulinas, células T y células del complejo mayor de histocompatibilidad clase II (células de Langerhans, macrófagos) que sirven como células presentadoras de antígenos. Las células T CD4 que predominan en la vagina son CD4+ a/b TCR(+), lo que implica su papel crítico en la respuesta del hospedero contra la infección por Candida. Estas observaciones avalan el concepto de independencia inmunológica o "compartamentalización" de las células T en la mucosa vaginal. En estudios realizados en modelos murinos con vaginitis, no se evidenció la infiltración de linfocitos T sistémicos durante la infección experimental. Estudios posteriores deben evaluar la expresión local de citoquinas, quimiocinas y de moléculas de adhesión durante la infección para otorgarle mayor importancia a los hallazgos obtenidos hasta el momento (70).
La inmunidad innata podría jugar un papel significativo contra la vaginitis por Candida, pero muy pocos trabajos avalan esta hipótesis. De hecho, los LPMN no parecen estar involucrados en la protección de la vagina y la mayoría de los estudios han demostrado que las células asesinas naturales no juegan un papel protector en la misma. Adicionalmente, estas células no son residentes de la mucosa vaginal.
Las células epiteliales de la mucosa vaginal producen una variedad de citoquinas y quimiocinas y representan un importante mecanismo de resistencia innata contra C. albicans. Se ha demostrado que estas células inhiben el crecimiento de C. albicans in vitro. Pero, esta defensa innata probablemente sea muy débil y puede ser opacada fácilmente en presencia de un gran número de microorganismos virulentos. Estudios críticos deben evaluar la actividad anti-Candida de las células epiteliales vaginales, de los PMN, macrófagos y células T en mujeres con CVVR o portadoras de VIH, para poder determinar si las infecciones por C. albicans son oportunistas estrictas basados en las deficiencias de la respuesta inmune local, puesto que los hallazgos obtenidos hasta este momento sugieren esa posibilidad. (70) (figura Nº 4).

Conclusiones
El balance que se establece entre Candida y los mecanismos de defensa efectivos del hospedero, es dinámico: por una parte, encontramos las múltiples barreras que ofrece la respuesta inmune y por otro lado se encuentra el peso de Candida como comensal y/o patógeno. Sin embargo, en el contexto del paciente inmunocomprometido, Candida se comporta como patógeno verdadero.
Es evidente que, los mecanismos de defensa encargados de proteger al hospedero contra las infecciones orales, gastrointestinales y vaginales son diferentes. Una muestra de ello es que, mientras existe una relación entre la inmunidad mediada por células y la incidencia de candidosis oral, no existe relación alguna entre este mecanismo de defensa y la CVVPE o la CVVR. Además, las células epiteliales juegan un papel importante en la resistencia innata a la infección o sirven para mantener al microorganismo en su estado comensal.
Considerando que la mayoría de los pacientes inmunosuprimidos se infectan con Candida, que los factores iatrogénicos están involucrados en la selección de cepas más patógenas y que son responsables de la emergencia de cepas más resistentes a la terapia antifúngica, los esfuerzos de los investigadores deben dirigirse a descubrir cuales son los mecanismos de defensa contra Candida en cada sitio particular, con la finalidad de desarrollar estrategias inmunes específicas que ayuden en la prevención y tratamiento de estas infecciones, ya sean de origen endógeno o exógeno.
Bibliografía:
1. Trick, W. E.; Jarvis, W. R.: Epidemiology of nosocomial fungal infection in the 1990s. Rev Iberoam Micol 15: 2-6, 1998. [ Links ]
2. Bodey, G. P.: Emerging antimicrobial-resistant pathogens in the immunocompromised host. Curr Opin Infect Dis 8: 411-414, 1995. [ Links ]
3. Gillieece, A. C.; Fenelon, L.: Unusual infections and novel therapy in the immunocompromised host. Curr Opin Infect Dis 13: 361-366, 2000. [ Links ]
4. Cassone, A.; De Bernardis, F.; Mondello, F.; Ceddia, T.; Agatensi, L.: Evidence for a correlation between proteinase secretion and vulvovaginal candidiasis. J Infect Dis 156: 777-783, 1987. [ Links ]
5. Fidel Jr, P. L.; Vázquez, J. A.; Sobel, J. D.: Candida glabrata: review of epidemiology, pathogenesis and clinical disease with comparison to C. albicans. Clin Microbiol Rev 12: 80-96, 1999. [ Links ]
6. Chaffin, W. L.; López-Ribot, J. L.; Casanova, M.; Gozalbo, D.; Martínez, J. P.: Cell wall and secreted proteins of Candida albicans: identification, function and expression. Microbiol Mol Biol Rev 62: 130-180, 1998. [ Links ]
7. Soll, D.R.: High-frequency switching in Candida albicans. Clin Microbiol Rev 5: 183-203, 1992. [ Links ]
8. De Bernardis, F.; Molinari, A.; Boccanera, M.; Stringaro, A.; Robert, R.; Senet, J. M.; Arancia, G.; Cassone, A.: Modulation of cell surface-associated mannoprotein antigen expression in experimental candidal vaginitis. Infect Immun 62: 509-519, 1994. [ Links ]
9. Cutler, J. E.: Putative virulence factors of Candida albicans. Annu Rev Microbiol 45: 187-218, 1991. [ Links ]
10. Pendrak, M. L.; Klotz, S. A.: Adherence of Candida albicans to host cells. FEMS Microbiol Lett 129: 103-114, 1995. [ Links ]
11. Kobayashi, S. D.; Cutler, J. E.: Candida albicans hyphal formation: is there a clearly defined role? Trends Microbiol 6: 92-94, 1998. [ Links ]
12. Murphy, J. W.; Bistoni, F.; Deepe, G. S. et al: Type 1 and type 2 cytokines: from basic science to fungal infections. Med Mycol 36(Suppl 1): 109-118, 1998. [ Links ]
13. Abbas, A. K.; Lichtman, A. H.; Pober, J. S.: Inmunología Celular y Molecular. 3ª Edición. Editorial Interamericana-Mc Graw-Hill. España, 1999. [ Links ]
14. Roitt, I.: Inmunología. Fundamentos. 9ª Edición. Editorial Médica Panamericana. Argentina, 1998. [ Links ]
15. Delves, P. J.; Roitt, I.: The Immune System. Second of two parts. In: Review Articles. Advances in Immunology. New Engl J Med 343: 108-117, 2000. [ Links ]
16. Senet, J. M.: Risk factors and physiopathology of candidiasis. Rev Iberoam Micol 14: 6-13, 1997. [ Links ]
17. Mishra, S. K.; Segal, E.; Gunter, E. et al: Stress, immunity and mycotic diseases. J Med Vet Mycol 32(Suppl 1): 379-406, 1994. [ Links ]
18. Jensen, J.; Warner, T.; Balish, E.: The role of phagocytic cells in resistance to disseminated candidiasis in granulocytopenic mice. J Infect Dis 170: 900-905, 1994. [ Links ]
19. Kennedy, M. J.; Volz, P. A.: Effect of various antibiotics on gastrointestinal colonization and dissemination by Candida albicans. J Med Vet Mycol 23:265-273, 1985. [ Links ]
20. Levine, J.; Dykoski, R. K.; Janoff, E. N.: Candida-associated diarrhea: A syndrome in search of credibility. Clin Infect Dis 21: 881-886, 1995. [ Links ]
21. Bernhardt, H.; Wellner, A.; Zimmermann, K.; Knoke, N.: Growth of Candida albicans in normal and altered faecal flora in the model of continous flow culture. Mycoses 38: 265-270, 1995. [ Links ]
22. Braun, P. C.: Surface hydrophobicity enhances corticosterone incorporation in Candida albicans. Infect Immun 62: 4087-4090, 1994. [ Links ]
23. Nohmi, T.; Abe, S.; Tausho, S.; Yamaguchi, H.: Suppression of anti-Candida activity of murine and human neutrophils by glucocorticoids. Microbiol Immunol 38: 977-982, 1994. [ Links ]
24. Heindenreich, S.; Kubis, T.; Schmidt, M.; Fegeler, W.: Glucocorticoid-induced alterations of monocyte defense mechanisms against Candida albicans. Cell Immunol 157: 320-327, 1994. [ Links ]
25. Deslauriers, N.; Coulombe, C.; Carre, B.; Goulet, J. P.: Topical application of a corticosteroid destabilizes the host-parasite relationship in an experimental model of the oral carrier state of Candida albicans. FEMS Immunol Med Microbiol 11: 45-55, 1995. [ Links ]
26. Denning, D. W.: Epidemiology and pathogenesis of systemic fungal infections in the immunocompromised host. J Antimicrob Chemother 28: 1-16, 1991. [ Links ]
27. Ueta, E.; Osaki, T.; Yoneda, K.; Yamamoto, T.; Umazume, M.: Influence of inductive chemo-radiotherapy on salivary polymorphonuclear leukocyte (SPMN) functions in oral cancer. J Oral Pathol Med 23: 418-422, 1994. [ Links ]
28. Sandovskylosica, H.; Barrnea, L.; Segal, E.: Fatal systemic candidiasis of gastrointestinal origin - an experimental model in mice compromised by anti-cancer treatment. J Med Vet Mycol 30: 219-231, 1992. [ Links ]
29. Rantala, A.; Niinikoski, J.; Lehtoen, O. P.: Early Candida isolations in febrile patients after abdominal surgery. Scand J Infect Dis 25: 479-485, 1993. [ Links ]
30. Lecciones, J.; Lee, J.; Navarro, E. et al: Vascular catheter-associated fungemia in patients with cancer: analysis of 155 episodes. Clin Infect Dis 14: 875-883, 1992. [ Links ]
31. Raad, I.; Bodey, G.: Infectious complications of indwelling vascular catheters. Clin Infect Dis 15: 197-210, 1992. [ Links ]
32. Meyers, J.: Fungal infections in bone marrow transplant patients. Semin Oncol 17: 10-13, 1990. [ Links ]
33. Jones, S.; White, G.; Hunter, P. R.: Increased phenotypic switching in strains of Candida albicans associated with invasive infections. J Clin Microbiol 32: 2869-2870, 1994. [ Links ]
34. Hauman, C.H.; Thompson, I.O.; Theunissen, F.; Wolfaart, P.: Oral carriage of Candida in healthy and HIV-seropositive persons. Oral Surg Med Pathol 76: 570-572, 1993. [ Links ]
35. Fidel Jr, P. L.: Host defense against oropharyngeal and vaginal candidiasis: site-specific differences. Rev Iberom Micol 16: 8-15, 1999. [ Links ]
36. Lehrer, N.; Segal, E.; Cihlar, R.; Calderone, R.: Pathogenesis of vaginal candidiasis: studies with a mutant which has reduced ability to adhere in vitro. J Med Vet Mycol 24: 127-131, 1986. [ Links ]
37. Holmes, A. R.; Gopal, P. K.; Jenkinson, H. F.: Adherence of Candida albicans to a cell surface polysaccharide receptor on Streptococcus gordonii. Infect Immun 63: 1827-1834, 1995. [ Links ]
38. Repentigny, L.; Aumont, F.; Bernard, K.; Belhumeur, P.: Characterization of binding of Candida albicans to small intestinal mucin and its role in adherence to mucosal epithelial cells. Infect Immun 68: 3172-3179, 2000. [ Links ]
39. Hoffman, M.; Haidaris, C.: Analysis of Candida albicans adhesion to salivary mucin. Infect Immun 61: 1940-1949, 1993. [ Links ]
40. Calderone, R. A.; Braun, P. C.: Adherence and receptors relationships of Candida albicans. Microbiol Rev 55: 1-20, 1991. [ Links ]
41. Hostetter, M. K.: Adhesins and ligands involved in the interaction of Candida spp. with epithelial and endothelial cells. Clin Microbiol Rev 7: 29-42, 1994. [ Links ]
42. Pendrak, M. L.; Klotz, S. A.: Adherence of Candida albicans to host cells. FEMS Microbiol Lett 129: 103-114, 1995. [ Links ]
43. Sturtevant, J.; Calderone, R.: Candida albicans adhesins: bichemical aspects and virulence. Rev Iberoam Micol 14: 90-97, 1997. [ Links ]
44. Barret-Bee, K.; Hayes, Y.; Wilson, R. G.; Riley, J. F.: A comparison of phospholipase activity, cellular adherence and pathogenicity of yeasts. J Gen Microbiol 131: 1217-1221, 1985. [ Links ]
45. Greenfield, R. A.: Host defense system interactions with Candida. J Med Vet Mycol 30: 89-104, 1992. [ Links ]
46. Kaminishi, H.; Miyaguchi, H.; Tamaki, T.; Suenaga, N.; Hisamatsu, M. et al.: Degradation of humoral host defense by Candida albicans proteinase. Infect Immun 63: 984-988, 1995. [ Links ]
47. Sobel, J. D.: Pathogenesis and epidemiology of vulvovaginal candidiasis. Ann N Y Acad Sci 544: 547-557, 1988. [ Links ]
48. Vasquez, J. A. et al.: Kariotyping of Candida albicans isolates obtained longitudinally in womwn with recurrent vulvovaginal candidiasis. J Infect Dis 170: 1566-1569, 1994. [ Links ]
49. Panizo, M. M.; Pérez, C.; Maniscalchi, M. T.: Susceptibilidad in vitro a los antifúngicos de Candida sp. y serotipos de Candida albicans aisladas de pacientes con vaginítis primaria y recurrente. Bol Soc Ven Microbiol 20: 16-21, 2000. [ Links ]
50. Fleury, F. J.: Recurrent Candida vulvovaginitis. Chemotherapy 28(Suppl 1): 48-50, 1982. [ Links ]
51. Andriole, V. T.; Wiernik, P.H.: Immunologic pathogenesis of recurrent vulvovaginal candidiasis. Clin Guid Fung Infect 6: 1-8, 1994. [ Links ]
52. Fidel, P. L. Jr.; Lynch, M. E.; Sobel, J. D.: Candida-specific cell mediated immunity is demonstrable in mice with experimental vaginal candidiasis. Infect Immun 61: 1990-1995, 1993. [ Links ]
53. Fidel, P. L. Jr.; Lynch, M. E.; Sobel, J. D.: Candida-specific Th1-type responsiveness in mice with experimental vaginal candidiasis. Infect Immun 61: 4202-4207, 1993. [ Links ]
54. Fidel, P. L. Jr.; Lynch, M. E.; Conaway, D. H.; Tait, L.; Sobel, J. D.: Mice immunized by primary vaginal C. albicans infection develop acquired vaginal mucosal immunity. Infect Immun 63: 547-553, 1995. [ Links ]
55. Fidel, P. L. Jr.; Lynch, M. E.; Sobel, J. D.: Circulating CD4 and CD8 T cells have little impact on host defense against experimental vaginal candidiasis. Infect Immun 63: 2403-2408, 1995. [ Links ]
56. Fidel, P. L. Jr.; Cutright, J. L.; Sobel, J. D.: Effects of systemic cell-mediated immunity on vaginal candidiasis in mice resistant and susceptible to Candida albicans infections. Infect Immun 63: 4191-4194, 1995. [ Links ]
57. Kirkpatrick, C. H.; Rich, R. R.; Bennett, J. E.: Chronic mucocutaneous candidiasis: Model building in cellular immunity. Ann Intern Med 75: 955-978, 1971. [ Links ]
58. Mathur, S.; Virella, G.; Koistinen, J.; Horger, E. O.; Mahvi, T. A.; Fundenberg, H. H.: Humoral immunity in vaginal candidiasis. Infect Immun 15: 287-294, 1977. [ Links ]
59. Fong, I. W.; McCleary, P.; Read, S.: Cellular immunity of patients with recurrent of refractory vulvovaginal moniliasis. Am J Obstet Gynecol 166: 887-890, 1992. [ Links ]
60. Corrigan, E. M.; Clancy, R. L.; Dunkley, M. L.; Eyers, F. M.; Beagley, K. W.: Cellular immunity in recurrent vulvovaginal candidiasis. Clin Exp Immunol 111: 574-578, 1998. [ Links ]
61. Syverson, R. A.; Buckley, H.; Gibian, J.; Ryan, J. J. M.: Cellular and humoral immune status in women with chronic Candida vaginitis. Am J Obstet Gynecol 134: 624-627, 1979. [ Links ]
62. Fidel, P. L. Jr.; Lynch, M. E.; Redondo-Lopez, V.; Sobel, J. D.; Robinson, R.: Systemic cell-mediated immune reactivity in women with recurrent vulvovaginal candidiasis (RVVC). J Infect Dis 168: 1458-1465, 1993. [ Links ]
63. Fidel, P. L. Jr.; Sobel, J. D.: Immunopathogenesis of recurrent vulvovaginal candidiasis. Clin Microbiol Rev 9: 335-348, 1996. [ Links ]
64. Iman, N.; Carpenter, C. C. J.; Mayer, K. H.; Fisher, A.; Stein, M.; Danforth, S. B.: Hierarchical pattern of mucosal Candida infections in HIV-seropositive woman. Am J Med 89: 142-146, 1990. [ Links ]
65. Rhoads, J. L.; Wright, D. C.; Redfield, R. R.; Burke, D. S.: Chronic vaginal candidiasis in women with human immunodeficiency virus infection. JAMA 257: 3105-3107, 1987. [ Links ]
66. White, M. H.: Is vulvoaginal candidiasis an AIDS-related illness? Clin Infect Dis 22 (Suppl 2): S124-S127, 1996. [ Links ]
67. Rogers, T. J.; Balish, E.: Immunity to Candida albicans. Microbiol Rev 44: 660-682, 1980. [ Links ]
68. Han, Y.; Cutler, J. E.: Antibody response that protects against disseminated candidiasis. Infect Immun 63: 2714-2719, 1995. [ Links ]
69. Matthews, R. C.; Burnie, J. P.; Howat, D.; Rowland, T.; Walton, F.: Autoantibody to heat-shock protein 90 can mediate protection against systemic candidosis. Immunology 74: 20-24, 1991. [ Links ]
70. Fidel Jr, P. L.: Host defense against oropharyngeal and vaginal candidiasis: site-specific differences. Rev Iberom Micol 16: 8-15, 1999. [ Links ]












 uBio
uBio 
